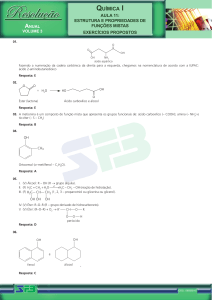
Nomenclatura
dos Compostos
Orgânicos
Professora Paula Melo Silva
A nomenclatura orgânica oficial começou a ser criada em 1892 num
congresso internacional em Genebra. Após várias reuniões surgiu a
nomenclatura IUPAC (União Internacional de Química Pura e Aplicada).
A nomenclatura IUPAC obedece aos seguintes princípios:
I. Cada composto tenha um único nome que o distinga dos demais;
II. Dada a fórmula estrutural de um composto, seja possível elaborar seu
nome, e vice-versa.
Obs.: Apesar de a nomenclatura IUPAC ser a oficial, existem outros tipos
de nomenclatura como, por exemplo, a nomenclatura usual.
Princípios Básicos:
Cada composto orgânico deve ter um nome
diferente;
A partir do nome, deve ser possível esquematizar
a fórmula estrutural do composto orgânico e
vice-versa.
1. Determinar a cadeia principal
Comporta todas as ligações necessárias (duplas ou triplas)
Apresenta maior número de carbonos
A cadeia mais ramificada
A cadeia de radicais menos complexos
2. Numerar a cadeia
As ligações recebem menor número possível
As ramificações recebem o menor número possível
3. Nomear o composto citando os radicais ramificados em ordem crescente
de complexibilidade precedidos e separados por hífen pelo número onde
eles ocorrem, finalizando com o acréscimo do nome correspondente à
cadeia principal e, se existente, a localização da ligação dupla ou tripla
O INÍCIO do nome está relacionado com o número de
átomos de carbono na cadeia principal;
O MEIO do nome está relacionado com o tipo de
ligação entre átomos de carbono da cadeia principal;
O FINAL do nome está relacionado com a função
orgânica a qual pertence o composto orgânico.
<INÍCIO>
Número de átomos
de carbono na
cadeia principal
<MEIO>
Tipo de ligação
entre os átomos
de carbono da
cadeia principal
<FINAL>
Função orgânica
à qual pertence a
molécula
O INÍCIO do nome está relacionado com o número
de átomos de carbono na cadeia principal.
1
MET
6
HEX
2
ET
7
HEPT
3
PROP
8
OCT
4
BUT
9
NON
5
PENT
10 DEC
O MEIO do nome está relacionado com o tipo de
ligação entre átomos de carbono da cadeia
principal;
SIMPLES
AN
DUPLA
EN
TRIPLA
IN
DUAS DUPLAS
DIEN
DUAS TRIPLAS
DIIN
UMA DUPLA E UMA TRIPLA
ENIN
O FINAL do nome está relacionado com a função
orgânica a qual pertence o composto orgânico.
Vejamos dois exemplos:
Hidrocarbonetos
são substâncias
formadas apenas
por carbono e
hidrogênio.
Álcoois são substâncias que
apresentam o grupo OH
(hidroxilo) ligado a um carbono
que apresenta apenas ligações
simples.
HIDROCARBONETO
O
ÁLCOOL
OL
6 Carbonos HEX
Ligação Simples
entre os átomos de
carbono
AN
Hidrocarboneto O
HEXANO
2 Carbonos ET
Ligação Dupla
entre os átomos
de carbono
EN
Hidrocarboneto O
ETENO
2 Carbonos ET
Ligação Simples
entre os átomos
de carbono
AN
Álcool OL
ETANOL
São estruturas formadas por carbono e hidrogénio
que estão ligadas à cadeia principal.
METIL
ISOPROPIL
ETIL
BUTIL
PROPIL
SECBUTIL
ISOBUTIL
TERCBUTIL
VINIL
BENZIL
FENIL
A partir de estruturas com 4 ou mais carbonos na cadeia principal
que apresentam insaturações, ramificações e/ou funções*, é
necessário a utilização de uma numeração para a localização das
mesmas.
Esta numeração é feita a partir do lado da cadeia mais próximo da
função, insaturação ou ramificação (nesta ordem de prioridade).
1º - FUNÇÃO
2º - INSATURAÇÃO
3º RAMIFICAÇÃO
*No caso das funções em alguns casos com 3 carbonos.
HEPT – 3 – ENO
BUTAN – 2 – OL
HEPT – 2 – ENO
HEX – 2 – INO
PENT – 1,3 – DIENO
6 – METIL –
HEPT – 2 – ENO
BUT – 2 – EN – 2 – OL
3 – METIL – PENTAN – 1 – OL
3 – METIL – HEPT – 5 – EN – 2 – OL
4 – ETIL – HEPT – 2 – EN – 1,7 – DIOL
É importante notar que em estruturas como o
eteno, propeno e o propino não é necessária a
numeração para localização da insaturação pois
esta só pode estar localizada num único e
determinado local.
PROPENO
ETANOL
Os compostos de cadeia fechada tem o seu nome
precedido pelo prefixo CICLO
CICLOPENTANO
CICLOHEXANO
CICLOPENTENO
CICLOHEXA – 1,3 – DIENO
CICLOHEXINO
CICLOHEXA – 1,4 – DIENO
4 – METIL –
CICLOPENTENO
6 – METIL – CICLOHEXA
– 2,4 – DIENOL
Algumas
considerações
sobre os
hidrocarbonetos
Pontos de fusão e ebulição
Polaridade
Características gerais
Nomenclatura
São pouco reativos. Apolares. Insolúveis em água. Possuem baixo P.F. e P.E.
aumentando de acordo com o acréscimo de átomos de carbono na cadeia.
O seu P.E. aumenta 20-30ºC com o aumento de mais um átomo de carbono.
São menos densos que a água, tendem a aumentar com o acréscimo de
mais um átmomo de carbono na cadeia, chegando ao máximo de d = 0,8
g/m.
As cadeias ramificadas apresentam P.F. e P.E. mais baixos que as cadeias
normais (mesma massa molecular ou próximas). Solúveis em benzeno, éter e
clorofórmio. Apresentam ligações covalentes.
Características
Fórmula Geral CnH2n+2
Terminação ANO
Indicativo de Função O (hidrocarboneto)
Indicativo de Ligação Simples AN
Terminação dos Radicais IL(A)
De C1 a C4 são gases, de C5 a C17 são líquidos e, acima de
C17 são sólidos.
Escolher a cadeia mais longa como sendo a principal;
Se existem várias cadeias longas, seguir a mais ramificada;
Numerar a cadeia principal, começando mais próximo à
ramificação;
Dar a localização das ramificações seguidas do nome do
radical e, por fim, dar o nome à cadeia principal.
CH4
H3C-CH3
Metano
Etano
H3C-CH2-CH3 Propano
2-metil-butano
2,3-dimetil-pentano
2,2,4-trimetil-pentano
Características
Fórmula Geral: CnH2n; onde n ≥ 2
Terminação: ENO (EN = dupla ligação; O = indicativo de função)
Escolher a cadeia mais longa que tiver uma ligação dupla ;
Numerar a cadeia principal, começando mais próximo à ligação
dupla ;
Dar a localização da(s) ramificação(ões) seguidas do nome do(s)
seu radical(is) e, por fim, dar o nome da cadeia principal
localizando a ligação dupla .
Posição da Dupla Ligação - ALCENOS
Buteno - C4H8 - existem duas fórmulas possíveis:
CH2 = CH – CH2 – CH3 /nome: 1 – buteno
CH3 – CH2 – CH = CH2 /nome: 1 – buteno
CH3 – CH = CH – CH3 /nome: 2 – buteno
Os números na designação 1–buteno e 2–buteno indicam a posição da ligação dupla (entre
dois átomos de carbono). O nome buteno significa que se trata de um composto com 4
átomos de carbono na cadeia principal. É ainda importante realçar que a fórmula CH3 – CH2 –
CH = CH2 representa também o 1–buteno, uma vez que neste caso a numeração mais baixa
significa que a contagem deve ter início no carbono mais à direita porque este se encontra
mais próximo da ligação dupla . Estes dois compostos (1–buteno e 2–buteno) têm ambos a
mesma fórmula química, C4H8,mas apresentam conformação espacial diferente, chamados de
isómeros.
Mais de uma Ligação dupla - ALCENOS
No seu nome, deve constar a indicação do número de ligações duplas existentes, e quais
as respetivas posições. Esta indicação aparece entre o prefixo relativo ao número de
átomos de carbono na cadeia principal e antes do sufixo ENO, e usam-se os termos di,
tri, tetra, etc, consoante o número de ligações duplas existentes.
Exemplo: CH2 = CH – CH = CH – CH3
1,3–pentadieno, ou seja, apresenta duas duplas ligações situadas no átomo de carbono ->
no átomo de carbono 1 e no átomo de carbono 3
1,3 – ciclopentadieno, ou seja, apresenta
duas duplas ligações situadas no átomo de
carbono -> no átomo de carbono 1 e no
átomo de carbono 3
3 – metil – but -1- eno
3,4 – dimetil – pent – 2 - eno
2 – etil – 4 metil – hex – 1 - eno
Radical do eteno
Radicais do propeno
Apresentam cadeias alifáticas insaturadas por uma ligação tripla . São
chamados de hidrocarbonetos acetilénicos (derivados do gás acetileno).
Características
Fórmula Geral: CnH2n-2; onde n ≥ 2
Terminação: INO (IN = ligação tripla; O = indicativo de função)
Radicais MONOVALENTES dos ALCINOS: Ocorre a perda de um
hidrogénio.
Radical do etino
Radicais do propino
Escolher a cadeia mais longa que tiver uma ligação tripla ;
Numerar a cadeia principal, começando mais próximo à ligação
tripla ;
Dar a localização da(s) ramificação(ões) seguidas do nome
do(s) seu radical(is) e, por fim, dar o nome da cadeia principal
localizando a ligação tripla .
Podemos ainda, considerar o etino (acetileno) como cadeia
principal.
4 – metil – pent – 2- ino
2 – metil – hept – 1- ino
6-etil-3-metil-oct-4 - ino
3,4-dimetil-pent-1- ino
São hidrocarbonetos alifáticos que apresentam duas duplas
ligações.
Características
Fórmula Geral: CnH2n-2; onde n ≥ 3
Terminação : DIENO (Di = dois; EN = ligação dupla; O = indicativo de
função)
As ligações duplas estão localizadas no mesmo carbono.
As ligações duplas estão separadas por uma ligação simples.
As ligações duplas estão separadas por duas ou mais ligações
simples.
Escolher a cadeia mais longa que tiver duas ligações duplas ;
Numerar a cadeia principal, começando mais próximo à ligação
dupla ;
Dar a localização da(s) ramificação(ões) seguidas do nome do(s)
seu radical(is) e, por fim, dar o nome da cadeia principal
localizando as ligações duplas .
Podemos ainda, considerar o propadieno (aleno) como cadeia
principal.
H2C=C=CH2
Propadieno
H2C=CH-CH=CH2
Buta- 1,3 - dieno
H2C=C=CH-CH2-CH3
Penta -1,2 - dieno
H2C=CH-(CH2)4CH=CH2
Octa -1,7- dieno
2- metil – penta -1,4 - dieno
4- metil – penta -1,2 - dieno
3- t-butil– penta -1,3 - dieno
3- isobutil - 6 – metil- octa -1,4 - dieno
São hidrocarbonetos cíclicos saturados, isto é, só apresentam
ligações simples.
Características
Fórmula Geral: CnH2n; onde n ≥ 3
Nomenclatura: CICLO
alcanos)
+
HIDROCARBONETO (semelhante aos
Radicais: São chamados de CICLOALQUIL(A).
Terminação dos Radicais: CICLO + HIDROCARBONETO + IL(A)
(semelhante aos alcanos)
Radicais MONOVALENTES dos CICLANOS: Ocorre a perda de
um hidrogênio.
Radical do ciclopropano
Radical do ciclobutano
Radical do ciclopentano
Radical do ciclohexano
Escolher a cadeia mais longa como sendo a principal;
Numerar a cadeia principal, começando da ramificação (se
houver);
Dar a localização das ramificações seguidas do nome do seu
radical e, por fim, dar o nome da cadeia principal observando o
caminho mais curto entre os radicais.
Dar a localização da(s) ramificação(ões) seguidas do nome do(s)
seu radical(is) e, por fim, dar o nome da cadeia principal
observando o caminho mais curto entre os radicais.
ciclopropano
ciclobutano
ciclopentano
1,1,-dietil-3-metil-ciclohexano
ciclohexano
metil-ciclopentano
São hidrocarbonetos cíclicos insaturados por uma ligação dupla .
Características
Fórmula Geral: CnH2n-2; onde n ≥ 3
Nomenclatura: CICLO + HIDROCARBONETO
(semelhante aos alcenos)
Radicais: São chamados de CICLOALQUENIL(A).
Terminação dos Radicais: CICLO + HIDROCARBONETO +
ENIL(A) (semelhante aos alcenos)
Escolher a cadeia mais longa como sendo a principal;
Numerar a cadeia principal, começando da ligação dupla ;
Dar a localização da(s) ramificação(ões) seguidas do nome do(s) seu
radical(is) e, por fim, dar o nome da cadeia principal observando o caminho
mais curto entre a dupla e o(s) radical(is).
ciclopropeno
1-metil-ciclohexeno
ciclobuteno
ciclohexeno
4-metil-ciclohexeno
Benzeno
Naftaleno
Antraceno
Fenantreno
Metil-benzeno ou tolueno
1-etil-naftaleno
Etenil-benzeno ou estireno
3-etil-2-metil-naftaleno
Substituintes ORTO (O), META (m) e PARA (p)
1.ORTO (o): Substituintes nos carbonos 1 e 2.
2.META (m): Substituintes nos carbonos 1 e 3.
3.PARA (p): Substituintes nos carbonos 1 e 3.
1,4-dimetilbenzeno;
1,2-dimetilbenzeno;
1,3-dimetilbenzeno;
4-metiltolueno;
2-metiltolueno;
3-metiltolueno;
p-metiltolueno;
o-metiltolueno;
m-metiltolueno;
Radical MONOVALENTE do BENZENO: Ocorre a perda de um
hidrogénio.
fenil (a)
Compostos
Orgânicos
oxigenados
Álcoois
Éteres
Cetonas
Aldeídos
Ésteres
Ácidos carboxílicos
São compostos orgânicos que possuem uma ou mais hidroxilos
(OH) ligadas diretamente a uma cadeia carbónica que não
pertença a um anel aromático.
NOMENCLATURA
OFICIAL Hidrocarboneto + Ol
VULGAR Álcool + Radical + Ico
NO = Metanol
NV = Álcool metílico
NO = Etanol
NV = Álcool etílico
NO = Propanol-2
NV = Álcool isopropílico
4) CH2=CH-CH2-OH
5)
OH
NO = Propen-2-ol-1
NV = Álcool alílico
NO = Ciclohexanol
NV = Álcool Ciclohexílico
6)
NO = Fenil-metanol
CH2-OH
NV = Álcool Benzílico
CH3–OH monoálcool
CH2–CH2
|
|
OH OH
diálcool
CH2–CH–CH2 triálcool
|
| |
OH OH OH
1,2 - etanodiol
1,2,3 - propanodiol
São mais reativos que os
hidrocarbonetos.
Possuem caráter ácido mais
fraco que a água. Por esse
motivo, é fácil a
identificação de um álcool
e de um fenol na prática,
pois, os álcoois não reagem
com as bases e os fenóis
reagem.
Possuem na molécula uma
parte polar (hidroxilo) que é
chamada de hidrofílica
(hidro=água; filos=amigo) e
outra apolar
(hidrocarboneto) chamada
de hidrofóbica (hidro=agua;
fobia=medo).
H3C-CH2-OH
apolar
polar
O etanol é solúvel na gasolina (apolar) e na água
(polar).
Os álcoois de cadeia carbónica pequena
apresentam características polares e os de cadeia
grande apresentam características apolares.
Os monoálcoois possuem
P.F. e P.E. mais altos que os
hidrocarbonetos de massa
molecular aproximada, pois
organizam-se formando
pontes de hidrogénio.
Os poliálcoois possuem P.F.
e P.E. ainda maiores que os
monoálcoois com o mesmo
número de carbonos na
cadeia.
De C1 a C12 são líquidos e,
acima de C12 são sólidos.
C4 e C5 são praticamente
insolúveis.
Os monoálcoois são menos
densos que a água. O
poliálcoois são mais
densos.
H
R
R
R
O
O
O
H
H
H
H
O
O
R
R
São compostos que contêm um ou mais grupos hidroxilos
diretamente ligados a núcleos aromáticos, ou ainda, são
compostos aromáticos resultantes da substituição de um ou mais
hidrogénios ligados ao seu núcleo por igual número de
hidroxilos.
NOMENCLATURA
OFICIAL Hidroxi + Benzeno
VULGAR Radical + Fenol
1)
2)
OH
OH
CH3
NO = Hidróxi-benzeno
NO = 1-hidróxi-2-metil-benzeno
NV = Fenol
NV = o-metil-fenol
3)
4)
OH
OH
OH
OH
NO = 1,2-dihidróxi-benzeno NO = 1,3-dihidróxi-benzeno
NV = o-hidróxi-fenol
NV = m-hidróxi-fenol
Características dos fenóis
• Apresentam caráter ácido.
• Os monofenóis são polares e os
polifenóis podem ser polares ou
apolares.
• Possuem P.F. e P.E. mais elevados que
os hidrocarbonetos de moléculas
próximas pois formam pontes de
hidrogénio entre si e com a água.
• Os fenóis mais simples são líquidos ou
sólidos de baixo P.F. os demais são
sólidos.
• O fenol é solúvel em água (9g por 100g
de H2O), os demais monofenóis são
praticamente insolúveis.
OH
OH
OH
OH
OH
OH
OH
CH3
CH3
OH
OH
catecol
resorcinol
hidroquinona
CH3
o-cresol
m-cresol
p-cresol
O fenol em solução aquosa foi o primeiro anti-séptico
comercializado. O seu uso foi introduzido em hospitais por volta
de 1870, provocando uma queda muito grande no número de
mortes causadas por infeção pós-operatória. Na época o nome
da solução diluída era ácido carbólico.
O fenol comum deixou de ser utilizado com essa finalidade
quando se descobriu que é corrosivo, podendo causar
queimaduras quando em contato com a pele e venenoso quando
ingerido por via oral.
Os éteres, representados genericamente por (R-O-R’), podem ser
definidos de várias maneiras. Apresentam-se apenas três destes
conceitos:
CH3-O-CH3
São compostos derivados da água, pela substituição dos seus
dois átomos de hidrogénio por igual número de radicais
orgânicos.
H2O R-O-R’
R-OH R-O-R’
NOMENCLATURA
OFICIAL Radical + Oxi + Hidrocarboneto
VULGAR Éter + 1º Grupo orgânico --- ICO + 2º Grupo orgânico --- ICO
Obs: os grupos devem ser escritos em ordem alfabética
NO = Metóxi-metano
NO = Metóxi-etano
NV = Éter metílico
NV = Éter etílico-metílico
NO = Etóxi-etano
NV = Éter etílico
NO = 2-metóxi-propano
NV = Éter isopropílico-metílico
O etoxietano, também conhecido como éter etílico, éter sulfúrico, ou simplesmente éter, tem
fórmula molecular C4H10O e fórmula estrutural CH3CH2-O-CH2CH3. É uma substância líquida
volátil e altamente inflamável. Utilizado inicialmente como anestésico, foi abandonado pelo
risco de explosão e dependência O nome éter, aplicado para designar o espaço vazio entre a
matéria, foi atribuído a essas substâncias devido à grande volatilidade do éter etílico,
também denominado éter sulfúrico, obtido pela primeira vez no século XVI pelo naturalista
alemão Valerius Cordus ao tratar spiritus vigni (álcool) com oleum dulce vitrioli (ácido
sulfúrico). Esse composto ficou esquecido durante muito tempo e em 1730 foi redescoberto
por Frobenius. O nome éter aplicava-se também aos ésteres, que posteriormente foram
chamados éteres-sais, enquanto os éteres propriamente ditos foram chamados éteresóxidos. A denominação "éster" para os éteres-sais foi proposta por Gmelin. Costuma-se
dividir os éteres em dois grupos: simples, ou simétricos, se os dois radicais ligados ao
oxigénio forem iguais; e mistos, ou assimétricos, se forem diferentes.
Antigamente, o éter era produzido pelo aquecimento do álcool etílico com ácido sulfúrico
concentrado (daí o nome éter sulfúrico).
Hoje em dia, é produzido pela passagem de vapor de álcool sobre alumina. Em ambos os
métodos, o controle de temperatura deve ser preciso para minimizar produção de etileno.
Risco de explosão
Quando exposto ao ar e à luz, os éteres produzem peróxidos explosivos, principalmente se
forem aquecidos ou destilados. Para evitar esta situação são usados alguns conservantes em
pequenas quantidades.
Drogas
Os traficantes utilizam o éter como solvente para separar a cocaína da pasta feita com as
folhas de coca.
Causa dependência física e psicológica importante após 30 a 40 dias de uso frequente.
No Brasil, é vendido em farmácias normalmente misturado ao álcool etílico, devido a sua
volatilidade e para evitar usos ilícitos.
São compostos orgânicos que se caracterizam pela presença na
estrutura de um grupo carbonila ligado a um átomo de hidrogénio,
formando:
O metanal é o principal aldeído, sendo também conhecido por aldeído fórmico,
formaldeído ou formol. Quando dissolvido em água forma-se uma solução
cuja concentração pode ser no máximo 40% em massa, conhecida como
formol ou formalina.
NOMENCLATURA
OFICIAL Hidrocarboneto + Al
NO = Metanal
NO = Etanal
NV = Aldeído fórmico
NV = Aldeído acético
NV = Formol
NO = Fenil-metanal
4)
CHO
NV = Aldeído benzóico
São compostos que se caracterizam pela presença
de um grupo carbonila ligado a dois radicais de
hidrocarbonetos. Obedecem às fórmulas gerais:
Podem ser definidos, ainda, como produtos da
oxidação dos álcoois secundários.
[O]
R-CH-R'
R-C-R'
OH
O
NOMENCLATURA
OFICIAL Hidrocarboneto + Ona
VULGAR Radical menor + Radical maior + Cetona
1) CH3COCH3
NO = Propanona
NV = Dimetil-cetona
NV = Acetona
2) CH3CH2COCH3
NO = Butanona
NV = Metil-etil-cetona
NO = 2-metil-pentanona-3
NV = Etil-isopropil-cetona
4)
C-CH3
O
NO = Metil-ciclohexil-cetona
A Acetona é um solvente para diversas aplicações, da família das Cetonas. É
um líquido incolor, de odor pungente. Possui Ponto de Ebulição 56,2 ºC, Ponto de
Fusão –94,7ºC. Fórmula Química: (CH3)2CO. Peso Molecular: 58,08. Nome
Químico: 2-propanona.
APLICAÇÕES
A Acetona é utilizada para a limpeza de equipamentos precisos; é solvente de
Iodeto e Permanganato de potássio; utilizado para vulcanização de borracha. É
amplamente utilizado nas seguintes aplicações: tintas e vernizes; tintas de
impressão; adesivos; thinners e removedores; extração; precipitação e
cristalização de vitaminas, antibióticos e outros produtos farmacêuticos;
desengraxe e limpeza de cinescópios e componentes eletrónicos; adsorvente
para acetileno; etc. Como intermediário químico é muito utilizada na produção
de Bisfenol A, Diacetona álcool, Metilisobutilcetona, etc.
São compostos que possuem um ou mais grupos carboxílicos na
molécula.
O
O
R
R
C
C
OH
Ácido
Acila
1) H-COOH
NO = Ácido metanóico
2) CH3COOH
NO = Ácido etanóico
NV = Ácido fórmico
NV = Ácido acético
3) CH3-CH2-CH2-COOH
NO = Ácido butanóico
4) CH3CH2CH2CH2COOH
NO = Ácido pentanóico
NV = Ácido butírico
NV = Ácido valérico
São compostos resultantes da reação de um ácido
carboxílico com um álcool ou fenol, com eliminação de
água.
RCOOH
+
R'OH
RCOOR'
RCOOH
+
ArOH
RCOOAr
+
+
H2O
H2O
Os ésteres podem, ainda, ser definidos como compostos
resultantes da substituição do hidrogénio ionizável de um ácido
por radicais de hidrocarbonetos.
RCOOH
RCOOR'