CICLO
DE
KREBS
Prof. Didier Salmon
MSc Cristiane S.
Lessa
Bioquímica para Enfermagem
Janeiro 2016
13/01/16
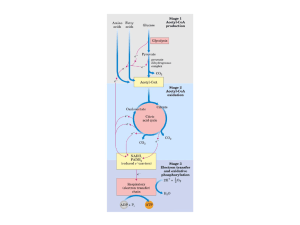
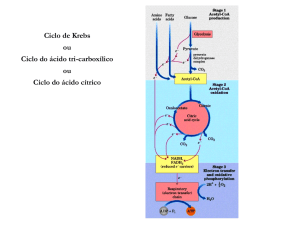
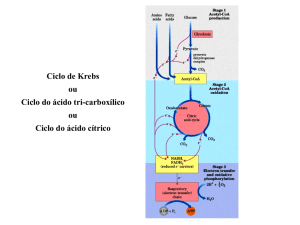
Ciclo de Krebs
• Também conhecido como ciclo do ácido cítrico ou ciclo
dos ácidos tricarboxílicos;
• É o estágio final do metabolismo de carboidratos,
aminoácidos e lipídeos;
• É executado na matriz mitocondrial de eucariontes e no
citoplasma dos procariontes.
• Faz parte do metabolismo aeróbico;
• Foi descoberto por Hans Krebs
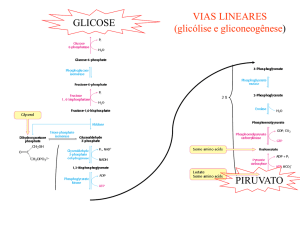
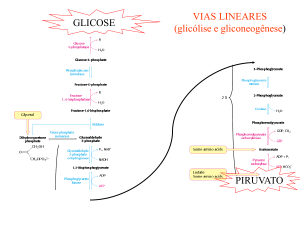
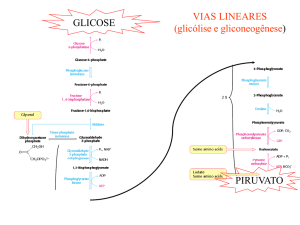
Vias Lineares
• Glicólise e Gliconeogênese
GLICOSE
PIRUVATO
Via Circular
• Ciclo do Ácido Cítrico ou Ciclo de Krebs
– Representa o estágio final da
oxidação de fontes de energia
metabólica (carboidratos, ácidos
graxos e aminoácidos)
– Rota central de recuperação de
energia a partir de vários
combustiveis metabólicos
Um pouco de história...
• Como resultados de experimentos Lavoisier postula que:
– “Na natureza nada se cria, nada se perde, tudo se transforma.”
• Equação de Lavoisier:
Matéria orgânica + O2 CO2 + H2O + energia
• Otto Warburg busca entender a equação de Lavoisier em
diferentes tecidos;
• Desenvolve um respirômetro para medir o consumo de O2 e a
produção de CO2.
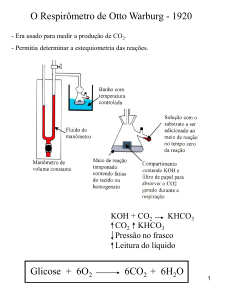
Respirômetro de Warburg
Coloca o
substrato
Pressão
CO2
Tecido
Meio de cultura
Fluido
com cor
Papel de filtro
com KOH
KOH + CO2
KHCO3
-
Era usado para medir a
produção de CO2.
-
Permitia determinar a
estequiometria das
reações.
•
Células Produzem CO2
•
Formação de Bicarbonato
•
↓ Pressão no frasco
•
↑ Líquido na coluna
•
Mede consumo de O2
pela diminuição da
pressão e de CO2 por
formação de bicarbonato
Destino do Piruvato na Presença de
O2
• A: Piruvato (C3) + 3O2
3CO2 + 3H2O
• Szent – Györg (1930) testa ácidos C4
• B: Piruvato (C3) + ácidos dicarboxílicos (C4) + nO2
50
piruvato +
CO2
40
30
piruvato
20
10
0
0
5
10
tempo
15
20
nCO2 + nH2O
oxaloacetato
succinato
malato
fumarato
Hans Krebs
•
Krebs então testa outros ácidos dicarboxílicos. Em 1935 descobre que um deles, o
α-cetoglutarato, com 5 carbonos, assim como nos experimentos de Szent-Györgyi,
aceleravam a produção de CO2 e não eram consumidos na reação
•
Em 1937 Krebs testa ácidos tricarboxílicos como citrato, isocitrato e aconitato,
agora com 6 carbonos, e observa que a produção de CO2 também era estimulada e
esses intermediários não eram consumidos.
50
piruvato
CO2
40
30
piruvato
20
10
0
0
5
10
tempo
15
20
+
citrato
isocitrato
aconitato
Hans Krebs
•
Segundo Krebs, outra contribuição significativa para suas descobertas veio dos
estudos de Martius e Knoop, em 1937, que elucidaram a transformação oxidativa
de citrato até α-cetoglutarato
Em 1936, Carl Martius e Franz
Knoop demonstraram que o
citrato pode ser formado de
modo não-enzimático a partir
do oxaloacetato e do piruvato
Hans Krebs
•
Krebs também observou que a formação de citrato (C6) ocorria rapidamente após
a adição de oxaloacetato (C4) em diversos tecidos.
Oxaloacetato (C4) + ???(C2)
•
Citrato(C6)
Composto vindo provavelmente da degradação da glicose
Juntando as seguintes informações:
•
1- ácidos di- e tri- carboxílicos aceleravam a formação de CO2 em diversos tecidos
mas não eram consumidos na reação.
•
2- algum composto de 2 carbonos vindo provavelmente da glicólise se combinava
com oxaloacetato e formava um composto de 6 carbonos (citrato) que iniciava
uma via de interconversão, Krebs conclui e postula um modelo que ele chamou de
“Ciclo do Ácido Cítrico” ou dos “Ácidos Tricarboxílicos”.
Krebs então postula que:
“O piruvato, ou um derivado vindo da glicólise (acetato), se condensa
com o oxaloacetato e forma citrato. Por uma sequência de reações que
envolvem cis-aconitato, isocitrato, α-cetoglutarato, succinato, fumarato,
malato e oxaloacetato como intermediários, um ácido acético é oxidado
e o oxaloacetato necessário para a reação inicial de condensação é
regenerado. Isso explica a ação catalítica dos ácidos di e tricarboxílicos
(de 4, 5 e 6 carbonos), bem como a capacidade que esses ácidos
possuem de se oxidar nos tecidos que oxidam carboidratos.”
Ciclo do Ácido Cítrico
• Mitocôndria
– Membranas interna e externa
– Matriz Mitocondrial
Matriz
Membrana interna
Membrana externa
Os experimentos de Fritz Lipmann
• Os experimentos de Fritz Lipmann
– Naquela época já se sabia que a Coenzima A estava envolvida em reações de
transferência de carbono e que ela era derivado do ácido pantotênico, uma
vitamina pertencente ao complexo B (vit. B5).
Ac. Pantotênico = Vit. B5
Os experimentos de Fritz Lipmann
Lipmann demonstra que o consumo de O2 é aumentado na presença de
ácido pantotênico quando se fornece glicose-fosfato para leveduras
Coenzima A
• Ubíqua nos tecidos
• Síntese de citrato aumenta na presença de CoA
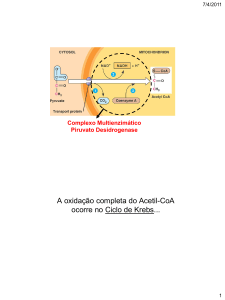
E como é formado Acetil-CoA a
partir do piruvato?
Pelo Complexo Piruvato Desidrogenase!!!
•
Complexo multienzimático associados de modo não
covalente.
Possui três tipos de enzimas em cópias múltiplas: E1, E2, E3
E1= piruvato desidrogenase (amarelo)
E2= di-hidrolipoil-transacetilase (verde)
E3= di-hidrolipoil-desidrogenase (vermelho)
Grande o suficiente para ser
visto em microscopia eletrônica
O Complexo Piruvato Desidrogenase
Reação de descarboxilação oxidativa
•
Complexo multienzimático: grupos de enzimas associadas de modo não-covalente
que catalisam duas ou mais reações seqüencias em uma rota metabólica
– Aumento a velocidade das reações, canalização dos intermediários
minimizando as reações secundárias, controle coordenado das reações
catalisadas
O Complexo Piruvato Desidrogenase
Descarboxilação Oxidativa
1- O piruvato reage com o TPP ligado à E1, sendo
descarboxilado ao derivado hidroxietil;
2- Transferência de 2e- e do grupo acetil a
partir do TPP para a forma oxidada do grupo
lipoil-lisina do centro do complexo E2,
formando o acetil-tio éster do grupo lipoil
reduzido;
3- Transesterificação, o grupo SH da CoA
substitui o SH da E2, produzindo Acetil CoA.
4- A E3 promove a transferência de 2 átomos
de hidrogênio dos grupos lipoil reduzidos de
E2 ao grupo prostético FAD de E3,
restaurando a forma oxidada do grupo lipoillisina de E2.
5- O FADH2 reduzido de E3 transfere um ion hidreto ao NAD, formando NADH. O complexo
enzimático está agora pronto para outro ciclo catalítico.
Cinco coenzimas, Quatro vitaminas
• Cinco coenzimas (Grupos prostéticos) participam da reação
– TPP (tiamina) – Vitamina B1
– FAD (riboflavina) – Vitamina B2
– NAD (niacina) – Vitamina B3
– CoA-SH (pantotenato) – Vitamina B5
– Lipoato
Tiamina (Vitamina B1)
Cinco coenzimas, Quatro vitaminas
• Cinco coenzimas (Grupos prostéticos) participam da reação
– TPP (tiamina)
– FAD (riboflavina)
– NAD (niacina)
– CoA-SH (pantotenato)
– Lipoato
Riboflavina (Vitamina B2)
Cinco coenzimas, Quatro vitaminas
• Cinco coenzimas (Grupos prostéticos) participam da reação
– TPP (tiamina)
– FAD (riboflavina)
– NAD (niacina)
– CoA-SH (pantotenato)
– Lipoato
Niacina (Vitamina B3)
Cinco coenzimas, Quatro vitaminas
• Cinco coenzimas (Grupos prostéticos) participam da reação
– TPP (tiamina)
– FAD (riboflavina)
– NAD (niacina)
– CoA-SH (pantotenato)
– Lipoato
Vitamina B5
Cinco coenzimas, Quatro vitaminas
• Cinco coenzimas (Grupos prostéticos) participam da reação
– TPP (tiamina)
– FAD (riboflavina)
– NAD (niacina)
– CoA-SH (pantotenato)
– Lipoato
Lipoato
Atua como transportador de acilas.
Beriberi – Deficiência de B1
A tiamina está envolvida em várias funções após
fosforilada no organismo:
• Metabolismo de carboidratos;
• Metabolismo de lipídeos (mielina);
• Metabolismo de aminoácidos;
• Produção de neurotransmissores;
Sua falta provoca doenças, como o beribéri,
caracterizada por perda da função neural.
Principais causas:
• Dieta pobre em B1;
• Abuso de álcool (dificulta absorção da B1);
• Baixa absorção da vitamina B1 pelo intestino (como por infecção de
Penicillium citreonigrum);
• Diarreias e/ou vômitos por longos períodos;
• Genética (rara)
Ciclo de Reações
da PD
Piruvato Desidrogenase (E1)
Diidrolipoil Transacetilase (E2)
Hidroxietil-TPP
Diidrolipoil Desidrogenase (E3)
Lipoamido = ácido lipóico
ligado a um resíduo lisina
Piruvato Desidrogenase (E1)
Diidrolipoil Transacetilase (E2)
Diidrolipoil Desidrogenase (E3)
Hidroxietil-TPP
Acetil- diidrolipoamido
Transesterificação e produção
da AcetilCoA
Piruvato Desidrogenase (E1)
Oxidação da hidroxietil a acetila na
redução do dissulfeto do lipoamida
Diidrolipoil Transacetilase (E2)
Diidrolipoil Desidrogenase (E3)
Hidroxietil-TPP
diiidrolipoamido
Piruvato Desidrogenase (E1)
Diidrolipoil Transacetilase (E2)
Diidrolipoil Desidrogenase (E3)
Hidroxietil-TPP
Regeneração do lipoamido
Piruvato Desidrogenase (E1)
Diidrolipoil Transacetilase (E2)
Diidrolipoil Desidrogenase (E3)
Arsênico
MAS...
O complexo piruvato desidrogenase pode ser inibido pela reação do grupo
lipoamido com compostos que contêm arsênico
Resumindo as reações do PDH
E1= piruvato desidrogenase
Piruvato + TPP
Hidroxietil-TPP + CO2
E2= dihidrolipoil transacetilase
Hidroxietil-TPP + lipoil-lisina oxidada
TPP + Acetil tioester da lipoil-lisina reduzida
E2= dihidrolipoil transacetilase
Acetil tioester da lipoil-lisina reduzida + CoA
Acetil-CoA + lipoil lisina reduzida
E3= dihidrolipoil desidrogenase: restauração do complexo PDH ao seu estado
inicial (regeneração da lipoamida oxidada e produção de FADH2 e redução do
FADH2 pelo NAD produzindo NADH )
Regulação do Complexo Piruvato
Desidrogenase
• Inibida quando [ATP/ADP], [NADH/NAD+] e [acetilCoA/CoA]
– Balanço energético positivo
• Inibida por ácido graxos de cadeia longa (modificação
alostérica)
• Por modificação covalente de E1 (mamíferos):
– piruvato desidrogenase cinase fosforila E1 inativa o PDC
(ATP é um ativador alostérico desta cinase)
– piruvato desidrogenase fosfatase: reativa o PDC
Insulina
A insulina reverte essa inativação ativando a PD fosfatase promovendo
a síntese de acetil-CoA
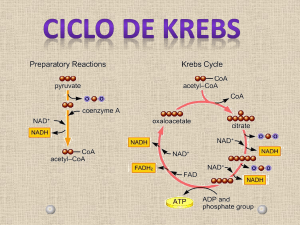
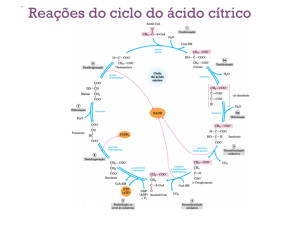
As Reações do Ciclo de Krebs
Matriz Mitocondrial
1) Citrato Sintase
• Sintase: reação de condensação sem nucleosídeo trifosfato (ATP, GTP...)
ou outra origem de energia
1) Citrato Sintase
• Oxaloacetato (em amarelo) é o primeiro substrato a se ligar, e
promove uma mudança conformacional, criando um sítio de ligação
para o segundo substrato, o Acetil-CoA (em vermelho um análogo
da Acetil-CoA) = reação cinética seqüencial ordenada
1) Citrato Sintase
• Importância da ligação tioéster
2) Aconitase
• Isomerização de citrato a isocitrato via cis-aconitato
• Aconitase contêm um grupo ferro-enxofre 4Fe-4S
3) Isocitrato Desidrogenase
• Ocorre a primeira descarboxilação oxidativa com liberação com
conservação de energia na forma de NADH
• O CO2 eliminado vem do OAA não do acetil-CoA
4) a-Cetoglutarato Desidrogenase
• Perda do grupo carboxila na forma de CO2 e Energia de oxidação
conservada na ligação tioéster
5) Succinil-CoA Sintetase
• Energia livre de hidrólise da ligação tioéster do succinil-CoA forte e
negativa (-36 kJ/mol)
• Sintetase: reação de condensação com uso de nucleosídeos trifosfato
5) Succinil-CoA Sintetase
• Fosforilação a nível do substrato, como na
glicólise.
6) Succinato Desidrogenase
• Catalisa a desidrogenação estereoespecífica do succinato em fumarato
• Única enzima do ciclo que não se encontra solúvel na matriz
Malonato = inibidor competitivo
7) Fumarase
8) Malato Desidrogenase
• Regeneração do Oxaloacetato pela oxidação do malato
Saldo Final
• 3 NADH
• 1 FADH2
• 1 GTP ou ATP
Componentes do TCA são importantes
intermediários anabólicos
• O ciclo de Krebs é uma via anfibótica, serve para processos
catabólicos e anabólicos;
• Intermediários da via são precursores de vias de biossíntese:
- Oxaloacetato convertido em glicose na gliconeogênese;
- Succinil-CoA é intermediário central para a síntese do
anel porfirínico dos grupos heme e transportadores de elétrons;
- O citrato produzido por alguns organismos é usado na
industrias para variados propósitos;
• Esses intermediários são repostos por reações anapleróticas.
Componentes do TCA são importantes
intermediários anabólicos
Reações anapleróticas repõem os intermediários
O catabolismo de proteínas gera
diversos intermediários do TCA
Regulação do Ciclo de Krebs
Regulação em dois níveis principais:
• Conversão de piruvato a Acetil-CoA (piruvato desidrogenase)
• A entrada de acetil-CoA no ciclo (citrato-sintase)
Regulada também:
• Na reação da Isocitrato-desidrogenase;
• Na reação da alfa-cetoglutarato-desidrogenase
Regulação do Ciclo de Krebs
No músculo cardíaco o fluxo de metabólitos no TCA é proporcional a taxa de
consumo de oxigênio :
3 níveis de regulação:
Piruvato carboxilase
-Disponibilidade de Substrato
-Inibição por acumulo de Produto
-Inibição competitiva retroativa
pelos intermediários
Velocidades da glicólise e do CK
são reguladas de maneira
integrada (NADH, ATP, Citrato)
Diabetes e formação dos corpos cetónicos...