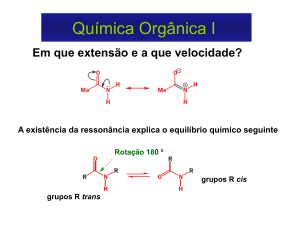
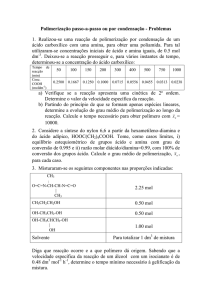
Unidade I
Química e
Indústrias
Equilíbrio Químico
Equilíbrio Químico
Reacções completas e incompletas
Reacção completa: há esgotamento de pelo menos um
dos reagentes.
Reacção completa: no final, isto é, atingido o equilíbrio,
existe apenas uma mistura de todos os reagentes e de
todos os produtos de reação.
Equilíbrio Químico
Reacções reversíveis e irreversíveis
Reacção
irreversível:
Reacções
químicas
que
dão
origem aos produtos da reacção mas, mesmo em
sistema fechado, os produtos em contacto não reagem
entre si para regenerar os reagentes.
Exemplo:
HCl (aq) + Mg (s) MgCl2 (aq) + H2O
Equilíbrio Químico
Reacções reversíveis e irreversíveis
Reacção reversível: produtos da reacção reagem entre si,
regenerando-se assim em reagentes.
Nas reacções reversíveis coexistem as reacções directa,
em que os reagentes originam os produtos da reacção, e
inversa, em que os produtos da reacção regeneram os
reagentes.
Reacção directa
A+B
C+D
Reacção inversa
Equilíbrio Químico
Reacções reversíveis e estado de equilíbrio
-
O
equilíbrio
químico
dinâmico,
isto
atingido
o
reacções
directa
continuam
a
é,
é
uma
vez
equilíbrio,
as
e
inversa
processar-se
a
igual velocidade.
- No equilíbrio químico não há
alteração
das
macroscópicas
propriedades
mensuráveis
(cor, pressão, temperatura e
outras) do sistema reaccional.
Equilíbrio Químico
Equilíbrios Homogéneos e Heterogéneos
-Um equilíbrio diz-se homogéneo quando os constituintes
do sistema se encontram todos na mesma fase.
Exemplo: N2 (g) + 3H2 (g)
2NH3 (g)
- Um equilíbrio químico diz-se heterogéneo quando os
constituintes do sistema se encontram em diferentes
fases.
Exemplo: CaCO3 (s)
NH4 (g) + H2S (g)
Equilíbrio Químico
Curvas de variação das concentrações dos
reagentes em função do tempo
Neste sistema o reagente consomese totalmente – trata-se de uma
reacção irreversível.
Neste sistema reaccional atinge-se o
estado de equilíbrio ao fim de te
segundos. A partir desse instante as
concentrações de A e B não variam –
reacção reversível.
Equilíbrio Químico
Diferentes estados de equilíbrio de um
sistema reaccional
- Para uma dada reacção, pode haver uma infinidade de
estados de equilíbrio. Assim, as quantidades de substância
presentes no equilíbrio dependem das quantidades iniciais
dos reagentes.
- No entanto, à mesma temperatura e para uma mesma
reacção há uma relação que se mantém constante – a
constante de equilíbrio, K.
Equilíbrio Químico
Constante de equilíbrio
Considerando a seguinte reacção reversível:
aA+bB
C D
K
a
b
A B
c
cC+dD
d
Constante de Equilíbrio
Para uma dada reacção, mantendo constante a temperatura, K é
sempre independente das concentrações iniciais.
Equilíbrio Químico
Unidades da constante de equilíbrio
Considerando a seguinte reacção reversível:
A+B
C+D
C D mol.dm3 mol.dm3
K
A B mol.dm3 mol.dm3
Logo, o valor de K não tem unidades – K é
adimensional
Equilíbrio Químico
Ordem de grandeza da constante de equilíbrio
A extensão da reacção directa é
o grau de transformação dos
reagentes
em
produtos
da
reacção, uma vez atingido o
equilíbrio.
Equilíbrio Químico
Ordem de grandeza da constante de equilíbrio
Kc >> 1 implica que no equilíbrio há muito
maior quantidade de produtos de reacção
que reagentes.
A extensão da reacção directa é
muito superior à extensão da
reacção inversa.
Equilíbrio Químico
Ordem de grandeza da constante de equilíbrio
Kc << 1 implica que no equilíbrio há muito
maior quantidade de reagentes que
produtos de reacção.
A extensão da reacção inversa é
muito superior à extensão da
reacção directa.
Equilíbrio Químico
Ordem de grandeza da constante de equilíbrio
Kc 1 as quantidades de reagentes e de
produtos da reacção presentes no equilíbrio
são da mesma ordem de grandeza.
A extensão das reacções directa e
inversa não são muito diferentes.
Equilíbrio Químico
Constante de equilíbrio das reacções directa e
inversa
Kc
N2 (g) + 3 H2 (g)
2 NH3 (g)
K’c
2
NH 3
Kc
N 2 H 2 3
Constante de Equilíbrio
da reacção directa
Constante de Equilíbrio
da reacção inversa
Ou seja,
K c'
1
Kc
K
'
c
3
N 2 H 2
NH 3 2
Alteração do estado de equilíbrio de
um sistema
-O carácter dinâmico do equilíbrio torna-o
sensível
a
qualquer
alteração
das
condições de equilíbrio.
- Qualquer alteração produzida num
sistema em equilíbrio obriga-o a evoluir no
sentido de atingir um novo estado de
equilíbrio.
Alteração do estado de equilíbrio de
um sistema
O químico francês Henri de Le Chatelier, como resultado de
observações experimentais, propôs uma regra simples que
permite fazer previsões qualitativas sobre o efeito das
alterações provocadas num sistema em equilíbrio.
Princípio de Le Chatelier
Se a um sistema de equilíbrio se introduz uma
perturbação, o sistema vai reagir evoluindo no
sentido de contrariar essa perturbação.
Alteração do estado de equilíbrio de
um sistema
Factores que afectam o estado de equilíbrio de
um sistema:
- Temperatura
- Concentração
- Pressão
gasosos)
(sistemas
com
componentes