Universidade Paulista – UNIP Curso de Engenharia
Aula-03: Ligações Químicas e sua relações com as propriedades dos
materiais
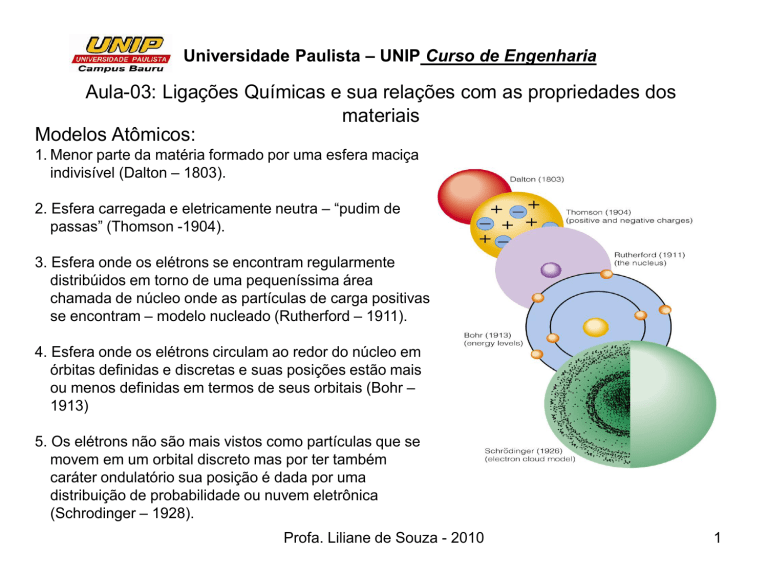
Modelos Atômicos:
1. Menor parte da matéria formado por uma esfera maciça
indivisível (Dalton – 1803).
2. Esfera carregada e eletricamente neutra – “pudim de
passas” (Thomson -1904).
3. Esfera onde os elétrons se encontram regularmente
distribúidos em torno de uma pequeníssima área
chamada de núcleo onde as partículas de carga positivas
se encontram – modelo nucleado (Rutherford – 1911).
4. Esfera onde os elétrons circulam ao redor do núcleo em
órbitas definidas e discretas e suas posições estão mais
ou menos definidas em termos de seus orbitais (Bohr –
1913)
5. Os elétrons não são mais vistos como partículas que se
movem em um orbital discreto mas por ter também
caráter ondulatório sua posição é dada por uma
distribuição de probabilidade ou nuvem eletrônica
(Schrodinger – 1928).
Profa. Liliane de Souza - 2010
1
Comparação entre o modelo de Bohr e o mecânico-ondulatório
0
n- principal (camada)
Surgem os números quânticos
Cada elétron é caracterizado
por 04 números quânticos
0
l- subcamada (orbitais)
ml=no de estados energéticos
de cada orbital
ms= orientação do elétron
Distância do núcleo
Elétron
em órbita
Região de máxima probabilidade
núcleo
Profa. Liliane de Souza - 2010
2
Elemento
f
Energia
f
d
d
p
s
No Atômico
Conf.Eletrônica
1s1
1s2
1s22s1
1s22s2
1s22s22p1
H
He
Li
Be
B
Z=1
Z=2
Z=3
Z=4
Z=5
Na
Z=11
Cl
Z=17 1s22s22p63s23p5
p
s
d
p
s
1s22s22p63s1
p
s
s
1
2
3
4
5
Número quântico principal, n
Profa. Liliane de Souza - 2010
3
Universidade Paulista – UNIP Curso de Engenharia
Atração Interatômica : ligação atômica
Quanto mais profundo for o poço de
energia mais forte é a ligação química
Atrativa
Repulsiva
Magnitude: distância entre os átomos
Profa. Liliane de Souza - 2010
4
Tipos de Atrações lnteratômicas
• Ligação Iônica – atração eletrostática: cátion + ânion.
Ligação Metálica – um caso especial de atração
eletróstatica: cátions + nuvem de elétrons.
• Ligação Covalente – formação de dipolos induzidos ou
permanentes
formação de moléculas.
Profa. Liliane de Souza - 2010
5
Ligação interatômica
• Ligação iônica: mais fácil de ser descrita e visualizada
os átomos se tornam íons com perda ou ganho de elétrons para
adquirir configurações estáveis semelhante a um dos gases nobres
(2 ou 8 elétrons m sua última camada)
a ligação ocorre por forças atrativas que é função da distância
interatômica:
atrativa: EA= - A /r
repulsiva: ER= - B / rn Onde A e B são constantes que dependem de cada sistema
iônico e r é o raio de aproximação.
Profa. Liliane de Souza - 2010
6
Ligação Atômica
Ligação Covalente
– compartilhamento dos elétrons de valência
de dois átomos adjacentes
Representação esquemática da
ligação covalente na molécula
de metano ( CH4 ) e água (H2O)
7
Atrações Interatômicas
Os estados sólidos, líquidos e gasosos dos materiais estão diretamente
ligados às atrações que mantém os átomos unidos.
• Ligações Primárias:
iônicas, covalentes e metálicas
•Ligações Secundárias:
--dipolo induzido
- forças Van der Waals
-ligações de hidrogênio
são fracas em relação às primárias (Energia de ligação 10
kJ/mol ou 0,1 eV/átomo)
Ocorrem entre dipolos induzidos e moléculas
polares
8
Ligação Atômica nos Sólidos
Ligação Metálica
– elementos metálicos possuem de um a três
elétrons de valência
– os elétrons de valência não estão ligados a um
único átomo, mas estão mais ou menos livres para
de movimentar por todo o metal - nuvem
eletrônica
– os núcleos e os elétrons restantes formam o núcleo
iônico carregados positivamente
– os elétrons livres protegem os núcleos iônicos das
forças repulsivas (“cola”)
– bons condutores elétricos e térmicos devido aos
elétrons livres
– ruptura dúctil na temperatura ambiente
Ilustração esquemática
da ligação metálica
9
Universidade Paulista – UNIP Curso de Engenharia
Características dos sólidos iônicos:
Ligação: interação com muitos átomos em todas as direções.
Energia de ligação relativamente grandes (600 a 1500 kJ/mol)
temperaturas de
fusões elevadas
Sólidos iônicos em geral são duros e frágeis
Sólidos iônicos em geral são isolantes térmicos e elétricos
10
Universidade Paulista – UNIP Curso de Engenharia
Características:
Sólidos covalentes: interação direcional, isto é, ela ocorre na
direção entre um átomo e outro.
No de ligações covalentes: número de elétrons de valência(N’)
Cl = 1s22s22p63s23p5 N’=7 logo NoLV= 8 - N’ = 1
C= 1s22s22p2
N’=4 logo NoLV= 8 – N’ = 4
Os sólidos covalentes podem ser muito fortes ou muito fracos
dependerá dos átomos envolvidos e suas estruturas de
empacotamento.
11
Ligação Iônica e Covalentes
Exemplos ligação iônica:
– Diamante (Tf = 3550oC)
– Bismuto (Tf = 270oC)
Informações gerais: ligações iônicas e covalentes
Normalmente as ligações interatômicas
são parcialmente iônicas e parcialmente
covalentes, poucos compostos exibem
ligações
com
caráter
que
seja
exclusivamente iônico ou covalente;
Diferença eletronegatividade
Quanto maior for a diferença entre as
eletronegatividades mais iônica será a
ligação. De modo contrário, quanto menor
for a diferença de eletronegatividade maior
será o grau de covalência.
12
Ligação Atômica nos Sólidos
Ligações Secundárias: Dipolo Induzido Flutuantes
Todos os átomos apresentam constantes movimentos vibracionais,
que podem causar distorções instantâneas e de curta duração com a
conseqüente criação de pequenos dipolos elétricos.
Um dipolo pode ser criado ou induzido num átomo ou molécula que
seja normalmente simétrico.
Sólidos formados por este tipo de ligações apresentam baixíssimos
pontos de fusões e ebulições.
13
Ligação Atômica nos Sólidos
• Ligações Secundárias ou de Van der Waals
Ligações entre Molécula Polares e Dipolo Induzido
Momentos dipolo permanentes existem em algumas moléculas em
virtude de um arranjo assimétrico, tais moléculas são chamada de
moléculas polares.
As moléculas polares podem induzir dipolos em moléculas apolares
adjacentes, desse modo se forma uma ligação.
A magnitude dessa ligação será maior que será maior que a de dipolo
induzido.
14
Ligação Atômica nos Sólidos
• Ligações Secundárias ou de Van der Waals
Ligações Dipolo Permanentes e pontes de hidrogênio
Ligação de hidrogênio é o tipo mais forte de ligação
secundária. Ocorre entre moléculas nas quais o H está
ligado covalentemente ao Fluor, F
Oxigênio, O
Nitrogênio, N
Ex.: HF, H2O,NH3.
Ligação por ponte de hidrogênio com magnitude de
ligação maior que para os outros tipos de ligação
secundária.
15
16
Relação com as Propriedades
• Materiais sólidos: interação com muitos
átomos.
• Resistência mecânica: aumenta com a força
máxima e com o aumento da energia de ligação
(aumento da profundidade do poço da curva de
energia de ligação.
• Pontos de fusão e de ebulição: aumentam
com o aumento da energia de ligação.
• Coeficiente de expansão térmica: diminui com
o aumento da energia de ligação.
Profa. Liliane de Souza - 2010
17
Classificação dos Materiais: tipos
• Pode-se classificar a maioria dos materiais em 3 tipos:
Metais, Poliméricos e Cerâmicos
- Os metais são compostos por elementos cujos átomos perdem
elétrons facilmente (ligação metálica)
- Elementos não metálicos que compartilham elétrons formam os
materiais orgânicos como os polímeros (ligação covalente).
- Materiais cerâmicos contêm elementos metálicos e não-metálicos:
MgO, SiO2, vidros (ligações iônicas e covalentes).
• As 3 categorias citadas, às vezes, não são nitidamente delineadas.
• Temos materiais intermediários entre os cerâmicos e os plásticos
(silicones, por exemplo).
• Os semicondutores podem ser considerados como metais ou como
materiais cerâmicos dependendo da composição.
• O grafite também é outro material que não se encaixa em nenhuma
das classificações básicas.
Profa. Liliane de Souza - 2010
18
Exercício
Tendo em conta as energia de ligação
dos seguintes compostos
MgO – 640 kj/mol
C (diamante) - 713 kj/mol
H2O – 51 kJ/mol
E os raios atômicos:
O (Z=8) – 0,60 Angstron
C (Z=6)– 0,70 Angstron
H (Z=1) - 0,46 Angstron
Mg (Z=12) – 1,6 Angstron
Estime as curvas de Energia Potencial
vs distância internuclear.
Tendo em conta os números atômicos
de cada átomo a partir de suas
distribuições eletrônicas proponha os
tipos de ligações dos compostos.
Profa. Liliane de Souza - 2010
19
Universidade Paulista – UNIP Curso de Engenharia
COORDENAÇÃO ATÔMICA
Distância interatômica
No Coordenação
Raio Atômico e Iônico
Profa. Liliane de Souza - 2010
20
Universidade Paulista – UNIP Curso de Engenharia
No Coordenação – NC: número de vizinhos mais próximos de um dado átomo em
uma dada estrutura espacial
Estruturas cristalinas
EMPACOTAMENTOS
Estruturas amorfas
Profa. Liliane de Souza - 2010
21