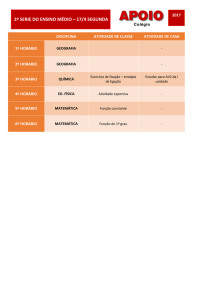
TERMOQUÍMICA
Alyson Oliveira 15754
Vanessa Cortez 15787
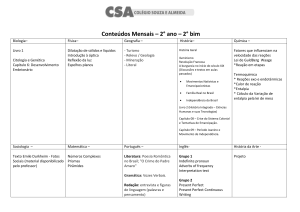
Tópicos a serem abordados
A Natureza da Energia
A Primeira Lei da Termodinâmica
Entalpia
Entalpia de Reação
Calorimetria
Lei de Hess
Entalpias de Formação
Alimentos e Combustíveis
A Natureza da Energia
Energia: capacidade de realizar trabalho e de
transferir calor.
Energia Cinética: energia relacionada ao
movimento de um corpo.
Energia Potencial: é a forma de energia que se
encontra em um determinado sistema e que
pode ser utilizada a qualquer momento para
realizar trabalho.
A Natureza da Energia
Unidades de energia:
Joule (J)
Caloria (cal)
1 cal = 4,184 J
Sistema e Vizinhança
Transferência de Energia:
Calor
Trabalho
A Primeira Lei da Termodinâmica
É a lei que enuncia a conservação de energia.
Energia interna = Energia total do sistema = Σ
Ecinética + Epotencial das partes constituintes do
sistema.
A energia interna é uma propriedade extensiva
(proporcional à massa).
A temperatura e a pressão exercem influência
sobre a energia interna.
A Primeira Lei da Termodinâmica
∆E = Efinal – Einicial
∆E = q + ω
q > 0 : calor recebido
q < 0 : calor desprendido
ω > 0 : trabalho motor
ω < 0 : trabalho resistente
A Primeira Lei da Termodinâmica
Processo
endotérmico:
transferência de calor
da vizinhança para o
sistema.
Processo exotérmico:
transferência de calor
do sistema para a
vizinhança.
A Primeira Lei da Termodinâmica
Função de estado : depende somente do estado
final e inicial do sistema e não do processo pelo
qual foi atingido este estado (pressão, volume,
temperatura, entalpia etc).
Entalpia
Calor trocado sob pressão constante.
Entalpia (H) é uma função de estado.
Entalpia é uma propriedade extensiva
(proporcional à energia interna)
∆H = Hfinal – Hinicial = qp (P = cte)
∆H > 0 : processo endotérmico
∆H < 0 : processo exotérmico
Entalpia de Reação
∆Hr = Hprodutos – Hreagentes
Representação:
2 H2(g) + O2(g) 2 H2O(g)
∆H = - 483,6 kJ
Calorimetria
A medição do fluxo de calor.
O aparelho utilizado para medir o fluxo de calor
é denominado calorímetro.
Calorimetria
Capacidade calorífica: é a quantidade de calor
necessária para que um corpo aumente sua
temperatura em 1 K (1ºC).
Capacidade calorífica molar: é a capacidade
calorífica de 1 mol de substância (pura).
Calor específico: é a quantidade de calor que
deve ser fornecida a 1 g de uma substância
para aumentar sua temperatura em 1ºC (1 K),
de 14,5 a 15,5ºC.
Calor específico = q / m x ∆T (J / g x K)
q = m x c x ∆T
Calorimetria
As técnicas e os equipamentos aplicados
em calorimetria dependem da natureza do
processo estudado (P = cte ou V = cte).
∆T > 0 qreação < 0 reação exotérmica
∆T < 0 qreação > 0 reação endotérmica
Calorimetria
Bomba calorimétrica: utilizada para estudar a
energia química potencial acumulada nas
substâncias, medida a volume constante.
Para calcular o calor de combustão a partir do
aumento de temperatura medido na bomba
calorimétrica é necessário saber a capacidade
calorífica (Ccal) do calorímetro.
qreação = - Ccal x ∆T
Calorimetria
Bomba calorimétrica
Lei de Hess
A lei de Hess estabelece que se uma
reação for executada em uma série de
etapas o ∆H para a reação será igual à
soma das variações de entalpia para as
etapas individuais.
Lei de Hess
Exercício
A entalpia de combustão de C em CO2 é -393,5
kJ/mol de C, e a entalpia de combustão de CO
em CO2 é - 283,0 kJ/mol de CO.
(1) C(s) + O2(g) CO2(g)
∆H = -393,5 kJ
(2) CO(g) + ½ O2(g) CO2(g) ∆H = -283,0 kJ
Utilizando-se esses dados, calcule a entalpia de
combustão de C para CO:
C(s) + ½ O2(g) CO(g)
Lei de Hess
Resolução
C(s) + ½ O2(g) CO2(g)
CO2(g) CO(g)
∆H = -393,5 kJ
∆H = 283,0 kJ
C(s) + ½ O2(g) CO(g)
∆H = -110,5 kJ
Entalpias de Formação
Entalpia de Formação: é o calor liberado ou absorvido
na formação de 1 mol de uma determinada substância a
partir de substâncias simples no estado padrão.
Estado padrão: forma original de uma substância pura à
pressão atmosférica (1atm) e à temperatura de interesse
(298 K ou 25ºC).
H=0
Cgrafite
O2(g)
Srômbico
P4 (branco)
H>0
Cdiamante, C60, C40
O3(g)
Smonoclínico
Pn (vermelho)
Alimentos e Combustíveis
Calor específico de combustão: é a
energia liberada quando 1 g de uma
substância sofre combustão.
Alimentos:
Reação química da respiração celular
C6H12O6(s) + 6 O2(g) 6 CO2(g) + 6 H2O(g) ∆H = - 2803 kJ
Alimentos e Combustíveis
Alimentos e Combustíveis
Combustível: denomina-se combustível
qualquer corpo cuja combinação química
com outro seja exotérmica.
Quanto maior a porcentagem de carbono
e hidrogênio em um combustível, mais
alto é seu calor específico de combustão.
Alimentos e Combustíveis
Alimentos e Combustíveis
Combustíveis fósseis
Alimentos e Combustíveis
Energia Nuclear
Alimentos e Combustíveis
Energia Solar
Alimentos e Combustíveis
Energia Eólica
Alimentos e Combustíveis
Energia Geotérmica
Alimentos e Combustíveis
Energia Hidrelétrica
Alimentos e Combustíveis
Energia de Biomassa
Referências Bibliográficas
Theodore L. Brown, H. Eugene Le May, Jr.
, Bruce E. Bursten - 9ª edição. – Química
a Ciência Central
Imagens – www.google.com