Vapor d´água e seus efeitos
termodinâmicos
Energia livre de Gibbs e Helmholtz
Equação de Clausius Clapeyron
Funções Termodinâmicas e condições
de equilíbrio
Em estados de equilíbrio todas as
transformações de fase são possíveis e são
reversíveis
Vapor
Vapor
Liquido
Liquido
Sólido
Sólido
Entropia
Aumenta
neste sentido
Sólido
Liquido
Vapor
• Portanto qualquer aumento em entropia de
um corpo é igual em magnitude à diminuição
em entropia do ambiente.
• Lembrando que a condição necessária para
um estado de equilíbrio é que a entropia total
de um corpo e do ambiente sejam ctes.
• Entretanto, esta condição de equilíbrio de
estado é muito difícil de ser aplicada em
prática.
• Dessa maneira, podemos avaliar duas funções
de estado termodinâmico que podem nos
levar a condições de equilíbrio sob certas
condições:
Energia Livre de Helmholtz
Energia Livre de Gibbs
Energia Livre de Helmholtz - F
• A energia livre de Helmholtz, F, de um corpo
de massa unitária é expressa como:
F = u – TS
onde u é a energia interna, T a temperatura e S
a entropia do sistema
Analisando a variação de F, ou seja,
diferenciando temos:
dF = du – TdS – SdT
• lembrando que em um estado de equilíbrio e
em processo reversível , temos que da 1º lei
da termodinâmica
dq du pd
dq
mas, dS
T
TdS du pd
dF SdT pd
• Logo se um corpo estiver em equilíbrio e a sua
temperatura e volume forem constantes, temos
que:
dF = 0
• Por outro lado, se um corpo sofrer uma mudança
de fase espontânea, ou seja, transformação
irreversível, temos que:
dF < -SdT - pd ( ou dF < du – TdS – SdT)
• Se a transformação for isotérmica temos que:
dF = du – TdS
• Se a transformação for espontânea,
irreversível, com T e constantes temos:
dF ≤ 0
Logo tanto a entropia (S) como a energia
interna (du) aumentam.
• Dessa maneira, em um estado de
equilíbrio com T e Vol constantes,
a energia livre de Helmholtz tem
um mínimo e por esta razão é
conhecida como potencial
termodinâmico com Vol e T cte.
Energia Livre de Gibbs - G
• A energia livre de Gibbs, G, de um corpo de
massa unitária pode ser expressa como:
G u TS p
Onde u é a energia interna, T a temperatura, p a
pressão e o volume específico e S é a
entropia do sistema
Analisando a variação de G, ou seja,
diferenciando temos
dG du TdS SdT pd dp
da 1º e da 2º lei da termodinâmica e para um
processo reversível, temos
TdS du pd
Logo, temos
dG TdS TdS SdT dp
dG SdT dp
• Portanto se T e P são constantes para
um corpo em equilíbrio, dG = 0
• Já para um corpo que sofre uma
transformação espontânea,
irreversível, temos que:
dG SdT dp
onde dG ≤ 0
• O critério de equilíbrio
termodinâmico de um corpo com T e
P constantes é que a energia livre de
Gibbs tenha um valor mínimo.
• Portanto, a energia livre de Gibbs é
também conhecida como potencial
termodinâmico a pressão constante.
• Como a energia livre de F e G estão
relacionadas com a energia interna,
podemos avaliar como o trabalho
pode ser aproveitado e estar
relacionado com estas energias.
• Da 1º lei da termodinâmica, nós
assumimos que o trabalho realizado
foi a partir de uma expansão pd
• Adicionalmente podemos ter que o
trabalho pode ter sido realizado a
partir de uma expansão elétrica ou
mesmo a partir de duas superfícies
entre duas fases vapor/liquido ou
liquido/gelo.
• Da 1º lei temos
• dq = du + dWtotal, onde
dWtotal é o trabalho realizado
por um corpo de massa unitária
• De um processo reversível temos
dq = TdS
• Logo TdS = du + dWtotal
• Mas como dF = du – TdS –SdT,
temos que dWtotal = -dF – SdT
Portanto se T = cte dWtotal = -dF,
• Ou seja, o trabalho realizado por um
corpo em um processo reversível e
isotérmico é igual a diminuição da
energia livre de Helmholtz de um
corpo.
• Agora se dA é trabalho realizado por
um corpo de massa unitária sob e
sobre qualquer trabalho pd, temos
que
dA = dWtotal - pd
Mas
dG = du –TdS – SdT + pd + dp
e da 1º+2º Lei
TdS = du + dWtotal
dA dG SdT dp
• Portanto se T e P são constantes temos
que:
dA = -dG
• Dessa maneira, o trabalho externo
realizado por um corpo em um
processo reversível, térmico e isobárico
é igual a diminuição da energia livre de
Gibbs de um corpo.
• Finalmente, temos que se uma
molécula é removida de um
material em uma certa fase com
T e P constantes, temos que a
mudança resultante na energia
livre de Gibbs de um material é
conhecida como Potencial
Químico daquela fase.
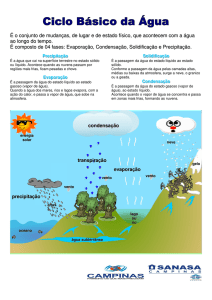
Equação do estado para o vapor d’água
• Diferentemente de outros constituintes
atmosféricos, a água aparece na atmosfera em
três fases, sólido, liquido e vapor.
• Na fase vapor, temos que o vapor d’água na
atmosfera se comporta aproximadamente
como um gás ideal
Portanto temos que a equação do estado
pode ser re-escrita como:
e v RvT
eq. (1)
onde e=pressão de vapor, v = densidade
do vapor e R v = é constante individual
do vapor d’água (461,5 J/kgK)
De uma outra forma
e v
R´
T
eq. (2)
onde =R’/ R v = m v /m = 0,622
Equação de Clausius-Clapeyron
• Assumindo um ambiente fechado e
termicamente isolado
Equilíbrio - I
• O equilíbrio é alcançado quando
as taxas de condensação e
evaporação se tornam iguais.
• Logo a temperatura do ar e a do
vapor se igualam a do liquido e
não existe uma transferência
liquida de uma fase para outra.
Equilíbrio - II
• Quando isso ocorre, dizemos que
o ar acima do liquido esta
saturado com vapor d’água e a
pressão parcial sob estas
condições é definida como
pressão de vapor de saturação.
Pressão de Vapor de Saturação
• Também conhecida como equação
de Clausius Clapeyron – C.C.
• Pressão de saturação entre as
interfaces
–Vapor liquido (condensação)
–Vapor sólido (sublimação)
–Liquido Sólido (congelamento)
• Durante as transições de fase,
faz-se necessário energia (calor)
para sobrepor a energia cinética
de algumas moléculas, por
exemplo
vapor liquido,
vapor sólido e
liquido sólido.
Para converter uma unidade de
massa de água liquida para vapor
a T e P constantes, temos que
adicionar energia (calor) ao
sistema, ou seja, calor latente.
No caso de liquido para vapor
utilizamos o calor latente de
vaporização.
da 1º lei da termodinâmica
u2
2
u1
1
eq. (3)
Lv dq' du es d
A seguinte notação é adotada para as
diferentes fases da água:
1-liquido, 2-vapor e 3-sólido.
Considerando que o processo de
mudança é isotérmico e isobárico a
equação (3) pode ser integrada e se
tornar:
Lv (u2 u1 ) es ( 2 1 )
eq. (4)
Combinando a mudança de fase a um
processo reversível; ou seja:
dq´
dS
T
TdS dq´
Integrando
S2
TdS
dq
´
L
v
S1
Lv T (S 2 S1 )
Lv T (S 2 S1 ) (u 2 u1 ) es ( 2 1 )
Re-arranjando os termos por fases de estado
temos:
u1 es1 TS1 u2 es 2 TS 2
eq. (5)
u1 es1 TS1 u2 es 2 TS 2
• Esta igualdade mostra uma
combinação particular de
variáveis termodinâmicas que
permanecem constantes em uma
mudança de fase isotérmica e
isobárica.
• Esta combinação é conhecida
com a função de Gibbs que é
descrita como:
G u1 es1 TS1
• Logo a eq (5) se reduz a G1 = G2
Embora G seja constante durante a
transformação de fase, a função de
Gibbs varia (aumento da entropia),
logo T e P podem variar.
Dessa maneira, temos que analisar a
variação da energia livre de Gibbs
(dG) durante esta transição.
Processo não- isotérmica e
não-isobárico
dg du es d des TdS SdT
eq. (6)
• Levando em conta a
termodinâmica:
o
1
e
o
2
lei da
dq´ = du + esd
dq´= TdS
A eq. (6) se torna:
dg = des – SdT
eq. (7)
Suponha a vaporização de uma
unidade de massa de água liquida
em um processo reversível, logo
temos que:
G1=G2
• Portanto haverá uma variação da
energia livre de Gibbs de forma que
G1 G1+dG1
G2 G2+dG2
Mas como G1 = G2
G1+dG1 e
G2+dG2
Portanto dG1= dG2, logo:
1des S1dT 2 des S 2 dT
des ( S 2 S1 )
dT ( 2 1 )
des
Lv
dT T ( 2 1 )
Lembrando:
Lv
( S 2 S1 )
T
eq. (8)
Equação de Clausius-Clapeyron
Analogamente podemos ter as
transições de vapor-sólido e liquido e
sólido
des
Lv
dT T ( 2 1 )
Vapor - Sólido
desf
dT
Lf
T (1 3 )
Vapor - Liquido
desi
Ls
dT T ( 2 3 )
Sólido- Liquido
Vapor - Liquido
des
Lv
0
dT T ( 2 1 )
2 1
Vapor - Sólido
desi
Ls
0 2 3
dT T ( 2 3 )
Sólido- Liquido
desf
dT
Lf
T (1 3 )
0
1 3
esfT)
es(T)
esi(T)
• Em condições atmosféricas,
temos que 2 >> 1
(vapor>>liquido), e o vapor age
como se fosse um gás ideal,
• da mesma forma temos que 2
>> 3 (vapor>>sólido)
Simplificando a eq. Clausius-Clapeyron
(C.C.),
des
Lv
dT T 2
eq. (9)
Lembrando a eq. estado do vapor: =RvT/es
des
Lv es
2
dT
RvT
Assumindo que o Calor Latente de
vaporização é cte, podemos integrar a
equação (9):
es (T )
T
des Lv dT
2
dT
R
T
v
es 0 6.11
To
es Lv 1 1
ln
eso Rv To T
Lv 1 1
es eso exp
Rv To T
eq. (10)
Similarmente para a fase sólida
Ls 1 1
esi eso exp
Rv To T
o
onde To=273 K
25
ES
Ei
Pressao de Vapor (mb)
20
15
10
5
0
-30
-25
-20
-15
-10
-5
0
Temperatura (C)
5
10
15
20
0.50
ES-Ei
Pressao de Vapor (mb)
0.40
0.30
0.20
0.10
0.00
-30 -28 -26 -24 -22 -20 -18 -16 -14 -12 -10 -8 -6 -4 -2
Temperatura (C)
0
Diagrama que esquematiza as possíveis
situações entre e, es, e ei em uma
nuvem com fase mista:
(a) e > es e e > ei processo onde tanto
as gotas liquidas como as particulas de
gelo crescem;
(b) e < es e e > ei processo onde as
gotículas líquidas evaporam e as
partículas de gelo crescem – processo
de WBF;
(c) e < es e e < ei processo onde tanto
as gotículas de água como as
particulas de gelo evaporam.
Korolev, JAS 2006.