1
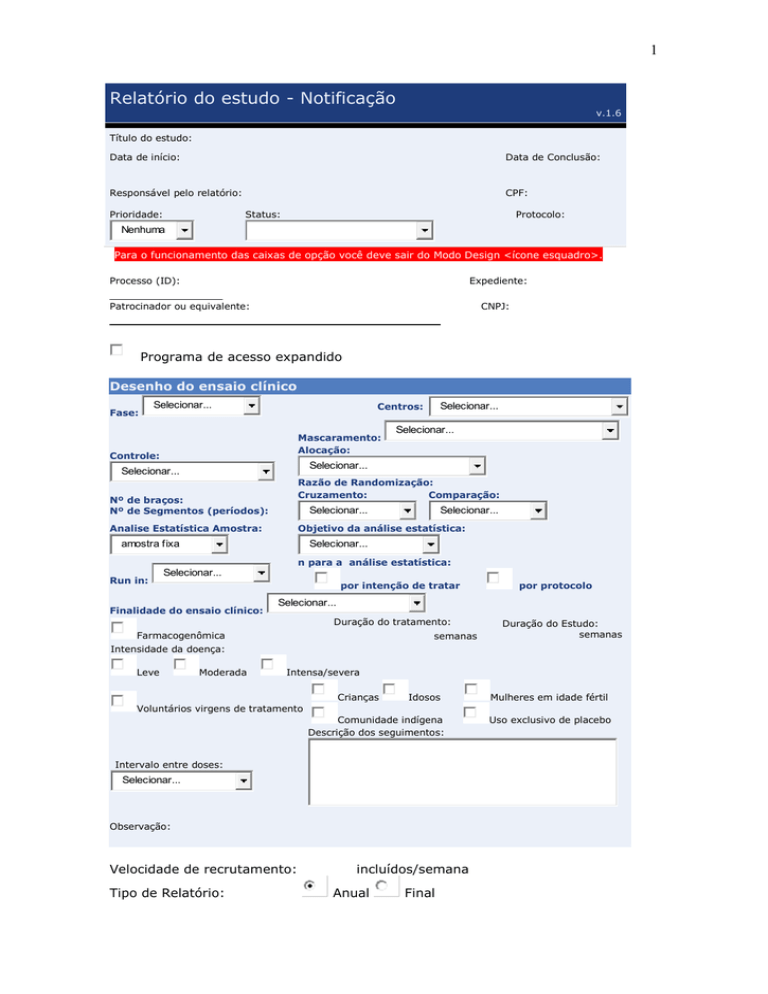
Relatório do estudo - Notificação
v.1.6
Título do estudo:
Data de início:
Data de Conclusão:
Responsável pelo relatório:
CPF:
Prioridade:
Status:
Protocolo:
Nenhuma
Para o funcionamento das caixas de opção você deve sair do Modo Design <ícone esquadro>.
Processo (ID):
Expediente:
Patrocinador ou equivalente:
CNPJ:
Programa de acesso expandido
Desenho do ensaio clínico
Fase:
Centros:
Selecionar...
Mascaramento:
Alocação:
Controle:
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Razão de Randomização:
Cruzamento:
Comparação:
Nº de braços:
Nº de Segmentos (períodos):
Selecionar...
Analise Estatística Amostra:
Selecionar...
Objetivo da análise estatística:
amostra fixa
Selecionar...
n para a análise estatística:
Run in:
Selecionar...
por intenção de tratar
Finalidade do ensaio clínico:
Selecionar...
Duração do tratamento:
Farmacogenômica
Intensidade da doença:
Leve
Moderada
por protocolo
semanas
Duração do Estudo:
semanas
Intensa/severa
Crianças
Idosos
Mulheres em idade fértil
Voluntários virgens de tratamento
Comunidade indígena
Descrição dos seguimentos:
Intervalo entre doses:
Selecionar...
Observação:
Velocidade de recrutamento:
Tipo de Relatório:
incluídos/semana
Anual
Final
Uso exclusivo de placebo
2
Dados da publicação dos dados parciais (Nome da revista, título do trabalho,
autores, volume, série, ano, páginas, editora):
1. Há algum paciente ainda participando do estudo? ( ) Sim ( ) Não
2. Há algum paciente ainda em acompanhamento? ( ) Sim ( ) Não
3. Há algum paciente em acompanhamento para análise de sobrevida? ( ) Sim ( ) Não
4. A inclusão está aberta em algum centro? ( ) Sim ( ) Não
5. Qual foi a data de inclusão do primeiro paciente do estudo?
6. Há extensão para este protocolo? ( ) Sim ( ) Não
Especificar
Foram enviadas as aprovações dos CEPs para a extensão do protocolo? ( ) Sim ( ) Não
Centro
Nome do Investigador
principal
CPF
Sim
Não
7. Houve gravidez? ( ) Sim ( ) Não
Especificar paciente e local; descrever conduta adotada.
8. Houve quebra do código para mascaramento do estudo? ( ) Sim ( ) Não
Especificar paciente e local; descrever circunstâncias.
9. O NÚMERO DE VOLUNTÁRIOS NO ENSAIO CLÍNICO
Número de
voluntários
no Brasil
Número de
voluntários
no estudo
Extensão
(quando couber)
Voluntários planejados para o estudo
Voluntários que assinaram o TCLE
Voluntários randomizados / incluídos
Voluntários descontinuados
(não incluir as falhas de triagem)
Completaram o estudo
Obs
9.1 Houveram perdas de seguimento? ( ) Sim ( ) Não
Especificar número do sujeito, alocação de seguimento e motivo da perda.
número do sujeito
alocação de seguimento
motivo da perda
10. Justificar retirada de cada voluntário (descontinuados)
11. Indique se algum dos itens abaixo ocorreu no estudo desde o último relatório:
Eventos Adversos Graves (EAGs) ( ) Sim ( ) Não
(Devem ser relatados ao CEP no momento em que o centro tomou conhecimento do EAG)
Desvios do protocolo ( ) Sim ( ) Não
Emendas ao protocolo ( ) Sim ( ) Não
Propagandas / Material para recrutamento. Foi aprovado pelo CEP da instituição? ( ) Sim ( ) Não
3
Alteração na localização de algum centro? ( ) Sim ( ) Não
Especificar:
Mudança de investigador principal? ( ) Sim ( ) Não
Especificar:
Alteração no regime de dosagem? ( ) Sim ( ) Não
Especificar:
12. Desde o último relatório, houve informações de segurança relatadas aos centros?
Essa informação foi relatada aos CEPs?
13. Desde o último relatório, algum CEP encerrou ou suspendeu aprovação de qualquer centro
participante deste estudo?
14. Desde o último relatório, algum CEP impôs restrições ou sanções a qualquer centro participante
deste estudo?
15. Algum paciente buscou compensação por danos causados por este estudo?
16. Algum centro recebeu alguma queixa de pacientes referente à condução do estudo?
17. Houve mudança de CEP em algum centro deste estudo?
Se você responder "sim" a qualquer uma das perguntas 11 a 17, você deverá fornecer uma
explicação detalhada e qualquer documentação pertinente.
Demografia da população incluída:
(características, gravidade, raça, idade, basal, sexo, ...)
Descrição dos resultados, indicar nível de significância (valor de p) para cada
resultado, e os valores de NNT ou NNH para cada intervenção
Conclusão dos Resultados segundo o patrocinador*:
Selecionar...
* item obrigatório no caso de relatório final;
Comentários
Comentário Geral
Enviado por
Data
4
Eventos adversos
Número
ou
Código
Descrição Data da
do
Causa do Evento Adverso
Evento
notificação
Sujeito
de
pesquisa
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Identificação do Centro de Pesquisa
(Instituição mantenedora;
Evolução Clínica
Nome do centro)
5
Eventos adversos graves
Número
ou
Código
Descrição Número da
do
Causa do Evento Adverso
Evento
notificação
Sujeito
de
pesquisa
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Selecionar...
Identificação do Centro de
Pesquisa
(Instituição mantenedora;
Nome do centro)
Evolução Clínica
6
Termo de responsabilidade
Assumo, civil e criminalmente, inteira responsabilidade pela veracidade das
informações aqui apresentadas.
Data
NOME:
Patrocinador:
Assinatura
CNPJ:
CPF:
Ações da Vigilância Sanitária
Avaliador:
Prioridade:
Nenhuma
Status:
Data de Conclusão:
Não Iniciado
Descrição da ação
Enviado por
Data
Encaminhamentos
Nome
Endereço de e-mail
Comentários de Fechamento
Número do Telefone