UTILIZAÇÃO
DE
DIFERENTES
MÉTODOS
DE
COLORAÇÃO
PARA
A
IDENTIFICAÇÃO
DE
COMPONENTES TISSULARES DO INTESTINO DELGADO
DE SUÍNOS
USE OF DIFFERENT STAIN METHODS FOR TISSULAR COMPONENTS
IDENTIFICATION IN SMALL INTESTINE SECCIONS OF SWINE
Francisco Carlos de Sousa1, Carlos Marcelo Viana de Sousa2, Samuel Ramos Silva2, Leonel
Praciano Matos2, Fernando Maria Leite Pinheiro3, Dácio Ítalo Alves Teixeira4, José Roberto Feitosa
Silva5 , Cláudio Cabral Campello6
RESUMO
A coloração dos tecidos é uma etapa indispensável para que se possa estudar, eficientemente, cortes histológicos ao
microscópio ótico e consiste em se corar, com diferentes cores, as estruturas celulares e intersticiais presentes nas secções obtidas por
microtomia. O presente trabalho foi desenvolvido com o objetivo de identificar e estudar as estruturas constituintes da mucosa do
intestino delgado de leitões por meio de diversos métodos de coloração aplicados sobre cortes histológicos seriados. Para tanto,
amostras de intestino, obtidas de leitões com idades de 7 e 14 dias após o desmame, foram processadas para estudo histológico
(fixadas em formaldeído tamponado, desidratadas em série alcoólica de concentração crescente, diafanizadas em xilol, impregnadas e
incluídas em parafina), seccionadas seqüencialmente em micrótomo e submetidas à coloração com os métodos de HematoxilinaEosina (HE), PAS-Alcian Blue, métodos tricrômicos de Azan-Mallory e Gomori e histoquímica com lectinas conjugadas com
fluoresceína. Os resultados obtidos demonstraram que o método de PAS-Alcian Blue foi o mais indicado para evidenciar o glicocálix
da borda em escova do epitélio cilíndrico simples e as células caliciformes; a coloração com HE mostrou claramente o núcleo das
células absortivas e dos linfócitos intraepiteliais, contrastando com o citoplasma, e também possibilitou a visualização das células
caliciformes, mas não demonstrou a borda em escova; a coloração realizada com o tricrômico de Gomori não permitiu a identificação
de nenhuma estrutura em particular; o corante de Azan-Mallory promoveu uma nítida diferenciação entre o núcleo e o citoplasma,
evidenciou as fibras musculares e as hemácias em capilares presentes na lâmina própria dos vilos intestinais; a microscopia de
fluorescência destacou a borda em escova. Nas lâminas de parede intestinal coradas com lectinas fluoresceinadas pôde-se observar a
vascularização de baixo calibre, visível através da presença de hemácias fluorescentes.
Palavras-chave: estudo histológico, intestino delgado, leitões.
ABSTRACT
The coloration of the tissues is an indispensable stage to study, efficiently, histological sections by light microscopy and it
consists of blushing, with different colors, the cells and interstitial structures in the sections obtained by microtome. The present work
was developed with the objective of to identify and to study the constituent structures of the mucous membrane of the small intestine
of pigs through several coloration methods applied on seriate histological cuts. For so much, intestinal samples, obtained of piglets
with 7 and 14 days after weaning, were processed for histological study (fixed in buffered formaldehyde, dehydrated in alcoholic
series of growing concentration, cleared in xylene and embedded in paraffin), seccioned in microtome and submitted to coloration
with the methods of Hematoxylin-Eosin (HE), PAS-Alcian Blue, trichrome methods of Azan-Mallory and Gomori and histochemical
procedures with lectins conjugated with fluorescein. The results obtained demonstrated that the method of PAS-Alcian Blue was the
most suitable to evidence the glicocalyx of the simple cylindrical epithelium brush border and the goblet cells; the coloration with HE
showed clearly the nucleus of the absortive cells and the same structure of the intraepithelial lymphocytes, contrasting with the
cytoplasm and it made possible the visualization of the goblet cells, but it did not demonstrate the brush border; the coloration
accomplished with the trichrome of Gomori did not allow the identification of any special structure; the method of Azan-Mallory
promoted a clear differentiation between the nucleus and the cytoplasm, evidenced the muscular fibers and the erithrocytes in
capillary presents within the intestinal villi; the fluorescence microscopy detached the brush border. Low caliber blood vessels were
seen in the intestinal wall blushed with lectins bound to FITC mainly because of the presence of fluorescent erithrocytes.
Keywords: histological study,1small intestine, piglets.
1
Estudante de graduação em Medicina Veterinária. Monitor da Disciplina de Histologia Veterinária.
Estudante de graduação em Medicina Veterinária. Estagiário do Laboratório de Histologia.
3
Mestre. Doutorando em Zootecnia (UFC). Professor da Universidade do Vale do Acaraú (UVA).
4
Mestre. Professor da Faculdade de Veterinária da Universidade Estadual do Ceará.
5
Doutor. Professor do Centro de Ciências da Universidade Federal do Ceará.
6
Doutor. Professor da Faculdade de Veterinária da Universidade Estadual do Ceará. Orientador.
2
INTRODUÇÃO
A coloração dos tecidos é uma etapa indispensável para que se possa estudar eficientemente
cortes histológicos ao microscópio ótico e consiste em se corar, com diferentes cores, as estruturas
celulares e intersticiais presentes nas secções obtidas por microtomia (Junqueira e Junqueira, 1983).
A importância do processo de coloração em histologia reside no fato de que as partes constituintes
das células e da matriz extracelular são usualmente transparentes e, a menos que exista uma
considerável diferença nos seus índices de refração, elas não são facilmente distinguíveis umas das
outras (Sheehan e Hrapchak, 1973).
Para que se possa obter suficiente contraste de coloração nos cortes histológicos comuns,
em geral são empregadas combinações de corantes ácidos e básicos (Geneser, 2003). Os corantes
ácidos ou aniônicos ligam-se às estruturas com carga predominante positiva, isto é, catiônicas,
básicas, chamadas então de acidófilas. Os corantes básicos ou catiônicos ligam-se às estruturas com
carga predominante negativa, isto é, aniônicas, ácidas, denominadas assim de basófilas (Cormack,
2003). Contudo, alguns métodos de coloração como o tricrômico de Mallory, utilizam diversos
corantes ácidos, que coram diferentes estruturas teciduais (Geneser, 2003).
Muito freqüentemente, na rotina de um laboratório de histologia ou histopatologia, utilizase o método de coloração por Hematoxilina e Eosina (HE) como principal recurso para a
diferenciação de constituintes tissulares com vistas ao seu estudo microscópico (Prophet, 1994). No
entanto, embora este método seja adequado para a visualização de núcleos celulares (com seus
diferentes padrões no estado de condensação da cromatina), citoplasma e limites intercelulares, não
constitui uma ferramenta apropriada quando se pretende investigar estruturas particulares como o
sistema vascular de baixo calibre nos tecidos, fibras do tecido conjuntivo, células secretoras de
glicoproteínas e proteoglicanas, etc.
O intestino delgado (lat. Intestinus, víscera) é um órgão tubular que se estende do piloro
gástrico até a válvula ileocecal, de onde começa o intestino grosso. Apresenta-se subdividido em
três segmentos: duodeno, jejuno e íleo (Geneser, 2003).
A análise da superfície interna desta parte do sistema digestivo mostra a existência de uma
série de dobras ou pregas, em geral paralelas entre si, percorrendo um trajeto circular oblíquo ao
longo do tubo. Essas dobras incluem a mucosa e parte da submucosa. A membrana mucosa do
intestino delgado apresenta numerosas projeções digitiformes denominadas vilos ou vilosidades
intestinais. Entre as bases destas abrem-se as glândulas intestinais (ou criptas de Lieberkühn) que se
aprofundam na lâmina própria até o nível da muscular da mucosa (George, 1985). O epitélio de
revestimento da mucosa intestinal é do tipo prismático simples sendo formado por células
absortivas (enterócitos, caracterizado pela presença de uma condensação em sua superfície apical
— os microvilos formando uma borda estriada), células caliciformes (produtoras de muco,
constituído por glicoproteínas, cuja principal função é lubrificar e proteger o epitélio intestinal),
células enteroendócrinas (constituintes do sistema neuroendócrino difuso), células M (atuam
interiorizando antígenos, sendo importantes para as funções do sistema imunitário do intestino) e
células de Paneth (típicas células exócrinas com grânulos de secreção acidófilos contendo lisozima)
(Ratineau et al., 2001; Ettarh e Carr, 1997). A lâmina própria é constituída por tecido conjuntivo
frouxo ricamente vascularizado e ocupa a porção central das vilosidades e os espaços entre as
glândulas intestinais, sendo comum nesta camada de tecido a presença de folículos linfáticos
solitários. A muscular da mucosa é constituída de duas camadas de músculo liso. A camada
seguinte da parede é a submucosa, a qual constitui-se de tecido conjuntivo frouxo contendo vasos
sanguíneos e linfáticos. Nela são encontrados nervos e células ganglionares que, conjuntamente,
formam o plexo submucoso ou de Meissner (Junqueira e Carneiro, 2004). Disposta seqüencialmente
está a túnica muscular, que se apresenta formada por fibras musculares lisas orientadas em dois
planos, o circular interno e o longitudinal externo, entre os quais localizam-se fibras nervosas e
gânglios do plexo mioentérico ou de Auerbach. Externamente, encontra-se a serosa. Esta se compõe
de um tecido conjuntivo frouxo, recoberto por epitélio pavimentoso simples correspondente ao
peritônio visceral (Cormack, 2003).
A digestão intestinal tem início quando os conteúdos do estômago são influenciados pelo
suco pancreático, bile e secreções intestinais e continua por todo o comprimento do intestino
delgado. O desempenho dessa função exige quantidades volumosas de enzimas digestivas,
juntamente com um grande suprimento de muco para proteger as células epiteliais de autodigestão,
lesões mecânicas e compostos irritantes. As enzimas são fornecidas por células especiais da mucosa
e submucosa, bem como por glândulas que se situam fora do intestino e estão a ele ligadas por
ductos, tais como o fígado e o pâncreas. O muco é produzido pelas glândulas da submucosa e por
células caliciformes (Stinson e Calhoun, 1982).
Diversos tipos de protocolos de coloração têm sido empregados nas pesquisas envolvendo
descrição morfológica de cortes histológicos de intestino delgado.
Ettarh e Carr (1997) realizaram estudo morfológico do epitélio da mucosa entérica em ratos
diabéticos corando os cortes com azul de metileno e fucsina básica para a identificação
individualizada dos diferentes tipos celulares.
Méndez et al., (2001) utilizaram três métodos de coloração para identificação de
mucossubstâncias presentes em cortes de diferentes porções do trato intestinal de frangos: PAS para
o estudo de mucossubstâncias neutras, a combinação dos métodos PAS e Alcian Blue com pH igual
a 2,5 para mucossubstâncias ácidas e a mesma combinação, mas com pH igual a 1,0, para as
mucossubstâncias sulfatadas.
Zeng et al., (2003) e Jidong et al., (2004), trabalhando com intestino delgado de ratos,
utilizaram a técnica de picrosirius red para a análise do colágeno e a de HE para observações
histológicas gerais.
Dilkin et al., (2004) pesquisaram as lesões causadas por intoxicação com fumonisinas
submetendo cortes de intestino delgado de suínos à coloração com PAS (ácido periódico e reativo
de Schiff), com coloração de fundo pela hematoxilina para a evidenciação do muco neutro.
Seixas Filho et al., (2001) utilizaram a técnica de coloração histoquímica de impregnação
pela prata com a finalidade de verificar a distribuição das células enteroendócrinas nos diferentes
segmentos dos intestinos médio, posterior (ou reto) e cecos pilóricos de peixes ósseos.
O estudo dos diversos componentes do intestino delgado requer, muitas vezes, a
combinação de múltiplas técnicas de coloração complementares paralelas, a fim de que se possa
investigar eficazmente a estrutura histológica completa deste segmento do sistema digestório.
O presente trabalho foi desenvolvido com o objetivo de identificar e estudar as estruturas
constituintes da mucosa do intestino delgado de leitões por meio de diversos métodos de coloração
aplicados sobre cortes histológicos seriados, procurando indicar os métodos mais adequados para o
estudo de cada estrutura em particular.
MATERIAL E MÉTODOS
Os animais utilizados no presente trabalho compreendem parte de um lote original de 80
leitões selecionados para experimento destinado à avaliação de ingredientes alternativos de origem
animal e vegetal na dieta de suínos em crescimento. O grupo controle do referido experimento foi
empregado nesta pesquisa. Os leitões, adquiridos comercialmente em granja suinícola, foram
criados nas instalações do Setor de Suinocultura do Departamento de Zootecnia do Centro de
Ciências Agrárias da Universidade Federal do Ceará (CCA/UFC).
Foram coletadas amostras de intestino delgado desses animais, as quais foram inicialmente
fixadas em formaldeído a 10% tamponado por um período de 24 horas e então transferidas para
recipientes contendo álcool etílico a 70% em água destilada, onde permaneceram por cerca de 72
horas. Em seguida, procedeu-se à desidratação das peças em série alcoólica de concentração
crescente (80%, 90%, 95%, 2 100%), diafanização em xilol (2 2 h), inclusão em parafina
histológica e realização de cortes seqüenciais em micrótomo (espessura de 5m). Por fim, as
lâminas contendo secções de intestino delgado foram submetidas a coloração com os métodos de
Hematoxilina-Eosina (HE), PAS-Alcian Blue ou pelos métodos tricrômicos de Azan-Mallory e
Gomori, de acordo com o seguinte protocolo:
1.Desparafinização em xilol
2.Hidratação em série alcoólica de concentração decrescente (100%, 90%, 70% e água destilada)
3.Coloração:
•HE: imersão em hematoxilina (35 segundos), azulecimento em água mineral (5 segundos), imersão
em eosina (5 segundos), remoção do excesso em água destilada.
•PAS-Alcian Bue: imersão em Alcian Blue (30min.), imersão em ácido periódico (15 min.),
lavagem em água destilada, imersão em Reagente de Schiff (15 min.), lavagem em água corrente (5
min.), imersão em hematoxilina (25 segundos) , remoção do excesso em água destilada.
•Tricrômico de Azan-Mallory: imersão no corante (Azul de anilina+Orange G+Fucsina ácida+ácido
fosfotúngstico+água destilada) por 8 minutos.
•Tricrômico de Gomori: imersão em hematoxilina (35 segundos), lavagem em água destilada,
imersão no corante tricrômico de Gomori (Cromotropo C+Fast Green+ácido fosfotúngstico+ácido
acético glacial+água destilada) por 18 minutos
4.Desidratação em série alcoólica de concentração crescente (70%, 90%, 100%)
5.Preparação para montagem (banho em xilol)
6.Montagem da lamínula em Bálsamo do Canadá
Paralelamente, lâminas contendo cortes dos mesmos órgãos foram submetidas a tratamento
com a lectina de Vatairea macrocarpa (VML) fluoresceinada. A lectina usada no experimento foi
cedida pelo Laboratório de Moléculas Biologicamente Ativas, BioMol-Lab (UFC-CE) após ser
isolada e purificada conforme descrito por Cavada et al. (1998).
O processo de marcação da lectina com fluoresceína isotiocianato obedeceu ao seguinte
protocolo: alíquotas contendo 1mg da lectina acrescida do monossacarídeo inibidor (1,0M) foram
dissolvidas em 2,0 mL de solução de conjugação (1,5 mL de tampão carbonato/bicarbonato de
sódio 0,2M; pH 9,3, contendo 0,5 mL de etilenoglicol). Apos rápida agitação em vortex, 500µl de
uma solução de FITC (0,05mg, em etilenoglicol) foi adicionada e a mistura submetida à agitação
por 5h a 4°C ao abrigo da luz. Após incubação, a fração contendo o complexo lectina/FITC foi
separada da FITC não conjugada por meio de cromatografia de exclusão molecular em coluna PD
10 (Pharmacia LKB – 9,0ml), previamente equilibrada com água Milli Q saturada com N-butanol
5%, com fluxo contínuo mantido por força da gravidade. Imediatamente antes da cromatografia,
450µl da solução de equilíbrio foram adicionados à amostra e, em seguida, aplicada a coluna. O
pico I, que correspondia à fração lectina/FITC foi retirado com 3,5 mL de solução N-butanol 5%,
enquanto que a FITC não conjugada foi eluída no Pico II com 10ml da mesma solução.
A lectina fluoresceinada foi conservada sob forma liofilizada até que, imediatamente antes
da utilização, esta foi diluída em solução salina 0,15M e mantidas protegidas da luz. Em seguida, a
solução contendo a lectina marcada com FITC foi aplicada sobre lâminas contendo cortes
histológicos desparafinizados e hidratados e estas foram incubadas em estufa a 37oC por 1 hora.
Finalmente, as lâminas incubadas foram lavadas com NaCl 0,15M para remoção dos excessos de
lectina e eliminação de ligações inespecíficas fracas.
As imagens obtidas com microscópio trinocular Nikon Eclipse E-400 (aumento 40X) foram
captadas por câmara digital Nikon Coolpix 5000 acoplada ao microscópio.
RESULTADOS E DISCUSSÃO
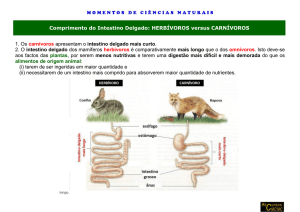
Os resultados obtidos encontram-se demonstrados nas FIGURAS 1 e 2. As imagens
demonstraram que o método de Hematoxilina e Eosina (FIGURA 1A) foi útil para o
reconhecimento da estrutura geral, permitindo a identificação dos limites entre o revestimento
epitelial cilíndrico simples e o tecido conjuntivo frouxo da lâmina própria que preenche
internamente os vilos. A delimitação entre as células do epitélio de revestimento foi feita, bem
como a identificação de células caliciformes e de linfócitos intraepiteliais. Os cortes apresentaram a
coloração típica conferida por este método, isto é, a hematoxilina corou em púrpura o núcleo das
células absortivas e dos linfócitos intra-epiteliais, enquanto a eosina corou o citoplasma em rosa.
As células caliciformes não foram coradas. A coloração com HE foi limitada para a evidenciação do
glicocálix nos microvilos da borda em escova do epitélio intestinal, como também para o estudo do
trajeto dos leitos capilares na lâmina própria dos vilos e das glicoproteínas armazenadas no
citoplasma das células caliciformes.
Nos cortes corados pelo método de PAS-Alcian Blue (FIGURA 1B) tornou-se evidente o
glicocálix na borda em escova do epitélio cilíndrico simples, que se corou em roxo e as células
caliciformes que foram coradas em azul forte. A lâmina própria dos vilos apresentou regiões de
coloração azul pouco intensa entremeada com áreas de cor arroxeada. A coloração roxa do
glicocálix e da lâmina própria pode ter sido um efeito combinado do Alcian Blue e do Reagente de
Schiff, indicando a presença de mucopolissacarídeos neutros e ácidos na borda em escova e
substância fundamental amorfa do tecido conjuntivo da lâmina própria. Não foi observado efeito de
coloração exclusiva pelo método de PAS, o que teria se manifestado pela presença da cor magenta.
Embora haja a possibilidade da não existência de substâncias mucopolissacarídicas exclusivamente
neutras, alternativamente pode-se questionar se o Reagente de Schiff, notoriamente fotossensível,
perdera suas propriedades de coloração. Ainda assim, o procedimento combinado de coloração com
PAS-Alcian Blue tornou visíveis elementos que não haviam sido mostrados claramente pelo método
de HE. No entanto, os limites intercelulares e a localização dos linfócitos intraepiteliais não foram
feitos tão eficientemente quando do uso desta técnica histoquímica.
O corante de Azan-Mallory (Figura 1C) promoveu uma boa diferenciação entre o núcleo
(que se corou em azul escuro) e o citoplasma (corado em azul claro), evidenciou as fibras
musculares (dados não mostrados) e elementos fibrosos do tecido conjuntivo. No entanto, sua
principal utilidade foi a de destacar as hemácias em capilares presentes na lâmina própria dos vilos
intestinais, que apareceram num tom de alaranjado a vermelho, permitindo a visualização de
capilares que não puderam ser percebidos por meio de outros protocolos de coloração.
A coloração realizada com o tricrômico de Gomori (Figura 1D) não permitiu, nos cortes
realizados neste trabalho, a identificação de nenhuma estrutura celular ou extracelular em particular.
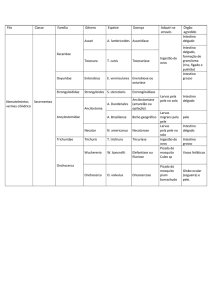
O uso da microscopia de fluorescência mostrou a arquitetura geral do vilo intestinal e a
borda em escova discretamente fluorescente, até mesmo nas lâminas controle, que foram apenas
desparafinizadas, hidratadas e observadas ao microscópio com filtro azul (Figura 2A), mas nenhum
tipo celular foi evidenciado. Nas lâminas de parede intestinal coradas com a lectina VML
fluoresceinada (Figura 2B) pôde-se observar a presença de hemácias em vasos de pequeno calibre,
as quais apareceram emitindo fluorescência. Curiosamente, a borda em escova e as células
caliciformes não exerceram atração sobre as proteínas carboidrato-ligantes utilizadas. Uma possível
explicação para a ausência de marcação de tipos celulares e de glicoproteínas com a lectina usada é
que o carboidrato pelo qual esta tem afinidade (galactose) poderia não estar presente nas lâminas
estudadas. O resultado obtido na microscopia de fluorescência usando lectina marcada com FITC se
contrapõe à afirmação feita por Pusztai (1991), de que a lectina de soja (SBA), uma proteína com
afinidade de ligação também por galactose (e N-acetil galactosamina), é capaz de se ligar a
glicoproteínas situadas na superfície interna do intestino delgado, desencadeando diversos efeitos
biológicos. É possível que a não ligação da VML com o epitélio intestinal tenha relação com a
especificidade fina desta lectina, uma vez que houve preservação dos carboidratos nos cortes
histológicos aqui estudados, como foi demonstrado pela coloração com PAS-Alcian Blue (Figura
1B). No entanto, esta observação leva a se questionar se a ligação estabelecida entre a SBA (lectina
galactose-ligante) e o epitélio intestinal é de origem unicamente lectínica, já que a VML, com o
mesmo tipo de afinidade, não se ligou ao epitélio intestinal de suínos no presente trabalho.
Investigações mais aprofundadas e repetitivas precisarão ser feitas no intuito de esclarecer as razões
pelas quais ocorreram esses fenômenos.
CONCLUSÃO
Com base nos resultados obtidos, pode-se concluir que o método de HE poderia ser
considerado como método de eleição para o estudo da estrutura histológica geral dos vilos
intestinais nos cortes empregados, podendo funcionar perfeitamente para a realização de medidas
morfomicrométricas ou contagem de infiltrados linfocitários no tecido epitelial de revestimento. Se,
por outro lado, a intenção é evidenciar estruturas como o sistema vascular de baixo calibre e sua
distribuição no eixo longo dos vilos, a opção preferencial deve ser o método de Azan-Mallory . O
uso de lectinas fluoresceinadas com afinidade específica por galactose não seria indicado para o
estudo das lâminas de suínos utilizadas nesse trabalho, uma vez que, a despeito da presença
confirmada de polissacarídeos nos corte histológicos, estas substâncias não forneceram sítios de
ligação para as lectinas testadas.
REFERÊNCIAS BIBLIOGRÁFICAS
1
CAVADA, B. S., SANTOS, C. F., GRANGEIRO, T. B., NUNES, E. P., SALES, P. V. P.,
RAMOS, R. L., SOUSA, F. A. M., CRISÓSTOMO, C. V., CALVETTE, J. J. 1998.
Purification and characterization of a lectin from seeds of Vatairea macrocarpa Duke.
Phytochemistry, 49(3): 675 – 680.
2
CORMACK, D. H. Fundamentos de histologia. Rio de Janeiro. Guanabara Koogan, 371 p,
2003.
3
DILKIN, P., HASSEGAWA, R., REIS, T.A., MALLMANN, C.A, CORRÊA, B. 2004.
Intoxicação experimental de suínos por fumonisinas. Ciência Rural 34 (1): 175 – 181.
4
ETTARH, R. R., CARR, K. E. A morphological study of teh enterical mucosal epithelium in
the streptozotocin-diabetic mouse. Life Sciences 61 (18): 1851 – 1858, 1997.
5
GENESER, F. Histologia com bases biomoleculares. 2003. Rio de Janeiro. Guanabara Koogan,
616 p.
6
GEORGE, L. L., ALVES, C. E. R.,CASTRO, R. R. L. 1985. Histologia comparada. São Paulo.
Livraria Roca Ltda, 293 p.
7
JIDONG, YU, ZENG, Y., ZHAO, J., LIAO, D., GREGERSEN, H. 2004. Quantitative analysis
of collagen fiber angle in the submucosa of small intestine. Computers in Biology and
Medicine, 34: 539 – 550.
8
JUNQUEIRA, L. C. U., JUNQUEIRA, L. M. M. S. 1983. Técnicas básicas de citologia e
histologia. São Paulo. Livraria Editora Santos, 110 p.
9
JUNQUEIRA, L. C., CARNEIRO, J. 2004. Histologia Básica: Texto e Atlas. 10a Edição.
Editora Guanabara-Koogan. Rio de Janeiro. Brasil. 540 p.
10 MÉNDEZ, A., GARCIA, G. 2001. Patrón de secreción de mucosustancias de pollos de engorde
durante su ciclo productivo. Revista de la Faculdad de Ciencias Veterinarias 42 (3-4):101-108.
11 PROPHET, E. B. Tissue processing: dehydration, clearing and infiltration. In: Laboratory
methods in histotechnology. PROPHET, E. B., MILLS, B., ARRINGTON, J. B., SOBIN, L. H.
1994. Eds. Washington D. C. Armed Forces Institute of Pathology, 274 p.
12 PUSZTAI, A. 1991. Plant Lectins. Cambridge. Cambridge University Press, 205 p.
13 RATINEAU, C., DREAU, S., BLANC, M., BERNARD, C., CORDIER-BUSSAT, M.,
ABELLO, J., CHAYVIALLE, J., ROCHE, C. 2001. CCK expression in enteroendocrine cells
is regulated by soluble factor(s) from underlying fibroblasts. Molecular and Cellular
Endocrinology 175: 5 – 13.
14 SEIXAS FILHO, J.T., FONSECA, C.C., OLIVEIRA, M.G.ALMEIDA., DONZELE, J.L.,
MENIN, E. 2001. Determinação do sistema endócrino difuso de três Teleostei (Pisces) de água
doce com hábitos alimentares diferentes. Revista Brasileira de Zootecnia 30 (5): 1403 – 1408.
15 SHEEHAN, D. C., HRAPCHAK, B. B. 1973. Theory and practice of histotechnology. Saint
Louis. The C. V. Mosby Company, 218 p.
16 STINSON, A. W., CALHOUN, M. L. 1982. Sistema digestivo. In: DELLMANN, H. D.,
BROWN, E. M. Eds. Histologia Veterinária. Guanabara Koogan. Rio de Janeiro. 397p.
17 ZENG, YJ, QIAO AK, YU JD, ZHAO JB, LIAO DH, XU XH, HANS G. 2003.Collagen fiber
angle in the submucosa of small intestine and its application in gastroenterology. World
Journal of Gastroenterology, 9 (4): 804 – 807.
A
C
B
D
FIGURA 1.Cortes histológicos de intestino delgado de suínos corados com HE (A), PAS-Alcian Blue (B), Azan-Mallory (C) e Gomori (D)
A
B
FIGURA 2.Cortes histológicos de intestino delgado de suínos observados em microscopia de fluorescência. A: controle; B: lâmina incubada com VML