3ª lista de exercícios de Física – Termologia
A quantidade de calor(Q) é medida em calorias.
Uma Caloria é a quantidade de calor necessária para elevar de 1°C a temperatura de 1g de água. A
principal unidade derivada da caloria é a grande caloria, quantidade de calor necessária para elevar de 1°C
a temperatura de 1000g de água. A grande caloria equivale a 1000 calorias. A caloria é indicada pela sigla
cal e a grande caloria pela sigla kcal.
Observe que a caloria, por definição, é a quantidade de calor que eleva 1g de água de 1°C. Logo,
podemos concluir que o calor específico da água é de 1 cal/g°C (uma caloria por grama por graus
Celsius). Estando a água e o ferro recebendo mesma quantidade de calor, o ferro se aquece muito mais
rapidamente que a água.
Isso significa que o ferro necessita de menos calor que a água para elevar sua temperatura. Logo, o ferro
tem menos calor específico que a água. Calor específico de uma substância é a quantidade de calor,
medida em calorias, que eleva 1grama dessa substância de 1 grau C. O cálculo da quantidade de calor
necessária para elevar a temperatura de um corpo é feito com base na fórmula:
Q = m . c . Δt , onde m=massa do corpo em gramas, c é o valor do calor específico em cal/g°C e Δt é a
variação de temperatura que quer-se obter. Ex:
Qual é a quantidade de calor que eleva de 15°C para 60°C a temperatura de 250g de água?
m=250g
Q = 250.1.45 = 11250 cal
c=1cal/g°C
t=60-15=45°C
O conceito científico de calor não é o mesmo ao qual nos referimos no cotidiano. Quando dizemos calor,
muitas vezes estamos nos referindo à sensação de temperatura ambiente alta e este termo não condiz com
o conceito científico. Calor é uma energia que vai do corpo de maior temperatura para o de menor
temperatura.
Enquanto corpos de temperaturas diferentes trocam energia (sempre o mais quente transmite energia para
o mais frio) esta energia trocada é calor. Se todos os componentes de um sistema estiverem na mesma
temperatura, faz-se o equilíbrio térmico e não haverá trocas de energia térmica entre eles, e não haverá
calor!
Ao ser transferido de um corpo para outro, a quantidade de calor transferida (Q) poderá provocar uma
variação de temperatura ou uma mudança de estado físico naquele que recebe o calor.
A TRANSMISSÃO DE CALOR
A transmissão de calor ocorre principalmente por 3 processos:
Condução
Convecção
Irradiação
A condução ocorre quando a energia é transmitida de molécula para molécula de um corpo. Alguns
materiais são bons condutores de calor, por exemplo, os metais. Alguns materiais são isolantes térmicos:
lã, madeira, isopor, porcelana e outros.
A convecção de calor ocorre pelo deslocamento dos fluídos (gases e líquidos). Quando um líquido ou gás
se aquece a sua densidade tende a diminuir tornando-o “mais leve” e proporcionando um movimento de
ascensão. É o que acontece nas geladeiras, quando o ar quente gerado às voltas do alimento ali colocado
se desloca para o congelador. Ou nas chaminés onde vemos as fumaças deslocando-se para o alto.
A radiação ou irradiação ocorre quando uma fonte térmica emite ondas eletromagnéticas em todas as
direções produzindo um aquecimento. Por exemplo, o Sol, nossa fonte de energia. Podemos pensar
também em uma fogueira, uma lareira acesa, um forno quente.Este processo é o único dos três que não
necessita de um meio material para ocorrer transmissão do calor.
Questões:
1.Um estudante afirma que seu agasalho é de boa qualidade porque evita que o frio passe através dele.
Esta afirmação é correta? Justifique.
2.As antigas panelas de pedra, ainda hoje servem para manter o alimento já preparado quente por mais
tempo. A pedra é bom condutor de calor?
3.Se o congelador fosse colocado na parte inferior de uma geladeira haveria a formação de correntes de
convecção? Explique.
4.Os grandes tanques, usados para armazenar gasolina (ou outros combustíveis) são pintados de tinta
prateada. Por quê?
5.Como uma garrafa térmica evita as perdas de calor por condução, convecção e radiação?
6.Uma estufa armazena em seu interior parte da energia térmica incidente por radiação que fica retida
porque a condução e a convecção são evitadas. Explique porque sentimos este mesmo efeito quando
entramos em um carro que ficou estacionado ao sol.
7.Se você fosse resfriar um barril de chope utilizando gelo deveria colocar o gelo na parte superior ou
inferior do barril?
8.Como se deve vestir um bombeiro ao estar em contato com altas temperaturas?
9.Como se utilizar apropriadamente papel alumínio para assar uma batata na grelha, colocamos a parte
refletora para o lado externo ou interno da batata?
10.Explique como se dá forma a brisa marítima, ou seja, por que o vento sopra da areia para o mar à noite
e do mar para a areia durante o dia.
QUANTIDADE DE CALOR
Quando um corpo recebe calor podem ocorrer mudanças diferentes em suas propriedades físicos, a
temperatura pode aumentar ou pode haver mudança de estado físico.
Quando a temperatura varia dizemos que o calor recebido é calor sensível e quando ocorre mudança de
estado o calor é chamado calor latente.
Cálculo da quantidade de calor sensível (Q):
Cada substância ao receber uma determinada quantidade de calor sofre uma variação de temperatura que
depende da suas próprias características, no caso da água definimos que:
A cada 1 caloria recebida por um grama de água sua temperatura varia de 1ºC , sob pressão normal.
Observe que multiplicamos a massa de água pela variação de temperatura e por um fator 1 que é
denominado calor específico sensível da água. Usando a mesma lógica podemos calcular a quantidade de
calor necessário para aquecer outras substâncias desde que nos seja fornecido o calor específico desta.
Qual a unidade de medida do c?
Utilize a tabela a seguir para responder aos problemas de 1 a 6
Substância
C (cal/gºC)
Água
1,00
gelo
0,50
ferro
0,11
glicerina
0,60
ouro
0,03
1 Retirados 500g de gelo do congelador a – 20 ºC qual a quantidade de calor que esta quantidade de gelo
deverá absorver para atingir 0ºC?
2. Qual a quantidade de calor necessária para aquecer 300 g de ouro de 20ºC para 120ºC?
3. Determine a variação de temperatura sofrida por l litro de água líquida ao receber
50000 cal.
4. Calcule a quantidade de calor necessária para aquecer 300 g de glicerina de 20ºC a 120ºC.
5. Para aquecer 1 kg de ferro de 50ºC para 250ºC quanto de calor devemos fornecer?
6. Qual a quantidade de calor que deve ser retirado de 2 l de água a 90ºC para que sua temperatura caia
para 10ºC?
Quantidade de calor latente (l):
Ao receber ou perder calor vimos que o sistema pode sofrer variação de temperatura, algumas vezes,
entretanto o sistema poderá sofrer uma mudança de estado físico. Nestes casos o calor trocado com o
meio recebe o nome de calor latente.
Por exemplo, no caso do exercício 1 o gelo ao atingir 0 ºC, a pressão normal, deverá sofrer mudança de
estado (fusão). O calor absorvido para a mudança de estado também depende da substância. No caso do
gelo, o calor específico latente de fusão é 80 cal/g. Significa que para fundir um grama de gelo 80 calorias
serão absorvidas.
Ou seja:
Q = m.l
No exercício 1, para que 500g de gelo sofram fusão teremos: Q = 500.80
Q = 40000 cal (= quantidade de calor necessária para a fusão)
7.Considere 200 g de gelo retirados a – 10 ºC do congelador. Determine a quantidade de calor necessário
para transformar este gelo em vapor d´água sob pressão normal.
São dados:
Calor específico da água : 1 cal g/ºC
Calor específico do gelo: 0,5 cal g/ºC
Calor latente de fusão do gelo = 80 cal/g
Faça um gráfico representando esta curva de aquecimento da água.
8.Ao misturar 1 litro de água a 800C com 2 litros de água a 200C, qual será a temperatura final de
equilíbrio térmico (sob pressão normal)?
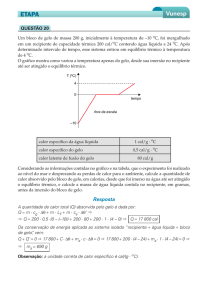
9. (MACKENZIE-SP) O gráfico a seguir mostra a variação da temperatura de certa massa de água (calor
específico=1cal/g°C e calor latente de vaporização=540cal/g), contida em um calorímetro ideal, a partir
do instante em que uma fonte térmica começa a lhe fornecer calor à razão constante de 2160cal/minuto. A
massa de água líquida contida no calorímetro, 25 minutos após o início de seu aquecimento, é de:
a) 135 g b) 80 g c) 55 g d) 40 g e) 25 g
10. (PUC-MG) Na figura a seguir, está representada uma caixa totalmente fechada, cujas paredes não
permitem a passagem de calor. No seu interior fez-se vácuo. Nesta caixa estão suspensos, presos por
cabos isolantes térmicos, e sem tocar qualquer superfície da caixa, dois corpos, A e B, sendo,
inicialmente, a temperatura de A maior do que a de B. Após algum tempo, verifica-se que A e B
atingiram o equilíbrio térmico. Sobre tal situação, é correto afirmar que a transferência de calor entre A e
B NÃO se deu:
a) nem por condução, nem por convecção.
b) nem por condução, nem por radiação.
c) nem por convecção, nem por radiação.
d) por condução, mas ocorreu por convecção e por radiação.
e) por radiação, mas ocorreu por condução e por convecção.
11. (VUNESP-SP) Uma garrafa de cerveja e uma lata de cerveja permanecem durante vários dias numa
geladeira. Quando se pegam com as mãos desprotegidas a garrafa e a lata para retirá-las da geladeira,
tem-se a impressão de que a lata está mais fria do que a garrafa. Este fato é explicado pelas diferenças
entre
a) as temperaturas da cerveja na lata e da cerveja na garrafa.
b) as capacidades térmicas da cerveja na lata e da cerveja na garrafa.
c) os calores específicos dos dois recipientes.
d) os coeficientes de dilatação térmica dos dois recipientes.
e) as condutividades térmicas dos dois recipientes.
12. (VUNESP-SP) Quando uma enfermeira coloca um termômetro clínico de mercúrio sob a língua de
um paciente, por exemplo, ela sempre aguarda algum tempo antes fazer a sua leitura. Esse intervalo de
tempo é necessário
a) para que o termômetro entre em equilíbrio térmico com o corpo do paciente.
b) para que o mercúrio, que é muito pesado, possa subir pelo tubo capilar.
c) para que o mercúrio passe pelo estrangulamento do tubo capilar.
d) devido à diferença entre os valores do calor específico do mercúrio e do corpo humano.
e) porque o coeficiente de dilatação do vidro é diferente do coeficiente de dilatação do mercúrio.
13.(MACKENZIE-SP) Um corpo de massa 100g ao receber 2400 cal varia sua temperatura de 20°C para
60°C, sem variar seu estado de agregação. O calor específico da substância que constitui esse corpo,
nesse intervalo de temperatura, é:
a) 0,2 cal/g.°C. b) 0,3 cal/g.°C. c) 0,4 cal/g.°C. d) 0,6 cal/g.°C e) 0,7 cal/g.°C.
14. (FUVEST-SP) Uma piscina com 40m2 de área contém água com uma profundidade de 1,0m. Se a
potência absorvida da radiação solar, por unidade de área, for igual a 836W/m2, o tempo de exposição
necessário para aumentar a temperatura da água de 17°C a 19°C será aproximadamente:
a) 100 segundos. b) 10.000 segundos. c) 1.000.000 segundos. d) 2.500 segundos.
e) 25.000 segundos.
15.(PUC-SP) É preciso abaixar de 3°C a temperatura da água do caldeirão, para que o nosso amigo possa
tomar banho confortavelmente. Para que isso aconteça, quanto calor deve ser retirado da água?
O caldeirão contém 104g de água e o calor específico da água é 1cal/g°C.
a) 20 kcal b) 10 kcal c) 50 kcal d) 30 kcal
e) Precisa-se da temperatura inicial da água para determinar a resposta.
16,(FUVEST-SP) Dois recipientes de material termicamente isolante contêm cada um 10g de água a 0°C.
Deseja-se aquecer até uma mesma temperatura os conteúdos dos dois recipientes, mas sem misturá-los.
Para isso é usado um bloco de 100g de uma liga metálica inicialmente à temperatura de 90°C. O bloco é
imerso durante um certo tempo num dos recipientes e depois transferido para o outro, nele permanecendo
até ser atingido o equilíbrio térmico. O calor específico da água é dez vezes maior que o da liga. A
temperatura do bloco, por ocasião da transferência, deve então ser igual a:
a) 10°C b) 20°C c) 40°C d) 60°C e) 80°C
17 (FUVEST-SP) Em um copo grande, termicamente isolado, contendo água à temperatura ambiente
(25°C), são colocados 2 cubos de gelo a 0°C. A temperatura da água passa a ser, aproximadamente, de
1°C. Nas mesmas condições se, em vez de 2, fossem colocados 4 cubos de gelo iguais aos anteriores, ao
ser atingido o equilíbrio, haveria no copo:
a) apenas água acima de 0°C b) apenas água a 0°C c) gelo a 0°C e água acima de 0°C