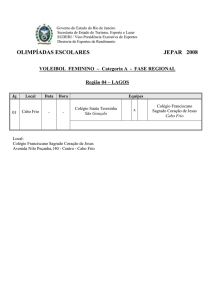
Colégio Nossa Senhora do Sagrado Coração
2° ano ensino médio
Resumo
Colégio Nossa Senhora do Sagrado Coração
Força dos ácidos e das bases de acordo com com a teoria de Brönsted - Lorry
• Ácido – toda espécie química capaz de doar prótons
• Base – toda espécie química capaz de receber prótons
• Reações ácido/base – são reações onde há transferência de prótons.
H+
Exemplo 1
HCl
Ácido
+
H2O ↔ H3O+ +
Base
Ácido conjugado
Par conjugado
Par conjugado
ClBase conjugada
Colégio Nossa Senhora do Sagrado Coração
Força dos ácidos e das bases de acordo com com a teoria de Brönsted - Lorry
H+
Exemplo 2
NH3
Base
+
H2O ↔ OHÁcido
+
Base conjugada
Par conjugado
Par conjugado
NH4+
Ácido conjugado
Colégio Nossa Senhora do Sagrado Coração
Força dos ácidos e das bases de acordo com com a teoria de Brönsted - Lorry
• Quanto mais forte for o ácido maior será a tendência
de doar prótons, e apresentará um Ka elevado, no
caso do exemplo 1 o HCl encontra-se quase que 100%
dissociado, por se tratar de um ácido forte.
• Para os ácidos com pouca tendência a doar prótons,
são considerados ácidos fracos, e apresentará uma
base conjugada forte.
• O comportamento ácido – base depende também do
outro reagente, note que no exemplo 1 a água atua
como base, e no exemplo 2 atua como ácido, podemos
dizer então que a água possui comportamento
anfótero.
Colégio Nossa Senhora do Sagrado Coração
Força dos ácidos e das bases de acordo com com a teoria de Brönsted - Lorry
• Exercícios
1) Indique o ácido e a base de Brösnted - Lorry e seus
pares conjugados.
HNO3(aq) + HPO2-4(Aq) ↔ NO-3(aq) + H2PO4
Colégio Nossa Senhora do Sagrado Coração
Força dos ácidos e das bases de acordo com com a teoria de Brönsted - Lorry
H+
HNO3(aq) + HPO2-4(Aq) ↔ NO-3(aq) + H2PO4
Ácido
Base conjugada
Base
Par conjugado
Par conjugado
Ácido Conjugado
Colégio Nossa Senhora do Sagrado Coração
Hidrólise de sais
• Dissolução de sal derivado de ácido forte com base forte: caráter da
solução será neutra.
• Dissolução de sal derivado de ácido forte com base fraca: caráter da
solução será ácida.
• Dissolução de sal derivado de ácido fraco com base forte: caráter da
solução será basica.
• Dissolução de sal derivado de ácido fraco com base fraca: caráter da
solução dependerá do Ka e do Kb.
Colégio Nossa Senhora do Sagrado Coração
Hidrólise de sais
Exercícios:
Quais dos seguintes sais produz uma solução de pH < 7 ao ser dissolvido em
água.
a) NaCl
b) NH4Cl
c) K2CO3
Principais ácido forte
HCl, HBr e HI
Nitrico: HNO3
Clorico: HClO3
Perclorico: HClO3
Sulfurico: H2SO4
Principais Bases Fortes
Todas do grupo 1 A metais alcalinos:
Li; NaOH; KOH; RbOH; CsOH.
Alguns dos metais alcalinos terrosos
grupo 2A : Ca(OH)2; Ba(OH)2; Sr(OH)2
Colégio Nossa Senhora do Sagrado Coração
Hidrólise de sais
a) NaCl
Na+ e Cl-
NaOH e HCl
pH neutro
Principais ácido forte
HCl, HBr e HI
Nitrico: HNO3
Clorico: HClO3
Perclorico: HClO3
Sulfurico: H2SO4
Principais Bases Fortes
Todas do grupo 1 A metais alcalinos:
Li; NaOH; KOH; RbOH; CsOH.
Alguns dos metais alcalinos terrosos
grupo 2A : Ca(OH)2; Ba(OH)2; Sr(OH)2
Colégio Nossa Senhora do Sagrado Coração
Hidrólise de sais
a) NH4Cl
NH4+ e Cl-
NH4OH e HCl
pH ácido < 7
Principais ácido forte
HCl, HBr e HI
Nitrico: HNO3
Clorico: HClO3
Perclorico: HClO3
Sulfurico: H2SO4
Principais Bases Fortes
Todas do grupo 1 A metais alcalinos:
Li; NaOH; KOH; RbOH; CsOH.
Alguns dos metais alcalinos terrosos
grupo 2A : Ca(OH)2; Ba(OH)2; Sr(OH)2
Colégio Nossa Senhora do Sagrado Coração
Hidrólise de sais
a) K2CO3
K+ e CO2-
KOH e H2CO3
pH básico > 7
Principais ácido forte
HCl, HBr e HI
Nitrico: HNO3
Clorico: HClO3
Perclorico: HClO3
Sulfurico: H2SO4
Principais Bases Fortes
Todas do grupo 1 A metais alcalinos:
Li; NaOH; KOH; RbOH; CsOH.
Alguns dos metais alcalinos terrosos
grupo 2A : Ca(OH)2; Ba(OH)2; Sr(OH)2