Fundamentos da expressão gênica em
células vegetais
Transdução de sinais em plantas
Controle do ciclo celular
INTRODUÇÃO
Crescimento e desenvolvimento de uma planta iniciam com
germinação de uma semente.
Continuam com desenvolvimento vegetativo, floração,
frutificação, dispersão de sementes e processos de
senescência.
Fase vegetativa do desenvolvimento tem início com célula
única, o zigoto, predestinado a crescer de forma organizada.
O zigoto passa a sofrer três processos celulares
imprescindíveis
para
o
crescimento
e
o
desenvolvimento: divisão celular, alongamento celular e
diferenciação celular.
Estes processos produzem a organogênese.
Nas plantas, a organogênese se mantém constante nos
meristemas, o que é conhecido como crescimento
indeterminado.
Crescimento e desenvolvimento
dependem de sinais
ambientais
(abióticos ou exógenos), principalmente
presença de água, nutrição, luz, fotoperíodo e
temperaturas.
Estes induzem a síntese de
sinais endógenos, os
hormônios vegetais ou mensageiros primários.
Hormônios vegetais ou fitormônios atuam no controle do
ciclo celular, da expressão gênica e
da ativação
enzimática.
Os primeiros hormônios vegetais a serem estudados
foram: AUXINAS, GIBERELINAS, CITOCININAS, ETILENO
E ÁCIDO ABSCÍSICO.
Mais tarde foram descobertos: BRASSINOSTERÓIDES,
JASMONATOS,
ÁCIDO
SALICÍLICO,
POLIAMINAS,
SISTEMINAS E OLIGOSSACARINAS.
Ativação” e “repressão” de genes causam alteração nos
padrões de síntese de proteínas e enzimas.
Estas
estão envolvidas na
diferenciação celular.
indução de divisão e
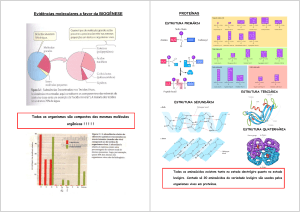
Genes são seqüências de DNA que codificam mRNAs.
Estes codificam proteínas estruturais e enzimas.
Genoma de plantas contém entre 20 a 30 mil genes.
O genoma de Arabidopsis thaliana está
totalmente mapeado e contém 25.498
genes.
1500 codificam proteínas fatores de
transcrição
responsáveis
pela
transcrição do gene em seu mRNA.
1200 codificam proteínas quinases
(ou
cinases),
importantes
na
transdução de sinais biológicos.
600 codificam proteínas quinases
receptoras celulares presentes nas
membranas.
Arabidopsis thaliana (L.) Heynh. (Brassicaceae)
Esquema de expressão gênica
TRANSCRIÇÃO
TRADUÇÃO
Genoma de arroz é 5 vezes maior que o de Arabidopsis
thaliana, o menor genoma encontrado em plantas até agora.
Genes podem ser agrupados em dois grandes grupos:
constitutivos e regulados.
Genes
constitutivos
(ou“housekeeping”)
são
responsáveis pela manutenção de processos celulares
vitais, por exemplo, a respiração celular, estando
permanentemente ligados.
Genes regulados são ativados em fases especiais do
desenvolvimento em resposta aos estímulos específicos
como luz, fotoperíodo stress.
Como exemplo,
temos os genes envolvidos com
expressão de órgãos florais e genes envolvidos com o
aparato fotossintético.
Fundamentos da expressão gênica
Expressão
de genes eucarióticos requer proteínas
especiais, as RNA polimerases.
Há três tipos de RNA polimerases: I, II e III.
RNA polimerases I - no nucléolo - sintetizam rRNAs.
RNA polimerases II - no nucleoplasma, sintetizam prémRNA.
RNA polimerases III - no nucleoplasma, sintetizam
pequenos RNAs: tRNA e 5S rRNA.
RNA polimerase II requer para seu funcionamento,
proteínas
transcrição
transcrição.
conhecidas
que
como
formam
o
fatores
gerais
de
complexo
inicial
de
Transcrição inicia quando o último fator geral de transcrição, ligase ao complexo fosforilando a RNA polimerase II.
RNA polimerase
II
copia apenas uma das fitas de DNA no
sentido anti-senso 3’ para 5’.
Genes
possuem também seqüências adjacentes de DNA:
promotor ou promotor mínimo (seqüência mínima TATA BOX) e
seqüências adicionais reguladoras.
RNA polimerase II liga-se ao promotor mínimo TATA BOX.
Esse é o local de união do complexo inicial de transcrição.
O promotor mínimo pode ser regulado por seqüências reguladoras e
conservadas de DNA.
São conhecidas como CAAT BOX e GC BOX
São locais de
transcricionais.
ligações
de
outras
proteínas
fatores
COMPLEXO RNA POLIMERASE + FATORES GERAIS DE TRANSCRIÇÃO
Seqüência da ligação dos fatores gerais de
transcrição à RNA polimerase II.
Promotor
Complexo inicial de
transcrição
Fosforilação de DNA
Fatores transcricionais reguladores
CAAT BOX e GC BOX podem reprimir ou ativar a
expressão do gene.
O processo de expressão gênica apresenta duas grandes
fases.
1ª FASE - transcrição: síntese de mRNA copiado do molde
de DNA.
2ª FASE - tradução:
ribossomos(citoplasma).
Genes eucarióticos possuem regiões codificadoras exons
e não codificadoras introns.
Pré-mRNA sofre processamento com retirada de seqüências
introns.
A seguir ocorre a tradução no RE.
síntese
de
proteínas
nos
Expressão gênica em células eucarióticas
Formação de mRNA com retirado dos introns
Expressão gênica em células eucarióticas
Regulagem de expressão gênica
Regulagem de expressão gênica
Regulagem de expressão gênica
Transcrição
Tradução
Síntese de polipeptídio
Códon e anticódon
Ribossomo e síntese de polipeptídio
Seqüências adicionais de DNA de célula vegetal reguladas por
hormônios são chamadas de elementos de resposta.
Na transcrição, o DNA forma alças (looping) entre o promotor e
seqüências adicionais.
Há contato físico entre as seqüências reguladoras havendo controle
positivo ou negativo.
Após tradução, as proteínas podem durar poucos minutos sendo
destruídas.
Ubiquitina é um peptídeo pequeno (76aa) que liga-se e marca
proteínas
a
serem
destruídas
no
proteossomo 26S.
Mais de 90% das proteínas têm vida curta.
complexo
proteolítico,
o
Organização e regulação de um gene eucariótico
Fundamentos da transdução (tradução +
indução) de sinais em plantas
Hormônios vegetais são mensageiros químicos primários.
Adaptam crescimento e desenvolvimento da planta às quantidades e
qualidades de luz e outros fatores ambientais.
Para atuarem, Hormônios (H) ligam-se às proteínas receptoras (R)
Forma-se o complexo H + R.
Hormônios lipofílicos atravessam membranas celulares e possuem
receptores no núcleo, citoplasma, RE.
Hormônios
hidrossolúveis não entram na célula e possuem
receptores na membrana plasmática.
Complexo H + R inicia via de transdução de sinais com síntese ou
ativação de mensageiros secundários.
Sinalização transmembrana de esteróides em plantas. A molécula do
esteróide (em amarelo) se liga ao domínio de ligação do receptor quinase
BRI1 (em azul). Isto gera uma plataforma de encaixe para a proteína coreceptora BAK1 (cor de laranja), que é recrutada para o complexo. Interação
física entre as BRI1 e BAK1 inicia a resposta de sinalização dentro da célula.
Crédito: Zina Deretsky, National Science Foundation
Receptores de hormônios vegetais
em geral são
proteínas semelhantes as enzimas quinases (ou cinases)
e são autofosforiláveis.
Quinases são enzimas que tranferem grupos fosfatos de
doadores de alta energia, como ATP.
Única molécula de hormônio tem seu sinal amplificado.
Ocorre ativação enzimática e produção de centenas de
moléculas de mensageiros secundários.
Os mensageiros secundários mais estudados são:
cAMP, DAG, IP3, Ca+2.
Hormônios esteroidais entram no núcleo e agem como
fatores de transcrição ativando uma proteína receptora.
Brassinosteróides são hormônios esteroidais de plantas.
Produção de cAMP (adenosina monofosfato cíclica)
Em hormônios hidrossolúveis o complexo H + R forma-se
na membrana plasmática.
Ativa uma
membrana.
proteína
heterotrimérica
G
presente
na
Proteína heterotrimérica G tem três sub-unidades :, , .
liga-se a GTP (guanidina trifosfato) que ativa a enzima
adenilil-ciclase produzindo cAMP.
cAMP ativa enzima quinase A (PKA) que fosforila proteínas
fatores de transcrição.
Esse modelo ocorre também em plantas.
Em plantas, cAMP ativa canais de K+ de membranas
celulares de células guardas de Vicia faba.
Esse processo ocorre durante a abertura de estômatos.
Modelo de
transdução de
sinais
Síntese de cAMP
H+R ativa proteína
G
substituindo
GDP por GTP
Ativação da
adenilil-ciclase
Síntese
cAMP
de
c AMP
Produção de IP3 (inositol-tri-fosfato) e DAG (diacilglicerol)
Complexo H + R: ativação de proteína G e ativação de
fosfolipase C (PLC).
PLC hidrolisa o fosfolipídio de membrana PIP2 (fosfatidil –
inositol 4,5- bifosfato)
Formação de IP3 (inositol-3-fosfato) e DAG (diacil-glicerol).
IP3 é hidrossóluvel e difunde-se no citosol.
IP3 + receptor do tonoplasto:
abre canais de Ca2+ do
tonoplasto
Isso gera aumento temporário dos níveis de Ca2+ no citosol.
Aumentos de Ca2+ ocorrem em células-guardas de estômatos no
mecanismo de fechamento induzido por ABA (ÁCIDO ABSCÍSICO).
Ca2+ pode se ligar a uma proteína calmodulina e ativar várias
enzimas.
Há proteínas quinases dependentes de Ca2+ envolvidas na resposta
de fechamento estomático induzida por ABA.
Esse processo foi estudado na regulagem de canais de ânions no
tonoplasto de células guardas de Vicia faba.
DAG (lipídio associado à membrana) ativa proteína quinase C (PKC)
que fosforila canais de íons, fatores de transcrição e outras enzimas.
Formação de IP3 e DAG
Formação de DAG e IP3-Função de IP3
CALMODULINA
Controle do ciclo celular
Os hormônios vegetais estão também envolvidos no
controle do ciclo celular.
Fases do ciclo celular : G1, S e G2 (interfase); M (mitose).
G1 é o START: preparação para duplicação de DNA
nuclear, pelo complexo de pré-replicação de cromatina.
S: DNA replicado.
G2 : preparo para mitose.
Enzimas que controlam transição do ciclo celular:
proteínas quinases dependentes de proteínas ciclinas
(CDKS).
Hormônios vegetais induzem a expressão gênica de CDKs
e ciclinas.
CDK fazem transição de G1 para S e de G2 para M (mitose).
Regulação de atividade de CDKS:
1)
2)
Síntese de proteínas ciclinas.
Destruição de ciclinas pela ubiquitina no proteossomo
26 S.
3)
Fosforilação
e
desfosforilação
de
resíduos
de
aminoácidos na molécula de CDK pelas fosfatases.
Mudança
de G1 para S necessita de ciclinas TIPO G.
Mudança
de G2 para M necessita de ciclinas mitóticas.
Fosforilação
de algumas moléculas de tirosinas das CDKs faz a
ativação.
Outras
atividade.
moléculas de tirosinas ao se fosforilarem inibem
CDK ativa estimula
mitose
CDKs são inativas até que se complexem
com ciclinas.
O complexo é ativado por fosforilação
através da enzima CDK quinase (CAK).
Referências
Dewitte, W &. Murray, J.A.H. 2003. THE PLANT CELL
CYCLE Annu. Rev. Plant Biol. 2003. 54:235–64 2003
Taiz, L. & Zeiger, E. 1998. Plant Physiology. Sinauer
Associates, Inc, Publishers, 792p.
Taiz, L. & Zeiger, E.2006. Plant Physiology. Sinauer
Associates, Inc, Publishers, 705p.
Taiz, L. & Zeiger, E. 2010. Sinauer Associates, Inc,
Publishers.