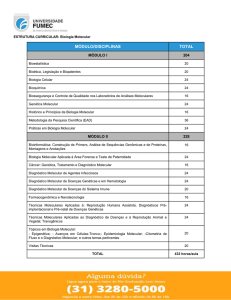
7. Trabalho Experimental
Propriedades das substâncias iônicas e moleculares
7.1 Introdução
As propriedades das substâncias estão relacionadas com o tipo e força de suas
ligações químicas. Elementos e compostos reagem quimicamente para formar substâncias
que podem ser iônicas ou moleculares.
Nas substâncias iônicas (como NaCl ) os íons (Na+ e Cl- ) são mantidos unidos por
fortes forças eletrostáticas denominadas ligações iônicas.
As substâncias moleculares (como H2O) consistem em moléculas nas quais um
grupo de átomos estão unidos por ligações covalentes.
Compostos iônicos têm altos pontos de fusão e ebulição devido a forte atração
entre íons de cargas opostas. São bons condutores de eletricidade quando em solução ou no
estado de fusão.
Moléculas que consistem de átomos covalentemente ligados formam substâncias
moleculares que tem baixos ponto de fusão e ebulição. Estas moléculas também exibem
baixa condutância elétrica.
7.2 Caráter iônico ou covalente de ligação
A predominância do caráter iônico ou covalente de uma ligação é determinada
pela eletronegatividade dos elementos na substância. Eletronegatividade é a medida da
atração que um átomo tem por elétrons envolvidos na ligação entre dois átomos. Quando a
diferença na eletronegatividade(E) é maior que 1,7, a ligação formada é considerada
predominantemente iônica. Se esta diferença é menor que 1,7, a ligação é considerada
covalente. A figura abaixo mostra os valores da eletronegatividade para alguns elementos
comuns.
Figura 1 – Eletronegatividade para os elementos mais comuns
7.3 Propriedades dos compostos iônicos
As substâncias iônicas são tipicamente de alto ponto de fusão; têm calores de
fusão e vaporização muito altos, freqüentemente se dissolvem em água(mas raramente em
outros solventes comuns), e são más condutoras de eletricidade no estado sólido mas se
tornam bons condutores quando fundidos ou dissolvidos em água. Todas estas propriedades
estão relacionadas à alta energia requerida para deslocar os íons de suas posições muito
estáveis no campo eletrostático gerado pelos íons circundantes de carga oposta.
Tabela 1 – Alguns compostos iônicos
Composto
Descrição
Usado em filme fotográfico. O brometo de prata, ativado pela luz
AgBr
é seletivamente reduzido a prata livre no processo de revelação,
aparecendo como o “preto”, no negativo branco e preto.
Bórax, usado em preparados de limpeza, fabricação do vidro e na
Na 2 B 4 O 7 .10H 2 O
preparação de artefatos à prova de fogo.
CaHSO 3 2
Na indústria do papel, usado para dissolver a lignina da madeira,
NaOH
Lixívia, usada em certos tipos de limpadores de esgotos.
deixando fibras de celulose.
Fermento de pão, também usado em extintores de incêndio de pó
NaHCO 3
seco e “úmido”
Metassilicato de sódio, usado com ou como substituto de aditivos
Na 2 SiO 3
fosfatados em detergentes
Um componente das baterias de níquel-cádmio de
NiO 2
“flash”(recarregável).
PbO 2
Reagente catódico da bateria de automóvel.
Pb 3 O 4
Zarcão. Primeira mão na pintura de ferro e aço.
ZnS
Emissor de luz em tubos fluorescentes.
7.4 Propriedades de compostos moleculares
As ligações são geralmente(mas não sempre) mais fortes que as ligações iônicas.
A ligação iônica pura é descrita como uma simples atração eletrostática entre íons de carga
oposta, enquanto que a ligação covalente envolve o compartilhamento de elétrons nos
campos positivos de dois ou mais núcleos.
É importante lembrar que a fusão e ebulição de substâncias tais como o silício
envolvem o rompimento de ligações covalentes. Em substâncias moleculares, tais como o
tetracloreto de carbono, a fusão e a ebulição não quebram as ligações covalentes das
moléculas individuais, mas apenas as forças muito mais fracas entre as moléculas vizinhas.
Tabela 2- Alguns compostos moleculares
Composto
Descrição
Formado pela decomposição elétrica da água, ou pela ação de
ácidos(ou água) sobre metais apropriados. Misturas adequadas
H2
com oxigênio são altamente explosivas. Acidentes com tais
explosões são comuns entre os motoristas que vão verificar à
noite, com um fósforo, o nível da água da bateria ou do radiador.
Um gás venenoso formado durante a combustão incompleta de
hidrocarbonetos usados como combustíveis. Um processo
industrial em grande escala para a preparação de níquel puro usa a
CO
reação:
CALOR
Ni 4CO g NiCO 4g
Ni 4CO g
PURO
Em soluções aquosas, usado como “amoníaco doméstico” para
NH 3
fins de limpeza. Amônia e seus compostos são produtos
“agroquímicos” importantes para adição de nitrogênio aos solos.
FREON 12
(CF2 Cl 2 )
Gás atóxico, usado em refrigeração e sistema de ar condicionado.
7.5 Parte Experimental
“...Passe um pente por seu cabelo diversas vezes. Use o pente carregado para levantar um
pequeno pedaço de papel. Esta atração eletrostática simula uma ligação iônica “pura”.
Agora verifique quanta força você tem que fazer para puxar o papel do pente.Compare
esta força com a requerida para arrancar um selo bem colado de um envelope. Esta última
situação simula uma ligação covalente “pura”...”
(Rod O’Connor – INTRODUÇÃO À QUÍMICA)
Materiais:
Tubos de ensaio
Suporte par tubos
Béquer
Buretas
Bastão de borracha
Am perímetro
Reagentes:
Cloreto de sódio (sólido)
Cloreto de sódio 1mol/L
Clorato de sódio (sólido)
Àcido Clorídrico 3mol/L e 1mol/L
Hexano
Tetracloreto de carbono
Àlcool metílico
Álcool etílico
Iodo metálico
1ª Experiência: Condutividade elétrica das substâncias iônicas e moleculares
1. Adicione aos béqueres as seguintes substâncias:
ABCDEFGH-
Água destilada
Cloreto de sódio sólido(NaCl)
NaCl 1M
Clorato de sódio sólido(NaClO3)
NaClO3 em estado de fusão
Ácido clorídrico 3M(HCl)
HCl 0,1M
Hexano(C6H14)
1.Usando a montagem mostrada na figura, teste a condutividade elétrica das substâncias
relacionadas, pelo contato dos eletrodos com as mesmas.
Figura 1- Circuito elétrico
OBS: Não tocar nos eletrodos
Lave os eletrodos com água destilada antes de usá-los novamente.
Anote suas observações na tabela abaixo, atribuindo (0) para o não condutor, (1)
para baixa e média condutividade e (2) para alta condutividade. O brilho do bulbo da
lâmpada indicará a taxa de condutividade.
Substância
Taxa de condutividade
A – Água destilada
B – NaCl sólido
C – NaCl 1mol/L
D – NaClO3 sólido
E – NaClO3 em estado de fusão
HCl 3 mol/L
HCl 0,1 mol/L
Hexano(C6H14)
2ª EXPERIÊNCIA: Polaridade das moléculas
a) Adicione, aproximadamente, 30mL de água destilada em uma bureta. Ajuste a torneira
da bureta de modo a obter um fluxo contínuo e lento de água.
b) Atrite com um pedaço de flanela um bastão de borracha ( pente ou régua),
aproximando-o do fluxo de água da bureta. Observe.
c) Repita o procedimento anterior usando hexano (C6H14) ou tetracloreto de carbono
(CCl4)
d) Complete o quadro abaixo:
Observações
Água
Hexano
3ª EXPERIÊNCIA: Solubilidade do iodo no sistema H2O/ C6H14
a) Em tubo de ensaio adicione 5mL de água (H2O) e 5mL de hexano (C6H14). Adicione
alguns cristais de iodo(I2), agitando o tubo. Observe o ocorrido.
Observação:
Questionário
1) Explique os resultados obtidos na 1ª experiência, dando enfoque a estrutura eletrônica
dos átomos de tungstênio (W), encontrados no filamento da lâmpada, ao receberem uma
diferença de potencial em suas extremidades.
2) Explique a diferença de comportamento do hexano ( ou tetracloreto de carbono) e da
água em relação ao bastão de borracha atritado em relação a polaridade das moléculas das
duas substâncias.
3) Como você classificaria o iodo em termos de sua polaridade. Explique o porque da
classificação.
4) Uma certa substância é um líquido à temperatura ambiente e é insolúvel em água. Sugira
qual os tipos básicos de unidades estruturais ( íons, moléculas, átomos ) está presente na
substância e indique um experimento adicional que pode ser executado para confirmar sua
previsão.
5) Dê a fórmula de um sólido contendo carbono que é:
a) molécula
b) iônico
c) estrutura covalente
d) metálico