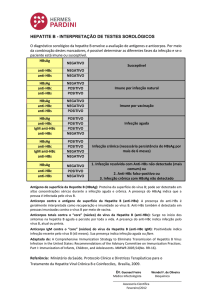
Diagnóstico Laboratorial das
Hepatites A, B e C
Amadeo Sáez-Alquézar
Vitória 2008
Hepatites por Vírus
Até 1965
Hepatite Infecciosa
A
Curto período de incubação
Hepatite por soro homólogo
Longo período de incubação
B
Hepatites Virais
Hepatite por vírus A
Hepatite por vírus B
Hepatite por vírus C
Hepatite por vírus D
Hepatite por vírus E
Hepatites Não A-E
HAV
HBV
HCV
HDV
HEV
HGV..
Vírus Epstein Bar, Citomegalovírus, Herpes, outros
Hepatites Virais Mais Frequêntes
VÍRUS
Família
A
Picornaviridae
B
Hepadnaviridae
C
Flaviviridae
D
Deltaviridae
E
Caliciviridae
Características das Hepatites
A
B
C
D
E
Agente
HAV
HBV
HCV
HDV
HEV
Dimensões
Envelope
Genoma
27-32
Não
RNA
42
Sim
DNA
55-65
Sim
RNA
36
do HBV
RNA
27-34
Não
RNA
Fecal/oral
Parenteral
Sexual
Sim
Não
Não
Não
Sim
Sim
Não
Sim
pouc.freq
Não
Sim
...
Sim
Não
Não
F. crônica
Não
(5-7%) (>80%)
Sim
Não
Transmissão
Hepatites Não A-E
Vírus da Hepatite G ou GB-C
Agente
etiológico
HGV
TTV
flavivirus
circovirus
RNA
DNA
50 – 100
30 – 50
SIM
NÃO
Marcadores
HGV – RNA
Anti-E2
TTV – DNA
Transmissão
Parenteral
Parenteral
Família
Genôma
Tamanho (nm)
Envelope
Diagnóstico das Hepatites por Vírus
• Testes sorológicos.
– Marcadores sorológicos (Ac, Ag).
• Testes de biologia molecular.
– Amplificação de ácidos nucléicos.
• Testes bioquímicos.
– Enzimas, pigmentos biliares, proteínas.
HAV e HEV
• Distribuição mundial
• Transmissão entérica (fecal-oral)
• Não apresentam formas crônicas
• Hepatite aguda grave:
– HAV
• Crianças < 1%; adultos >2%
– HEV:em gestantes
• 15 – 25%
HAV: Prevenção da Infecção
• Melhoria dos Padrões Sócio-econômicos e de Higiene.
• Em áreas endêmicas para HAV: A vacinação de crianças
é mandatoria.
• A imunogenicidade da vacina para hepatite A é muito alta,
obtendo-se 97% a 100% de soro conversão após uma
única dose e de 100% com a segunda dose.
• Vacinar viajantes de áreas não endêmicas para áreas
endêmicas.
Vacinas: Havrix® e Vaqta®
Transmissão da HVA
• Por contato pessoal
• Doméstico, sexual, crianças em locais
de estudo e recreação.
• Por água e alimentos
contaminados.
• Pelo sangue (rara)
• Uso de drogas endovenosas.
• Transfusão sangüínea
HVA - Características Clínicas
• Período de incubação: 30 (15-50)
dias
• Icterícia por faixa etária
• < 6 anos:
< 10%
• 6 a 14 anos:
40 – 50%
• > 14 anos:
70 – 80%
• Complicações: raras
• Formas crônicas: ausentes
Distribuição geográfica da
infecção pelo vírus da Hepatite A
CDC
HAV Estrutura e
variabilidade genética
• Estrutura icosahédrica
• Não envelopado
• Genoma: fita única de RNA
– 7500 nucleotídeos (3 regiões)
– Região codificadora (P1 – P2 – P3)
– 4 proteínas virais: VP1, VP2, VP3 e VP4
• Três Genótipos (15% de variações no VP1)
• Um único sorotipo
P2: Proteínas nâo estruturais (2A, 2B e 2C)
P3: Proteinas estruturais (3A, 3B, 3C e 3D)
Marcadores Sorológicos
da Hepatite por Vírus A
• Anti-VHA (IgM)
– Anticorpos contra o VHA, subclasse IgM
• FASE AGUDA
• Anti-VHA (IgG)
– Anticorpos contra o VHA, subclasse IgG
• RECUPERAÇÃO - IMUNIDADE
EVOLUÇÃO DA INFECÇÃO PELO VHA
Fase
ictérica
Convalescença
Anti-VHA IgM
Anti-VHA IgG
Viremia
ALT
VHA
Nas fezes
0
2
4
6
8
10
12
Semanas após a infecção pelo VHA
14
Imuno Captura : IgM reverso
anti-HAV (IgM), anti-HBc (IgM), anti-Delta (IgM)
H2O2/TMB
HRP
H2SO4
AgHAV
Positivo
Fase sólida
HVE Características
Clínicas
Paraná R & Schinoni MI
• Período de incubação:: 40 (15 – 60) dias
• Formas graves:
– Gestantes:
• Gravidade:
1% - 3%
15% - 25%
aumenta com a idade
• Formas crônicas::
não identificadas.
HEV – Características
epidemiológicas
• A maioria dos surtos estão associados à
ingestão de água contaminada com fezes.
• A transmissão, pessoa a pessoa, é mínima.
• Frequêntemente descrita em viajantes para
áreas endêmicas.
Distribuição geográfica da
infecção pelo vírus da Hepatite E
CDC
Surtos de infecção confirmada em > 25% de hepatites
esporádicas Não ABC
Marcadores Sorológicos para
o Vírus da Hepatite E
• Anti-HEV IgM
– Fase aguda
• Diagnóstico
• Anti-HEV IgG
– Recuperação
• Prevalência
Prevalência de infecção por HEV e HAV - Rio de Janeiro
Grupos
Anti-HEV (IgG)
(%)
Anti-HAV (IgG)
(%)
Doadores de sangue
(93)
4,3
92,5
Gestantes (304)
1,0
84,5
0
31,2
Área rural (145)
2,1
79
Hemodiálise (65)
6,2
91
11,8
80,4
Área urbana (260)
Usuários de drogas
IV (102)
TRINTA, Karen S, LIBERTO, Maria Isabel M, PAULA, Vanessa S de et al.
Hepatitis E virus infection in selected Brazilian populations.
Mem. Inst. Oswaldo Cruz, Jan. 2001, vol.96, no.1, p.25-29.
Infecção pelo HBV
• A prevalência da infecção por HBV, no
mundo, é estimada em torno de 4 – 5%
da população total do planeta.
– Portadores crônicos assintomáticos
– Hepatite crônica (350 milhões)
– Carcinoma Hepatocelular (HCC)
• Estima-se que ocorrem 50 milhões de
novos casos, por ano, de infecção pelo
HBV.
Distribuição Mundial da Infecção
Crônica por HBV
CDC
HBsAg Prevalência
8% - Alta
2-7% - Intermediária
<2% - Baixa
Formas de Transmissão do HBV
Exposição per cutânea e de mucosas a
fluídos corporais contaminados.
Contato sexual
Transfusão sangüínea
Transplante de órgãos
Vertical (mãe p/ o recém nascido)
Uso de agulhas e seringas contaminadas
Acidentes em laboratório
Infecção pelo HBV
Adultos
80% Assintomática
5-10% Infecção
20% Doença Aguda
crônica
>1% Hepatite Fulminante
30%
5% a 10%
Cirrose
Crianças
Quase sempre Sub-clínica
Hepato
carcinoma
23% Em 5 anos
Falência
hepática
Transplante
ou óbito
Infecção Crônica por HBV
Risco para
desenvolver
infecção
crônica
Risco para
Desenvolver
HCC
Período
perinatal
> 90%
25%
Crianças
1 a 5 anos
25 – 50%
25%
Crianças (>5)
Adultos
6 – 10%
15%
Infecção
HBV - PREVENÇÃO
• Imunização passiva
– Imuno globulina
• Proteção curta (2 – 3 meses)
• Imunização ativa
– Vacina
• Proteção longa (anos)
– Plasma purificado (1981)
– Vacina recombinante (1986)
VACINA HBV
• Esquema
– Três doses (0-1-6 meses)
– Não é necessário reiniciar, se passou o tempo
estabelecido entre as doses.
• Eficacia
– Resposta adequada: anti-HBs > 10UI/ml
• Proteção (> 15 anos)
– 1ª dose: 30-50% - 2ª dose: 75% - 3ª dose:
96%
– Menor em imunodeprimidos e idosos
Vírus da Hepatite B
Marcadores sorológicos
da Hepatite por Vírus B
• AgHBs
• Anti-HBs
• AgHBe
• Anti-HBe
• Anti-HBc (IgM)
• Anti-HBc (IgG ou total)
HBV EVOLUÇÃO NORMAL
Fases Clínicas
Pré-Inctérica
Inctérica
Convalescença
AgHBs
Anti-HBs
AgHBe
Anti-HBe
Anti-HBc IgM
Anti-HBc IgG
ALT
HBV-DNA
0
1
2
3
4
5
6
12
Meses após a infecção pelo VHB
24
AgHBs
AgHBe
Anti-HBe
Anti-HBc IgM
Anti-HBc IgG
ALT
HBV-DNA
0
1
2
3
4
5
6
Meses após a infecção pelo VHB
12
24
Perfis Sorológicos Observados em
Indivíduos Infectados pelo HBV
Perfil
Ag HBs
1
+
+
+
+
+
-
2
3
4
5
6
7
8
Anti-HBc
IgM
+
+
-
Anti-HBc
IgG
+
+
+
+
+
-
AntiHBs
+
+
+
Interpretações para o anti-HBc (+) com AgHBs/anti-HBs (-)
1-Resultado falso positivo para o anti-HBc.
Mais de 66% dos indivíduos com AgHBs negativo, anti-HBc
positivo e anti-HBs negativo, quando submetidos à vacinação
contra o HBV soroconvertem, com positividade para o anti-HBs, o
que indicaria que o anti-HBc isolado correspondia a um resultado
falso positivo.
2-Infecção passada pelo HBV e que após algum tempo
desapareceu o anti-HBs.
3-O AgHBs está en níveis muito baixos, ou se encontra formando
imunocomplexos com o anti-HBs, de modo que não pode ser
detectado.
4-Mutantes AgHBs. Ainda que as provas para detecção do AgHBs
apresentem alta sensibilidade, alguns testes podem não detectar
mutantes.
HBV – DNA circular de hélice dupla
parcialmente fechada e envelope lipídico
4 Regiões abertas para leitura
S
P
C
X
Genoma: 3.200 nucleotídeos
GENOMA DO HBV
Pré S1
Pré S2
DNA Polimerase
gene P
AgHBc
AgHBe
gene C
Pré C
AgHBs
gene S
HBV: Replicação e Variantes
Replica seu genoma (DNA) via transcrição
reversa do RNA pré-geonómico
• Inserção incorreta de nucleotídeos no cDNA
• Geração de “quasiespécies”
• Alta replicação viral: 1012-13 por dia
• Alta taxa de mutações
HBV – AgHBs – Variantes
• Subtipos
– O AgHBs possui diversas proteínas
– Determinantes antigênicos (a, d, y, w, r)
• Combinações: subtipos
– Mais comuns: adw, adr, ayw.
• O determinante antigênico “a” é comum a todos os subtipos
• Genótipos
– Baseados na divergência genética de 8%, ou mais, da sequência
completa de nucleotídeos
– Genótipos: A, B, C, D, E, F, G, H
• Mutantes
Genótipos Distribuição
do HBV Geográfica
Genótipos
A
B
C
D
E
F
G
H
A/D
B/C
Ba
Bj
A
A
G
G
H
F
D
AD
D
E
C
BaB
A
Baseados na divergência genética de 8% ou mais
da sequência completa de nucleotídeos
Stuyver et al., J Gen Virol. 2000;81(1):67-74. deMan et al., J Hepatol. 1998;29(4):669-75.
Bj
BC D
Variantes do HBV
Os subtipos e genótipos do HBV se
originam de forma natural durante o
curso da infecção pelo HBV
– Consolidadas na natureza
– Apresentam distribuição étnica e
geográfica características
Mutantes do HBV
1. Gerados espontaneamente
durante o curso da infecção
natural pelo HBV
2. Gerados num ambiente de pressão
seletiva
Uso de imuno profilaxia ativa
Uso de imuno profilaxia passiva
Tratamento com anti-virais
Principais Mutantes do HBV
Mutantes pré-Core ou Core promoter
• Achados em cepas mais virulentas
Mutantes no gene P (polimerase)
• Resistência a anti-virais
Mutantes no gene X
• Associados ao desenvolvimento de hepatocarcinoma
Mutantes no gene S
• Modificam os epítopos imunodominantes do
determinante antigênico “a”
Principais Mutações do HBV
• Na região pré core do DNA-HBV
(mutantes de escape do AgHBe)
– Falha na expressão do AgHBe a partir da região PréCore
• Ex: aa gly, substituído pelo aa arg
• [PCR DNA-HBV (+) e AgHBe (-)]
• Resistência aos anti-virais
– Mutações na Polimerase
• Lamivudina
• Adefovir
Estrutura antigênica do AgHBs
O envelope do HBV contem 3 proteínas (complexo AgHBs)
SHAgHBs com 226 aa
MHAgHBs com 281 aa
LHAgHBs com 345 aa
Codificadas pelo gene S do genoma viral
REGIÕES
S
S/pré-S1
S-pré-S1/pré-S2
Região hidrofílica globular: aas 99 a 169 do SHAgHBs
DETERMINANTE ANTIGÊNICO “a”
aas 121 – 149 da região S
Determinante Antigênico “a”
É comum a todos os sub-tipos do HBV
Tem afinidade com o determinante “a”
– Acs contra o AgHBs na infecção pelo HBV
– Acs após a vacinação
– Acs das gamaglobulinas específicas policlonais
(HBIg)
– Acs dos kits diagnósticos para a detecção de
AgHBs
Principais Mutações do HBV
• No determinante antigênico “a”
– Gly (145) substituída por arg
– Lys (141) substituída por glu
– Vacina, HBIG e diagnóstico “escape”
• G145R, K141E (Alça 2 “determinante a”)
• T126S, T131N (Alça 1 “determinante a”)
– G145R
• Descrita mais frequentemente em pacientes
vacinados, mas também em portadores crônicos
não vacinados
Alça 1do determinante “a”
121
s-s-124
Vaccine Escape Mutants:
126
158 Y
F
131
99
T126S
M133L
D144E
N144R
Thr143Leu
Ser 143Leu
133
137
141
G130N res à lamivudina
--s--s- 149
107 -s-s- 138 139
T131N
K141E
G145R
164
D
s-s-147
E
145
144 G
D
195
R
I
W
E
Alça 2 do determinante “a”
(Carman, W. J Viral Hepatitis 1997 4: 11-20)
210
M
198
I
M
S
196
Mutações do AgHBs
• Diagnóstico de HBV em indivíduos AgHBs
negativos
– Importância dos Ac monoclonais / policlonais
• Falha na vacinação de recém nascidos de
mães Ag HBs positivas (0,6 – 4,0%)
• Falha na imuno profilaxia em receptores de
transplante ortotópico de fígado (11 -66%)
• Falhas no tratamento com antivirais
BRASIL –Testes obrigatórios na triagem
sorológica de doadores de sangue
•
•
•
•
•
Anti-HIV1/2
Anti-HTLVI/II
Anti-HCV
Ag HBs
Anti-HBc
Sífilis
Chagas
ALT
(2)
(1)
(1)
(1)
(1)
(1)
(2)
(1)
Nº 1.376 Nov / 93 Nº 2.009 Out / 96
Nº 488 / 98
•
•
•
•
Anti-HIV1/2
Anti-HTLVI/II
Anti-HCV
Ag HBs
Anti-HBc
Sífilis
Chagas
– ELISA
• Alta sensibilidade
RDC Nº 343 Dez / 2002
RDC Nº 153 Junho / 2004
(2)
(1)
(1)
(1)
(1)
(1)
(1)
Testes para detecção do AgHBs
• Sensibilidade
• Especificidade
• Detecção de mutantes
Sensibilidade clínica de 17 kits com marca CE,
frente a diversos painéis de soro-conversão
Ensaio
PRISM HBsAg
Enzygnost HBsAg 5.0
Monolisa Ag HBs Ultra
Elecsys HBsAg
Murex HBsAg Version 3
ETI-MAK 4
ARCHITECT HBsAg
ADVIA Centaur HBsAg
Vitros HBsAg Reagent Pack
Imx HBsAg (V2) Reagent Pack
Immulite I/2000 HBsAg
AxSYM HBsAg (V2) Reagent Pack
ORTHO Antibody to HBsAg ELISA
Cobas Core HBsAg II EIA
Genedia HBsAg 3.0
Bioelisa HBsAg Colour
Hepanostika HBsAg Uni-Form II
Fabricante
Abbott
DADE Behring
Bio-Rad
Roche
Murex
DiaSorin
Abbott
Bayer
Ortho-Clinical
Abbott
DPC
Abbott
Ortho-Clinical
Roche
Greencross
Biokit
Bio-Mérieux
Rank
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Sheiblauer H,Soboll H and Nick S. J. Med. Virol. 78:S66-S70, 2006
Sensibilidade analítica de 7 kits para AgHBs.
Dados recentes da literatura:
1-Ly TD et al, J. Clin. Microbiol 2006; 44(7): 2321-2326
2- Ly TD et al. J. Med. Virol. 2007; 79:S37-S41.
Sensibilidad analítica de 7 kits AgHBs
Marca
Limite mínimo de
detecção
HBsAg 5.0 – Dade Behring
0,07 ng/ml
Monolisa Ultra – BioRad
0,08 ng/ml
Vidas Ultra – Bio-Mérieux
0,09 ng/ml
Liaison Dia - Sorin
0,11 ng/ml
Advia Centaur - Bayer
0,12 ng/ml
Architect - Abbott
0,13 ng/ml
AxSYM V2 - Abbott
0,16 ng/ml
Ensaio Direto “Sandwich”:
Detecção de AgHBs (ELISA)
Ac Monoclonais
(mistura)
H2O2/TMB
HRP
Ag HBs
H2SO4
Ac monoclonais
Ac policlonais
Fase sólida
Positivo
Anticorpos
Policlonais: Reconhecem múltiplos sítios de ligação do Ag
Monoclonais: Reconhecem um único sítio de ligação do Ag
Ac Policlonais
Ac Monoclonais
Sensibilidade de acordo com o tipo de
anticorpos utilizados em kits AgHBs
Anticorpos na
Fase sólida
Anticorpos do
conjugado
Sensibilidade
1 anticorpo
monoclonal
1 anticorpo
monoclonal
~ 1,5 ng/mL
Anticorpos
policlonais
2 anticorpos
monoclonais
0,3-0,5 ng/mL
3 anticorpos
monoclonais
Anticorpos
policlonais
< 0,15 ng/mL
Triagem Sorológica de Doadores de
Sangue para o HBV
• Na seleção dos testes para AgHBs,
dar preferência:
– Aos que apresentem melhor sensibilidade
• Detecção <0,1 ng de AgHBs /mL
– Aos que consigam detectar o maior número
de mutantes
Teste rápido para Ag HBs
VIKIA - bioMérieux
Evaluation of VIKIA HBs Ag, a new immuno-chromatographic test for the qualitative detection of
HBs antigen in serum, plasma and whole blood human samples.
Serge Diagbouga, Centre Muraz, Bobo Dioulasso, Burkina-Faso
Dr Kavita Chatterjee, Department of Transfusion Medicine, All India Institute of Medical Sciences, New Delhi, India
Dr Madhu Choudhary, Department of Microbiology, Employee State Insurance Hospital, Basidarapur New Delhi.
India
Dr Amadeo Saez Alquezar, PANEL laboratory, Sao Paulo, Brazil
Suzanne Marcillat, R&D Immunoessais Department, bioMérieux, France
Results : VIKIA HBsAg and Determine HBsAg presented a sensitivity of 99.0% (418/422 samples tested)
and 97.8% (413/422 samples tested), and a specificity of 99.8% (1525/1528 samples tested) and 100.0%
(1528/1528 samples tested), respectively.
The paired samples of plasma, serum, venous and capillary whole blood gave homogeneous results
when tested with VIKIA HBsAg.
Conclusion: These results demonstrate that VIKIA HBsAg perform equally with plasma, serum, venous
and capillary whole blood. In addition, Vikia HBsAg detects well the most prevalent HBV genotypes and
combines a high sensitivity and specificity. Therefore, it represents an improvement in the quality of HBV
rapid testing in comparison to the rapid test used in reference
Ensaios para HBV DNA
HBV Digene Hybrid-Capture I
Digene Corp.
HBV Digene Hybrid-Capture II
Ultra-Sensitive Digene
Hybrid-Capture II
Roche
Molecular
Systems
Artus-Biotech
Bayer Corp.
Amplicor HBV Monitor
Cobas Amplicor HBV Monitor
Cobas Taqman 48 HBV
Real Art HBV PCR Assay
Versant HBV DNA 1.0
Versant HBV DNA 3.0
WHO International Standar
Locarnini S, 2005
1UI/ml = 5-6 cópias/mL
1
10 102 103 104 105 106 107 108 109 1010
HBV DNA IU/mL
Importância do anti-HBc
• Diagnóstico
– Anti-HBc (IgM / IgG)
• Triagem sorológica
– Anti-HBc IgG (total)
• Sensibilidade
• Especificidade
% de receptores infectados
Hepatites pós - Transfusionais
30
HBsAg
25
20
Exclusão de doadores com fatores de Risco p/ HIV
15
Anti-HIV
ALT/Anti-HBc
10
Anti-HCV
5
0
1965
Testes HCV
melhorados
1970
1975
1980
1985
1990
Ano
Adaptado de HJ Alter and Tobler and Busch, Clin Chem 1997
1995
2000
AÇÕES PARA EVITAR AS
HEPATITES PÓS-TRANSFUSIONAIS
1965: Descoberto o
Antígeno Australia
(AgHBs)
1960
1975: Reconhece-se que cerca de 90% de
todas as hepatites transmitidas por transfusão
eram “não-A, não-B”. (NANB).
1970
Testes AgHBs 3ªgeração
aplicados na triagem
1990: Início da Triagem
para anti-HCV (1ª G)
1990
1980
1985-87: Triagem por
Anti-HBc e ALT
“surrogate tests” para HNANB
2000
AgHBs
+
Anti-HBc
1991: Triagem por Anti-HBc recomendada 1995: NIH/NHLBI Concensus Development
Conference recomenda que o teste ALT seja
pela FDA para reduzir a incidência de
descontinuado; Mantem-se o teste anti-HBc
hepatite B transmitida por transfusão
para evitar o risco residual de transmissão do HBV
Marcadores da Infecção pelo HBV
Perfis observados na triagem de doadores
PERFIL Ag HBs Anti-HBc
1
2
3
4
5
6
7
8
Neg
Pos
Pos
Neg
Neg
Neg
Neg
Neg
Neg
Pos
Pos
Pos
Pos
Pos
Pos
Pos
Anti-HBs
Ag HBe Anti-HBe HBV DNA
Pos
Neg
Pos
Neg
Neg
Pos
Pos
Pos/Neg
Pos/Neg
Pos
Pos/Neg
Pos
Pos
Pos
Pos
Neg
Neg
Neg
2 e 3: Portadores. (3 = alta infectividade)
4 e 5: Hepatite B oculta. (DNA em baixas concentrações: <103 UI/mL)
6 e 7: Exposto ao HBV? Imune? Anti-HBs? Infectante?
8: Recuperação sorológica
Sensibilidade analítica e Especificidade de
alguns kits anti-HBc (total)
Testes Anti-HBc
Marcas
Sensibilidade (PEI/mL)
Especificidade (%)
0,7
99,85
<0,5
99,83
Dade Behring
-
99,7
Wiener
-
99,4
BioKit
1,5
-
Bio Rad
0,6
99,6 - 100
bioMérieux
Dia Sorin
Ensaio Competitivo
Anti-HBc Total
H2O2/TMB
Soro
AgHBc
HRP
H2SO4
NEGATIVO
Fase sólida
Ensaio Indireto: IgG
H2O2/TMB
Ag
HRP
H2SO4
Soro
Fase sólida
Positivo
Ensaio Direto “Sandwich”: IgG
Anti-HBs
H2O2/TMB
HRP
H2SO4
Fase sólida
Positivo
Falhas na detecção do Anti-HBc
Avettand-Fenoel V, et al. J. Clin. Microbiol. 2006
2.169 amostras de soro, AgHBs (+) [hepatite crônica p/ HBV]
Anti-HBc
Positivo
2.130
Negativo
39 (1,79%)
26 (66,6%)
+/- com kits diferentes
Apenas 3 mutações
HIV (+) = 13
Transplantados = 5
13 (33,3%)
Sempre Neg
-Pacientes altamente imunocomprometidos
-Falta de sensibilidade de alguns kits
Tipos de Testes ELISA utilizados para a
triagem de doadores de sangue no Brasil
Tipos de testes Anti-HBc - Brasil - 2007
6%
7%
ELISA
MEIA
QUIMIO
87%
RFP e RFN (%) para a triagem por anti-HBc,
observados nos PCQES* desenvolvidos para
Bancos de Sangue no Brasil (2006 – 2007)
3
2,8
2,5
%
2
1,4
1,5
1
1
0,5
0,4
0,3
0
0,13
0,26
0,17
0,1
PA0407
PA0807
0,2
0,35
0
PA0406
PA0806
PA1206
RFN
RFP
(*) Programas de Controle de Qualidade Externo em Sorologia
PA1207
Importância do Anti-HBc na triagem
sorológica de doadores de sangue
• Eliminar o risco residual de
transmissão do HBV por transfusão
Testes AgHBs com baixa sensibilidade
Níveis de AgHBs indetectáveis
Mutantes no determinante “a” do HBV
Hepatite B oculta
Dados da Triagem sorológica para anti-HBc em
Regiões de média prevalência para o AgHBs
Países
AgHBs (neg) Anti-HBc (pos)
Paquistão
17,28%
Grécia
14,95%
Índia
10,82%
Triagem sorológica pelo anti-HBc
Bhatti FA et al. Transfusion 2007
Paquistão - Transfusão de unidades de sangue:
1,5 milhões de unidades transfundidas anualmente
Prevalência de AgHBs (+) em doadores: 2,16%
O anti-HBc não é usado na triagem de doadores
Estudo do anti-HBc em 966 doadores mostrou:
185 (19%) foram anti-HBc (+)
167 (17,28%) eram AgHBs (-) e anti-HBc (+)
Desses 167, 76% eram anti-HBs (+)
HBV-DNA foi detectado em 5 doadores que eram
AgHBs (-) e anti-HBc (+). Infecção oculta pelo HBV
1 em cada 200 doadores AgHBs negativos ainda
poderiam transmitir HBV para os receptores
% de Bolsas descartadas na Triagem Sorológica de
Doadores de Sangue, por Macroregião – Brasil, Dados
HEMOPROD / ANVISA / MS - 2002
Norte Nordeste Sudeste Centro
Oeste
Sul
Brasil
AgHBs
0,6
0,77
0,42
0,43
0,46
0,52
AntiHBc
8,12
4,29
2,91
4,95
4,92
4,2
AntiHCV
0,62
0,69
0,47
0,35
0,38
0,51
AntiHIV
0,46
0,9
0,39
0,41
0,27
0,49
Importância do Anti-HBc na triagem
sorológica de doadores de sangue
• Em regiões de baixa prevalência
Descarte de 2 a 5%
• Em regiões de média e alta
prevalência para o AgHBs
O descarte pode atingir mais de 20%
Em regiões com baixa prevalência para o AgHBs, mas
onde ocorra intensa transmissão horizontal em crianças,
o descarte por anti-HBc em doadores pode chegar aos 10%
Alternativas em Regiões com
Alta Prevalência de Anti-HBc (+)
Conseguir um pool de doadores negativos para AgHBs
e Anti-HBc e motivá-los a doar sangue regularmente
Vacinar os doadores com apenas anti-HBc (+)
e verificar a soroconversão
Importar unidades de sangue de regiões com baixa
prevalência de Anti-HBc
Alternativas em Regiões com Alta
Prevalência de Anti-HBc (+)
Aproveitar doadores anti-HBc (+)
Doadores anti-HBc (+) com anti-HBs >100 mUI/mL,
Poderiam ser aceitos
Doadores anti-HBc (+) com anti-HBs < 100 mUI/mL,
só seriam aceitos se fossem HBV-DNA Negativos
Controverso, porque a presença de anti-HBs nem
sempre é indicativa da ausência de HBV - DNA
Alternativas em Regiões com Alta
Prevalência de Anti-HBc (+)
Um estudo no Irã com 2.000 doadores mostrou a
presênça de Anti-HBc (+) em 131 (6,55%) sendo que
16 dos 131 (12,2%) eram HBV – DNA (+)
Se o anti-HBc é (+) a bolsa de sangue deverá ser
Descartada
Posteriormente o teste para HBV-DNA pode ser
adequado para seguimento da infecção por HBV
Behzad-Behbahani A. J. Med. Res. 2006
Arraes LC et al. Rev. Inst. Med. Trop. S.Paulo 2003
Yotsuyanagi H et al. Transfusion, 2001
Reatividade de mutantes r-HBsAg,
em vários ensaios AgHBs
Mutantes (conc.)
145R H
145R L
144A H
144A L
142L H
142S H
142S L
133L L
126H H
126S L
Wild type
ENSAIOS
A
B
C
D
E
F
G
H
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
N
N
N
N
N
N
+
+
+
+
+
+
N
N
N
N
N
N
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
N
N
+
+
+
+
+
+
+
+
+
+
+
+
+
N
+
N
+
+
+
+
+
+
+
Harrison T.J. et al, 1998
N
+
Comportamento dos testes para detecção de AgHBs na
presença de mutantes do antígeno de superfície do HBV
Coleman PF
Emerging Infectious Diseases • www.cdc.gov/eid • Vol. 12, No. 2, February 2006
Desempenho de kits AgHBs para a detecção
de mutantes
Louisirirotchanakul, S et al. HBsAg diagnostic kits in the detection of hepatitis B
Virus mutation within “a” determinant. Viral. Immunology 2006; 19(1): 108-114.
Painel de referência com amostras
de doadores de sangue - Tailândia
N = 212 amostras
107 AgHBs Negativas
105 AgHBs Positivas
Painel de mutantes AgHBs rec
Thr126-Ser
Gln129-His
Met133-Leu
Asp144-Ala
Gly145-Arg
Thr126-Ser + Gly145-Arg
Pro142=Leu + Gly145-Arg
Pro142-Ser + Gly145-Arg
Asp144-Ala + Gly145=Arg
Desempenho de diversos kits AgHBs frente a
um painel de referência de doadores de sangue
na Tailândia
Performance de kits diagnósticos Ag HBs
Painel de referência (doadores de sangue) 107 Negativas e 105 positivas para Ag HBs
Ab : MONO / POLI
Ab: MONO / MONO
Sensibilidade (% )
LC 95%
Especificidade (% )
LC 95%
AxSYM
HBsAg (V2)
100
VIDAS
HBsAg
(ultra)
100
Hepanostika MONOLISA
HBsAg
HBsAg
Uniform II
(Ultra)
100
100
95,6-99,9
95,6-99,9
95,6-99,9
95,6-99,9
95,6-99,9
95,6-99,9
95,6-99,9
95,6-99,9
100
100
100
100
99,07
100
100
99,07
95,6-99,9
95,6-99,9
95,6-99,9
95,6-99,9
94,2-99,9
95,6-99,9
95,6-99,9
94,2-99,9
Elecsys Vitros Enzygnost Ortho
HBsAg I HBsAg
HBsAg
HBsAg
100
100
100
100
Louisirirotchanakul, S et al. HBsAg diagnostic kits in the detection of hepatitis B
Virus mutation within “a” determinant. Viral. Immunology 2006; 19(1): 108-114.
Kits AgHBs usados no estudo
Louisirirotchanakul, S et al. HBsAg diagnostic kits in the detection of hepatitis B
Virus mutation within “a” determinant. Viral. Immunology 2006; 19(1): 108-114.
Abbott Diag
AxSYM
HBsAg (V2)
MEIA
fluor
Bio-Mérieux AS
VIDAS
HBsAg (Ultra)
ELFA
fluor
Ab: Mono/poli
Bio-Mérieux AS Hepanostika HBsAg Uniform II
EIA
color
Bio-rad
Roche Diag
MONOLISA
HBsAg (Ultra)
EIA
color
Elecsys
HBsAg I
ECLIA
quimiolum
HBsAg
ECI
quimiolum
Ortho-Clinical Diag Vitros
Ab: Mono/mono
Dade Behring
Enzygnost
Ortho-Clinical Diag Ortho
HBsAg
EIA
color
HBsAg
EIA
color
MEIA: microbead enzyme-linked immunoassay; ELFA: enzyme-linked fluorescent assay;
EIA: enzyme-linked immunosorbent assay; ECLIA: electrochemiluminescence-linked immunoassay;
ECI: enhanced chemiluminescence immunoassay.
Desempenho de diversos kits AgHBs frente a
um painel de Mutantes AgHBs rec
Performance de kits diagnósticos Ag HBs
Painel de referência: Mutantes Ag HBs rec
Ab : MONO / POLI
Ab: MONO / MONO
Fluorescência
EIA color
Quimiolum
EIA color
Mutantes AgHBs rec
AxSYM
HBsAg (V2)
Thr126-Ser
7,96 (Pos)
Gln129-His
7,02 (Pos
Met133-Leu
7,17 (Pos)
Asp144-Ala
5,56 (Pos)
Gly145-Arg
5,56 (Pos)
Thr126-Ser + Gly145-Arg
4,77 (Pos)
Pro142=Leu + Gly145-Arg
5,80 (Pos)
Pro142-Ser + Gly145-Arg
5,94 (Pos)
Asp144-Ala + Gly145-Arg
5,25 (Pos)
Control Negativo
1,06 (Neg)
Control Positivo*
8,69 (Pos)
(*): recombinant Wild-type HBS Ag
VIDAS
HBsAg
(ultra)
9,7 (Pos)
8,5 (Pos)
8,7 (Pos)
5,4 (Pos)
5,8 (Pos)
10,5 (Pos)
4,9 (Pos)
5,8 (Pos)
6,1 (Pos)
0,08 (Neg)
1,3 (Pos)
Hepanostica MONOLISA
HBsAg
HBsAg
Elecsys
Uniform II
(Ultra)
HBsAg I
1,96
1,96
2,00
1,48
1,53
1,36
1,29
1,48
1,58
0,54
2,20
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Neg)
(Pos)
6,19
7,49
6,35
6,33
4,91
4,20
3,74
5,04
4,19
0,57
7,53
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Pos)
(Neg)
(Pos)
9,88
9,70
8,59
7,73
0,46
0,48
0,48
0,46
0,47
0,47
10,1
(Pos)
(Pos)
(Pos)
(Pos)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Pos)
Vitros
HBsAg
12,9
13,7
11,2
0,15
0,06
0,06
0,06
0,04
0,09
0,08
15,6
(Pos)
(Pos)
(Pos)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Pos)
Louisirirotchanakul, S et al. HBsAg diagnostic kits in the detection of hepatitis B
Virus mutation within “a” determinant. Viral. Immunology 2006; 19(1): 108-114.
Enzygnost
HBsAg
9,35
8,81
9,01
7,61
0.69
0,83
0,61
0,26
0,61
0,39
9,45
(Pos)
(Pos)
(Pos)
(Pos)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Pos)
Ortho
HBsAg
5,33
6,43
5,65
0,71
0,43
0,47
0,43
0,43
0,47
0,45
7,35
(Pos)
(Pos)
(Pos)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Neg)
(Pos)
Desempenho de kits AgHBs para a detecção de mutantes
Roche Mutant Panel (Recombinant)
Enzygnost
HBsAg
5.0
Dade
Mutação
Diluição
1:10
pura
1:10
1:10
pura
pura
1:10
pura
1:10
pura
pura
1:10
1:10
1:10
pura
D144A/L186T
D144A/L186T
M133T
M133T/Y161F
T123N
Y100C/P120T
T143L
T143L
S143L
S143L
S38P/M198T
C76Y/R169H
S53L/I126N/S210N
C76Y/T143M/F219S
C76Y/T143M/F219S
Murex
ETI-MAK-4 Architect Immulite ORTHO Monolisa Hepanostika Bioelisa
HBsAg
HBsAg
HBsAg HBsAg
HBsAg
HBsAg
HBsAg
HBsAg
Version 3
ELISA TS 3
Ultra
Uniform II
colour
Behring
Murex
Dia-Sorin
Abbott
DPC
Ortho
S/CO
20,2
n.t
29,2
16,1
26,9
0,6
47,1
n.t
49,4
n.t
12,7
36,3
20,3
6,5
n.t
S/CO
12,8
n.t
21,1
14,4
4,5
32,9
36,3
n.t
over
n.t
10,0
27,0
8,0
5,2
n.t
S/CO
8,7
n.t
22,4
9,5
23,1
46,6
82,4
n.t
over
n.t
6,9
35,7
14,7
5,3
n.t
S/CO
0,4
n.t
1,1
0,3
VNS
VNS
5,2
n.t
15,6
n.t
VNS
1,7
0,6
0,3
n.t
S/CO
3,3
n.t
7,8
1,7
VNS
VNS
24,5
n.t
157,7
n.t
VNS
11,7
4,0
1,8
n.t
S/CO
0,5
8,4
7,2
2,2
0,8
27,8
-0,1
0,6
0,0
1,2
5,5
43,7
19,3
0
n.t
Bio-Rad BioMérieux
S/CO
8,2
n.t
12,9
4,8
VNS
VNS
24,6
n.t
28,5
n.t
VNS
6,9
4,1
2,3
n.t
Cut-off of ARCHITECT assay = 0,05 IU/mL
Sheiblauer H,Soboll H and Nick S. J. Med. Virol. 78:S66-S70, 2006
S/CO
2,3
n.t
7,3
2,3
2,0
6,7
16,1
n.t
47,4
n.t
1,8
6,9
2,1
0,8
13,6
Biokit
S/CO
4,6
n.t
7,0
3,1
4,8
14,5
22,2
n.t
34,6
n.t
2,9
12,8
6,3
2,3
n.t
Desempenho de kits AgHBs para a detecção de
mutantes
ABBOTT Coleman Panel
Mutação
T126S
Q129H
M133L
D144A
G145R
T126S / G145R
P142L / G145R
P142S / G145R
D144A / G145R
AxSYM Advia
HBsAg Centaur
V2
HBsAg
Bioelisa
HBsAg
colour
Monolisa
HBsAg
Ultra
Enzygnost
HBsAg
5.0
Dade
ETI-MAK-4
HBsAg
Immulite
HBsAg
Murex
HBsAg
Version 3
Elecsys
HBsAg
Abbott Bayer
Biokit
Bio-Rad
Behring
Dia-Sorin
DPC
Murex
Roche
S/CO
S/CO
S/CO
S/CO
S/CO
S/CO
S/CO
S/CO
S/CO
3,74
20,17
3,84
12,73
14,11
10,42
3,56
10,32
8,64
4,08
20,21
30,9
16,31
11,26
8,76
3,22
8,90
8,61
4,17
12,72
3,13
12,41
12,09
8,42
3,06
9,95
8,58
3,16
6,47
1,94
12,31
11,06
3,58
2,30
8,45
6,55
3,20
0,10
2,06
11,03
0,80
4,21
2,47
8,80
0,56
2,35
0,10
1,58
9,21
0,82
4,06
2,29
6,56
0,56
3,26
0,10
2,54
10,48
0,72
3,76
2,67
8,37
0,56
3,10
0,10
2,39
10,57
1,69
4,09
2,90
8,81
0,56
2,61
0,10
1,52
10,71
2,63
3,33
1,67
8,40
0,56
Sheiblauer H,Soboll H and Nick S. J. Med. Virol. 78:S66-S70, 2006
Desempenho de Kits Ag HBs para a Detecção de
Mutantes
Natural Mutant Panel
Sheiblauer H,Soboll H and Nick S. J. Med. Virol. 78:S66-S70, 2006
Sensitivities of four New commercial hepatitis B
surface antigen (HBsAg) assays in detection of HBsAg
mutant forms.
Thoai Duong Ly et al. J. Clin. Microbiol, july 2006
Sensitivities of four New commercial hepatitis B
surface antigen (HBsAg) assays in detection of HBsAg
mutant forms.
Thoai Duong Ly et al. J. Clin. Microbiol, july 2006
Desempenho de Kits Ag HBs na Detecção de
Mutantes (Ly TD. J. Med. Virol. 2007; 79:S37-S41)
Recombinant mutants: Abbott Panel
Teste
Q129H
Auzyme
5,8
GS 3.0
28
Test System 3
15,8
Vitros Eci
10,7
Centaur
21,61
AxSYM v 2
8,15
Architect
0,26
Immulite
7,64
Elecsys
15,06
Liaison
17
Vidas ultra
1,33
Bio-Elisa
30,9
Eti-Mak 4
15,6
Monolisa ultra
25,4
Hepanostika ultra
22
Dade 5.0
50,9
Murex v 3
8,8
M133L
6,9
25
12,3
8,8
14,61
8,33
1,23
7,25
11,66
15
1,61
3,13
13,3
17,7
19,19
41,98
9,95
D144A
7,1
5
0,71
0,18
3,06
6,32
0,67
5,64
10,69
6,2
1,34
1,94
5,7
19,3
13,13
50
8,45
G145R
6,4
0,4
0,15
0,14
<0,1
6,4
1,09
6,82
0,37
4
1,09
2,06
7,1
14,6
17,09
1,16
8,8
P142L/
G145R
5,1
0,4
0,17
0,13
<0,1
6,51
1,08
6,25
0,33
3,7
1,06
2,54
6,6
15,8
17,27
0,86
8,37
Bio-Rad Panel
P142S/
G145R
6,4
0,4
0,23
0,14
<0,1
6,19
0,65
5,83
0,35
5
1,15
2,39
5,2
13
15,56
3,24
8,81
T123N/
T124S
NT
NT
NT
NT
0,3
1,29
0,11
0,57
NT
5,8
0,49
NT
3,6
1,51
47
0,46
NT
T126S
NT
NT
NT
NT
1,73
2,2
0,06
0,91
NT
4,6
0,2
NT
21,5
4,6
46
1,48
NT
T123N
NT
NT
NT
NT
0,56
0,99
0,07
7,58
NT
6,5
1,16
NT
3
3,05
46
Over
NT
Reactive S/CO: AxSYM = 2; Architect = 0,05 IU/ml; Liaison = 1,1; Vidas ultra = 0,13; los demás = 1
Janela Imunológica do HBV
Janela imunológica
NAT
Vírus
Testes ELISA
HBV
56 dias
31-42 dias
HBV
56 dias
45 (34-66) dias
Risco residual de transmissão por transfusão
1:77.000 a 149.000
NAT para HBV na Triagem de doadores
de sangue
NAT para HBV
Doações
1.641.891
Doações NAT-HBV (+),
AgHBs (-)
10
Rendimento período de
janela
1/164.189
Rendimento Infecções HBV
ocultas
39 (1/42.100)
Sociedade Espanhola de Transfusão Sanguínea, 2007
Vírus da Hepatite Delta (HDV)
• O HDV precisa da presença do HBV para
causar infecção.
• Distribuição heterogênea ao redor do
mundo.
• Endêmico em algumas regiões da América
Latina, Europa e África.
• Pode estar associado a formas graves de
hepatites em algumas regiões do Norte da
América do Sul.
Vírus da Hepatite Delta (HDV)
Vírus da Hepatite B
Vírus da Hepatite Delta
Envelope
AgHBs
Envelope
AgHBs
DNA
polimerase
RNA
42 nm
DNA
Core (27 nm)
AgHBc
AgHBe
Vírus Delta
Core (27 nm)
Virus Delta
Marcadores sorológicos
da Hepatite por Vírus Delta
• Anti-VHD (IgM)
– Fase aguda
• Anti-VHD (IgG)
– Recuperação
• AgVHD
– Fase aguda
VIRUS DA HEPATITE DELTA
INFECÇÃO SIMULTÂNEA COM O VHB
VHD-RNA
VHB-DNA
IgG
Anti-VHD
IgM anti-VHD
IgG anti-VHD
AgHBs
Anti-HBs
ALT
VHD
+
VHB
0
1
2
3
4
Meses
5
6
12
SUPERINFECÇÃO PELO VHD
EM PORTADOR DO VHB
VHD-RNA
VHB-DNA
Anti-VHD
IgM anti-VHD
IgG anti-VHD
AgHBs
ALT
VHD
Diagnóstico da infecção por HDV
AgHBs
Anti-HBc
IgM
Anti-HDV
IgM
Anti-HDV
Total
+
+
+
Coinfecção
+
Neg
+
Super
infecção
+
+/-
Neg
+
Infecção
passada
+
+/-
Neg
Neg
Ausência de
infecção
Interpretação
Hepatite por Vírus C (HCV)
• A infecção pelo HCV representa um
dos mais graves problemas de saúde
pública no Brasil e no mundo.
• 170 milhões de pessoas infectadas
pelo HCV, no mundo.
• Indivíduos infectados pelo HCV
– Hepatite crônica (80% - 85%)
• Cirrose hepática (20%)
– HCC (10% - 20%)
História Natural da Hepatite C crônica
(50 anos)
Hoofnagle JH, Hepatology 36(5), 2002
Prevalência de infecção pelo HCV em
doadores de sangue
Anit-HCV Prevalence*
>5% - High
1.1-5%- Intermediate
0.2-1%- Low
<0.1% - Very Low
Unknown
*Anti-HCV defined by EIA and supplemental testing
CDC
Transmissão do HCV
• A principal via: parenteral
– Entre usuários de drogas intravenosas
– Por agulhas e seringas
• Esterilização inadequada ou reutilização
– Transfusão Sangüínea
– Transplante de órgãos
• Vertical
• Sexual (ineficiente)
• Ocupacional
Teste para HCV recomendado em:
• Usuários de drogas ilícitas injetáveis
• Quem recebeu fatores de coagulação antes de
1987
• Quem recebeu hemocomponentes ou órgãos antes
de 1992
• Pacientes submetidos a hemodiálise
• Evidência de doença hepática
• Profissionais da área da saúde (com suspeita de
exposição a sangue contaminado com HCV)
• Crianças nascidas de mães HCV positivas
Recomendações após exposição ao
HCV
• Seguimento após picadas de agulhas, cortes ou
exposição de mucosas a sangue HCV positivo
– Testar a fonte de contaminação p/ HCV
– Testar a pessoa exposta, se a fonte for (+)
– Anti-HCV e ALT, imediato e até 4-6 meses
– HCV-RNA em 4-6 semanas (+ rápido)
– Confirmar todos os anti-HCV com IB
• Encaminhar a pessoa infectada a serviço médico
especializado para avaliação e seguimento
CDC
Risco de infecção após picada com
agulha usada em paciente infectado
Vírus
Risco
HBV
30%
HCV
3%
HIV
0.3%
Padrão Sorológico na Infecção aguda por HCV com
Recuperação
anti-HCV
Título
HCV - RNA
ALT
Normal
0
1
2
3
4
5
6
Meses
Tempo após a Infecção
1
2
3
Anos
4
Mod. CDC, 2002
HCV - Evolução para Infecção Crônica
anti-HCV
Título
HCV RNA
ALT
Normal
0
1
2
3
4
5
6
1
2
3
Anos
Meses
Tempo após a infecção
4
Evolução do HCV-RNA, Ag HCV e anti-HCV
Evolução
Para
a cura
Evolução
Para a
cronicidade
Detecção da infecção pelo HCV
Testes Laboratoriais
• Indiretos
– Pesquisam a presença de anticorpos contra o
HCV
• Diretos
– Testes de biologia molecular para pesquisa
do RNA – HCV
– Pesquisam a presença do Ag core do HCV
• Combinação
– Pesquisam a presença de anticorpos contra o
HCV e do Ag core do HCV
Estrutura do RNA - HCV
Estrutural
Não-Estrutural
-----estrutura --------- --processamento ---- -----replicação ----C
E1
E2
NS2
NS3
NS4A NS4B
NS5A
NS5B
C
Nucleocapsídeo
Protease
ELISA
Proteínas do envelope
Reunião e entrada
Serina protease
Helicase
NS3
cofator
Replicação ?
1ª geração
2ª geração
3ª geração
Fosfoproteína
replicação
RNA dependente
RNA polimerase
Testes Laboratoriais – HCV ELISA
– 1ª Geração – NS4
– 2ª Geração – Core+NS3+NS4
– 3ª Geração – Core+NS3+NS4+NS5
• Ac IgG + IgM
• Variantes virais da NS3
– 4ª Geração – Ag / Ac
Testes Laboratoriais - HCV
•
•
•
•
•
•
ELISA
MEIA
Quimioluminescência (CLIA)
Aglutinação de partículas de gelatina
Imuno blot
Testes rápidos
Imunoblot – RIBA HCV 3.0
Interpretação
Positivo
Positivo
Indeterminado
Indeterminado
Negativo
Negativo
Controle IgG c100(p)
5-1-1(p)
Nível II
c33c
c22 (p)
NS5
Controle IgG
hSOD
Nível I
Amostras Repetidamente Reagentes
M urex
ELISA-1 ELISA-2
RIBA-3
M urex
Resul tado Amostras
ELISA-1 ELISA-2
RIBA-3
Amostras
DO/CO
DO/CO
DO/CO
DO/CO
DO/CO
DO/CO
Resul tado
1
0,29
0,24
1,29
N
29
0,41
0,27
6,29
N
2
3,56
3,43
3,73
IND
30
0,24
6,13
0,10
N
3
0,35
0,18
1,01
N
31
1,01
0,42
0,18
N
4
0,39
0,16
1,09
N
32
0,21
0,41
3,29
N
5
0,39
0,15
1,52
N
33
13,68
2,41
1,17
IND
6
0,23
1,44
1,17
N
34
0,23
0,18
1,45
N
7
2,89
0,19
0,07
N
35
0,27
1,63
0,16
N
8
0,32
0,23
1,36
IND
36
0,28
0,97
0,25
N
9
0,25
0,17
1,20
N
37
0,42
6,36
0,10
N
10
0,50
0,41
1,16
N
38
0,21
0,22
3,79
N
11
0,36
1,28
1,80
N
39
0,24
0,18
1,98
IND
12
1,75
1,48
0,68
IND
40
0,29
1,67
0,17
N
13
0,22
0,94
0,08
N
41
0,29
7,01
0,74
N
14
0,28
2,16
0,08
N
42
0,34
1,16
0,32
N
15
0,28
5,12
1,47
IND
43
0,25
0,37
1,90
N
16
13,81
10,73
9,89
POS
44
1,36
0,27
0,09
N
17
0,33
0,31
5,19
N
45
0,25
0,24
3,23
N
18
0,21
0,18
1,06
N
46
0,31
2,59
0,07
N
19
0,39
2,88
0,08
IND
47
1,01
0,25
0,03
N
20
0,31
0,18
3,41
48
0,45
0,34
1,47
21
2,46
0,54
1,58
49
0,43
0,18
3,17
22
0,29
0,23
1,09
N
IND
N
50
14,04
11,37
9,69
N
IND
POS
23
0,31
0,19
3,27
N
51
0,80
0,18
4,93
N
24
0,11
1,02
0,02
N
52
0,26
1,28
0,43
N
25
0,33
1,36
1,55
N
53
0,53
0,21
2,34
N
26
0,35
0,93
0,14
N
54
14,02
11,35
13,62
POS
27
0,31
1,74
0,06
N
55
1,17
0,33
1,39
N
28
0,40
0,21
8,18
N
56
0,41
0,21
6,19
N
Avaliação de Kits anti-HCV - ELISA
Sensibilidade
Especificidade
Triagem
Sensibilidade
Especificidade
Kit “A”
Kit “B”
Kit “C”
100%
100%
100%
99,4%
98,6%
97,9%
100%
99,4%
98,2%
98,6%
100%
97,9%
Triagem + painel de
soros (-) e Heterólogos
Sáez-Alquezar A et al. Laes & Haes 169: 90-94, 2006
Ensaios para a detecção do RNA - HCV
• Testes qualitativos
– Limite inferior de detecção: 10 – 50 UI/mL
• Testes quantitativos*
– Valor de corte para quantificação do RNA
• Limite inferior: ~ 600 UI/mL
• Limite linear superior : 850.000 – 7.700.000 UI/mL
(*): Amplificação do alvo (PCR ou TMA ou amplificação do sinal (branched )
A OMS padronizou as unidades de quantificação do RNA-HCV em UI/mL
Exemplos de fatores de conversão
Cobas Amplicor HCV Monitor. V2,9: 1 UI/mL = 2,7 cópias/ml
Versant HCV RNA Quantitative assay: 1 UI/ml = 5,2 cópias/ml
ALGORITMO PARA HCV
ELISA - 3.0
ANTI-VHC
PCR
NÃO-REAGENTE
Positivo
REPETIDAMENTE
REAGENTE
Negativo
SOROTECA
IMUNOBLOT
LIA ou RIBA
NEGATIVO
INDETERMINADO
POSITIVO
PCR
CONFIRMAÇÃO
PCR
GENOTIPAGEM
Nomenclatura dos Diferentes
Genótipos do Vírus da Hepatite C
Genótipos
Subtipos
1
1a, 1b, 1c
2
2a, 2b, 2c
3
3a, 3b, 3c
4
4a
5
5a
6
6a
Stuyver & Simmonds
Genotipagem do HCV
INNO - LIPA
RFLP
Restriction fragment Lenghtpolymorphism
Seqüênciameneto de porções variáveis
do genoma
Distribuição dos diferentes genótipos
do HCV em diferentes regiões
• Genótipos 1, 2 e 3.
– Países Ocidentais , Oriente Próximo
• Genótipos 5 e 6.
– África do Sul, Sudeste da Ásia
• Genótipo 4.
– Oriente Médio, África Central, Brasil
Prevalência dos genótipos do HCV
São Paulo – Brasil (N=348)
Doadores de Hemofílicos
sangue
(%)
(%)
Transplante
renal
(%)
Hepatite
crônica C
(%)
Total
(%)
Genótipos
1
2,9
4,3
75,0
5,2
12,9
1a
17,6
34,8
-
20,3
18,7
1b
38,2
17,4
-
36,6
31,3
2
5,9
13,0
5,0
3,2
4,3
3
32,4
30,4
15,0
33,9
31,3
4a
0
0
2,5
0
0,3
Mix
2,9
0
2,5
0,8
1,1
Bassit L et al. Rev. Inst. Méd. Trop. São Paulo. v. 41 (3): 183 – 189, May – June, 1.999.
Bassit L et al. Hepatology Vol. 29 (3): 994 – 95, 1.999.
Considerações Sobre o uso de
Testes ELISA anti-HCV
Pacientes imunocompetentes
Pacientes imunocomprometidos ou em
Hemodiálise
Pacientes com Hepatite Crônica
Populações de alto risco
Populações de baixa prevalência
Doadores de sangue
Hemoterapia
• Importância da Triagem
Sorológica em Doadores de
Sangue
– Usar testes que diminuam o período
da janela imunológica
• Anti-HCV
• Combo Ag/Ac
• Ag
• NAT (mini pool – amostras individuais)
Janela imunológica na infecção pelo
HCV com os marcadores utilizados
Infecção NAT
Ag
EIA 3ª EIA 2ª
EIA 1ª
Ag/Ac
Janela imunológica
0
13 15
70
80
DIAS
150
Alan Kitchen
Example of a representative profile
HCV Seroconversion Panel BBI 917 :
HCV-Ag/Ac
Redução da Janela Imunológica
Ranking on 35 Seroconversion panels, including subtype
1a, 1b, 2b, 3a in average days of delay for detection versus NAT :
HCV Ultra detects exposure to HCV with a minimum
of 17 days earlier than anti-HCV Ab assays tested :
70 % reduction of the serologic HCV WP
Desempenho do HCV-Ag/Ac
frente a diferentes Genótipos
A total of 405 genotyped samples were tested :
133 genotypes from various origin
272 genotypes from 2 hospital laboratories
All these samples from different genotypes were
found positive : 100 % sensitivity (405 / 405)
Bio-Rad
Janela Imunológica dos
vírus HBV, HCV e HIV
Janela imunológica
Vírus
Testes ELISA
Ag / Ac
NAT
HBV
56 dias
-
31-42 dias
HCV
70 dias
25-39 dias ?
23 dias
HIV
22 dias
15-16 dias
11 dias
Fase inicial da infecção pelo HCV
Eclipse
Retrovirus Epidemiology Donor Study [REDS] group
Busch MP. Transfusion 2006; 46:1624-1640
Bianco C.
Janela Imunológica com os testes diagnósticos
para a infecção por HCV
Anti-HCV 1ª G
150 dias
Anti-HCV 2ª G
82 dias
Anti-HCV 3ª G
66 dias
38 -94 dias
Combo Ag/Ac
12,5 dias*
39,2 dias**
38 dias menos
que o anti-HCV
NAT
7.4 dias*
31.9 dias**
8 – 9 dias
(*)Buch M et al. Transfusion 2005, 45:254-264
(**) Laperche S et al. Transfusion 2005. 45:1965-72
Muito Obrigado
[email protected]