UNIDADE I
Espetros, radiação e
energia
Espetros, radiação e energia
Na sequência do estudo do Universo, uma
questão impõe-se:
Como é possível obter informação sobre a
composição química de astros tão distantes?
Espetros, radiação e energia
• A energia produzida por uma estrela traduz-se
pela radiação electromagnética emitida por esta
e que percorre o espaço.
• É essa radiação, que é recolhida na Terra, que
fornece informação sobre a temperatura da
estrela, bem como a sua composição química.
• Mas, para conhecer a sua composição química,
é necessário decompor essa luz, obtendo o seu
espetro.
Espetros, radiação e energia
• O espetro é o resultado da
decomposição da luz.
• A luz, ou radiação visível, é apenas
uma pequena parte da chamada
radiação eletromagnética.
• Ao espetro total da luz chamamos
espectro eletromagnético.
Espetro eletromagnético
Menos energética
Mais energética
Espetro eletromagnético
Aplicações da radiação
eletromagnética
Ondas rádio:
- Transmissão de rádio e televisão.
- Radiotelescópios.
Microondas:
- Comunicação com veículos espaciais e radioastronomia.
- Transmissões por satélite.
- Deteção de excesso de velocidade (RADAR).
- Fornos microondas.
Aplicações da radiação
eletromagnética
Infravermelhos:
- Tratamento de doenças como reumatismo.
- Deteção de tumores no cérebro.
- Sistemas de segurança anti-roubo.
- Deteção de mísseis por satélite.
- portas automáticas e controlos remotos.
Ultra-violeta:
- Responsáveis pelo bronzeamento.
- Esterilização de produtos.
Aplicações da radiação
eletromagnética
Raios X:
- Radiografias.
- Controlo de bagagem nos aeroportos.
Raios gamas:
- Tratamento de certos cancros.
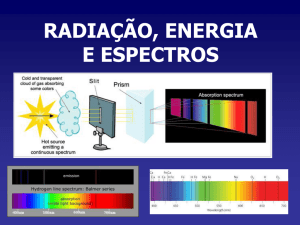
Como obter um espetro?
A experiência de Newton
Concluiu que a luz branca, por
exemplo a luz solar visível, é
composta radiações de todas as
cores – o prisma simplesmente
separa esses componentes.
Espetro da luz branca (contínuo)
Como obter um espetro?
Espetro da luz branca (contínuo)
Espetro do átomo de hidrogénio
(descontínuo)
Tipos de espetros
Contínuos
• Mostra uma gama invariada e
ininterrupta de cores.
Descontínuos ou de riscas
• Mostra riscas correspondentes
a radiações que são específicas
dos elementos que os
originam.
Tipos de espetros
Contínuo
Descontínuo
Espectro de Emissão
Descontínuo
Espectro de Absorção
Astronomy - spectroscopy - 1/3
Espetros das estrelas
• Todos os corpos, incandescentes ou não, emitem radiações
que originam um espetro de emissão contínuo. Estas
radiações conferem-lhes cor, que depende da temperatura a
que se encontram.
Espetros das estrelas
Espetro de Absorção de uma estrela
• Por observação da luz emitida por uma estrela é
possível determinar que elementos esta possui na
sua constituição.
• Utilizando um espetroscópio é possível decompor a
luz proveniente da estrela, obtendo o seu espetro.
Espetroscópio
Como determinar que elementos químicos
ou iões estão presentes numa estrela?
Como determinar que elementos químicos
ou iões estão presentes numa estrela?
H
He
Li
Espetros de emissão de diferentes elementos químicos.
•
Comparando os espetros de absorção e emissão de diferentes elementos, verificase que cada elemento tem um único espetro de emissão e um único espetro de
absorção, que são diferentes dos espetros dos outros elementos.
Que elementos estão presentes na
estrela?
Espetro de absorção da estrela.
Que elementos estão presentes na
estrela?
Espetro de absorção da estrela.
• Comparando as riscas do espetro da estrela com os espetros dos diferentes
elementos químicos (obtidos em laboratório), constata-se que algumas
riscas coincidem com as observadas nos espetros de alguns elementos.
• O espetro de riscas de um dado elemento é, portanto, característico
desse elemento, constituindo uma espécie de “impressão digital” do
mesmo e permitindo reconhecer a sua presença em qualquer material ou
na atmosfera de uma estrela.
Por que razão se formam espetros
de emissão e absorção?
• A espetroscopia fotoelectrónica tem por base a
análise da energia dos eletrões emitidos por
amostras de matéria constituída por certos átomos
ou moléculas.
• Cada átomo (ou molécula) pode ser identificado
por um conjunto de linhas espetrais.
• Para compreender como se formam os espetros de
emissão ou absorção é necessário estudar a
estrutura atómica.
Modelos atómicos
Interpretação do espetro de
riscas
Espetro de emissão do átomo de hidrogénio
Foi o físico dinamarquês Niels Bohr quem
propôs, pela primeira vez, uma teoria da
estrutura atómica que explicava os espetros de
emissão de riscas.
Bohr (1885-1962)
Interpretação do espetro de
riscas
Emissão e Absorção de radiação
E
N
E
R
G
I
A
n=3
n=2
n=1
E
N
E
R
G
I
A
Emissão
Cada círculo pretende representar simbolicamente um eletrão
n=3
n=2
n=1
Absorção
Interpretação do espetro de
riscas
Modelo de Bohr
O eletrão só pode ocupar certas órbitas com
determinado raio.
A cada órbita está associado um certo valor
de energia.
As saídas dos eletrões das órbitas só são permitidas por absorção
(excitação) ou emissão (desexistação) de certas quantidades de energias: a
energia do elctrão está quantizada ou quantificada.
Modelo de Bohr
Energia que o eletrão no átomo pode
assumir em cada nível:
2,18 10
En
n2
E
N
E
R
G
I
A
18
n=3
E3 2, 42 1019 J
n=2
E2 5, 45 1019 J
n=1
E1 2,18 1018 J
Modelo de Bohr
O estado de mais baixa energia corresponde ao
nível mais estável e designa-se por estado
fundamental.
Quando o eletrão do átomo de hidrogénio se
encontra em qualquer um dos níveis de energia
correspondentes a n = 2, 3, …, cuja energia é
superior à do estado fundamental, diz-se que se
encontra num estado excitado.
Como explicou Bohr a existência de espetros
atómicos descontínuos?
O aparecimento das riscas espetrais está associada à descontinuidade da
energia do eletrão no átomo.
E
N
E
R
G
I
A
n=3
n=2
n=1
Como explicou Bohr a existência de espetros
atómicos descontínuos?
Espetro de emissão do átomo de H – região visível
E (J)
n=6
n=5
n=4
n=3
n=2
n=1
Espetro de absorção para o átomo de H
Espetro de absorção do átomo de H – região visível
E (J)
n=6
n=5
n=4
n=3
Absorção de radiação IV
n=2
Absorção de radiação visível
Absorção de radiação UV
n=1
Como explicou Bohr a existência de espetros
atómicos descontínuos?
• A emissão de radiação pelo átomo excitado está energeticamente associada à
“queda” do eletrão de um nível energético superior para um nível energético
inferior.
• O valor da energia libertada é igual à diferença de energia entre os dois níveis
de transição, o que explica o aparecimento de riscas no espectro.
E
N
E
R
G
I
A
n=3
n=2
E
n=1
E E final Einicial
Espetro de emissão do átomo de
hidrogénio
Um estudo mais pormenorizado do espetro atómico de emissão do átomo de
hidrogénio revelou a existência de mais riscas espetrais para além das
visíveis.
Espetro de emissão do átomo de
hidrogénio
Séries
Nível final
Nível inicial
Região do
espectro
Lyman
1
2, 3, 4, …
Ultravioleta
Balmer
2
3, 4, 5, …
Visível
Pachen
3
4, 5, 6, …
Infravermelho
Brackett
4
5, 6, 7, …
Infravermelho