Química Orgânica
• Introdução: Química Orgânica é o ramo da
química que estuda os composto que
contêm carbono, chamado compostos
orgânicos.
Os compostos orgânicos estão presentes
em nossa vida diária:
Álcool Comum
Vinagre
C2H6O
C2H4O2
Petróleo e seus derivados.
Tipo
Exemplos
Derivados do petróleo
Gasolina, querosene
Fibras Sintéticas
Nylon , Teflon , PVC
Polímeros Naturais
DNA, RNA, borracha
Produtos de refrigeração e aerosóis
Freon ( hidrocarbonetos
polihalogenados )
Tintas e resinas
Tintas de água e de óleo
Explosivos
TNT trinitrotolueno
Gorduras e óleos
Óleo de milho , óleos vegetais
Sabões e detergentes
Detergentes para roupa e louça
Químicos agrícolas
Glutamato de sódio
Aditivos de alimentos e conservantes
Glucose , amilose
Açúcares e amidos
Cabelo, pele , amilase
Proteínas e enzimas
Insulina , adrenalina
Hormonais
Aspirina , penicilina , AZT , Viagra
Fármacos
Ainda na pré-história, tais substâncias
eram utilizadas pelo homem para a
produção de calor, para realização de
pinturas nos corpos, em cerâmicas e em
desenhos nas cavernas.
Desde os alquimistas
do século XVI, as técnicas
para extração de
substâncias foram sendo
aperfeiçoadas.
Do limão extraiu-se o ácido cítrico (C6H8O7);
Das gorduras animais,
extraiu-se a glicerina (C3H8O3).
Em 1777, Bergman
(Torben Olof Bergman),
introduziu a expressão:
COMPOSTOS ORGÂNICOS.
De acordo com Bergman,
tínhamos:
-COMPOSTOS ORGÂNICOS: Substâncias
extraídas dos organismos vivos;
-COMPOSTOS INORGÂNICOS:
Substâncias do reino mineral.
Juntamente com a distinção
proposta por Bergman em 1777,
desenvolveu-se a concepção de que
um simples composto orgânico não
poderia jamais ser sintetizado pelo
homem, haja visto que para a
produção desses compostos seria
necessário a existência de "uma
força vital" que somente existiria
nos organismos vivos.
Essa idéia, proposta por Jöns
Jacob von Berzelius no ano de 1807,
deu origem à Teoria da Força Vital
ou simplesmente vitalismo.
Berzelius
Cianato de amônio
+
aquecendo = Uréia
Conceito atual:
Química orgânica
É um ramo da Química que estuda os
compostos do elemento carbono,
denominados compostos orgânicos.
Importante: Esseção
Existe um pequeno grupo de compostos
que contém carbono, mas são estudados na
química inorgânica por não apresentarem
certas características comuns aos compostos
orgânicos. São os chamados compostos de
transição. Como exemplos:
NH4CNO – Cianato de amônio;
CO2 – Gás carbônico;
HCN – ácido cianídrico.
Propriedades gerais:
• Tipo de ligação: os compostos orgânicos
são moleculares (ligações covalentes), sem
carga (íons). Por isso os compostos
orgânicos não são bons condutores de
eletrólitos (eletricidade).
• PF, PE e Estabilidade térmica: Apresentam
baixos PF e PE (por serem moleculares)
com atração entre suas moléculas reduzida,
devido a ausência de cargas elétricas.
O açúcar é orgânico e o sal é inorgânico e
apresenta maior estabilidade térmica, uma
vez que o açúcar derrete facilmente.
• A velocidade de reação dos compostos
orgânicos é lenta, e geralmente necessitam
de catalisadores. Como exemplo: a
hidrogenação de óleos, que melhora a
estabilidade do óleo e modifica a sua
textura.
Uma hidrogenação completa modifica a
textura do óleo endurecendo-o para produzir
a margarina.
• Solubilidade: A maioria dos compostos
orgânicos é pouco solúvel ou insolúvel em
água.
As mãos sujas de graxa
devem ser lavadas em
solvente orgânico:
Gasolina
Fibras sintéticas, alimentos,
cosméticos, medicamentos e
combustíveis são alguns dos
produtos que envolvem milhões de
substâncias em que o principal
componente é o mais
extraordinário dos elementos
químicos, o:
Carbono.
Tipos de carbono
1o
:
l igado diretamente, no máximo, a 1 outro C
2o
:
l igado diretamente a
2
outros carbonos
3o :
l igado diretamente a
3
outros carbonos
: l igado diretamente a 4
outros carbonos
4o
Tipos de Carbono
H
H
CH3 H H
CH3 H
H- C - C - C - C - C - C - C -H
H
H
CH3 H
H
H
H
Atividade
Quantos carbono 1º, 2º, 3º 4º
existem na molécula abaixo:
Carbonos primários:
1, 7, 8, 9, 10, 12 e 13.
-Carbonos secundários:
5 e 6.
Carbonos terciários:
2, 4 e 11.
Carbonos quaternários:
3.
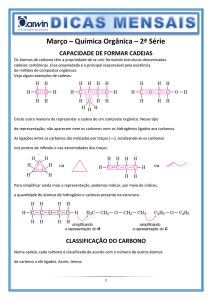
Cadeia Carbônica
É a estrutura formada por todos os
átomos de carbono de uma molécula
orgânica e também pelos
heteroátomos que estejam
posicionados entre carbonos
Regra
• Para que heteroátomos possa estar entre
carbonos é necessário que ele faça pelo
menos duas ligações
Fórmulas químicas dos
compostos orgânicos
Fórmula molecular
Indica apenas os
elementos que formam o
composto número de
átomos de cada
elemento.
etano
C2H6
Fórmulas químicas dos
compostos orgânicos
Fórmula
estrutural plana
Indica a
distribuição plana
dos átomos que
formam a
molécula.
etano
Fórmulas químicas dos
compostos orgânicos
Fórmula estrutural plana
condensada
A quantidade de
hidrogênios ligados aos
carbonos são escritos na
forma de índices.
Etano
CH3 – CH3
Friedrich August
Kekulé von
Stradonitz foi um
químico alemão.
Em 1857, ele
determinou as
características
fundamentais do
átomo de
carbono nos
compostos.
O carbono é tetravalente
Trata-se do primeiro
postulado de Kekulé, que
atribui ao carbono a
possibilidade de quatro
ligações.
A estrutura ao lado
representa o composto:
CH4
CH3Cl
As quatro valências são iguais entre si
O Carbono forma ligações
múltiplas
Ligação SIMPLES
(Sigma)
Ligação DUPLA
(Uma sigma outra pi)
Ligação TRIPLA
(Par sigma e outra pi)
O Carbono forma cadeias
Os tipos de cadeia orgânica:
-Quanto ao fechamento da cadeia
Acíclica ou aberta
Cíclica ou fechada
-Quanto à disposição dos
átomos:
Normal
Ramificada
-Quanto aos tipos de ligações:
Saturada
Insaturada
-Quanto à natureza dos átomos:
Homogênea: Na
cadeia, existe apenas
átomos de carbono
Heterogênea: Na
cadeia, existe átomos de
outros elementos
(heteroátomos)
II.Cadeia Fechada ( cíclica )
• Quanto à presença de anel
aromático
Aromática : - Cadeia constituída por compostos que
apresentam o anel benzênico em sua estrutura.
Ii
• Estrutura I – representação de todos os átomos.
• Estrutura I I – simplificação da estrutura I.
• Estrutura I I I – representação das ligações : o
círculo no meio representa as três ligações
duplas. Essas ligações não se encontram fixas em
suas posições, mas sim deslocadas ao longo do
anel.
Alicíclica ou não aromática : - Cadeia alicíclica
constituída por compostos que não apresentam o anel
aromático (benzênico) em sua estrutura.
As cadeias cíclicas também pode ser classificadas
como:
Homogêneas ou Heterogêneas
E
saturadas ou insaturadas.
Exemplos :
I – Cadeia carbônica aberta, normal , saturada e
homogênea.
II – Cadeia carbônica cíclica, aromática, insaturada e
homogênea.
III – Cadeia carbônica aberta, ramificada, saturada e
heterogênea.
IV
– Cadeia carbônica
saturada e
Observação
: Podemoscíclica,
contar alicíclica,
o número de
homogênea.
insaturações presentes em uma molécula: para cada
V – Cadeia
carbônica
aberta,
normal, insaturada
e
ligação
dupla,
temos uma
insaturação
e, para cada
homogênea.
ligação
tripla, temos duas insaturações. Assim, na
estrutura II,temos três insaturações e, em V ,temos
-Classificação dos carbonos na
cadeia:
Secundário
Primário
Terciário
Quaternário
Função orgânica:
É um conjunto de substâncias com
propriedades químicas semelhantes
denominadas de propriedades funcionais.
Para estudo das funções, é preciso
iniciarmos o estudo da sua nomenclatura,
que exige o cumprimento de normas
estabelecidas pela IUPAC (Union of Pure
and Applied Chemistry).
Para tanto, vamos iniciar o estudo dos
prefixos...
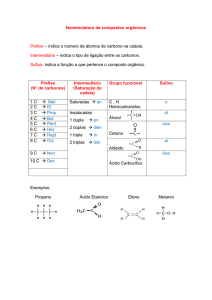
Número de carbonos
Prefixo
1
2
3
4
5
6
7
8
9
10
Met
Et
Prop
But
Pent
Hex
Hept
Oct
Non
Dec
Radicais orgânicos e seus nomes:
Regras fundamentais na nomenclatura dos compostos:
1) Considerar, como cadeia principal, a cadeia mais longa; se há
várias de mesmo comprimento, escolha como cadeia principal a
mais ramificada;
2) Numerar a cadeia de modo que as ramificações recebam os
menores números possíveis (regra dos menores números);
3) Citar as ramificações, em ordem alfabética, precedidas pelos
seus números de colocação na cadeia principal e finalizar com o
nome correspondente à cadeia principal.
Os HIDROCARBONETOS, são compostos orgânicos formados
exclusivamente por: carbono e hidrogênio.
Alcanos: São os principais formadores do petróleo.
Os alcanos apresentam apenas ligações simples.
Alcenos: Matéria-prima na fabricação de plásticos
e fibras têxteis.
Possuem duplas ligações.
Alcinos: Usados na fabricação de plásticos e solventes.
Possuem tripla ligação.
Resumindo:
Nomenclatura:
alcanos
Prefixo + an + o
alcenos
Prefixo + en + o
alcinos
Prefixo + in + o
Acompanhe os exemplos a seguir
CH4
METANO
CH3____CH3
ETANO
ETENO
CH3
PROPENO
ETINO
2-metil -pentano
Radical
Cadeia
2,2,4 trimetil - pentano
-Hibridização
O carbono sofre hibridização, ou seja,
mistura de orbitais.
Existem três tipos de hibridização para o
carbono.
Orbitais
x
s orbital
px orbital
z
y
pz orbital
py orbital
Hibridização sp3
•É a mistura de 3 orbitais p “puros” com um
orbital s “puro”, formando 4 novos orbitais
“híbridos” denominados sp3.
•A geometria dos 4 orbitais sp3 é tetraédrica (os
4 orbitais partem do centro do tetraédro e
dirigem-se, cada um, para um dos vértices do
tetraédro).
•O ângulo entre os orbitais sp3 será de
aprox.109°
•Acontece no C que se liga através de 4 ligações
simples ( o C é tetravalente).
2p
hibridação
sp3
H
H
H
H
Hibridização sp2
• É a mistura de um orbital s com dois
orbitais p (pertencentes a um mesmo
átomo), resultando em 3 novos orbitais
denominados híbridos sp2.
• Os três orbitais híbridos sp2 situam-se num
mesmo plano formando ângulos de 120°
entre si (geometria plana triangular).
• Acontece com C que possua uma dupla
ligação.
• Num C do tipo sp2 existirá um orbital p
“puro” que será responsável pela ligação
covalente do tipo pi.
H2C=CH2
• Molécula de eteno (etileno).
• Os dois átomos de C encontram-se ligados
por uma dupla ligação Uma ligação sigma
sp2-sp2 e uma ligação pi).
• Cada átomo de C encontra-se ligado a dois
átomos de H (duas ligações sigma s-sp2).
HIBRIDIZAÇÃO DO CARBONO sp2
Etileno
H
H
C
C
H
H
Cada carbono é hibrido sp2 . O hidrogênio é 1s.
Uma ligação da dupla é sp2 - sp2. A outra é p - p.
2p
2p
hibridação
2s
sp2
Exemplo de hibridação sp C2H2
• Etino (acetileno)
• Em torno dos átomos de C existem dois orbitais híbridos sp
e dois orbitais p “puros”.
• Os dois orbitais híbridos se ligarão através de ligações
sigma s-sp (H-C) e sigma sp-sp(C-C).
• Os dois orbitais p de cada carbono se ligarão produzindo
duas ligações pi entre os carbonos (resultando numa tripla
ligação entre os dois carbonos).
• Liga tripla uma ligação e duas ligações p
Fórmula estrutural do acetileno
H C
C
H
Cada átomo de carbono é um híbrido sp.
Os hidrogênios possuem orbitais 1s, não hibridizados.
2p
2p
hibridação
sp
2s
Observe que a tripla ligação consiste de uma e 2p .
As duas ligações p provem dos orbitais p, não hibridizados.
H C
H
C
C H
C
H