O estudo do carbono
A estrutura dos compostos orgânicos começou a ser
desvendada a partir da segunda metade do século XIX, com as idéias de
Couper e Kekulé sobre o comportamento químico do carbono. Dentre
essas idéias, hoje conhecidas como postulados de couper-kekulé, três
são fundamentais:
01) O átomo de carbono é tetravalente (estado hibridizado)
02) As unidades de valência do carbono são iguais entre si
03) Átomos de carbono ligam-se diretamente ente si, formando
estruturas denominadas cadeias carbônicas.
1
Na ligação signa (), a interpenetração de orbitais é frontal, segundo um
mesmo eixo. É uma ligação forte, difícil de ser rompida. Ocorre entre
vários orbitais, tais como s, o p ou os híbridos.
2
Na ligação pi (), a interpenetração de orbitais é lateral, segundo eixos
paralelos. É uma ligação fraca, mas fácil de ser rompida. Ocorre apenas
entre orbitais do tipo p “puro”.
3
No estado fundamental, o carbono (Z=6) possui apenas 2 elétrons
desemparelhados e, desse modo, só poderia fazer 2 ligações covalentes
comuns:
1s², 2s², 2p²
No entanto, o carbono é tetravalente. Para explicar esse fato utilizamos
a teoria da hibridação de orbitais resumida abaixo:
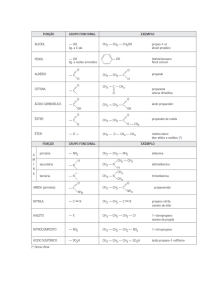
Tipos de Ligação
Ângulos entre as ligações
Geometria
Exemplos
Hibridação sp3
4 ligações
109º 28’
Tetraedro regular
etano: C2H6
Hibridação sp2
3 ligações e 1
120º
Trigonal plana
eteno: C2H4
Hibridação sp
2 ligações e 2
180º
Linear
etino: C2H2
4
etano, tetraedro regular
eteno, trigonal plana
etino, linear
5
É comum classificarmos um determinado átomo de carbono na cadeia de
um composto orgânico pelo número de átomos de carbono que está(ão)
diretamente ligado(s) a ele, independente do tipo de ligação (simples,
dupla, tripla). Essa classificação é importante para o estudo das reações
orgânicas.
Classificação
Definição
Carbono Primário Carbono
Secundário
ligado a um outro ligado apenas a 2
carbono
outros carbonos
Carbono
Terciário
ligado a 3 outros
carbonos
Carbono
Quaternário
ligado a 4 outros
carbonos.
Exemplo
6
Cadeias carbônicas – Classificação em resumo
homogênea ou heterogênea
Cadeia aberta, acíclica
ou alinfática
normal ou ramificada
saturada ou isaturada
homocíclica ou heterocíclica
alicíclica
cadeia fechada ou
saturada ou insaturada
cíclica
mononuclear
aromática
polinuclear (condensada ou isolada)
7
Cadeias carbônicas – Exemplos
aberta ou cíclica?
H
H
C
C
H
C
alicíclica ou aromática?
H
normal ou ramificada?
N
H
H
H
homogênea ou heterogênea?
saturada ou insaturada?
H
aberta ou cíclica?
C
H
C
C
H
Cl
C
Br
alicíclica ou aromática?
normal ou ramificada?
homogênea ou heterogênea?
C
O
H
saturada ou insaturada?
8
Radicais Orgânicos:
Radiais Alquilas ou
alcoílas:
Derivam dos alcanos
(saturados) e possuem
uma única valência livre
(elétron
desemparelhado).
Estrutura do nome:
prefixo + il ou ila
A
H3C
H3C
A
C
H2
A
H3C
A
H3C
C C C
H2 H2 H2
A
A
n-propil
etil
metil
C C
H2 H2
H3C
n-butil
H3C
A
C
H
C CH3
H2
H
H3C C CH3
H3C
CH3
s-butil
CH2
CH2
CH2
A
C
CH2 CH2 A
H
A
C
C
H3C
H
H3C
isopentil ou isoamil
CH3
H3C
C
C A
H2
CH3
neo-pentil
CH2
A
isobutil
CH3
n-pentil
C
CH3
t-butil
H3C
CH2
CH3
s-propil ou isopropil
H
H3C
C
H
CH3
s-pentil ou s-amil
A
H3C
C
H3C
C CH3
H2
t-pentil
9
Radiais Alquenilas:derivam dos alcenos (ligação dupla) e possuem uma única
valência livre.
Estrutura do nome: Prefixo+infixo+il ou ila
H
H2C
A
H3C C
H
C
C A
H
H2C C
H
A
etenil ou vinil
propenil
C A
H2
H3C C
CH2
isopropenil
alil
Radiais Alquinilas:derivam dos alcinos (ligação tripla) e possuem uma única
valência livre.
Estrutura do nome: Prefixo+infixo+il ou ila
HC
C
etinil
A
H3C C
C A
propinil
HC C
C A
H2
propargil
10
Radiais Cíclicos:derivam dos ciclanos (saturados) e possuem uma única
valência livre.
Estrutura do nome: ciclo + prefixo+il ou ila
A
A
CH
H2C
CH2
ciclopropil
A
CH2
H2C
CH
H2C
CH2
H2C
ciclobutil
CH
CH2 CH2
ciclopentil
Radical Benzil: não se enquadra em nenhum grupo. Possui um núcleo
aromático ligado a um carbono, no qual se localiza a valência livre.
A
H2C
11
Radiais Arila:derivam dos aromáticos e possuem uma única valência livre.
Estrutura do nome: prefixo + il ou ila.
Observação: o nome fenil deriva do feno (benzeno em alemão).
alf a
A
A
alf a
fenil
alf a
beta
beta
beta
beta
beta
beta
alf a
alf a
A
beta
beta
alf a
alfa-naftil
alf a
alf a
beta-naftil
CH3
CH3
A
A
CH3
A
orto-toluil ou o-toluil
meta-toluil ou m-toluil
para-toluil ou p-toluil
12
Introdução: Os alcanos, também chamados de hidrocarbonetos
parafínicos ou parafinas, são compostos constituídos exclusivamente por
carbono e hidrogênio e formam uma série homóloga (de mesma função
porém diferem pelo número de átomos de carbono da cadeia principal)
de fórmula geral Cn H2n + 2, cujo menor representante é o metano (CH4).
Alcanos são hidrocarbonetos de cadeia carbônica acíclica
(alinfática), saturada e homogênea.
H
H3C
CH3
butano
H3C
C
CH3
Isomeria de cadeia:
CH3
Número de isomeros ópticos = 2n, sendo
n = número de carbonos assimétricos
metil-propano
CH3
H3C
C*
Isomeria Óptica
Carbono Assimétrico
CH3
d-3-metil-hexano
l-3-metil-hexano
13
1C = met
06C = hex
2C = et
07C = hept
3C = prop
08C = oct
4C = but
09C = non
5C = pent
10C = dec
Nomenclatura:
11C = undec
1C Met
CH4
Ligação simples an
12C = dodec
Metano
Terminação: o
13C = tridec
14C = tetradec
15C = pentadec
16C = hexadec
2C Et
H3C - CH3
Ligação simples an
Terminação: o
Etano
17C = heptadec
18C = octadec
19C = nonadec
20C = eicos
21C = heneicos
14
Dicas:
Para os alcanos isômeros, os pontos de fusão e ebulição decrescem à
medida que a cadeia se ramifica.
H3C
CH3
H3C
H3C
CH3
n-pentano
CH3
CH3
H3C
CH3
PE = 36°C
metil-butano
dimetil-propano
PE = 28°C
PE = 9°C
Aumento da ramificação
Diminuição do PF e PE
15
Questão sobre alcanos:
(ITA-SP) A(s) Ligação(ções) carbono – hidrogênio existente(s) na molécula
de metano (CH4) pode(m) ser interpretada(s) como sendo formada(s) pela
interação frontal dos orbitais atômicos s do átomo de hidrogênio, com os
seguintes orbitais atômicos do átomo de carbono:
a) Quatro orbitais p
b) Quatro orbitais híbridos sp3
c) Um orbital híbrido sp3
d) Um orbital s e três orbitais p
e) Um orbital p e três orbitais sp2
16
Introdução: Os alcenos, também chamados hidrocarbonetos etilênicos
ou olefinas, são compostos constituídos exclusivamente por carbono e
hidrogênio e formam uma série homóloga de fórmula geral Cn H2n, cujo
primeiro membro é o eteno (C2H4)
Alcenos são hidrocarbonetos de cadeia carbônica acíclica
(alinfática), insaturada com uma única ligação e homogênea.
H3C
2-buteno
CH3
H3C
CH2
Isomeria de cadeia
H3C
H3C
Isomeria de posição
metil - propeno
H3C
H
H3C
H
CH2
1 - buteno
H3C
CH3
2 - buteno
Isomeria Geométrica
H3C
cis 2-buteno
H
H
CH3
trans 2-buteno
17
1C = met
6C = hex
2C = et
7C = hept
3C = prop
8C = oct
4C = but
9C = non
5C = pent
10C = dec
Nomenclatura:
2C et
H2C = CH2
Ligação dupla en
eteno
Terminação: o
3C prop
H2C = CH – CH2 Ligação dupla en
propeno
Terminação: o
18
Dicas:
Os carbonos da dupla ligação do eteno (C2H4) se ligam através de ligação
sp2 – sp2 e de ligação p – p.
pi
s
sp2
p
p
sp2
s
sp2
sp2
s
sp2
sp2
s
19
Questão sobre alcenos:
(Febasp) A fórmula molecular de um hidrocarboneto com a seguinte cadeia
carbônica: C – C = C = C – C é:
a) C5H8
b) C5H10
c) C5H6
d) C5H18
20
Introdução: Os alcinos, também chamados hidrocarbonetos etínicos ou
hidrocarbonetos acetilênicos, são compostos constituídos exclusivamente
de carbono e hidrogênio e formam uma séria homóloga de fórmula geral
Cn H2n – 2, cujo primeiro membro é o etino (C2H2).
Alcinos são hidrocarbonetos de cadeia carbônica acíclica
(alinfática), insaturada com uma única ligação e homogênea.
HC
CH3
1 - butino
H3C
CH3
Isomeria de posição
2 - butino
21
1C = met
6C = hex
2C = et
7C = hept
3C = prop
8C = oct
4C = but
9C = non
5C = pent
10C = dec
Nomenclatura:
_
H C = CH
2C et
Ligação tripla in
etino
Terminação: o
HC
_
= C – CH3
3C prop
Ligação tripla in
propino
Terminação: o
22
Introdução:Os hidrocarbonetos aromáticos, também chamados de
arenos, são compostos constituídos exclusivamente de carbono e
hidrogênio e que possuem pelo menos um anel benzênico. A Fórmula
geral dos hidrocarbonetos benzênicos é: Cn H2n - 6
CH3
CH3
CH3
Isomeria de posição
CH3
CH3
CH3
Isomeria óptica
H
C*
H3C
CH3
* Carbono assimétrico
H
d-sec-butil-benzeno
H
l-sec-butil-benzeno
Isomeria geométrica
CH3
H
cis
CH3
H
trans
23
Nomenclatura: Destacamos os nomes especiais dos radicais ligados
diretamente ao anel aromático.
CH3
R
1
orto
orto
6
2
H3C
para
5
1
meta
meta
6
2
5
3
4
3
4
CH3
CH3
1 , 2 - dimetil-benzeno
orto-dimetil-benzeno
CH 2
3-etil-1-metil-benzeno
meta-etil-metil-benzeno
24
CH3
O 2N
NO 2
Curiosidade
O composto 2,4,6-trinitro-tolueno é um
poderoso explosivo, mais conhecido como TNT.
NO 2
25
Questão sobre aromáticos:
(PUC - RS) As estruturas a seguir representam, na ordem, as fórmulas do
tolueno, fenol e ácido benzóico, utilizados, respectivamente, na produção
de explosivos, desinfetantes e aromatizantes:
OH
O
CH3
I
OH
II
III
Esses compostos possuem em comum:
a) O caráter ácido
b) Os pontos de fusão
c) O radical fenila
d) A massa molecular
e) A função química
26
Introdução: Os haletos orgânicos, também chamados derivados
halogenados, são compostos que derivam dos hidrocarbonetos pela
substituição de átomos de hidrogênio por igual número de átomos de
halogênio (F, Cl, Br, I).
Nomenclatura Oficial (IUPAC)
Nesta nomenclatura, o átomo de halogênio é considerado uma ramificação
Cl
H3C
CH 2
H3C
Cl
Cl
CH 2
CH 2
Cl
Cl
cloro-etano
1 , 2 - dicloro-propano
1 , 3 - dicloro-benzeno
27
Nomenclatura não oficial: Nesta nomenclatura, obedecemos ao seguinte
esquema:
Haleto de _______________________________________
nome do radical ligado ao átomo de halogênio
H3C
CH 2
CH 2
CH 2
Cl
H2 C
C
Br
I
cloreto de etila
H
brometo de benzila
iodeto de ciclopropila
28
BHC (Benzeno-Hexa-Clorado, 1,2,3,4,5,6-hexacloro-cicloexano )
Cl
Cl
Cl
Cl
Cl
Cl
BHC
O BHC é usado com um poderoso inseticida.
29
DDT (Dicloro-Difenil-Tricloro-etano)
Cl
Cl
Cl
C
C
Cl
H
Cl
DDT
O DDT é usado com um poderoso inseticida.
30
Questão sobre haletos:
(ITA - SP) Em relação a estrutura eletrônica do tetrafluoreto de carbono,
assinale a opção que contém a afirmativa errada:
a) Em torno do átomo de carbono tem-se um octeto de elétrons
b) Em torno de cada átomo de flúor, tem-se um octeto de elétrons
c) A molécula é apolar, embora contenha ligações polares entre átomos
d) A molécula contém um total de 5.8 = 40 elétrons
e) Os ângulos das ligações flúor-carbono-flúor são consistentes com
hibridização sp3 do carbono.
31
Introdução:Os álcoois são compostos orgânicos que apresentam o grupo
oxidrila ou hidroxila (- OH) ligado a átomo de carbono saturado.
Mas, o que ocorre se o grupo –OH não está ligado a átomo de carbono
saturado? Temos dois casos a considerar:
O grupo –OH se liga a carbono
de dupla ligação, neste caso, o
composto pertence à função
enol.
H3C
CH 2
O grupo –OH se liga a carbono
de núcleo benzênico, neste
caso, o composto pertence à
função de fenol.
CH2
OH
OH
2 - hidroxi - 1 - propeno
Fenol
32
Classificação dos álcoois:Os álcoois tem uma classificação quanto ao
número de hidroxilas.
Monoálcool ou monol: Apresenta uma oxidrila na molécula
Diálcool ou diol: apresenta duas oxidrilas na molécula
Triálcool ou triol: apresenta três oxidrilas molécula.
H3C
CH 2
H2 C
H3C
OH
HC
CH 2
HO
CH 2
CH 2
OH
OH
OH
OH
1 , 3 diidroxi-propano
1 , 2 - diidroxi-propano
1 , 1 - diidroxi-etano
Este diol tem as duas
oxidrilas ligadas ao mesmo
carbono. Ele recebe o
nome de diol gêmeo ou
gem-diol.
Este diol tem as duas
oxidrilas
ligadas
a
carbonos separados por
um outro carbono. Ele
recebe o nome de beta glicol
Este diol tem as duas
oxidrilas
ligadas
a
carbonos vizinhos. Ele
recebe o ome de diol
vicinal ou alfa - glicol.
33
Características Físicas:
Os álcoois se caracterizam por apresentarem
elevados pontos de ebulição; considerando os monoálcoois, verifica-se
que os primeiros membros são solúveis em água, e que a solubilidade
vai diminuindo com o aumento da cadeia.
H3C
CH 2
O ----------- H
O
H
|
|
|
CH 2
CH 2
CH3
CH3
-----------
H
O
Pontes de hidrogênio entre as moléculas do álcool etílico explicam o seu
elevado ponto de ebulição (PE = +78,5 0 C)
H3C
CH 2
O ----------H
|
|
|
H
O
-----------
H
H
O
-----------
CH 2
CH3
Pontes de hidrogênio entre moléculas de álcool etílico e de água
explicam a solubilidade total.
34
Como explicar a diminuição da solubilidade com o aumento da cadeia?
R
OH
Parte apolar
Parte polar
(insolúvel)
(solúvel)
A media que aumenta a cadeia, está aumentando a parte apolar, que é
insolúvel; desse modo, as suas propriedades prevalecem e, assim, a
solubilidade diminui.
35
Questão sobre álcoois:
(PUC-RS) O glicerol ou glicerina, é um composto encontrado em
cremes e sabonetes, porque esse composto:
H2C
OH
CH 2
CH2
OH
OH
a) É um triálcool alifático insaturado
b) Apresenta molécula apolar semelhante à da água
c) Interage com a água por pontes de hidrogênio
d) Apresenta átomo de carbono central assimétrico
e) Pertence à mesma função química da água.
Comentário: 500mL de água + 500mL de etanol não fazem juntos um
litro de solução.
36
Introdução:Os Fenóis são compostos orgânicos que apresentam o grupo
oxidrila (-OH) ligado diretamente a um carbono do núcleo benzênico.
Nomenclatura: A nomenclatura oficial (IUPAC) considera o grupo –OH
uma ramificação chamada hidroxi. Havendo necessidade de numeração,
esta deve iniciar pelo cabono que apresentar o grupo –OH.
OH
OH
1
6
2
5
3
OH
CH3
4
Hidroxi-benzeno
1 - hidroxi - 3 - metil-benzeno
beta - hidroxi-naftaleno
ou
orto-hidroxi-metil-benzeno
37
Os fenóis também apresentam nomes especiais que não obedecem a
nenhuma regra de nomenclatura.
OH
OH
HO
CH3
fenol
o-cresol
OH
catecol
OH
OH
alfa - naftol
beta - naftol
38
Dica: Aquecendo fenol com anidrido ftálico, na presença de ácido
sulfúrico, forma-se um composto chamado fenolftaleína, empregado em
laboratório como indicador ácido-base.
HO
O
H
OH
OH
C
O
+
C
H2SO4
C
+
O
H2O
O
H
OH
C
O
39
A fenolftaleína é usada como indicador ácido-base porque adquire cor
conforme o meio:
-O
HO
O
OH
C
C
O
O
C
meio ácido = incolor
C
O
O-
meio básico = rosa
40
Exercícios sobre Fenóis:
Desenhe a molécula das seguintes estruturas:
a)
3–etil–1–hidroxi-benzeno
b)
1-hidroxi-3,5-dimetil-benzeno
c)
1-hidroxi-2,4,6-trimetil-benzeno
OH
OH
OH
H3C
CH3
CH2
CH3
3-ethylphenol
H3C
CH3
CH3
3,5-dimethylphenol
2,4,6-trimethylphenol
41
Introdução: Os éteres são compostos orgânicos que apresentam átomo
de oxigênio ligado a dois radicais monovalentes, alquila ou arila.
Nomenclatura: A nomenclatura oficial da IUPAC propõem escrever o
nome do radical alcoxi com menor número de átomos de carbono,
seguido do nome do hidrocarboneto correspondente ao outro radical
ligado ao oxigênio.
Radical alcoxi: metoxi
H3C
H3C
O
CH3
O
metoxi-etano
CH2
CH3
hidrocarboneto correspondente: metano
42
Introdução:Os aldeídos são compostos orgânicos que apresentam o
grupo funcional( - CHO) denominado formila ou metanoíla.
Nomenclatura: Devemos considerar a cadeia principal a mais longa, que
contenha o grupo funcional. A numeração dos carbonos deve iniciar
sempre no carbono mais próximo ao grupo funcional do aldeído.
H3C
O
CH2
CH
C
H
H3C
3 - metil-butanal
43
Questão sobre aldeídos:
(UEL-PR) A oxidação do composto representado por R – COOH originou
ácido propanóico. Logo, o radical R é:
a) Etil
b) Metil
c) N-propil
d) Fenil
e) isobutil
44
Introdução:Cetonas são compostos orgânicos que apresentam o grupo
funcional carbonila entre carbonos.
Nomenclatura:Devemos considerar como cadeia principal a mais longa,
que contenha o grupo funcional, no caso, a carbonila. Começa-se a
numerar a cadeia pelo carbono mais extremo próximo ao grupo
carbonila.
O
H3 C
CH3
H3C
O
CH
C
C
CH 3
acetona
CH3
CH2
R
C
R
radical carbonila
O
3 - metil - 2 - pentanona
45
Introdução:Os ácidos carboxílicos são
apresentam o grupo funcional carboxila.
compostos
orgânicos
que
Nomenclatura:Devemos considerar como cadeia principal a mais longa,
que contenha o grupo funcional. Também devemos numerar a cadeia
começando pelo carbono do grupo funcional.
O
O
H3C
HC
HC
C
CH2
R
C
OH
OH
Radical Carboxila
CH3
CH3
ácido - 3 , 4 - dimetil-pentanóico
46
Questão sobre ácidos carboxílicos
(Unifor–CE) O composto
propriedades:
CH3COOH
tem,
em
solução
aquosa,
a) Ácidas e, portanto, reage com HCl
b) Ácidas e, portanto, reage com NaOH
c) Nem ácidas nem básicas e, por isso, se dissolvem em água.
d) Básicas e, portanto, reage com HCl
e) Básicas e, portanto, reage com NaOH
47
Derivados de ácidos carboxílicos.
O
R
C
H
O
O
R
O
R
R
O]sal orgânico
O
O
C
C
O
C
R
+
O
éster
C
R1
C
R
O
cloreto de ácido
C
Cl
anidrido
O
48
Introdução: As aminas são compostos orgânicos nitrogenados que
derivam, teoricamente, da molécula de gás amoníaco (NH3), através da
substituição de hidrogênios por radicais alquila ou arila.
Nomenclatura:A nomenclatura oficial propõem escrever para as aminas o
nome dos radicais ligados ao nitrogênio, seguido da palavra amina.
H2N
CH3
metilamina
H3C
N
CH2
N
CH3
CH3
CH3
H
etil-metilamina
dimetil-fenilamina
49
Introdução: As amidas são compostos orgânicos nitrogenados e
derivados da amônia (NH3) pela substituição de hidrogênio por radical
acila.
Nomenclatura: Para amidas primárias, trocamos a terminação “óico” do
ácido correspondente pela palavra “amida”.
O
H3C
O
C
H3C
C
OH
NH2
ácido etanóico
etanamida
Para amidas N-substituídas, escrevemos a letra N, seguida do nome dos
radicais, e completamos o nome da amida primária correspondente.
O
H3C
C
N
CH2
CH3
CH3
N-metil-N-etil-propanamida
50
Nitrilas
Isonitrilas
Derivado
do
cianeto
de
hidrogênio, HCN, pela substituição
do hidrogênio por uma cadeia
carbônica.
Derivado
do
isocianeto
de
hidrogênio, HNC, pela substituição
do hidrogênio por uma cadeia
carbônica.
R
R1
C
R1
C
N
R
C
R2
R2
N
C
Nomenclatura:
Nomenclatura:
Prefixo+infixo+o+nitrila
Prefixo+ il + carbilamina
H3C
C
N
IUPAC: etanonitrila
usual: cianeto de metila
H3C
N
C
IUPAC: metilcarbilamina
Usual: isocianeto de metila
Dica: a acrilonitrila (CH2=CH-CN), é o monômero para
a fabricação da lã sintética orlon.
51
Nitrocompostos
Possui o grupo -NO2 ligado a uma cadeia carbônica.
R
R1
C
NO 2
R2
Nomenclatura:
Nitro + prefixo + infixo + o
NO 2
nitrobenzeno
52
53
54
55
56
57
2. Ligações Químicas
Ligações Intermoleculares
Introdução
As moléculas de uma substância sólida ou líquida se mantêm unidas através da atração existente entre elas.
Quanto maior for a força de atração maior será a coesão entre as moléculas. Isso ocasionará um aumento
nos pontos de fusão e ebulição da substância. As moléculas dos gases praticamente não exercem forças de
atração entre si. Por isso os gases apresentam baixo ponto de ebulição e extrema facilidade de se expandir.
As forças intermoleculares são classificadas em dois tipos: Força de Van der Waals e Ligação de hidrogênio.
Força de Van de Waals
São divididas em vários tipos, conforme a natureza das partículas:
Íon - Dipolo permanente: Atração entre um íon e uma molécula polar (dipolo).
58
2. Ligações Químicas
Ligações Intermoleculares
Íon - Dipolo induzido: Atração entre um íon e uma molécula apolar. O íon causa uma atração ou repulsão
eletrônica com a nuvem eletrônica da molécula apolar, causando uma deformação da nuvem eletrônica na
molécula apolar e provocando a formação de dipolos (induzidos).
Dipolo permanente - Dipolo permanente: Atração entre moléculas polares. Os dipolos atraem-se pelos pólos
opostos (positivo-negativo).
Dipolo permanente - Dipolo induzido: Atração entre uma molécula polar e uma molécula apolar. O dipolo
causa repulsão eletrônica entre seu pólo positivo e a nuvem eletrônica da molécula apolar e uma repulsão
entre esta nuvem e seu pólo negativo. Isso causa uma deformação da nuvem eletrônica na molécula apolar,
provocando a formação de dipolos (induzidos).
59
2. Ligações Químicas
Ligações Intermoleculares
Dipolo induzido - Dipolo induzido: Também chamada Força de dispersão de London, é uma atração que
ocorre entre moléculas apolares, que quando se aproximam umas das outras, causam uma repulsão entre
suas nuvens eletrônicas, que então se deformam, induzindo a formação de dipolos. Essa força é mais fraca
que a do tipo dipolo permanente - dipolo permanente. Logo, as substâncias que apresentam esse tipo de
ligação apresentam menor ponto de fusão e ebulição. Quanto maior for o tamanho da molécula, mais
facilmente seus elétrons podem se deslocar pela estrutura. Maior é então, a facilidade de distorção das
nuvens eletrônicas, e mais forte são as forças de dispersão de London. Isso faz com que a substância tenha
maior ponto de ebulição.
60
2. Ligações Químicas
Ligações Intermoleculares
A ligação de hidrogênio
A ligação de hidrogênio, também conhecida como ponte de hidrogênio, é um enlace químico em que o átomo
de hidrogênio é atraído simultaneamente por átomos muito eletronegativos, atuando como uma ponte entre
eles. As ligações de hidrogênio podem existir no estado sólido e líquido e em soluções. É condição essencial
para a existência da ligação de hidrogênio a presença simultânea de um átomo de hidrogênio ácido e de um
receptor básico. Hidrogênio ácido é aquele ligado a um átomo mais eletronegativo do que ele, de maneira que
o seu elétrons sofra um afastamento parcial. Receptor básico é uma espécie química que possua um átomo
ou grupo de átomos com alta densidade eletrônica, sendo que o ideal é a presença de pelo menos um par de
elétrons livres. A ligação de hidrogênio pode ser de dois tipos:
intramolecular - Nesse caso a configuração espacial da molécula é favorável à formação da ligação entre um
grupo doador e um receptor de prótons dentro da própria molécula.
Intermolecular - Envolve o grupo doador de prótons de uma molécula e o grupo receptor de prótons de outra
molécula.
61
Propriedades Físicas e Químicas dos Compostos Orgânicos
62
63
64
65
Introdução: Vamos recordar a obtenção da uréia através
aquecimento do cianato de amônio, realizada em 1828, por Wöhler:
do
NH2
NH 4OCN
cianato de amônio
Aquecimento
O
C
uréia
NH2
Note que a fórmula molecular do cianeto de amônio e da uréia é
CH4N2O.
Então, podem existir substâncias diferentes com a mesma fórmula
molecular? Para designar este fenômeno, o cientista Berzelius, maior
autoridade científica da época, criou o termo isomeria (iso = igual;
mero = número)
66
Esquema de Análise
As fórmulas moleculares
de duas substãncias
(deferentes)
são iguais?
SIM
São isômeros
NÃO
Não são isomeros
A diferença
entre essas substâncias
pode ser precebida na
formula estrutural plana?
SIM
São Isômeros
Planos
NÃO
São isômeros
espaciais
67
Isomeria de Cadeia ou também isomeria de núcleo, é o fenômeno de
ocorrência de dois ou mais compostos de mesma fórmula molecular,
pertencentes à mesma função e que diferem do tipo de cadeia
carbônica.
H3C
H3C
CH
CH2
CH2
CH3
CH3
butano
função: hidrocarboneto
cadeia: aberta e normal
fórmula molecular: C 4H10
H3C
metil-propano
função: hidrocarboneto
cadeia: aberta e ramificada
fórmula molecular: C 4H10
68
Isomeria de posição é o fenômeno de ocorrência de dois ou mais
compostos de mesma fórmula molecular, pertencentes à mesma função
e que diferem na posição de um grupo de átomos ou na posição de uma
insaturação (dupla ou tripla ligação).
H3C
H3C
CH2
CH3
CH2
CH
OH
OH
1 - propanol
função: álcool
cadeia: aberta saturada e normal
fórmula molecular: C 3H8O
2 - propanol
função: álcool
cadeia: aberta saturada e normal
fórmula molecular: C 3H8O
69
Isomeria de função ou isomeria funcional, é o fenômeno de ocorrência
de dois ou mais compostos de mesma fórmula molecular que pertencem
a funções diferentes.
O
O
C
H3C
CH2
H
propanal
função: aldeído
cadeia: aberta saturada e normal
fórmula molecular: C 3H6O
H3C
C
CH3
propanona
função: cetona
cadeia: aberta saturada e normal
fórmula molecular: C 3H6O
70
Metameria ou isomeria de compensação
CH2
H3C
O
CH3
CH2
metoxi-propano
função: éter
cadeia: aberta e heterogênea
fórmula molecular: C 4H10O
O
H3C
CH2
CH3
CH2
etoxi-etano
função: éter
cadeia: aberta e heterogênea
fórmula molecular: C 4H10O
A diferença entre os compostos está na posição do heteroátomo
oxigênio; então, o metoxi-propano e o etoxi-etano são isômeros de
posição. Esta isomeria tem nome diferenciado pois a diferença está no
heteroátomo da cadeia.
71
Tautomeria
H
H
C
O
H
O
C
C
H
H
aldeído (C 2H4O)
H
C
H
H
enol (C 2H4O)
Dissolvendo etanal em água, verificamos que parte desse aldeído se
converte em enol, através da migração de um átomo de hidrogênio na
molécula, estabelecendo um equilíbrio dinâmico entre aldeído e enol,
chamado equilíbrio aldo-enólico.
Esses isômeros de função, que coexistem em equilíbrio numa solução,
transformando-se um no outro através de rearranjo molecular, recebem
o nome de tautômeros. Este tipo de isomeria não ocorre apenas com
aldeídos, mas também com outros compostos (equilíbrio ceto-enólico
por exemplo).
72
Exercício:
01) Construa a fórmula estrutural e verifique o tipo de isomeria que
ocorre entre os compostos abaixo:
a)
2- buteno e ciclobutano
b)
2-metil-pentano e 3-metil-pentano
c)
Butanal e butanona
73
Isomeria Geométrica: Consideremos que esses átomos podem dispor-se
no espaço de duas maneiras diferentes, sem, no entanto mudar as
ligações entre eles. Ocorrem isômeros geométricos quando a fórmula
estrutural plana apresenta dois carbonos ligados por dupla ligação e
quando, para cada um desses carbonos, aparecem dois ligantes
diferentes entre sim, ou então quando a cadeia carbônica é cíclica e em
pelo menos dois carbonos do ciclo aparecem, para cada um deles, dois
ligantes diferentes entre si.
H
C
Cl
C
C
H
H
trans - 1, 2-dicloro-eteno
Cl
Cl
Cl
C
H
cis - 1 , 2-dicloro-eteno
isomeros geométricos
Usa-se “trans” para os radicais em planos de simetria diferentes e “cis”
para radicais em planos de simetria iguais.
74
Isomeria E e Z: A representação cis e trans pode causar ambigüidade se
for aplicada a alcenos cujos átomos de carbono da dupla possuam em
conjunto mais que dois ligantes diferentes. As letras vem do alemão,
“E” vem de entgegen que significa opostos e a letra “Z” vem de
zusammen que significa juntos.
No sistema E-Z, examinamos os dois grupos ligados a cada átomo de
carbono da dupla ligação e o colocamos em ordem de prioridade.
Terá maior prioridade o ligante cujo átomo imediatamente ligado ao
carbono da dupla tiver maior número atômico.
75
Exemplo: consideramos o alceno 3-metil-3-hepteno
H3C
CH2
CH2
CH2
C
x
CH3
C
y
H
CH3
No carbono x o ligante de maior prioridade é o n-propil, pois o carbono
tem número atômico maior que o átomo de hidrogênio.
No carbono y o ligante de maior prioridade é o etil, pois o carbono desse
radical está ligado a outro carbono, já o radical metil está ligado a um
hidrogênio.
Então, o nome do composto é: Z-3-metil-3-hepteno. A configuração do
E-3-metil-3-hepteno está abaixo:
H
CH2
C
x
H3C
CH2
CH2
CH3
C
y
CH3
76
Isomeria Óptica: Esse tipo de isomeria só ocorre com moléculas
assimétricas, isto é, moléculas que nunca conseguimos dividir de modo
que os dois lados resultantes dessa divisão sejam iguais. A diferença
fundamental entre os isômeros ópticos está na capacidade de desviar o
plano de vibração de uma luz polarizada para a direita (sentido horário)
ou para a esquerda (sentido anti-horário).
Carbono Assimétrico: Um modo de verificarmos se a molécula de
determinado composto orgânico é assimétrica e, portanto, se possui
atividade óptica é observar se essa molécula possui átomo de carbono
assimétrico.
Átomo de carbono assimétrico é aquele que sofre hibridização sp3 e
possui todos os 4 ligantes diferentes entre si.
b
a
*C
c
d
C* = carbono assimétrico
a=b=c =d
77
A luz polarizada
Uma lâmpada incandescente emite uma luz que é constituída de
ondas eletromagnéticas, que se propagam com vibrações em infinitos
planos, formando, teoricamente, um movimento espiralado. Esse movimento
é resultado da composição das diversas vibrações em vários planos. Se
"filtrarmos" essas vibrações de modo que se tenha vibração em apenas um
plano, teremos a chamada luz polarizada. Veja o esquema abaixo:
78
Os dispositivos capazes de "filtrar" os planos de propagação da luz
são denominados polarizadores. Existem muitas maneiras de polarizar a luz,
uma delas é utilizar o prisma de Nicol - um cristal transparente de CaCO3
denominado espato da Islândia, que possui a propriedade de produzir a dupla
refração da luz. Para cada raio incidente saem dois raios refratados. Esses
dois raios refratados são polarizados, porém, em planos diferentes. Para obter
a luz em um único plano de vibração é preciso eliminar um desses raios. Para
isso o prisma é cortado segundo um plano diagonal e em seguida as partes
cortadas são coladas com uma resina transparente denominada bálsamo do
Canadá.
79
Exemplo: Carbono assimétrico no 3-metil-hexano
CH3
H3C
CH2
*C
CH2
CH2
CH3
H
* carbono assimétrico
etil = metil = n-propil = hidrogênio
A relação do número de carbonos assimétricos com o número de
isômeros opticamente ativos se dá pela regra de van’t Hoff.
Número de carbonos ópticos ativos = 2n
Sendo n=número de carbonos assimétricos na molécula
80
Exercícios:
(Fuvest-SP) A substância com a fórmula abaixo é:
O
C
H2C
O
C
C
CH3
H
H
CH2
CH2
CH3
a) Um éter cíclico, cuja molécula tem dois carbonos assimétricos
b) Uma cetona cíclica, cuja molécula tem um carbono assimétrico
c) Uma cetona cíclica, cuja molécula tem dois carbonos assimétricos
d) Um éster cíclico, cuja molécula tem um carbono assimétrico
e) Um éster cíclico, cuja molécula tem dois carbonos assimétricos
81