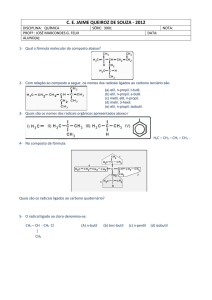
Propriedades físicas
e químicas dos
compostos
orgânicos
SOLUBILIDADE
Semelhante dissolve
semelhante
Polaridade de substâncias orgânicas
POLAR
CH4
APOLAR
Influência das Cadeias Carbônicas
Álcool
Fórmula
Solubilidade
(g/100g de H2O)
Etanol
CH3CH2OH
Infinita
1-propanol
CH3CH2CH2OH
Infinita
1-butanol
CH3CH2CH2CH2OH
7,9
1-pentanol
CH3CH2CH2CH2CH2OH
2,3
1-octanol
CH3CH2CH2CH2CH2CH2CH2CH2OH
0,05
H3C – CH2 – CH2 – CH2 – CH2 – OH
Parte Apolar
Parte
Polar
Quando maior a cadeia carbônica, menor será a solubilidade.
Ácido carboxílico
Solubilidade (g/100g
de H2O)
Ácido acético
Infinita
Ácido pentanóico
3,7
Ácido hexanóico
1,0
Ácido heptanóico
0,79
Temperatura de fusão e ebulição
Van der Waals (dipolo induzido) (APOLAR)
Dipolo-dipolo (permanente) (POLAR)
Ligação de Hidrogênio (POLAR)
Temperatura de ebulição –
Forças Intermoleculares
Substância
Fórmula
Massa
molar
Temperatura de
Ebulição (ºC)
Propano
CH3CH2CH3
44
- 45ºC
Metoximetano
CH3 – O – CH3
46
- 25ºC
Etanal
CH3CHO
44
+ 20ºC
Etanol
CH3CH2OH
46
+ 78ºC
T.F. e T.E. de Hidrocarbonetos
Proporcional ao tamanho da cadeia.
MAIOR CADEIA = MAIOR T.E.
◦ Área de contato maior, entre as moléculas!
Para hidrocarbonetos ramificados:
MAIOR NÚMERO DE RAMIFICAÇÕES
= MENOR T.E.
◦ Área de contato menor, entre as moléculas!
Solubilidade
Semelhante dissolve semelhante!
POLAR, dissolve POLAR
APOLAR, dissolve APOLAR
CH3 – CH2 –––––––––––––––– OH
Apolar
(etanol)
Polar
CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3
(Octano)
Apolar
Usando um álcool de maior cadeia
carbônica
Aumenta a solubilidade em compostos
apolares.
Hexan-1-ol
OH
octano
Vitaminas e Solubilidade
Vitamina C – Hidrossolúvel
Vitamina A e E – Lipossolúveis