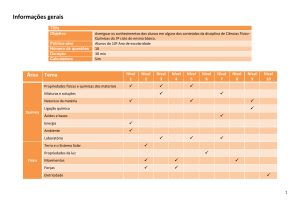
CIÊNCIAS
Ensino Fundamental, 9º Ano
Descrição dos tipos de funções
químicas, suas propriedades e seus
efeitos químicos e biológicos
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
Antigamente acreditava-se que:
- Substâncias orgânicas = eram aquelas que se originavam de
organismos vivos (vegetal e animal)
- Substâncias inorgânicas = seriam as de origem mineral
No entanto, verificou-se que isso não era correto, pois grande parte
das substâncias orgânicas podem sim ser sintetizada em laboratório.
Hoje em dia, esses grupos são conceituados da seguinte forma:
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
É possível classificar uma substância dentro de suas funções a partir
da análise dos tipos de íons que se formam quando esta é dissolvida em
água.
Essas substâncias também são chamadas de funções inorgânicas,
que se caracterizam por compostos que não possuem cadeia carbônica.
As SUBSTÂNCIAS INORGÂNICAS são classificadas de acordo
com características e comportamento químico semelhantes.
http://www.mundoeducacao.com/upload/conteudo_legenda/cf0360b1ba7
09b0f3d57e62492c784a9.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
TEORIA DA DISSOCIAÇÃO IÔNICA
SVANTE ARRHENIUS
Em 1884, realizou vários experimentos para explicar a condutividade
de algumas soluções.
A condutividade elétrica das soluções dependia da existência de
íons, que eram os responsáveis por transportar a carga.
soluções iônicas transportavam corrente elétrica porque os seus íons,
que antes estavam em um aglomerado iônico, eram separados quando
colocados em água.
DISSOCIAÇÃO IÔNICA
IONIZAÇÃO
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
CLASSIFICAÇÃO DAS FUNÇÕES INORGÂNICAS
ARRHENIUS
ÁCIDOS
BASES
SAIS
ÓXIDOS
Envolve:
Acidez
Basicidade
Solubilidade em água
Reatividade
Condutibilidade elétrica
http://www.estudopratico.com.br/wp-content/uploads/2014/08/funcoes-quimicas.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
ÁCIDOS
Compostos moleculares que se dissociam em íons em solução aquosa
Possuem hidrogênio que é liberado como cátion quando dissolvidos
Possui elemento químico H+, do lado esquerdo, ligado a ametais. Ex: HCl, HCN,
HCO3
Boa condução da eletricidade em solução aquosa
Sabor azedo, como o do limão, por exemplo
Os elementos que formam ácidos se formam por ligações covalentes e ganham
elétrons
No geral, são tóxicos e corrosivos
Mudam a cor de certas substâncias (indicadores ácido-base, que são
substâncias orgânicas)
Reagem com base formando sal e água → NEUTRALIZAÇÃO
HCl + NaOH → NaCl + H2O
Liberam hidrogênio quando reagem com metais
2 HCl + Zn→ ZnCl2 + H2(g)
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
PROCESSO DE IONIZAÇÃO
Formação de íons
Quando um ácido entra em contato com a água, ele se ioniza e libera H+
Exemplos:
HCl + H2O → H+ + ClHF + H2O → H+ + FH2SO4 → H+ + SO42 CLASSIFICAÇÃO DOS ÁCIDOS
PRESENÇA DE OXIGÊNIO
- ácidos sem oxigênio – HIDRÁCIDOS
Ex: HCl, HBr, HF
- ácidos com oxigênio – OXIÁCIDOS
Ex: H2SO4, HNO3, H3BO3
https://upload.wikimedia.org/wikipedia/commons/9/9b/Sal
petersaeure.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
NÚMERO DE H+ IONIZÁVEIS
•
MONOÁCIDO – produz 1 H+
Ex: HCl, HNO3
• DIÁCIDO – produz 2 H+
Ex : H2SO4,H2CO3
• TRIÁCIDO – produz 3 H+
Ex: H3PO4, H3BO3
• TETRÁCIDOS – produz 4H+
Ex: H4SiO4
FORÇA ÁCIDA
• HIDRÁCIDOS:
- Fortes: HI, HCl, HBr
- Moderado: HF
- Fraco: demais hidrácidos
• OXIÁCIDOS:
Sendo a fórmula genérica: HaEOb:
- H = hidrogênio
- E = elemento químico
- O = oxigênio
a = nº de H
/
b = Nº de O
Se b - a:
3 ou 2 = forte 1 = moderado 0 = fraco
Exemplos:
HNO3 → 3-1=2 → ác. forte
H3PO4 → 4-3=1 → ác. moderado
H3BO3 → 3-3=0 → ác. fraco
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
NOMENCLATURA
• HIDRÁCIDOS
Ácido + nome do elemento + ídrico
Exemplos:
HCl – ácido clorídrico
H2S – ácido sulfídrico
• OXIÁCIDOS
Ácido + nome do elemento + oso/ico
Exemplos:
H2SO4 – ácido sulfúrico
HNO3 – ácido nítrico
H3PO4 – ácido fosfórico
HClO3 – ácido clórico
H2CO3 – ácido carbônico
OSO= diminuir nº de O
HIPO___OSO= diminuir 2 nº de O
PER____ICO= aumentar nº de O
Exemplos:
H2SO5 – ácido persulfúrico
H2SO4 – ácido sulfúrico
H2SO3 – ácido sulfuroso
H2SO2 – ácido hiposulfuroso
Então:
Ácido per+elemento+ico
Ácido+elemento+ico
Ácido +elemento+oso
Ácido+hipo+elemento+oso
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
FUNÇÃO E APLICAÇÃO DOS ÁCIDOS
Ac. desoxirribonucleico - DNA= forma o material genético dos seres vivos.
Ac. Acetilsalisílico (AAS) - C9H8O4= utilizado como anti-inflamatório, analgésico,
e inibidor da agregação das plaquetas sanguíneas.
Ac nítrico - HNO3= utilizado como matéria prima na fabricação de explosivos e
na fabricação de plásticos; utilizado na produção de fertilizantes e de compostos
orgânicos; um dos ácidos responsáveis pela chuva ácida; altamente corrosivo e
seus vapores são muito tóxicos.
Ac. Carbônico – HCO3= esta presente na água com gás e refrigerante
gaseificado.
Ac. Acético - C2H4O2= presente no vinagre; conhecido desde a antiguidade,
quando era obtido a partir do vinho azedo; usado na produção de aspirina;
usado para tingir tecidos, preservar madeiras e dissolver gomas.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
Ac. Clorídrico – HCl= presente no estômago para participar da digestão;
vendido comercialmente como ácido muriático; usado para remover o excesso
de cimento em pisos e azulejos; usado para limpar superfície metálicas antes de
uma soldagem; é corrosivo. O ácido muriático é o ácido clorídrico impuro.
Ac. Cítrico – C6H8O7= presente nas frutas cítricas; importante na prevenção do
escorbuto.
Ac. Cianídrico – HCN= utilizado em industrias como plásticos, acrílicos e
corantes.
Ac. Sulfúrico – H2SO4= usado na bateria de automóveis; produção de
fertilizantes agrícolas para produção de adubos; produção de papéis, tintas,
plásticos; um dos ácidos responsável pela chuva ácida; é muito corrosivo.
Ácido fluorídrico (HF) – é utilizado para a produção de alumínio, corrosão de
vidros (em automóveis), decoração em objetos de vidro. É altamente corrosivo
para a pele.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
BASES
Compostos iônicos que se dissociam em íons em solução aquosa
Possuem hidroxila (OH)- que é liberado como ânion quando dissolvidos
As substâncias que apresentam o grupo (OH)-, do lado direito, ligado a metais.
Ex: NaOH, Ca(OH)2, Mg(OH)2,
Boa condução da eletricidade em solução aquosa
mudam a cor de certas substâncias, os chamados indicadores ácido-base
Coloração avermelhada com a fenolftaleína incolor
Sabores adstringentes (sabor igual ao da banana verde que parece que
“prende” a língua)
Reagem com os ácidos e produzem sal e água → NEUTRALIZAÇÃO
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
PROCESSO DE DISSOCIAÇÃO
separação dos íons que já existem
Quando uma base entra em contato com água, ela se dissocia e libera
OH-.
Exemplos:
NaOH + H2O ↔ Na+ + OHMg(OH)2 + H2O ↔ Mg2+ + 2OHAl(OH)3 + H2O ↔ Al3+ + 3OH CLASSIFICAÇÃO DAS BASES
NÚMERO DE OH- DISSOCIADAS:
• Tribase - possui três OH• Monobase - possui uma OHEx: Al(OH)3, Fe(OH)3
Ex: NaOH, NH4OH
• Dibase - possui dois OHEx: Mg(OH)2, Fe(OH)2
• Tetrabase - possui quatro OHEx: Pb(OH)4, Sn(OH)4
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
FORÇA BÁSICA / GRAU DE DISSOCIAÇÃO:
• Base Forte – tem grau de dissociação de quase 100%
Bases dos metais alcalinos e alcalinos terrosos
Ex: NaOH, KOH, Ca(OH)2
Exceção: Mg(OH)2 que é uma base fraca
• Base Fraca – tem grau de dissociação inferior a 5%.
Demais bases, incluindo o Mg(OH)2 e NH4OH
SOLUBILIDADE EM ÁGUA:
• Solúveis: bases dos metais alcalinos e o NH4OH http://www.mundoeducacao.com/upload/conteudo/ali
mentos-alcalinos.jpg
Ex: KOH, NaOH, LiOH, NH4OH
• Pouco solúveis: bases dos metais alcalinos terrosos
Ex: Ba(OH)2, Ca(OH)2, Mg(OH)2
• Insolúveis: demais bases
Ex: Fe(OH)2, Al(OH)3, Sn(OH)2
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
NOMENCLATURA
ELEMENTOS COM UM NOX / FIXO:
→ Hidróxido de + nome do elemento
Exemplos:
NaOH (nox 1+) – hidróxido de sódio
Mg(OH)2 (nox 2+) – hidróxido de magnésio
Ca(OH)2 (nox 2+) – hidróxido de cálcio
ELEMENTOS COM MAIS DE UM NOX / VARIÁVEL:
→ Hidróxido de + nome do elemento + OSO / ICO
Ou ainda:
→ Hidróxido de + nome do elemento + número do NOX em romano
Exemplos:
Fe(OH)2 – hidróxido ferroso ou hidróxido de ferro II → NOX menor
Fe(OH)3 – hidróxido férrico ou hidróxido de ferro III → NOX maior
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
FUNÇÃO E APLICAÇÃO DAS BASES
Hidróxido de magnésio - (Mg(OH)2)= presente no leite de magnésia utilizado
para combater a acidez estomacal;
Cal hidratada - (Ca(OH)2)= usada como argamassa na construção civil e
pinturas;
Hidróxido de sódio - (NaOH)= soda cáustica - utilizado para a limpeza de
materiais, no desentupimento de canos e largamente empregado na indústria; é
tóxico e corrosivo; É muito usado na indústria química para preparar sabão e
outros compostos orgânicos.
Hidróxido de amônio - (NH4OH)= componente de vários produtos de limpeza,
saponificação de gorduras; vendidos no comércio; é tóxico e irritante aos olhos.
http://www.soq.com.br/conteudos/ef/fun
caoquimica/index_clip_image002.jpg
http://www.soq.com.br/conteudos/ef
/funcaoquimica/index_clip_image00
4.jpg
http://www.soq.com.br/conteudos/ef/f
uncaoquimica/index_clip_image006.j
pg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
INDICADORES ÁCIDO-BASE E O Ph
Há um grupo de substâncias que
assume diferentes colorações em função
de o meio em que se encontram ser ácido
ou básico.
indicadores ácido-base
Há uma escala numérica, com valores
entre 0 e 14, que indica se o meio á ácido,
básico ou neutro.
http://blogdoenem.com.br/wp-content/uploads//sites/2/2014/06/escala-ph.jpg
POTENCIAL HIDROGENIÔNICO
INDICADOR
ÁCIDO
BASE
NEUTRO
FENOLFTALEÍNA
INCOLOR
ROSA
INCOLOR
TORNASSOL
ROSA
AZUL
-
https://lh3.googleusercontent.com/HRApIEDJMUoFNCwLssrDAgvkRAUyFGSVzuBBMOsa9Cbpj2wQCoM5TomTGsNovOYgb2Mfw=s170
http://www.fbqf.unt.edu.ar/institutos/quimicaanalitica/Instituto/objetos/imagen06.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
ÓXIDOS
Compostos que são formados por dois elementos químicos diferentes, que
podem ser também chamados de compostos binários
Os óxidos se formam pela combinação do oxigênio com quase todos os
elementos da tabela periódica, tendo apenas como padrão a presença do
oxigênio, com exceção o Flúor
ligação entre o oxigênio e outro elemento pode ser iônica ou covalente
http://st-listas.20minutos.es/images/2012-09/342746/3707206_640px.jpg?1347569649
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
CLASSIFICAÇÃO
ÓXIDOS BÁSICOS → reagem com água para formar bases ou reagem
com ácidos formando sal e água.
Exemplos:
Na2O + H2O → 2NaOH
2Na2O + 2HCl → 2NaCl + H2O
- São sólidos iônicos. Metais alcalinos e alcalinos terrosos reagem com
a água. Estes metais tem NOX 1+, 2+ e 3+
ÓXIDOS ÁCIDOS → reagem com água para formar ácido ou reagem
com base formando sal e água.
Exemplos:
SO3 + H2O → H2SO4
SO3 + 2 NaOH → Na2SO4 + H2O
- São moleculares. São formados por oxigênio e não-metais ou metais
com NOX elevado.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
ÓXIDOS ANFÓTEROS → comportam-se como óxidos básicos e
também como óxidos ácidos. Só reagem com ácido forte ou base forte.
Exemplos:
ZnO + HCl → ZnCl2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
- São, em geral, sólidos iônicos, insolúveis em água.
- Podem ser formados por: Zn, Pb, Sn, As, Sb.
ÓXIDOS NEUTROS → não reagem com água, nem com ácido e nem
com base.
Exemplos: CO, N2O, NO.
- São gases e moleculares, formados por não-metais.
PERÓXIDOS → reagem com água ou com ácido diluído formando
água oxigenada (H2O2).
Exemplos:
Na2O2 + 2H2O → 2NaOH + H2O2
Na2O2 – peróxido de sódio
Na2O2 + H2SO4 → Na2SO4 + H2O2
H2O2 – peróxido de hidrogênio
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
NOMENCLATURA DOS ÓXIDOS
Nomeamos os óxidos de acordo com os grupos de divisão:
ÓXIDOS MOLECULARES - Ácidos:
Antes da palavra óxido e do nome do elemento, colocamos os
prefixos mono, di, tri, tetra, penta, etc.
Ex: CO2 - dióxido de carbono
SO3 - trióxido de enxofre
ÓXIDOS IÔNICOS - Metais alcalino e alcalinos terrosos:
Escrevemos a palavra óxido seguida da preposição de e do nome do
elemento associado ao oxigênio.
Ex: CaO - óxido de cálcio
- Caso o elemento, metal, forme dois cátions diferentes, a distinção é
feita da mesma forma que para as bases e para os sais:
Ex: FeO - óxido de ferro II ou óxido ferroso
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
FUNÇÃO E APLICAÇÃO DOS ÓXIDOS
Peróxidos= na indústria são usados como clarificadores (alvejantes) de
tecidos, poupa de celulose, etc.
- Peróxido de hidrogênio - H2O2= popularmente conhecida como água
oxigenada, é usada como anti-séptico e algumas pessoas a utilizam para a
descoloração de pêlos e cabelos;
Dióxido de silício – SiO2= é o óxido mais abundante da crosta terrestre, ele é
um dos componentes dos cristais, das rochas e da areia;
Óxido de Cálcio – CaO= cal viva/cal virgem - obtido a partir da decomposição
do calcário, é usado na agricultura para diminuir a acidez do solo e também na
preparação de argamassa na construção civil;
Óxido Nitroso - N2O= Conhecido como gás hilariante, esse óxido inalado em
pequena quantidade provoca euforia, mas pode causar sérios problemas de
saúde; é utilizado como anestésico;
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
Dióxido de Enxofre - SO2= É usado para a obtenção de ácido sulfúrico e no
branqueamento de óleos alimentícios, entre outras aplicações.
Monóxido de Carbono - CO= Usado para obter certos produtos químicos e na
metalurgia do aço.
Água - H2O= presente em quase tudo em nosso planeta;
Gás carbônico - CO2= utilizado, por exemplo, pelos seres produtores das
cadeias alimentares, no processo da fotossíntese; encontrado nos refrigerantes
e na água mineral gaseificados.
Óxido de zinco - ZnO= é um pó branco (alvaiade) usado em pinturas do rosto de
palhaços. Usado também como protetor solar.
http://www.soq.com.br/conte
udos/ef/funcaoquimica/index
_clip_image014.jpg
http://www.mercored.com/up
load/photos/1/1389-7.jpg
https://lh3.googleuserconten
t.com/WNUVSU7fSVDgj3zH
xSuLv26GALCkeW5Xvd2a4
m0sjDCcU_jRxpw8N5q1HXt
f-SVdRhDGAQ=s127/
https://lh3.googleuserconten
t.com/_UQZjOTHXsDiBRoL
R9tUVIuIbXgoBwBoFHjGGv
rrY3Eoe8dWxCu9gcba9zXWSsJDZie=s85
https://yt3.ggpht.com/loiSESDa_Hw/AAAAAAAAA
AI/AAAAAAAAAAA/qFrh9qB
_H10/s900-c-k-no/photo.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
SAIS
Compostos iônicos que apresentam, ao menos, um cátion diferente de H+
e, no mínimo, um ânion diferente de (OH) Encontrados na natureza no estado sólido geralmente sob a forma de minerais,
ou dissolvidos, como no caso do cloreto de sódio ou sal de cozinha (NaCl)
Muitos sais apresentam sabor salgado
Alguns apresentam alta solubilidade em água, e outros apresentam valores de
solubilidade tão pequenos que não considerados insolúveis, como é o caso do
carbonato de cálcio (CaCO3), um constituinte do mármore
Conduzem eletricidade quando estão na fase líquida (fundidos) ou em solução
aquosa, porque nestes casos há elétrons livres
Geralmente são sólidos à temperatura e pressão ambiente (25°C e 1atm)
Podem ser obtidos da reunião entre ácidos e bases.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
DISSOCIAÇÃO DOS SAIS
Quando um sal se dissolve em água, ele sofre uma dissociação
semelhante à que ocorre com as bases, visto que também é um composto
iônico e, nessas dissociação, são liberados íons.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
SAL NEUTRO OU NORMAL → Com apenas um cátion e um ânion, ele é
resultado de uma reação entre uma base e um ácido fortes ou entre uma base e
um ácido fracos.
Exemplos:
NaCl: cátion → Na+ (vem do hidróxido de sódio, NaOH, uma base forte)
ânion → Cl- (vem do ácido clorídrico, HCl, um ácido forte)
Na2SO4: cátion → Na+ (vem do hidróxido de sódio, NaOH, uma base forte)
ânion → SO42- (vem do ácido sulfúrico, H2SO4, um ácido forte)
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
SAL BÁSICO OU HIDROXISSAL → formado a partir de uma base forte e um
ácido fraco, de modo que, em meio aquoso, forma íons hidroxila (OH–)
Exemplo:
NaOOCCH3:
Cátion → Na+ (vem do hidróxido de sódio, NaOH, uma base forte)
Ânion → CH3COO– (vem do ácido etanóico, CH3COOH, H2CO3, um ácido
fraco).
No exemplo acima, o ânion acetato (CH3COO–) hidrolisa-se em meio aquoso e
forma o ácido acético e íons hidroxila (OH–), o que torna a solução básica
SAL MISTO OU DUPLO → Possui dois tipos de cátions e dois tipos de ânions
diferentes do H+ e do OH-. Eles são provenientes de uma reação de
neutralização parcial.
Exemplos:
KNaSO4: cátions → K+ e Na+; ânion → SO42CaClBr: cátion → Ca+; ânions → Cl- e Br Ca(NO3)Br: cátion → Ca+; ânions → NO3- e Br -
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
SAL HIDRATADO → São aqueles que apresentam moléculas de água em sua
estrutura cristalina sólida. Isso porque alguns sais são higroscópicos, ou seja,
possuem a capacidade de absorver facilmente a água do ambiente.
Exemplo: CuSO4 . 5 H2O
ALÚMEN → São sais formados por dois cátions — um monovalente (com
carga +1) e outro trivalente (com carga +3) — um único ânion (o sulfato (SO42-))
e água de cristalização.
Exemplo: KAl(SO4)2 . 12 H2O
http://www.mundoeducacao.com/upload/conteudo_legenda/0b7732edd13b690d228de02517a3d6a4.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
NOMENCLATURA
SAIS NEUTROS:
Nome do ânion + de + nome do cátion
Exemplos:
NaCl = (Cl- - cloreto) + de + (Na+ - sódio) = cloreto de sódio
Na2SO4= (SO42- - sulfato) + de + (Na+ - sódio) = sulfato de sódio
Quando o cátion pode adquirir mais de uma valência:
- menor valência= números romanos ou acrescentar o sufixo “oso”
- maior valência= sufixo “ico”
Exemplos:
FeSO4= sulfato de ferro II (ou sulfato ferroso)
Fe2(SO4)3 = sulfato de ferro III (ou sulfato férrico)
SAIS DUPLOS:
A única diferença é o acréscimo no final do nome dos dois cátions em vez de só um. No
caso dos sais duplos que possuem dois ânions, coloca-se o nome dos dois no início.
Exemplos:
KNaSO4 = sulfato de sódio e potássio
CaClBr = cloreto brometo de cálcio
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
HIDROGENOSSAIS - há hidrogênios na fórmula:
Prefixo que indica + hidrogeno + nome do ânion + de + nome do cátion
o nº de H
Exemplos:
NaHCO3 = monohidrogenocarbonato de sódio ou hidrogenocarbonato de sódio
(seu nome no cotidiano é bicarbonato de sódio)
- O prefixo mono opcional
KH2PO4 = di-hidrogenofosfato de potássio
HIDROXISSAIS - há OH na fórmula:
Prefixo que indica + hidroxi + nome do ânion + de + nome do cátion
o nº de OH
Ex: BaOHCl = monohidroxicloreto de bário
Cu2(OH)2SO4 = di-hidroxisulfato de cobre II
SAL HIDRATADO:
Nome do sal
+
segundo as regras
anteriores
Prefixo que indica
a quantidade de
moléculas de água
Exemplos:
CuSO4 . 5 H2O = sulfato de cobre II penta-hidratado
CaCl2 . 2 H2O = cloreto de cálcio di-hidratado
+
hidratado
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
FUNÇÃO E APLICAÇÃO DOS SAIS
Cloreto de sódio – NaCl= é obtido da água do mar e utilizado na alimentação
como sal de cozinha e na conservação de carnes. Na indústria, é usado para a
produção de soda cáustica e gás cloro;
Carbonato de sódio - Na2CO3= também chamado de soda ou barrilha. Usado
para a fabricação de vidro, sabão, corantes e no tratamento de água de piscina;
Carbonato de cálcio - CaCO3= na natureza, é encontrado na forma de
mármore, calcário e calcita. Forma as estalactites e as estalagmites das
cavernas. Usado na produção de cimento e de cal virgem (CaO). Reduz a
acidez do solo;
Hipoclorito de sódio - NaOCl= usado como anti-séptico e alvejante
(clareamento de roupas);
Sulfato de Cálcio – CaSO4= Gesso para imobilizações.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
Bicarbonato de sódio - NaHCO3= Antiácido;
Carbonato de amônio - (NH4)2CO3= Expectorante;
Carbonato de lítio - Li2CO3= Antidepressivo;
Cloreto de sódio – NaCl= Soro fisiológico;
Fluoreto de estanho II - SnF2= Fortalecimento do esmalte dental;
Permanganato de potássio - KMnO4= Antimicótico;
Sulfato de ferro II - FeSO4= Fonte de ferro para anêmicos;
Sulfato de magnésio - MgSO4= Laxante.
http://desculpasengordam.com.br/wp
-content/uploads/2012/09/sal295x300.jpg
http://www.memari7.com/upload1/20
1411/371-500-(8).jpg
http://www.meteoweb.eu/wpcontent/uploads/timthumb.php?src=h
ttp://www.meteoweb.eu/wpcontent/uploads/2012/05/stalactitestalagmite-1.jpg&q=80&w=644&zc=1
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
PROBLEMAS AMBIENTAIS
Dióxido de Enxofre - SO2= é um dos principais poluentes atmosféricos; em dias úmidos,
combina-se com o vapor de água da atmosfera e origina a chamada chuva ácida;
Monóxido de Carbono - CO= é normalmente o principal poluente da atmosfera das zonas
urbanas; inalado combina com a hemoglobina das hemácias do sangue, neutralizando-as
para o transporte de gás oxigênio no organismo;
Ácido nítrico - HNO2 e Ácido nitroso - HNO3= Na atmosfera, esse óxidos, por estarem em
pequena quantidade, não fazem com que a chuva ácida seja considerada nociva.
Entretanto, ao longo do tempo ela pode causar certo impacto ambiental.
http://nation.com.pk/print_images/larg
e/2014-07-28/1406510195-7236.jpg
https://todossomoschuvaacida.files
.wordpress.com/2012/10/poluic3a7
c3a3o2.jpg
Óxidos de enxofre - SO2 e SO3= está presente em combustíveis fósseis usados em
indústrias, como o carvão mineral; e em automóveis, como derivados do petróleo,
principalmente o óleo diesel. Esses óxidos reage com a água da chuva, forma-se o ácido
sulfúrico (H2SO4), que é considerado o grande vilão da chuva ácida.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
SAÚDE:
AMBIENTE
OS ÁCIDOS E A FORMAÇÃO DA
CÁRIE
SALINIZAÇÃO / ACIDEZ
doença infecciosa causada por bactérias
Streptococcus mutans
desmineralização de alguns tecidos
duros do dente.
ácido lático e outros tipos de ácidos
O processo de salinização dos solos e das
águas subterrâneas e superficiais é um dos
mais importantes problemas de degradação
ambiental.
•
ORIGEM DO PROBLEMA
•
CONSEQUÊNCIAS
•
POSSÍVEIS SOLUÇÕES
https://lh3.googleusercontent.com/bLu1YXYzZTiGKKS9QkBhOtkrN1pcC
80CdfGW2BLR_jMVc6lDrVa9ZW6sNyahe5tKfORx0OU=s166
http://www.geografia.seed.pr.gov.br/modules/gale
ria/uploads/7/normal_1195salinizacaosolos.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
- QUESTÕES PARA DESAFIOS
1- (UEL-PR) X é uma substância gasosa nas condições ambientes. Quando liquefeita,
praticamente não conduz corrente elétrica, porém forma solução aquosa que conduz bem a
eletricidade. Uma fórmula provável para X é: a) KBr. b) HCl. c) Ar. d) N2. e) O3.
2- (FGV-SP) Alguns compostos, quando solubilizados em água, geram uma solução aquosa
que conduz corrente elétrica. Dos compostos abaixo:
I. Na2SO4.
II. O2.
III. C12H22O11.
IV. KNO3.
V. CH3COOH.
VI. NaCl.
Formam-se solução aquosa que conduz eletricidade:
a) apenas I, IV e VI.
b) apenas I, IV, V e VI.
c) apenas I e VI.
d) apenas VI.
e) Todos.
3- Qual das substâncias a seguir apresenta sabor azedo quando em solução aquosa?
a) Na2S. b) NaCl.
c) CaO.
d) HCl.
e) NaOH.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
4- Sabor adstringente é o que percebemos quando comemos uma banana verde (nãomadura). Que substância a seguir teria sabor adstringente?
a) CH3COOH.
b) NaCl.
c) Al(OH)3.
d) C12H22O11.
e) H3PO4.
5- Quando o solo é excessivamente ácido, agricultores procuram diminuir a acidez por meio
da adição de substâncias com propriedades alcalinas. Com essa finalidade, um dos
produtos utilizados é o:
a) NaCl.
b) CaO.
c) Na2SO4. d) NH4NO3.
e) KClO4.
6- (Covest-90) Várias substâncias são encontradas no comércio e utilizadas como
medicamentos, alimentos, desinfetantes, etc., tais como: água oxigenada (peróxido de
hidrogênio), álcool (álcool etílico), açúcar (sacarose), sal de cozinha (cloreto de sódio), água
sanitária (hipoclorito de sódio). Assinale o item que apresenta as fórmulas químicas desses
compostos, na ordem dada:
a) H2O2, CH3OH, C12H22O11, NaCl, NaIO3.
b) H3O, C2H5OH, C6H12O6, NaCl, NaClO.
c) H2O, C2H5OH, C6H12O6, NaCl, NaClO4.
d) H2O2, C3H6OH, C12H22O11, Na2Cl, NaClO2.
e) H2O2, C2H5OH, C12H22O11, NaCl, NaClO.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
DINÂMICA: ATIVIDADE SOCIALIZADA
Solicite aos educandos que levem embalagens de qualquer produto que
utilizem em casa para a sala de aula, tais como: pasta de dente, biscoitos,
sucos, refrigerantes, água, sabonete, shampoo, leite etc;
Peça a eles que construa uma tabela com as seguintes informações: tipo de
produto, o nome de alguma substância que esteja discriminada no rótulo, sua
respectiva fórmula e qual função química, como por exemplo:
Produto
Substância
Fórmula
Grupo
Pasta de dente
fluoreto de sódio
NaF
sais
Peça para que troquem as embalagens entre si e preencham a tabela com
um mínimo de produtos estabelecidos pelo educador;
Ao final a tabela é entregue ao educador para a correção juntamente com
todas as em embalagens.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
AULA PRÁTICA – LAB DE QUÍMICA
IDENTIFICAÇÃO DE ÁCIDOS E BASES COM INDICADOR NATURAL
OBJETIVO: Testar a acidez/basicidade de algumas substâncias , seu “pH” e como estes
conceitos estão relacionados com o organismo, utilizando água de repolho roxo (indicador
natural - tornassol).
METODOLOGIA: detergente, sabão em barra, leite de magnésia (MgOH), limão, vinagre.
O indicador é repolho roxo, onde basta realizar a maceração, a diluição em água e a
filtragem. A solução obtida funciona como um indicador ácido-base.
Misturamos cada substância com o indicador em tubos de ensaio e ele nos mostrará se
é ácido ou base.
A atividade é realizada em pequenos grupos, cada grupo tem seu material. Os grupos
comparam as cores obtidas nos tubos de ensaio com a tabela de cores de Ph, identificando a
acidez/basicidade das substâncias, em forma de relatório.
CONCLUSÃO: Bases= o detergente que misturado com o indicador fica roxo, o leite de
magnésia que misturado com o indicador fica verde fraco e o sabão em barra que
misturado com o indicador a cor fica verde forte e espumante.
Ácidos= o limão quando misturado com o indicador fica com a cor de vermelho, o vinagre que
misturado com o indicador natural fica de cor rosa e a água sanitária que misturada com o
indicador ela fica transparente.
http://www.alunosonline.com.br/upload/conteudo/images/indicador-derepolho-roxo.jpg
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
PESQUISA PARA A CONTEXTUALIZAÇÃO
OBJETIVO: Contextualizar as funções químicas com eventos e substâncias
do dia-a-dia.
Muitas áreas da sociedade e economia precisam da determinação dos
caráter ácido-básico-óxido-sais das substâncias.
Questione a turma sobre quais são essas áreas e qual a importância deste
conhecimento no cotidiano.
Exemplos: a piscicultura precisa determinar o “pH” da água de cada espécie
criada nos tanques. A cosmética também necessita destes conhecimentos na
fabricação de produtos.
- A atividade sugerida com grupos de até 3 integrantes.
- Será realizada a pesquisa com o tema proposto, e cada grupo apresenta na
sala o material na cartolina, para uma melhor socialização do tema.
Ciências, 9º Ano, Descrição dos tipos de funções químicas,
suas propriedades e seus efeitos químicos e biológicos
REFERÊNCIAS BIBLIOGRÁFICAS
• http://www.mundoeducacao.com/quimica/funcoes-inorganicas.htm Acesso em
08/10/2015
• http://www.estudopratico.com.br/funcoes-quimicas-acidos-bases-sais-e-oxidos/ Acesso
em 08/10/2015
• http://www.sobiologia.com.br/conteudos/Oitava_quimica/funcaoquimica.php Acesso em
08/10/2015
• http://www.mundoeducacao.com/quimica/propriedades-classificacao-dos-acidos.htm
Acesso em 08/10/2015
• http://www.soq.com.br/conteudos/ef/funcaoquimica/ Acesso em 08/10/2015
• http://www.sobiologia.com.br/conteudos/Oitava_quimica/funcaoquimica.php Acesso em
08/10/2015
• http://www.mundoeducacao.com/quimica/propriedades-classificacao-dos-acidos.htm
Acesso em 08/10/2015
• http://www.mundoeducacao.com/quimica/oxidos-efeito-estufa.htm Acesso em 08/10/2015
• http://pibid-bio-uepg.blogspot.com.br/2013/08/as-funcoes-inorganicas-e-sua.html Acesso
em 08/10/2015
• http://www.geografia.seed.pr.gov.br/modules/galeria/detalhe.php?foto=919&evento=7
Acesso em 08/10/2015
• http://www.alunosonline.com.br/quimica/indicadores-acidobase.html Acesso em
08/10/2015