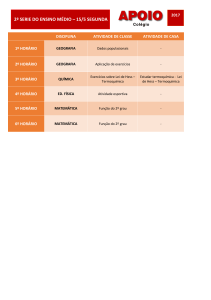
O que você deve saber sobre
TERMOQUÍMICA
Quando uma substância sofre uma transformação (física ou
química), sempre existe uma quantidade de calor envolvida. As
transformações que liberam calor são exotérmicas; as que absorvem
calor são endotérmicas. O conteúdo de calor associado a uma
substância é chamado de entalpia (H). Quando uma reação é
realizada sob pressão constante, a quantidade de calor liberada ou
absorvida recebe o nome de variação de entalpia (ΔH).
I. Variação de entalpia (∆H)
Indica a quantidade de calor envolvida em uma transformação.
(∆H) = Hprodutos - Hreagentes
(∆H) = Variação
de entalpia
TERMOQUÍMICA
Hprodutos = Entalpia
dos produtos
Hreagentes = Entalpia
dos reagentes
I. Variação de entalpia (∆H)
Reação endotérmica
Reação exotérmica
TERMOQUÍMICA
II. Diagrama de entalpia
Processo endotérmico
TERMOQUÍMICA
II. Diagrama de entalpia
Processo exotérmico
TERMOQUÍMICA
III. Principais fatores que afetam o ∆H de uma reação
Quantidade de reagentes
Estado físico das substâncias
TERMOQUÍMICA
III. Principais fatores que afetam o H de uma reação
Estado físico das substâncias
As moléculas de água que se encontram no estado sólido apresentam um menor
conteúdo energético que as moléculas que estão nos estados líquido e gasoso.
TERMOQUÍMICA
III. Principais fatores que afetam o H de uma reação
Estado alotrópico
Quanto menor o conteúdo energético,
maior é a estabilidade do composto.
O carbono grafite é mais estável que o carbono diamante.
O fósforo vermelho é mais estável que o fósforo branco.
O enxofre rômbico é mais estável que o enxofre monoclínico.
Temperatura
Ao variar a temperatura, variam a agitação das
moléculas e a entalpia dos envolvidos na reação.
TERMOQUÍMICA
IV. Entalpia ou calor de formação (∆Hf)
Substância
H°
(kJ/mol)
Substância
H° (kJ/mol)
C (grafite)
0,0
N2O (g)
+81,6
C (diamante)
+1,9
N2O3 (g)
+86,6
C4H10 (g) (butano)
–125,7
S (monoclínico)
+0,3
C6H6 (l) (benzeno)
+49,1
SO3 (g)
–395,7
C2H6O (l) (etanol)
–277,6
Fe3O4 (s)
–1.118,4
C3H6O (l) (acetona)
–248,4
TERMOQUÍMICA
V. Entalpia ou calor de combustão
É a variação de entalpia associada à combustão (queima) de 1 mol
de substância a 25 oC e 1 atm com excesso de oxigênio.
∆H de combustão: 1 mol da substância que sofre combustão;
negativo, pois as reações de combustão são exotérmicas.
TERMOQUÍMICA
VI. Lei de Hess
O ∆H da reação depende apenas dos estados inicial e final.
TERMOQUÍMICA
VI. Lei de Hess
TERMOQUÍMICA
VII. Energia de ligação
Energia fornecida para romper 1 mol de ligações entre dois átomos
em um sistema gasoso a 25 ºC e 1 atm.
Reagentes: processo endotérmico – quebra de ligações
Produtos: processo exotérmico – formação de ligações
Calor absorvido na
quebra das ligações
∆H da reação =
presentes nos reagentes
(H>0)
TERMOQUÍMICA
+
Calor liberado na
formação das ligações
presentes nos produtos
(H<0)
VII. Energia de ligação
TERMOQUÍMICA
EXERCÍCIOS ESSENCIAIS
1
(UFRJ)
A redução das concentrações de gases responsáveis pelo efeito estufa constitui o desafio central do trabalho de muitos
pesquisadores. Uma das possibilidades para o sequestro do CO2 atmosférico é sua transformação em outras moléculas.
O diagrama a seguir mostra a conversão do gás carbônico em metanol.
a) Indique as etapas endotérmicas e exotérmicas.
RESPOSTA: Etapa endotérmica: II III
Etapas exotérmicas: I II e III IV
b) Calcule a variação da entalpia na conversão do CO2 em metanol.
RESPOSTA:
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
4
(Fuvest-SP)
O 2-metilbutano pode ser obtido pela hidrogenação catalítica, em fase gasosa, de qualquer dos seguintes alcenos isoméricos:
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
4
a) Complete o esquema da figura com a fórmula estrutural de cada
um dos alcenos que faltam. Além disso, ao lado de cada seta,
coloque o respectivo ∆H de hidrogenação.
RESPOSTA:
Nas três reações, o produto final é o mesmo e, portanto, a
entalpia dos produtos também é a mesma. A reação que libera
maior quantidade de energia indica o reagente de maior
entalpia (já representada no gráfico dado). Completa-se o
esquema da seguinte maneira:
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
4
b) Represente, em uma única equação e usando fórmulas moleculares,
as reações de combustão completa dos três alcenos isoméricos.
RESPOSTA:
Os alcenos citados no texto apresentam a mesma fórmula
molecular C5H10 (são isômeros); portanto, a equação da
reação de combustão completa é:
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
4
c) A combustão total de cada um desses alcenos também leva a uma
variação negativa de entalpia. Essa variação é igual para esses três
alcenos? Explique.
RESPOSTA:
Pelo gráfico, verifica-se que o conteúdo energético (calor de
formação) de cada isômero é diferente. Como os produtos na
combustão dos três isômeros são os mesmos, o ∆H de
combustão dos três isômeros será diferente.
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
6
(UFRN)
A hidrazina (N2H4) é um combustível que pode substituir a gasolina (C 8H18) em motores de explosão. Um estudante de Química
coletou, na literatura especializada, dados termodinâmicos relativos às reações de combustão desses dois combustíveis.
Tabela 1
Tabela 2
Fazendo uso desses dados, atenda às solicitações a seguir.
a) Escreva as equações balanceadas de combustão da hidrazina
e da gasolina.
RESPOSTA:
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
6
b) Considerando dois carros iguais, com motores de mesmo
desempenho, determine, por meio de cálculos, qual dos combustíveis
deverá proporcionar maior quilometragem por litro (ver tabelas 1 e 2).
RESPOSTA:
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
8
(Fuvest-SP)
Pode-se calcular a entalpia molar de vaporização do etanol a partir das entalpias das reações de combustão representadas por:
Para isso, basta que se conheça, também, a entalpia molar de:
a) vaporização da água.
b) sublimação do dióxido de carbono.
c) formação da água líquida.
d) formação do etanol líquido.
e) formação do dióxido de carbono gasoso.
RESPOSTA: A
TERMOQUÍMICA — NO VESTIBULAR
EXERCÍCIOS ESSENCIAIS
14
(UFRGS-RS)
Os valores de energia de ligação entre alguns átomos são fornecidos no quadro abaixo.
Considerando a reação representada por:
o valor aproximado de ∆H, em kJ, é de:
a) -820.
b) -360.
c) +106.
d) +360.
e) +820.
RESPOSTA: A
TERMOQUÍMICA — NO VESTIBULAR