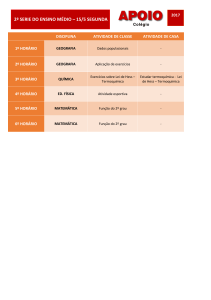
E.E. Aracy Eudociak.
__/__/__
nota : __________
Alunos (as):___________ e ____________ EJA III sala 3
Atividade de produção - Química – profª Karine
1. Como é pode ser definida a termoquímica?
2. Numere a segunda coluna de acordo com a primeira:
1. Calor de reação
2. Reação
endotérmica
3. Reação exotérmica
4. Entalpia
5. Termoquímica
6. Tipos de entalpia
( ) estuda as variações de calor de uma reação química.
( ) quantidade de calor/energia envolvida em uma reação química.
(
(
(
(
) Representada por H é a quantidade de calor de um sistema.
) calor liberado para o meio externo, ΔH < 0.
) entalpia de formação, padrão, combustão, etc..
) calor absorvido do meio externo, ΔH > 0.
3. Quais fatores podem influenciar na rapidez de uma reação química? Cite-os.
4. Como é pode ser encontrado o valor de ΔH de uma reação química?
5. Dadas as equações abaixo calcule o ΔH para a reação N2 + 2O2 = 2NO
N2 + 2O2 = 2NO2 ΔH= +66kJ
2NO + O2 = 2NO2 ΔH= -113kJ
6. Assinale a reação que corresponde a formação de metano (CH4):
a) CH4 + 2O2 = CO2 + 2H2O
b) CH4 = H2 + C2
c) H2 + 2C = CH4
7. Escreva a reação termoquímica e classifique os processos dos gráficos abaixo em: exotérmico
ou endotérmico.
a) H CH4 + 2O2
b) H
C2 H2
ΔH= -890kJ
CO2 + 2H2 O
2C + H2
ΔH= +228kJ