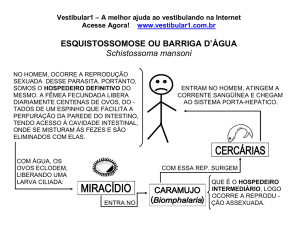
Química Inorgânica
Número de oxidação (Nox).
Oxidação e Redução.
Agente oxidante e Agente redutor.
Balanceamento de equação pelo método da
tentativa.
Balanceamento de equação pelo método da
oxirredução.
Vestibular1 –
www.vestibular1.com.br
Número de Oxidação – Nox.
O conceito de Nox surgiu no sentido de
ampliar um outro conceito da Química, o de
Valência (do latim Valentia, que significa
“capacidade”). Relacionado à possibilidade de
um elemento químico em estabelecer ligações
químicas. Sendo assim, Nox é a carga que
formalmente um átomo teria em uma
substância, admitindo-se que ele somente
cedesse ou recebesse elétrons.
Vestibular1 –
www.vestibular1.com.br
Valência e Nox na Tabela Periódica
Nome da Família
Grupos
Valência
Nox
Metais Alcalinos
IA
1
+1
Metais Alcalinos Terrosos
II A
2
+2
Família do Boro
III A
3
+3
Família do Carbono
IV A
4
+4 ou –4
Família do Nitrogênio
VA
3
-3
Família dos Calcogênios
VI A
2
-2
Família dos Halogênios
VII A
1
-1
Vestibular1 –
www.vestibular1.com.br
Cálculo do Nox Médio
Para o cálculo do Nox médio de um
elemento em uma dada substância, devemos
raciocinar como se todas as ligações fossem
iônicas, isto é, ocorressem com transferência de
elétrons. Para isto, vamos relembrar a seqüência
dos principais elementos em ordem crescente de
eletronegatividade.
H < P < C < S < I < Br < Cl < N < O < F
O Nox médio é dado pela média aritmética
dos Nox de todos os átomos daquele dado
elemento presentes na fórmula do composto.
Vestibular1 –
www.vestibular1.com.br
Regras para o cálculo do Nox médio
1ª - Atribuir cargas parciais aos átomos
em cada ligação. + 1 para os menos
eletronegativos e -1 para os mais
eletronegativos.
2ª - Somar as cargas parciais do átomo em
questão.
3ª - Fazer a média aritmética dos valores
encontrados.
Vestibular1 –
www.vestibular1.com.br
Exemplos
Vestibular1 –
www.vestibular1.com.br
Regras para o cálculo do Nox de elementos
em substâncias diversas.
1ª - Em uma substância simples o Nox de um
elemento é sempre ZERO.
EX. : H2, O2, O3, Fe, Zn.
2ª - Íons simples apresentam Nox igual a
carga do íon.
EX. :Cl -1, F -1, Na +1, Ca +2, Cu +1, Fe +2,
Hg2+2.
3ª - Metais alcalinos, Ag e o cátion Amônio
(NH4+1), quando em substâncias compostas, Nox
= +1.
EX. : NaCl , (NH4)2S, Ag2S,Vestibular1
Na2SO
– 4,
www.vestibular1.com.br
4ª - Metais alcalinos Terrosos, Zn e Cd, quando
em substâncias compostas, apresentam Nox = +2.
EX. : BaCl2 , ZnS , CdF2 , ZnSO4.
5ª - Al, quando em substâncias compostas,
apresentam Nox = +3. EX. : AlCl3, Al2S3, Al2O3.
6ª - Os halogênios, como elementos mais
eletronegativos (mais a direita) de substâncias
compostas, apresentam Nox = -1. EX. : AgCl,
CaCl2, KBr, HF.
7ª - Hidrogênio (H) em substâncias compostas,
apresentam Nox = +1. Exceto quando em hidretos
metálico ( hidrogênio ligado a metal ), neste caso
Vestibular1
apresentará Nox = -1. EX. : HCl, NH3www.vestibular1.com.br
, NaH,
CaH– 2.
8ª - Os calcogênios, quando os elementos
mais eletronegativos de uma substância,
apresentam Nox = -2. EX. : Na2S, CaS, K2Se,
Al2S3, Fe2O3.
9ª - Oxigênio, apresenta Nox = -2.Exceto nos
peróxidos (Nox = -1) e nos superóxidos ( Nox = 1/2 ). EX. : H2O, H2O2, CaO, Na2O4, K2O2,
Fe2O3.
10ª - Nas substâncias compostas a soma dos
Nox = 0. EX. : HNO3 , H2SO4 , H2Cr2O7,
Ca(MnO4)2.
11ª -Nos íons compostos a soma dos Nox =
-1,Vestibular1
-3.–
carga do íon. EX. : CrO4-2, SO4-2, NOwww.vestibular1.com.br
BO
3
3
Oxidação e Redução
Oxidação é o aumento do número de oxidação
(Nox) de um dado elemento químico através da
perda de elétrons.
Redução é a diminuição do número de
oxidação de um elemento químico através do
ganho de elétrons.
Aumento do Nox = Oxidação
-7 -6 -5 -4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
Diminuição do Nox = Redução
Vestibular1 –
www.vestibular1.com.br
Agente oxidante e Agente redutor
Agente Oxidante é a substância que contém
o elemento que sofreu redução.Ou seja, esta
substância provoca a oxidação de um dado
elemento.
Agente Redutor é a substância que contém o
elemento que sofreu oxidação. Ou seja, esta
substância provoca a redução de um dado
elemento.
Vestibular1 –
www.vestibular1.com.br
Encontre nas reações químicas abaixo, quem
sofreu oxidação e quem sofreu redução, quem é o
agente oxidante e quem é o agente redutor.
MnO2+ FeSO4+ H2SO4MnSO4+ Fe2(SO4)3+ H2O
KCl + KClO4 KClO3
Mn3O4 + Al Al2O3 + Mn
K2Cr2O7 + HCl KCl + CrCl3 + Cl2 + H2O
H2SO4 + KMnO4 + H2O2 K2SO4 + MnSO4 + H2O +
O2
Vestibular1 –
www.vestibular1.com.br
Balanceamento de equações pelo
método das tentativas
Consiste em colocar coeficientes nas
substâncias reagentes e produtos de maneira
que cada elemento tenha o mesmo número de
átomos nos reagentes e nos produtos. O uso
constante do método acabou sugerindo
algumas regras que, se observadas, facilitam
bastante o trabalho.
Vestibular1 –
www.vestibular1.com.br
Regras Práticas
Método das Tentativas
1ª. Começar o acerto com o elemento (ou radical) que
apareça apenas uma vez tanto nos reagentes como nos
produtos.
2ª. Começar com o elemento (ou radical) de índices
maiores.
3ª. Eleito o elemento (ou radical) de índices maiores,
utilizá-los nos coeficientes das substâncias do membro
oposto.
4ª. Adotar o mesmo procedimento com todos os
elementos (ou radicais) restantes.
5ª. Conferir o número de átomos de cada elemento nos
dois membros da equação.
6ª. Os coeficientes devem ser os menores números
Vestibular1 –
inteiros possíveis
www.vestibular1.com.br
Balancei as equações abaixo.
Al2(CO3)3 Al2O3 + CO2
Al(OH)3 + H4P2O7 Al4(P2O7)3 + H2O
H2SiF6 + NaOH NaF + Si(OH)4 + H2O
Ca3(PO4)2 + H2SO4 H3PO4 + CaSO4
Vestibular1 –
www.vestibular1.com.br
Método da Oxirredução
Em geral, nas reações de oxirredução o
método das “tentativas” não é prático. Por
isso, o processo mais utilizado consiste em
determinar a proporção entre o oxidante e o
redutor e depois continuar o balanceamento
por tentativa. Para tanto, devemos seguir
algumas regras que nos ajudarão a resolver
este problema.
Vestibular1 –
www.vestibular1.com.br
Regras Práticas
Método da Oxirredução
1ª. Determina-se o Nox de todos os
elementos participantes da equação.
2ª Identifica-se o(s) elemento(s) que
sofre(m) oxidação e redução.
3ª. Calcular a variação do Nox (Nox)
do oxidante e do redutor, da seguinte
maneira: Nox=(Nox(maior)–Nox(menor)) x n,
onde n é o m.m.c dos índices do
elemento considerado.
Vestibular1 –
www.vestibular1.com.br
4ª. A variação total do Nox do oxidante será
o coeficiente do redutor e vice-versa, sempre
levando-se em consideração o maior índice
para o elemento.
5ª. Balancear os demais elementos pelo
método das tentativas.
6ª. Conferir o número de átomos de cada
elemento nos dois membros da equação.
7ª. Os coeficientes devem ser os menores
números inteiros possíveis
Vestibular1 –
www.vestibular1.com.br
Balancei as equações abaixo
MnO2+ FeSO4+ H2SO4MnSO4+ Fe2(SO4)3+ H2O
KCl + KClO4 KClO3
Mn3O4 + Al Al2O3 + Mn
K2Cr2O7 + HCl KCl + CrCl3 + Cl2 + H2O
H2SO4 + KMnO4 + H2O2 K2SO4 + MnSO4 + H2O +
O2
Vestibular1 –
www.vestibular1.com.br