Instrumentação laboratorial clínica
É função do laboratório clínico analisar amostras retiradas de pacientes de modo
a obter informação que possa contribuir para o diagnóstico e para a avaliação da
eficácia das terapias.
As principais secções do laboratório clínico são a química, a hematologia e a
microbiologia.
A secção de química realiza análises ao sangue, urina, fluído
cerebrospinal e outros fluidos para determinar as quantidades
presentes para várias substâncias clinicamente importantes.
A secção de hematologia realiza a determinação do número e
características dos vários elementos do sangue (glóbulos vermelhos
e brancos e plaquetas)
A secção de microbiologia realiza estudos em vários tecidos e fluidos
corporais para determinar se estão presentes microrganismos
patológicos
508
Instrumentação laboratorial clínica
Exemplo 1 – H.U.C.
A Área de Administração I integra os designados Meios Complementares de
Diagnóstico e Terapêutica e Serviços de Apoio Clínico e engloba os seguintes
serviços:
Anatomia Patológica
Imunohemoterapia
Imagiologia
Esterilização Central
Patologia Clínica
Centro de Responsabilidade de Medicina Física
e de Reabilitação
Laboratório de
Hematologia
Centro de Responsabilidade de Medicina
Nuclear
O LH desenvolve a sua actividade de modo a fornecer resultados de estudos
analíticos e propostas de diagnóstico laboratorial, no âmbito da Hematologia
Laboratorial, cobrindo as seguintes valências: Citometria, Citologia, Imunidade
Celular, Hemostase, Biologia Molecular e Bioquímica.
509
Instrumentação laboratorial clínica
Espectrofotometria
A espectrofotometria é a base de muitos dos instrumentos utilizados em química
clínica. Tal sucede devido à facilidade de medição, à boa precisão e exactidão e à
adequação das técnicas espectrofotométricas a procedimentos de medição
automáticos.
A espectrofotometria baseia-se na absorção ou emissão selectiva, para diferentes
comprimentos de onda, das substâncias de interesse clínico.
510
Instrumentação laboratorial clínica
Algumas definições
Lc
Lei de Beer: I1 I0 10
A absorvância ou densidade óptica é dada por:
A L c log10
I1
I0
A percentagem de transmitância é definida por:
I
%T 100 1 100 10L c
I0
onde
I0 é a irradiância da luz incidente (W·m-2)
I1 é a irradiância após a passagem pela amostra (W·m-2)
L é a distância percorrida pela luz na amostra (cm)
c é a concentração de espécies absorventes no material (mol·l-1)
é o coeficiente de absorção (ou absortividade molar) do absorvente (l mol-1·cm-1)
511
é o comprimento de onda da luz
Instrumentação laboratorial clínica
Algumas definições
Então
A log10
I0
100
log10
2 log10 %T
I1
%T
A concentração de uma substância é determinada a
partir de um padrão de concentração conhecida dessa
mesma substância
Ad
Cd Cp
A
p
512
Instrumentação laboratorial clínica
Sistema espectrofotométrico
513
Instrumentação laboratorial clínica
Métodos instrumentais de análise - Cromatografia
A cromatografia (correctamente devia dizer-se cromatologia) é o método mais
generalizado de realizar separações analíticas. O termo engloba um conjunto de
métodos que permite a separação de componentes de misturas complexas
Em todas as separações cromatográficas a amostra está dissolvida numa fase
móvel, que pode ser um gás, um líquido ou um fluído supercrítico*. Esta fase
móvel é forçada a atravessar uma fase estacionária imiscível que está fixa
numa coluna ou numa superfície sólida. As duas fases são escolhidas de forma
a que os componentes da amostra se distribuam de forma diferente entre as
fases estacionária e móvel.
* Um fluído supercrítico é qualquer substância a uma pressão e temperatura acima do ponto crítico
514
Instrumentação laboratorial clínica
Métodos instrumentais de análise - Cromatografia
Os componentes que forem fortemente retidos pela fase estacionária movem-se
lentamente com o fluxo da fase móvel. Componentes fracamente retidos
acompanham rapidamente o movimento da fase móvel
Em consequência destas diferenças de mobilidade, os componentes da amostra
separam-se em bandas discretas que podem ser analisadas quantitativamente
ou qualitativamente
* Um fluído supercrítico é qualquer substância a uma pressão e temperatura acima do ponto crítico
515
Instrumentação laboratorial clínica
Métodos instrumentais de análise - Cromatografia
A classificação dos métodos de cromatografia pode ser feita com base em duas
categorizações distintas:
A primeira baseia-se nos métodos físicos utilizados para colocar em contacto as
fases estacionária e móvel
na cromatografia de coluna a fase estacionária é
mantida num tubo estreito através do qual a fase
móvel é forçada por gravidade ou pressão
na cromatografia planar a fase estacionária é
suportada numa placa plana ou nos interstícios de
um papel. Aqui a fase móvel é forçada por
gravidade ou por capilaridade.
516
Instrumentação laboratorial clínica
Métodos instrumentais de análise - Cromatografia
A segunda classificação é mais fundamental e baseia-se nos tipos de fases
móvel e estacionária e nos tipos de equilíbrio envolvidos na transferência de
solutos entre fases.
Surgem as classificações cromatografia líquida (LC), cromatografia gasosa
(GC) e cromatografia supercrítica (SFC) conforme o tipo de fase móvel
empregue.
A cromatografia líquida é a única que pode ser executada quer em coluna quer
em suporte de papel. As cromatografias gasosa e de fluído supercrítico estão
limitadas aos procedimentos com coluna.
517
Instrumentação laboratorial clínica
Métodos instrumentais de análise - Cromatografia
Classificação Geral
Cromatografia
Líquida
Cromatografia
Gasosa
Cromatografia
Supercrítica
Método Específico
Fase estacionária
Tipo de equilíbrio
Líquido – líquido, ou partição
Líquido adsorvido num
sólido
Partição entre
líquidos imiscíveis
Líquido - fase ligada
Espécie orgânica ligada
a uma superfície sólida
Partição entre líquido
e superfície ligada
Líquido - sólido, ou adsorção *
Sólido
Adsorção
Permuta iónica
Resina de permuta iónica
Permuta iónica
Exclusão molecular
Líquido nos interstícios
de um polímero sólido
Partição
Gás – líquido
Líquido adsorvido num
sólido
Partição entre gás e
líquido
Gás - fase ligada
Espécie orgânica ligada
a uma superfície sólida
Partição entre líquido
e superfície ligada
Gás - sólido
Sólido
Adsorção
Espécie orgânica ligada
a uma superfície sólida
Partição entre fluído
supercrítico e
superfície ligada
Fonte: Principles of Instrumental Analysis, D. Skoog e J. Leary. 4ª Edição
* fixação de moléculas de gases ou líquidos à superfície de outra substância
518
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas
Amostra
Fase móvel
Eluição: processo de remoção de um
material adsorvido (adsorvato) de um
adsorvente, com um líquido (eluente)
A+B
B
A
A eluição implica o transporte de
uma espécie através da coluna pela
adição contínua de uma fase móvel.
B
A
No instante t0, uma porção única de
amostra, contida na fase móvel, é
introduzida no topo de uma coluna.
B
A
t0
t1
Sinal do Detector
t2
B
t3
A
t0
t1
t2
t4
Detector
Os componentes da amostra
distribuem-se entre as duas fases.
B
t3
t4
519
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas
Amostra
Fase móvel
A introdução de fase móvel adicional
(o eluente) força esta fase a descer
a coluna, ocorrendo mais partição
da amostra entre a fase móvel e
partes “frescas” da fase estacionária
(t1)
A+B
B
A
B
A
B
A
t0
t1
Sinal do Detector
t2
B
t3
A
t0
t1
t2
t4
B
t3
t4
Detector
A adição contínua de fase móvel
arrasta moléculas dos analitos ao
longo da coluna, num processo
contínuo de transferências entre as
fases móvel e estacionária.
520
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas
Amostra
Fase móvel
A+B
Contudo, como o movimento das
componentes da amostra só pode
ocorrer na fase móvel, a taxa média
a que uma espécie migra depende
da fracção de tempo que a espécie
permanece nessa fase.
B
A
B
A
B
A
t0
t1
Sinal do Detector
t2
B
t3
A
t0
t1
t2
t4
Detector
B
t3
t4
521
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas
Amostra
Fase móvel
Esta fracção de tempo é pequena
para substâncias que sejam
fortemente retidas pela fase
estacionária (B) e é elevada quando
a retenção na fase móvel é mais
provável (A).
A+B
B
A
B
A
B
A
t0
t1
Sinal do Detector
t2
B
t3
A
t0
t1
t2
t4
Detector
Idealmente, as diferenças nas taxas
de migração levam a que os
componentes da mistura se separem
em bandas localizadas ao longo da
coluna (t2).
B
t3
t4
522
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas
Amostra
Fase móvel
A+B
O isolamento das espécies
separadas é conseguido fazendo
passar uma quantidade suficiente de
fase móvel pela coluna para que as
componentes atinjam a sua
extremidade onde podem ser
detectadas ou recolhidas (t3 e t4)
B
A
B
A
B
A
t0
t1
Sinal do Detector
t2
B
t3
A
t0
t1
t2
t4
Detector
B
t3
t4
523
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas
A figura mostra os perfis de concentração para as espécies A e B em dois fases do
processo de eluição (t1 e t2). A espécie B é mais retida pela fase estacionária e,
como tal, durante a migração, o seu pico surge atrasado relativamente à espécie A.
Concentração
O movimento ao longo da coluna aumenta a distância entre os dois picos.
Simultaneamente ocorre alargamento das duas bandas o que diminui a eficiência
da coluna como dispositivo de separação. O alargamento das bandas é inevitável.
Contudo é possível determinar condições em que este alargamento ocorre mais
lentamente do que a separação entre bandas.
t1
Deste modo, desde que a coluna seja
suficientemente longa é possível assegurar
uma boa resolução das espécies contidas
na amostra.
t2
B
A
B
Distância
A
524
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Coeficientes de partição
A eficiência de uma coluna de cromatografia na separação de dois analitos
depende das taxas relativas a que as duas espécies são eluídas. Estas taxas são
determinadas pelo valor das constantes de equilíbrio das reacções pelas quais as
espécies se distribuem entre as fases móvel e estacionária.
Muitas vezes o equilíbrio de distribuição envolvido na cromatografia pode ser
descrito por equações simples que envolvem a transferência de um analito entre
A estacionaria
as 2 fases. Para uma espécie A podemos escrever A movel
525
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Coeficientes de partição
A constante de equilíbrio para este equilíbrio designa-se por coeficiente de
partição e é definida por:
c
K E
cM
cM e cE são as concentrações molares de analito nas fases móvel e
estacionária, respectivamente.
Idealmente K é constante para uma gama larga de concentrações.
A cromatografia em que esta equação se aplica designa-se por cromatografia
linear. Só estudaremos este tipo de cromatografia
526
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Tempo de retenção
A figura mostra um cromatograma típico para uma amostra com um único analito.
O tempo que decorre desde a introdução da amostra até à chegada do pico do
analito ao detector é denominado tempo de retenção.
Sinal do detector
O pico pequeno resulta de uma espécie não retida pela coluna. Muitas vezes a
amostra ou a fase móvel contém uma espécie deste tipo. O tempo necessário
para que a espécie não retida atinja o detector é designado por tempo morto
tR
A velocidade média de migração do analito é
L
v
tR
com L o comprimento da coluna.
tM
A velocidade média das moléculas da
fase móvel é
Tempo
u
L
tM
527
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Relação entre tempo de retenção e
coeficientes de partição
De forma a relacionar o tempo de retenção de uma espécie molecular com o seu
coeficiente de partição, expressa-se a sua velocidade de migração em função da
velocidade da fase móvel.
v = u · (fracção de tempo que o analito passa na fase móvel)
528
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Relação entre tempo de retenção e
coeficientes de partição
Esta fracção corresponde ao quociente entre o número médio de moles de analito na
fase móvel e o número total de moles do analito presentes na coluna:
moles de analito na fase movel
v u
moles de analito na coluna
cM VM
v u
c
V
c
V
M M
E
E
1
v u
1 cE VE
cM VM
cM e cE - concentrações molares de analito nas
fases móvel e estacionária, respectivamente
VM e VE - volumes das fases móvel e
estacionária, respectivamente
529
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Relação entre tempo de retenção e
coeficientes de partição
Usando a definição de coeficiente de partição obtém-se:
1
v u
1 K VE
VM
Esta equação relaciona a velocidade de migração de um
analito com o seu coeficiente de partição e com os
volumes das duas fases. Estes volumes podem ser
estimados a partir do método de preparação da coluna.
O factor de capacidade de uma espécie A define-se por:
V
k 'A K A E
VM
Logo
1
v u
'
1
k
A
530
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Relação entre tempo de retenção e
coeficientes de partição
O factor de capacidade de uma espécie pode ser obtido a partir da análise do
cromatograma:
1
v u
'
1
k
A
L
L
tR tM
k 'A
1
'
1
k
A
tR tM
tM
Quando o factor de capacidade de uma espécie é muito
inferior à unidade a eluição ocorre tão rapidamente que
a determinação exacta dos tempos de retenção é difícil.
Se o factor de capacidade for superior a 20 os tempos
de eluição são muito longos.
Idealmente as separações são realizadas em condições
para as quais os factores de capacidade de um
componente de uma mistura se situam entre 1 e 5.
531
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Factor de selectividade
O factor de selectividade de uma coluna para duas espécies A e B é definido por
KB
KA
com KB o coeficiente de partição para a espécie mais fortemente
retida e KA o coeficiente de partição para a espécie menos retida (ou
mais eludida).
De acordo com esta definição, é sempre maior que 1.
Atendendo à definição de factor de capacidade podemos escrever
k B'
'
kA
ou ainda
tR B tM
tR A tM
532
Instrumentação laboratorial clínica
Cromatografia de eluição em colunas – Resolução de uma coluna
R
Z
WA WB
2
2
2 Z
R
WA WB
R
2 tR B tR A
Sinal do detector
A resolução de uma coluna mede a sua capacidade para separar dois analitos.
Define-se a partir da expressão
Z
A
B
WA
WB
Tempo
WA WB
Uma resolução de 1.5 garante a separação completa das bandas (0.3 % de
sobreposição). Para uma resolução igual a 1 a sobreposição é de cerca de 4%.
533
Instrumentação laboratorial clínica
Electroforese
A electroforese é um processo no qual espécies com carga eléctrica (iões ou
partículas coloidais) são separadas com base na sua diferente mobilidade sob a
acção de um campo eléctrico.
Pode ser definida como o movimento de uma fase sólida relativamente a um líquido.
Este líquido, designado por solução tampão, é suportado por uma substância sólida
denominada meio.
A solução tampão desempenha duas funções: transportar a corrente eléctrica e
manter constante o pH e a força iónica do meio durante a migração das moléculas.
É uma técnica muito utilizada na separação de proteínas e de ácidos nucleicos,
uma vez que estas são moléculas ionizáveis (proteínas) ou com carga eléctrica
(proteínas, ácidos nucleicos).
534
Instrumentação laboratorial clínica
Electroforese
Vamos limitar a nossa discussão à electroforese de zona ou de suporte que é
o tipo de electroforese utilizado em química clínica.
Nesta técnica a amostra é aplicada no meio. Sob a acção do campo eléctrico,
grupos de partículas de dimensões, carga e forma idênticas migram a
velocidades idênticas. Isto resulta na separação das partículas em zonas.
535
Instrumentação laboratorial clínica
Electroforese
As separações electroforéticas são normalmente realizadas em géis que
actuam como filtros, condicionando as velocidades de migração das moléculas:
as moléculas mais pequenas deslocam-se mais rapidamente enquanto que as
moléculas de maiores dimensões deslocam-se mais lentamente.
Utilizam-se normalmente géis de agarose
para separar ácidos nucleicos e
géis de acrilamida para separar proteínas
Aparelho de electroforese de DNA.
Coloca-se um gel de agarose na caixa que
contém solução tampão.
536
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
A força exercida por um campo eléctrico de intensidade E sobre uma partícula
carregada com carga eléctrica q é:
Fe q E
quando a partícula se desloca num gel fica sujeita a uma força de atrito:
Fa v f
com v a velocidade da partícula e f o coeficiente de atrito viscoso.
Atingida a velocidade limite tem-se:
qE
v
f
537
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
A mobilidade de uma partícula é definida como sendo a distância em
centímetros percorrida pela partícula por unidade de tempo e por unidade de
intensidade de campo eléctrico.
Esta definição normaliza a mobilidade ao campo eléctrico aplicado. Temos
então
v q
E f
Esta expressão aplica-se apenas a concentrações de iões muito baixas e a
meios não condutores. As moléculas poli-iónicas estão rodeadas por uma
nuvem de iões de sinal contrário que altera o campo eléctrico efectivo aplicado
aos iões a separar. Isto leva a que a expressão anterior seja uma fraca
aproximação do que se passa em electroforese.
538
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
A mobilidade depende quer de propriedades das partículas (densidade de carga
superficial, tamanho) e de propriedades do meio (força iónica, permitividade
eléctrica, pH, temperatura). Para forças iónicas elevadas a equação de
Smoluchowski dá uma expressão aproximada da mobilidade electroforética:
ez
h
em que e é a permitividade do meio, h é a viscosidade do meio e z é o potencial
da superfície da partícula.
A força iónica de uma meio depende da concentração de todos os iões
presentes na meio:
I
1
c i qi2
2 i
em que ci é a concentração molar do ião i e qi é a carga do ião i.
539
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
Os aminoácidos, os péptidos ou as proteínas apresentam carácter
anfotérico (i.e. são capazes de dar ou aceitar protões pelo que tanto
podem actuar como ácidos ou como bases).
Isto sucede devido à coexistência, em cada molécula, de funções ácidas
(-COOH) e básicas (-NH2).
As substâncias anfotéricas, em meio ácido, comportam-se como bases
fracas, captando iões H+. Em meio alcalino, actuam como ácidos fracos
libertando protões.
540
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
É muito raro que os grupos -NH2 e -COOH coexistam em número igual na
forma livre.
É ainda mais raro que estes grupos funcionais sejam ionizados de igual modo
[pK (COOH) = 2,4 e pK (NH2) = 9-12].
Assim, podemos concluir que cada molécula anfotérica possui o seu ponto
isoeléctrico característico.
Define-se ponto isoeléctrico como o pH para o qual uma substância não se
desloca sob a influência do campo eléctrico, ou seja, é electricamente neutra.
541
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
A carga eléctrica das proteínas depende do pH do meio.
Se o pH é superior ao ponto isoeléctrico, a proteína fica com carga negativa e
migra para o ânodo.
Se o pH é inferior ao ponto isoeléctrico, a proteína é carregada positivamente e
migra para o cátodo.
542
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
Como vimos, a velocidade de migração das proteínas na electroforese é
directamente proporcional à sua carga eléctrica e inversamente proporcional ao
seu peso molecular.
O deslocamento das partículas é ainda influenciado pela força iónica do meio e
pela temperatura.
Numa electroforese mantêm-se constantes o pH e a força iónica do meio,
através de uma solução tampão.
543
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
O fluxo de corrente eléctrica através do meio gera calor. Este calor tem dois
efeitos importantes na electroforese.
Por um lado, leva ao aumento da temperatura do meio o que leva à
diminuição da sua resistência eléctrica e consequente aumento da
velocidade de migração.
Por outro lado, o calor produz evaporação da água à superfície do meio. Isto
resulta num aumento da concentração de partículas e leva igualmente ao
aumento da velocidade de migração.
544
Instrumentação laboratorial clínica
Electroforese – Princípios fundamentais
Devido a estes efeitos é necessário manter constante a tensão aplicada ou a
corrente eléctrica, de forma a assegurar a reprodutibilidade da técnica.
Estes problemas são muito significativos quando o meio utilizado é um gel.
Com este tipo de meio devem-se utilizar fontes de corrente para minimizar os
efeitos das produção de calor.
545
Instrumentação laboratorial clínica
Electroforese – aplicações clínicas
Todos os fluidos biológicos contêm uma mistura heterogénea de proteínas. A
electroforese tem sido aplicada ao estudo de proteínas séricas, proteínas da urina,
proteínas do líquido cefalo-raquídeo, lipoproteínas e glicoproteínas séricas.
A análise electroforética das proteínas séricas ou proteinograma electroforético,
é um exame frequentemente requisitado na prática clínica diária, devido ao seu
valor no auxílio do diagnóstico de variadas doenças. Utiliza-se em geral uma
electroforese a um pH básico, sendo as moléculas proteicas essencialmente
separadas com base na sua carga O aspecto global do perfil electroforético, é por
vezes suficiente para referenciar de imediato algumas anomalias proteicas
características.
A electroforese desempenha um papel importante no diagnóstico de mieloma
múltiplo, macroglobulinémia, enteropatia exudativa, sindroma nefrótico, cirrose,
sarcoidose e de várias doenças do colagénio.
546
Instrumentação laboratorial clínica
Electroforese – aplicações clínicas
Na electroforese de zona utilizada em química clínica, a fase aquosa é
estabilizada sobre um suporte poroso impregnado de solução tampão condutora.
A principal aplicação desta técnica é no fraccionamento das proteínas e
lipoproteínas séricas.
A electroforese comporta 3 fases:
1ª fase - electroforese propriamente dita, em que há separação das diferentes
fracções proteicas.
2ª fase - revelação (coloração e lavagem dos meios de suporte)
3ª fase - leitura (avaliação quantitativa das diversas fracções).
Quando colocamos as proteínas do soro num campo eléctrico com meio de pH
8.6, elas comportam-se como aniões, deslocando-se para o pólo positivo (ponto
isoeléctrco (pI) da albumina = 4.5; pI g-globulina 7.5).
547
Instrumentação laboratorial clínica
Electroforese – aplicações clínicas
A revelação da electroforese por ser realizada por diferentes processos, conforme o
que se pretende evidenciar.
Exemplos
cadeias peptídicas - corante específico (azul de Coomassie R): proteinograma
fracções glucosídicas das glicoproteínas - corante para glícidos (Mac. Manus reagente de Schiff): glicoproteinograma
estruturas lipídicas das lipoproteínas - corante para lípidos (negro de Sudão):
lipoproteinograma
548
Instrumentação laboratorial clínica
Electroforese – aplicações clínicas
Proteinograma
Num proteinograma, observam-se 5
zonas de migração (bandas) em que
a mais próxima do ânodo
corresponde à albumina (menor
peso molecular e maior carga
eléctrica negativa) e as seguintes às
globulinas 1, 2, b e g,
respectivamente.
Os valores normais destas fracções
proteicas no soro (em %) são:
Albumina 50-60 %
Globulina 1 3-5 %
Globulina 2 5-10 %
Globulina b 10-15 %
Globulina g 15-20 %
549
Instrumentação laboratorial clínica
Electroforese – aplicações clínicas
Glicoproteinograma (glicidograma)
No glicidograma, observam-se normalmente 3 bandas principais, a nível das 1,
2 e b-globulinas, e mais 2 bandas menores, ao nível da seroalbumina e das globulinas.
550
Instrumentação laboratorial clínica
Electroforese – aplicações clínicas
Lipoproteinograma (Lipidograma)
No lipidograma aparecem, em condições normais, três fracções:
-lipoproteínas, situadas em geral entre a albumina e as 1-globulinas.
Correspondem a lipoproteínas de alta densidade (HDL): 20-25 %.
b-lipoproteínas, localizadas a nível das bglobulinas. Correspondem às
lipoproteínas de baixa densidade (LDL),
caracterizadas pela sua riqueza em
colesterol: 45-50%.
uma terceira zona menos constante
encontrada entre as b-lipoproteínas e a linha
de partida e que corresponde às
lipoproteínas de densidade inferior à
unidade, caracterizadas por um teor muito
elevado em triglicerídeos: 84 %.
551
Instrumentação laboratorial clínica
Electroforese – Procedimento e Instrumentação
Ilustramos aqui um procedimento de electroforese em que o meio de suporte é um
acetato de celulose, meio que continua a ser muito utilizado em laboratórios clínicos.
A tira de acetato de celulose é
saturada com a solução tampão e
é colocada no seu suporte
(“ponte”). A ponte é colocada com
ambas as extremidades em
contacto com a solução tampão.
As amostras a testar são
colocadas na tira de acetato em
locais marcados. Tipicamente
cada tira pode ser utilizada para
analisar até 8 a 10 amostras
552
Instrumentação laboratorial clínica
Electroforese - Procedimento e Instrumentação
Com este tipo de electroforese utilizam-se fontes de tensão. Um valor típico
de tensão é 250 V (corrente inicial na gama de 4 a 6 mA). A tensão é aplicada
durante 15 a 20 minutos.
O passo seguinte consiste na fixação e marcação das bandas de proteínas
de forma a poderem ser detectadas e quantificadas.
O processo de fixação e marcação
pode ser feito em exposições
separadas ou combinadas a um
fixador e a um corante. No final
deste processo a membrana é
“limpa” de forma a ficar
transparente, processo que não
afecta as bandas correspondentes
às espécies coradas. A membrana é
seca em preparação para o
processo de densitometria.
553
Instrumentação laboratorial clínica
Electroforese - Procedimento e Instrumentação
O densitómetro é um dispositivo que inclui uma fonte de luz, filtros e um
detector, tipicamente um fotodíodo. Mede-se a quantidade de luz absorvida.
O aparelho varre a trajectória de migração de uma amostra. A saída de baixa
tensão do detector é amplificada por um pré-amplificador muito estável e
integrada (filtragem de alta frequência e medição da área de baixo de pico).
Os dados são registados por um registrador x-y.
554
Instrumentação laboratorial clínica
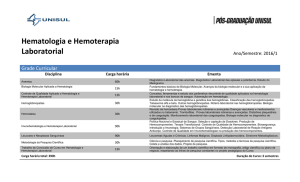
Hematologia – Conceitos básicos
Vamos discutir apenas aspectos relacionados com a medição dos constituintes
do sangue: glóbulos vermelhos (RBCs – Red Blood Cells), glóbulos brancos
(WBCs – White Blood Cells) e plaquetas.
Normalmente existem 5 tipos de WBCs no sangue periférico. Por ordem
decrescente de número no sangue de um adulto: neutrófilos, linfócitos,
monócitos, eosinófilos e basófilos.
O parâmetro básico que se pretende medir é o número de constituintes de cada
tipo por microlitro. o valor normal de RBCs por microlitro num homem adulto é
4.6 a 6.2 x 106. Para uma mulher adulta a gama de valores é de 4.6 a 5.4 x 106.
as gamas de WBCs e plaquetas são independentes do género. Para as WBCs
temos 4500 a 11000 por microlitro. Quanto às plaquetas, 150000 a 400000 por
microlitro.
O hematócrito (HCT) é o quociente entre o volume de todos os constituintes do
sangue e o volume total da amostra de sangue. É apresentado como
percentagem. As gamas normais são 40 a 54% nos homens e 35 a 47% nas
555
mulheres.
Instrumentação laboratorial clínica
Hematologia – Conceitos básicos
As gamas normais de hemoglobina (Hb) são 13.5 a 18 g/dl nos homens e 12 a
16 g/dl nas mulheres.
Um segundo conjunto de medidas destina-se a caracterizar o volume das RBCs
e a concentração da Hb. Incluem o volume corpuscular médio (MCV - Mean
Corpuscular Volume), medido em m3, a hemoglobina corpuscular média (MCH
- Mean Corpuscular Hemoglobin), medida em picogramas e a concentração
média de hemoglobina corpuscular (MCHC - Mean Corpuscular Hemoglobin
Concentration), medida em percentagem. Estas medidas constituem os
chamados índices RBC. Os valores normais são:
MCV: 82 – 98 m3
MCH: 27 – 31 pg
MCHC: 32 – 36%
556
Instrumentação laboratorial clínica
Hematologia – Conceitos básicos
Algumas das medidas que apresentámos pode ser relacionadas entre si:
MCV
10 HCT
Contagem de RBCs
MCH
10 Hb
Contagem de RBCs
MCHC
100 Hb
HCT
557
Instrumentação laboratorial clínica
Hematologia – Conceitos básicos
558
Instrumentação laboratorial clínica
Hematologia – Instrumentação
Existem duas classes principais de dispositivos para medir a características do
sangue.
Uma classe corresponde a instrumentos cujo princípio de medição é a variação
na resistência eléctrica de uma solução quando os constituintes do sangue
passam por uma abertura.
A outra classe utiliza, para fazer as medições, a deflexão de um feixe de luz
provocada pela passagem dos constituintes do sangue.
A empresa Coulter Corporation fabrica equipamentos que pertencem à primeira
destas classes. Como esta empresa é líder na venda de analisadores de
sangue vamos estudar aqui um dos seus produtos, bem representativo desta
classe de equipamentos: o Coulter STKS
559
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
560
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
561
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
A amostra é sangue
anticoagulado com EDTA. Este
anticoagulante impede a
agregação dos constituintes do
sangue que, a ocorrer, resultaria
em erros na sua contagem. O
volume da amostra deve ser
cuidadosamente medido antes
de ser introduzido no aparelho.
No diluidor I, a amostra é diluída
para 1:224 com uma solução de
osmolaridade semelhante à do
plasma. A amostra diluída é
separada: parte vai para o
diluidor II, parte vai para a
câmara de mistura e lise.
Diluting
fluid
Diluter I
WBC
stabilizing
agent
Lysing
agent
Diluter II
Lysing
and
mixing
Lysing
and
mixing
Triple
transducer WBC
bath
module
Hgb
Hemoglobinometer
RBC
bath
C
C
C
C
C
C
Analyzer computer
Laboratory
computer
system
Data
management
system
Printer
562
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
A função da câmara de mistura
e lise é preparar a amostra para
as medições do seu conteúdo
de hemoglobina e da contagem
de WBCs. o agente de lise
provoca a hemólise fazendo
com que os RBCs soltem o seu
conteúdo de hemoglobina para
a solução. As WBCs não são
alteradas pelo agente de lise.
Diluting
fluid
Diluter I
WBC
stabilizing
agent
A adição do agente de lise aumenta o
volume da amostra para 1:250. Uma
segunda substância –solução de Drabkin
– converte a hemoglobina em
cianometemoglobina, de forma a cumprir
a norma padrão de determinação da
concentração de hemoglobina.
Lysing
agent
Diluter II
Lysing
and
mixing
Lysing
and
mixing
Triple
transducer WBC
bath
module
Hgb
Hemoglobinometer
RBC
bath
C
C
C
C
C
C
Analyzer computer
Laboratory
computer
system
Data
management
system
Printer
563
Instrumentação laboratorial clínica
Vacuum (6"Hg)
Hematologia – Instrumentação: Coulter STKS
De seguida a amostra passa através do banho
de WBCs que funciona como uma cuvete para
a determinação do conteúdo de hemoglobina
por espectrofotometria.
O passo final neste processo é a contagem de
WBCs. A figura ilustra o método utilizado para
esta contagem (e para a contagem de RBCs)
Aperture
current
Internal
electrode
+
External
electrode
-
Blood
cell
suspension
Sample
beaker
Uma bomba de vácuo retira um volume controlado de
fluido do banho de contagem através da abertura.
Entre os 2 eléctrodos circula uma corrente constante,
que atravessa a abertura. Sempre que cada WBC
passa pela abertura desloca um volume de solução
igual ao seu próprio volume. Como a resistência
eléctrica do WBC é muito superior à resistência
eléctrica da solução, a passagem de WBCs pela
abertura é assinalada por picos de tensão no circuito
que liga os dois eléctrodos (amplitude = volume).
Aperture
Aperture tube
100 m
75 m
Detail of
aperture
(WBC)
564
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
Para aumentar a exactidão da
medida, o sistema utiliza 3
unidades de contagem em
WBC
stabilizing
paralelo. As unidades partilham
agent
o eléctrodo do banho de
contagem. Os eléctrodos do
tubo de abertura são individuais.
A saída de cada um destes
eléctrodos é ligada a um préamplificador. À saída do préamplificador, os impulsos são
discriminados por um discriminador
integral cujo nível foi definido na
calibração. Os impulsos acima do nível
de discriminação são processados por
um integrador que produz um sinal DC
proporcional à contagem de WBCs, ou
directamente por um contador.
Diluting
fluid
Diluter I
Lysing
agent
Diluter II
Lysing
and
mixing
Lysing
and
mixing
Triple
transducer WBC
bath
module
Hgb
Hemoglobinometer
RBC
bath
C
C
C
C
C
C
Analyzer computer
Laboratory
computer
system
Data
management
system
Printer
565
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
As saídas dos 3 contadores ou
integradores de impulsos são
enviadas para um circuito de
WBC
stabilizing
votação. Se a 3 saídas forem
agent
concordantes numa gama
especificada o processo é
validado e o resultado final
corresponde à sua média.
O passo seguinte consiste na
correcção do sinal médio de
contagem relativamente a
acontecimentos de coincidência:
passagem simultânea de 2 ou mais
WBCs pela abertura. O aparelho utiliza
análise estatística para corrigir o nível
médio de coincidências para um dado
tamanho de abertura.
Diluting
fluid
Diluter I
Lysing
agent
Diluter II
Lysing
and
mixing
Lysing
and
mixing
Triple
transducer WBC
bath
module
Hgb
Hemoglobinometer
RBC
bath
C
C
C
C
C
C
Analyzer computer
Laboratory
computer
system
Data
management
system
Printer
566
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
Examinemos agora o lado
direito do aparelho. O processo
inicia-se com uma diluição
adicional no diluidor II. Esta
segunda diluição resulta da
maior concentração de RBCs no
sangue. A contagem de RBCs
decorre num processo similar ao
da contagem de WBCs. O
aparelho classifica células
Diluting
fluid
Diluter I
WBC
stabilizing
agent
maiores do que 35.9 fl como RBCs e
regista um histograma da distribuição
dos volumes das RBCs (256 canais). O
MCV e o parâmetro RDW (coeficiente de
variação do histograma) são calculados
a partir deste histograma.
Lysing
agent
Diluter II
Lysing
and
mixing
Lysing
and
mixing
Triple
transducer WBC
bath
module
Hgb
Hemoglobinometer
RBC
bath
C
C
C
C
C
C
Analyzer computer
Laboratory
computer
system
Data
management
system
Printer
567
Instrumentação laboratorial clínica
Hematologia – Instrumentação: Coulter STKS
Células com volumes a gama de
2 a 20 fl são classificadas como
plaquetas. Os volumes destas
células são registados num
histograma de 64 canais. Este
histograma é processado para
obter o valor MPV (volume
médio das plaquetas).
Diluting
fluid
Diluter I
WBC
stabilizing
agent
Lysing
agent
Lysing
and
mixing
Lysing
and
mixing
Triple
transducer WBC
bath
module
A contagem de RBCs, e os valores de
Hb e MCV são introduzidos num
computador que calcula os valores de
HCT, MCH e MCHC usando as
equações dos slides anteriores
Diluter II
Hgb
Hemoglobinometer
RBC
bath
C
C
C
C
C
C
Analyzer computer
Laboratory
computer
system
Data
management
system
Printer
568