UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
Química Orgânica
Princípios básicos
Nomenclatura
Características
Prof. Dr. Fernando Cruz Barbieri
S.J. dos Campos - Dutra
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.1. Evolução da Química Orgânica:
• Bergmam 1777 - Dividiu a química
Compostos orgânicos: substâncias dos organismos vivos;
Compostos inorgânicos: substâncias do reino mineral.
• Gmelim 1848 - Reconhece que o carbono é o elemento fundamental dos
compostos orgânicos;
• Kekulé 1858 - Definiu que a Química orgânica é a química dos compostos
de carbono e definiu 3 postulados.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.2 Postulados de Kekulé:
1º Postulado: O carbono é tetravalente, ou seja, pode estabelecer até 4 ligações
com outros elementos;
•Apresenta 2 e 4 elétrons nas camadas K e L respectivamente;
C (Z=6)
K = 2
L = 4
2º Postulado: As 4 ligações () de um carbono são iguais, ou seja, as 4 valências são
equivalentes:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.2 Postulados de Kekulé:
3º Postulado: Os átomos de Carbono ligam-se entre si formando longas cadeias, é
a chamada propriedade de encadeamento
• Os
átomos de carbono também podem realizar ligações com átomos de outros
elementos químicos organógenos, que são os elementos químicos cujos átomos formam
os compostos orgânicos (O, P, S, N e H).
C = 4 ligações
O = 2 ligações
N = 3 ligações
S = 2 ligações
P = 3 ligações
H = 1 ligação
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.3. Tipos de ligação do carbono
1.4. Classificação dos carbono
C
l
l
Primário: – C – C
l
l
Secundário: C – C – C
l
Terciário: C – C – C
l
C
l
Quaternário: C – C – C
l
C
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.5. Hibridização dos átomos de carbono
sp3:
l
–C–
l
l
sp2: – C =
sp: = C = ou – C
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.6. Classificação das cadeias carbônicas
1.6.1 Quanto ao fechamento da cadeia
Acíclica ou alifática (aberta)
l
l
l
–C–C–C–
l
l
l
Cíclica (fechada)
H2C
ou
H2C
CH2
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.6. Classificação das cadeias carbônicas
1.6.2 Quanto a disposição dos átomos
Normal
l
l
l
Ramificada
l
l
–C–C–C–C–C–
l
l
l
l
l
1.6.3 Quanto aos tipos de ligações
l
l
l
l
l
l
l
l
l
l
l
l
l
l
l
–C–C–C–C–C
Saturada
l
CH3
Insaturada
l
l
l
l
–C–C–C–C–C–
l
l
l
l
l
l
l
–C–C=C–C–C
l
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.6. Classificação das cadeias carbônicas
1.6.4 Quanto a presença de átomos
Homogênea
l
l
l
l
l
l
–C–C–C–
Heterogênea
l
l
l
l
–C–O–C–
1.6.5 Quanto a cadeia carbônica fechada
cíclica
Aromática
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1. Princípios Básicos da química orgânica
1.6. Classificação das cadeias carbônicas
1.6.6 Quanto a cadeia aromática
Mononuclear
Polinuclear condensado
1.6.7 Quanto ao poli nuclear
Polinuclear isolado:
CH2
Núcleo – núcleo
Cadeia alifática
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.1 Introdução
•O
enorme número de compostos orgânicos existentes nos obriga a
agrupá-los em classes semelhantes, denominadas Funções Orgânicas;
• Função Orgânica é um conjunto de substâncias com propriedades químicas
semelhantes (denominadas Propriedades Funcionais);
• Com
o crescimento do número de compostos orgânicos conhecidos a
situação foi se complicando de tal modo que, os químicos, reunidos no
Congresso Internacional de Genebra (1892), resolveram iniciar uma
racionalização na nomenclatura orgânica.;
• Após
várias reuniões internacionais, surgiu a denominada Nomenclatura
IUPAC (sigla para "International Union of Pure and Applied Chemistry",
isto é União Internacional de Química Pura e Aplicada);
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.1 Introdução
• Em
função da variedade de cadeias carbônicas que podem aparecer, são muito
importantes as fórmulas estruturais, que nos revelam a estrutura, isto é, a
disposição dos átomos dentro das moléculas, como exemplos a molécula da
gasolina:
que normalmente é abreviada para:
Denominada formula condensada
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.1 Introdução
• Outra versão ainda mais simplificada da mesma fórmula seria:
Na qual a cadeia principal é representada por uma linha ziguezague.
Exemplos: hidrocarbonetos
CH3CH2CH2CH2
CH3CH=CHCH2CH3
CH3C
CCH2CH2CH2CH2CH3
CH3CH2CH2CH2
CH3CH=CHCH2CH3
CH3C
CCH2CH2CH2CH2CH3
Cada grupo C ou CH ou CH2 ou CH3 representa um vértice da linha
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.1 Introdução
• A nomenclatura IUPAC é formada por inúmeras regras, com objetivo de
se dar nomes bastantes lógicos aos compostos orgânicos, de modo que:
- Cada composto tenha um nome diferente que os distinga de todos os
demais;
- Dada a fórmula estrutural de um composto, seja possível elaborar seu
nome e vice-versa;
2.2 Nomenclatura oficial:
•A
nomenclatura oficial da IUPAC leva em consideração o número de
Carbonos, os tipos de ligações entre eles e a função a que pertencem as
substâncias o qual é composta por três partes:
- um prefixo, que indica o número de átomos presentes na cadeia;
- um infixo (intermediário), que indica o tipo de ligação entre os átomos
de Carbono, e;
- um sufixo, que indica a função a que pertence o composto orgânico.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.2 Nomenclatura oficial:
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
+
INFIXO
+
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
INFIXO
et
Apenas ligações
simples
an
3
prop
1 ligação dupla
en
4
but
5
pent
ligação tripla
in
6
hex
2 ligações duplas
dien
7
hept
3 ligações duplas
trien
8
oct
9
non
2 ligações triplas
diin
10
dec
3 ligações triplas
triin
11
unde
20
eicos
1 dupla e 1 tripla
enin
SUFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
Varia de acordo com a
terminação de cada
grupo funcional
(ex:
ol – álcool
o – hidrocarboneto
óico – ácido carboxílico
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.2 Nomenclatura oficial: exemplo
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.3 A escolha da cadeia principal:
•
Se a cadeia possuir pelo menos 1 carbono terciário ou quaternário, ela será
ramificada e haverá uma cadeia principal e uma ou mais cadeias secundárias
denominadas radicais, e essa escolha da cadeia principal é feita segundo os critérios
abaixo:
•A cadeia principal é a que possui o grupo funcional;
•A cadeia principal é a seqüência de átomos de carbono que possua o maior
número de insaturações e maior quantidade de átomos de carbono.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.3 A escolha da cadeia principal:
ERRADO, pois a cadeia tomada como principal tem
apenas SEIS átomos de carbono
a)
CORRETO, pois a cadeia tomada como principal tem
SETE átomos de carbono. Além disso, o sentido da
numeração dará ao CH3 o menor número possível
ERRADO, pois há apenas uma ramificação
b)
CORRETO, pois apesar de a cadeia agora escolhida
ter o mesmo número de átomos de carbono (6), ela é
a mais ramificada
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.4 Localização do grupo funcional e das insaturações:
• Sempre
que a cadeia carbônica permitir mais de uma possibilidade para a
localização do grupo funcional e/ou das instaurações, será necessário numerar os
carbonos, e essa numeração deverá ser feita de acordo com as seguintes regras:
•A
cadeia principal deve ser numerada a partir da extremidade
mais próxima da “característica” mais importante no composto;
•Deve se entender por “característica” um grupo funcional ou uma
insaturação, nesta ordem de importância;
•Quando
(grupo funcional > insaturação)
existir mais de uma possibilidade de localização da
insaturação, deveremos indicar o número do carbono em que a
mesma se localiza;
•A
numeração dos carbonos da cadeia deve ser iniciada da
extremidade mais próxima da insaturação;
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.4 Localização do grupo funcional e das insaturações:
•A numeração deve seguir a regra dos menores números, ou seja,
a soma dos números dos carbonos que efetivamente indicam a
localização do grupo funcional e/ou insaturações deve ser a menor
possível;
•A IUPAC recomenda que os números devem ser escritos antes do
que eles indicam;
•Separar
os números entre si por virgulas e os números das
palavras por hífen:
Nomenclatura
antiga
Atual
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.4 Localização do grupo funcional e das insaturações:
• Casos em que a numeração se faz necessário
pent – 2 – ino
hepta – 2,3,5 – trieno
propano– 1,2 – diol
Numera-se a cadeia a partir da
extremidade mais próxima da
ligação tripla. Essa ligação fica
entre os carbonos 2 e 3.
Escolhe-se o menor número.
Numera-se a cadeia a partir da
extremidade que localize as ligações
duplas com os menores números
possíveis. Para que possa soar
melhor, coloca-se a vogal a entra as
consoantes do prefixo e do sufixo.
Numera-se a cadeia a partir da
extremidade mais próxima dos grupos
funcionais. O número de grupos que se
repetem é indicado pelos radicais di, tri,
tetra, penta. As consoantes nesta caso,
são unidas pela vogal o.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.4 Localização do grupo funcional e das insaturações:
• Casos em que a numeração se faz necessário
1
hex – 2 – en – 2 - ol
Numera-se
a
cadeia
a
partir
da
extremidade mais próxima do grupo
funcional, porque o grupo funcional é a
característica mais importante de um
composto. O número deve ser escrito
preferencialmente antes daquilo que indica.
• Casos em que a numeração não se faz necessário
Como não há outra possibilidade para a
localização das ligações triplas, não é necessário
indicar por números suas localizações.
Como se trata de um ciclo, não é
necessário indicar a localização dupla
pois, qualquer que seja a sua
posição,
ela
estará
entre
os
carbonos 1 e 2.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.4 Localização do grupo funcional e das insaturações:
• Casos em que a numeração não se faz necessário
Não é necessário indicar a localização do grupo –
OH pois, qualquer que seja o número do ciclo ao
qual esse grupo estiver ligado, este carbono será
o de número 1, ( a cadeia carbônica é numerada a
partir do grupo funcional).
As fórmulas ao lado representam o mesmo
composto escrito ao contrário, não é
necessário, portanto, indicar a localização do
grupo – OH.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.5 Radicais derivados de hidrocarbonetos:
•
Como a cadeia principal é a que possui o grupo funcional, os radicais são compostos
apenas de carbono e hidrogênio e por isso são ditos derivados de hidrocarbonetos;
• Uma vez escolhida a cadeia principal, as cadeias restantes são consideradas radicais;
•O nome dos radicais deve vir antes do nome da cadeia principal e irá depender de dois
fatores:
10 Da presença ou não de insaturação
•Se o radical for saturado, o nome será:
•Se o radical for insaturado, o nome será:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.5 Radicais derivados de hidrocarbonetos:
2
0
Do tipo de carbono onde se localiza a valência livre à cadeia principal
•Nos
casos onde existem várias possibilidades para a posição da valência livre,
antes dos nomes são colocados prefixos para indicar a sua posição:
1 carbono
2 carbonos
3 carbonos
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.5 Radicais derivados de hidrocarbonetos:
2
0
Do tipo de carbono onde se localiza a valência livre à cadeia principal
•Nos
casos onde existem várias possibilidades para a posição da valência livre,
antes dos nomes são colocados prefixos para indicar a sua posição:
4 carbonos
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.5 Radicais derivados de hidrocarbonetos:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.6 Localização dos radicais na cadeia principal:
•
A localização dos radicais deve ser dada pela numeração dos carbonos da cadeia
principal, segundo as regras já estudadas no item anterior.
10 Os grupos que não pertencem à cadeia principal são os radicais;
20 A cadeia principal deve ser numerada a partir da extremidade mais próxima
da característica mais importante dos compostos;
(grupo funcional > insaturação > radicais)
30 A numeração deve seguir a regra dos menores números possíveis;
40 Se após obedecidas regras anteriores ainda restar mais de uma
possibilidade, iniciar a numeração pela extremidade mais próxima do radical;
50 Em caso de dois ou mais radicais iguais na mesma cadeia,usar os seguintes
prefixos para indicar a quantidade: di, tri, tetra ligados ao radical que se
repete.
60 Colocar os radicais em ordem alfabéticas.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.6 Localização dos radicais na cadeia principal:
•
Exemplos
Cadeia principal
4-etil-3-metil–heptano
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.6 Localização dos radicais na cadeia principal:
•
Exemplos
Cadeia principal
2-etil-3,5-dimetil–hept-1-eno
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2. Nomenclatura nos compostos orgânicos
2.6 Localização dos radicais na cadeia principal:
•
Exemplos
Cadeia principal
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1a Lista de exercícios
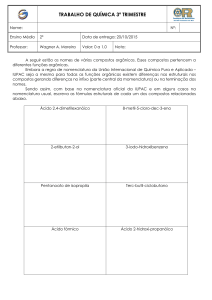
1) Complete com hidrogênio as ligações que estão faltando nos átomos dos compostos abaixo:
a)
b)
c)
2) Complete com as ligações para que as valências dos átomos envolvidos sejam satisfeitas:
a)
b)
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1a Lista de exercícios
3) Complete com hidrogênios as ligações que estão faltando nos átomos dos compostos abaixo:
a)
b)
c)
4) Classifique os átomos de carbono primários, secundários, terciários e quaternários nas
cadeias mencionadas a seguir:
a)
b)
5) Quantos átomos de carbono possui a cadeia principal da molécula representada abaixo?
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1a Lista de exercícios
6) Dê a fórmula estrutural dos seguintes radicais:
a)
b)
c)
d)
e)
f)
g)
h)
metil
etil
butil
isopropil
fenil
t-butil
iso-butil
propil
7) Os nomes dos radicais orgânicos
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
1a Lista de exercícios
8) Com relação ao composto a seguir, os nomes dos radicais ligados ao carbono terciário
são:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3. Introdução: Função orgânica é uma série de compostos que possuem propriedades
químicas semelhantes. Essa propriedades são determinadas por um grupamento
atômico em comum, chamado de grupo funcional...
3.1 Função hidrocarboneto: são compostos orgânicos formados exclusivamente
por átomos de Carbono e Hidrogênio.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.1 Nomenclatura oficial dos hidrocarbonetos:
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
+
INFIXO
+
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
INFIXO
et
Apenas ligações
simples
an
3
prop
1 ligação dupla
en
4
but
5
pent
ligação tripla
in
6
hex
2 ligações duplas
dien
7
hept
3 ligações duplas
trien
8
oct
9
non
2 ligações triplas
diin
10
dec
3 ligações triplas
triin
11
unde
20
eicos
1 dupla e 1 tripla
enin
SUFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
Terminação dos
hidrocarbonetos
o
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.2 Alcanos ou parafinas: são hidrocarbonetos acíclicos e saturados.
•Sua nomenclatura é dada utilizando o infixo AN e o sufixo O, ou seja, os nomes
dos alcanos possuem prefixo de numeração e ANO no final.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.3 Alcenos ou olefinas: são Hidrocarbonetos acíclicos contendo duplas
ligações.
• Sua nomenclatura é dada utilizando o infixo EN e o sufixo O ou seja, os nomes
dos alcenos possuem prefixo de numeração e ENO no final.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.3 Alcenos ou olefinas: são Hidrocarbonetos acíclicos contendo duplas
ligações.
• Em casos onde existem mais de uma possibilidade para a posição da dupla ligação,
é necessário indicar a sua posição, através de uma numeração.;
• O Carbono 1 é sempre o Carbono da extremidade mais próxima da dupla ligação
na cadeia, fazendo com que sejam usados os menores números possíveis.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.4 Alcinos: São Hidrocarbonetos Alifáticos Insaturados contendo triplas
ligações. Possuem nomenclatura igual a dos alcenos, porém o seu infixo é IN.
• Sua nomenclatura é dada utilizando o infixo IN e o sufixo O ou seja, os nomes
dos alcinos possuem prefixo de numeração e INO no final.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.4 Alcadienos ou dienos: são caracterizados pela presença de duas ligações
duplas em sua estrutura. Sua nomenclatura é igual ao dos Alcenos, porém utiliza antes do
infixo EN o prefixo DI, para indicar duas ligações duplas. Em sua numeração, deve-se
numerar a cadeia de tal forma que as ligações duplas tenham os menores números
possíveis.
• Sua nomenclatura é dada utilizando o infixo DIEN e o sufixo O ou seja, os nomes dos
alcadienos possuem prefixo de numeração e DIENO no final.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.4 Alcadienos ou dienos: Baseado na localização das ligações duplas em sua
cadeia, os alcadienos são classificados em: ACUMULADOS, CONJUGADOS e
ISOLADOS
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.5 Ciclanos ou cicloalcanos ou cicloparafinas: São hidrocarbonetos cíclicos
contendo apenas ligações simples. Sua nomenclatura é simples: usamos a terminação
ANO e colocamos antes do nome o prefixo CICLO, para indicar que a cadeia é
cíclica.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.6 Ciclenos ou cicloalcenos ou ciclolefinas: São hidrocarbonetos cíclicos
contendo uma ligação dupla. Sua nomenclatura é simples: usamos a terminação ENO
e colocamos antes do nome o prefixo CICLO, para indicar que a cadeia é cíclica.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.7 Aromáticos: São aqueles que possuem pelo menos um anel aromático. Não
seguem normas de nomenclatura, tendo cada um nomes próprios.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.7 Aromáticos:
Os hidrocarbonetos aromáticos são os que possuem um ou mais anéis
benzênicos ou aromáticos.
•O
hidrocarboneto aromático mais simples chama-se BENZENO e é o fundamento de toda
família aromática. Experimentalmente, verifica-se que todos os comprimentos da ligação C-C no
benzeno são iguais e que os ângulos da ligação C-C-C são de 120º;
•
Contudo, estas formas são muitos menos importantes que as de Kekulé. A molécula de
benzeno costuma representar-se assim:
C6 H 6
•O benzeno é um líquido incolor e tóxico que se encontra no alcatrão da hulha, onde se separa
pelo processo de destilação fracionada e sua formula geral é dada pela equação:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.7 Aromáticos: Para ramificados benzênicos temos regras de numeração simples. Para apenas
um radical, não é necessário indicar a posição. Para radicais iguais, o Carbono 1 é aquele que
faz com que a cadeia tenha os menores números possíveis. Para radicais diferentes, o Carbono
1 é aquele contiver o radical mais simples e a numeração deve seguir de modo a se obterem os
menores números possíveis para os outros radicais.
•Quando
o ramificado benzênico apresentar apenas dois radicais, suas posições podem ser
indicadas de outra maneira, utilizando-se prefixos:
3-etil-1-metil
Prefixo
Posições dos Radicais
orto- ou o-
1e2
meta- ou m-
1e3
para- ou p-
1e4
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.1.8 Características dos hidrocarbonetos:
• Possuem moléculas praticamente APOLARES, que se mantêm unidas por forças de Van Der
Waals;
• Possuem baixos pontos de fusão e de ebulição, comparados com os compostos polares;
• Dissolvem-se em substâncias apolares mas não são insolúveis na água, que é polar;
• São menos densos do que a água, inclusive porque suas moléculas, sendo apolares, tendem a
ficar mais distantes entre si ;
• A principal aplicação desses compostos é que eles formam toda a matéria-prima da indústria
petroquímica e fertilizantes agrícolas. São também amplamente usados como combustíveis;
• Nas condições ambientes são:
GASES
com 1 a 4 átomos de carbonos
LÍQUIDOS
com 5 a 17 átomos de carbonos
SÓLIDOS
com mais de 17 átomos de carbonos
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2a Lista de exercícios
1)
O que são hidrocarbonetos e como são classificados.
2) Como é explicada a nomenclatura segundo a IUPAC de um hidrocarboneto?
3) Para o composto orgânico a seguir formulado, aplicando a nomenclatura IUPAC, o seu nome
correto é:
4) Dê os nomes, segundo a IUPAC dos seguintes hidrocarbonetos orgânicos:
a)
d)
b)
c)
e)
f)
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
2a Lista de exercícios
g)
h)
5) Um alcano encontrado nas folhas do repolho contém em sua fórmula 64 átomos de hidrogênio.
O número de átomos de carbono na fórmula é:
6) Um alcino tem peso molecular igual a 68 u.m.a. A fórmula molecular deste alcino é:
Dados: H = 1 u; C = 12 u
7) Quantos carbonos existem no ciclano de menor peso molecular?
8) Dê as fórmulas estruturais dos seguintes compostos
a)
b)
c)
d)
e)
f)
buta-1,2-dieno
2,2-dimetil-3-isopropil-octano
4-metil-hexano
4-etil-3-metil-hep-3-eno
2,2,4-trimetil-pentano
Hepta-2,4-dieno
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.2 Álcool: É considerado álcool todo composto que tiver uma Hidroxila ou Oxidrila
(-OH) ligado a um Carbono saturado e não-aromático. Existem três sistemas de
nomenclatura: oficial, usual e Nomenclatura de Kolbe, sendo que esta última é
menos utilizada.
3.2.1 Nomenclatura oficial dos álcoois:
É dada indicando a posição da Hidroxila através de numeração (para álcoois com
mais de 2 Carbonos), o prefixo de numeração indicando a quantidade de Carbonos
presentes na molécula e o sufixo OL, que indica a função álcool.
Veja as regras em um resumo:
• O Carbono 1 será sempre o que estiver mais próximo da Hidroxila;
• Quando a Hidroxila puder estar presente em mais de um Carbono, é necessário
indicar sua posição;
• Se o álcool for ramificado, a posição dos radicais deverá ser indicada através de
numeração;
• Em álcoois insaturados, a posição da insaturação virá antes do nome do álcool e a
posição da Hidroxila virá antes do prefixo OL, separada por hífens.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.2.1 Nomenclatura oficial dos álcoois:
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
+
INFIXO
+
SUFIXO
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
INFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
et
Apenas ligações
simples
an
Terminação dos álcoois
3
prop
1 ligação dupla
en
4
but
pent
in
OL
5
ligação tripla
6
hex
2 ligações duplas
dien
7
hept
3 ligações duplas
trien
8
oct
9
non
2 ligações triplas
diin
10
dec
3 ligações triplas
triin
11
unde
20
eicos
1 dupla e 1 tripla
enin
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.2.1 Nomenclatura oficial dos álcoois:
• Quando o álcool tiver mais de uma Hidroxila, suas posições devem ser indicadas
utilizando sempre os menores número possíveis. Antes do sufixo OL deverá ser
indicada, através do prefixo di, tri, tetra, etc a quantidade de Hidroxilas presentes
no álcool. Para álcoois onde o número de Hidroxilas é igual ao número de Carbonos,
não é necessário indicar a posição das Hidroxilas;
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.2.2 Nomenclatura usual dos álcoois:
A nomenclatura usual dos álcoois, que é válida somente para álcoois saturados, é
composta de regras bem simples, mas para dominá-la é necessário saber bem a
nomenclatura de radicais. Veja como fazer:
•Antes do nome, colocar a palavra Álcool;
• Identificar o radical orgânico preso
numeração e o sufixo - ico.
à Hidroxila, utilizando o prefixo de
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.2.3 Nomenclatura de Kolbe:
A nomenclatura de Kolbe, pouco utilizada atualmente, considera o Carbono ligado à
Hidroxila como um radical chamado Carbinol e tubo que estiver ligado a ele como outros
radicais. Veja as regras:
• Considerar o Carbono ligado à Hidroxila como um radical chamado Carbinol;
• Considerar os outros Carbonos como radicais, dando os seus nomes e colocando-os antes
do nome Carbinol, em ordem crescente de complexidade;
• Em caso de dois ou três radicais iguais, usa-se o prefixo Di ou Tri respectivamente
3.2.4 Classificação dos álcoois:
•Os Álcoois são classificados de acordo com a quantidade de Hidroxilas e pelo tipo de Carbono
no qual ela está ligada. Quando possuir uma Hidroxila, será chamado de monoálcool ou monol.
Com duas, diálcool ou diol, e assim por diante. Um álcool é primário quando possui uma Hidroxila
ligada a um Carbono primário. A mesma lógica segue para Álcoois Secundários e Terciários (não
existem Álcoois Quaternários!).
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.2.5 Características dos álcoois:
• São estáveis apenas os poliálcoois que possuem os grupos
- OH ligados a carbo
no distintos. A Presença de dois ou mais grupos –OH ligados a um mesmo carbono dá
origem a uma estrutura muito instável;
•As
moléculas dos álcoois podem fazer pontes de hidrogênio entre si e com as
moléculas de água, o que explica o fato de a maioria deles ser solúvel nesse meio;
• Por serem saturados praticamente não possuem caráter ácido;
• De um modo geral, à temperatura e pressão ambientes, os álcoois
carbonos são líquidos, os demais são sólidos;
com até 12
• Os monoálcoois não aromáticos são menos densos que a água;
• Os álcoois mais simples são usados como solventes e como combustíveis. O etanol
particularmente é usado também na fabricação de bebidas.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.3 Enol: Um Enol é um Álcool que possui Hidroxila ligada a um Carbono insaturado
e não-aromático. Eles são compostos especiais porque geram espontaneamente
Cetonas ou Aldeídos, dependendo da posição da Hidroxila, num fenômeno chamado
Tautomeria.
3.3.1 Nomenclatura oficial dos enóis:
•Sua
nomenclatura é igual a dos álcoois, porém a posição da Hidroxila deve vir
indicada entre o prefixo de numeração e o sufixo OL.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.3.1 Nomenclatura oficial dos enóis:
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
et
3
prop
4
but
5
pent
6
hex
7
hept
8
oct
9
non
10
dec
11
unde
20
eicos
+
INFIXO
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
+
INFIXO
1 ligação dupla
en
SUFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
Terminação dos álcoois
OL
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.3.2 Características dos enóis:
• Os enóis possuem um fraco caráter ácido;
• São compostos instáveis, pois os elétrons
da ligação entre carbonos são
facilmente atraídos pelo oxigênio do grupo –OH, o que provoca um rearranjo na
molécula;
•A
instabilidade própria dos enóis impede que eles sejam amplamente estudados
tanto a nível de propriedades como a nível de aplicações.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.4 Fenol: Os fenóis são compostos que apresentam Hidroxila presos a Carbono
Aromáticos.
3.4.1 Nomenclatura oficial dos fenóis:
• Na sua nomenclatura, a Hidroxila é denominada Hidróxi e depois coloca-se o nome do
aromático. Caso ocorram ramificações, é necessário indicar suas posições através das
regras de nomenclatura de hidrocarbonetos cíclicos ou utilizando o Carbono 1 como o
Carbono da Hidroxila.
• Mas qual a diferença química entre um fenol e um álcool cíclico, se os dois tiverem o
mesmo número de carbonos. Os fenóis são mais ácidos que os álcoois cíclicos, isto é, os
fenóis possuem maior facilidade de liberar íons H+ (prótons) do que os álcoois cíclicos. A
explicação é dada pelo conceito de ressonância e densidade eletrônica.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.4.2 Características dos fenóis:
• As
moléculas dos fenóis podem fazer pontes de hidrogenios entre is, por isso
possuem pontos de fusão e ebulição mais elevados
que os compostos que são
apolares;
• Os fenóis mais simples são líquidos ou sólidos de baixo ponto de fusão e os demais
são sólidos;
•O
fenol comum é relativamente solúvel em água (9g / 100g H2O), devido à
formação de pontes de hidrogênio entre as moléculas desse composto e as moléculas
de água, os demais monofenóis são praticamente insolúveis;
• São mais densos que a água, possuem cheiro forte característicos. São tóxicos e
cáusticos;
• As Aplicações dos fenóis vão desde a produção de desinfetantes e medicamentos
contra queimaduras, até a fabricação de baquelita (plásticos que resiste o calor) e
de explosivos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.5 Éter: Um éter é um composto onde o oxigênio está diretamente ligado a dois
radicais orgânicos. Possuem nomenclatura oficial e usual.
3.5.1 Nomenclatura oficial dos éteres: A nomenclatura oficial dos éteres é
relativamente simples.
Nomenclatura
Veja as regras:
• O menor radical ligado ao Oxigênio é nomeado dando-se o prefixo de numeração
para radicais seguido do prefixo - óxi, que indica a presença do Oxigênio;
• O maior radical recebe o nome normal de um hidrocarboneto;
• Para nomear, utiliza-se sempre o nome da menor parte e
parte, separada por hífens.
depois o da maior
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.5.1 Nomenclatura oficial dos éteres: A nomenclatura oficial dos éteres é
relativamente simples.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.5.2 Nomenclatura usual dos éteres: A nomenclatura usual dos Éteres é semelhante a
dos Álcoois. Veja as regras:
• Antes do nome, coloca-se a palavra Éter, para indicar a função;
• Dá-se o nome do menor radical ligado ao Oxigênio;
• Dá-se o nome do maior radical ligado ao Oxigênio, seguido do prefixo - ílico. Em caso
de Éteres com duas partes iguais, apenas coloca-se o nome do radical com o prefixo Di(opcional), seguido do prefixo – ílico;
•O nome do menor radical vem primeiro, seguido do nome do maior radical, separado por
hífen.
3.5.3 Classificação dos éteres:
• Os éteres são classificados de acordo com os radicais ligados ao Oxigênio;
• Um éter é simétrico quando os dois radicais são iguais e assimétricos quando os
radicais são diferentes utilizando os exemplos anteriores.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.5.4 Características dos éteres
• As moléculas dos éteres não fazem pontes de hidrogênios entre si e polaridade,
devido à geometria angular das ligações com oxigênio, é muito fraca, por isso os
pontos de fusão e ebulição desses compostos são tão baixos como os do
hidrocarbonetos;
• Os éteres mais simples são gases, os demais são líquidos voláteis;
• São normalmente menos densos que a água;
• Por serem reativos e dissolverem muito bem a maioria dos compostos orgânicos,
são largamente utilizados como solventes inertes em reação orgânicas e na extração
de essências, óleos e gorduras de suas fontes naturais.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.6 Aldeído: É considerado Aldeído todo composto que possuir o grupo Carbonila
ligado a um Carbono primário, formando o grupo funcional que o identifica, chamado
Formila ou Aldoxila:
, que muitas vezes é abreviada como -CHO. Esse grupo
funcional estará sempre localizado numa extremidade
nomenclatura oficial e alguns possuem nomenclatura usual.
da
cadeia.
Possuem
3.6.1 Nomenclatura oficial dos aldeídos: A nomenclatura oficial destes compostos é
feita obedecendo as seguintes regras:
• O Carbono 1 será sempre o Carbono da Aldoxila. Em caso de duas Aldoxilas, o
Carbono 1 será a que der os menores números para as ramificações e depois para as
insaturações;
• O nome é dado utilizando o prefixo de numeração com o sufixo AL. Em caso de
duas Aldoxilas, usa-se o prefixo DIAL, sem necessidade de informar posição, pois
as mesmas sempre se encontram na extremidade das cadeias;
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.6.1 Nomenclatura oficial dos aldeídos:
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
+
INFIXO
+
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
INFIXO
et
Apenas ligações
simples
an
3
prop
1 ligação dupla
en
4
but
5
pent
ligação tripla
in
6
hex
2 ligações duplas
dien
7
hept
3 ligações duplas
trien
8
oct
9
non
2 ligações triplas
diin
10
dec
3 ligações triplas
triin
11
unde
20
eicos
1 dupla e 1 tripla
enin
SUFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
Terminação dos
aldeídos
AL
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.6.1 Nomenclatura oficial dos aldeídos:
Prop-2-enal
2-Etil-3-Metil-Pentanal
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.6.2 Nomenclatura usual dos aldeídos:
•Apenas
alguns Aldeídos possuem nomenclatura usual, que lhes é dada de acordo
com o Ácido Carboxílico correspondente. Veja quais são os Aldeídos com
nomenclatura usual:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.6.3 Características dos aldeídos:
• As moléculas dos aldeídos são polares devido à geometria do grupo aldoxila;
• Não fazem pontes de hidrogênio entre si, mas podem fazer com as moléculas de
água e por isso os aldeídos com até 4 carbonos são solúveis nesse meio;
• Também são solúveis em etanol, etóxi-etano e benzeno;
• Os aldeídos que possuem 1 ou 2 carbonos são gases à
temperatura e pressão
ambientes,os seguintes são líquidos e apenas os que possuem um número muito
grande de carbonos são sólidos;
• Os aldeídos mais simples são menos densos que a água;
• O metanal, dissolvido em água 40%, forma uma solução denominada formol, usada
como desinfetante e na conservação de cadáveres;
• O etanal é usado como solvente, na fabricação do etanol, do ácido acético, e do
inseticida DDT e seus derivados.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.7 Cetona: Cetonas são compostos que possuem o grupo Carbonila
ligado a um
carbono secundário (sendo abreviada para -CO-), formando o grupo funcional
onde R1 e R2 são obrigatoriamente
nomenclatura oficial e usual.
dois radicais,
iguais ou
não.
,
Possuem
3.7.1 Nomenclatura oficial das cetonas: A nomenclatura das Cetonas diz que o
sufixo utilizado para designar a função é -ONA. Veja as regras:
• Em
caso de existir mais de uma possibilidade para a posição da Carbonila, sua
posição deve ser indicada fazendo com que o Carbono 1 seja aquele que estiver na
extremidade mais próxima da Carbonila;
• Nas Cetonas com mais de uma Carbonila, o Carbono 1 é aquele que faz com que a
cadeia tenha os menores números possíveis;
• Em
Cetonas insaturadas, a posição da Carbonila deverá vir entre o prefixo de
insaturação (-en ou -in) e o sufixo que designa função (-ONA).
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.7.1 Nomenclatura oficial das cetonas:
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
+
INFIXO
+
SUFIXO
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
INFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
et
Apenas ligações
simples
an
Terminação das cetonas
3
prop
1 ligação dupla
en
4
but
5
pent
ligação tripla
in
ONA
6
hex
2 ligações duplas
dien
7
hept
3 ligações duplas
trien
8
oct
9
non
2 ligações triplas
diin
10
dec
3 ligações triplas
triin
11
unde
20
eicos
1 dupla e 1 tripla
enin
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.7.1 Nomenclatura oficial das cetonas:
3.7.2 Nomenclatura usual das cetonas: A nomenclatura usual das Cetonas parece com
a nomenclatura de Kolbe (dos álcoois). Denomina-se o Carbono da Carbonila como
Cetona e coloca-se os nomes dos radicais presos a ela. Esta nomenclatura não é
possível de ser feita em Cetonas com mais de uma Carbonila.
• A IUPAC considera como oficial o nome usual Acetona para a Propanona (Dimetil-
Cetona). No ensino médio, porém, o nome Acetona não é reconhecido como Oficial ou
Usual, devendo ser evitado seu uso.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.7.3 Classificação das cetonas:
• As Cetonas São classificadas pelos radicais ligados à Carbonila
Carbonilas.
e a quantidade de
• Uma Cetona, assim como um éter, é classificada como simétrica se os dois radicais
ligados à Carbonila forem iguais e assimétrica quando estes forem diferentes.
Utilizando os exemplos anteriores, temos:
• As Cetonas podem ser monocetonas quando tiverem uma Carbonila, dicetonas quando
tiverem duas, tricetonas com três e assim por diante.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.7.4 Características das cetonas:
• As moléculas das cetonas são polares devido à geometria angular e costumam ser
mais polares que as moléculas dos aldeídos, por isso têm pontos de fusão e ebulição
mais altos;
• As cetonas com até 1 carbonos são líquidas à pressão e temperaturas ambientes,
acima disso são sólidas;
• As cetonas mais simples são menos densa que a água, a solubilidade das cetonas
em água diminui com o aumento do número de carbonos, sendo solúvel apenas as
cetonas de cadeias acíclica com até 6 carbonos;
• As
cetonas aromáticas são insolúveis, possuem cheiro agradável e são parte
constituinte de óleos essenciais encontrados em flores e frutas;
• A propanona é a cetona mais importante em termos de aplicações. É um liquido
incolor, de cheiro agradável, inflamável, usado principalmente como solvente de
esmalte, tintas, vernizes e na extração de óleos de semente vegetais.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.8 Ácidos carboxílicos: Os Ácidos Carboxílicos são formados por uma Carboxila
(Carbonila + Hidroxila), tendo o seguinte grupo funcional:
, que geralmente é
abreviado para -COOH ou em alguns livros para -CO2H. Possuem nomenclatura
oficial e usual e numeração própria, assim como os Aldeídos.
3.8.1 Nomenclatura oficial das ácidos carboxílicos: O sufixo da função Ácido
Carboxílico é -ÓICO e o nome deve ser acompanhado da palavra Ácido. Esta
nomenclatura é igual, em regras, à dos Aldeídos. Veja:
• O Carbono 1 será sempre o Carbono da Carboxila. Em caso de duas, o carbono 1
será a que der os menores números para as ramificações e depois para as
insaturações;
• Em
caso de duas Carboxilas, usa-se o prefixo DIÓICO, sem necessidade de
informar posição, pois as mesmas sempre se encontram na extremidade das cadeias;
• Caso o Ácido seja ramificado, pode-se indicar as posições 2, 3 e 4 com as letras
gregas alfa, beta, gama e delta, respectivamente. Geralmente esta numeração é
utilizada em Ácidos com apenas uma ramificação e não é muito usada atualmente,
não podendo ser usada para indicar posição de insaturações.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.8.1 Nomenclatura oficial dos ácidos carboxílicos :
PREFIXO
NÚMERO DE
ÁTOMOS DE
CARBONO
PREFIXO
1
met
2
+
INFIXO
+
TIPO DE LIGAÇÃO
ENTRE ÁTOMOS DE
CARBONO
INFIXO
et
Apenas ligações
simples
an
3
prop
1 ligação dupla
en
4
but
5
pent
ligação tripla
in
6
hex
2 ligações duplas
dien
7
hept
3 ligações duplas
trien
8
oct
9
non
2 ligações triplas
diin
10
dec
3 ligações triplas
triin
11
unde
20
eicos
1 dupla e 1 tripla
enin
SUFIXO
TIPO DE FUNÇÃO
ENTRE A CADEIA
DE CARBONO
SUFIXO
Terminação dos ácidos
carboxílicos
ÓICO
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.8.1 Nomenclatura oficial dos ácidos carboxílicos:
Ácido 3-Metil-But-2-enóico
3.8.2 Nomenclatura usual dos ácidos carboxílicos: Alguns Ácidos Carboxílicos possuem
nomenclatura usual, que geralmente está associada a sua fonte natural. Veja quais são
os Ácidos e qual a origem de seus nomes;
• Por
motivos históricos, a IUPAC considera oficial todas as nomenclaturas acima
(exceto a do Ácido Valérico, ainda considerada usual);
• Nas escolas geralmente todos estes nomes
são utilizados como usuais. Por isso, o
uso destes nomes como oficiais deve ser evitado.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.8.2 Nomenclatura usual dos ácidos carboxílicos:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.8.3 Características dos ácidos carboxílicos:
• Da mesma forma que nos oxiácidos inorgânicos, o hidrogênio ionizável de um acido
carboxílico é aquele que está ligado ao oxigênio;
• As moléculas de ácidos são muitos polares (principalmente quando cadeia carbônica
é muito curta), podem fazer pontes de hidrogênio entre si, e por isso, possuem
altos pontos de fusão e ebulição;
• Os ácidos carboxílicos com até 9 carbonos são líquidas à pressão e temperaturas
ambientes, com 10 ou mais carbonos são sólidos brancos semelhantes à cera;
• Os ácidos alifáticos com até 4 carbonos na moléculas são solúveis em água, com 5
carbonos são parcialmente solúveis e os demais são praticamente insolúveis;
• São solúveis em etanol, etóxi-etano e benzeno. Em geral são mais densos que a
água;
• As
aplicações dos ácidos carboxílicos principalmente o metanóico e o etanóico,
abrangem: tingimento de tecidos, desinfetantes, preparação de perfumes, corantes,
seda artificial, acetona, vinagre, e a síntese de vários compostos orgânicos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
Derivados dos ácidos carboxílicos
Éster
Sal orgânicos
Anidrido
Haleto de acila
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.9 Éster: Éster é todo composto que possui um radical Acilato,
, onde R1
e R2 são radicais orgânicos, iguais ou não e R1 pode ser um átomo de Hidrogênio. O
Acilato geralmente é abreviado para – COO - ou em alguns casos CO2 - Possuem
nomenclatura oficial e usual.
3.9.1 Nomenclatura oficial dos ésteres: O prefixo que indica a função é - ATO. A
nomenclatura dos ésteres é dividida em duas partes. veja as regras:
• Contar o número de Carbonos da parte ligada ao Carbono do Acilato (incluindo o
Carbono do Acilato), dar o nome como Hidrocarboneto, colocar o prefixo - ATO e a
preposição DE;
• Caso seja necessário indicar posição de ramificações ou insaturações, o Carbono 1
é o Carbono do Acilato;
• Contar o número de Carbonos presos ao Oxigênio do Acilato e considerá-los como
um radical orgânico, dando sua nomenclatura oficial. Normalmente utiliza-se o
prefixo - ILA para estes radicais.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.9.1 Nomenclatura oficial dos Ésteres: A nomenclatura oficial dos éteres é
relativamente simples.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.9.2 Nomenclatura usual dos ésteres: A nomenclatura usual dos Ésteres é diferente
da Oficial somente na parte do Acilato. Como os Ésteres são geralmente originários da
reação entre os Ácidos Carboxílicos e os Álcoois, a nomenclatura usual destes
compostos seguem a dos Ácidos. Os Acilatos então recebem os seguintes nomes:
Assim, todos os outros Ésteres
seguem a mesma lógica de
nomenclatura. Embora a IUPAC
reconheça
como
oficial
as
nomenclaturas acima (exceto a
do Pentanoato), nas escolas e
vestibulares
elas
são
reconhecidas como usuais. Logo
seu uso como nomenclatura
oficial deve ser evitada.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.9.3 Características dos ésteres:
• Os ésteres são normalmente obtidos pela reação entre um ácido carboxílico e um
álcool;
• Suas moléculas são levemente polares mas não fazem pontes de hidrogênio entre
si, por isso seus pontos de fusão e ebulição são mais baixos que os dos ácidos
carboxílicos com mesmo número de carbonos;
• Ésteres com até 3 carbonos na moléculas são parcialmente solúveis em água, os
demais são praticamente insolúveis;
• Possuem aroma bastante agradável;
• São usados como essência de frutas
e aromatizantes na indústria alimentícia,
farmacêutica e cosmética. Constituem também óleos vegetais e animais, ceras e
gorduras.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.10 Sal orgânico: Os sais orgânicos são compostos originados da reação de uma
base inorgânica com um ácido carboxílico. Esta reação resulta em um sal orgânico e
água, como o exemplo genérico abaixo:
Onde R é um radical orgânico ou Hidrogênio e Me é um metal ou NH4 + (Amônio). O
radical destacado em azul chama-se Acilato. Os sais possuem nomenclatura oficial e
usual.
3.10.1 Nomenclatura oficial dos sais orgânicos: A nomenclatura oficial dos sais
utiliza o prefixo - ATO e é muito parecida com a dos Ésteres. Veja as regras de
nomenclatura:
• Identificar
o número de carbonos preso ao Acilato, dando nomenclatura de
Hidrocarboneto seguido do prefixo – ATO;
• Se for necessário numerar, o Carbono 1 será o Carbono do Acilato;
• Identificar o metal ou NH , colocando antes de seu nome o nome da parte do
Acilato e a preposição DE;
+
4
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.10.1 Nomenclatura oficial dos sais orgânicos:
• Se o ânion do Acilato for bivalente e dois cátions diferentes estiverem ligados a
ele, antes da preposição DE utiliza-se a palavra DUPLO e entre o nome dos cátions
coloca-se a conjunção E;
• Se o ânion do Acilato for bivalente e apenas um cátion estiver ligado a ele, antes
da preposição DE coloca-se a palavra ÁCIDO.
Nomenclatura
But-2-enoato de Lítio
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.10.2 Nomenclatura usual dos sais orgânicos: A nomenclatura usual dos sais é
diferente da oficial apenas na parte do Acilato. Assim como nos Ésteres, o Acilato
recebe o nome usual do seu ácido de origem. Assim, temos:
A IUPAC reconhece como oficial
todos os nomes usuais da
listagem acima, exceto a do
Pentanoato.
Em
escolas
e
vestibulares, entretanto, estas
nomenclaturas
são
todas
consideradas usuais e seu uso
como oficial deve ser evitado.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.10.3 Características dos sais orgânicos:
• Os
sais de ácidos carboxílicos são normalmente obtidos pela reação entre um
ácido carboxílico e uma base de Arrhenius;
• São
compostos que possuem uma parte altamente polar formada pela atração
eletrostática entre cátions e ânions e uma outra parte, a da cadeia carbônica, que
tende a ser apolar conforme o número de carbono aumenta;
• Sais de ácidos carboxílicos de cadeia longa são denominados sabões;
• Como todos os sais, são sólidos cristalinos e não voláteis;
• Os sais de ácidos carboxílicos de metais alcalinos e de amônio são
água, porém os de metais pesados são praticamente insolúveis;
• Os sais mais usados industrialmente são os derivados do ácido
isso são denominados acetatos.
solúveis em
etanóico, que por
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.11 Anidrido: Os Anidridos são originários da desidratação de duas moléculas de
Ácidos Carboxílicos. O nome da função ANIDRIDO (AN = sem, IDRO = água) já
evidencia a desidratação. Em uma reação genérica, temos:
onde R1 e R2 são dois radicais orgânicos (iguais ou não). O ácido metanóico ao
sofrer desidratação libera CO e H2O, sendo assim o único a não formar Anidrido.
Os Anidridos possuem nomenclatura oficial e usual, de acordo com os ácidos que o
originaram.
•
3.11.1 Nomenclatura oficial dos anidridos: A nomenclatura oficial dos Anidridos tem
origem na dos Ácidos que o formaram. Veja as regras:
• Antes
função;
do nome do Anidrido, colocar a palavra ANIDRIDO, para designar a
• Dar o nome da menor parte do Anidrido do mesmo jeito que se daria a um Ácido,
apenas retirando a palavra ÁCIDO do nome e depois da maior parte;
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.11.1 Nomenclatura oficial dos anidridos:
• Em Anidridos cujas partes são iguais, não é necessário repetir o nome;
• Em casos que seja necessário numerar, o Carbono 1 é sempre o Carbono
Acilato.
Nomenclatura
Anidrido Prop-2-enóico - Pentaóico
do
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.11.2 Nomenclatura usual dos anidridos: A nomenclatura usual dos Anidridos é feita a
partir da nomenclatura usual dos Ácidos que os originaram. Assim, utilizando dois dos
exemplos acima,temos:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.11.3 Características dos anidridos:
• As moléculas dos anidridos são polares e não fazem pontes de hidrogênio entre si;
• Os anidridos mais simples são líquidos à temperatura e pressão ambientes, mas a
maioria deles é sólida;
• Poucos são solúveis em água, mas são solúveis em solventes orgânicos;
• Geralmente são mais densos que a água;
• São usados em testes de laboratórios e na síntese de outros compostos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.12 Haleto de acila: São compostos formados pelo grupo funcional
, onde R é
um radical orgânico ou Hidrogênio e X é um Halogênio (Flúor, Cloro, Bromo ou Iodo).
A parte destacada em azul é chamada Radical Acila e é geralmente abreviadapara CO-. Possuem nomenclatura oficial e usual.
3.12.1 Nomenclatura oficial dos haletos de acila: A nomenclatura destes compostos
possui o sufixo de função - ILA. As regras são:
• Colocar o nome do Halogênio seguido do sufixo - ETO (Fluoreto, Cloreto, Brometo
ou Iodeto) e a preposição DE;
• Contar
o número de Carbonos da Acila e colocar o nome do Hidrocarboneto
correspondente seguido do sufixo – ILA;
• Se
for necessário numerar, o Carbono 1 é o Carbono ligado ao Oxigênio e ao
Halogênio.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.12.1 Nomenclatura oficial dos haletos de acila:
Nomenclatura
Iodeto de Prop-2-inoila
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.12.2 Nomenclatura usual dos haletos de acila: A nomenclatura usual dos Haletos
de Acila é baseada na dos Ácidos Carboxílicos. Sendo assim, temos:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.12.3 Características dos haletos de acila:
• As moléculas dos haletos de ácidos não fazem pontes de hidrogênio entre si, mas
são polares;
• Os haletos mais simples são líquidos à temperatura e pressão ambientes, só os de
cadeia muito longa são sólidos;
• São poucos solúveis em água, mas são solúveis em solventes orgânicos;
• Geralmente são mais densos que a água;
• O uso principal desses compostos é na síntese de várias substâncias
como ácidos carboxílicos, éteres e ésteres.
orgânicas,
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.13 Aminas: As aminas são compostos formados a partir da substituição dos
Hidrogênios da amônia (NH3) por radicais orgânicos. Possuem dois tipos de
nomenclatura oficial, dependendo de seu tamanho. São classificadas pela quantidade
de radicais ligados ao Nitrogênio.
3.13.1 Nomenclatura oficial das aminas: As regras de nomenclatura deste tipo de
amina é relativamente simples:
• Contar quantos radicais estão presentes na amina;
• Colocar seus nomes, em ordem do menor para
AMINA, que pode ou não ser separada por hífen;
• Radicais
o maior, seguido da palavra
iguais são indicados uma única vez precedidos pelos prefixos di ou tri
para indicar radicais iguais.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.13.1 Nomenclatura oficial das aminas:
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.13.2 Nomenclatura das aminas complexas: As regras de nomenclatura de aminas
complexas são válidas apenas quando estas forem primárias. Veja quando uma amina é
considerada complexa:
•É
impossível, através de prefixos para radicais (tais como iso-, sec-, n-, etc)
indicar a posição do radical amino (NH2);
• É impossível ou muito difícil, através de regras de nomenclatura de radicais, indicar
o nome do radical ligado ao amino;
• O radical ligado ao grupo amino é ramificado ou insaturado e não
muito difícil dar seu nome pelas regras de nomenclatura comum;
• Caso
é possível ou é
isto ocorra, o grupo amino é considerado uma ramificação de um
hidrocarboneto comum. Neste caso, o Carbono 1 é aquele que estiver mais próximo do
grupamento amino. Veja alguns exemplos:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.13.3 Características das aminas:
• As aminas possuem um caráter básico pois o nitrogênio pode oferecer um par de elétrons através de
uma ligação covalente coordenada;
• As aminas alifáticas são mais básicas que as aromáticas porque, nas aromáticas, o par de elétrons
livres do nitrogênio tende a entrar em ressonância com os elétrons do anel, o que diminui sua
disponibilidade;
• São compostos polares e, com exceção das aminas terciárias, podem fazer pontes de hidrogênio entre
si;
• As aminas que possuem de 1 a 3 radicais metil substituídas também a etilamina são gases
à pressão
e temperaturas ambientes. As aminas primarias com até 12 carbonos são líquidas, as demais são
sólidas;
•Apenas
as aminas com até 5 carbonos na molécula são solúveis na água. As demais as demais são
solúveis em solventes menos polares como o benzeno, etóxi-etano e etanol;
• As aminas alifáticas mais simples são menos densas que a água. Aminas aromáticas como a fenilamina
são mais densas;
• As
aminas em geral, são muito usadas na síntese de diversos compostos orgânicos. Entram como
ingredientes na fabricação de certos tipos de sabão e na vulcanização da borracha;
• As aminas aromáticas, como por exemplo a fenilamina, são compostos importantes na fabricação de
corantes.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.14 Amidas: As amidas são caracterizadas pelo grupo funcional
, onde R1,
R2 e R3 podem ser radicais orgânicos (iguais ou não) ou Hidrogênio. Possuem
nomenclatura oficial e usual. As amidas que possuem pelo menos um radical orgânico
R2 ou R3 ligado diretamente ao Nitrogênio são chamadas de amidas substituídas e
os radicais são chamados de radicais substituintes.
• Aquelas que possuem um radical são as monosubstituídas e as que possuem dois
radicais são as disubstituídas. As amidas que possuem mais de um radical R1-CO
não são muito comuns.
3.14.1 Nomenclatura oficial das aminas: A nomenclatura oficial das amidas utiliza o
sufixo amida para dar o nome dos compostos desta função. Veja as regras:
• Dar
o nome do Hidrocarboneto correspondente ao radical R1-CO ligado ao
Nitrogênio. Em caso de necessidade de numeração para indicar ligação dupla e/ou
insaturação, o Carbono 1 é aquele que está ligado ao Nitrogênio;
• Em amidas substituídas, é necessário indicar quais são os radicais nomeando-os e
colocando antes de cada um dos seus nomes o prefixo N-, para indicar que os
radicais estão ligados ao Nitrogênio.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.14.1 Nomenclatura oficial das amidas:
Nomenclatura
N-etil-N-metilmetanoamida
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.14.1 Nomenclatura oficial das amidas: Amidas são compostos derivados
teoricamente do NH3 pela substituição de um, dois ou três hidrogênios por radicais
acilas:
• Ao contrario das aminas, não são comuns aminas com dois ou três radicais acilas
no mesmo nitrogênio;
• No entanto, são comuns amidas com radicais alquilas ou arilas no nitrogênio:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.14.2 Nomenclatura usual das amidas: As Amidas podem ser geradas a partir dos
Ácidos Carboxílicos. Sendo assim, elas possuem nomenclatura usual parecida com a dos
Ácidos. Não é comum empregar a nomenclatura usual para amidas ramificadas, mas
também é correto usá-la para amidas substituídas. Veja então quais são as amidas que
possuem nomenclatura usual:
A
IUPAC
considera
oficial
esta
nomenclatura, exceto a da Valeramida.
Nas
escolares
e
vestibulares,
entretanto, todos estes nomes são
considerados usuais.
Deve-se prestar atenção à nomenclatura
usual das Oxalamidas substituídas.
Quando ocorrerem radicais nos dois
Nitrogênios, um deves é denominado Ne o outro N'-. Veja o exemplo:
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.14.3 Características das amidas:
• As amidas possuem um caráter básico muito mais fraco, pois o oxigênio do grupo
carbonila atrai elétrons para perto de si diminuindo a densidade eletrônica do
nitrogênio, o que dificulta à adição de prótons;
• As
amidas são bastante polares, quase tanto quanto os ácidos carboxílicos, e
podem fazer pontes de hidrogênio entre si;
• Possuem em geral pontos de fusão e ebulição elevados;
• As amidas mais simples são solúveis em água e em geral todas são solúveis
solventes orgânicos como o etanol e o etóxi-etano;
• Uma
em
amida bastante conhecida
é a uréia, que é usada na produção de
fertilizantes agrícolas e medicamentos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3a Lista de exercícios
1)
O que são e como são classificadas as seguintes funções orgânicas:
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
álcool
enól
fenol
éter
aldeído
cetona
ácidos carboxílico
éster
haleto de acila
anidrido
sais de ácidos
aminas
amidas
2) Dê os nomes dos seguintes compostos orgânicas:
a)
b)
c)
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3a Lista de exercícios
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3a Lista de exercícios
p)
s)
v)
q)
r)
t)
u)
w)
x)
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3a Lista de exercícios
3) Escreva as fórmulas estruturais dos seguintes compostos:
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
p)
q)
Ciclopentanol
6-metil-heptanol
3,5-dimetil – hidroxi-benzeno
etóxi-etano
metóxi-etano
3,5-dimetil-hidroxi-benzeno
etanoato de potássio
cloreto de formila
3,5-dimetil-hexanal
4-metil-hexan-2-ona
ácido metil-propanóico
cloreto de butanoíla
metil isopropilamina
3-metil-pentanamida
butanoato de metila
dimetil-fenil-amina
2–etil-3,3–dimetil-butanoamida.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3a Lista de exercícios
4) Considere as seguintes substâncias:
e as seguintes funções químicas:
a – ácido carboxílico.
b – álcool.
c – aldeído.
d – cetona.
e – éster.
f – éter.
A opção que associa corretamente as substâncias com as funções químicas é:
a)
b)
c)
d)
e)
I
I
I
I
I
-
d ; II - c
d ; II - c
c ; II - d
a ; II - c
c ; II - d
;
;
;
;
;
III
III
III
III
III
-
e
f
e
e
f
;
;
;
;
;
IV
IV
IV
IV
IV
-
f.
e.
a.
d.
e.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.15 Nitrocompostos: São compostos que possuem o grupo funcional – NO2,
denominado de NITRO
ou
Radical
–C
O
NO2
Radical
–C
N
O
3.15.1 Nomenclatura oficial dos nitrocompostos: nomenclatura IUPAC recomenda
o uso da palavra nitro seguida do nome do hidrocarboneto a ele ligado.
Nomenclatura
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.15.2 Características dos nitrocompostos:
• Os
nitrocompostos são substâncias muito polares, possuem, portanto, elevados
pontos de fusão e ebulição;
•Os
nitroalcanos mais simples são líquidos fluidos a temperatura e pressão
ambientes;
•À
medida que o número de carbonos aumenta vão se tornando progressivamente
mais viscosos;
• Os nitroalcanos mais simples como o nitrometano e o nitroetano são pouco solúveis
em água, os demais são praticamente insolúveis;
•São mais densos que a água;
• Os nitrocompostos normalmente possuem cheiro agradável e não são venenosos;
• Um dos derivados aromáticos mais importantes é o nitrobenzeno, muito usado
como solvente de outros compostos;
• Os compostos dinitrobenzeno e o trinitrobenzeno são sólidos explosivos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.16 Nitrilos: São compostos que apresentam o grupo funcional HCN (derivado do
ácido cianídrico) pela substituição do hidrogênio por um radical de hidrocarbonetos:
Radical
–C
N
ou
– C – CN
3.16.1 Nomenclatura oficial dos nitrilos: A nomenclatura IUPAC recomenda o uso da
palavra NITRILO após o nome do hidrocarboneto correspondente.
Nomenclatura
etano nitrilo
•O nome dos nitrilos pode também ser formado pelo nome do radical ligado ao grupo
funcional, antecedido da palavra cianeto.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.16.2 Características dos nitrilos:
• São compostos polares e possuem altos pontos de fusão e ebulição;
• De um modo geral, os nitrilos que possuem de 2 a 14 carbonos na molécula são
líquidos à temperatura e pressão ambientes, os que possuem 15 ou mais carbonos
são sólidos;
• São
praticamente insolúveis em água, todos os nitrilos são tóxicos, embora o
sejam menos que o cianeto de hidrogênio;
• Um
nitrilo importante industrialmente é o acrilonitrilo usado na fabricação de
borrachas sintéticas de alta qualidade. Os nitrilos são também muito utilizados em
sínteses orgânicas.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.17 Isonitrilos: São compostos que apresentam o grupo funcional HNC (derivado do
acido isocianídrico) pela substituição do hidrogênio por um radical de hidrocarboneto:
Radical
– C – NC
ou
Radical
–C–N
C
3.17.1 Nomenclatura oficial dos isonitrilos: A nomenclatura IUPAC recomenda o uso
da palavra NITRILO após o nome do hidrocarboneto correspondente
Nomenclatura
•O nome dos isonitrilos pode também ser formado pelo nome do radical ligado ao
grupo funcional, antecedido da palavra isocianeto.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.17.2 Características dos isonitrilos:
• São compostos muito polares. Por aquecimento, os isonitrilos se transformam em
nitrilos porque o arranjo dos nitrilos confere maior estabilidade aos átomos;
• Os isonitrilos mais simples são líquidos incolores;
• São parcialmente solúveis em água e bastante solúveis em etano e etóxi-etano;
• Possuem cheiro repugnante e são tóxicos ;
• São usados na síntese de outros compostos orgânicos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.18 Haletos: Haletos orgânicos são compostos derivados dos hidrocarbonetos pela
troca de um ou mais hidrogênio por halogênios (F, Cl, Br, I – coluna 7A).
3.18.1 Nomenclatura oficial dos haletos: Em nomenclatura comum, usam-se as
palavras cloretos, brometos, etc., seguidas do nome do radical orgânico.
Nomenclatura
• Os halogênios são representados simbolicamente pela letra X;
• Na nomenclatura IUPAC, o halogênio é considerado apenas
ramificação presa á cadeia principal.
como sendo uma
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.18.2 Características dos Haletos:
• São compostos fracamente polares, e por isso, não são muito reativos;
• Os pontos de fusão e ebulição vão se tornando progressivamente mais altos à medida que os
seguintes fatores começam a pesar:
aumento do número de carbonos
aumento do número de halogênio substituídos
aumento da massa atômica dos halogênios substituídos
• Os monohaletos com até 3 carbonos na molécula são gases ou líquidos voláteis, os demais em
geral líquidos;
• São insolúveis em água mas são solúveis em solventes orgânicos de baixa polaridade
benzeno, o etóxi-etano, e o clorofórmio (CHCl3);
como o
• De
um modo geral, os monofluoretos e os monocloretos são menos densos que água, os
monobrometos e os monoiodetos são mais densos;
• Os
haletos orgânicos usados na síntese de diversos compostos orgânicos, entre eles o
compostos de Grignard. Muitos haletos orgânicos, como clorofórmio e o tetra cloreto de
carbono, são amplamente utilizados como solventes.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.19 Compostos de Grignard: Denomina-se compostos de Grignard todo composto
orgânico que possui uma cadeia carbônica (radical) ligada ao magnésio e este, por
sua vez ligado a um halogênio: flúor, bromo, cloro
ou iodo.
Radical
– C – MgX
Onde X = F-1, Cl-1, Br-1 e I-1
3.19.1 Nomenclatura oficial dos compostos de Grignard A nomenclatura IUPAC
recomenda o uso da palavra NITRILO após o nome do hidrocarboneto
correspondente:
Nomenclatura
•A ligação carbono e magnésio é considerada predominantemente covalente, porém é
altamente polar. A ligação magnésio – halogênio é iônica.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
3. Funções orgânicas
3.19.2 Características dos compostos de Grignard:
• Os
compostos de Grignard fazem parte de uma classe de compostos
organometálicos, isto é, que possuem um metal diretamente ligado a uma cadeia
carbônica;
• A reação de síntese de um composto de Grignard é feita a partir de um haleto
orgânico com o magnésio metálico em um meio de éter-anidro.
• ex: H C- Cl + Mg H C – MgCl
• A ligação carbono-magnésio é considerada predominantemente covalente, porém é
3
3
altamente polar;
• A ligação magnésio–halogênio é iônica;
• São compostos extremamente reativos. Reagem com muitos compostos orgânicos,
com água, gás carbônico e oxigênio;
• São
largamente utilizados na síntese de vários compostos orgânicos importantes
como os álcoois e os ácidos carboxílicos.
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
Funções oxigenadas
Definição: Compostos orgânicos com a presença do O.
FUNÇÃO
Grupo funcional
Fórmula geral
Exemplo
Álcool
– OH (lig. com C saturado)
R – OH
H3C – CH2 – OH
Enol
– OH (lig. com C dupla)
R – OH
H3C = CH – OH
Fenol
– OH (lig. Com núcleo Bz)
Ar – OH
– OH
Aldeído
–C=O
H
R–C=O
H
H–C=O
H
Cetona
–C–
O
R – C – R’
O
H3C– C – CH3
O
Ácido
carboxílico
–C=O
OH
R–C=O
OH
H3C – C = O
OH
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
Funções oxigenadas
Definição: Compostos orgânicos com a presença do O.
FUNÇÃO
Grupo funcional
Fórmula geral
Exemplos
Éster
–C=O
O–
R–C=O
O – R’
H3C – C = O
O – CH3
Anidrido
– C\ = O
O
/
–C=O
R–C=O
\
O
/
R’– C = O
H3C – C = O
\
O
/
H3C – C = O
Cloreto de
ácido
–C=O
Cl
R–C=O
Cl
H3C– C = O
Cl
Sal orgânico
–C=O
O–cátion
R–C
=O
O–cátion
H3C – C
=O
ONa
Éter
–O–
R – O – R’
H3C – O – CH3
UNIVERSIDADE PAULISTA - UNIP
NUTRIÇÃO e BIOLOGIA
Funções nitrogenadas
Definição: Compostos orgânicos com a presença do N.
FUNÇÃO
Grupo funcional
Amina
Imina
Amida
Imida
– NH2; – NH; – N –
R – NH2; R – NH; R – N – R
CH3– CH2 – NH2
Amina primária
R = NH
CH3 – CH = NH
–C=O
\ NH
2
R–C=O
\ NH
2
CH3 – C = O
\
NH2
= NH
/ \
R
NH
\ /
C=O
– NO ( – N = O)
Nitro
compostos
– NO2 ( – N = O)
O
Nitrilo (cianeto)
– CN (– C N)
Isonitrilo
– NC (– N = C)
cianeto)
Exemplos
= NH
Ligado a radical diacila
(iso-
Fórmula geral
C=O
Amida primária
C=O
/ \
H2C
NH
\C /= O
R – NO
CH3 – CH2 – NO
R – NO2
CH3 – CH2 – NO2
R – CN
R – NC
CH3 – CH2 – CN
CH3 – CH2 – NC