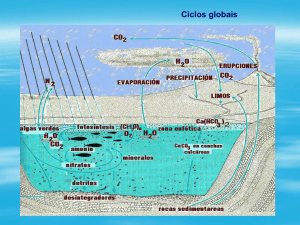
Química dos não-metais
Nome: Amanda Di Piazza Reis
Nome: Júlio César de Souza Matos
Professor: Élcio
Nº.: 14283
Nº.: 14301
EAM
Introdução
Hidrogênio
Compostos binários de H
Grupo 8A: gases nobres
Grupo 7A: halogênios
Os haletos de hidrogênio
Compostos inter-halogênios
Oxiácidos e oxiânions
Oxigênio - utilização
Ozônio
Óxidos
Peróxidos
Superóxidos
Outros elementos do Grupo 6A: S, Se, Te e Po
Sulfetos
Óxidos, oxiácidos e oxiânions de enxofre
Nitrogênio – propriedades e utilização
Óxidos e oxiácidos de nitrogênio
Processo de Ostwald
Outros elementos do grupo 5A: P, As, Sb e Bi
Carbono
Outros elementos do grupo 4A: Si, Ge, Sn e Pb
Boro
Referências bibliográficas
Hidrogênio (H)
Hidrogênio = produtor de água;
Combustível nuclear;
O universo é composto por 70% de H;
Constitui apenas 0,87% da massa da Terra;
Isótopos:
- prótio
- deutério (D): constituinte da água pesada (D2O).
- trítio: radioativo.
Composto de moléculas diatômicas;
Gás incolor, inodoro e sem sabor;
O carbono reage com o vapor d’água para
produzir uma mistura de gases H2 e CO.
O gás d’água é usado como combustível
industrial.
C(s) + H2O(g) → H2(g) + CO(g)
Utilização:
- Síntese de amônia (Processo Haber).
- Fabricação de metanol.
Compostos binários de H
Hidretos iônicos;
O hidreto de cálcio (CaH2) é usado para inflar
barcos salva-vidas, balões de previsão de tempo.
Hidretos metálicos;
Hidretos moleculares.
Grupo 8A: gases nobres
(He, Ne, Ar, Kr, Xe, Rn)
Quimicamente não-reativos;
Octeto completo de elétrons no nível de valência.
Argônio (Ar)
Neônio (Ne)
Hélio (He)
Grupo 7A: halogênios
(F, Cl, Br, I, At)
Bons agentes oxidantes;
São os mais eletronegativos;
Composto de moléculas diatômicas.
Utilização:
- Flúor (F): fluorocarbonos (usado como
refrigerantes, lubrificantes e plásticos).
- Bromo (Br): brometo de prata usado em filmes
fotográficos.
- Cloro (Cl): fabricação de compostos orgânicos,
agente alvejante na indústria de papel e tecidos,
tratamento de água para oxidar e destruir
bactérias.
- Iodo (I): sal de cozinha (KI). O iodo é essencial
para a formação da tirosina. Sua falta resulta na
formação do bócio.
Os haletos de hidrogênio
HCl, HBr e HI são ácidos fortes;
Soluções halídricas: exibem propriedades
características de ácidos, como a reação com
metais ativos para produzir gás hidrogênio;
HF torna o vidro opaco, por isso é armazenado
em recipientes plásticos ou de cera.
Compostos inter-halogênios
Moléculas formadas por átomos de diferentes
halogênios, como o ClF;
Quando os compostos inter-halogênios contêm
um átomo de halogênio em estado de oxidação
positivo, eles são extremamente reativos.
Portanto, são agentes oxidantes poderosos.
Oxiácidos e oxiânions
Oxiácidos são agentes oxidantes fortes;
Os oxiânions são formados pala remoção de H+
dos oxiácidos;
O cloreto de potássio (KCl) é usado para fazer
fósforos e fogos de artifício;
O ácido perclórico e seus sais são os mais
estáveis dos oxiácidos e oxiânions;
O perclorato de amônio (NH4ClO4) é usado como
um oxidante nos impulsionadores sólidos de
foguetes para ônibus espacial.
Oxigênio
Oxigênio = formador de ácido;
Elemento mais abundante em massa na Terra e
no corpo humano;
Agente oxidante para o metabolismo dos
alimentos;
Importante para a vida humana;
Alótropos do oxigênio:
- dioxigênio (O2)
- ozônio (O3)
Utilização do oxigênio
Agente oxidante muito usado;
Usado para remover impureza do aço;
Alvejar a polpa e o papel;
Medicina: ameniza as dificuldades de respiração.
Ozônio
Usado para tratamento doméstico da água;
Usado na preparação de medicamentos,
lubrificantes sintéticos;
Bloqueia a radiação ultra-violeta na atmosfera
superior;
Principal constituinte da névoa fotoquímica.
Óxidos
SO3(g) + H2O(l) → H2SO4(aq)
Responsável pelo chuva ácida;
Anidridos ácidos;
Anidridos básicos;
Anfóteros.
Peróxidos
Compostos contendo ligações O–O e oxigênio em
um estado de oxidação -1.
O peróxido de hidrogênio H2O2 concentrado é
uma substância perigosamente reativa, porque
sua decomposição para formar água e gás
oxigênio é muito exotérmica;
Usado como um anti-séptico leve;
Usado para alvejar tecidos.
Superóxidos
Compostos contendo ligações O–O e oxigênio em
um estado de oxidação de -1/2
O superóxido de potássio KO2 é usado como
fonte de oxigênio em máscaras utilizadas por
bombeiros.
Outros elementos do
Grupo 6A: S, Se, Te e Po
Enxofre: sua principal fonte são os grandes
depósitos no subsolo;
Processo de Frasch;
O selênio e o telúrio estão presentes em minerais
raros (Cu2Se, PbTe).
Propriedades e usos
Enxofre: amarelo, sem sabor e quase inodoro;
Insolúvel em água;
Usado na fabricação de ácido sulfúrico;
Usado para vulcanizar a borracha;
Selênio: usado nas células fotoelétricas,
medidores de luz e nas fotocopiadoras.
Sulfetos
O sulfeto de hidrogênio é o mais importante
(H2S).
Propriedades: - Odor repulsivo de ovo podre.
- Bastante tóxico.
Óxidos, oxiácidos e
oxiânions de enxofre
Dióxido de enxofre (SO2);
O ácido sulfúrico comercial é 98% de H2SO4.
Propriedades: ácido forte, bom agente
desidratante e um bom agente oxidante.
Os bissulfatos são componentes comuns dos
“ácidos secos”, usado para ajustar o pH de
piscinas e aquecedores, são também
componentes de muitos materiais de limpeza
para vaso sanitário.
Nitrogênio
O N2 constitui 78% em volume da atmosfera da
Terra;
O principal depósito natural de compostos de
nitrogênio são os de KNO3 (salitre) na Índia e
NaNO3 (salitre do Chile) no Chile e outras regiões
desérticas da América do Sul.
Propriedades do nitrogênio
Gás incolor, inodoro e sem sabor. Composto de
moléculas de N2;
Pouco reativo por causa das fortes ligações
triplas;
O N2 elementar é obtido em grande quantidades
comerciais pela destilação fracionada de ar
líquido.
Utilização do N2
Usado em embalagem de alimentos;
Fabricação de metais;
Produção de dispositivos eletrônicos;
N2(l) é empregado como um líquido
refrigerante para resfriar alimentos
rapidamente;
Usado em fertilizantes.
Composto de N2 com H2: amônia é o mais
importante.
Óxidos e oxiácidos de N2
Óxido nitroso (N2O): usado como gás propelente
em aerossóis e espumas.
Óxido nítrico(NO): constituinte principal da névoa
fotoquímica.
Dióxido de nitrogênio (NO2): constituinte da
névoa fotoquímica.
Ácido nítrico (HNO3): fabricação de NH4NO3 para
fertilizantes. Usado na produção de drogas,
plásticos e explosivos.
Ácido nitroso (HNO2).
Processo de Ostwald
1ª etapa: conversão catalítica de NH3 em NO;
2ª etapa: NO reage rapidamente com O2,
formando NO2;
3ª etapa: NO2 dissolvido em água forma ácido
nítrico (HNO3).
Outros elementos do
grupo 5A: P, As, Sb e Bi
Fósforo (P): possui vários alótropos, os mais
conhecidos são o fósforo branco e o fósforo
vermelho;
Haletos de fósforo: trialetos e penta-haletos. O
tricloreto de fósforo (PCl3) usado para preparar
sabões, detergentes, plásticos e inseticidas;
Compostos oxigenados de fósforo: óxido de
fósforo (III) (P4O6) e o óxido de fósforo (V)
(P4O10);
Os óxidos são importantes na bioquímica e como
fertilizantes.
Carbono
Constitui apenas 0,027% da crosta terrestre;
Existe em três formas cristalinas: grafite,
diamante e fulerenos.
Óxidos de carbono: monóxido de carbono e
dióxido de carbono;
Carbetos: - iônicos
- intersticiais
- covalentes
Outros compostos
inorgânicos de carbono
Cianeto de hidrogênio (HCN);
Dissulfeto de carbono (CS2).
Outros elementos do
grupo 4A: Si, Ge, Sn e Pb
O silício é o segundo elemento mais abundante,
depois do oxigênio;
Silicatos: o amianto é um termo geral aplicado ao
grupo de minerais silicato-fibrosos.
Vidro;
Silicones.
Boro
O Boro é o único elemento da família 3A que
pode ser considerado não-metálico.
Boranos são compostos contendo boro e
hidrogênio.
Referências bibliográficas
Química: A Ciência Central. / Theodore L.
Brown, H. Eugene LeMay, Jr., Brube E. Bursten.
São Paulo: Pearson Prentice Hall, 2005.