MINISTERIO DE CIÊNCIA E TECNOLOGIA – MCT
INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA - INPA
PROGRAMA INTEGRADO DE PÓS-GRADUAÇÃO EM BOTÂNICA
Crescimento e variação diurna da condutância estomática
e taxas fotossintéticas de cinco espécies
arbóreas da flora amazônica
Nilvanda dos Santos Magalhães
Manaus, Amazonas
Fevereiro, 2010
Nilvanda dos Santos Magalhães
Crescimento e variação diurna da condutância estomática
e taxas fotossintéticas de cinco espécies
arbóreas da flora amazônica
Orientado: Dr. Ricardo Antonio Marenco
Dissertação apresentada ao Instituto
Nacional de Pesquisas da Amazônia
como parte dos requisitos para a
obtenção do título de Mestre em
Botânica.
Manaus, Amazonas
Fevereiro, 2010
ii
Banca examinadora do projeto de dissertação (aula de qualificação):
1. Dr.Antonio Manzi – LBA-INPA – Mudanças climáticas.
2. Dr. Joaquim dos Santos - INPA- CPST - Manejo Florestal.
3. Dr. Kaoru Yuyama – INPA / CPCA- Plantas cultivadas.
Banca examinadora do trabalho de conclusão do curso (defesa oral):
1. Dr. Charles E. Zartaman – INPA - Botânica
2. Dra. Maria Tereza Fernadez Piedade – INPA – Max-Planck- Ecofisilogia vegetal
3. Dr. Joaquim dos Santos - INPA- CPST - Manejo Florestal
iii
FICHA CATALOGRÁFICA
M188
N952
Magalhães, Nilvanda dos Santos
Crescimento e variação diurna da condutância estomática e taxas
fotossintéticas de cinco espécies arbóreas da flora Amazônica /
Nilvanda dos Santos Magalhães. --- Manaus : [s.n.], 2010.
88 f. : il. color.
Dissertação (mestrado)-- INPA, Manaus, 2010
Orientador : Ricardo Antonio Marenco
Área de concentração : Ciências Biológicas, Agrárias e Humanas
1. Fotossíntese. 2. Características foliares. 3. Sub-bosque.
4. Variação diurna. 5. Condutância estomática. I. Título.
CDD 19. ed. 634.95
Sinopse:
Estudou-se o efeito da variação diurna da luminosidade e da
sazonalidade da precipitação no funcionamento dos estômatos, na
taxa fotossintética e no crescimento de arvoretas numa floresta de
terra-firme na Amazônia Central e avaliou-se as variações interespecíficas nas variáveis estudadas.
Palavras-chave: Características foliares, fotossíntese, sub-bosque,
variação diurna, condutância estomática.
iv
Aos minha mãe, Nilza dos Santos Magalhães,
Ao meus irmãos Márcio, Marcelo e Silvério,
Pelo amor e incentivo que recebi durante toda vida,
Ao meu esposo Darcy Rodrigues Pimentel e meu filho Dimithris dos S. M. Pimentel
Pelo amor carinho e companheirismo, compreensão e incentivo às minhas conquistas.
Com muito amor.
Dedico
v
Agradecimentos
À Deus, pela vida, saúde e por está sempre comigo.
A minha mãe Nilza dos Santos Magalhães e meus irmãos Marcio, Marcelo e Silvério,
que sempre me deram força para que mais esse sonho fosse realizado.
Ao meu esposo Darcy Rodrigues Pimentel e ao meu filho Dimithris dos Santos
Magalhães Pimentel, pelo carinho, companheirismo, compreensão durante toda esta
caminhada. Amo demais vocês.
Ao meu orientador Dr. Ricardo A. Marenco, que é muito mais que um orientador, um
amigo e que jamais deixou de acreditar em mim e me incentivar. Obrigada por tudo, pelos
ensinamentos, pela orientação e troca de experiências profissionais e de vida.
Ao Programa de Pós-graduação em Botânica do Instituto Nacional de Pesquisas da
Amazônia –INPA, em especial, a Coordenadora do Programa de Botânica, Dra. Maria Lúcia
Absy, pelo empenho em buscar o melhor para o Curso.
À Fundação de Amparo a Pesquisa do Estado do Amazonas (FAPEAM) pelo auxílio
financeiro (Projeto PIPT-1746/08) e pela concessão de bolsa de mestrado;
Aos Professores Doutores John Evans, João Domingos, Jeffrey Chambers e Lucas
Cernusak pelos valiosos comentários ao plano de trabalho.
Aos Professores Doutores Antonio Manzi, Kaoru Yuyama e Joaquim dos Santos por
aceitarem formar parte da Banca Examinadora (aula de qualificação) e pelos valiosos
comentários e sugestões que enriqueceram ainda mais o projeto de dissertação.
Aos Professores Doutores Maria Tereza F. Piedade, Charles E. Zartaman e Joaquim dos
Santos por aceitarem formar parte da Banca Examinadora (Defesa) e pelos valiosos
comentários e sugestões.
Aos colegas do Laboratório de Ecofisiologia de Árvores: Miguel Branco, Saul
Antezana, José Cintra, Keila Mendes, Helena Nascimento, Simone Verdes, Enedina, Priscila,
pelo apoio, colaboração e amizade.
As secretárias do curso de Botânica, Neide, Giselle e Jéssica pelo carinho e bom
atendimento.
A todos da Secretaria da CPST-INPA, em especial a D. Valdecira, Sr. Alcione (chefe
administrativo), Sr. Jesus e Sr. Geraldo (motoristas) por me ajudarem nesta difícil jornada.
vi
Aos pesquisadores e amigos: Dra Rosalee C. Netto, Dr. Joaquim Santos, MSc. Luiz
Alberto G. Assis pela atenção, colaboração e apoio logístico oferecido.
À equipe do Laboratório Temático de Solos e Plantas – INPA: Msc. Tânia Pena
Pimentel, Tec. Orlando F.C. Junior, Alexandre, Márcio Correa e Jonas.
Aos professores e alunos do curso de Botânica, que de alguma forma contribuíram
nesses dois anos de curso.
Enfim, a todas as pessoas que de alguma forma contribuíram direta ou indiretamente
para a realização deste trabalho.
vii
SUMÁRIO
LISTA DE TABELAS ..............................................................................................................ix
LISTA DE FIGURAS ................................................................................................................ x
RESUMO ................................................................................................................................xiii
ABSTRACT ............................................................................................................................xiv
1. INTRODUÇÃO...................................................................................................................... 1
2. OBJETIVOS........................................................................................................................... 4
2.1. Geral .................................................................................................................................... 4
2.2. Específicos........................................................................................................................... 4
3. REVISÃO BIBLIOGRÁFICA ...............................................................................................5
3.1. Dinâmica de crescimento em florestas tropicais ................................................................. 5
3.2. Relações hídricas ................................................................................................................. 5
3.3. Irradiância............................................................................................................................ 6
3.4. Area foliar específica e espessura foliar .............................................................................. 6
3.5. Nutrientes ............................................................................................................................ 7
3.6. Efeito da temperatura .......................................................................................................... 7
3.7. Fluorescência da clorofila e fotoinibição............................................................................. 7
3.8. Clorofilas ............................................................................................................................. 8
4. MATERIAL E MÉTODOS.................................................................................................... 9
4.1. Área de estudo ..................................................................................................................... 9
4.2. Espécies estudadas............................................................................................................. 10
4.3. Variáveis estudadas ........................................................................................................... 10
4.3.1. Condições ambientais ..................................................................................................... 10
4.3.2. Crescimento em diâmetro (caule) e altura da planta ...................................................... 11
4.3.3. Parâmetros das trocas gasosas ........................................................................................ 11
4.3.4. Índice de área foliar e fração de céu visível ................................................................... 14
4.3.5. Área foliar específica e espessura da folha..................................................................... 14
4.3.6. Determinação do teor relativo e do teor absoluto de clorofila ....................................... 14
4.3.7. Teor de nutrientes das folhas .......................................................................................... 15
4.3.8. Estudo da fluorescência .................................................................................................. 15
4.4. Delineamento experimental e análise estatística ...............................................................16
5. RESULTADOS E DISCUSSÃO .........................................................................................17
5.1. Condições ambientais ........................................................................................................ 17
5.2. Taxas de incremento anual em diâmetro e altura ..............................................................19
5.3. Trocas gasosas ................................................................................................................... 22
5.3.1. Fotossíntese máxima (Amax) e parâmetros da curva resposta à luz ................................ 22
5.3.2. Fotossíntese potencial (Apot) e parâmetros da curva resposta ao CO2 ............................ 26
5.3.3. Velocidade máxima de carboxilação da Rubisco (Vc-max) e taxa de transporte de elétrons
(Jmax) ......................................................................................................................................... 29
5.3.4. Efeito do horário do dia nas trocas gasosas.................................................................... 35
5.3.5 Características fotossintéticas em função da condutância estomática.............................37
5.4. Luminosidade no sub-bosque ............................................................................................ 38
5.5. Conteúdos de clorofila e nutrientes, área foliar específica, relação Fv/Fm e espessura foliar
.................................................................................................................................................. 44
6. CONCLUSÃO...................................................................................................................... 57
7. REFERÊNCIAS BIBLIOGRÁFICAS .................................................................................58
8. APÊNDICE A - Símbolos e abreviaturas mais usadas no texto.......................................... 71
9. APÊNDICE B – Curva resposta à luz em cinco espécies florestais na Amazônia Central. 72
10.APÊNDICE C – Ata da aula de qualicação e defesa oral. .................................................. 73
ANEXO (Tabela 1A)................................................................................................................ 75
viii
LISTA DE TABELAS
Tabela 1. Espécies estudadas com respectivos intervalos de altura e diâmetro das arvoretas no
início do período experimental......................................................................................10
Tabela 2. Médias dos dados climáticos do sub-bosque, observados no período do estudo.....18
Tabela 3. Incremento médio anual em diâmetro (IAD) e altura (IAA) em função da espécie e
da época do ano (seca e chuva).....................................................................................19
Tabela 4. Fotossíntese máxima (Amax), rendimento quântico aparente (Φ), ponto de
compensação à luz (Ic) em função da espécie e da época do ano (seca e chuva) .........24
Tabela 5. Condutância estomática (gs[380] ), parâmetro de convexidade (Θ) e respiração foliar
(Rd) em função da espécie e da época do ano (seca e chuva).......................................25
Tabela 6. Fotossíntese potencial (Apot), condutância estomática (gs[2000]) e ponto de
compensação de CO2 (Γ) em função da espécie e da época do ano (seca e chuva)......28
Tabela 7. Conteúdo de clorofila (a, b e a+b) em função da espécie e da época do ano (seca e
chuva)............................................................................................................................45
Tabela 8. Conteúdo de clorofila a/b, clorofila/carotenóides e no conteúdo de carotenóides em
função da espécie e da época do ano (seca e chuva).....................................................46
Tabela 9. Área foliar específica (AFE) e relação Fv/Fm em função da espécie e da época do
ano (seca e chuva).........................................................................................................48
Tabela 10. Espessura foliar fresca e desidratada em função da espécie e da época do ano (seca
e chuva).........................................................................................................................49
Tabela 11. Conteúdo de nitrogênio (N) e fósforo (P) em função da espécie e da época do ano
(seca e chuva)................................................................................................................52
ix
LISTA DE FIGURAS
Figura 1. Localização da área do estudo, Estação Experimental de Silvicultura Tropical........9
Figura 2. Precipitação mensal durante o período de estudo.....................................................17
Figura 3. Relação entre as taxas de incremento mensal em diâmetro (IMD) e altura (IMA)
com a precipitação mensal do período de estudo..........................................................20
Figura 4. Relação entre as taxas de incremento anual em diâmetro (IAD) e diâmetro inicial e
altura inicial e as taxas de incremento anual em altura (IAA) em cinco espécies nativas
da Amazônia.................................................................................................................21
Figura 5. Variação sazonal da fotossíntese saturada por luz (Amax) em cinco espécies
florestais de terra-firme na Amazônia Central..............................................................22
Figura 6. Variação sazonal da fotossíntese (Apot) de cinco espécies florestais de terra-firme na
Amazônia Central.........................................................................................................26
Figura 7. Variação sazonal da velocidade máxima de carboxilação da Rubisco (Vc-max) e taxa
de transporte de elétrons (Jmax) em cinco espécies florestais da flora amazônica ........29
Figura 8. Taxa de fotossíntese (Apot) em função da concentração de CO2 intercelular (Ci) em
cinco espécies arbóreas da flora amazônica. ...............................................................31
Figura 9. Taxa de transporte de elétrons (Jmax) em função da velocidade máxima de
carboxilação
da
Rubisco
(Vc-max)
em
cinco
espécies
florestais
da
flora
amazônica......................................................................................................................32
Figura 10. Relação entre taxa de fotossíntese (Amax e Apot) em função da velocidade máxima
de carboxilação da Rubisco (Vc-max) e taxa de transporte de elétrons (Jmax) em cinco
espécies florestais da flora amazônica..........................................................................33
x
Figura 11. Relação entre a fotossíntese potencial (Apot) com a taxa de incremento anual em
diâmetro (IAD) e altura (IAA) em cinco espécies nativas da Amazônia .....................34
Figura 12. Variação diurna da fotossíntese máxima (Amax), condutância estomática (gs[380]) e
transpiração (E) obtidos com cinco espécies florestais da Amazônia...........................35
Figura 13. Relação entre a condutância estomática (gs) e a fotossiíntese saturada por luz
(Amax), capacidade fotossintética (Apot), a velocidade máxima de carboxilação da
Rubisco (Vc-max) e taxa de transporte de elétrons (Jmax) em cinco espécies florestais da
Amazônia......................................................................................................................37
Figura 14. Relação entre a irradiância média diária no sub-bosque e a fração de céu visível
(FCV), nas épocas de chuva e de seca..........................................................................38
Figura 15. Variação sazonal do índice de área foliar (IAF) e da fração de céu visível (FCV),
nas duas épocas do ano (seca e chuva) de 2008............................................................39
Figura 16. Relação entre o índice de área foliar do dossel (IAF) e a fração de céu visível
(FCV)............................................................................................................................40
Figura 17. Fotossíntese saturada por luz (Amax), capacidade fotossintética (Apot) em função da
irradiância no sub-bosque cinco espécies florestais da Amazônia................................41
Figura 18. Relação entre irradiância no sub-bosque e a velocidade máxima de carboxilação
da Rubisco (Vc-max) e a taxa de transporte de elétrons (Jmax) em cinco espécies
florestais da Amazônia..................................................................................................42
Figura 19. Relação entre as taxas de incremento médio anual em altura (IAA) e diâmetro
(IAD) e a irradiância diária no sub-bosque...................................................................43
Figura 20. Relação entre fotossíntese potencial (Apot), velocidade máxima de carboxilação da
Rubisco (Vc-max), taxa máxima de transporte de elétrons (Jmax) e o conteúdo de
clorofila total.................................................................................................................47
xi
Figura 21. Relação entre fotossíntese saturada por luz (Amax), fotossíntese potencial (Apot),
velocidade máxima de carboxilação da Rubisco (Vc-max) e taxa de transporte de
elétrons (Jmax) e a área foliar específica (AFE) em cinco espécies florestais da
Amazônia......................................................................................................................50
Figura 22. Relação entre clorofila total, espessura foliar desidratada (EFD), e a área foliar
específica (AFE) em cinco espécies florestais da Amazônia........................................51
Figura 23. Relação entre fotossíntese saturada por luz (Amax), fotossíntese potencial (Apot),
velocidade máxima de carboxilação da Rubisco (Vc-max) e taxa máxima de transporte
de elétrons (Jmax) e conteúdo de nitrogênio (N)............................................................53
Figura 24. Relação entre clorofila total, espessura foliar desidratada (EFD) e o conteúdo de
nitrogênio (N)................................................................................................................54
Figura 25. Relação entre o conteúdo de nitrogênio (N) e fósforo (P) e a área foliar específica
(AFE) e em cinco espécies florestais da Amazônia......................................................55
Figura 26. Relação entre fotossíntese potencial (Apot), a taxa máxima de transporte de elétrons
(Jmax), a velocidade máxima de carboxilação da Rubisco (Vc-max) e o conteúdo de
fósforo (P) em cinco espécies florestais da Amazônia..................................................56
Figura 27. Taxa de fotossíntese (Amax) em função do fluxo de fótons fotossintéticamente
ativos (Q) em cinco espécies arbóreas da flora amazônica ..........................................72
xii
RESUMO
Os objetivos deste trabalho foram determinar o efeito da variação diurna no ambiente físico e
a sazonalidade da precipitação no funcionamento dos estômatos, na taxa fotossintética e no
crescimento de arvoretas numa floresta de terra-firme na Amazônia Central e avaliar as
variações inter-específicas nas variáveis estudadas. O estudo foi realizado na Estação
Experimental de Silvicultura Tropical (Núcleo ZF-2) do Instituto Nacional de Pesquisas da
Amazônia. Foram utilizadas cinco espécies arbóreas, na fase juvenil, com até 3 m de altura.
As trocas gasosas foram mensuradas com um sistema portátil de trocas gasosas utilizando-se
duas folhas por planta e três plantas por espécie. Os dados de crescimento (altura e diâmetro)
foram coletados nos anos de 2007 a 2009 e as demais variáveis foram coletadas nas épocas de
seca e chuva de 2008. A fotossíntese saturada por luz (Amax) e a fotossíntese potencial da folha
(Apot) foram medidas com luz saturante e concentração de CO2 em 380 µmol mol-1 e 2000
µmol mol-1, respectivamente, em folhas com bom aspecto fitosanitário e totalmente
expandidas. O efeito do horário do dia no movimento estomático e nas taxas fotossintéticas
(Amax) foi avaliado mediante a coleta de dados entre 06:00 e 18:00 h. Foi também determinado
os conteúdos de clorofila e de nutrientes. A fotossíntese máxima (Amax), a condutância
estomática (gs) e a transpiração (E) apresentaram forte variação diurna, com valores máximos
observados entre 09:00 e 14:00 h. Não houve efeito da época do ano (seca e chuva) nos
valores de incremento anual em diâmetro (IAD) e incremento anual em altura (IAA),
fotossíntese saturada por luz (Amax) e CO2 (Apot), velocidade máxima de carboxilação da
Rubisco (Vc-max), taxa máxima de regeneração da ribulose bisfosfato, (Jmax) e nos teores de
clorofila e nutrientes, espessura da folha, fluorescênca da clorofila (Fv/Fm) e área foliar
específica (AFE). Todavia, observou-se diferença significativa (p ≤ 0,05) entre as espécies nas
características anatômicas e fotossintéticas. Espessura foliar, Amax, Apot, Vc-max e Jmax foram
maiores em Simarouba amara. O incremento anual em diâmetro oscilou entre 0,19 à 0,80 mm
ano-1 e o incremento anual em altura variou de 0,01 à 0,10 m ano-1. A luminosidade do subbosque teve efeito positivo (p ≤ 0,05) em IAD, Amax, Apot, Vc-max, Jmax. Concluiu-se que a falta
de efeito da época do ano (seca e chuva) na capacidade fotossintética e anatômica nas
espécies estudadas pode ser devido ao fato de que durante o período estudado a estação seca
não foi tão forte a ponto de reduzir a umidade do solo a níveis que poderiam afetar
negativamente a assimilação de carbono e de outras características foliares nas espécies
examinadas. A variações na luminosidade do sub-bosque parece influenciar
significativamente o crescimento das plantas e a fisiologia foliar. Finalmente, o horário do dia
influencia significativamente as taxas fotossintéticas e a condutância estomática nas espécies
estudadas.
Palavras-chave: Amazônia Central, características foliares, fotossíntese, sazonalidade da
precipitação, crescimento de arvoretas, luminosidade no sub-bosque.
xiii
ABSTRACT
The aims of this study were to determine the effect of diurnal variation in the physical
environment and rainfall seasonality on stomatal functioning, photosynthetic rates and sapling
growth in a terra-firme rainforest in Central Amazonia, and to assess inter-specific variations
in studied variables. The study was conducted at the Tropical Forest Experimental Station
(ZF-2 reserve) of the National Institute for Research in the Amazon. I used saplings of five
tree species, up to 3 m high. Gas exchanges were measured with a portable gas exchange
system using two leaves per plant and three plants per species. Growth data (height and
diameter) were collected between 2007 and 2009, whereas the other variables were collected
in the dry and rainy season of 2008. Light-saturated (Amax) was measured in healthy and fully
expanded leaves under saturating light and a CO2 concentration of 380 µmol mol-1. Whereas
potential photosynthesis (Apot) was measured under saturating light and a [CO2] of 2000 µmol
mol-1 in the same leaves used for determining Amax. The effect of time of day on stomatal
movement and Amax was assessed by collecting data between 06:00 and 18:00 h. I also
determined chlorophyll and nutrient content of leaves. Amax, stomatal conductance (gs) and
transpiration (E) showed strong diurnal variation, with maximum values observed between
09:00 and 14:00 h. There was no effect of rainfall seasonality (dry and wet period) on the
annual increment in diameter (IAD) and height (IAA) of saplings, Amax, Apot, maximum
carboxylation velocity of Rubisco (Vc-max), maximum rate of ribulose bisphosphate
regeneration (Jmax), chlorophyll and nutrient content of leaves, leaf thickness, chlorophyll
fluorescence (Fv/Fm), and specific leaf area (SLA). However, there was a significant
difference (p ≤ 0.05) among species on anatomical and photosynthetic traits. Leaf thickness
and Amax, Apot, Vc-max and Jmax were higher in Simarouba amara. The annual increment in
diameter ranged between 0.19 and 0.80 mm year-1 and the annual increment in height
oscillated from 0.01 to 0.10 m year-1. Understory illumination had a positive effect (p ≤ 0.05)
on IAD, Amax, Apot, Vc-max, and Jmax. It was concluded that the lack of an effect of rainfall
seasonality on anatomical and photosynthetic traits of studied species may be due to the fact
that during the studied period the dry season was not so strong as to reduce soil moisture to
levels that could negatively affect carbon assimilation and other leaf traits of examined
species. Variation in understory irradiance seems to significantly influence sapling growth
and leaf physiology. Finally, the time of day significantly influences photosynthetic rates and
stomatal conductance in saplings of studied species.
Key words: Central Amazonia, leaf characteristics, photosynthesis, rainfall seasonality,
sapling growth, understory illumination.
xiv
1. INTRODUÇÃO
A vegetação e o clima coexistem em um equilíbrio dinâmico, que pode ser alterado
por pertubações diversas como desflorestamento, agricultura, pecuária intensiva, urbanização,
emissão de combustíveis fósseis e outras emissões químicas que modificam a atmosfera
enriquecendo-a com os gases do efeito estufa (Körner, 2003). Dentre estes gases, a principal
mudança ocorre na concentração do CO2. Desde o início da era industrial, a concentração
deste gás aumentou de 280 para 380 µmol mol-1, e as previsões antecipam que sua
concentração irá dobrar até a metade do século XXI (Prentice, 2001).
Na Amazônia Central pouco se sabe sobre o potencial efeito da alta concentração de
CO2 na assimilação de carbono de espécies de árvores no sub-bosque da floresta. Todavia,
tem sido amplamente discutida a relação positiva entre aumentos na concentração de CO2 na
atmosfera e aumentos nas taxas fotossintéticas e taxa de crescimento das plantas.
O
crescimento dos vegetais depende da atividade fotossintética, por sua vez a eficiência
fotossintética das plantas depende das condições abióticas (luz, temperatura, disponibilidade
de CO2, água e disponibilidade de nutrientes), além de estar associada às características
intrínsecas das plantas (Lee et al., 1996; Stuefer & Huber, 1998; Dewar et al., 1998;
Thornley, 1998). Sob esta óptica, se torna imperativo entender os processos responsáveis pela
captação do CO2 atmosférico e sua fixação na matéria orgânica, bem como os processos
responsáveis pelo acúmulo de biomassa nas plantas (que servem como estoques temporários
de carbono).
A fotossíntese é um dos principais processos que atenuam o impacto do dióxido de
carbono na atmosfera, pois ao converter o CO2 da atmosfera em carbono orgânico, a
fotossintese liga diretamente a biosfera com a atmosfera, e também liga o funcionamento das
plantas com as mudanças globais. Contudo, não se sabe ainda o quanto as mudanças
ambientais podem influenciar na capacidade fotossintética das plantas principalmente quanto
variações no regime luminoso, disponibilidade de água e de nutrientes.
A disponibilidade de luz é provavelmente o fator ambiental mais importante que afeta
o estabelecimento, o crescimento e a sobrevivência das plantas (Pooter, 2001). Os vários
estratos encontrados nas florestas tropicais, bem como os distúrbios provocados pela abertura
e fechamento de clareiras ocasionam a formação de vários gradientes de luminosidade, os
quais impõem o desenvolvimento de diferentes estratégias para a captação e otimização deste
recurso (Corrêa, 2004), como variações na estrutura foliar (Vogelmann et al., 1996; Givnish,
1988), haja vista ser este o órgão da planta que mais responde anatomicamente às variações
1
lumínicas de um determinado habitat (Dickison, 2000). Dessa forma, modificações nos níveis
de luminosidade à qual uma espécie está adaptada podem condicionar diferentes respostas
fisiológicas em suas características bioquímicas, anatômicas e de crescimento (Atroch et al.,
2001).
Variações no regime luminoso durante o crescimento normalmente levam a diferenças
nas taxas de fotossíntese (A), em razão das diferenças na velocidade máxima de carboxilação
da rubisco (Vc-max) e na taxa máxima de regeneração da ribulose bisfosfato, RuBP (Jmax),
dependente do transporte de elétrons, bem como das diferenças nas taxas de difusão de CO2
para os cloroplastos (Bjorkman, 1981). Segundo Farquhar et al., (1980), o valor de A
representa o valor mínimo de dois fatores limitantes: a atividade da rubisco (Ac) e a taxa de
regeneração da RuBp (Aj) . Isto é, A = min { Ac, Aj}- Rd em que Rd indica a taxa de respiração
da folha na presença de luz.
A resposta da fotossíntese à irradiância é comumente descrita por uma hipérbole não
retangular que inclui os parâmetros teta (Θ) e fi (Φ), em que teta (Θ) representa a
convexidade da curva e fi (Φ) o rendimento quântico máximo (Ogren, 1993). Em condições
naturais, A é geralmente limitada pela luz, por isso Φ e Θ são parâmetros importantes. Em
plantas C3 em concentração de CO2 ambiente, Φ é uma função dessa concentração nos
espaços intercelulares (Ci) e pode ser diminuído pela alta irradiância devido à fotoinibição.
Em alta irradiância as folhas absorvem mais energia radiante do que a capacidade de
processamento do aparato fotossintético, podendo o excesso de energia radiante levar a
fotoinibição da fotossíntese, ou seja, redução nos valores de Φ (Choudhury & Behera, 2001;
Demmig-Adams & Adams, 2006). A irradiância excessiva, estresse hídrico e aumentos na
temperatura (aumento na fotorrespiração) podem também levar a decréscimos em Φ.
Além da luminosidade existem outros fatores que induzem a planta a criar estratégias
para a sua sobrevivência, entre eles a exigência de nutrientes e a disponibilidade hídrica. Para
as florestas tropicais são poucos os estudos que investigam a concentração de nutrientes
foliares. A análise de nutrientes foliares tem-se mostrado bom indicador do estresse
nutricional de várias espécies, especialmente por comparação de plantas com pouco e ótimo
suprimento de nutrientes (Malavolta, 1980). A concentração de nutrientes foliares varia de
acordo com a sazonalidade e com a idade da folha (Sobrado & Medina, 1980; Marin &
Medina, 1981), com a luz disponível (Drechsel & Zech, 1991), lixiviação (Waring &
Schlesinger, 1985; Marschner, 1986) e com o tipo de solo florestal (Vitousek & Stanford,
1986; Thompson et al., 1992). Em alguns ecossistemas florestais as folhas jovens tendem a ter
2
maiores concentrações de N, P e K. À medida que as folhas envelhecem, ocorre diminuição
destes nutrientes, enquanto as concentrações de Ca, Mg e Fe aumentam, em função dos
processos de translocação dos nutrientes e do acúmulo dos produtos fotossintéticos na folha
(Binkley, 1986; Marin & Medina, 1981).
O regime hídrico também pode afetar a taxa de crescimento e as oscilações em
diâmetro da planta ao longo do ano. As variações no teor de água da planta podem afetar o
diâmetro das árvores ao alterar a hidratação da madeira ou do súber (Simonneau et al., 1993).
Além disso, a baixa umidade no solo leva à diminuição gradual da fotossíntese pela maior
resistência à fixação do CO2 em decorrência do fechamento dos estômatos (Marenco &
Lopes, 2009).
Os estômatos são constituídos por duas células-guarda. Isto é, o poro estomático está
situados entre essas duas células especializadas, as quais controlam a abertura e fechamento
do mesmo. Os estômatos são regulados por estímulos que maximizam a absorção de CO2 e
minimizam as perdas de vapor de água pela transpiração, em um processo de interação entre
diversos fatores endógenos e exógenos. Podem responder de uma forma rápida aos estímulos
do meio, sendo um mecanismo de controle das interações entre a planta e o meio ambiente
(Assmann, 1993). Quando o potencial hídrico foliar diminui, os estômatos se fecham mesmo
em condições ótimas de luz, temperatura e CO2. Portanto, o movimento estomático é baseado
na turgescência das células-guarda. Os estômatos permanecem abertos em folhas com baixo
nível de estresse hídrico e se fecham com um moderado ou severo déficit hídrico, podendo
abrir-se quando for restituído o fluxo de água da folha (Larcher, 2000).
Poucos estudos têm sido feitos para caracterizar o funcionamento dos estômatos ao
longo do dia em árvores da Amazônia (Costa & Marenco, 2007). A maioria dos trabalhos
efetuados com árvores tropicais têm avaliado o desempenho estomático e fotossíntetico em
condições estáticas, ou seja, com mensurações realizadas em determinados horários durante o
dia, fornecendo pouca informação sobre como estes dois parâmetros (gs, Amax) se relacionam
com variáveis ambientais (irradiância, temperatura, velocidade do ar).
Assim sendo, os objetivos desta pesquisa foram determinar o efeito da variação diurna
no ambiente físico e a sazonalidade da precipitação no funcionamento dos estômatos, na taxa
fotossintética e no crescimento de arvoretas numa floresta de terra-firme na Amazônia Central
e avaliar as variações inter-específicas nas variáveis estudadas. Neste estudo, considerou-se a
premissa que a sazonalidade da precipitação e da luminosidade têm influencia direta nas
trocas gasosas e que espécies do mesmo grupo sucessional e até ecótipos da mesma espécie
reagem de igual forma às alterações na irradiância do entorno.
3
2. OBJETIVOS
2.1. Geral
Os objetivos deste trabalho foram determinar o efeito da variação diurna no ambiente
físico e a sazonalidade da precipitação no funcionamento dos estômatos, na taxa fotossintética
e no crescimento de arvoretas numa floresta de terra-firme na Amazônia Central e avaliar as
variações inter-específicas nas variáveis estudadas.
2.2. Específicos
9 Determinar o efeito do horário do dia nos parâmetros de trocas gasosas, bem como
determinar a relação entre fotossíntese e condutância estomática (A/gs);
9 Determinar o efeito da variação inter-específica nas características fotossintéticas de
arvoretas em uma floresta de terra-firme na Amazônia Central;
9 Determinar o efeito da sazonalidade da precipitação nas características fotossintéticas
de arvoretas em uma floresta de terra-firme na Amazônia Central;
9 Determinar o efeito da sazonalidade da precipitação no incremento em altura e
diâmetro das arvoretas durante o intervalo de dois anos;
9 Determinar o efeito da luminosidade disponível no sub-bosque no incremento em
diâmetro e altura das arvoretas;
9 Determinar o efeito da capacidade fotossintética da folha no incremento em diâmetro e
altura das arvoretas;
9 Determinar a relação entre os teores de clorofila, nitrogênio, fósforo, área foliar
específica, fração de céu visível (FCV) e as taxas de fotossíntese, Vc-max e Jmax da
folha.
4
3. REVISÃO BIBLIOGRÁFICA
3.1. Dinâmica de crescimento em florestas tropicais
O crescimento da planta é o resultado da diferença entre os ganhos de carbono, via
fotossíntese, e as perdas de carbono (por respiração, liberação de compostos carbonados
voláteis, produção de exsudatos). Na Amazônia Central as árvores apresentam um
crescimento mais lento do que em outras florestas tropicais, variando o crescimento em
diâmetro entre 1 e 2 mm por ano (Vieira et al., 2005). Árvores na fase juvenil, por outro lado,
crescem a taxas ainda menores do que árvores adultas, assim, árvores jovens podem levar até
150 anos para atingir o dossel da floresta (Clark & Clark, 1992). Mudanças nas taxas de
acumulação de carbono das árvores tropicais podem ocorrer por variações no ambiente físico
(Clark & Clark, 1994), dentre os quais podemos mencionar a disponibilidade de luz (Chazdon
& Fetcher, 1984), disponibilidade de água (Lewis et al., 2004) e provavelmente pode também
ser limitado pela quantidade de CO2 disponível na atmosfera (Lloyd & Farquhar, 2008).
A mensuração do crescimento das plantas é importante por que: primeiro, o
crescimento da planta integra efeitos ambientais nos processos fisiológicos primários
(fotossíntese e respiração); segundo, muitos estudos têm mostrado que parâmetros, tais como
sobrevivência, capacidade competitiva e reprodução, são fortemente correlacionados com
tamanho da planta (Fetcher et al., 1994).
3.2. Relações hídricas
A água é um componente essencial na reação fotossintética. Escassez de água ou seca
extrema na atmosfera e no solo criam um estresse hídrico que afeta a eficiência da reação
fotossintética na planta. O estresse de umidade afeta a fotossíntese através de um grande
número de mecanismos: por afetar o nível dos metabólicos intermediários, por inibir o
sistema de transporte de elétrons fotossintéticos, por causar fechamento dos estômatos e por
alterar a taxa de respiração.
Uma influência direta da disponibilidade de água na fotossíntese é através do impacto
sobre a abertura estomatal (Marenco & Lopes, 2009). Como os estômatos fecham em resposta
ao estresse, a resistência para a difusão do CO2 dentro das folhas aumenta. Assim, quando o
estresse de umidade do solo aumenta a taxa fotossintética ótima é atingida em irradiâncias
mais baixas; no entanto, quando o estresse de umidade do solo é baixo e com pouca demanda
evaporativa da atmosfera a fotossíntese continua a aumentar mesmo em altas irradiâncias.
5
Baixa umidade do ar reduz a fotossíntese, provavelmente devido à indução de rápida
evaporação que reduz o turgor nas células guarda causando o fechamento dos estômatos.
3.3. Irradiância
A luz é um dos fatores ambientais que mais limita o crescimento, a sobrevivência e a
reprodução das plantas. No entanto, nem toda a radiação fotossinteticamente ativa (RFA), que
compreende comprimento de onda de 400 a 700 nm, incidente no dossel da floresta é
interceptada ou absorvida pelas folhas, pois ao atingir a lâmina foliar uma fração é refletida
para a atmosfera e outra é transmitida, dependendo de fatores da planta e do ambiente. A
radiação que será absorvida pela planta é determinada pelo índice de área foliar (IAF). O IAF
é definido como a área foliar do dossel integrada por unidade de superfície projetada no solo,
m2/m2 (Watson, 1947) e está relacionado com a interceptação da água no dossel, trocas
gasosas e a radiação no sub-bosque da floresta.
Do ponto de vista fotossintético, as respostas da planta a variações na irradiância
ocorrem muito rapidamente. A fotossíntese (A) aumenta com a irradiância até atingir o ponto
de saturação por luz (Is), em que o aumento na luminosidade não causa aumento na taxa de
fotossíntese. Entre a irradiância de saturação (Is) e a escuridão, está a irradiância de
compensação (Ic) fase em que a fotossíntese bruta apenas compensa as perdas de CO2 por
respiração, sendo a fotossíntese líquida igual à zero. A irradiância de compensação varia de
acordo com a espécie, com as condições ambientais e com a densidade de fluxo de luz durante
o crescimento da planta, concentração de CO2 e a temperatura (Boardman, 1977).
3.4. Area foliar específica e espessura foliar
A área foliar específica é importante para avaliação de trocas gasosas com a atmosfera.
Estudos mostram que geralmente a área foliar específica (AFE) responde de forma variada às
condições ambientais; porém, há um padrão similar encontrado na maioria dos estudos, em
que a AFE é influenciada principalmente pela disponibilidade de luz no ambiente (Poorter,
1999). Alguns trabalhos têm mostrado que em baixa luminosidade a espessura da folha tende
a diminuir enquanto que a área foliar tende a aumentar, como uma estratégia para assegurar
de maneira mais eficiente a captura de luz em baixas intensidades luminosas (Dale, 1988;
Jones & McLeod, 1990).
6
3.5. Nutrientes
A baixa disponibilidade de alguns nutrientes, como N e P, assim como as adaptações
das plantas a estes baixos níveis têm recebido especial atenção, principalmente nos trópicos
(Chapin III, 1980; Jordan, 1985; Medina et al., 1990; Drechsel & Zech, 1991; Bergmann et
al., 1994; Turner et al., 1995; Kapelle & Leal, 1996; Aerts & Chapin III, 2000). A
disponibilidade de nutrientes minerais influencia indiretamente a fotossíntese através do seu
efeito no crescimento da planta. Um suprimento inadequado de nutrientes minerais (N, Mg,
Fe) produz redução no teor de clorofila, manifestada por uma clorose foliar cuja intensidade
depende do grau de deficiência e da mobilidade do elemento na planta. Assim, a clorose pode
aparecer nas folhas mais velhas quando o íon carente é móvel (N, K, Mg), ou nas novas se ele
é pouco móvel (Fe, Mn, Zn) (Epstein, 1972).
3.6. Efeito da temperatura
Os efeitos da temperatura nos processo fisiológicos da planta podem ser classificados
em efeitos diretos, ocorrendo nos processos fotossintéticos (Berry & Bjorkman, 1980), e
indiretos, alterando o funcionamento dos estômatos. Altas temperaturas podem levar ao
fechamento dos estômatos, ao provocar aumentos na concentração de CO2 na câmara
subestomática, seja por aumento na respiração ou pela redução na atividade fotossintética
(Salisbury & Ross, 1992). No entanto, os efeitos da temperatura na fotossíntese dependem
principalmente da espécie e das condições ambientais durante o crescimento da planta,
havendo, portanto, uma ampla variação na temperatura ótima de diferentes grupos de plantas
(Feller et al., 1998; Marenco & Lopes, 2009).
3.7. Fluorescência da clorofila e fotoinibição
A fluorescência é, no entendimento físico, a re-emissão de fótons em um comprimento
de onda maior daquele que incidiu na folha, podendo dissipar entre 1 a 3% da energia
recebida pela planta (Muller et al., 2001). Assim, a intensidade da fluorescência pode ser
determinada expondo a folha a um determinado comprimento de onda e medindo a
quantidade de luz re-emitida em um comprimento de onda maior. Alguns parâmetros são
importantes na medição da fluorescência, a fluorescência máxima (Fm), a fluorescência
mínima (F0) e a relação Fv/Fm. O rendimento quântico máximo do fotossistema II pode ser
obtido ao se determinar a razão entre a fluorescência variável e a fluorescência máxima,
7
representada por Fv /Fm, enquanto que os valores de F0 parecem ser muito úteis para se inferir
sobre a ocorrência de fotoinibição crônica ou dinâmica (Dias & Marenco, 2006).
A
fotoinibição é um estado de stress fisiológico que ocorre em todos os organismos
fotossintetizantes que liberam oxigênio quando expostos à luz. Segundo Long et al. (1994) a
fotoinibição é a redução da fotossíntese lentamente reversível que após uma exposição
prolongada a luz pode levar a redução da fotossíntese máxima A fotoinibição pode ser
exacerbada via redução da capacidade fotossintética induzida por estresses ambientais, tais
como alta temperatura da folha e déficit hídrico, sendo que nos trópicos, a luz do sol pode
aumentar a temperatura da folha acima de 40 ºC. Adicionalmente, danos causados pela alta
temperatura no FSII podem ser inferidos a partir da medição do valor de F0 (Kitao et al.,
2000). Dependendo do tempo que uma planta leva para se recuperar da fotoinibição, esta pode
ser dinâmica (a planta se recupera do estresse radiativo durante a noite) ou crônica, a planta
leva vários dias para se recuperar do estresse fotoinibitório em condições de baixa
luminosidade (Castro et al., 1995).
3.8. Clorofilas
As clorofilas são responsáveis pela captura da radiação luminosa, que finalmente leva
a formação de ATP e NADPH e por essa razão são estreitamente relacionadas com a
eficiência fotossintética das plantas e consequentemente, ao crescimento e a adaptabilidade a
diversos ambientes (Almeida et al., 2004).
Presentes nos vegetais superiores sob as formas a e b, as clorofilas são
constantemente sintetizadas e destruídas, em processos influenciados por fatores internos e
externos as plantas. Entre os fatores externos, os nutrientes minerais se destacam, por
integrarem a estrutura molecular das plantas, como também por atuarem em alguma etapa das
reações que levam à síntese desses pigmentos.
As concentrações de clorofilas podem variar com o ambiente luminoso em que a
planta está adaptada. Em condições de baixa luminosidade (plantas de sombra) apresentam
maior concentração de clorofila por unidade de área do que folhas de sol (Boardmann, 1977,
Oguchi et al., 2005). Assim, uma planta com alto conteúdo de clorofila é potencialmente
capaz de atingir taxas fotossintéticas mais altas (Chappelle & Kim, 1992).
8
4. MATERIAL E MÉTODOS
4.1. Área de estudo
O estudo foi realizado na Estação Experimental de Silvicultura Tropical (Núcleo ZF2),
área de Pesquisa da Coordenação de Pesquisa em Silvicultura Tropical (CPST) do Instituto
Nacional de Pesquisas da Amazônia (INPA), localizada à 60 km a noroeste de Manaus (02º
36’ 21” Sul, 60º 08’ 11” Oeste) (Figura 1).
Área do estudo
Torre
60 km
INPA-V8
Manaus
Figura 1. Localização da área do estudo (Estação Experimental de Silvicultura Tropical –
Núcleo ZF-2 (02º 36’ 21” Sul, 60º 08’ 11” Oeste).
A região apresenta características de clima equatorial úmido, com duas épocas do ano
distintas: uma com precipitação elevada (de outubro a junho) e outra com baixa precipitação
(50 a 100 mm de chuva por mês – denominada estação seca) de julho a setembro. A
temperatura média anual é de 26,7 ºC, apresentando valores médios para as máximas e
mínimas de 31,2 ºC e 23,5 ºC, respectivamente. A precipitação anual é de 2.240 mm (Instituto
Nacional de Metereologia, INMET, média de 1961 a 1990) e a umidade relativa apresenta
uma média anual de 84%, variando de 77% a 88%. A vegetação da região é constituída por
uma floresta densa de terra firme (Higuchi et al., 1997) e os solos são classificados como
latossolos, com baixa fertilidade e alta acidez (Ferraz et al., 1998).
9
4.2. Espécies estudadas
No estudo foram selecionadas cinco espécies de plantas de importância econômica e
ecológica na fase juvenil (Tabela 1), com até três metros de altura. As repetições foram
formadas por três arvoretas por espécie, estando cada amostra em diferentes microambientes
dispersos ao longo das trilhas. Nestas espécies os dados de crescimento de árvores foram
coletados nos anos 2007 a 2009, e os parâmetros de trocas gasosas e características
anatômicas foram coletados na época de seca e chuva, tendo como referência os meses de
agosto e dezembro de 2008.
Tabela 1. Espécies estudadas com respectivos intervalos de altura e diâmetro das arvoretas no
início do período experimental (janeiro de 2007).
Olacaceae
Altura
Inicial (m)
0,92 a 1,57
Diâmetro
inicial (mm)
4,33 a 9,49
2-Guateria olivacea
Annonaceae
1,04 a 1,51
6,61 a 8,33
3-Rinorea guianensis
Violaceae
0,92 a 1,45
5,35 a 13,0
4-Simarouba amara
Simaroubaceae
0,87 a 1,00
6,69 a 8,42
5-Duroia saccifera
Rubiaceae
0,79 a 2,37
5,15 a 14,0
Espécies
Família
1-Minquartia guianensis
4.3. Variáveis estudadas
4.3.1. Condições ambientais
Foram realizadas coletas de dados de irradiância, temperatura e umidade do ar
utilizando sensores específicos conectados a um datalogger (Li-1400, Li-Cor, NE, EUA)
adicionalmente foi medida a precipitação com um pluviômetro convencional instalados em
uma torre de observação a 40 metros de altura, a 3,3 km da área do estudo. Instalou-se
equipamento similar (medidor de irradiância, temperatura e umidade) na área do estudo. As
coletas dos dados climáticos foram realizadas a uma freqüência semanal. A irradiancia do
sub-bosque foi estimada multiplicando-se a média de irradiância total (acima do dossel) pela
fração de céu visível do microsítio de cada arvoreta. Para os meses que não foram realizadas
as coletas de precipitação, devido a problemas técnicos, utilizou-se dados da CEPLAC
(Comissão Executiva do Plano da Lavoura Cacaueira, 02° 33´ 45” S, 60° 01´57” O), sendo a
estação metereológica mais próxima da área do estudo. Nas épocas de seca e chuva foi
10
também determinada a umidade do solo gravimetricamente como a relação: (Su – Sc)/Su, em
que Su e Sc representam à massa do solo úmido e seco, respectivamente.
4.3.2. Crescimento em diâmetro (caule) e altura da planta
As coletas dos dados em diâmetro e altura foram realizadas mensalmente. Para o
diâmetro, as medidas foram realizadas a uma altura de 50 cm acima do nível do solo, nos
sentidos norte-sul e leste-oeste, para obtenção do valor médio do diâmetro do caule, com
auxílio de um paquímetro digital (precisão de 0,01 mm). A altura foi medida utilizando-se
uma trena com precisão de 1 mm. As taxas de incremento médio anual e mensal em diâmetro
e altura foram determinadas utilizando as seguintes equações:
IMD = (D1 – D0)/t
Equação (1)
IAD = (D1 – D0)/t
Equação (2)
Onde, IMD, incremento mensal em diâmetro (mm); IAD, incremento anual em
diâmetro (mm), D1, corresponde ao diâmetro final, D0 diâmetro inicial; t, corresponde ao
tempo em meses (Equação 1) ou anos (Equação 2).
IMA = (A1 – A0)/t
Equação (3)
IAA = (A1 – A0)/t
Equação (4)
Em que, IMA, incremento mensal em altura (m); IAA, incremento anual em altura
(m); A1, corresponde a altura final; A0, diâmetro inicial, dividido pelo tempo (t, em meses
para Equação 3 ou anos para Equação 4).
4.3.3. Parâmetros das trocas gasosas
Para a realização das medições de trocas gasosas (taxa de assimilação de CO2 ,
transpiração e condutância estomática) foi utilizado medidor de fotossíntese (LI-6400, Li-Cor,
Lincoln, EUA), com controle independente de luz (Li-6400-02B) e CO2 (6400-01). Antes das
coletas destrutivas foram realizadas curvas da taxa de assimilação líquida de CO2 (A) em
função do fluxo de fótons fotossinteticamente ativos (curvas resposta à luz) e em função da
concentração de CO2 (curvas resposta ao CO2) na mesma folha. As medições de trocas
gasosas foram realizadas em três plantas por espécie e duas a quatro folhas por planta com
bom aspecto fitossanitário e totalmente expandidas.
11
Antes da construção das curvas resposta à luz [curva A(Q)] e ao CO2 [curva A(Ci)] e
medição dos outros parâmetros fotossintéticos, foi medido a condutância estomática (gs) entre
07:00 e 18:00 h, em duas folhas por planta, para verificar os horários do dia nos quais gs
permanece relativamente estável. A condutância estomática foi determinada em [CO2]
ambiente (gs[380]) e em [CO2] saturante (gs[2000]). Depois de efetuadas essas medições (gs ao
longo do dia) foram coletados os dados referentes às características fotossintéticas da folha,
naqueles horários do dia de maior estabilidade da condutância estomática. Todas as medições
de trocas gasosas foram efetuadas com valores altos de condutância da camada limítrofe (gbl)
de 1,42 mol m-2 s-1.
As curvas resposta à luz [curva A(Q)] foram construídas a uma concentração de CO2
de 380 μmol mol-1. Os valores A foram registrados em valores de fluxo de fótons (Q) de 2000,
1500, 1000, 500, 250, 100, 50 e 0 μmol m-2 s-1(ver exemplo no Apêndice B). A partir da curva
A(Q) foram determinados a fotossíntese saturada por luz (Amax), Φ, Θ e Ic.
As curvas resposta ao CO2 [curva A(Ci)] foram geradas conforme descrito por Long &
Bernacchi (2003), intensidades de CO2 de 380, 250, 200, 150, 100, 50, 0, 380, 450, 550, 650,
800, 1000 e 2000 μmol mol-1, com fluxo de fóton de 1000 μmol m-2 s-1. Dados da curva A(Ci)
foram utilizados para determinar fotossíntese saturada por luz e [CO2] (Apot), Vc-max, Jmax e a
concentração de CO2 de compensação (Γ).
Para ajustar os dados obtidos das curvas resposta à luz [curva A(Q)] foi utilizada a
equação da hipérbole não retangular;
(ΘAg²-(ΦQ + Agmax)A+ ΦQAgmax = 0)
Equação (5)
Nesta equação, Ag representa a fotossíntese bruta (Ag = A – Rd). A equação 5 é uma
quadrática de segunda ordem da forma: y = ax2 + bx + c = 0, que pode ser resolvida para;
x = [-b ± (b2 – 4ac)0,5]/2a
Equação (6)
Os coeficientes, a, b e c da equação (6), representam: teta (Θ), (ΦQ + Agmax) e
ΦQAgmax, respectivamente. Substituindo na equação 6 temos:
A ={[(ΦQ +Amax+ Rd) – ((ΦQ+ Amax + Rd)2 - 4ΦQΘ( Amax+ Rd))0,5]/2Θ} – Rd
Equação (7)
Onde A é a taxa de fotossíntese líquida (µmol (CO2) m-2 s-1); Φ, declividade inicial ou
rendimento quântico aparente (mol (CO2) mol fótons-1); Θ, parâmetro de convexidade que
12
descreve grau de curvatura na curva de luz (sem dimensões); Q, fluxo de fótons na folha
(µmol (fótons) m-2 s-1); Amax, taxas de fotossíntese saturada por luz, Rd a taxa de respiração no
escuro (µmol (CO2) m-2 s-1).
A convexidade (Θ) foi calculada seguindo a metodologia de Magalhães et al. (2009).
A irradiância de compensação (Ic) foi calculado dividindo-se a respiração no escuro (Rd) pelo
rendimento quântico (Φ), (i. e, Ic = Rd/Φ), determinados com o intercepto (valor de “A”
quando “Q” é zero) do segmento linear da curva A(Q) (Villar et al., 1994).
As taxas de fotossíntese em função da atividade da rubisco (Ac) e da taxa de transporte
de elétrons (Aj) foram estimadas conforme a seguir (Farquhar et al., 1980):
Ac = [Vcmax (Ci -Γ*)]/[Ci + Kc(1+ O/Ko)]
Equação (8)
Aj = [Jmax (Ci -Γ*)]/([4Ci + 8Γ*)]
Equação (9)
Em que: Γ* é a concentração de CO2 de compensação na ausência de respiração e na
presença de luz; Kc e Ko representam as constantes de Michaelis-Mentem da Rubisco para
CO2 e O2, respectivamente e O representa a concentração de oxigênio nos espaços
intercelulares.
O valor do ponto de compensação de CO2 ausência de respiração e na presença de luz
(Γ*) foi de 36,9 µmol. mol-1 a 25º C, corrigido para temperatura conforme Brooks & Farquhar
(1985):
Γ* = 36,9 + 1,88(T -25) + 0,036(T -25)2
Equação (10)
Os valores das constantes cinéticas da reação de carboxilação (Kc) e da reação de
oxigenação (Ko) da enzima Rubisco utilizados foram: Kc 404 µmol(CO2)mol-1, Ko 248
mmol(O2)mol-1 a 25º C (Caemmerer, 2000). Para corrigir as constantes cinéticas em função da
temperatura medida na folha em graus Celsius (T) foi utilizada a equação de Arrhenius:
Kc (T) = Kc 25 e (59400 (T - 25) / (8,314 * 298,15 * (T + 273,15)))
Equação (11)
Ko (T ) = Ko 25 e (36000 (T - 25) / (8,314 * 298,15 * (T + 273,15)))
Equação (12)
Sendo Kc 25 o valor de Kc a 25º C, Ko 25 o valor de Ko a 25º C, 59400 e 36000 J.mol-1a
energia de ativação das respectivas constantes e 8,314 J K-1 mol-1 a constante universal dos
13
gases (Caemmerer, 2000). Os valores de Vc-max e Jmax foram normalizado a 25 °C utilizando
as equações (11) e (12) descritas por Medlyn et al. (1999).
4.3.4. Índice de área foliar e fração de céu visível
O índice de área foliar (IAF) foi estimado utilizando-se um analisador de dossel (LAI2000, Plant Canopy Analyser - Li-Cor, NE, EUA). Este aparelho possui um filtro óptico que
restringe a transmissão radiativa para comprimentos de onda menores que 490 nm (abaixo de
490 nm as folhas refletem e transmitem pouca radiação). Um dos sensores foi instalado acima
do dossel da floresta em uma torre de observação próximo da área do estudo e outro foi
utilizado na área experimental.
Além do IAF, o LAI-2000 também calcula a fração de céu visível (FCV) que é a
quantidade de aberturas e mini-aberturas no dossel da floresta, variável importante que
determina a quantidade de luz que passa pelo dossel e atinge o sub-bosque. Foram realizadas
duas coletas em cada época do ano (seca e chuvosa). Os dados de IAF e FCV foram coletados
no inicio da manhã.
4.3.5. Área foliar específica e espessura da folha
Após as medições da fotossíntese, as mesmas folhas foram coletadas para a
determinação da área foliar específica (AFE), calculada como a relação entre área foliar e
biomassa de folhas. A área da folha foi medida com um medidor de área da folha (Li-3000A,
Li-Cor, EUA). A espessura da folha foi medida com um paquímetro digital (precisão de 10
µm) entre as nervuras maiores da folha; efetuando-se a coleta dos dados antes e depois da
desidratação (72 ºC até massa constante) do tecido foliar.
4.3.6. Determinação do teor relativo e do teor absoluto de clorofila
Para analisar o conteúdo de clorofila e carotenóides, a relação clorofila/carotenóides e
a relação clorofila a/b, selecionou-se folhas totalmente expandidas e com bom aspecto
fitossanitário. Devido a distância da área do estudo para o laboratório de análise no INPA, as
folhas foram colocadas em sacos plásticos e transportados em caixas de isopor contendo gelo,
para evitar a desidratação das folhas. A clorofila foi extraída (mesmo dia) retirando-se disco
foliares (5 mm de diâmetro), que foram pesados e imediatamente macerados com uma
solução aquosa contendo acetona 80% (10 mL / amostra) e posterior determinação
espectrometricamente (SP-2000 UV, Spectrum, Shangai, China), nos comprimentos de onda
14
480, 645 e 663 nm. Os conteúdos de clorofilas e carotenóides foram obtidos segundo
metodologia descrita por Hendry & Price (1993):
Clorofila a (mg L-1) = 12.7A663 - 2.69A645
Equação (13)
Clorofila b (mg L-1) = 22.9A645 - 4.68A663
Equação (14)
-2
Carotenóides (µmol m ) = [(A480 + 0.114A663 - 0.638A645)V]/(112.5Af) . Equação (15)
Onde: V, indica o volume de extrato (mL); Af, área foliar (m2). Os valores de clorofila,
foram transformados de unidades de miligramas para micromoles, tendo-se como base a
massa molecular desses compostos, isto é, multiplicando por 1,119 (clorofila a) e 1,102
(clorofila b).
4.3.7. Teor de nutrientes das folhas
Para determinação dos teores de nutrientes amostras de folhas das plantas (duas a
quatro por planta em função do tamanho) foram desidratadas em estufa (Tecnal TE – 394/I) a
72 ºC até massa constante, moídas e submetidas à análise química para determinação das
concentrações de nitrogênio (N) e fósforo (P). Para determinação do conteúdo de nitrogênio
foliar utilizou-se o método Kjeldahl. O teor de fósforo foi determinado por calorimetria e as
leituras das absorbâncias em 690 nm no espectrofotômetro usando molibidato de amônio e
ácido ascórbico a 3% (Rorison et al., 1993).
4.3.8. Estudo da fluorescência
A fluorescência da clorofila foi medida em duas folhas por planta utilizando-se um
analisador da eficiência da planta (PEA, MK2 – 9600 – Hansatech, UK). Antes de efetuar a
medição, a folha foi aclimatada a escuridão por 20 min. Posteriormente, em uma área de 4
mm de diâmetro foi aplicado um pulso de luz de 3000 µmol m-2 s-1. A fluorescência da
clorofila foi detectada usando um fotodiodo depois do feixe de luz atravessar um filtro para
ondas longas. Foram registrados os valores de fluorescência inicial (F0), máxima (Fm),
variável (Fv) e a eficiência quântica potencial máxima do fotossistema II ou relação Fv/Fm.
Onde:
9 Fluorescência inicial (F0) - Intensidade de fluorescência quando todos os centros de
reação do FSII estão abertos (folha aclimatada ao escuro).
15
9 Fluorescência máxima (Fm) - Intensidade de fluorescência quando todos os centros de
reação do FSII estão fechados (após receber um pulso de luz intensa).
9 Fluorescência variável (Fv) - Diferença entre Fm e F0.
9 Razão Fv/Fm - representa a eficiência quântica potencial do FS II (Krause, 1991)
4.4. Delineamento experimental e análise estatística
O delineamento experimental utilizado foi inteiramente casualizado, tendo como
tratamentos as cinco espécies e as épocas do ano (de seca e chuvosa). As repetições foram,
três plantas por espécie e de duas a quatro folhas por planta. Os dados foram submetidos a
análise de variância (ANOVA) e as diferenças entre as espécies analisadas mediante o teste de
Tukey (p≤ 0,05). O efeito das variáveis quantitativas (trocas gasosas, incremento anual,
irradiância e fração de céu visível, características foliares e teores de nutrientes e clorofila)
das arvoretas foram analisadas por meio de analises de regressão. Utilizou-se o programa
estatístico SAEG 9.0 (Universidade Feferal de Viçosa). No ANOVA considerou-se como
unidade experimental “a planta”. Assim, os graus de liberdade (gl) no ANOVA, foram
distribuídos como segue: épocas (2-1), espécies (5-1), interação época x espécie (4x1) e
resíduo (total (30-1) – (2-1) – (5-1) – 4) = 20. Para os dados de crescimento, a unidade
experimental foi a planta individual, os gl foram calculados de forma similar.
16
5. RESULTADOS E DISCUSSÃO
5.1. Condições ambientais
Durante o período de coleta de dados de crescimento a variação na precipitação
oscilou conforme mostrado no gráfico abaixo (Figura 2). Durante o estudo a precipitação
mensal foi superior a 100 mm, com exceção do mês de setembro que apresentou 90 mm.
Esses valores estão dentro das médias históricas (1961-1990) registradas na região do estudo
(Inmet, 2009). A precipitação no mês de agosto (época seca) foi 80% menor em relação a
dezembro (época chuvosa), no entanto a umidade do solo mostrou-se similar nas duas épocas
do estudo (Tabela 2).
800
Temperatura
600
500
Precipitação
20
400
300
10
200
Temperatura (°C)
Precipitação (mm)
700
30
100
0
Jan
Fe eiro
ve r
eir
Ma o
rço
Ab
ri
Ma l
i
Jun o
ho
Jul
Ag ho
Se osto
tem
Ou bro
No tubro
ve m
De bro
zem
br o
0
Meses
Figura 2. Precipitação mensal durante o período de estudo. Os dados correspondem à média
dos meses de janeiro a dezembro de 2007 a 2009. A linha horizontal contínua mostra o valor
da temperatura (°C) e as linhas verticais nas barras indicam o desvio padrão (DP). No gráfico
a linha tracejada representa o valor de 100 mm, abaixo do qual um determinado mês é
considerado seco (Walsh, 1996).
17
A média diária de irradiância no sub-bosque e acima do dossel foi 7% e 20% menor na
época de chuva em relação a época seca, respectivamente (Tabela 2). Em contrapartida, a
temperatura do ar, apresentou tendência similar nas duas épocas do ano, com valores de 25,2
°C na época seca e 24,22 °C na época chuvosa.
Tabela 2. Médias (desvio padrão) dos dados climáticos do sub-bosque, observados no
período do estudo na época de chuva e de seca de 2008.
Variável
Seca
Chuva
1
Irradiância acima do dossel (mol m-2 dia-1)
30,7 (5,80)
24,6 (11,46)
2
Irradiância no sub-bosque (mol m-2 dia-1)
0,81 (0,46)
0,75 (0,52)
Temperatura média (ºC)
25,2 (0,88)
24,22 (0,68)
Umidade relativa (%)
96,2 (2,82)
98,50 (0,89)
Chuva (mm)
106 (14,00)
574 (114,00)
Umidade do solo (%)
31,81 (2,19)
33,30 (3,95)
1. Medida acima do dossel numa torre de observação a 40 m de solo.
2.Estimada como a irradiância total acima do dossel multiplicada pela fração de céu visível e
não inclui a fração de luz difusa no sub-bosque.
A média da umidade do ar do sub-bosque mostrou pouca variação, oscilando entre 96
a 98% nos meses de seca e de chuva respectivamente. Os valores de irradiância no subbosque encontrados neste estudo são similares aos encontrados por outros autores (Molion,
1987; Marenco & Vieira, 2005; Kursar & Coley, 1999) ou em florestas tropicais (Chadzon &
Fetcher, 1984). Vale ressaltar que a quantidade de luz que atinge o sub-bosque da floresta
variou muito de um ponto a outro no microsítio da medição devido às aberturas e miniaberturas do dossel.
18
5.2. Taxas de incremento anual em diâmetro e altura
As épocas do ano (seca e chuvosa) não apresentaram efeito sobre as taxas de
incremento médio anual em diâmetro (IAD) e altura (IAA) das arvoretas (p > 0,05), assim
como também a interação época/espécie não foi significativa (Tabela 1A). Porém houve
diferença significativa (p < 0,05) das taxas de IAD e IAA entre as espécies (Tabela 3).
O menor incremento em diâmetro e o maior acréscimo em altura foi observado em R.
guianensis. Os resultados das médias de crescimento relatados nesse estudo (Tabela 3) são
menores do que as médias relatadas para espécies com DAP (diâmetro acima do peito) acima
de 10 cm em florestas tropicais (Clark & Clark, 2001), e por exemplo na Amazônia, 1 mm
ano-1 (Vieira et al., 2005). Os baixos valores de incremento em espécies de sub-bosque podem
está relacionado à baixa luminosidade a que as arvoretas estão expostas, limitando a baixa
assimilação de CO2 o crescimento da planta. Além disso, árvores na fase juvenil podem
apresentar crescimento nulo em altura em períodos curtos de tempo (Clark & Clark, 2001).
Tabela 3. Incremento médio anual em diâmetro (IAD) e altura (IAA) em arvoretas de cinco
espécies nativas da Amazônia nos anos de 2007 a 2009. Cada valor corresponde à média de
três plantas (desvio padrão). Mostra-se também o valor de F entre espécies.
IAA
IAD
(mm ano )
(m ano-1)
M. guianensis
0,32 (0,15)ab
0,06 (0,04)a
G. olivacea
0,64 (0,30)a
0,09 (0,06)ab
R. guianensis
0,19 (0,15)bc
0,10 (0,12)ab
S. amara
0,54 (0,45)ab
0,05 (0,03)b
D. saccifera
0,80 (0,80)a
0,01 (0,01)c
Média
0,49 (0,23)
0,06 (0,04)
2,51*
2,35*
56
44
Espécies
F (entre espécies)
CV (%)
-1
Médias seguidas pela mesma letra, minúsculas nas colunas, não diferem ao nível de 5% de
probabilidade pelo teste de Tukey. *: significativo a 5% de probabilidade.
19
Alguns estudos comprovam que a variabilidade no regime hídrico pode acarretar
alterações nas taxas de crescimento das plantas (Clark & Clark, 1994; Vieira et al., 2005;
Feeley et al., 2002). No entanto, não houve relação significativa entre as taxas de incremento
em diâmetro e altura mensal (p > 0,05) com a precipitação (Figura 3A-B). De acordo com
Vieira et al. (2005) árvores com DAP acima de 50 cm, respondem melhor a variações na
precipitação do que árvores com DAP menor que 30 cm. Assim, o resultado encontrado neste
estudo pode ser explicado pela quantidade de chuva ocorrida durante o ano, ou, seja, a
inexistência de época seca bem intensa, já que o menor valor de precipitação no período de
estudo foi de 100 mm.
4,5
y = 0,0004x - 0,0581
-1
y = 1E-05x + 0,0024
r² 2= 0,0004nsns
r² = 0,0004
R
ns
B
0,5
2,0
0,2
-0,5
-0,1
-3,0
-0,3
0
200
400
Precipitação (mm)
600
0
200
400
IMA (m mês-1 )
IMD (mm mês )
ns
2
R == 0,01
0,0142
r²
A
600
Precipitação (mm)
Figura 3. Relação entre as taxas de incremento mensal em diâmetro (IMD, A) e altura (IMA,
B) com a precipitação mensal do período de estudo. Dados coletados nos anos de 2007 e 2009
em cinco espécies nativas da Amazônia. ns: não significativo a 5% de probabilidade.
Muitos estudos têm avaliado o crescimento em diâmetro em árvores adultas da
Amazônia (Vieira et al., 2005; Silva et al., 2002), porém ainda são escassos estudos
envolvendo crescimento em altura e diâmetro na fase juvenil.
A relação entre altura inicial e sua respectiva taxa de incremento anual (IAA) não
apresentou efeito significativo (p > 0,05). No entanto o mesmo não foi observado para relação
20
entre o diâmetro inicial e taxas de incremento anual (IAD) (Figura 4 A-B). Observou-se
decréscimo no IAD em espécies que possuem maior diâmetro inicial. Essa constatação é
contraditória a apoiada por alguns autores como Clark et al. (1999) e Vieira et al. (2005) que
afirmam que árvores de maior diâmetro tendem a apresentar taxas de crescimento maior do
que as árvores de menor diâmetro.
2,7
-1
y = -0,0083x + 0,0749
ns
*
r²R2==0,22*
0,2242
r²2 = 0,003
r²
1,7
R
r² = 0,0026
0,5
B
ns
0,3
0,7
0,1
-0,3
-0,1
0
5
10
15
Diâmetro inicial (mm)
0
1
2
IAA (m ano-1)
IAD (mm ano )
y = -0,0691x + 1,0578
A
3
Altura inicial (m)
Figura 4. Relação entre as taxas de incremento anual em diâmetro (IAD, A) e diâmetro inicial
e altura inicial e as taxas de incremento anual em altura (IAA, B). Dados coletados em cinco
espécies nativas da Amazônia. ns: não significativo a 5% de probabilidade. *: significativo a
5% de probabilidade.
21
5.3. Trocas gasosas
5.3.1. Fotossíntese máxima (Amax) e parâmetros da curva resposta à luz
Não houve efeito da época do ano (seca e chuva) nos valores de Amax, Φ, Ic, Rd, gs[380]
e Θ. No entanto observou-se diferença significativa (p<0,05) entre espécies para Amax, Ic e Rd
(Tabela 4,5).
A falta de efeito da época do ano (seca e chuva) nos parâmetros analisados pode ser
atribuída ao fato dos teores de umidade do solo terem sido similares em ambas as épocas
(seca e chuva) (Tabela 2), resultado de chuvas frequentes ocorridas durante o mês de agosto
(o mês mais seco do ano) (Inmet, 2009).
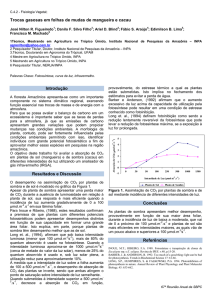
Os valores de Amax variaram de 2,62 µmol m-2 s-1 encontrados em Duroia saccifera
para 5,87 µmol m-2 s-1 em Simarouba amara (Figura 5), o que está de acordo com resultados
encontrados em plantas aclimatadas à sombra relatados por outros autores (McMillen &
McClendon, 1983; Kaiser e Kappen, 2000). Em estudos com espécies de arvores no subbosque de uma floresta de terra-firme da Amazônia Central, Mendes (2009) e Nascimento
(2009) encontraram valores de Amax, entre 1 a 6 µmol m-2 s-1, similares aos citados neste
estudo.
9
Amax (μmol m-2 s-1)
seca
chuva
6
3
M
ac
ci
fe
ra
ar
a
D
.s
am
S.
.g
ui
an
en
si
s
G
.o
liv
ac
ea
e
R
.g
ui
an
en
si
s
0
Espécies
Figura 5. Variação sazonal da fotossíntese (Amax) de cinco espécies florestais de terra-firme
na Amazônia Central. Cada barra corresponde a média de três plantas por espécie. As linhas
verticais nas barras indicam o erro padrão da média.
22
Os valores de Amax e Φ observados neste estudo estão dentro da faixa de valores
encontrados em outras espécies da sucessão tardia, tais como Hydrophyllum virginianum,
Quecus rubra e Aesculus glabra (Bazzaz & Carlson, 1982) e Minquartia guianensis
(Magalhães et al., 2009). Marenco & Vieira (2005) também encontraram valores similares de
Amax, Φ e Θ aos relatados neste trabalho. Entretanto, vale ressaltar que os valores de Φ
relatados neste estudo (Tabela 4) são menores do que os valores máximos potenciais (em
torno de 0,08) observados em plantas C3 em baixa [O2] ou alto Ci (Bjorkman, 1981), o que
pode ser inferido devido ao fato de Φ neste estudo ter sido determinado em [CO2] e [O2]
ambiente no presente trabalho.
Valores de condutância estomática (gs[380]) similares aos encontrados neste trabalho
(Tabela 5) foram relatados por Kaiser & Kappen (2000) em espécies de sub-bosque na
Amazônia.
Os valores de Rd e Ic oscilaram entre 0,19 e 4,69 µmol m-2 s-1 em Rinorea guianensis
para 0,52 e 12,47 µmol m-2 s-1 Simarouba amara, respectivamente (Tabela 4,5). A maior
irradiância de compensação (Ic) é o resultado de uma maior taxa de respiração (Rd) o que pode
estar relacionado a maior espessura da folha de Simarouba amara como será mostrado na
seção 5.5. Além disso, Simarouba amara encontra-se em microsítios com maior FCV, como
mostrado na seção 5.4. Assim, plantas em alta luminosidade apresentam um maior
investimento em proteínas envolvidas no ciclo de Calvin (Bjorkman, 1981).
23
Tabela 4. Fotossíntese máxima (Amax), rendimento quântico aparente (Φ), irradiância de compensação (Ic) em função da espécie e da época do
ano (seca e chuva). Dados coletados nos meses de agosto (seca) e dezembro (chuva) de 2008. Cada valor corresponde a médias de três arvoretas
(desvio padrão). Mostra-se também o valor de F entre espécies e para a interação espécie x época.
Espécie
Amax (µmol m-2 s-1)
Φ (mol (CO2) mol-1 (fótons))
Seca
Chuva
seca
Chuva
M. guianensis
2,88(0,24)Aa
3,11(0,41)Ab
0,04(0,01)Aa
G. olivacea
5,07(1,97)Aa
4,62(0,92)Aab
R. guianensis
3,86(0,52)Aa
S. amara
D. saccifera
Ic (µmol m-2 s-1)
Seca
Chuva
0,04(0,00)Aa
11,04(3,24)Aab
5,25(1,02)Ba
0,05(0,00)Aa
0,04(0,01)Aa
8,32(2,05)Aabc
8,47(3,73)Aa
4,07(0,87)Aab
0,04(0,00)Aa
0,06(0,02)Aa
5,26(1,62)Ac
4,69(1,83)Aa
4,32(1,89)Aa
5,87(0,58)Aa
0,04(0,01)Aa
0,04(0,01)Aa
12,45(1,19)Aa
12,47(3,09)Aa
2,62(0,62)Aa
3,19(1,62)Ab
0,04(0,01)Aa
0,03(0,01)Aa
6,59(1,14)Abc
9,05(7,17)Aa
3,75(1,43)
4,17(1.34)
0,04(0.01)
0,04(0,013)
8,73(3,25)
7,99(4,45)
CV (%)
34,01
23,36
18,81
23,20
22,93
49,81
F (entre espécies)
1,89 ns
4,08*
1,14 ns
3,26 ns
6,71*
1,88 ns
Média
F (sp x época)
0,63 ns
2,44 ns
1,39 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não diferem ao nível de 5% de probabilidade pelo teste de
Tukey. ns: não significativo a 5% de probabilidade. *: significativo a 5% de probabilidade.
24
Tabela 5. Condutância estomática em [CO2] ambiente (gs[380] ), convexidade da curva de luz (Θ), respiração foliar (Rd) em função da espécie e da
época do ano (seca e chuva). Dados coletados nos meses de agosto (seca) e dezembro (chuva) de 2008. Cada valor corresponde a médias de três
arvoretas (desvio padrão). Mostra-se também o valor de F entre espécies e para a interação espécie x época.
Espécie
gs[380] (mol m-2 s-1)
Θ (sem unidade)
Seca
Chuva
Seca
chuva
M. guianensis
0,06(0,01)Aa
0,08(0,01)Aa
0,78(0,02)Aa
G. olivacea
0,13(0,07)Aa
0,11(0,02)Aa
R. guianensis
0,11(0,03)Aa
S. amara
D. saccifera
Média
CV (%)
F (entre espécies)
F (sp x época)
Rd (µmol m-2 s-1)
Seca
Chuva
0,77(0,06)Aa
0,36(0,01)Aab
0,20(0,04)Ba
0,73(0,11)Aa
0,71(0,80)Aa
0,40(0,09)Aa
0,36(0,18)Aa
0,12(0,01)Aa
0,70(0,12)Aa
0,78(0,02)Aa
0,19(0,06)Ab
0,25(0,05)Aa
0,11(0,08)Aa
0,16(0,06)Aa
0,76(0,08)Aa
0,78(0,13)Aa
0,43(0,13)Aa
0,52(0,12)Aa
0,13(0,07)Aa
0,12(0,07)Aa
0,79(0,06)Aa
0,79(0,03)Aa
0,26(0,02)Aab
0.24(0,15)Aa
0,12(0,04)
0,11(0,06)
0,75(0,08)
0,76(0,07)
0,33(0.11)
0,31(0,16)
55,19
35,30
11,31
9,91
23,42
38,24
ns
ns
ns
5,16*
3,47 ns
0,57
1,54
0,43 ns
0,58
0,52
0,30 ns
ns
1,36 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não diferem ao nível de 5% de probabilidade pelo teste de
Tukey. ns: não significativo a 5% de probabilidade. *: significativo a 5% de probabilidade.
25
5.3.2. Fotossíntese potencial (Apot) e parâmetros da curva resposta ao CO2
A fotossíntese potencial (Apot) e a condutância estomática em [CO2] saturante (gs[2000])
nas espécies estudadas resultou similar nas épocas seca e chuvosa (Tabela 6). No entanto, a
concentração de CO2 de compensação (Γ) foi 30% maior na época seca. Não houve diferença
significativa entre as espécies apenas para gs[2000].
A semelhança entre valores de fotossíntese potencial (Apot) entre as épocas do ano
(seca e chuva) pode ser atribuída à alta umidade do solo medida durante o estudo, como
resultado das chuvas frequentes no mês de agosto (106 mm) (Tabela 2) tipicamente o mês
mais seco do ano (Inmet, 2009). Vale ressaltar que, embora Apot tenha sido similar nas
espécies estudadas em ambas as épocas (seca e chuva) não é possível concluir que o mesmo
pode ser esperado para as próximas décadas, haja vista que alguns modelos climáticos
prognosticam intensificação da época de seca (Cox et al., 2004) em decorrências das
mudanças associadas ao aquecimento do planeta.
Os valores de Apot variaram de 6,75 µmol m-2 s-1 em Duroia saccifera para 12,32 µmol
m-2 s-1 em Simarouba amara (Figura 6).
Apot (μmol m-2 s-1)
21
seca
chuva
14
7
M
.g
ui
an
en
si
s
G
.o
liv
ac
ea
R
e
.g
ui
an
en
si
s
S.
am
ar
a
D
.s
ac
ci
fe
ra
0
Espécies
Figura 6. Variação sazonal da fotossíntese (Apot) de cinco espécies florestais de terra-firme na
Amazônia Central. Cada barra corresponde a média de três plantas por espécie. As linhas
verticais nas barras indicam o erro padrão da média.
26
Esses valores são equivalentes aos relatados por outros autores (Mendes, 2009;
Nascimento, 2009) em espécies no sub-bosque da floresta. Em três variedades de citros
(‘Valência’, ‘Murcote’ e ‘Tahiti) Machado et al. (2005) também encontram valores de Apot (9,8
a 13 µmol m-2 s-1) semelhantes aos relatados neste trabalho. Oliveira et al. (2002) estudando
as trocas gasosas em mudas de pupunheira (Bactris gasipaes Kunth) observaram que o valor
de Apot foi de 10,1 µmol m-2 s-1. Entretanto, os valores máximos de Apot obtidos neste estudo
são menores do que os encontrados por Marenco et al. (2003) em Ochroma pyramidale (24
µmol m-2 s-1), talvez pelo fato de em O. pyramidale ser uma espécie pioneira crescida em
ambiente ensolarado.
27
Tabela 6. Fotossíntese potencial (Apot), condutância estomática em [CO2] saturante (gs[2000]) e concentração de CO2 de compensação (Γ) em
função da espécie e da época do ano (seca e chuva). Dados coletados nos meses de agosto (seca) e dezembro (chuva) de 2008. Cada valor
corresponde a médias de três arvoretas (desvio padrão). Mostra-se também o valor de F entre espécies e para a interação espécie x época.
Espécie
Apot (µmol m-2 s-1)
Γ* (µmol mol-1)
gs[2000] (mol m-2 s-1)
Seca
chuva
Seca
Chuva
seca
Chuva
M. guianensis
8,35(1,24)Aa
8,65(0,04)Aa
0,07(0,00)Aa
0,08(0,01)Aa
100,8(9,9)Aa
84,9(3,88)Aa
G. olivacea
11,08(2,10)Aa
9,26(1,71)Aa
0,14(0,07)Aa
0,10(0,03)Aa
94,1(22,6)Aa
79,3(10,5)Aa
R. guianensis
9,71(2,09)Aa
8,92(2,45)Aa
0,09(0,04)Aa
0,10(0,06)Aa
82,1(2,73)Aa
76,8(1,27)Ba
S. amara
11,11(3,25)Aa 12,32(2,38)Aa
0,11(0,09)Aa
0,14(0,08)Aa
105,0(14,6)Aa
82,3(1,87)Aa
D. saccifera
6,75(0,83)Aa
7,13(1,86)Aa
0,10(0,04)Aa
0,13(0,08)Aa
104,2(9,8)Aa
87,2(14,4)Aa
9,39(2,46)
9,26(2,38)
0,10(0,05)
0,11(0,05)
97,2(14,46)
82,1(7,97)
22,09
20,53
57,89
51,73
13,98
10,03
ns
ns
ns
ns
ns
0,77 ns
Média
CV (%)
F (entre espécies)
F (sp x época)
2,42
2,97
0,52 ns
0,51
0,57
0,32 ns
1,45
0,46 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não diferem ao nível de 5% de probabilidade pelo teste de
Tukey. ns: não significativo a 5% de probabilidade.
28
5.3.3. Velocidade máxima de carboxilação da Rubisco (Vc-max) e taxa de transporte de
elétrons (Jmax)
Não houve efeito da época do ano (seca e chuva) nos valores de Vcmax, Jmax, calculada
a partir da curva A-Ci, no entanto a diferença nos valores de Vcmax entre as espécies foi
significativa (p<0,05) (Tabela 1A).
A velocidade máxima de carboxilação da Rubisco (Vc-max) e a taxa máxima de
transporte de elétrons (Jmax) variaram de 14,3 µmol m-2 s-1 e 30,6 µmol m-2 s-1 em Duroia
saccifera para 22,4 µmol m-2 s-1 e 50,1 µmol m-2 s-1em Simarouba amara (Figura 7).
Figura 7. Variação sazonal da velocidade máxima de carboxilação da Rubisco (Vc-max) e taxa
de transporte de elétrons (Jmax) nas épocas de seca e chuva referentes ao ano de 2008 em
cinco espécies nativas da Amazônia. Cada barra corresponde a média de três plantas por
espécie. As linhas verticais nas barras indicam o erro padrão da média.
29
Os valores de Vc-max e Jmax observados neste estudo estão dentro da faixa de valores
encontrados em outras espécies da floresta tropical, variando entre 9 e 126 µmol m-2 s-1 e 30 e
222 µmol m-2 s-1, respectivamente (Wullschleger, 1993). Também Manter & Kerrigan (2004)
observaram que Vcmax oscilou entre 20 e 75 µmol m-2 s-1 em espécies de folhas largas.
Conforme o modelo de Farquhar et al. (1980) a fotossíntese é limitada,
principalmente, por dois fatores (Vc-max e Jmax). Assim observa-se que em M. guianensis, G.
olivacea, S. amara, R. guianensis e D. saccifera a transição da fotossíntese limitada por Ac
para limitada por Aj ocorreu em Ci de 670, 400, 405, 590 e 420 µmol mol-1, respectivamente
(Figura 8). Contudo, independente da espécie, o fator limitante da fotossíntese em níveis CO2
do ambiente (CO2 no ar de 380 µmol mol-1) foi a velocidade de carboxilação da Rubisco e em
alta [CO2] o fator limitante da fotossíntese foi o transporte de elétrons (Figura 8, linhas
verticais tracejadas) o que está de acordo com os resultados de Sage & Kubien (2007), que
mostram, exceto em temperaturas muito altas, que a fotossíntese é mais comumente limitada
pela atividade da Rubisco. Os resultados desta pesquisa concordam com os relatados por
outros autores que mostram que a fotossíntese é limitada, principalmente, pela atividade da
Rubisco (Ellsworth et al., 2004; Onoda et al., 2005).
Assim, como a enzima Rubisco possui baixa afinidade (Km alto) pelo CO2, na
concentração atual de CO2, ela está limitada por este substrato (Drake et al., 1997; Bowes,
1991; Stitt,1991; Yeoh et al., 1981) e possui também atividade como oxigenase. Uma vez que
esta reação com o oxigênio é inibida competitivamente pelo CO2 (Drake et al., 1997; Bowes,
1991; Stitt, 1991), espera-se que, se a fotossíntese estiver limitada pela Rubisco, um aumento
da concentração atmosférica de CO2 de 350 ppm para 700 ppm aumente a taxa de assimilação
em torno de 78% (Stitt, 1991). Se a fotossíntese estiver limitada pela regeneração de seu
substrato (a ribulose 1,5-bisfosfato), esta deve se beneficiar apenas do deslocamento da reação
de oxigenação e, portanto, com o mesmo aumento na concentração atmosférica de CO2 deve
aumentar apenas em torno de 27% (Stitt, 1991).
Entretanto, vários estudos têm mostrado (Delucia et al.,1985; Drake et al., 1997;
Webber et al., 1994) que plantas cultivadas em uma atmosfera enriquecida de CO2 podem
apresentar aclimatação (perda da sensibilidade) à alta concentração de dióxido de carbono no
ar. Desse modo, a magnitude do aumento da fotossíntese obtidos neste estudo em nível de
folha (curva de resposta da fotossíntese ao CO2) pode não se refletir em estudos de longo
prazo.
30
-2 -1
A ( μmol m s )
25
A
Ac
16
Aj
7
670
-2 -1
A ( μmol m s )
-2
25
B
Ac
16
C
Ac
Aj
Aj
7
400
405
-2
25
-2
E
Ac
-1
A ( μmol m s )
D
16
Ac
Aj
7
Aj
590
420
-2
0
500
1000
1500
-1-1
Ci C(µmol
m ))
i (μmolmol
2000
0
500
1000
1500
-1
-1
Ci C(µmol
mol
m ))
i (μmol
2000
Figura 8. Taxa de fotossíntese (Apot) em função da concentração de CO2 intercelular (Ci) para
M. guianensis (A) G. olivacea (B), S. amara (C), R. guianensis (D), D. saccifera (E). A curva
tracejada mostra à limitação da fotossíntese imposta pela taxa de carboxilação da Rubisco (Ac,
calculada conforme a Equação 9). A linha continua indica a limitação da fotossíntese imposta
pelo transporte de elétrons (Aj, calculada conforme a Equação 8). A linha continua vertical
mostra o valor de Ci em que ocorre a transição de fotossíntese limitada por Ac para limitada
por Aj. Os números (dentro dos gráficos) mostram os valores de Ci em µmol mol-1. Cada
ponto corresponde a média de duas épocas e três plantas por espécie. As barras em cada
símbolo correspondem ao erro padrão da média.
31
Observou-se uma relação significativa (r2 = 0,87, p<0,05) entre Vc-max e Jmax (Figura
9), que está de acordo com os resultados encontrados por outros autores (Wullschleger, 1993;
Manter & Kerrigan, 2004; Kattge & Knorr, 2007) que observaram relação positiva entre
ambos os parâmetros. A regeneração da RuBP envolve o transporte de elétrons, à síntese de
ATP (e NADPH) e parte das reações do ciclo de Calvin, o que torna evidente a relação
positiva entre esses parâmetros.
-2 -1
Jmax (μmol m s )
100
y = 1,7161x + 7,5516
**
2
Rr² == 0,87**
0,8668
67
33
0
0
12
24
36
-2 -1
Vc-max (μmol m s )
Figura 9. Taxa máxima de transporte de elétrons (Jmax) em função da velocidade máxima de
carboxilação da Rubisco (Vc-max) de cinco espécies florestais de terra-firme na Amazônia
Central. Cada símbolo representa uma planta por espécie na época chuvosa (circulo aberto, ○)
e na época seca (circulo fechado, ●). **: significativo a 1% de probabilidade. Valores de Jmax
e Vc-max calculados a 25 ºC.
Muitos estudos têm mostrado relação significativa entre a Rubisco e Amax (Evans,
1983; Evans & Terashima 1988) atribuída a variação no estado de ativação da rubisco e/ou a
resistência na transferência de CO2 dos espaços intercelulares para os sítios de carboxilação
(Evans & Terashima 1988; Cheng & Fuchigami 2000). Warren & Adams (2001) também
registraram forte relação entre Amax e o conteúdo da Rubisco por unidade de área. Analisando
o comportamento da fotossíntese saturada por luz (Amax) e por CO2 (Apot) em relação a Vc-max e
32
Jmax, observou-se relação linear altamente significativa (p<0,05) entre esses parâmetros em
espécies de sub-bosque (Figura 10).
12
y = 0,2313x - 0,2091
8
4
B
r² 2= 0,73** **
R = 0,7271
8
14
0
y 11
= 0,4041x22
+ 1,9979 3321 5
2 = 0,77**
r²
R = 0,7702
Vcmax
14
C
y =30
0,2445x - 0,1292
55
2
0,96**
Rr² == 0,9585
Jmax
D
80
Apot
-2 -1
y = 0,1244x - 0,8291
4
0
21 0
Apot (μmol m s )
A
r²2 = 0,74**
R = 0,7395
Amax
-2 -1
Amax (μmol m s )
12
7
7
0
0
0
11
22
33
-2 -1
Vc-max (μmol m s )
5
30
55
80
-2 -1
Jmax (μmol m s )
Figura 10 - Taxa de fotossíntese (Amax e Apot) em função da velocidade máxima de
carboxilação da Rubisco (Vc-max) e taxa máxima de transporte de elétrons (Jmax) a 25˚ C de
cinco espécies florestais de terra-firme da Amazônia. Cada ponto representa uma planta por
espécie na época chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●). **:
significativo a 1% de probabilidade. Valores de Jmax e Vc-max calculados a 25 ºC.
Não houve relação (p > 0,05) entre a fotossíntese potencial (Apot) e o incremento anual
(IAD e IAA) (Figura 11A-B), o que não confirma os resultados encontrados por Kruger &
Volin (2006) onde relatam que as taxas fotossintéticas afetam o crescimento das arvoretas. A
falta de efeito da fotossíntese (Apot) nas médias de crescimento anual indica que o crescimento
(em diâmetro e altura) das arvoretas está relacionado não somente a capacidade fotossintética
da planta, mas a outros fatores como a área foliar, a força de drenos e a translocação de
33
assimilados que também interagem de forma complexa (Gifford & Evans, 1981; Ueda &
Shibata, 2001).
-2 -1
Apot (μmol m s )
30
20
30
y = 0,4492x + 9,107
ns
2r² = 0,006 ns
Rr² = 0,0064
10
0
-0,3
A
20
y = 8,9003x + 8,7515 B
ns
2
0,06 ns
r²r² == 0,0574
R
10
0
0,25
0,8
1,35 -0,1
-1-1
IAD (mm
(mmano
ano ))
IAD
0,02
0,14
0,26
-1
IAA(m
(mano
ano-1))
IAA
Figura 11. Relação entre a fotossíntese potencial (Apot) com a taxa de incremento anual em
diâmetro (IAD) e altura (IAA) de cinco espécies florestais de terra-firme na Amazônia
Central. ns: não significativo a 5% de probabilidade.
34
5.3.4. Efeito do horário do dia nas trocas gasosas
As taxas fotossintéticas (A) assim como a condutância estomática (gs) e a transpiração
(E) em [CO2] ambiente apresentaram forte variação diurna para as espécies analisadas em
ambas as épocas, apresentando valores de A, gs e E maiores entre 09 e 14:00 h (Figura 12 AC).
Amax (μmol m-2 s-1)
12
y = -0,0878x2 + 1,9982x - 7,5534
2
**
RR²
==0,2878
0,28 **
A
8
4
0
y = -0,0026x2 + 0,0589x - 0,2264
**
0,27 **
==
0,2712
R2R²
-2 -1
-2 -1s )
ggss (mol
(μmolmm
s )
0,3
B
0,2
0,1
0,0
E (μmol
m-2 s-1)
m
5
y = -0,0331x2 + 0,7549x - 2,941
2
R R²
= 0,3584
= 0,36**
**
C
3
2
0
4
9
14
19
Tempo (h)
Figura 12 - Variação diurna da fotossíntese máxima (A, Amax), condutância estomática (B, gs)
e transpiração (C, E) em cinco espécies florestais da Amazônia. Cada símbolo representa uma
folha por planta na época chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●).
Medições efetuadas a 380 µmol mol-1, luz saturante (1000 µmol m-2 s-1) e temperatura foliar
de 28 ± 1 ºC. A linha contínua mostra a tendência observada ao longo do dia. **: significativo
a 1% de probabilidade.
35
Os resultados encontrados nesse estudo concordam com os relatados por outros
autores (Kaiser & Kappen, 2000; Zotz & Winter, 1994) que observaram valores máximos de
gs nos horários da manhã e valores mínimos de gs ao final da tarde. O aumento da Amax, gs
nesse período pode ser explicada pelo aumento da luminosidade nesse período conforme
descrito por Marenco & Vieira (2005).
Embora seja bem conhecido que a luz estimula a abertura dos estômatos (Raschke et
al., 1979; Mooney et al., 1983; Mooney & Chu, 1983, Shimazaki et al., 2007; Baroli et al.,
2008) e que os estômatos abrem em irradiância acima de 2-8 µmol m-2 s-1 (Habermann, 1973;
Hsiao et al., 1973), logo ao amanhecer a luminosidade foi ineficaz em induzir a abertura dos
estômatos, mesmo após uma hora de iluminação contínua na câmara foliar.
Como observado neste trabalho os maiores valores de gs coincidiram com os horários
de maior luminosidade, maior temperatura e menor umidade do ar, o que sugere que alguns
ou todos esses fatores, podem de alguma forma ter papel importante na modulação do
movimento estomático durante o dia. Porém, tais fatores não explicam a variação diurna no
movimento estomático, haja vista que as condições ambientais foram mantidas constantes na
câmera foliar durante todo o dia. Assim, é provável que fatores endógenos tenham também
contribuído para a variação diurna no movimento estomático observado neste estudo.
Doughty et al. (2006) mostraram que os ritmos circadianos podem contribuir para oscilações
diurnas na fotossíntese e gs .
Os valores de transpiração encontrados nesse estudo são menores do que os relatados
por Maruyama et al. (2005), mas o padrão de declínio ao final da tarde foi semelhante. O
aumento da transpiração ao meio dia (Figura 12-C) foi atribuído à maior temperatura do ar
nesses horários, bem como o aumento da gs. Já o declínio ao final da tarde pode ser explicado
pela baixa condutância estomática, pois o fechamento estomático impede a saída da molécula
de água da folha para o ambiente externo, haja vista que nas condições de mensuração
(valores altos da condutância da camada limítrofe: 1,42 mol m-2 s-1) a transpiração depende
diretamente de gs. Padrões semelhantes do efeito do horário do dia na transpiração foliar
foram descritos em estudos no sub-bosque (Kaiser & Kappen, 2000) com mudas de espécies
florestais (Maruyama et al., 2005) e em espécies pioneiras (Ishida et al., 1999).
36
5.3.5 Características fotossintéticas em função da condutância estomática
Diversos estudos têm mostrado que há uma estreita relação entre as taxas
fotossintéticas e condutância estomática gs (Kumar et al., 1999; Park & Furukawa, 1999;
Marenco et al., 2006). Neste estudo observou-se uma forte correlação entre fotossíntese
máxima (Amax) e condutância estomática (gs) (p<0,05), bem como fotossíntese potencial
(Apot), a velocidade máxima de carboxilação da Rubisco (Vc-max) e a taxa máxima de
transporte de elétrons (Jmax) e a condutância estomática (gs) (Figura 13).
-2 -1
-2 -1
y = 2,24Ln(x) + 9,4103
r²
R2== 0,61**
0,6072**
r²
A
B
y = 12,83x + 8,2319
2
= 0,13*
*
R
= 0,1346
r² r²
10
20
4
10
-2
0,00
60
0
0,13
0,25
0,38 C 0,00
y = 32,518x + 15,113
r²r²
-2 -1*
0,176
R2==0,17*
0,13
0,25
y = 45,498x + 34,62
r²R2== 0,11*
-2 -1 *
0,1117
r²
0,38 D
120
gs (mol m s )
gs (mol m s )
40
80
20
40
0
0,00
Jmax (μmol m-2 s -1)
Vc-max (μmol m s )
30
Apot (μmol m-2 s -1)
Amax (μmol m s )
16
0
0,13
0,25
0,38
0,00
-2 -1
gs (mol m s )
0,13
0,25
0,38
-2 -1
gs (mol m s )
Figura 13. Relação entre a condutância estomática (gs) e a fotossíntese saturada por luz (A,
Amax), capacidade fotossintética (B, Apot), a velocidade máxima de carboxilação da Rubisco
(C, Vc-max) e a taxa máxima de transporte de elétrons (D, Jmax) de cinco espécies florestais da
Amazônia. Medições efetuadas em concentração de CO2 380 (Amax) e 2000 (Apot) e
temperatura foliar de 28 ± 1 ºC. Cada símbolo representa uma folha por planta na época
chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●). *: significativo a 5% de
probabilidade. **: significativo a 1% de probabilidade,
37
Os dados mostram que valores baixos de gs limitam a capacidade fotossintética das
folhas mesmo em altas (5 vezes) concentrações de CO2 na câmera foliar. Isto pode ser
explicado pelo fato da entrada de CO2 na cavidade subestomática ocorrer quase que
exclusivamente através dos estômatos (Boyer et al., 1977), obviamente o efeito de gs no
controle da [CO2] é mais evidente em [CO2] ambiente (Figura 13 A versus B).
5.4. Luminosidade no sub-bosque
Uma estimativa de luminosidade no sub-bosque foi obtida multiplicando a irradiância
absoluta acima do dossel pelos valores de FCV. Dessa forma, obteve-se uma estimativa da
luminosidade em cada um dos microsítios em que as arvoretas usadas neste estudo cresciam.
Observou-se que a quantidade de luz que atinge o sub-bosque da floresta é menor na época de
chuva do que na época de seca (Figura 14), fato este que pode ser explicado pela alta
nebulosidade durante os meses de maior precipitação.
-2
-1
-1
Irradiância
diária
(mol
Irradiância
(mol
m-2mdiadia
))
3,0
2,0
1,0
0,0
0,00
0,04
0,08
0,12
FCV
Figura 14. Relação entre a irradiância no sub-bosque (estimada como a irradiância acima do
sub-bosque multiplicado por FCV) e a fração de céu visível (FCV), nas épocas de chuva
(círculo aberto, ○) e de seca (círculo fechado, ●) de 2008.
38
O índice de área foliar (IAF) e a fração de céu visível (FCV) não apresentaram
diferença significativa (p > 0,05) com as épocas do ano (seca e chuva) (Tabela 1A). No
entanto, somente FCV apresentou diferenças significativas (p > 0,05) entre espécies.
A média do IAF oscilou de 3 a 5 (Figura15), o que está dentro da faixa de valores
observados por outros autores (Clark et al., 2008; Myneni et al., 2007; Asner et al., 2003;
McWillians et al.,1993). Por exemplo, McWillians et al. (1993) relatam o índice de área foliar
numa floresta de terra-firme a Amazônia foi em média 5,7 e Clark et al. (2008) encontraram
IAF de 6,0 numa floresta úmida da Costa Rica.
Os valores da FCV oscilaram de 0,02 a 0,06, onde valor menor de IAF e maior de
FCV foi encontrado na espécie Simarouba amara em ambas as épocas (seca e chuvosa)
(Figura 15).
Figura 15. Variação sazonal do índice de área foliar (IAF, A) e da fração de céu visível
(FCV, B), nas épocas de chuva e de seca referentes ao ano de 2008. Cada barra corresponde a
média de três plantas por espécie. As linhas verticais nas barras indicam o erro padrão da
média. Os dados de IAF e FCV correspondem aos valores observados nos microsítios do subbosque ocupados pelas arvoretas das espécies estudadas.
39
O índice de área foliar (IAF) teve relação altamente significativa com a fração de céu
visível (FCV) (r2 = 0,88**) no sub-bosque. Essa relação é possível porque o IAF é
quantificado a partir da quantidade de folhagem no dossel; isto é, maior FCV implica em
menor IAF (Figura 16).
7,0
-0,2084
y = 2,0291x
**
R
r²r² ==0,886
0,88**
2
IAF
5,3
3,7
2,0
0,00
0,04
0,08
0,12
FCV
Figura 16. Relação entre o índice de área foliar do dossel (IAF – m2 área foliar/m2 superfície)
e a fração de céu visível (FCV, fração de abertura do dossel/céu aberto). Cada símbolo
representa medição de uma planta por espécie na época chuvosa (circulo aberto, ○) e na época
seca (circulo fechado, ●). **: significativo a 1% de probabilidade,
A irradiância no sub-bosque interferiu significativamente (p < 0,01) nas taxas de
fotossíntese máxima (Amax) e potencial (Apot) (Figura 17), o que mostra que pequenas
alterações no ambiente luminoso do sub-bosque influenciam de forma significativa o
desempenho fotossintético da planta. Porém, este estudo não permite inferir sobre a
capacidade de resposta da folha aos sunflecks, embora, seja relatado por Pearcy (1990) que as
folhas de plantas do sub-bosque tenham potencial para responder rapidamente aos sunflecks.
Pearcy (1990) relata que a grande parte dos valores de fotossíntese podem ser
atribuídos a utilização do sunflecks pelas folhas das plantas do sub-bosque. Porém deve se
considerar um conjunto de fatores que atuam preliminarmente para a assimilação de CO2,
como a condutância estomática, as enzimas fotossintéticas e a taxa de luminosidade do
entorno.
40
Segundo Oguchi et al. (2005) o aumento nas taxas de fotossíntese de plantas
adaptadas à baixa irradiância, e que passam a receber mais luz, só é possível quando as folhas
possuem capacidade para aumentar o tamanho dos cloroplastos nas células do mesofilo; isto
é, na interface cloroplasto/espaço intercelulares. Esses autores ainda sugerem que plantas que
possuem grande espaço vazios nas células do mesofilo (área da membrana celular não
ocupada por cloroplastos) conseguem desenvolver-se rapidamente após uma abertura no
dossel.
-2 -1
Amax (μmol m s )
15
A
y = 1,7218x + 2,5934
r²2 = 0,36**
10
R = 0,3603
5
0
2,00
y1,00
= 3,535x + 6,4795
B 3,00
-2
-1
r²R2=diária
=0,52**
0,5181
Irradiância
(mol m dia )
-2 -1
Apot (μmol m s )
270,00
18
9
0
0,00
1,00
2,00
3,00
-2
-1
-1
Irradiância
diária
(mol
Irradiância
(mol
m-2mdiadia
) )
Figura 17. Fotossíntese saturada por luz (A, Amax), capacidade fotossintética (B, Apot) em
função da irradiância no sub-bosque cinco espécies florestais da Amazônia. Cada símbolo
representa uma planta por espécie na época chuvosa (circulo aberto, ○) e na época seca
(circulo fechado, ●). **: significativo a 1% de probabilidade.
41
Warren & Adams (2001) encontraram fraca relação entre o conteúdo da Rubisco por
unidade de área e a irradiância relativa em Pinus pinaster. No entanto, neste estudo, a
velocidade máxima de carboxilação da rubisco (Vc-max) e taxa máxima de transporte de
elétrons (Jmax) mostraram-se sensíveis a variações de luminosidade no sub-bosque da floresta
(Figura 18).
-2 -1
Vc-max (μmol m s )
60
A
y = 7,0014x + 12,467
r²2 == 0,43**
0,4309**
R
r²
40
20
0
-2 -1
Jmax (μmol m s )
0,00
120
1,00
2,00
B 3,00
y = 14,188x + 27,235 -2 -1
2= 0,52**
Irradiânciar²
(mol m dia )
R
= 0,5207 **
r²diária
80
40
0
0,00
1,00
2,00
3,00
-2
-1
-1
Irradiância
(mol
m-2mdiadia
) )
Irradiância
diária
(mol
Figura 18. Relação entre irradiância no sub-bosque e a velocidade máxima de carboxilação
da Rubisco (A, Vc-max) e a taxa máxima de transporte de elétrons (B, Jmax) em cinco espécies
florestais de terra-firme na Amazônia Central. Cada símbolo representa uma planta por
espécie na época chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●). **:
significativo a 1% de probabilidade.
42
A irradiância no sub-bosque apresentou relação significativa (p < 0,05) com o
incremento médio anual em diâmetro (IAD) (Figura 19B), o que corrobora com Clark et al.,
(1999) que observaram uma forte associação entre o incremento anual em diâmetro e a
irradiância do ambiente em espécies tropicais de árvores juvenis. No entanto o mesmo
comportamento não foi observado para o incremento médio anual em altura (IAA) (Figura
19A). Este fato pode ser explicado devido a mudanças ocorridas no ambiente da plantas
promovidas por aberturas de clareiras, o qual influenciou nos dados de FCV em dado
momento.
0,5
-1
IAA (m ano )
y = -0,0249x + 0,0841
0,3
r²
2 = 0,03
ns
Rr² = 0,035
A
ns
0,1
-1
IAD (mm ano )
-0,1
-0,50
3,0
1,50
y0,50
= 0,2668x
+ 0,28262,50B
2
r² r²==0,0928
-2 * -1
R
0,09*
Irradiância
(mol
m dia )
2,0
0,9
-0,2
-0,50
0,50
1,50
2,50
-2
-1
Irradiância (mol m dia )
Figura 19. Relação entre as taxas de incremento médio anual em altura (IAA, A) e diâmetro
(IAD, B) e a irradiância no sub-bosque. Dados coletados em cinco espécies florestais de terrafirme na Amazônia Central. ns: não significativo a 5% de probabilidade. *: significativo a 5%
de probabilidade.
43
5.5. Conteúdos de clorofila e nutrientes, área foliar específica, relação Fv/Fm e espessura
foliar
A época do ano não influenciou significativamente (p < 0,05) nos teores de clorofila,
na razão clorofila a/b, nos teores de carotenóides, relação clorofila/carotenóides, AFE, relação
Fv/Fm, espessura foliar e teores de nutrientes (Tabelas 7-11). Os teores de clorofila total por
unidade de área encontrados neste estudo (Tabelas 7) são comparáveis aos relatados em
estudos anteriores (Bjorkman & Demmig, 1995). Em relação à razão clorofila a/b todas as
espécies apresentaram entre 1 e 3 µmol m-2 (Tabela 8). Os resultados obtidos neste estudo
concordam com valores encontrados em espécies na fase juvenil crescidas sob baixa
luminosidade (McMillen & McClendon, 1983; Boardman, 1977). Segundo Torres Netto et al.
(2005) a razão a/b em plantas que crescem nos ambientes com baixa luminosidade tem uma
relação em torno de 2,5-2,9. O teor de carotenóide variou entre 64,6 em Rinorea guianensis e
108,0 em Duroia saccifera (Tabela 8). A relação clorofila/carotenóide oscilou entre 3,42 em
Minquartia guianensis e 4,90 µmol m-2 em Duroia saccifera. Estes resultados corroboram
com os encontrados por Oguchi et al. (2005) e Carvalho et al. (2006) que têm mostrado
diferenças nas concentrações de clorofila em folhas que recebem níveis diferentes de
luminosidade. Segundo Hikosaka & Terashima (1995) plantas aclimatadas à sombra
apresentam uma maior concentração de complexos coletores de luz (FSII e FSI), o que
explica maior concentração de clorofila em espécies na fase juvenil crescidas sob baixa
luminosidade.
É importante observar que a relação clorofila/carotenóide foi maior do que valores
reportados por outros autores para plantas aclimatadas ao sol (4,1 neste estudo contra 2,25
relatado por Magalhães et al. (2009) para planta de sol). Isto se deve ao fato de plantas de
sombra apresentarem menor proporção de carotenóides com relação ao teor de clorofila total,
haja vista que os carotenóides participam na fotoproteção.
44
Tabela 7. Teores absolutos de clorofila (a, b e a+b) em função da espécie e da época do ano (chuva e seca). Dados coletados nos meses de
agosto (seca) e Dezembro (chuva) de 2008. Cada valor corresponde a médias de três arvoretas (desvio padrão). Mostra-se também o valor de F
entre espécies e para a interação espécie x época.
Espécie
Clorofila a
Clorofila b
Clorofila a+b
(µmol m-2)
(µmol m-2)
(µmol m-2)
Seca
Chuva
Seca
M. guianensis
210,53(83,52)Aa
177,11(44,66)Aa
134,46(18,73)Aa
184,82(23,43)Aa 344,99(102,25)Aa
261,93(67,32)Aa
G. olivacea
318,85(50,22)Aa
252,78(31,75)Aa
134,28(22,21)Aa
107,03(17,10)Aa
453,14(72,43)Aa
359,81(48,84)Aa
R. guianensis
202,00(55,57)Aa
193,54(30,99)Aa
126,33(44,05)Aa
84,34(18,30)Aa
328,39(77,73)Aa
277,89(48,68)Aa
S. amara
259,03(33.81)Aa
250,23(63,74)Aa
122,43(7,80)Aa
128,36(47,33)Aa
381,46(40,60)Aa
378,59(102,21)Aa
D. saccifera
218,66(28,54)Aa
267,33(52,13)Aa
99,44(19,77)Aa
112,66(21,03)Aa
318,10(47,61)Aa
380,00(72,56)Aa
241,81(63,85)
228,20(53,97)
123,40(25,27)
123,44(29,28)
365,21(78,94)
331,64(79,84)
CV (%)
22,30
20,31
20,61
26,85
19,61
21,32
F (espécie)
2,40 ns
2,24 ns
0,95 ns
1,39 ns
1,75 ns
1,96 ns
Média
F (sp x época)
1,05 ns
Chuva
1,68 ns
Seca
Chuva
1,21 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não diferem ao nível de 5% de probabilidade pelo teste de
Tukey. ns: não significativo a 5% de probabilidade.
45
Tabela 8. Razão clorofila a/b, teores de carotenóides e na relação clorofila/carotenóides em função da espécie e da época do ano (seca e chuva).
Dados coletados nos meses de agosto (seca) e dezembro (chuva) de 2008. Cada valor corresponde a médias de três arvoretas (desvio padrão).
Mostra-se também o valor de F entre espécies e para a interação espécie x época.
Espécie
Razão clorofila a/b
Carotenóides (µmol m-2)
Relação chl/car
Seca
Chuva
Seca
Chuva
Seca
Chuva
M. guianensis
1,53(0,43)Aa
2,10(0,17)Aa
100,66(28,58)Aa
67,03(15,14)Ab
3,42(0,13)Aa
3,89(0,16)Aa
G. olivacea
2,38(0,02)Aa
2,37(0,08)Aa
103,54(33,22)Aa
91,52(1,86)Aab
4,54(0,82)Aa
3,93(0,45)Aa
R. guianensis
1,70(0,55)Aa
2,31(0,17)Aa
92,05(24,00)Aa
64,60(9,19)Ab
3,58(0,10)Aa
4,29(0,17)Aa
S. amara
2,11(0,18)Aa
2,07(0,54)Aa
88,65(26,44)Aab
4,56(0,29)Aa
4,30(0,20)Aa
D. saccifera
2,22(0,22)Aa
2,37(0,13)Aa
84,20(14,05)Aa
69,36(22,69)Aa
108,08(10,89)Aa
4,90(1,50)Aa
3,58(0,99)Aa
1,98(0,43)
2,24(0,27)
89,96(24,92)
83,97(21,10)
4,20(0,89)
3,99(0,51)
CV (%)
17,00
12,07
28,16
17,94
18,47
12,62
F (espécie)
3,42 ns
0,92 ns
0,88 ns
4,36*
2,14 ns
1,08 ns
Média
F (sp x época)
1,61 ns
2,90ns
2,35 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não diferem ao nível de 5% de probabilidade pelo teste de
Tukey. ns: não significativo a 5% de probabilidade. *: significativo a 5% de probabilidade.
46
Alguns estudos mostram que em condições de sombreamento a eficiência da
fotossíntese possue relação positiva com a concentração de clorofila (Gabrielsen, 1948), o que
corrobora com os resultados encontrados neste estudo, onde os parâmetros fotossintéticos
(Apot, Vc-max e Jmax) foram significativamente (p≤0,05) influenciados pelo aumento do
contéudo de clorofila, ou seja, a medida que aumenta os valores de clorofila total aumenta as
taxas fotossintéticas da folha (Figura 20 ).
30
-2 -1
Apot (μmol m s )
A
2
r = 0,15*
20
10
60 50
250
450
B 650
-2
2
-2 -1
Vc-max (μmol m s )
0
Clorofila
(μmol m )
r = total
0,23*
40
20
0
-2 -1
Jmax (μmol m s )
120 50
250
450
C 650
-2
2
Clorofila
(μmol m )
r =total
0,19*
80
40
0
50
250
450
650
-2
Clorofila total (μmol m )
Figura 20 - Relação entre fotossíntese potencial (Apot), velocidade máxima de carboxilação da
Rubisco (Vc-max), taxa máxima de transporte de elétrons (Jmax) e o conteúdo de clorofila total.
Os dados mostram os resultados obtidos com cinco espécies. Cada ponto representa uma
folha por planta. *: significativo a 5% de probabilidade.
47
Os valores de AFE variaram de 14,38 m2 kg-1 em G. olivacea para 24,52 m2 kg-1 em
Rinorea guianensis (Tabela 9). Estes valores de AFE estão na faixa de valores observados por
Marenco & Vieira (2005) que encontraram valores de AFE entre 15 m2 kg-1 e 24 m2 kg-1 para
espécies de dossel na fase juvenil. Em estudo com mudas de Guapira opposita, Lima- Junior
(2005) encontrou maior AFE em folhas de sombra. Groninger et al. (1996), observaram em
plantas jovens, tolerantes a sombra, maior AFE em condições de sombreamento. Rego &
Possamai (2006) também observaram que mudas de Cariniana legalis (Martius) tem maior
AFE em baixa luminosidade. A eficiência fotoquímica do fotossistema II, avaliada pela razão
Fv/Fm apresentaram oscilaram entre 0,58 a 0,78 (Tabela 9). De acordo com Boardman (1977),
valores da razão Fv/Fm entre 0,75 e 0,85 são característicos de plantas em ótimas condições de
desenvolvimento.
Tabela 9. Área foliar específica (AFE) e relação Fv/Fm em função da espécie e da época do
ano (seca e chuva). Dados coletados nos meses de agosto (seca) e dezembro (chuva) de 2008.
Cada valor corresponde a médias de três arvoretas (desvio padrão). Mostra-se também o valor
de F entre espécies e para a interação spécie x época.
Espécie
AFE (m2 kg-1)
Fv/Fm
Seca
Chuva
Seca
Chuva
M. guianensis
18,54(3,67)Aa
16,74(1,31)Aa
0,69(0,03)Aa
0,73(0,01)Aa
G. olivacea
14,38(0,67)Aa
14,44(1,96)Aa
R. guianensis
24,52(6,42)Aa
20,72(1,86)Aa
0,67(0,13)Aa
0,67(0,18)Aa
0,58(0,04)Ab
0,71(0,03)Aa
S. amara
21,64(0,75)Aa
20,55(5,00)Aa
20,97(0,93)Aa
0,70(0,05)Aa
0,59(0,05)Ab
19,71(4,61)Aa
0,78(0,02)Aa
0,75(0,02)Aa
19,92(4,87)
18,51(3,15)
0,70(0,09)
0,67(0,08)
CV (%)
20,14
13,77
14,34
5,06
F (espécie)
2,65 ns
3,04 ns
0,60 ns
17,13*
D. saccifera
Média
F (sp x época)
0,30 ns
1,34 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não
diferem ao nível de 5% de probabilidade pelo teste de Tukey. ns: não significativo a 5% de
probabilidade. *: significativo a 5% de probabilidade.
48
Em relação a espessura foliar, os valores oscilaram entre 0,09 e 0,20 mm em folhas
desidratadas (Tabela 10), o que está dentro dos padrões encontrados para folhas desenvolvidas
em baixa intensidade luminosa (McMillen & McClendon, 1983; Niinemets, 2001). Estudos
comprovam que plantas de sombra apresentam espessura foliar mais fina do que plantas
crescidas sob alta radiação solar (Oguchi et al., 2005). O baixo valor de espessura foliar pode
ser explicado pelo fato de que as plantas adaptadas a baixa intensidade luminosa investem
muito pouco em espessura foliar, mas podem aumentar após serem transferidas a maior
irradiância (Oguchi et al., 2005).
Tabela 10. Espessura foliar fresca (EFF) e desidratada (EFD) em função da espécie e da
época do ano (seca e chuva). Dados coletados nos meses de agosto (seca) e dezembro (chuva)
de 2008. Cada valor corresponde a médias de três arvoretas (desvio padrão). Mostra-se
também o valor de F entre espécies e para a interação spécie x época.
EFF (mm)
Espécie
EFD (mm)
Seca
Chuva
Seca
Chuva
M. guianensis
0,12(0,01)Aa
0,14(0,01)Ab
0,09(0,01)Aa
0,11(0,01)Ab
G. olivacea
0,21(0,06)Aa
0,22(0,04)Aab
R. guianensis
0,14(0,01)Aa
0,15(0,01)Ab
0,16(0,06)Aa
0,09(0,02)Aa
0,17(0,04)Aab
0,13(0,02)Ab
S. amara
0,21(0,03)Aa
0,15(0,06)Aa
0,24(0,03)Aa
0,18(0,03)Aa
0,20(0,02)Aa
0,17(0,06)Aab
0,12(0,04)Aa
0,14(0,04)Aab
0,17(0,05)
0,18(0,05)
0,13(0,05)
0,15(0,04)
CV (%)
23,95
17,75
25,89
18,62
F (espécie)
3,29 ns
5,22*
3,98ns
5,70*
D. saccifera
Média
F (sp x época)
0,60 ns
0,18 ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não
diferem ao nível de 5% de probabilidade pelo teste de Tukey. ns: não significativo a 5% de
probabilidade. *: significativo a 5% de probabilidade.
A área foliar específica (AFE) foi positivamente correlacionada (p ≤ 0,05) com Apot,
Amax, Vc-max e Jmax (Figura 21). O aumento da AFE está relacionado com a diminuição das
49
variáveis acima mencionadas, seguindo o mesmo padrão encontrado por outros autores
(Evans, 1983; Reich et al., 1992, 1999; Poorter & Evans, 1998).
12
30
-2 -1
B
2
2
r = 0,12*
r = 0,15*
8
20
4
10
0
0
60 0
11
22
-2
-2 -1
33C 0
-1
11
22
2
AFE2 (m kg )
r = 0,15*
D
33
-2
120
-1
r (m
= 0,16*
kg )
AFE
40
80
20
40
0
0
0
11
22
-2
33
-1
AFE (m kg )
0
11
22
-2
Jmax (μmol m-2 s-1)
Vc-max (μmol m s )
Apot (μmol m-2 s-1 )
Amax (μmol m s )
A
33
-1
AFE (m kg )
Figura 21. Relação entre fotossíntese saturada por luz (A, Amax), fotossintética potencial (B,
Apot) velocidade máxima de carboxilação da Rubisco (C, Vc-max) e taxa máxima de transporte
de elétrons (D, Jmax) e a área foliar específica (AFE) em cinco espécies florestais de terrafirme na Amazônia Central. Cada símbolo representa uma planta por espécie na época
chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●). *: significativo a 5% de
probabilidade. Valores de Jmax e Vc-max calculados a 25 ºC.
A área foliar específica foi positivamente correlacionada com clorofila total ( r2= 0,11,
p ≤ 0,05) e espessura foliar ( r2= 0,10, p ≤ 0,05) (Figura 22), haja vista que o aumento da AFE
esta relacionado com a diminuição da espessura foliar e conteúdos de clorofila, o que
corrobora com os resultados encontrados por outros estudos (Evans, 1983; Reich et al., 1992,
1999; Poorter & Evans, 1998), onde mostra forte e positiva relação entre a área foliar
específica (AFE) e espessura.
50
A
-2
Clorofila
m-2m) )
Clorofilatotal
(a+b)(µmol
(μmol
1200
1200
y = -7,9939x + 496,81
2
0,12**
R r²==0,1169
r²
800
800
400
400
0
0,4 10
23
y 17
= -0,004x + 0,2155
EFD
(mm )
EFD
(mm)
-2
B 30
-1
2
kg *)
AFE
= 0,1004
Rr² (m
r²
0,10*
0,3
0,1
0,0
10
17
23
-2
30
-1
AFE (m kg )
Figura 22. Relação entre , clorofila total (clorofila (a+b)), espessura foliar desidratada (EFD)
e a área foliar específica (AFE) em cinco espécies florestais da Amazônia. Cada símbolo
representa uma planta por espécie na época chuvosa (circulo aberto, ○) e na época seca
(circulo fechado, ●). *: significativo a 5% de probabilidade.
Folhas de G. olivacea, em ambas as épocas, exibiram o maior conteúdo de nitrogênio
(N), 1.07 enquanto que o menor conteúdo de nitrogênio foi encontrado em R. guianensis com
0.78 g m-2, respectivamente (Tabela 11). Esses valores são comparáveis aos relatados em
diversos estudos em diferentes espécies (Evans, 1983; Reich et al., 1995; Osone et al., 2008).
Quanto ao conteúdo de fósforo (P), as folhas das cinco espécies exibiram teores
similares no período “seco” e chuvoso. Os dados obtidos corroboram com os resultados de
vários autores que concluíram que o P está quase sempre em baixo suprimento nas florestas
tropicais (Medina et al. 1990; Thompson et al. 1992; Turner et al. 1995), devido ao alto
51
intemperismo dos solos e aos processos de imobilização deste nutriente no solo (Waring &
Schlisinger 1985).
Tabela 11. Conteúdo de nitrogênio (N) e fósforo (P) em função da espécie e da época do ano
(seca e chuva). Dados coletados nos meses de agosto (seca) e dezembro (chuva) de 2008.
Cada valor corresponde a médias de três arvoretas (desvio padrão). Mostra-se também o valor
de F entre espécies e para a interação spécie x época.
N (g m-2)
P (g m-2)
Espécie
Seca
Chuva
Seca
Chuva
M. guianensis
0,91(0,19)Aa
0,84(0,07)Aa
0,03(0,01)Aa
0,03(0,00)Aa
G. olivacea
1,07(0,11)Aa
1,03(0,10)Aa
0,03(0,01)Aa
0,02(0,00)Aa
R. guianensis
0,78(0,16)Aa
1,02(0,11)Aa
0,02(0,01)Aa
0,02(0,00)Aa
S. amara
0,92(0,02)Aa
0,99(0,13)Aa
0,03(0,01)Aa
0,03(0,01)Aa
D. saccifera
0,85(0,23)Aa
0,97(0,28)Aa
0,02(0,01)Aa
0,02(0,01)Aa
0,90(0,17)
0.97(0,15)
0,024(0,009)
0.023(0,005)
CV (%)
17,85
16,09
31,78
19,51
F (espécie)
1,32 ns
0,74 ns
0,56 ns
1,80 ns
Média
F (sp x época)
0,95ns
0,21ns
Médias seguidas pela mesma letra, maiúsculas nas linhas e minúsculas nas colunas, não
diferem ao nível de 5% de probabilidade pelo teste de Tukey. ns: não significativo a 5% de
probabilidade.
A relação entre a capacidade fotossintética (Amax, Apot, Vc-max e Jmax), e o conteúdo de
nitrogênio foliar foi significativa (p≤0,05) (Figura 23), o que corrobora com resultados
encontrados por outros autores (Field & Mooney, 1986; Medlyn et al., 1999; Peterson et al.,
1999; Warren & Adams, 2001) que relatam que a fotossíntese saturada por luz (Amax) e a
capacidade de carboxilação da rubisco (Vc-max) possuem relação linear com o conteúdo de
nitrogênio por unidade de área.
52
12
30
-2 -1
2
r = 0,24**
8
r = 0,12**
20
10
4
0
60 0,5
0,8
1,0
-2 -1
-2
1,3
C 0,5
0,8
-1
1,0
-2
Nr2 (m
kg )
= 0,22**
1,3 D
0
120
-1
2
N
kg )
r (m
= 0,17**
40
80
20
40
0
0
0,5
0,8
1,0
-2
1,3
0,5
-1
N (m kg(g) m-2)
Nitrogênio
0,8
1,0
-2
Jmax (μmol m-2 s-1)
Vc-max (μmol m s )
B
Apot (μmol m-2 s-1 )
Amax (μmol m s )
A
2
1,3
-1
N (m kg(g )m-2)
Nitrogênio
Figura 23 - Relação entre fotossíntese saturada por luz (A, Amax), fotossíntese potencial (B,
Apot), velocidade máxima de carboxilação da Rubisco (C, Vc-max), a taxa máxima de transporte
de elétrons (D, Jmax) e conteúdo de nitrogênio (N). Os dados mostram os resultados obtidos
com cinco espécies. Cada ponto representa uma folha por planta. **: significativo a 1% de
probabilidade.
O efeito positivo do nitrogênio foliar em Apot, clorofila total (Figura 24) foi consistente
aos resultados relatados por Evans (1983), Reich et al. (1992) e Hikosaka (2004; 2005)
confirmando a importância desse nutriente no aparato fotossintético.
Assim, plantas com maiores concentrações de nitrogênio foliar apresentaram maiores
taxas fotossintéticas, sendo estas taxas fotossintéticas maiores em plantas com menor área
foliar específica, ou seja, maior espessura foliar.
53
O aumento na espessura da folha (baixos valores de AFE) está relacionado às maiores
taxas fotossintéticas por unidade de área, provavelmente pelo aumento no acúmulo da rubisco
e aumento nos teores de nitrogênio foliar por unidade de área em comparação a folha com
maior AFE (Reich et al., 1992). Aproximadamente 80% do nitrogênio total da folha são
investidos nos cloroplastos, particularmente na rubisco (Evans & Seeman, 1989). O que leva a
relação positiva entre o teor de nitrogênio e a capacidade fotossintética da folha. Vários
estudos mostraram que a baixa irradiância aumenta a divisão do nitrogênio e a quantidade de
clorofila nos tilacóides, pois a capacidade de transporte dos elétrons por unidade de clorofila
diminui (Evans, 1983).
-2
A
B
2
0,60
2
r = 0,20**
r = 0,31**
800
0,40
400
0,20
0
0,00
0,5
0,8
1,0
-2
1,3
-1
N (m kg (g
) m-2)
Nitrogênio
0,5
0,8
1,0
-2
EFD (mm)
Chorofila total (μmol m )
1200
1,3
-1
N (m kg(g) m-2)
Nitrogênio
Figura 24 - Relação entre clorofila total, espessura foliar desidratada (EFD) e conteúdo de
nitrogênio (N). Os dados mostram os resultados obtidos com cinco espécies. Cada ponto
representa uma folha por planta. **: significativo a 1% de probabilidade.
O conteúdo de nitrogênio (N) e fósforo (P) da folha apresentou correlação positiva (P
≤ 0,05) com a AFE (Figura 25). Osone et al. (2008) observaram declínio de 47% no conteúdo
de nitrogênio total da planta com o aumento no gradiente da AFE o que sugere que o aumento
na AFE esteja associado ao um declínio na concentração de N foliar, que por sua vez é um
outro componente ligado ao crescimento.
54
3
3,0
0,08
B
2
r = 0,21**
2
r = 0,45**
2
2,0
0,05
1
1,0
0,03
0
0,0
0,00
0
11
22
-2
33
0
11
-1
AFE (m kg )
22
-2
Fósforo (g m -2 )
Nitrogênio (g m-2)
-2
Nitrogênio (g m )
A
33
-1
AFE (m kg )
Figura 25. Relação entre conteúdo de nitrogênio (N) e fósforo (P) e a área foliar específica
(AFE) em cinco espécies florestais da Amazônia. Cada simbolo representa uma planta por
espécie na época chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●). **:
significativo a 1% de probabilidade.
O fósforo (P) foi positivamente relacionado (P ≤ 0,05) com Apot, Vc-max e Jmax (Figura
26), o que confirma a importância deste nutriente no processo fotossintético (ATP, NAPH). A
oferta de fósforo inorgânico regula o ciclo de Calvin e o transporte de metabólicos e de
compostos assimilados. Contudo, a deficiência do mesmo resulta em uma acumulação de
assimilados (sacarose e amido) no cloroplasto, deprimindo a fotossíntese até mesmo sob
condições favoráveis (Senft, 1978; Lauer et al., 1989). Reich et al. (1995) também observou
correlação significativa entre a capacidade fotossintética e o conteúdo de fósforo, o que
corrobora com os resultados apresentados neste trabalho.
55
-2 -1
Apot (μmol m s )
30
20
y = 217,97x + 3,8855
2
0,3286 **
r²R==0,33**
A
r²
10
0
-2 -1
Jmax (μmol m s )
1200,01
0,03
y0,02
= 829,05x + 17,954
-2
-1
PRr²2(m
kg ) **
== 0,2966
0,30**
B 0,04
0,02
0,03
y = 284,4x
-2 +-110,965
kg )
P (m
2
Rr² = 0,1186
0,12* *
C 0,04
r²
80
40
600,01
-2 -1
Vc-max (μmol m s )
0
40
r²
20
0
0,01
0,02
0,03
-2
-1
0,04
-2
PFósforo
(m kg(g )m )
Figura 26 - Relação entre fotossíntese potencial (A, Apot), a taxa máxima de transporte de
elétrons (B, Jmax), a velocidade máxima de carboxilação da Rubisco (C, Vc-max), e o conteúdo
de fósforo (P) em cinco espécies florestais da Amazônia. Cada símbolo representa uma planta
por espécie na época chuvosa (circulo aberto, ○) e na época seca (circulo fechado, ●). *:
significativo a 5% de probabilidade. **: significativo a 1% de probabilidade.
56
6. CONCLUSÃO
¾ As taxas de fotossíntese máxima (Amax) e a condutância estomática (gs) mostraram ser
influenciadas pelo horário do dia, o que indica que medições das taxas fotossintéticas
devem ser realizadas entre 9 e 14 h.
¾ A variação sazonal da precipitação nas épocas seca e chuvosa não teve efeito na
fotossíntese máxima e potêncial, velocidade máxima de carboxilação da Rubisco (Vcmax),
a taxa máxima de transporte de elétrons (Jmax), provavelmente devido ao curto
período de seca na época de estudo.
¾ A espécie Simarouba amara apresentou maiores taxas fotossintéticas (Amax e Apot), Vcmax
e Jmax e maior espessura foliar. Microsítios do sub-bosque ocupados por esta
espécie apresentaram menor índice de área foliar (IAF) e maior valor de fração de céu
visível (FCV), indicando que variações na luminosidade do sub-bosque influenciam
significativamente os parâmetros fisiologicos e anatômicos da folha.
¾ O fator limitante da fotossíntese em níveis CO2 do ambiente (CO2 no ar de 380 µmol
mol-1), independente da espécie, foi a velocidade de carboxilação da Rubisco,
mostrando que, aumentos na [CO2] de 380 a 700 µmol mol-1 pode incrementar a taxa
fotossintética da planta.
¾ Houve relação positiva entre a capacidade fotossintética (Amax, Apot, Vc-max e Jmax) e os
conteúdos de nitrogênio e fósforo, o que mostra que taxas fotossintéticas podem ser
limitadas pela disponibilidade de nutrientes.
¾ A taxa de crescimento de arvoretas no sub-bosque é relativamente baixa (0,8 mm ano1
) e tende a ser maiores nos ambientes mais iluminados. Porém, aparentemente não há
correlação com a capacidade fotossintética da folha, o que mostra que o crescimento
da planta é o resultado de uma complexa interação de fatores, como fotossíntese foliar,
translocação de assimilados e respiração.
57
7. REFERÊNCIAS BIBLIOGRÁFICAS
Aerts, R.; Chapin III, F.S. 2000. The mineral nutrition of wild plants revisited: re-evaluation
of processes and patterns. Advances in Ecological Research, 30:1-67.
Almeida, L.P.; Alvarenga, A.A.; Castro, E.M.; Zanela, S.M.; Vieira, C.V. 2004. Crescimento
inicial de plantas de Cryptocaria aschersoniana Mez. submetidas a níveis de radiação
solar. Ciência Rural, 34: 83- 88.
Asner, G.P.; Scurlock, J.M.O.; Hicke, J.A. 2003. Global synthesis of leaf area index
observations: implications for ecological and remote sensing studies. Global Ecology
and Biogeograph, 12: 191–205.
Assmann, S.M. 1993. Signal transduction in guard cells. Annual Review of Cell Biology, 9:
345-375.
Atroch, E.M.A.C; Soares, A.M.; Alvarenga, A.A.; Castro, E.M. 2001. Crescimento, teor de
clorofilas, distribuição de biomassa e características anatômicas de plantas jovens de
Bauhinia forticata Link submetidas à diferentes condições de sombreamento. Ciência
e Agrotecnologia, 25: 853–862.
Baroli, I.; Price, G.D.; Badger, M. R.; Caemmerer, S.V. 2008. The contribution of
photosynthesis to the red light response of stomatal conductance. Plant Physiology,
146: 737-747.
Bazzaz, F.A.; Carlson, R.W. 1982. Photosynthetic acclimation to variability in the light
environment of early and late sucessional plants. Oecologia, 54: 313-316.
Bergmann, C.; Sturmann, M.; Zech, W. 1994. Site factors, foliar nutrient levels and growth of
Cordia alliodora plantations in the humid lowlands of Northern Costa Rica. Plant and
Soil, 166: 193-202.
Berry, J.A.; Bjorkman, O. 1980. Photosynthetic response and adaptation to temperature in
higher plants. Annual Review Plant Physiology, 31: 491-543.
Binkley, D. 1986. Forest nutrition management. A Wiley- Interscience Publication. New
York, John Wiley & Sons.
Björkamn, O; Demmig-Adams, B. 1995. Regulation of photosynthetic light energy capture,
conversion, and dissipation in leaves of higher plants. In: Schulze, E.D. & Caldwell,
M.M. (Eds.). Ecophysiology of Photosynthesis. Berlin, Heidelberg, New York:
Springer –Verlag.17-47.
58
Björkman, O. 1981. Responses to different quantum flux densities. In Encyclopedia of Plant
Physiology, NS. Physiological Plant Ecology 1. 12A, Lange, O.; Nobel, P.; Osmond,
C.; Ziegler, H., Eds. Springer-Verlag: Berlin, 57-107.
Boardman. N.K. 1977. Comparative photosynthesis of sun and shade plants. Annual Review
of Plant Physiology, 28: 355-377.
Bowes, G. 1991. Growth at elevated CO2 photosynthetic responses mediated through
Rubisco. Plant Cell and Environment, 14: 795- 806
Boyer, J.S; Wong, S.C; Farquhar, G.D. 1977. CO2 and water vapor exchange across leaf
cuticle (epidermis) at various water potentials. Plant Physiology, 114: 185-191.
Brooks, A. & Farquhar, G.D. 1985. Effects of temperature on the CO2/O2 specificity of
ribulose-1, 5-bisphosphate carboxilase/oxigenase and the rate of respiration in the
light. Planta, 165: 397-406.
Caemmerer, S. Von. 2000. Biochemical models of leaf photosynthesis. CSIRO Publishing,
Camberra, 165 p.
Carvalho, N.O.S.; Pelacani, C.R.; Rodrigues, M.O.S.; Crepaldi, I.C. 2006. Crescimento inicial
de plantas de Licuri (Syagrus coronata (Mart.) Becc.) em diferentes níveis de
luminosidade. Revista Árvore, 30: 351-357.
Castro, Y.; Fetcher, N; Fernández, D.S. 1995. Chronic photoinhibition in seedlings of tropical
trees. Physiologia Plantarum, 94: 560-565.
Chapin III, F.S. 1980. The mineral nutrition of wild plants. Annual Review of Ecology and
Systematics, 11: 233-240.
Chappelle, E.W.; Kim, M.S. 1992. Ratio analysis of reflectance spectra (RARS): an algorithm
for a remote estimation of the concentractions of clorophyll a, chorophyll b, and
carotenoids in soybean leaves. Remote Sensing of Environment, 39: 239-247.
Chazdon, R.L.; Fetcher, N. 1984. Photosynthetic light environment in a lowland tropical rain
forest in Costa Rica. Journal of Ecology, 72: 553-564.
Cheng L.; Fuchigami L.H. 2000. Rubisco activation state decreases with increasing nitrogen
content in apple leaves. Journal of Experimental Botany, 51: 1687-1694.
Choudhury, N.K.; Behera, R.K. 2001. Photoinhibition of photosynthesis: role of carotenoids
in photoprotection of chloroplast constituents. Photosynthetica, 39: 481-488.
Clark, D.A.; Clark, D.B. 1992. Life history diversity of canopy and emergent trees in a
neotropical rainforest. Ecological Monographs, 62: 315–344.
Clark, D.A.; Clark, D.B. 2001. Getting to the canopy: Tree height growth in a neotropical rain
forest. Ecology, 82: 1460-1472.
59
Clark, D.A.; Clark. D.B. 1994. Climate-induced annual variation in canopy tree growth in a
Costa Rican tropical rain forest. Journal of Ecology, 82: 865–872.
Clark, D.B. ; Olivas, P.C. ; Oberbauer, S.F. ; Clark, D.A. ; Ryan, M.G. 2008. First direct
landscape-scale measurement of tropical rain forest leaf area index, a key driver of
global primary productivity. Ecology Letters, 11: 163–172.
Clark, D.B.; Palmer, M.; Clark, D.A. 1999. Edaphic factors and the landscape-scale
distribution of tropical rain forest trees. Ecology, 80: 2662–2675.
Corrêa, I.J. 2004. Plasticidade fenotípica em indivíduos jovens de Aloysia virgata (Ruiz et
Pav.)A. L. Juss – Verbenaceae. Dissertação de Mestrado. São Carlos: UFSCAR, 58p.
Costa. G.F.; Marenco. R.A. 2007. Fotossíntese, condutância estomática e potencial hídrico da
folha em árvores jovens de andiroba (Carapa guianensis). Acta Amazônica, 37: 229234.
Cox. P.M.; Betts. R.A.; Collins. M.; Harris. P.P.; Huntingford. C.; Jones. C.D. 2004.
Amazonian forest dieback under climate-carbon cycle projections for the 21st century.
Theoretical and Applied Climatology, 78: 137-156.
Dale, J.E. 1988. Control of leaf expansion. Annual Review of Plant Physiology, 39:267–295.
Dellucia, E.H.; Sasek, T.W.; Strain, B.R. 1985. Photosynthetic inhibition alter long-term
exposure to elevated levels of atmospheric carbon dioxide. Photosynthesis Research,
7: 175-184.
Demmig-Adams, B.; Adams, W.W. 2006. Photoprotection in an ecological context: the
remarkable complexity of thermal energy dissipation. New Phytologist, 172: 11-21.
Dewar, R. C.; Medlyn, B. E.; Mcmurtrie, R. E. 1998. A mechanistic analysis of light and
carbon use efficiences. Plant, Cell and Environment. 21:573-588.
Dias, D.P.; Marenco, R.A. 2006. Photoinhibition of photosynthesis in Minquartia guianensis
and Swietenia macrophylla inferred by monitoring the initial fluorescense.
Photosynthetica, 44: 235-240.
Dickson, W.C. 2000. Integrative plant anatomy. Horcant academy Press, San Diego.
Doughty, C.E.; Goulden, M.L.; Miller, S.D.; Da Rocha, H.R. 2006. Circadian rhythms
constrain leaf and canopy gas exchange in an Amazonian forest. Geophysical
Research Letters, 33:1-5 (L15404, doi:10.1029/2006GL026750).
Drake, B.G., Gonzàlez-Meler, M.A., Long, S.P. 1997. More efficient plants: a consequence of
rising atmospheric CO2? Annual Review of Plant Physiology and Molecular Biology,
48:609- 639.
60
Drechsel, P.; Zech, W. 1991. Foliar nutrient levels of broadleaved tropical trees: a tabular
review. Plant and Soil, 131: 29-46.
Ellsworth, D.; Reich, P.B.; Naumburg, E.S. Koch, G.W.; Kubiske, M.E.; Smith, S.D. 2004.
Photosynthesis, carboxylation and leaf nitrogen responses of 16 species to elevated
pCO2 across four free-air CO2 enrichment experiments in forest, grassland and desert.
Global Change Biology, 10: 2121-2138.
Epstein, E. 1972. Mineral nutrition of plants: principles and perspectives. New York, John
Wiley and Sons. 412p.
Evans J. R. & Terashima I. 1988. Photosynthetic characteristics of spinafre leaves grown
with different nitrogen treatment. Plant Cell Physiology, 29:157-165.
Evans, J.R. 1983. Nitrogen and photosynthesis in the flag leaf of wheat (Triticum aestivum L).
Plant Physiology, 72: 297-302.
Evans, J.R.; Seemann, J.R. 1989. The allocation of protein nitrogen in the photosynthetic
apparatus: cost, consequences, and control. In: Briggs, W. R. (Eds) Photosynthesis. A.
R. Liss, New York, 183-205.
Farquhar, G.D.; Von Caemmerer, S.V.; Berry, J.A. 1980. A biochemical model of
photosynthetic CO2 assimilation in leaves of C3 species. Planta, 149:78-90.
Feeley, K.J.; Wright, S.J.; Supardi, M.N.N.; Kassim, A.R.; Davies, S.J. 2002. Decelerating
growth in tropical forest trees. Ecology Letters, 10:461–469.
Feller, U.; Crafts-Brandnser, S.J.; Salvucci, M.E. 1998. Moderately hight temperatures inhibit
ribulose-1,5-bisphosphate
carboxylase/oxygenase
(Rubisco)
activase
mediated
activation of Rubisco. Plant Physiology, 116: 539-546.
Ferraz, J.; Ohta, Salles, P.C. 1998. Distribuição dos solos ao longo de dois transectos em
floresta primária ao norte de INPA, Manaus, AM. In: Higuchi, N., Campos, M.A.A.,
Sampaio, P.T.B., dos Santos, J. Pesquisas florestais para conservação da floresta e
reabilitação de áreas degradadas da Amazônia, 111-143.
Fetcher, N.; Oberbauer, S.F.; Chazdon, R.L. 1994. Physiological ecology of plants. In:
Mcdade, L.A.; Bawa, K.S.; Hespenheide, H.A.; Hartshorn, G.S. Editora La Selva:
ecology and natural history of a neotropical rain forest, Chicago and London, The
University Press, 128-141.
Field C. & Mooney H. A. 1986. The photosynthesis-nitrogen relationship in wild plants. In:
On the Economy of Plant Form and Function (ed. T.J. Givnish). Cambridge University
Press, Cambridge, 25-55.
61
Gabrielsen, E.K. 1948. Effects of different chlorophyll concentrations on photosynthesis in
foliage leaves. Physiologia Plantarum, 1:5-37.
Gifford, R.M.; Evans, L.T. 1981. Photosynthesis, carbon partitioning, and yield. Annual
Review of Plant Physiology and Plant Molecular Biology, 32: 485-509.
Givnish, T.J. 1988. Adaptation to sun and shade: a whole-plant perspective. Australian
Journal of Plant Physiology, 15: 63-92.
Groninger, J.W.; Seiler, J. R.; Peterson, J.A.; Kreh, R. E. 1996. Growth and photosynthetic
responses of four Virginia piedmont tree species to shade. Tree Physiology, 16: 773778.
Habermann, H.M. 1973. Evidence for two photoreactions and possible involvement of
phytochrome in light-dependent stomatal opening. Plant Physiology, 51:543-548.
Hendry, G.A.F.; Price, A.H. 1993. Stress indicators: chlorophylls and carotenoids. In: Hendry,
G.A.F.; Grime, J.P. Methods in comparative plant ecology. Chapman & Hall, London,
148-152.
Higuchi, N; Dos Santos, J.; Ribeiro, R.J.; Freitas, J.V.; Vieira, G.; Coic, A.; Minette, L.J.
1997. Crescimento e incremento de uma floresta amazônica de terra-firme manejada
experimentalmente. In: Biomassa de nutrientes florestais. Editora INPA/DFID, 89132.
Hikosaka, K. 2004. Interspecific difference in the photosynthesis–nitrogen relationship:
patterns, physiological causes, and ecological importance. Journal of Plant Research,
117:481–494.
Hikosaka, K. 2005. Nitrogen partitioning in the photosynthetic apparatus of Plantago asiatica
leaves grown under different temperature and light conditions: similarities and
differences between temperature and light acclimation. Plant Cell Physiology,
46:1283–1290
Hikosaka, K.; Terashima, I. 1995. A model of the acclimation of photosynthesis in the leaves
of C3 plants to sun and shade with respect to nitrogen use. Plant, Cell and
Environment, 18:605-618.
Hsiao, T.C.; Allaway, W.G.; Evans, L.T. 1973. Action spectra for guard cell Rb+ uptake and
stomatal opening in vicia-faba. Plant Physiology, 51: 82-88.
InMet. 2009. Clima (www.inmet.gov.br/clima). Acesso: 14/08/09.
Ishida, A.; Toma, T.; Marjenah. 1999. Limitation of leaf carbon gain by stomatal and
photochemical processes in the top canopy of Macaranga conifera, a tropical pioneer
tree. Tree Physiology, 19: 467-473.
62
Jones, R.H; Mcleod, K.W. 1990. Growth and photosynhetic responses to a range of light
environments in Chinese tollowtree e carolina ash seedlings. Forest Science, 30:851852.
Jordan, C.F. 1985. Nutrient cycling in tropical forest ecosystems. Chichester, John Wiley &
Sons.
Kaiser, H.; Kappen, L. 2000. In situ observation of stomatal movements and gas exchange of
Aegopodium podagraria L. in the understorey. Journal of Experimental Botany,
51:1741-1749.
Kapelle, M.; Leal, M.E. 1996. Changes in leaf morphology and foliar nutrient status along a
successional gradient in a Costa Rican upper montane Quercus forest. Biotropica, 28:
331-344.
Kattge, J.; Knorr, W. 2007. The temperature dependence of photosynthetic capacity in a
photosynthesis model acclimates to plant growth temperature : a re-analysis of data
from 36 species. Plant Cell and Environment, 30:1176-1190.
Kitao, M.; Lei, T.T.; Koike, T.; Tobita, H.; Maruyama, Y. 2000. Susceptibility to
photoinhibition of three deciduous broadleaf tree species with different successional
traits raised under various light regimes. Plant Cell and Environment, 23:81-89.
Körner, C. 2003. Ecological impacts of atmospheric CO2 enrichment on terrestrial
ecosystems. Philosophical Transactions the Royal Society, 1810:2023-2041.
Krause, G.H.; Weis, E. 1991. Chlorophyll fluorescense and photosynthesis: The basis. Annual
Review Plant Physiology and Plant Molecular Biology, 42: 313-49.
Kruger, E.L.; Volin, J.C. 2006. In Reexamining the empirical relation between plant growth
and leaf photosynthesis. Functional Plant Biology, 421-429.
Kumar, A.; Turner, N.C.; Singh, D.P.; Singh, P.; Barr, M. 1999. Diurnal and seasonal patterns
of water potential, photosynthesis, evapotranspiration and water use efficiency of
clusterbean. Photosynthetica, 37:601-607.
Kursar, T.A.; Coley, P.D.1999. Contrasting modes of light acclimation in two species of the
rainforest understory. Oecologia, 121:489-498.
Larcher. W. 2000. Ecofisiologia vegetal. São Carlos: Rima. 531 pp.
Lauer, M.J.; Pallardy, St. G.; Blevins, D.G.; Randall, D.D. 1989. Whole leaf carbon exchange
characteristics of phosphate-deficient soybeans (Glycine max L.). Plant Physioogy, 91:
848-854.
63
Lee, D.W.; Baskaran, K.; Mansor, M.; Mohamad, H.; Yap, S.K. 1996. Irradiance and spectral
quality affect Asian tropical rain forest tree seedling development. Ecology, 7:568580.
Lewis, S.L.O; Malhi, Y.O; Phillips, O.L. 2004. Fingerprinting the impacts of global change
on tropical forests. Philosophical Transactions of the Royal Society of London, Series
B, 359: 437-462.
Lima-Junior, E.C.; Alvarenga, A.A.; Castro, E.M.; Vieira, C.V.; Oliveira, H.M. 2005. Trocas
gasosas, características das folhas e crescimento de plantas jovens de Cupania vernalis
Camb. submetidas a diferentes níveis de sombreamento. Ciência Rural, 35: 10921097.
Lloyd, J.; Farquhar, G.D. 2008. Effects of rising temperatures and [CO2] on the physiology
of tropical forest trees. Philosophical Transactions of the Royal Society, Series B, 363:
1811-1817.
Long, S.; Hunphries, S.; Falkowski, P. 1994. Photoinhibition of photosynthesis in nature.
Annual Review of Plant Physiology and Plant Molecular Biology, 45: 633-662.
Long, S.P.; Bernacchi, C.J. 2003. Gas exchange measurements, what can they tell us about
the underlying limitations to photosynthesis? Procedures and sources of error. Journal
of Experimental Botany, 54:2393-2401.
Machado, E.C.; Schmidt, P.T.; Medina, C.L.; Ribeiro, R.V. 2005. Respostas da fotossíntese
de três espécies de citros a fatores ambientais. Pesquisa Agropecuária Brasileira, 40:
161-1170.
Magalhães, N.S.; Marenco, R.A.; Mendes, K.R. 2009. Aclimatação de mudas de acariquara à
alta irradiância. Pesquisa Agropecuária Brasileira, 7:687-694.
Malavolta. E. 1980. Elementos de nutrição mineral de plantas. São Paulo, Editora
Agronômica Ceres Ltda. 251pp.
Manter, D.K.; Kerrigan, J. 2004. A/Ci curve analysis across a range of woody plant species:
influence of regression analysis parameters. Journal of Experimental Botany, 55:
2581-2588.
Marenco, R.A.; Lopes, N.F. 2009. Fisiologia Vegetal: fotossíntese, respiração, relações
hídricas nutrição mineral. 3ª ed, Editora UFV, Minas Gerais. 486pp.
Marenco, R.A.; Siebke, K.; Farquhar, G.D.; Ball, M.C. 2006. Hydraulically based stomatal
oscillations and stomatal patchiness in Gossypium hirsutum. Functional Plant Biology,
33:1103-1113.
64
Marenco, R.A.; Vieira, G. 2005. Specific leaf area and photosynthetic parameters of tree
species in the forest understorey as a function of the microsite light environment in
Central Amazonia. Journal of Tropical Forest Science, 265-278.
Marenco. R.A.; Vieira. G.; Gonçalves. J.F.C. 2003. Leaf micronutrient concentrations and
potential photosynthesis on Ochroma pyramidale established in a degraded land. Acta
Amazônica. 33:23-31.
Marin, D.; Medina, E. 1981. Duracion foliar, contenido de nutrientes y esclerofilia en arboles
de un bosque muy seco tropical. Acta Cientifica Venezolana, 32: 508-514.
Marschner, H. 1986. Mineral nutrition of higher plants. London, Academic Press & Harcourt
Brace & Company, Publishers.
Martínez, D.E.; Guiamet, J.J.G. 2004. Distortion of the SPAD 502 chlorophyll meter readings
by changes in irradiance and leaf water status. Agronomie, 24:41-46.
Maruyama, Y.; Nakamura, S.; Marenco, R.A.; Vieira, G.; Sato, A. 2005. Photosynthetic traits
of seedlings of several tree species in an Amazonian forest. Tropics,14:211-219.
Mcmillen, G.G.; Mcclendon, J.H. 1983. Dependence of photosynthetic rates on leaf density
thickness in deciduous woody plants grown in sun and shade. Plant Physiology,
72:674-678.
Mcwillians, A.L.C.; Roberts, J.M.; Cabral, O.M.R.; Leitão, M.V.B.R.; Costa, A.C.L.;
Maitelli, G.T.; Zamparoni, C.A.G.R. 1993. Leaf area index and above-ground biomass
of terra firme and adjacent clearings in Amazonia. Functional Ecology, 7:310- 317.
Medina, E.; Garcia, V.; Cuevas, E. 1990. Sclerophylly and oligotrophic environments:
relationships between leaf, structure, mineral nutrient content, and drought resistance
in tropical rain forest of the upper Rio Negro region. Biotropica. 22: 51-64.
Medlyn, B.E.; Badeck, F.W.; De Pury, D.G.G.; Barton, C.V.M.; Broadmeadow, M.;
Ceulemans, R.; De Angelis, P.; Forstreuter, M.; Jach, M.E.; Kellomaki, S.; Laitat, E.;
Marek, M.; Philippot, S.; Rey, A.; Strassemeyer, J.; Laitinen, K.; Liozon, R.; Portier,
B.; Roberntz, P.; Wang, K.; Jarvis, P.G. 1999. Effects of elevated [CO2] on
photosynthesis in European forest species: a meta-analysis of model parameters. Plant
Cell and Environment, 22:1475-1495.
Mendes, K.R. 2009. Efeito da sazonalidade da precipitação no crescimento e trocas gasosas
em espécies arbóreas numa floresta de terra-firme da Amazônia Central. Dissertação
de Mestrado, Instituto Nacional de Pesquisa da Amazônia-INPA, Manaus, Amazonas.
82 pp.
65
Molion, L.C.B. 1987. Micrometeorology of an Amazonian rain forest. In: The geophysiology
of Amazonia: vegetation and climate interactions. In: Dickinson, R. E. Eds. New
York, Toronto, Singapore: John Wiley & Sons-The United Nations University, 255272
Mooney, H.A.; Chu, C. 1983. Stomatal Responses to Humidity of Coastal and Interior
Populations of a Californian Shrub. Oecologia, 57: 148-150
Mooney, H.A.; Field, C.; Yanes, C.V.; Chu, C. 1983. Environmental controls on stomatal
conductance in a shrub of the humid tropics. Proceedings of the National Academy of
Sciences of the United States of America, 80:1295-1297.
Müller, P.; Li, X.P.; Niyogi, K.K. 2001. Non-photochemical quenching. A response to excess
light energy. Plant Physiology, 125:1558-1566.
Myneni, R.B.; Yang, W.; Nemani, R.R.; Huete, A.R.; Dickinson, R.E.; Knyazikhin, Y.;
Didan, K.; Fu, R.; Juarez, R.I.N.; Saatchi, S.S.; Hashimoto, H.; Ichii, K. Shabanov,
N.V.; Tan, B.; Ratana, P.; Privette, J.L.; Morisette, J.T.; Vermote, E.F.; Roy, D.P.;
Wolfe, R.E.; Friedl, M.A.; Running, S.W.; Votava, P.; El-Saleous, N.; Devadiga, S.;
Su, Y.; Salomonson, V.V. 2007. Large seasonal swings in leaf area of Amazon
rainforests. Proceedings of the National Academy of Sciences of the United States of
America, 104:4820–4823.
Nascimento, H.C.S. 2009. Influência da luminosidade do sub-bosque no crescimento e
características foliares de espécies arbóreas da Amazônia na fase juvenil. Dissertação
de Mestrado, Instituto Nacional de Pesquisa da Amazônia-INPA, Manaus, Amazonas.
85 pp.
Niinemets, Ü. 2001. Global-scale climatic controls of leaf dry mass per area, density, and
thickness in trees and shrubs. Ecology, 82: 453-469.
Ogren, E. 1993. Convexity of the photosynthetic light-response curve in relation to intensity
and direction of light during growth. Plant Physiology, 101:1013-1019.
Oguchi, R.; Hikosaka, K.; Hirose, T. 2005. Leaf anatomy as a constraint for photosynthetic
acclimation: differential responses in leaf anatomy to increasing growth irradiance
among three deciduous trees. Plant Cell and Environment, 28:916-927.
Oliveira, M.A.J.; Bovi, M.L.A.; Machado, E.C.; Gomes, M.M.A.; Habermann, G.; Rodrigues,
J.D. 2002. Fotossíntese, condutância estomática e transpiração em pupunheira sob
deficiência hídrica. Scientia Agrícola, 59:59-63.
66
Onoda, Y.; Hikosaka, K.; Hirose, T. 2005. Seasonal change in the balance between capacities
of RuBP carboxylation and RuBP regeneration affects CO2 response of photosynthesis
in Polygonum cuspidatum. Journal of Experimental Botany, 56: 755-763.
Osone, Y.; Ishida, A.; Tateno, M. 2008. Correlation between relative growth rate and specific
leaf area requires associations of specific leaf area with nitrogen absorption rate of
roots. New Phytologist, 179:417–427.
Park, S.Y.; Furukawa, A. 1999. Photosynthetic and stomatal responses of two tropical and
two temperate trees to atmospheric humidity. Photosynthetica, 36:181-186.
Pearcy, R.W. 1990. Sunflecks and photosynthesis in plant canopies. Annual Review of Plant
Physiology and Plant Molecular Biology, 41: 421-453.
Peterson, A.; Ball, J.; Luo, Y. 1999. The photosynthesis leaf nitrogen relationship at ambient
and elevated atmospheric carbon dioxide: a meta-analysis. Global Change Biology,
5:331-346.
Poorter, H.; Evans, J.R. 1998. Photosynthetic nitrogen-use efficiency of species that differ
inherently in specific leaf area. Oecologia, 116: 26-37.
Poorter, L. 1999. Growth responses of 15 rain-forest tree species to a light gradient: the
relative importance of morphological and physiological traits. Functional Ecology,
13:396-410.
Pooter, L. 2001. Light-dependent changes in biomass allocation and their importance for
growth of rain forest tree species. Functional Ecology, 15:113-123.
Prentice, I.C. 2001. The carbon cycle and atmospheric carbon dioxide. In: Climate change
2001: The Scientific Basis (ed. IPCC). Cambridge University Press, 183-237.
Raschke, K. 1979. Movements using turgor mechanisms: movements of stomata. In: Haupt,
W.; Feinleib, M.E. (Ed.). Physiology of movements: Encyclopedia of plant physiology;
Berlin: Springer-Verlag, 383-441.
Rego, G.M.; Possamai. E. 2006. Efeito do sombreamento sobre o teor de clorofila e
crescimento inicial do jequitibá-rosa. Boletim de Pesquisa Florestal, 53: 179-194.
Reich, P.B.; Ellsworth, D.S. & Uhl, C. 1995. Leaf carbon and nutrient assimilation and
conservation in species of differing successional status in an oligotrophic Amazonian
forest. Functional Ecology, 9:65-76.
Reich, P.B.; Ellsworth, D.S.; Walters, M.B.; Vose, J.M; Gresham, C.; Volin, J.C. & Bowman,
W. 1999. Generality of leaf trait relationships: A test across six biomes. Ecology, 80:
1955-1969.
67
Reich, P.B.; Walters, M.B. & Ellsworth, D.S. 1992. Leaf lifespan in relation to leaf, plant and
stand characteristics among diverse ecosystems. Ecological Monographs, 62:365-392.
Rorison, I.H.; Spencer, R.E.; Gupta, P.L. 1993. Chemical analysis. In: Hendry, G.A.F.;
Grime, J.P. Methods in comparative plant ecology. Chapman & Hall, London. 156163.
Sage, R.F.; Kubien, D.S. 2007. The temperature response of C3 and C4 photosynthesis. Plant
Cell and Environment, 30:1086-1106.
Salisbury, F.B.; Ross, C.W. 1992. Plant Physiology, 4ª ed. Wadsworth Publishing, Belmont,
CA. 682p.
Senft, W. H. 1978. Dependence of light-saturated rates of algal photosynthesis on intracellular
concentrations of phosphorus. Limnology and. Oceanography. 23:709-718.
Shimazaki, K. I.; Doi M.; Assmann, S. M., Kinoshita, T. 2007. Light regulation of stomatal
movement. Annual Review Plant Biology, 58:219-247.
Silva, R.P.; Santos, J.; Tribuzi, E.S.; Chambers, J.Q.; Nakamura, S.; Higuchi, N. 2002.
Diameter increment and growth patterns for individual tree growing in Central
Amazon, Brazil. Forest Ecology and Management, 166:295–301.
Simonneau, T.; Habib, R.; Goutouly, J.P.; Huguet, J.G. 1993. Diurnal changes in stem diameter
depend upon variations in water-content - Direct Evidence in Peach-Trees. Journal of
Experimental Botany, 44: 615-621.
Sobrado, M.A. & Medina, E. 1980. General morphology, anatomical structure, and nutrient
content of sclerophyllous leaves of the “bana” vegetation of Amazonas. Oecologia,
45: 341-345.
Stitt, M. 1991. Rising CO2 levels and their potential significance for carbon flow in
photosynthetic cells. Plant, Cell and Environment, 14:741-762.
Stuefer, J.F.; Huber, H. 1998. Differencial effects of light quantity and spectral light quality
on growth, morphology and development of two stoloniferous Potentilla species.
Oecologia, 117:1-8.
Thompson, J.; Proctor, J.; Viana, V.; Milliken, W.; Ratter, J.A. & Scott, D.A. 1992.
Ecological studies on a lowland evergreen rain forest on Maracá Island, Roraima,
Brazil. I. Physical environment, forest structure and leaf chemistry. Journal of
Ecology, 80: 689-703.
Thronley, J.H.M. 1998. Dynamic modelo f leaf photosynthesis with acclimation to light and
nitrogen. Annals of Botany, 81:421-430.
68
Torres Netto, A.; Campostrini, E.; Oliveira, J.; G.; Bressan-Smith, R.E. 2005. Photosynthetic
pigments, nitrogen, chlorophyll a fluorescence and SPAD-502 readings in coffee
leaves. Scientia Horticulturae, 104:199–209.
Turner, I.M.; Ong, B.L. & Tan, H.T.W. 1995. Vegetation analysis, leaf structure and nutrient
status of a Malaysian heath community. Biotropica, 27: 2-12.
Ueda, M.; Shibata, E. 2001. Diurnal changes in branch diameter as indicator of water status of
Hinoki cypress Chamaecyparis obtusa. Trees, 15: 315-318.
Vieira, S.; Trumbore, S.; Camargo, P.B.; Selhorst, D.; Chambers, J.Q.; Higuchi, N. 2005.
Slow growth rates of Amazonian trees: consequences for carbon cycling. Proceedings
of the National Academy of Sciences of the United States of America, 102:18502–
18507.
Villar, R.; Hield, A.A.; Merino, J. 1994. Comparison of methods to estimate dark respiration
in the light in leaves of two woody species. Plant physiology, 105:167-172.
Vitousek, P.M. & Sanford Jr., R.L. 1986. Nutrient cycling in moist tropical forest. Annual
Review of Ecology and Systematics. 17: 137-167.
Vogelmann, T.C.; Nishio, J.N. & Smith, W.K. 1996. Leaves and light capture: light
propagation and gradients of carbon fixation within leaves. Trends in Plant Science, 1:
65-70.
Walsh, R.P.D. 1996. Climate. In: Richards, P.W. (Coord). The tropical rain forest. Cambridge
University Press, 159-205.
Waring, R.H. & Schlisinger, W.H. 1985. Forest Ecosystems. Concepts and management.
Orlando, Academic Press, Inc. Harcourt Brace Jovanovich Publishers.
Warren, C.R. & Adams, M.A. 2001. Distribuition of N, Rubisco and photosynthesis in Pinus
pinaster and acclimation to light. Plant, Cell and Environment, 24:597-609.
Watson, D.J. 1947. Comparative physiological studies on growth of field crops: I. Variation
in net assimilation rate and leaf area between species and varieties, and within and
between years. Annals of Botany, 11: 41-76.
Webber, A.N.; Nie, G.Y.; Long, S.P. 1994. Acclimation of photosynthetic proteins to rising
atmospheric CO2. Photosynthesis Research, 39: 413-425.
Wullschleger, S.D. 1993. Biochemical limitations to carbon assimilation in C3 plants - a
retrosprective analysis of the A/Ci curves from 109 species. Journal of Experimental
Botany, 44:907-920.
Yeoh, H.H.; Badger, M.R.; Watson, L. 1981. Variations in kinetic properties of ribulose-1,5bisphosphate carboxylase among plants. Plant Physiology. 67:1151- 1155.
69
Zotz, G.; Winter, K. 1994. Photosynthesis of a tropical canopy tree, Ceiba pentandra, in a
lowland forest in Panama Tree Physiology, 14:1291-1301.
70
8. APÊNDICE A - Símbolos e abreviaturas mais usadas no texto
Amax – fotosíntese maxima (µmol m-2 s-1)
Apot – fotossíntese potencial (µmol m-2 s-1)
AFE – área foliar específica (m2 kg-1)
Chl a – clorofila a (µmol m-2) (µmol m-2)
Chl a/b – razão clorofila a/b
Chl a+b – clorofila a + b(µmol m-2)
Chl b – clorofila b (µmol m-2)
Chl/car – relação clorofila a + b /carotenóides
E – transpiração (mmol m-2 s-1)
FCV – fração de céu visível
gs[380] – condutância estomática em [CO2] ambiente (mol m-2 s-1)
gs[2000] – condutância estomática em [CO2] saturante (mol m-2 s-1)
IAF – índice de área foliar
Ic – irradiância de compensação (µmol m-2 s-1)
Jmax,25 °C - taxa de transporte de elétrons normalizado à 25°C (µmol m-2 s-1)
Rd – a taxa de respiração no escuro (µmol m-2 s-1)
Vc-max, 25 °C - velocidade máxima de carboxilação da Rubisco normalizado à 25°C
(µmol m-2 s-1)
Γ* - concentração de CO2 de compensação (µmol mol-1)
Θ – convexidade da curva de luz (sem dimensões)
Φ – rendimento quântico aparente (mol (CO2) mol-1 (fótons))
71
9. APÊNDICE B – Curva resposta à luz em cinco espécies florestais na Amazônia Central.
7
-2 -1
A ( μmol m s )
A
4
1
-2
7
-2 -1
A ( μmol m s )
B
C
4
1
-2
7
-2 -1
A ( μmol m s )
D
E
4
1
-2
0
500
1000
1500
-2 -1
Q( μmol m s )
2000
0
500
1000
1500
2000
-2 -1
Q( μmol m s )
Figura 27. Taxa de fotossíntese (Amax) em função da radiação fotossintéticamente ativa (Q)
para M. guianensis (A), G .olivacea (B), S. amara (C), R. guianensis (D), D. saccifera (E).
Cada ponto corresponde a média de duas épocas, três plantas por espécie e duas a quatro
folhas por planta. As barras em cada símbolo correspondem ao erro padrão da média.
72
10. APÊNDICE C – Ata da aula de qualicação e defesa oral.
73
74
ANEXO (Tabela 1A)
75
Tabela 1A. Resumo das análises de variância, mostrando F (de Fisher), grau de liberdade (gl)
e significância das variáveis analisadas no estudo, em função das épocas (epo) e das espécies
(spp). NS: não significativo (p > 0,05), * significativo (p < 0,05) e ** altamente significativo
(p < 0,01).
Variáveis/ efeitos
gl
(efeito, res)
F
Amax
Variáveis/ efeitos
gl
(efeito, res)
F
Rd
Epo
1,20
1,03ns
Epo
1,20
0,10ns
Spp
4,20
4,77**
Spp
4,20
6,55**
Epo x spp
4,20
0,63ns
Epo x spp
4,20
1,36ns
Φ
Apot
Epo
1,20
0,04ns
Epo
1,20
0,69ns
Spp
4,20
4,83**
Spp
4,20
2,53 ns
Epo x spp
4,20
0,52ns
Epo x spp
4,20
2,44 ns
gs[380]
Rd/Φ
Epo
1,20
0,31ns
Epo
1,20
0,41ns
Spp
4,20
1,36ns
Spp
4,20
4,32*
Epo x spp
4,20
0,43ns
Epo x spp
4,20
1,39 ns
gs[2000]
Fv/Fm
Epo
1,20
0,216ns
Epo
1,20
1,32 ns
Spp
4,20
0,762ns
Spp
4,20
3,24*
Epo x spp
4,20
0,323ns
Epo x spp
4,20
1,34 ns
Vc-max a 25ºC
IAF
Epo
1,20
0,001ns
Epo
1,20
1,25 ns
Spp
4,20
9,35**
Spp
4,20
2,51 ns
Epo x spp
4,20
0,58ns
Epo x spp
4,20
0,32 ns
Jmax a 25ºC
FCV
Epo
1,20
0,137ns
Epo
1,20
0,54ns
Spp
4,20
5,18**
Spp
4,20
4,28*
Epo x spp
4,20
0,59ns
Epo x spp
4,20
0,15 ns
76
Variáveis / efeitos
gl
(efeito, res)
F
Variáveis / efeitos
Γ
gl
(efeito, res)
F
Chl a
Epo
1,20
13,5**
Epo
1,20
0,55 ns
Spp
4,20
2,08ns
Spp
4,20
3,62 *
Epo x spp
4,20
0,468ns
Epo x spp
4,20
1,05 ns
Chl b
Espessura seca
ns
Epo
1,20
4,21
Epo
1,20
2,75 ns
Spp
4,20
0,69ns
Spp
4,20
9,17 **
Epo x spp
4,20
1,68 ns
Epo x spp
4,20
0,18 ns
Chl a/b
N
Epo
1,20
5,31ns
Epo
1,20
1,34 ns
Spp
4,20
3,27*
Spp
4,20
1,13 ns
Epo x spp
4,20
1,61ns
Epo x spp
4,20
0,95 ns
Chl a+ b
P
Epo
1,20
1,66 ns
Epo
1,20
1,01 ns
Spp
4,20
2,50 ns
Spp
4,20
1,50 ns
Epo x spp
4,20
1,21 ns
Epo x spp
4,20
0,21 ns
Carotenóides
IAD
Epo
1,20
0,62ns
Epo
1,20
1,25 ns
Spp
4,20
0,68 ns
Spp
4,20
2,51 *
Epo x spp
4,20
2,90 ns
Epo x spp
4,20
0,32 ns
Chl a+ b/Car
IAA
Epo
1,20
0,73 ns
Epo
1,20
0,69ns
Spp
4,20
1,30 ns
Spp
4,20
2,53 *
Epo x spp
4,20
2,35 ns
Epo x spp
4,20
2,44 ns
AFE
Espessura fresca
Epo
1,20
2,19 ns
Epo
1,20
1,57 ns
Spp
4,20
5,23*
Spp
4,20
8,05 **
Epo x spp
4,20
0,30 ns
Epo x spp
4,20
0,06 ns
77