REVISÃO
Pré-eclâmpsia: o que há
de anômalo na placentação?
Preeclampsia: what is wrong with placentation?
Patrícia Nessralla Alpoim1
Melina de Barros Pinheiro1
Sandra Cristina Armond2
Augusto Henriques Fulgêncio Brandão3
Antônio Carlos Vieira Cabral4
Karina Braga Gomes5
Luci Maria Sant’Ana Dusse5
Palavras-chave
Pré-eclâmpsia
Placentação
Invasão trofoblástica
Keywords
Preeclampsia
Placentation
Trophoblastic invasion
Resumo
A pré-eclâmpsia (PE) constitui a principal causa de morte materna em
diversos países do mundo e contribui significativamente para a prematuridade, o baixo peso fetal e o aumento
da mortalidade neonatal. A placenta constitui o substrato anatômico etiopatogênico principal para a doença,
inclusive em ambiente extra-uterino ou na ausência de embrião. O único tratamento efetivo para a PE consiste
na interrupção da gravidez e remoção completa da placenta. Em muitos casos, esta medida precisa ser tomada
prematuramente, visando garantir a vida da mãe, do bebê ou de ambos. Estudos clínicos, histológicos e
laboratoriais demonstram alterações hemodinâmicas, histológicas, imunológicas e bioquímicas na placentação
de mulheres portadoras de PE. Entender como essas alterações assumem proporções sistêmicas no organismo
materno pode ser a chave para impedir a progressão abrupta e violenta da doença. Certamente, o entendimento
de todo o processo fisiopatológico é necessário para qualquer proposta de predição, prevenção ou terapia que
possa diminuir as altíssimas taxas de mortalidade atribuídas à PE.
Abstract
Preeclampsia (PE) is the leading cause of maternal death in many countries
worldwide and contributes significantly to prematurity, low fetal weight and increased neonatal mortality.
The placenta seems to be the main etiopathogenic anatomical substrate for the disease even in extra-uterine
environment or in the absence of the embryo. The only effective treatment for PE is the pregnancy interruption
and complete placenta removal. In many cases, this action needs to be taken prematurely in order to ensure the
life of the mother, baby or both. Clinical, histological and laboratory have shown hemodynamic, histological,
immunological and biochemical abnormalities in placentation in women with PE. Understanding how these
changes take on systemic proportions in the mother may be the key to prevent the abrupt progression of the
disease. Indeed, an understanding of all physiological and the alterations in PE process is required for any action
of prediction, prevention or therapy that can reduce the extremely high rates of mortality associated to PE.
Doutora pelo Programa de Pós-graduação em Ciências Farmacêuticas na Universidade Federal de Minas Gerais (UFMG) – Belo Horizonte (MG), Brasil.
Doutoranda pelo Programa de Pós-graduação em Ciências Farmacêuticas da UFMG – Belo Horizonte (MG), Brasil.
Doutor em Medicina; Professor convidado no Programa de Pós-graduação Saúde da Mulher na UFMG – Belo Horizonte (MG), Brasil.
4
Doutor em Medicina; Professor titular Departamento de Ginecologia e Obstetrícia na UFMG – Belo Horizonte (MG), Brasil.
5
Doutora professora do Departamento de Análises Clínicas e Toxicológicas da Faculdade de Farmácia na Universidade Federal de Minas Gerais
UFMG – Belo Horizonte (MG), Brasil.
Endereço para correspondência: Luci Maria SantAna Dusse – Avenida Antonio Carlos, 6627, Bloco 3, Sala 4104 – CEP: 31270-901 – Belo Horizonte
(MG), Brasil – Email: [email protected]
1
2
3
Alpoim PN, Pinheiro MB, Armond SC, Brandão AHF, Cabral ACV, Gomes KB, Dusse LMS
Pré-eclâmpsia
A pré-eclâmpsia (PE) constitui a principal causa de morte
materna em diversos países do mundo e contribui significativamente
para a prematuridade, o baixo peso fetal e o aumento da mortalidade
perinatal. Caracteriza-se, em sua forma pura, pelo aparecimento
de hipertensão e proteinúria em gestantes normotensas, após
a vigésima semana de gestação, na grande maioria das vezes.
Clinicamente é importante distinguir a forma grave da doença,
que evolui com maior comprometimento sistêmico. A doença
pode ser complicada por condições clínicas ainda mais graves
como a eclâmpsia, a síndrome HELLP (Haemolysis, elevated
liver enzyme activity, low platelets) e coagulação intravascular
disseminada (CIVD)1 (C).
A PE está associada a elevado custo social, uma vez que,
frequentemente, resulta na internação prolongada da gestante
e do recém-nascido, podendo gerar sequelas em ambos1 (C).
A etiologia dessa doença é ainda desconhecida e sua ocorrência
natural se dá apenas em seres humanos e primatas superiores.
O único tratamento efetivo consiste na interrupção da gravidez
e remoção completa da placenta. Em muitos casos, esta medida
precisa ser tomada prematuramente, visando garantir a vida
da mãe, do bebê ou de ambos. A placenta parece constituir o
substrato anatômico etiopatogênico principal para a doença e
não há conexão com o ambiente uterino, uma vez que pode se
manifestar na ausência de embrião e em casos de gestação tubária
ou mesmo abdominal2 (D).
Embora alguns exames auxiliares façam parte da monitoração
da gestante com suspeita de PE, o diagnóstico é feito efetivamente
pela medida da pressão arterial e determinação da proteinúria1 (C).
Apesar dos sintomas da PE manifestarem após a vigésima semana de gestação, atualmente tem sido aceito que a patogênese da
doença é estabelecida precocemente na fase da placentação2,3 (D,C).
Esta revisão teve por objetivo abordar aspectos da placentação
fisiológica e fazer uma revisão da literatura relativa às alterações
que ocorrem na PE no que se refere à placentação.
Placentação
Placenta
A placenta consiste em uma estrutura de vilosidades ramificadas.
Cada vilosidade contém vasos sanguíneos fetais e macrófagos em
um centro de tecido conjuntivo mesenquimal cercado por duas
camadas de células especializadas (trofoblastos). A camada interna
é composta por células-tronco de citotrofoblasto, mononucleares
e a externa por sinciciotrofoblastos multinucleados, que cobre
100
FEMINA | Março/Abril 2013 | vol 41 | nº 2
toda a superfície das vilosidades da placenta, constituindo uma
barreira ao sangue materno. Os citotrofoblastos se fundem aos
sinciciotrofoblastos sobrejacentes para apoiar sua expansão e funcionar como local de troca de nutrientes e síntese de esteróides e
hormônios. Os citotrofoblastos localizados nas extremidades das
vilosidades também se diferenciam em trofoblastos extravilosos
que crescem para fora da placenta em colunas que se fundem
às vilosidades vizinhas para formar uma camada celular, que
invade a decídua e remodelam as artérias em espiraladas4 (D).
O desenvolvimento da placenta é importante desde o início da
gestação, com diferenciação e invasão dos trofoblastos na decídua
e, consequente remodelamento das artérias espiraladas, processo
crucial para o sucesso da gestação4 (D).
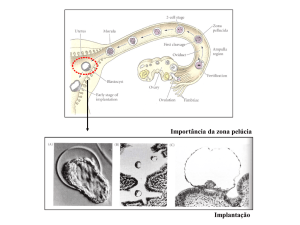
Implantação e formação dos trofoblastos
O processo de implantação, após a fecundação do óvulo e
formação do zigoto, inclui a aposição, adesão ao epitélio uterino
e a implantação propriamente dita ou penetração e, finalmente,
a decidualização. O primeiro evento de diferenciação celular dá
origem a duas células distintas, a célula precursora da massa
celular interna, a qual originará ao embrião e a célula precursora
do trofectoderma, tecido responsável pela formação do citotrofoblasto viloso e extra viloso que darão origem, respectivamente,
ao sinciotrofoblasto e trofoblasto invasivo. Esse, posteriormente,
dará origem ao trofoblasto endovascular e multinucleado5 (D).
A unidade originada após cada segmentação celular corresponde ao blastômero e, a partir de 16 blastômeros, denomina-se
blastocisto. O blastocisto estabelece contato com o epitélio
endometrial, por aposição e adesão, que envolve modificações
moleculares da superfície, tanto das células trofoblásticas, quanto
das células epiteliais uterinas. Em seguida, ocorre a morfogênese
do trofoblasto viloso, com proliferação rápida e crescimento
distal das células citotrofoblásticas, formando o vilo primário.
Quando o vilo primário sofre invasão pelas células mesenquimais
fetais, esse passa a ser denominado vilo secundário e quando há
formação de capilares é denominado vilo terciário6 (D).
As células citotrofoblásticas sofrem divisões assimétricas
responsáveis pela formação de dois tipos celulares, células
progenitoras, com a finalidade de manter o pool de células do
citotrofoblasto, e células intermediárias, as quais se fundirão
posteriormente para dar origem ao sinciciotrofoblasto. As células
do pool aumentam em número durante o crescimento placentário,
no entanto, se tornam espaçadas e com volume menor à medida
que a área do sincício aumenta6 (D).
Diversas moléculas de adesão são expressas na superfície das
células intermediárias (caderinas, proteínas de junção estreita
e outras). Além disso, produtos de genes capazes de mediar a
Pré-eclâmpsia: o que há de anômalo na placentação?
fusão de células, como ADAM 12 e proteínas do envoltório do
envelope de retrovírus (syncytin 1 e 2), também são formadas
proporcionando, dessa forma, a fusão das células intermediárias
do citotrofoblasto e, consequentemente, a formação do sinciciotrofoblasto. A síntese de DNA ocorre apenas nas células
do citotrofoblasto e essas têm índice mitótico de 1,5 a 2,9%,
da sexta a nona semana de gestação. O sinciciotrofoblasto é
exclusivamente pós-mitótico e seu índice mitótico é zero7 (C).
O sinciciotrofoblasto é constituído por uma camada multinuclear, contínua e ininterrupta de células que envolve o
citotrofoblasto e é responsável pela regulação das trocas gasosas,
de substratos e outros fatores entre a circulação fetal e materna. Além disso, é responsável pela síntese e secreção de várias
proteínas, hormônios esteróides e fatores de crescimento, como
a gonadotrofina coriônica (hCG) e lactogênio placentário6 (D).
A diferenciação do citotrofoblasto primário em sinciciotrofoblasto ocorre em dois estágios. No primeiro, as células do
citotrofoblasto proliferam, agregam e fundem-se para formar
o sincício. No segundo, ocorre a diferenciação bioquímica,
quando as células expressam genes envolvidos no transporte de
substratos, síntese e secreção de hormônios8 (C).
Invasão trofoblástica e remodelamento das artérias espiraladas
Nos estágios iniciais da gestação, as células trofoblásticas
fetais invadem a parede uterina de forma bem organizada.
Colunas de células citotrofoblásticas se formam das extremidades das vilosidades de ancoragem e uma camada de células,
os trofoblastos extravilosos, invadem a decídua na direção das
artérias espiraladas do útero. Dessa forma, os trofoblastos atingem o miométrio superficial na oitava semana de gestação9 (D).
O fornecimento de sangue para o útero é feito por meio
de uma estrutura de vasos ramificada, que mostra uma diminuição sucessiva no diâmetro dos vasos, à medida que
progridem através do miométrio e endométrio, as artérias
espiraladas8 (C). Essas suprem de sangue a camada endometrial e, no útero grávido, o miométrio e a decídua. Ao longo
da gestação as artérias espiraladas do leito placentário são
remodeladas e deixam de apresentar alta resistência e baixo
fluxo, passando a ter diâmetro dilatado, com consequente
aumento do fluxo sanguíneo e redução da pressão. Essas alterações ocorrem como resultado da perda de células musculares
lisas e da lâmina elástica da parede do vaso. O endotélio é
temporariamente substituído por uma camada de trofoblasto,
embora seja restaurado mais tarde na gestação. A luz do vaso
remodelado fica dilatada e há deposição de trofoblasto e de
uma matriz fibrinóide na parede do vaso. Acredita-se que
praticamente todas as 100–150 artérias do leito placentário
são transformadas. As artérias do centro da placenta sofrem
um processo de remodelação mais intenso8 (C).
A invasão dos trofoblastos extravilosos pode ocorrer via
intersticial, através da decídua, ou endovascular, através das
extremidades distais das artérias em espiral, onde a invasão
ocorre de forma retrógrada ao fluxo sanguíneo. Embora muitos
estudos já tenham sido realizados visando um melhor entendimento do processo de remodelamento das artérias, a importância
desempenhada pelas diferentes vias de invasão do trofoblasto
ainda não foi esclarecida. Alterações vasculares relacionadas à
via intersticial, incluindo vacuolização das células endoteliais
e edema das células muscular lisa vascular (CMLV), ocorrem
antes da invasão do trofoblasto e podem estar sob o controle dos
mesmos fatores responsáveis pelas alterações iniciais na decídua,
como hormônios esteróides10 (D).
Após a invasão dos trofoblastos extravilosos ocorre a invasão
dos trofoblastos intersticiais que podem influenciar as células
da parede do vaso, preparando-as para a invasão endovascular
subsequente11 (D). Acredita-se que ocorra uma interação inicial
dos trofoblastos intersticiais com as CMLV, uma vez que essas
células são as primeiras a serem perdidas das camadas mais
externas dos vasos. Os efeitos sobre a organização medial e
proteínas da matriz extracelular parecem ser particularmente
importantes. Estudos recentes de imuno-histoquímica sugeriram
que as células do sistema imunológico podem desempenhar um
papel na invasão trofoblástica12 (D).
A invasão do trofoblasto ocorrendo por via endovascular facilita
a interação inicial com o endotélio e as células do trofoblasto
e células endoteliais coexistem transitoriamente em vasos em
remodelação. Após a perda do endotélio os trofoblastos endovasculares são então posicionados para exercer maior influência
na CMLV medial6 (D).
Ainda não está claro se o trofoblasto endovascular tem uma
rota de invasão distinta do trofoblasto intersticial10 (D). Sabe-se
que a invasão do trofoblasto pode ser influenciada por uma infinidade de fatores regulatórios, tais como citocinas e fatores de
crescimento, moléculas de adesão, metaloproteinases de matriz
(MMPs) e tensão de oxigênio13 (C). O ambiente celular local
incluindo as células do sistema imunológico materno presentes
na decídua (macrófagos e células natural killer deciduais-NKd),
interações diretas ou a secreção de fatores solúveis podem, também, influenciar o processo de invasão, bem como o fenótipo
do trofoblasto. Dessa forma, estudos imunohistoquímicos têm
sugerido que ocorre alteração na expressão de várias moléculas
de adesão pelos trofoblastos, à medida que esses vão se aproximam das artérias espiraladas, como preparação para a interação
e substituição das células vasculares14 (D).
FEMINA | Março/Abril 2013 | vol 41 | nº 2
101
Alpoim PN, Pinheiro MB, Armond SC, Brandão AHF, Cabral ACV, Gomes KB, Dusse LMS
Vários mecanismos podem estar envolvidos nas alterações
que ocorrem nas células vasculares e seu microambiente, como
a reestruturação da matriz extracelular, diferenciação das células
vasculares, migração, mudanças na adesão celular e sensibilidade à apoptose. Tais eventos não são mutuamente exclusivos e
podem ser interdependentes. Alguns desses mecanismos podem
ser mediados, em parte ou totalmente, pelo trofoblasto invasor.
Além disso, as células do sistema imunológico materno podem
desempenhar um papel importante nesse processo. O destino
de cada célula endotelial e CMLV dentro do lúmen do vaso são
dependentes do equilíbrio entre estímulos pró e anti-apoptóticos.
Na artéria espiralada, a perda de células vasculares não implica
na perda da integridade do vaso, sugerindo que os mecanismos
envolvidos nesse processo são fortemente regulados15 (D).
A integridade estrutural e funcional das artérias espiraladas
é mantida pela matriz extracelular, uma estrutura complexa de
composição variável sintetizada e mantida em um estado
de equilíbrio dinâmico pela atividade estritamente balanceada de
enzimas proteolíticas. A parede da artéria espiralada é composta
por três camadas distintas com as células do vaso incorporadas
na matriz. A íntima consiste de uma única camada de células
endoteliais que se encontra no topo da membrana basal constituída predominantemente de colágeno tipo IV e lamininas
(elastina e fibronectina) que separam as células endoteliais e as
CMLV fornecendo força, resistência e suporte à parede do vaso.
A camada média contém fibras elásticas envolve a CMLV e a
adventícia é constituída predominantemente por fibras colágenas
e fibroblastos. Tanto a camada média quanto a adventícia impedem a invasão trofoblástica intersticial, enquanto a membrana
basal e a lâmina elástica interna formam uma barreira à invasão
endovascular e ao remodelamento das artérias16 (D).
As alterações na estrutura das artérias espiraladas iniciam
antes da chegada do trofoblasto e estão associadas à presença de
leucócitos maternos12 (D). A chegada subsequente de trofoblasto
intersticial resulta na alteração do segmento das artérias espiraladas do miométrio, incluindo a dilatação do lúmen, edema da
íntima, rompimento da lâmina elástica e aumento dos espaços
intercelulares. A desorganização da íntima e da média ocorre
após a chegada dos trofoblastos endovasculares, que invadem
o espaço subendotelial e rompem a interação entre as células
endoteliais, degradando a elastina17 (C). As enzimas proteolíticas
sintetizadas e liberadas pelas células vasculares e pelos trofoblastos
invasores parecem exercer um papel central para a remodelação
da matriz. As principais são as metaloproteinases de matriz
(MMPs), uma família de endopeptidases dependentes de zinco
que degradam todos os componentes da matriz extracelular. As
MMPs são produzidas pelas células endoteliais (MMP-1 e -9),
102
FEMINA | Março/Abril 2013 | vol 41 | nº 2
CMLV (MMP-2, -9, e elastase MMP-12), células natural killer decidual, macrófagos e trofoblastos extravilosos invasivos
(MMP-1, -2, - 9 -12 e MMP tipo membrana). Células NKd
também liberam granzima, uma serina protease com atividade
tripsina-like que degrada uma série de substratos, incluindo
colágeno IV e fibronectina18 (C).
A sobrevivência das células endoteliais e das CMLV depende
da interação dessas com a matriz extracelular, bem como da
geração de sinais intracelulares específicos. A ausência de sinais
consequente à degradação da matriz extracelular, ou a liberação
de peptídeos inibitórios após a degradação dos componentes da
mesma, pode resultar na indução de uma forma específica de
apoptose conhecido como anoikis, onde as células se destacam
da matriz. Os efeitos da degradação da matriz resultando em
migração ou perda de células são dependentes da extensão e
duração desse processo. Dessa forma, para que ocorra o remodelamento das artérias espiraladas é necessário que haja a perda
das células vasculares e a destruição da matriz extracelular19 (D).
Uma característica das alterações fisiológicas que ocorrem no
processo de remodelamento das artérias espiraladas é a secreção
de material fibrinóide (fibronectina, colágeno tipo IV e laminina)
pelo trofoblasto extraviloso. Embora este material se assemelhe ao
da membrana basal, sua secreção não é polarizada e, dessa forma,
os trofoblastos são incorporados dentro da matriz. Provavelmente
a deposição desse material fibrinóide tem como função manter a
integridade do vaso recém remodelado, bem como formar uma
membrana basal sobre a qual a re-endotelização possa ocorrer20 (D).
O fenótipo e o comportamento das CVLM, em qualquer
vaso, resultam da amplitude de diferenciação dessas células.
Ao contrário de outras células musculares, as CMLV não são
totalmente diferenciadas e podem alternar entre os fenótipos
funcionais (contrátil) e sintéticos (proliferativa) dependendo de
mudanças na expressão de múltiplos genes21 (D).
No remodelamento da artéria espiralada, uma mudança no
fenótipo de CMLV pode resultar em aumento da sensibilidade a
estímulos apoptóticos ou em aumento da migração dessas células.
De fato, a diferenciação de CMLV é conhecida por aumentar
o seu potencial migratório. A perda do fenótipo contrátil está
associada à alteração da estrutura da parede dos vasos, incluindo a
perda da organização em camadas de CMLV, a migração para longe
da luz dessas células e perda de marcadores de diferenciação em
outros exemplos de remodelação vascular, como aterosclerose22 (C).
O fenótipo da CMLV é dependente de uma série de fatores
externos, incluindo as células vizinhas e a matriz extracelular.
As células endoteliais promovem a diferenciação de CMLV
estimulando a expressão de proteínas contráteis e ao mesmo
tempo, inibem tanto a deposição de matriz quanto a prolifera-
Pré-eclâmpsia: o que há de anômalo na placentação?
ção dessas células. Tem sido admitido que a liberação de óxido
nítrico (NO) pelas células endoteliais tem um papel importante
nesse processo23 (D). Sabe-se que os trofoblastos podem secretar
citocinas inflamatórias, incluindo fator de necrose tumoral alfa
(TNF-a) e interleucina 1β (IL-1β) que poderiam estimular a
expressão da forma induzível da óxido nítrico sintase (iNOS)
pelas CMLV e resultar na apoptose dessas células24 (D).
Influências hemodinâmicas
As interações entre células endoteliais e CMLV são influenciadas por fatores mecânicos, tais como tensão de cisalhamento e
pressão e sinais parácrinos e autócrinos. Estes sinais são derivados
tanto do interior da parede do vaso quanto de células vizinhas e
podem afetar propriedades fundamentais das células, tais como
o estado de diferenciação e a sobrevivência. Perturbações dessas
interações, seja como resultado das alterações hemodinâmicas
que podem acompanhar a gestação, ou pela presença de trofoblasto invasor, podem ter um papel importante no processo de
remodelamento arterial25 (D).
As alterações hemodinâmicas que ocorrem nas artérias espiraladas em transformação são muito expressivas. A formação de
um tampão de trofoblastos endovascular nas primeiras semanas
de gestação reduz drasticamente o fluxo de sangue nesses vasos
e, ao mesmo tempo aumenta a pressão. Conforme a gestação
avança, a pressão dentro dos vasos diminui, devido à perda da
integridade desse tampão. Dessa forma, o fluxo de sangue para o
espaço interviloso aumenta o que resulta no aumento da tensão
de cisalhamento nas paredes dos vasos. No entanto, ainda não
está bem esclarecido como as alterações hemodinâmicas poderiam
influenciar o processo de remodelamento da artéria espiralada26 (D).
Papel do sistema imunológico
Considerando que metade dos genes do embrião é de origem
paterna e, portanto estranhos ao sistema imunológico materno,
a implantação da placenta e do embrião são vistos como um
“semi-enxerto”. No entanto, o sistema imunológico da mãe
consegue reconhecer a placenta como um “próprio temporário”
e, na gestação normal, não desencadeia uma resposta imune
contra essa. Vários fatores contribuem para essa tolerabilidade
incluindo o fato do trofoblasto não expressar moléculas de MHC
das classes I (HLA-A e B) e II. Além disso, o trofoblasto expressa
uma combinação única de moléculas MHC, HLA-C (classe Ia),
HLA-G e HLA-E (classe Ib), que previnem a resposta imune
materna à placenta e embrião. O HLA-G pode interagir com
receptores de linfócitos T citotóxicos e células natural killer (NK)
e inibir sua capacidade de induzir a lise celular, permitindo que
o trofoblasto coexista com um grande número de células do sis-
tema imunológico materno nas proximidades. Estudos sugerem
que as células deciduais imunológicas desempenham funções
vitais para garantir o sucesso da gravidez. Uma população de
células natural killer especializadas, denominadas células natural
killer deciduais (NKd), infiltram o útero antes da implantação
e permanecem em grande número (aproximadamente 70%
dos leucócitos deciduais) durante todo o primeiro trimestre da
gestação. As células NKd têm propriedades bastante distintas
das células NK do sangue periférico e exibem um fenótipo
CD56bright e CD16negativo. Apenas um pequeno percentual de
células NKd expressam o receptor de ativação CD160, comum
a maioria das células NK periféricas. Assim, as células NKd não
parecem ser naturalmente citotóxicas e podem ter uma função
completamente diferente no ambiente uterino. Estas células
parecem estar associadas aos vasos endometriais e glândulas
endometriais e influenciam uma série de processos que são
essenciais para o processo de implantação, como a invasão do
trofoblasto e remodelamento da artéria espiralada e a tolerância
imune à placenta e ao feto alogênico. Além disso, expressam
citocinas que normalmente não são produzidas por células NK
periféricas, incluindo citocinas angiogênicas, como fator de
crescimento vascular endotelial (VEGF), fator de crescimento
placentário (PlGF) e angiopoietina-227 (C).
A infiltração de NKd e macrófagos nas camadas de CMLV em
torno das artérias espiraladas tem o propósito de destruir essas
camadas e preparar para a fase seguinte de remodelamento das
artérias induzido pelos trofoblastos. Interações entre as células
NKd e o trofoblasto invasor também têm sido observadas in
vitro, resulta na produção de uma série de citocinas, incluindo
TNF-α, interferon-γ (IFNγ) e fator estimulador de colônia de
monócitos (M-CSF), que podem afetar a apoptose do trofoblasto,
invasão e remodelação27 (C).
Os macrófagos representam cerca de 20-25% dos leucócitos
deciduais no primeiro trimestre de gestação e é ainda controverso
se esse percentual permanece constante ou diminui ao longo
da gestação. Macrófagos deciduais podem desempenhar um
papel importante na promoção da tolerância imunológica por
meio da produção de citocinas e substâncias antiinflamatórias,
como IL-10 e indolamina 2,3-dioxigenase (IDO), bem como
de interações com células NKd que determina a produção de
IL-15. Os trofoblastos também podem interagir com os macrófagos e outros componentes do sistema imunológico por meio
da expressão de receptores do tipo Toll (Toll-like), uma família
de receptores de reconhecimento de padrões que são essenciais
para a resposta imune inata. Admite-se que esses receptores são
capazes de proporcionar à placenta a capacidade de reconhecer
antígenos, incluindo moléculas maternas e agentes não infec-
FEMINA | Março/Abril 2013 | vol 41 | nº 2
103
Alpoim PN, Pinheiro MB, Armond SC, Brandão AHF, Cabral ACV, Gomes KB, Dusse LMS
ciosas e desencadear a ativação das células imunes. Além disso,
os macrófagos podem avançar pelas células de músculo liso das
artérias espiraladas, antes da invasão dos trofoblastos extravilosos,
e inibir essa invasão28 (D).
Placentação na pré-eclâmpsia
Em 1967, Brosens, Robertson e Dixon relataram pela primeira vez que a PE estava associada ao comprometimento das
alterações fisiológicas das artérias espiraladas. Estes pesquisadores
demonstraram que as artérias espiraladas nessa doença eram mais
tortuosas, possuíam paredes espessas e estreitas e mantinham a
musculatura lisa e a lâmina elástica29 (D).
Estudos recentes têm demonstrado anormalidades no processo
de diferenciação do citotrofoblasto em mulheres pré-eclâmpticas.
A diferenciação incompleta das células do citotrofoblasto durante
a formação do trofoblasto viloso e invasivo resulta na invasão
estreita no útero e no comprometimento da fusão dessas células
para formação do sincício30 (D). Além disso, a fusão celular comprometida é responsável pela formação de uma estrutura vilosa
instável e pelo aumento da liberação de células trofoblásticas
no sangue materno31 (D).
Admite-se que o sucesso do remodelamento das artérias
espiraladas é dependente do recrutamento adequado de leucócitos e da invasão dos trofoblastos extravilosos, bem como da
expressão de um repertório específico de proteases e moléculas
pró e anti-apoptóticas. Um processo bem regulado de perda
celular e degradação da matriz extracelular é necessário para
que se atinja o delicado equilíbrio entre a vasodilatação ideal e
a manutenção da integridade vascular. Assim, a transformação
vascular representa uma série coordenada de alterações fisiológicas
que são implementadas ao longo das primeiras vinte semanas
de gestação, o que parece não ocorrer na PE30 (D).
À luz do conhecimento atual admite-se que a PE ocorra
em duas fases. A primeira se instala nas primeiras 12 semanas
de gestação, quando há diferenciação dos trofoblastos, invasão
da decídua e remodelamento das artérias espiraladas de forma
defeituosa. Isto resulta na entrada abrupta do sangue materno
no espaço interviloso, danificando mecanicamente os sinciciotrofoblastos, comprometendo a perfusão dos tecidos fetais.
A segunda fase ocorre no segundo ou terceiro trimestres, como
resultado da hipoperfusão e isquemia placentária. A placenta
isquêmica libera citocinas e radicais livres do oxigênio que
104
FEMINA | Março/Abril 2013 | vol 41 | nº 2
induzem a disfunção endotelial materna sistêmica e a resposta
inflamatória excessiva, aflorando a sintomatologia identificada
clinicamente2,3 (D, C).
Kam et al.11 (D) discordaram que a placenta sofra cronicamente de hipóxia na PE e postularam que o suprimento irregular
de sangue, com eventos de hipoperfusão e reperfusão constitui
o dano placentário de maior importância. Estes pesquisadores
verificaram que a vasodilatação reduzida no final das artérias
espiraladas resulta em uma maior velocidade do sangue no espaço
interviloso, mas não reduz o volume de sangue. Propuseram,
ainda, que os trofoblastos lisados liberam micropartículas na
circulação materna, contribuindo para induzir a disfunção
endotelial generalizada e a ativação da coagulação. Além disso,
as artérias espiraladas não remodeladas que mantiveram as
células musculares lisas contribuem para aumentar o risco de
vasoconstrição espontânea e perfusão intermitente do espaço
interviloso, resultando em isquemia e reperfusão. A perfusão
placentária irregular pode acarretar uma resposta ao estresse
oxidativo crônico, induzindo a produção de substâncias que
alcançam a circulação materna desencadeando uma resposta
inflamatória generalizada e disfunção endotelial11 (D).
Conclusão
Apesar da etiologia da PE não ter sido ainda elucidada, as
evidências científicas acumuladas apontam a placenta como sítio
de origem da doença. Estudos clínicos, histológicos e laboratoriais
demonstram alterações hemodinâmicas, histológicas, imunológicas e bioquímicas na placentação de mulheres portadoras de PE.
Entender como essas alterações assumem proporções sistêmicas
no organismo materno pode ser a chave para impedir a progressão abrupta e violenta da doença. Certamente, o entendimento
de todo o processo fisiopatológico é necessário para qualquer
proposta de predição, prevenção ou terapia que possa diminuir
as altíssimas taxas de mortalidade atribuídas à PE.
Agradecimentos
Os autores agradecem o apoio financeiro concedido pelo
Conselho Nacional de Desenvolvimento Científico e Tecnológico/
CNPq e Fundação de Amparo à Pesquisa do estado de Minas
Gerais/FAPEMIG.
Pré-eclâmpsia: o que há de anômalo na placentação?
Leituras suplementares
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
Report of the National High Blood Pressure Education Program Working Group
on High Blood Pressure in Pregnancy. Am J Obstet Gynecol. 2000;183(1):S1-S22.
Silasi M, Cohen B, Karumanchi SA, Rana S. Abnormal placentation, angiogenic
factors, and the pathogenesis of preeclampsia. Obstet Gynecol Clin North Am.
2010;37(2):239-53.
Roberts JM, Hubel CA. The two stage model of preeclampsia: variations on the
theme. Placenta. 2009;30 Suppl A:S32-7.
Mihu CM, Susman S, Rus Ciuca D, Mihu D, Costin N. Aspects of placental
morphogenesis and angiogenesis. Rom J Morphol Embryol. 2009;50(4):549-57.
Senner CE, Hemberger M. Regulation of early trophoblast differentiation - lessons
from the mouse. Placenta. 2010;31(11):944-50.
Handwerger S. New insights into the regulation of human cytotrophoblast cell
differentiation. Mol Cell Endocrinol. 2010;323(1):94-104.
Aplin JD. Developmental cell biology of human villous trophoblast: current
research problems. Int J Dev Biol. 2010;54(2-3):323-9.
Burton GJ, Woods AW, Jauniaux E, Kingdom JC. Rheological and physiological
consequences of conversion of the maternal spiral arteries for uteroplacental
blood flow during human pregnancy. Placenta. 2009;30(6):473-82.
Pijnenborg R, Bland JM, Robertson WB, Dixon G, Brosens I. The pattern of
interstitial trophoblastic invasion of the myometrium in early human pregnancy.
Placenta. 1981;2(4):303-16.
Pijnenborg R, Vercruysse L, Hanssens M. The uterine spiral arteries in human
pregnancy: facts and controversies. Placenta. 2006;27(9-10):939-58.
Kam EP, Gardner L, Loke YW, King A. The role of trophoblast in the physiological
change in decidual spiral arteries. Hum Reprod. 1999;14(8):2131-8.
Smith SD, Dunk CE, Aplin JD, Harris LK, Jones RL. Evidence for immune cell
involvement in decidual spiral arteriole remodeling in early human pregnancy.
Am J Pathol. 2009;174(5):1959-71.
Lunghi L, Ferretti ME, Medici S, Biondi C, Vesce F. Control of human trophoblast
function. Reprod Biol Endocrinol. 2007;5:6.
Zhou Y, Genbacev O, Fisher SJ. The human placenta remodels the uterus by
using a combination of molecules that govern vasculogenesis or leukocyte
extravasation. Ann N Y Acad Sci. 2003;995:73-83.
Harris LK. Review: Trophoblast-vascular cell interactions in early pregnancy: how
to remodel a vessel. Placenta. 2010;31 Suppl:S93-8.
Harris LK, Aplin JD. Vascular remodeling and extracellular matrix breakdown in
the uterine spiral arteries during pregnancy. Reprod Sci. 2007;14(8 Suppl):28-34.
Khong TY, Adema ED, Erwich JJ. On an anatomical basis for the increase in birth
weight in second and subsequent born children. Placenta. 2003;24(4):348-53.
18. Bischof P, Meisser A, Campana A. Involvement of trophoblast in embryo
implantation: regulation by paracrine factors. J Reprod Immunol. 1998;39(12):167-77.
19. Amabile PG, Wong H, Uy M, Boroumand S, Elkins CJ, Yuksel E, et al. In vivo
vascular engineering of vein grafts: directed migration of smooth muscle cells
by perivascular release of elastase limits neointimal proliferation. J Vasc Interv
Radiol. 2002;13(7):709-15.
20. Frank HG, Malekzadeh F, Kertschanska S, Crescimanno C, Castellucci M, Lang I,
et al. Immunohistochemistry of two different types of placental fibrinoid. Acta
Anat. 1994;150(1):55-68.
21. Kaplan-Albuquerque N, Bogaert YE, Van Putten V, Weiser-Evans MC, Nemenoff
RA. Patterns of gene expression differentially regulated by platelet-derived
growth factor and hypertrophic stimuli in vascular smooth muscle cells:
markers for phenotypic modulation and response to injury. J Biol Chem.
2005;280(20):19966-76.
22. Halka AT, Turner NJ, Carter A, Ghosh J, Murphy MO, Kirton JP, et al. The effects
of stretch on vascular smooth muscle cell phenotype in vitro. Cardiovasc Pathol.
2008;17(2):98-102.
23. Powell RJ, Hydowski J, Frank O, Bhargava J, Sumpio BE. Endothelial cell effect
on smooth muscle cell collagen synthesis. J Surg Res. 1997;69(1):113-8.
24. Geng YJ, Wu Q, Muszynski M, Hansson GK, Libby P. Apoptosis of vascular
smooth muscle cells induced by in vitro stimulation with interferon-gamma,
tumor necrosis factor-alpha, and interleukin-1 beta. Arterioscler Thromb Vasc
Biol. 1996;16(1):19-27.
25. Whitley GS, Cartwright JE. Cellular and molecular regulation of spiral artery
remodelling: lessons from the cardiovascular field. Placenta. 2010;31(6):465-74.
26. Pijnenborg R, Bland JM, Robertson WB, Brosens I. Uteroplacental arterial changes
related to interstitial trophoblast migration in early human pregnancy. Placenta.
1983;4(4):397-413.
27. Trowsdale J, Betz AG. Mother’s little helpers: mechanisms of maternal-fetal
tolerance. Nat Immunol. 2006;7(3):241-6.
28. Renaud SJ, Postovit LM, Macdonald-Goodfellow SK, McDonald GT, Caldwell JD,
Graham CH. Activated macrophages inhibit human cytotrophoblast invasiveness
in vitro. Biol Reprod. 2005;73(2):237-43.
29. Brosens I, Robertson WB, Dixon HG. The physiological response of the vessels of
the placental bed to normal pregnancy. J Pathol Bacteriol. 1967;93(2):569-79.
30. James JL, Whitley GS, Cartwright JE. Pre-eclampsia: fitting together the placental,
immune and cardiovascular pieces. J Pathol. 2010;221(4):363-78.
31. Chua S, Wilkins T, Sargent I, Redman C. Trophoblast deportation in pre-eclamptic
pregnancy. Br J Obstet Gynaecol. 1991;98(10):973-9.
FEMINA | Março/Abril 2013 | vol 41 | nº 2
105