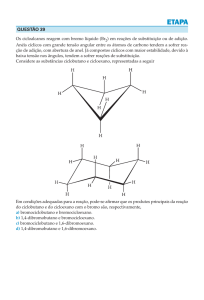
Modulo 28
Reatividade dos ametais
●
Geralmente os ametais
são elementos com
tendência de receber
elétrons, formando
ânions, pois possuem
alta eletronegatividade.
Isso significa que em
reações eles sofrem
redução e,
consequentemente,
provocam a oxidação de
outras espécies
químicas.
Reatividade química
A reatividade de um elemento está relacionada
com a perda ou ganha de elétrons. Quanto maior
a eletropositividade, maior a reatividade, isso no
caso dos metais, como por exemplo, césio (Cs) e
frâncio (Fr), considerados os mais reativos. E no
caso dos não-metais é a eletronegatividade que
deve ser maior que a reatividade, como por
exemplo, o flúor que é o não metal maios reativo.
O Hidrogênio quando escapa de mansinho é um sinal
que ele está em reação.
E todo fera que estuda não se esquece:
Reagindo ele se aquece é deslocado por metal. (bis)
Coluna 1A, 2A e Alumínio..Muita atenção que agente
vai seguindo
Com Manganês(Mn) , Zinco(Zn) e Cromo,
Ferro,Cobalto, Níquel, Estanho(Sn), Chumbo(Pb)- Eu
já sei como!
Pois se o metal for nobre, você não seja ingênuo, é
pouco reativo e não desloca o Hidrogênio.
Cobre(Cu), Mercúrio(Hg),Prata(Ag) e Platina,Ouro
(Au) também , não esquenta “essa menina”.
Cuidado! Os “não-metais”não brilham e não tem graça:
FOlClore Brasileiro Invadindo sua casa
1.Sabemos que reações de simples troca podem
ou não ocorrer dependendo do ametal que
representa a substância simples e sabemos
também que um ametal pode receber elétrons de
um outro ametal desde que seja mais eletrone­
gativo que ele. A reação X + HCl → HX + Cl2
ocorre somente se X for substituído por:
a)Na
b)F2
c)H2
d)Br2
e)Mg
2.Complete e balanceie as equações abaixo
(inclusive colocando o 1 quando necessário)
e, caso alguma delas não ocorra, deixe
indicado: “não ocorre”.
a)F 2 + NaBr →
b)Br2 + HCl →
c)H2 + NaCl →
d)Cl2 + HI →
3.
2 NaBr + Cl2 → 2 NaCl + Br2, conclui-se que:
a)o bromo é mais reativo que o cloro.
b)ocorre uma reação de dupla-troca.
c)o cloro é mais reativo que o bromo, deslocando-o
d)o sódio é mais eletronegativo que o cloro.
e)a molécula de bromo é monoatômica
.
4.E quacione as reações indicadas abaixo (caso existam); caso
contrário, indique “não ocorre”. Balanceie essas equa­ções.
a)Gás cloro com brometo de sódio
.
bGás flúor com ácido iodídrico
325.Dada a reatividade em ordem decrescente dos
halogênios, F > Cl > Br > I, a equação incorreta é:
a) 2 NaF + Cl2 → 2 NaCl + F2
b) 2 NaI + F2 → 2 NaF + I2
c)2 NaBr + Cl2 → 2 NaCl + Br2
d)2 NaI + Br2 → 2 NaBr + I2
e)2 NaBr + F2 → 2 NaF + Br2
331.O iodo pode ser obtido a partir de
iodetos naturais, tais como NaI, ao se tratar
de solu­ções aquosas de iodeto com:
a) cloreto de sódio.
b) ácido clorídrico.
c) soda cáustica.
d) água
e) cloro.
332.Os metais alcalinos são moles e extremamente reativos,
reagindo explosivamente com a água. Dentre as equações, a
que representa reação com água é:
X (s) + Ha) 2O(l) → X H(aq) + H2(g)
X (s) + Hb) 2O(l) → X OH(aq) + H2O(l)
X (s) + Hc) 2O(l) → X OH(aq)
X (s) + Hd) 2O(l) → X OH(aq) + O2(g)
X (s) + He) 2O(l) → X OH(aq) + H2(g)
335.Assinale a opção que contém o par de
substâncias de cuja mistura resulta uma rea­
ção química facilmente perceptível.
a) Br2(aq) + NaCl(aq)
b)Cl2(aq) + NaI(aq)
c)H2(g) + MgSO4(aq)
d)Ag(s) + ZnSO4(aq)
e)HCl(aq) + Cu(s)