a presença dos nêutrons e mésons entre os prótons no núcleo diminui a repulsão entre os prótons. Os nêutrons foram
descobertos por jarnes Chadwick, em 1932, quase 20 anos
depois da-criação do modelo atômico de Rutherford-Bohr.
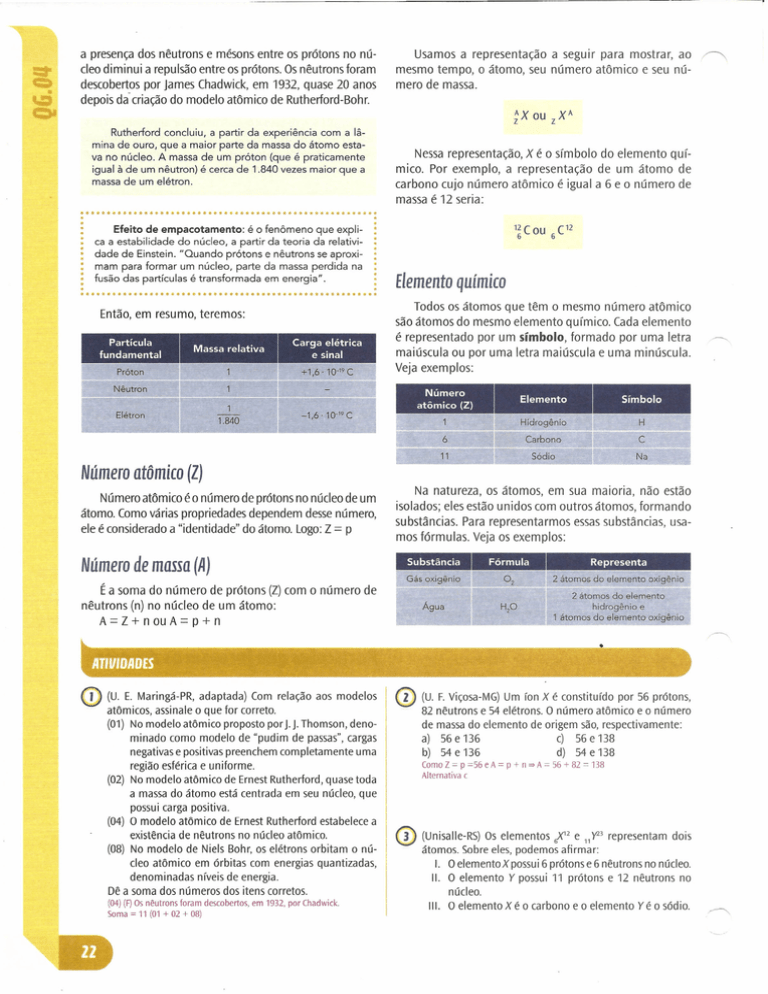
Usamos a representação a seguir para mostrar, ao
mesmo tempo, o átomo, seu número atômico e seu número de massa.
Rutherford concluiu, a partir da experiência com a lâmina de ouro, que a maior parte da massa do átomo estava no núcleo. A massa de um próton (que é praticamente
igual à de um nêutron) é cerca de 1.840 vezes maior que a
massa de um elétron.
Nessa representação, X é o símbolo do elemento químico. Por exemplo, a representação de um átomo de
carbono cujo número atômico é igual a 6 e o número de
massa é 12 seria:
.••..•••.........••....•................................
·•· Efeito de empacotamento: é o fenômeno que expli- ..•
ca a estabilidade do núcleo, a partir da teoria da relatividade de Einstein. "Quando prótons e nêutrons se aproximam para formar um núcleo, parte da massa perdida na
fusão das partículas é transformada em energia".
·
·....................................................... . Elemento químico
Todos os átomos que têm o mesmo número atômico
são átomos do mesmo elemento químico. Cada elemento
é representado por um símbolo, formado por uma letra
maiúscula ou por uma letra maiúscula e uma minúscula.
Veja exemplos:
Então, em resumo, teremos:
Partícula
fundamental
Massa relativa
Carga elétrica
e sinal
+1,6' 10-'9 C
Próton
_=:':;;:'iiiiiiiiiiiii'"
Nêutron
Número
atômíco (Z)
=~F====~F
1
Elétron
1.840
Elemento
Símbolo
-1,6·10-'9 C
6
Hidrogênio
H
Carbono
C
iiiiiiiiiiiiiiiiiiiiiiiiii=ll
~
~~___
11
Sódio _
~L
__
Na
Número atômico (Z)
Na natureza, os átomos, em sua maioria, não estão
isolados; eles estão unidos com outros átomos, formando
substâncias. Para representarmos essas substâncias, usamos fórmulas. Veja os exemplos:
Número atômico é o número de prótons no núcleo de um
átomo. Como várias propriedades dependem desse número,
ele é considerado a "identidade" do átomo. Logo: Z = P
Número de massa (A)
Representa
Gás oxigênio
É a soma do número de prótons (Z) com o número de
nêutrons (n) no núcleo de um átomo:
A Z + n ou A P + n
=
===::.=-=====
Água
=
Q) (U. E. Maringá-PR,
adaptada) Com relação aos modelos
atômicos, assinale o que for correto.
(01) No modelo atômico proposto por j. J. Thomson, denominado como modelo de "pudim de passas", cargas
negativas e positivas preenchem completamente uma
região esférica e uniforme.
(02) No modelo atômico de Ernest Rutherford, quase toda
a massa do átomo está centrada em seu núcleo, que
possui carga positiva.
(04) O modelo atômico de Ernest Rutherford estabelece a
existência de nêutrons no núcleo atômico.
(08) No modelo de Niels Bohr, os elétrons orbitam o núcleo atômico em órbitas com energias quantizadas,
denominadas níveis de energia.
Dê a soma dos números dos itens corretos.
(04) (F) Os nêutrons foram descobertos,
Soma = 11 (01 + 02 + 08)
em 1932, por Chadwick.
I
0 (u.
82
de
a)
b)
oxigênio
2 átomos do elemento
hidrogênio e
1 átomos do elemento oxigênio
F. Viçosa-MG) Um íon X é constituído por 56 prótons,
nêutrons e 54 elétrons. O número atômico e o número
massa do elemento de origem são, respectivamente:
56 e 136
c) 56 e 138
54 e 136
d) 54 e 138
= =
Como Z P 56 e A
Alternativa c
(1)
2 átomos do elemento
= P + n "" A = 56 + 82 = 138
(Unisalle-RS) Os elementos ;:'2 e 11)123 representam dois
átomos. Sobre eles, podemos afirmar:
I. O elemento X possui 6 prótons e 6 nêutrons no núcleo.
11. O elemento Y possui 11 prótons e 12 nêutrons no
núcleo.
111. O elemento X é o carbono e o elemento Y é o sódio.
r>.
Está(ão) correta(s):
a) somente I.
b) somente 11.
c) somente 111.
d)
I, li e 111.
e)
Nenhuma delas.
a)
b)
c)
d)
e)
I"
I. (V) Z = P =
= A = P + n = 12 = 6 + n = n = 6
11. (V)Z=p=11Y')=A=p+n=23=11+n=n=12
°
°
De acordo com o texto, o número atômico do antimônio é 50. Pelo gráfico, observa-se que os isótopos estáveis do antimônio possuem entre 12 e
24 nêutrons a mais do que o número de prótons, portanto o número de
nêutrons poderá ser:
• menor: 50 + 12 = 62
• maior: 50 + 24 = 74
Alternativa d
Observação: O número de prótons do antimônio é 51 (ver tabela periódica).
Para preservarmos a questão original, mantivemos o número 50.
111. (V)
Alternativa d
+EIJéM
G
entre 12 e 24 nêutrons a menos que o número de prótons.
exatamente o mesmo número de prótons e nêutrons.
entre e 12 nêutrons a mais que o número de prótons.
entre 12 e 24 nêutrons a mais que o número de prótons.
entre e 12 nêutrons a menos que o número de prótons.
(C5/H17) (Enem-MEC) Os núcleos dos átomos SãO.co.nst!tuídos de prótons e nêutrons, sendo ambos os pnncrpars
responsáveis pela sua massa. Nota-se que, na maioria dos
núcleos, essas partículas não estão presentes na mesma
proporção.
O gráfico mostra a quantidade de nêutrons (n) em função da quantidade de prótons (Z) para os núcleos estáveis conhecidos.
o
(C5/H17) Leia o texto a seguir.
A visualização, enquanto meio facilitador do entendimento
e da representação de fenômenos, vem sendo utilizada desde o
surgimento da ciênciapor meio de gravuras, gráficos e ilustrações,
e mais recentemente foi incrementada com o uso de recursos
eletrônicos e digitais, como a televisão e o computador. Porém,
mesmo com os avanços tanto dos modelos científicos quanto dos
meios que os representam, um fator é permanente e necessário
ao processo de elaboração dos modelos: a modelagem mental.
MELEIRO, A.; GIORDAN, M. Hipermídia
no ensino de modelos atômicos.
Educação em química e multimídia.
Disponível em: http://gnesc.sbg.org.br
Para representar o modelo atômico de Rutherford, um aluno pegou três moedas: duas de 50 centavos (7,8 gramas)
e uma de 1 centavo (2,4 gramas). Identifique como esse
modelo seria representado corretamente.
a) Próton: moeda R$ 0,50; nêutron: moeda R$ 0,01; elétron: moeda R$ 0,01.
b) Próton: moeda R$0,01; nêutron: moeda R$0,50; elétron:
moeda R$ 0,50.
c) Próton: moeda R$ 0,50; nêutron: m'oeda R$ 0,50; elétron: moeda R$ 0,01.
d) Próton: moeda R$0,50; nêutron: moeda R$0,01; elétron:
moeda R$ 0,50.
e) Próton: moeda R$ 0,01; nêutron: moeda R$ 0,50; elétron: moeda R$ 0,01.
120
110
:s
~
<=
s"
100
90
"li
c
'"
2
'"
E
80
"O
."
z
QUímica nova na escola.
(acesso em 22 dez 2012)
70
60
50
40
As moedas com maior massa, R$ 0,50, seriam representadas pelo próton e
pelo nêutron, pois estas partículas apresentam unidade de massa atômica 1 u
30
20
u.
e a moeda de R$ 0,01 seria o elétron, pois sua massa atômica é _1_
1.840
10
Alternativa c
10
20
30
40
50
60
70
80
90
100
110
Número de prótons (Z)
Adaptado de KAPLAN, I. Física nuclear. Rio de Janeiro: Guanabara Dois, 1978.
O antimônio é um elemento químico que possui 50·prótons (de acordo com o exercício proposto) e possui vários
isótopos - átomos que somente se diferem pelo número
de nêutrons. De acordo com o gráfico, os isótopos estáveis
do antimônio possuem:
)
EXERCíCIOS COMPLEMENTARES
@ (UFPR) Considere as seguintes
afirmativas sobre o modelo
atômico de Rutherford:
I. O modelo atômico de Rutherford é também conhecido como modelo planetário do átomo.
11. No modelo atômico, considera-se que elétrons de
cargas negativas circundam em órbitas ao redor de
um núcleo de carga positiva.
111.Segundo Rutherford, a eletrosfera, local onde se encontram os elétrons, possui um diâmetro menor que
o núcleo atômico.
IV. Na proposição do seu modelo atômico, Rutherford se
baseou num experimento em que uma lamínula de
ouro foi bombardeada por partículas alfa.
Assinale a alternativa correta.
a) Somente a afirmativa I é verdadeira.
b) Somente as afirmativas III e IV são verdadeiras.
c) Somente as afirmativas I, II e III são verdadeiras.
d) Somente as afirmativas I, II e IV são verdadeiras.
e) As afirmativas I, li, III e IV são verdadeiras.
(g)
(UFPA) No estudo do átomo, geralmente causa admiração
a descoberta de Rutherford e colaboradores a respeito da
dimensão do núcleo atômico em relação ao tamanho do
próprio átomo.
É comum, em textos de química, o uso de uma analogia em que um objeto redondo é colocado no centro do
campo de futebol, do estádio do Maracanã, para ajudar
na visualização de quão pequeno é o núcleo atômico. Na
tabela, encontram-se os diâmetros de alguns "objetos"
redondos e o diâmetro interno aproximado do estádio
do Maracanã.
Diâmetros de objetos redondos
Estádio do Maracanã
200m
Considerando-se a razão de diãmetros núcleo/átomo, encontrada na experiência de Rutherford, é correto afirmar:
a) A analogia que usa a bola de pingue-pongue apresenta a melhor aproximação para a razão de diâmetros
núcleo/átomo.
b) A analogia que usa o grão de areia apresenta a melhor
aproximação para a razão de diâmetros núcleo/átomo.
c) A analogia que usa a bola de futebol subestima a razão de diâmetros núcleo/átomo em duas ordens de
magnitude.
d) A analogia que usa a bola de pingue-pongue superestima a razão de diâmetros núcleo/átomo em 10-4 ordens
de magnitude.
e) Aanalogia que usa a bola de futebol apresenta a melhor
aproximação para a razão de diâmetros núcleo/átomo.
~
(UFPR) Durante os últimos 100 anos, a ciência contribuiu
muito para desvendar os segredos que envolvem o comportamento da matéria. Parte dessa contribuição se deve
à invenção da pilha voltaica por Alessandro Volta no início
do século XIX. Somente com a eletricidade disponível em
grande escala é que se pode passar do modelo de Dalton,
1808, para os modelos mais modernos. Relacione os modelos atômicos (coluna I) com as informações da coluna 11.
Coluna I
Coluna 11
(1) Modelo de Dalton
(2) Modelo de Thomson
(3) Modelo de Rutherford-Bohr
( ) Eletrosfera
( ) Emissão luminosa
( ) Descoberta do elétron
( ) Esfera indivisível
A sequência numérica que preenche a coluna II de cima
para baixo é:
a) 1 - 3 - 2-1
d) 1 - 2 - 3 - 3
b) 2 - 2 -1 - 2
e) 3 -1 -1 - 2
c) 3 - 3 - 2-1
@ (UTF-PR) Segundo o modelo
atômico de Ernest Rutherford
(ou modelo atômico orbital). o átomo é formado em grande parte por espaços vazios, constituídos por partículas
eletricamente carregadas de naturezas diferentes. A esta
natureza elétrica convencionou-se denominar de carga
positiva e carga negativa. para o próton e para o elétron
respectiva mente.
Rutherford também obteve dados experimentais que demonstravam que:
1) toda a massa do átomo estava concentrada no seu interior, ou seja, no núcleo do átomo;
2) a massa dos elétrons é aproximadamente 1.840 vezes
menor que a massa do próton.
Com base no texto pode-se afirmar que, se fosse possível
acrescentar elétrons indefinidamente ao átomo de urânio
(Z = 92 e A = 238 u), seriam necessários para aumentar em
1% a massa atômica desse elemento, aproximadamente:
d) 4.379 elétrons.
a) 1.692 elétrons.
b) 2.342 elétrons.
e) 1.840 elétrons.
c) 1.234 elétrons.
@ (UEA-AM) Leia o texto e responda
à questão.
O elemento químico magnésio (número atômico 12) é
indispensável à vida dos vegetais clorojilados, pois participa
da fotossíntese. O magnésio é, portanto, um dos responsáveis
pela exuberância de nossa floresta amazônica. Ele é também
fundamental à vida de outros seres vivos, incluindo o ser
humano. Um adulto requer a ingestão diária de cerca de
300 mg desse elemento. Seu isótopo natural mais abundante é o de número de massa 24. O magnésio não existe na
natureza sob a forma metálica, mas sim como íons MgH
O número de nêutrons presentes no núcleo do isótopo mais
abundante do magnésio é:
a) 2
b) 4
c) 8
d) 12
e) 24
1IT1I1IDIIDfS
o
(U. F. Lavras-MG) Indique a alternativa que melhor descreve
as características dos átomos: 55Mn, 56Fee 58Ni.
a) São isótonos e possuem número atômico diferente.
b) São isótopos, com número de massa diferente.
c) São isótonos, com mesmo número atômico.
d) São isótopos, com mesmo número de massa.
(Dado: números atômicos: Mn = 25, Fe = 26, Ni = 28)
concentrações. A presença de um metal em um corpo d'água
pode afetar os seres que ali habitam de duas formas básicas:
pode ser tóxico ao organismo ou pode ser bioacumulado. tendo seu efeito potencializado ao longo da cadeia alimentar.
LIMA, V.F.; MERÇON, F. Metais pesados no ensino da química. Conceitos
científicos
se
58
Fe
NI
n = 30
n = 30
26
eu
Portanto, são isótonos.
Alternativa a
(U. F.Viçosa-MG) O doreto de potássio (KCn está presente em
formulações de fertilizantes, sendo essencial para o desenvolvimento das plantas. Assinale a alternativa em quea distribuição eletrônica em camadas do íon potássio está correta.
a) 2, 8, 8, 1
d) 2, 8, 6, O
b) 2,8,7,2
e) 2,8,9, O
c) 2,8,8, O
A distribuição eletrônica do átomo de potássio (Z = 19) será:
15' 25' 2p' 35' 3p' ~
K
l
M
N
O íon potássio K' perderá um elétron da camada de valência, então:
1s' 25' 2p' 35' 3p'
----U
U
U
o
K
L
M
2
8
8
Alternativa c
(UFPB, adaptada) Os materiais metálicos são amplamente
usados na sociedade, por apresentarem propriedades como
condutibilidade térmica e elétrica, que são associadas às suas
estruturas atômicas. A prata e o ouro são metais que apresentam
elevada condutibilidade elétrica, no entanto, por causa de seu
alto custo, não são empregados na produção de cabos elétricos,
sendo, nessecaso, o uso do cobre economicamente mais viável.
Sabendo-se que a estrutura eletrônica do átomo de cobre é 1s2
2S22p6 3s23p6 4s' 3d10,julgue 01 ou F)as afirmativas a seguir.
(F) O cátion Cu+ possui configuração eletrônica igual a
152 2s2 2p6 3s2 3p6 4s2 3d9
(F) O cátion Cu+ possui configuração eletrônica igual a
1S22S22p6 3s2 3p6 3d9
(v) O átomo de cobre possui um elétron na camada de
valência.
(v) O terceiro nível de energia do átomo de cobre possui
18 elétrons.
A retirada de elétrons ocorre nos subníveis mais externos, então:
Cu" (átomo neutro) => 15' 25' Zp" 35' 3p' 4s' 3d"
Cátion Cu- (perde 1 e) => 1s' 2s' 2p' 3s' 3p' 3d'"
Cátion Cu" (perde 2 e) => 1s' 2s' 2p' 3s' 3p' 3d'
+ENEM
G
(C3/H12) Leia o texto a seguir.
Para o ser humano, existem 14 metais essenciais: cálcio,
potássio, sódio, magnésio, ferro, zinco, cobre, estanho, vanádio, cromo, manganês, molibdênio, cobalto e níquel. Dessa
relação, pode-se constatar que até alguns metais considerados tóxicos em concentrações elevadas, como zinco, cobre,
cromo e níquel, são fundamentais ao metabolismo em baixas
em:
(acesso em 26 dez. 2012)
Tendo os números atômicos: cálcio (20), potássio (19), sódio
(11), magnésio (12), ferro (26), zinco (30), cobre (29), estanho
(50), vanádio (23), cromo (24), manganês (25), molibdênio
(42), cobalto (27) e níquel (28). Quais as distribuições eletrônicas simplificadas, respectivamente, dos metais tóxicos
ao metabolismo em altas concentrações?
a) [18Ar]4s2 3d'°; ['8Ar]4s' 3d'°; [,sAr]4S' 3d5; [,sAr]4s2 3ds
b) [,8Ar]4s2 3d'°; [,sAr]4s2 3d9; [,sAr]4s2 3d4; [lSAr] 452 3d6
c) ['8Ar]4s2; [,8Ar]4S'; [lONe] 3$1; [,0Ne]3s2
d) [,8Ar]3d'° 4s2; [,aAr]3d'° 4s1; [,sAr] 3d6; [,sAr] 3d'°
e) ['8Ar]3d'O; [, Ar] ?d10; [,8Ar]3dS; [,8Ar]3d8
• • •
n = 30
Química nova na escala. Disponível
http://qnesc.sbq.org.br
Os átomos podem ser representados por:
::Mn
em destaque.
o
os metais consldera~os tOXICOSao metabolismo em altas concentrações
são: zinco, cobre, cromo e níquel. Distribuição eletrônica simplificada:
lOZn:[,.,Ar]4S' 3dlO:"Cu: [,;r]4s' 3d" (estado fundamental com subnível
d totalmente preenchido)
"Cr: ["Ar]4s' 3d5 (estado fundamental com subnível d semipreenchido)
"Ni: [18Ar]4S'3d'
Alternativa a
(O/H24) O físico inglês [ames Chadwick, em 1932, comprovou a existência do nêutron por meio de uma experiência
com colisão de partículas alfa em uma amostra de berflio,
da qual apareceu um tipo de radiação que muitos cientistas acreditavam ser raios gama. Após a realização de vários
cálculos e medida da massa da partícula, Chadwick concluiu
que a radiação invisível era formada por nêutrons, já que,
segundo Rutherford, estas tinham massa igual a do próton.
Assim, as partículas que constituem um átomo são: prótons,
nêutrons e elétrons. Quando um átomo apresenta o número
de prótons igual ao número de elétrons diz-se átomo neutro,
ou apenas átomo, mas se o átomo receber ou doar elétrons
serão chamados de íons, Englobando os átomos e os íons
(cátions e ânions) pode-se caracterizá-Ios como espécies
químicas. Dentre as espécies genérícas" A (6 elétrons), 0'5
(8 nêutrons), P- (10 elétrons), 12G, 16j (9 nêutrons), 21L + (12
nêutrons), sM, 11Q, sR's, P' (13 nêutrons), X3+ (10 elétrons),
quais deveriam apresentar o mesmo símbolo químico?
a) L+ e T
d) [2-, M, R e T
b) P-e)(3+
e) O,j,L+eT
c) A, O ej
Átomos de um mesmo elemento apresentam o mesmo símbolo químico, ou
seja, são isótopos e possuem a mesma quantidade de protons e, portanto,
o mesmo número atômico (Z).
Átomo A: prótons = elétrons, portanto Z = 6
Átomo O: A = Z + n; 15 = Z + 8; Z = 7
íon E' : Z = 8
Átomo G: Z = 12
ÁtomoJ: A = Z + n; 16 = Z + 9; Z = 7
íon L" A = Z + n; 21 = Z + 12; Z = 9
Átomo M: Z = 8
Átomo Q; Z = 11
Átomo R: Z = 8
Átomo T: A = Z + n; 21 = Z + 13: Z = 8
íon Xl<:Z = 13
Apresentam mesmo Z as espécies P-, M, R e T.
Alternativa d
EXERcí(IOS COMPLEMENTARES
~
~
(UEGO)Considere três átomos hipotéticos,X, Ye W, sabendo-se que:
I. X tem número atômico igual a 20, sendo isóbaro
de Ye isótono de W;
11. Ytem número atômico igual a 21, número de massa
igual a 44, sendo isótopo de W
O elétron mais energético do elemento químico W irá ocupar o subnível:
a) 3d
b) 3p
c) 4p
d) 4s
(PUC-PR)Os átomos dos elem,e~tos genéricosX, Ye Z apresentam as seguintes caracterrsncas:
I. X 2+é isoeletrônico de Y.
11. Ypossui número atômico igual a 28.
111. Y é isótopo de Z e isóbaro de X.
IV. Zé isótono de X.
V. X tem 30 nêutrons.
Sobre os elementos caracterizados, assinale a alternativa correta.
a) O número de massa de Z é 60.
b) O subnível mais energético de X é 4s2.
c) A distribuição eletrônica do íon Y 2+é: 1s2 2s2 2p6 W
3p6 4s2 3d6.
d) O número de nêutrons de Y é igual a 30.
e) O átomo X apresenta número igual de prótons e
nêutrons.
(ó)
(Feso-RJ) Um metal M apresenta 7 subníveis na configuração eletrônica de seu átomo. O subnível mais energético
tem 6 elétrons. O número atômico de M é igual a:
a) 22
b) 23
c) 24
d) 25
e) 26
@ (Ielusc-SC) Os implantes
dentários estão mais seguros no
Brasil e já atendem às normas internacionais de qualidade. O grande salto de qualidade aconteceu no processo de
confecção dos parafusos e pinos de titânio, que compõem
as próteses. Feitas com ligas de titânio, essas próteses sâo
usadas para fixar coroas dentárias, aparelhos ortodônticos e dentaduras, nos ossos da mandíbula e do maxilar.
Considerando que o número atômico do titânio é 22 e seu
número de massa é 48, sua configuração eletrônica será:
~ 1~2~2~3~3~4~4~
b) 1S22S22p6 3523p6 452 3d'0 4p6 5s24d'°
~ 1~2~2~3~3~4~3~
d) 1S2 2s2 2p6 352 3p6 45'
e) W 2522p6 3s2 3p6 4s2 3d6
@ (UFES) A configuração
eletrônica do átomo de ferro em
ordem crescente de energia é 152 2s2 2p6 3s2 3p6 452 3d6.
Na formação do íon Fe2+, o átomo neutro perde 2 elétrons. A configuração eletrônica do íon formado é:
a) 152252 2p6 3s2 3p6 3d6
~ 1~2~2~3~3~4~3dw
c) 152 2s2 2p6 3s2 3p6 4s' 3d5
d) 1S2 252 2p6 3s2 3p4 45' 3d6
e) 1S2 2s2 2p6 3s2 3p' 4s2 3d5












