Equilíbrio químico
1. Equilíbrio Químico.
Uma reacção química é um processo dinâmico, em que as moléculas de reagentes chocam
entre si, dando origem, por rearranjo das ligações entre os átomos, às moléculas dos
produtos. Este processo é reversível, isto é, as moléculas dos produtos podem
eventualmente percorrer o caminho inverso, refazendo os reagentes originais. Quando a
velocidade do processo no sentido directo iguala a do processo no sentido inverso, as
quantidades de reagentes e produtos deixam de variar no tempo e a reacção atinge o
estado de equilíbrio.
Uma das grandes descobertas de sempre no domínio da Química foi a de que este estado é
caracterizado, para cada reacção, por um valor constante do quociente do produto das
quantidades de produtos da reacção pelo produto das quantidades de reagentes. Este
quociente é a constante de equilíbrio da reacção K. Esta descoberta, devida a Guldberg e
Waage, é ainda hoje conhecida por lei de acção das massas.
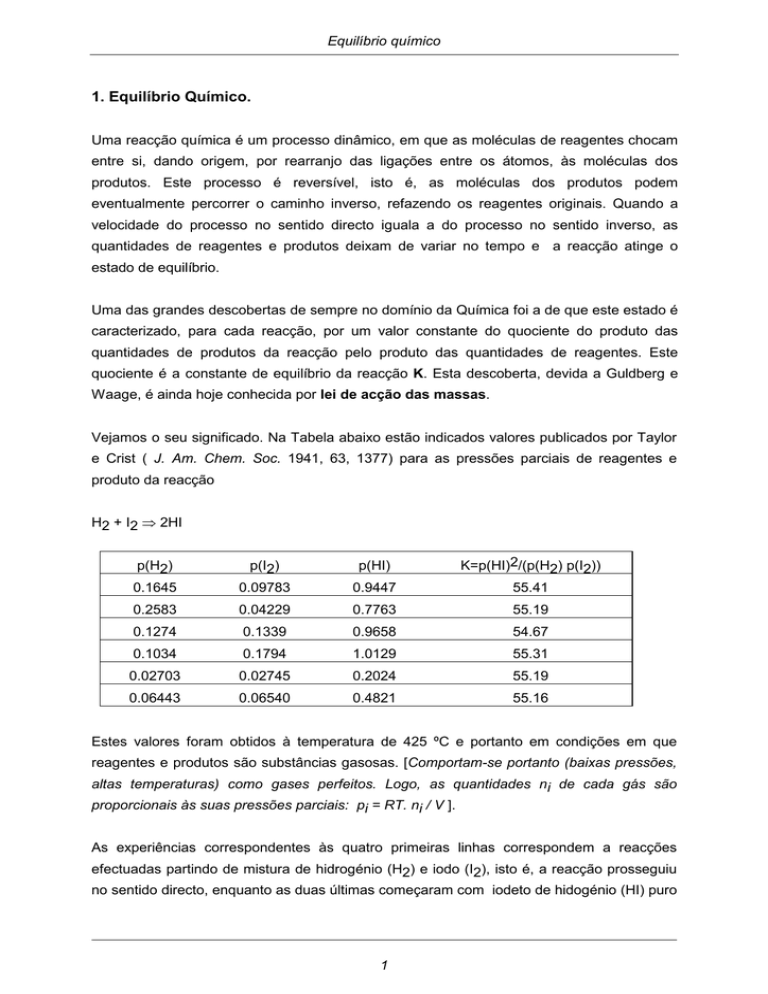
Vejamos o seu significado. Na Tabela abaixo estão indicados valores publicados por Taylor
e Crist ( J. Am. Chem. Soc. 1941, 63, 1377) para as pressões parciais de reagentes e
produto da reacção
H2 + I2 ⇒ 2HI
p(H2)
0.1645
p(I2)
p(HI)
K=p(HI)2/(p(H2) p(I2))
0.09783
0.9447
55.41
0.2583
0.04229
0.7763
55.19
0.1274
0.1339
0.9658
54.67
0.1034
0.1794
1.0129
55.31
0.02703
0.02745
0.2024
55.19
0.06443
0.06540
0.4821
55.16
Estes valores foram obtidos à temperatura de 425 ºC e portanto em condições em que
reagentes e produtos são substâncias gasosas. [Comportam-se portanto (baixas pressões,
altas temperaturas) como gases perfeitos. Logo, as quantidades ni de cada gás são
proporcionais às suas pressões parciais: pi = RT. ni / V ].
As experiências correspondentes às quatro primeiras linhas correspondem a reacções
efectuadas partindo de mistura de hidrogénio (H2) e iodo (I2), isto é, a reacção prosseguiu
no sentido directo, enquanto as duas últimas começaram com iodeto de hidogénio (HI) puro
1
Equilíbrio químico
e seguiram portanto o sentido inverso. As quantidades iniciais foram em todas elas
diferentes, de modo que, no equilíbrio, cada experiência apresenta um conjunto diferente de
pressões parciais.
A constante de equilíbrio, o quociente
p(HI)2
K =
p(H2) p(I2)
é, no entanto, sempre o mesmo e independente das condições iniciais.
O valor desta constante pode ser obtido empiricamente para cada reacção química, a uma
dada temperatura, tal como no exemplo acima. Este processo obrigaria, no entanto, a um
enorme esforço experimental de análise química de cada vez que fosse necessário saber
um valor de K. A Termodinâmica Química é a parte da Química Física que se dedica ao
cálculo, por métodos alternativos, dos valores de constantes de equilíbrio e da sua variação
com condições externas, como a temperatura.
Essencialmente o que se pretende é definir o sentido de evolução dum sistema químico
(quando um sistema deixa de evoluir, atingiu o equilíbrio).
Pode estabelecer-se um paralelo com sistemas puramente mecânicos, como um peso que
cai sob acção da gravidade, para se compreender o que é pretendido. Neste caso temos
um corpo com uma determinada energia potencial (dependente da altura), que é
transformada durante a queda em energia cinética. Enquanto esta aumenta, a energia
potencial diminui e a energia total conserva-se. O critério de evolução neste caso é, como
sabemos bem, o da diminuição da energia potencial: o sistema tende para uma energia
potencial mínima.
Um sistema químico é muito mais complexo que o sistema acima examinado. A energia
potencial e a energia cinética não variam regra geral de modo significativo (a não ser no
caso de explosões) e há portanto que encontrar outro critério de evolução. A ideia de que
esteja de algum modo relacionado com energia leva-nos a examinar as transformações
energéticas numa reacção química.
Energética das reacções químicas
Há
reacções químicas que se dão com libertação de calor, enquanto outras absorvem
2
Equilíbrio químico
calor. Medir o calor libertado ou absorvido num processo químico é uma tarefa
conceptualmente simples (embora na prática seja por vezes muito complicada). Utilizam-se
aparelhos denominados calorímeros, em que podemos, por exemplo, medir o aumento ou
diminuição de temperatura duma determinada quantidade de água n, colocada à volta do
recipiente onde se realiza a reacção. O calor Q será então calculado pelo produto de n pela
diferença de temperatura medida ∆T e pela capacidade calorífica da água C:
Q/J = n/mol . ∆T/K . C/J K-1 mol-1
(Ter em atenção que ∆T é representado pelo mesmo número em K ou em ºC, visto que se
trata duma diferença).
Calor é uma das formas que um sistema tem de trocar energia com o exterior. A outra é o
trabalho, como num motor dum automóvel, em que parte da energia libertada na combustão
é utilizada para fazer movimentar as rodas (a outra parte é dissipada para o exterior sob a
forma de calor, através do radiador). Num calorímetro, a variação de energia durante uma
reacção química é passada para o exterior totalmente sob a forma de calor.
Nas
condições
normalmente
prevalecentes
durante
uma
reacção,
isto
é,
a
pressão(atmosférica) fixa, o calor libertado ou absorvido corresponde à variação duma
forma de energia que os termodinâmicos designam por entalpia, representando-a pela letra
H.
Num calorímetro pode portanto medir-se a variação de entalpia duma reacção. O princípio
da conservação de energia (1º Princípio da Termodinâmica) impõe que, quando uma
reacção se dá no sentido inverso, a variação de entalpia seja igual em módulo, mas de sinal
contrário, ao da variação no sentido directo. Temos portanto que estabelecer (por
convenção arbitrária) qual o sinal que atribuimos em cada um dos casos. Por outro lado,
como só podemos medir variações (diferenças entre produtos e reagentes), convém-nos
estabelecer um zero convencional, para termos uma escala de medida.
O zero de entalpia foi estabelecido pela União Internacional de Química Pura e Aplicada
(IUPAC) como a entalpia dos elementos na sua forma mais estável a 25 ºC e à pressão
de 1 bar ( = 105 Pa).
Exemplo:
A entalpia do oxigénio é zero para a forma molecular O2, existente como gás, enquanto o
ozono, O3, e o oxigénio atómico, O, têm entalpias diferentes de zero.
3
Equilíbrio químico
Quanto ao sinal, consideram-se as variações de entalpia correspondentes a reacções em
que há libertação de calor,
negativas e as correspondentes a absorção de calor,
positivas.
Exemplo:
A entalpia de formação da água (líquida), a 25 ºC e 1 bar, é negativa, isto é, há libertação
de energia quando se forma 1 mol de água a partir dos seus elementos constituintes,
oxigénio e hidrogénio, na sua forma mais estável, O2 e H2:
H2 (g) + 1/2 O2 (g) ⇒ H2O (l)
∆fHº = –285.8 kJ mol-1
Então, a entalpia de dissociação da água terá que ser positiva:
H2O (l) ⇒ H2 (g) + 1/2 O2 (g)
∆dHº = +285.8 kJ mol-1
Neste exemplo, há vários pontos importantes a reter:
- Utiliza-se o símbolo ∆ por se tratar duma variação de entalpia entre reagentes e produtos;
os índices f e d designam as reacções, respectivamente, de formação dum composto a
partir dos seus ele mentos na forma mais estável e de dissociação desse composto; o
expoente º designa condições de referência (25 ºC, 1 bar).
- A unidade normalmente utilizada para a entalpia é kJ (=103 J). Sempre
que forem
realizados cálculos com estes valores, deverá ter-se em atenção este facto, como veremos
em pormenor a seguir.
- Como os elementos nesta forma têm entalpia nula, pode dizer-se que a entalpia de
formação da água é –285.8 kJ mol-1. Medindo valores de calor libertado ou absorvido
noutras reacções de formação, têm sido compiladas extensas tabelas de entalpias de
formação.
Foram medidas entalpias de formação para muitos compostos, cujos valores podem ser
encontrados em manuais de Química e publicações especializadas em Tabelas
Termoquímicas. Estes valores podem ser usados para calcular a variação de entalpia em
qualquer reacção química.
4
Equilíbrio químico
Exemplo:
O conhecimento da energia cedida na reacção de combustão de glucose é muito importante
do ponto de vista biológico. Este valor pode obter-se a partir dos seguintes valores de
entalpias de formação, retirados de tabelas termoquímicas:
∆fHº (glucose) = – 1274.0 kJ mol -1
∆fHº (dióxido de carbono) = – 393.5 kJ mol -1
∆fHº (água) = – 285.8 kJ mol -1
Então, podemos calcular ∆fHº da reacção
C6H12O6 (s) + 6O2 (g) ⇒ 6CO2 (g) + 6H2O (l)
através da subtracção das entalpias dos reagentes (O2 é um elemento na sua forma mais
estável e tem convencionalmente entalpia 0) das dos produtos:
∆rHº = – 285.8 x 6 – 393.5 x 6 – (–1274.0 + 0 x 6) = – 2801.8 kJ mol -1
Por vezes o problema é o oposto, sendo necessário conhecer a entalpia de combustão
para se calcular a entalpia de formação. É o caso dos hidrocarbonetos (compostos de
carbono e hidrogénio), cujas reacções de formação são normalmente irrealizáveis (quando
se combina carbono com hidrogénio, obtêm-se inúmeros hidrocarbonetos e nunca um único
puro). Vejamos o caso do hidrocarboneto mais simples, o metano.
Exemplo:
A entalpia de formação do metano não pode ser medida directamente por realização da
reacção
C (sól.) + 2H2 (g) ⇒ CH4 (g)
pelas razões acima apontadas. A reacção de combustão
CH4 (g) + 2O2 (g) ⇒ CO2 (g) + 2H2O (liq.)
é, pelo contrário, muito fácil de realizar (o metano é um combustível e o principal constituinte
do gás de cidade), podendo medir-se a sua variação de entalpia: ∆rHº = –890.3 kJ mol -1.
5
Equilíbrio químico
Somando então reacções de ∆rHº conhecida
2× [H2 (g) + 1/2 O2 (g) ⇒ H2O (liq.) ]
∆fHº = 2×( –285.8 kJ mol-1)
C (sól) + O2 (g) ⇒ CO2 (g)
∆fHº = – 393.5 kJ mol-1
CO2 (g) + 2 H2O (liq.) ⇒ CH4 (g) + 2 O2 (g)
∆rHº = + 890.3 kJ mol -1
C (sól.) + 2H2 (g) ⇒ CH4 (g)
∆fHº = – 393.5 kJ mol-1+2×(–285.8 kJ mol-1)+ 890.3 kJ mol -1= –74.8 kJ mol-1
obtém-se um valor para a reacção de formação do metano.
Repare-se como à soma de reacções para obter uma reacção final corresponde uma soma
dos valores de variação de entalpia - trata-se duma aplicação do princípio da conservação
da energia. Veja-se também como à reacção inversa da de combustão do metano se pode
atribuir uma variação de entalpia simétrica da de combustão.
Sentido das transferências de energia - definição de entropia
As tabelas termoquímicas dão a quantidade de energia trocada com o exterior quando se
dá uma reacção química, mas não respondem à questão inicial: em que sentido se vai dar
uma dada reacção? Na realidade há reacções que prosseguem espontaneamente com
absorção e outras com libertação de energia.
Para chegarmos a um critério de evolução química, examinemos uma transferência de
energia muito simples: calor a passar dum corpo quente para um corpo mais frio.
Trata-se dum fenómeno que, toda a gente sabe, se dá em sentido único: o calor só passa
espontaneamente dos corpos mais quentes para os mais frios. Para passar calor do mais
frio para o mais quente é preciso uma máquina, um frigorífico, por exemplo, e o fenómeno
não é portanto espontâneo.
Suponhamos que o corpo quente está à temperatura de 50 ºC (323 K) e o corpo frio a 25 ºC
(298 K) e que, postos em contacto, passam 300 J sob a forma de calor dum para o outro.
Introduzimos uma nova função termodinâmica, a que se dá o nome de entropia, definindo a
6
Equilíbrio químico
sua variação como o quociente do calor trocado pela temperatura: ∆S = Q / T. Como o
calor é cedido pelo corpo quente, temos que para este Q = −300 J, enquanto o corpo frio
recebe Q' = + 300 J. A variação que a função entropia sofre no processo espontâneo de
transferência de calor do corpo quente para o corpo frio é:
∆S = −300 / 323 + 300 / 298 = 0.071 J K-1> 0
A entropia é portanto definida de tal forma que aumenta ( a sua variação é maior que zero)
quando se dá um processo espontâneo. "O calor passa espontaneamente dos corpos
quentes para os mais frios" e "A entropia aumenta num processo espontâneo" são
afirmações equivalentes neste caso simples. São duas formas diferentes de enunciar o
Segundo Princípio da Termodinâmica, uma das leis mais importantes da Física. A segunda
forma é mais abstracta, mas permite uma aplicação mais fácil ao estudo das reacções
químicas.
Temos assim que uma reacção química evolui no sentido que aumenta a entropia. Quando
a entropia deixa de aumentar (porque atingiu um máximo), a reacção chega ao equilíbrio.
Como é que se calcula então a variação de entropia numa reacção química? Há duas
parcelas a considerar. A primeira parcela é a diferença de entropia entre os produtos da
reacção e os reagentes (cada substância tem uma entropia diferente). A segunda
corresponde ao efeito que a reacção produz no meio exterior - se ela liberta calor, a
entropia do meio exterior aumenta, se absorve calor, diminui.
A entropia duma substância pode ser medida, a partir da definição, realizando-se medidas,
desde temperaturas muito baixas, do calor necessário para aumentar a sua temperatura, ou
seja, da sua capacidade calorífica. Tomando a entropia a 0 K como o valor zero, a entropia
a uma temperatura T será:
T
T
S(T) = ∫ dQ/T = ∫ CdT/T
0
0
Os gases têm maior entropia que os líquidos e estes que os sólidos, devido ao calor de
fusão e de vaporização que é necessário fornecer.
Entropias a 298 K e pressão de 1 bar foram medidas para muitas substâncias e aparecem
normalmente tabeladas juntamente com as entalpias de formação. Recorrendo a estas
tabelas, é regra geral possível calcular a primeira parcela acima referida da variação de
7
Equilíbrio químico
entropia numa reacção química, a que podemos chamar variação interna. Para podermos
calcular a segunda parcela, precisamos de saber o calor que a reacção liberta ou absorve.
Mas essa grandeza já sabemos que corresponde à variação de entalpia. Então temos:
∆Stotal = ∆Sinterno+∆Sexterno = ∆rS − ∆rH / T
Exemplo:
A reacção de formação de ferrugem (oxidação do ferro) é, sem dúvida, uma reacção
espontânea à temperatura ambiente:
4Fe (sól.) + 3O2 (g) ⇒ 2Fe2O3 (sól.)
A parcela correspondente à variação interna de entropia pode calcular-se com base nos
seguintes valores encontrados em tabelas termoquímicas:
Substância
Sº/ J K-1mol-1
Fe
Fe2O3
87.4
27.3
O2
205
∆rSº = 87.4 x 2 − 27.3 x 4 − 205 x 3 = − 549.4 J K-1mol-1.
( Como um dos reagentes é um gás e o produto é um sólido, a variação de entropia da
reacção é negativa, a entropia interna diminui)
A segunda parcela é calculável com base no valor de entalpia de formação do óxido de ferro
Fe2O3: ∆fHº(Fe2O3) = – 824.2 kJ mol-1, obtida também numa tabela.
Então temos:
∆Sºtotal= ∆rSº− ∆rHº / T = −549.4 −(–824.2 x 1000 x 2) / 298.15 = + 4979 J K-1mol-1
A variação total de entropia é muito positiva, apesar da variação interna ser negativa,
porque a reacção liberta calor em grande quantidade, aumentando a entropia do meio
exterior. A entropia aumenta muito na formação de ferrugem.
(Repare-se como multiplicámos – 824.2 por 1000, para transformar kJ em J, e por 2, uma
vez que na reacção acima se formam 2 mol de Fe2O3, enquanto o valor de ∆fHº(Fe2O3) =
– 824.2 kJ mol-1 se reporta unicamente à formação de 1 mol)
8
Equilíbrio químico
Quando aumentamos muito a temperatura, o termo − ∆rHº / T vai-se tornando cada vez
mais pequeno, até que passa a ser menor em módulo que o termo ∆rSº. Para temperaturas
altas é então a reacção inversa, a formação de ferro a partir dos seus óxidos, que se torna a
reacção espontânea (por isso é que se trabalha a altas temperaturas nos altos fornos duma
siderurgia).
Conclusão:
Pode prever-se o sentido em que vai evoluir uma reacção química se soubermos
calcular o valor de ∆Sºtotal= ∆rSº−
− ∆rHº / T:
∆Sºtotal>0 → sentido directo
∆Sºtotal<0 → sentido inverso
Energia de Gibbs
As duas parcelas podem calcular-se através do uso de duas tabelas diferentes. Para
facilitar o uso destas tabelas, é preferível condensá-las numa só. Define-se para tal uma
nova função. Esta nova função tem as unidades duma energia e designa-se (actualmente)
por energia de Gibbs.
∆G = − T × ∆Stotal = ∆rH − T x ∆rS
A energia de Gibbs tende a diminuir (devido ao sinal − na definição, quando S aumenta, G
diminui) e atinge um mínimo no equilíbrio. Exerce, para um sistema químico, as mesmas
funções que a energia potencial para o sistema puramente mecânico que examinámos
acima. Por isso, a energia de Gibbs transportada por 1 mol duma determinada substância
química é também designada por potencial químico.
No exemplo de formação de ferrugem
∆Gº = − T x ∆Sºtotal= − 4979 x 298.15 = −1485 x 103 = −1485 kJ mol-1
Este valor significa que quando se passa de 4 mol de ferro e 3 mol de oxigénio para 2 mol
de óxido de ferro, a 298 K e pressão de 1 bar, há uma variação de energia de Gibbs muito
negativa. A reacção é muito favorável no sentido directo e prossegue até esgotar
9
Equilíbrio químico
praticamente um dos reagentes, o ferro ou o oxigénio. A constante de equilíbrio da reacção
tem portanto um valor muito elevado.
Examinemos agora uma outra reacção, a formação do amoníaco NH3 (uma reacção de
grande interesse industrial):
N2 + 3H2 ⇔ 2NH3
Consultando uma tabela, obtivemos a energia de Gibbs de formação em condições de
referência ∆fGº = − 16.5 kJ mol-1 (como na reacção tal como está escrita se formam 2 mol
de amoníaco, temos ∆rGº = − 33.0 kJ mol-1). É ainda um valor negativo, mas muito menos
negativo que no caso de formação de ferrugem. Verifica-se experimentalmente que, quando
se misturam azoto (N2) e hidrogénio (H2), estes reagem em grande extensão, mas no
equilíbrio ainda existem em quantidades apreciáveis. Os reagentes não se esgotam, ao
contrário do caso anterior. A constante de equilíbrio é maior que 1, mas bastante menor que
no caso da reacção anteriormente estudada.
Se quiséssemos agora comparar a tendência do amoníaco e do óxido de ferro para se
decomporem, formando os seus elementos constituintes, teríamos que examinar a
tendência das reacções acima indicadas para se darem no sentido inverso. Escrevendo-as
então ao contrário, facilmente poderíamos concluir, a partir do que já foi dito, que ∆rGº
seriam respectivamente + 33 e + 1485 kJ mol-1, e as constantes de equilíbrio
correspondentes seriam menores que 1, mas enquanto na decomposição do amoníaco
teríamos um valor não muito pequeno, na do óxido de ferro o valor seria praticamente 0.
Resumindo:
∆rGº
muito negativa
muito grande (∞)
negativa e pequena (em módulo)
>1
positiva e pequena
<1
muito positiva
muito pequena (≅ 0)
K equilíbrio
Relação entre ∆rGº e a constante de equilíbrio
10
Equilíbrio químico
A tabela acima sugere uma relação logarítmica entre ∆Gº e K. Pode provar-se por
argumentos termodinâmicos que
loge Kp = −∆Gº/RT
Esta é uma equação fundamental da Termodinâmica Química e permite calcular constantes
de equilíbrio só a partir de informação termodinâmica (entalpias, entropias) sobre reagentes
e produtos da reacção.
Exemplo:
O gás dióxido de azoto (um dos principais poluentes produzido no motor dum automóvel)
pode existir como molécula simples (monómero) ou como uma associação de duas
moléculas (dímero). O equilíbrio entre estas duas formas pode traduzir-se pela seguinte
reacção:
2NO2 (g) ⇔ N2O4 (g)
Determinar a quantidade de cada destas espécies, à pressão de 1 bar.
O primeiro passo é a consulta duma tabela para se obter os valores de ∆fGº para cada
gás.
Substância
∆fGº/kJmol-1
NO2
51.3
N2O4
97.8
Calculamos então ∆rGº = 97.8 − 2 x 51.3 = − 4.8 kJ mol-1 = − 4800 J mol-1.
O segundo passo é o cálculo do valor da constante de equilíbrio K.
[Numa reacção em fase gasosa, a constante de equilíbrio exprime-se em função das
pressões parciais das substâncias envolvidas e designa-se por Kp. A unidade usada é o
bar, pressão à qual são medidas ∆fGº].
loge Kp= 4800 / (8.314 x 298.15) = 1.9373 ⇒ Kp = 6.94.
Então temos
p(N2O4)
6.94 =
p(NO2)2
e uma segunda equação que relaciona as pressões parciais:
11
Equilíbrio químico
p(N2O4) + p(NO2) = 1 bar
[A soma das pressões parciais iguala a pressão total]
Ficamos assim com um sistema de duas equações a duas incógnitas. Por substituição da
segunda na primeira:
p(N2O4)
1 − p(NO2)
6.94 = =
p(NO2)2
p(NO2)2
obtendo-se uma equação do segundo grau, com duas soluções:
p(NO2) = 0.314 bar e
p(NO2) = − 0.458 bar
A pressão não pode ser negativa, pelo que a primeira solução é a única aceitável. Temos
portanto:
p(NO2) = 0.314 bar e p(N2O4) = 1 − p(NO2) = 0.686 bar
Como a pressão é proporcional à quantidade de substância, através da equação dos gases
perfeitos, temos uma composição de equilíbrio de 31.4 % (molar) de NO2 e 68.6 % de
N2O4.
[Estes números exemplificam como a ∆rGº pequeno e negativo corrresponde K pouco maior
que 1 e quantidades apreciáveis no equilíbrio, tanto de reagentes como de produtos].
Variação da constante de equilíbrio com a temperatura
A uma determinada temperatura, a constante de equilíbrio é um número fixo que caracteriza
uma reacção no equilíbrio, quaisquer que tenham sido as concentrações iniciais de
reagentes e produtos. Este número varia no entanto com a temperatura. Aumenta com o
aumento de temperatura para algumas reacções e para outras diminui. Esta variação pode
ser facilmente interpretada em termos da equação abaixo apresentada:
log e K =
− ∆G º − ∆H º ∆S º
=
+
RT
RT
R
Se admitirmos que ∆Hº e ∆Sº são grandezas que variam lentamente com a temperatura, o
que é válido na maioria das reacções químicas, podemos usá-las, em primeira
12
Equilíbrio químico
aproximação, como valores constantes na equação acima. Pode então facilmente ver-se
que só a primeira parcela do termo direito da equação varia com a temperatura, porque
contem o factor 1/T. Logo, o logaritmo da constante de equilíbrio (e portanto também a
própria constante K) varia com T de acordo com o sinal e a magnitude da variação de
entalpia da reacção ∆Hº.
Assim, quando T aumenta, 1/T diminui e:
- se ∆Hº for positivo (reacção endotérmica), a parcela (-∆Hº/RT) torna-se menos negativa e
log K aumenta;
- se ∆Hº for negativo (reacção exotérmica), a parcela (-∆Hº/RT) torna-se mais negativa e
log K diminui.
Conclusão:
A constante de equilíbrio duma reacção endotérmica aumenta quando a temperatura
aumenta.
A constante de equilíbrio duma reacção exotérmica diminui quando a temperatura
aumenta
Esta conclusão é uma das formas do Princípio de Le Chatelier que, enunciado com
generalidade, diz que os fenómenos no equilíbrio tendem a contrariar qualquer modificação
externa que se aplique às condições de equilíbrio (há também quem lhe chame o princípio
da perversidade da Natureza).
Aplicado ao caso da variação de temperatura, este enunciado traduz-se da seguinte
maneira:
Uma reacção endotérmica no equilíbrio reage a um acréscimo da temperatura produzindo
mais produtos (K aumenta), o que irá absorver algum calor do meio exterior e tende a fazer
baixar T, contrariando o seu aumento inicial. Pelo contrário, se tiver havido um decréscimo
da temperatura, a reacção evolui no sentido inverso, que é exotérmico, e produz mais
reagentes, libertando calor, o que tende a aumentar de novo a temperatura.
13