Setor 1306
Aula 41 – Energia de Ligação
Exercício extra.
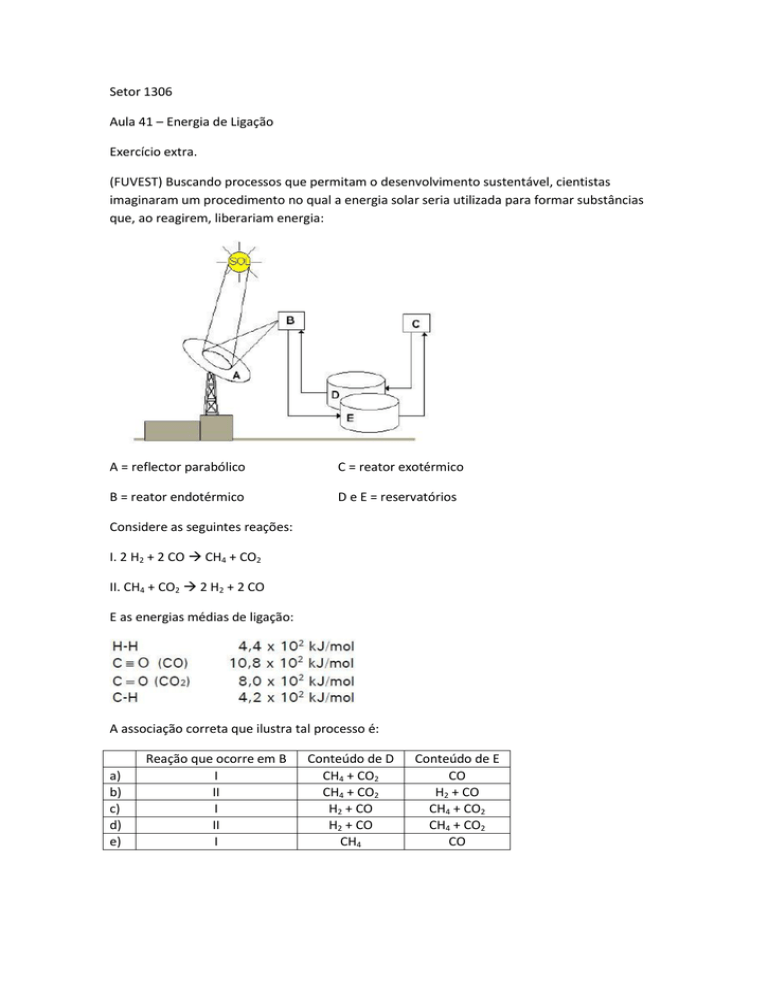
(FUVEST) Buscando processos que permitam o desenvolvimento sustentável, cientistas
imaginaram um procedimento no qual a energia solar seria utilizada para formar substâncias
que, ao reagirem, liberariam energia:
A = reflector parabólico
C = reator exotérmico
B = reator endotérmico
D e E = reservatórios
Considere as seguintes reações:
I. 2 H2 + 2 CO CH4 + CO2
II. CH4 + CO2 2 H2 + 2 CO
E as energias médias de ligação:
A associação correta que ilustra tal processo é:
a)
b)
c)
d)
e)
Reação que ocorre em B
I
II
I
II
I
Conteúdo de D
CH4 + CO2
CH4 + CO2
H2 + CO
H2 + CO
CH4
Conteúdo de E
CO
H2 + CO
CH4 + CO2
CH4 + CO2
CO
RESOLUÇÃO
Repare que a reação I é o inverso de II. Assim, se uma delas for exotérmica, a outra será
endotérmica e a energia (entalpia) envolvida no fenômeno será a mesma.
O reservatório B recebe a energia solar focalizada pelo refletor A. Como esse recebe energia,
em B ocorrerá a reação endotérmica. O reator B é abastecido pelo reservatório D, isso indica
que em D encontram-se os reagentes da reação endotérmica. Os produtos do processo que
ocorrem em B são enviados para o reservatório E.
Podemos calcular o ∆H da reação II através das energias de ligação:
CH4 + CO2 2 H2 + 2 CO
Quebra:
Formação:
4.(C - H)
+ 2.(C = O)
4. (4,2.102)
+ 2.(8.102) = 32,8.102 kJ absorvidos
2.(H - H)
+ 2.(C À O)
2.(4,4.102)
+2.(10,8.102) = 30,4.102 kJ liberados
Como a energia absorvida é maior que a energia liberada, o fenômeno é endotérmico e o ∆H é
positivo. A diferença entre a energia absorvida e liberada é a variação de entalpia. Assim:
∆H = + 2,4.102 kJ.
Ocorrem então em B a reação II. Em D encontram-se os reagentes (CH4 e CO2) e em E os
produtos (H2 e CO) do processo.
Alternativa B.
Caso você tenha trabalhado inicialmente com a reação I, deverá encontrar uma reação
exotérmica, onde a energia absorvida foi 30,4.102 kJ e a energia liberada foi de 32,8.102 kJ e
∆H= -2,4.102 kJ. Como a reação I é exotérmica, ela ocorrerá no reator C e a reação II em B.












