Módulos
4, 5, 6 e 7
Andrea Thompson Da Poian
Debora Foguel
Marílvia Dansa Petretski
Olga Lima Tavares Machado
Bioquímica II
Volume
2ª edição
2
Bioquímica II
Volume 2 - Módulos 4, 5, 6 e 7
2a edição
Andrea Thompson Da Poian
Debora Foguel
Marílvia Dansa Petretski
Olga Lima Tavares Machado
Apoio:
Fundação Cecierj / Consórcio Cederj
Rua Visconde de Niterói, 1364 – Mangueira – Rio de Janeiro, RJ – CEP 20943-001
Tel.: (21) 2299-4565 Fax: (21) 2568-0725
Presidente
Masako Oya Masuda
Coordenação do Curso de Biologia
UENF - Ana Beatriz Garcia
UFRJ - Masako Oya Masuda
UERJ - Cibele Schwanke
Material Didático
Departamento de Produção
ELABORAÇÃO DE CONTEÚDO
Andrea Thompson Da Poian
Debora Foguel
Marílvia Dansa Petretski
Olga Lima Tavares Machado
EDITORA
Tereza Queiroz
COORDENAÇÃO EDITORIAL
COORDENAÇÃO E REVISÃO
Jane Castellani
Ana Tereza de andrade
REVISÃO TIPOGRÁFICA
DESIGN INSTRUCIONAL E REVISÃO
Jane Castellani
Kátia Ferreira dos Santos
Alexandre Rodrigues Alves
Carmen Irene Correia de Oliveira
José Meyohas
COORDENAÇÃO DE
PRODUÇÃO
COORDENAÇÃO DE
ILUSTRAÇÃO
Eduardo Bordoni
ILUSTRAÇÃO
Jefferson Caçador
Salmo Dansa
Sami Souza
CAPA
Eduardo Bordoni
REVISÃO TÉCNICA
Jorge Moura
PRODUÇÃO GRÁFICA
Marta Abdala
PROGRAMAÇÃO VISUAL
Andréa Dias Fiães
Fábio Rapello Alencar
Equipe CEDERJ
Copyright © 2004, Fundação Cecierj / Consórcio Cederj
Nenhuma parte deste material poderá ser reproduzida, transmitida e gravada, por qualquer meio
eletrônico, mecânico, por fotocópia e outros, sem a prévia autorização, por escrito, da Fundação.
D111b
Da Poian, Andrea Thompson.
Bioquímica II. v. 2 / Andrea Thompson Da Poian. -- 2.ed. –
Rio de Janeiro : Fundação CECIERJ, 2007.
270p.; 19 x 26,5 cm.
ISBN: 85-89200-46-9
1. Respiração celular. 2. Ciclo de Krebs. 3. Metabolismo de aminoácidos. 4. Uréia. 5.
Metabolismo de carboidratos. 6. Degradação. Sintese de ácidos. 7. Glicose. 8. Biossintese.
9. Insulina. 10. Glicocorticóides. I. Foguel, Debora. II. Petretski, Marílvia Dansa. III.
Machado, Olga Tavares. IV. Título.
CDD: 572
2007/2
Referências Bibliográficas e catalogação na fonte, de acordo com as normas da ABNT.
Governo do Estado do Rio de Janeiro
Governador
Sérgio Cabral Filho
Secretário de Estado de Ciência, Tecnologia e Inovação
Alexandre Cardoso
Universidades Consorciadas
UENF - UNIVERSIDADE ESTADUAL DO
NORTE FLUMINENSE DARCY RIBEIRO
Reitor: Almy Junior Cordeiro de Carvalho
UFRJ - UNIVERSIDADE FEDERAL DO
RIO DE JANEIRO
Reitor: Aloísio Teixeira
UERJ - UNIVERSIDADE DO ESTADO DO
RIO DE JANEIRO
Reitor: Nival Nunes de Almeida
UFRRJ - UNIVERSIDADE FEDERAL RURAL
DO RIO DE JANEIRO
Reitor: Ricardo Motta Miranda
UFF - UNIVERSIDADE FEDERAL FLUMINENSE
Reitor: Roberto de Souza Salles
UNIRIO - UNIVERSIDADE FEDERAL DO ESTADO
DO RIO DE JANEIRO
Reitora: Malvina Tania Tuttman
Bioquímica II
SUMÁRIO
Volume 2 - Módulos 4, 5, 6 e 7
Módulo 4
Aula 12 - Respiração celular ____________________________________ 7
Aula 13 - Ciclo de Krebs - Parte 1 ______________________________ 17
Aula 14 - Ciclo de Krebs - Parte 2 ______________________________ 29
Aula 15 - Metabolismo de carboidratos I _________________________ 51
Aula 16 - Metabolismo de carboidratos II ________________________ 65
Módulo 5
Aula 17 - A oxidação dos aminoácidos e a produção de uréia _________ 83
Aula 18 - Ciclo da uréia______________________________________ 95
Aula 19 - Metabolismo de aminoácidos ________________________ 103
Módulo 6
Aulas 20 / 21 - Degradação de lipídeos _______________________ 115
Aulas 22 / 23 - Síntese de ácidos graxos _______________________ 135
Módulo 7
Aula 24 - Via das pentoses-fosfato ____________________________ 149
Aula 25 - Degradação do glicogênio ___________________________ 159
Aula 26 - Biossíntese do glicogênio ___________________________ 167
Aula 27 - Regulação do metabolismo do glicogênio _______________ 175
Aula 28 - Introdução à gliconeogênese _________________________ 187
Aula 29 - A via gliconeogênica _______________________________ 199
Aula 30 - Regulação da gliconeogênese ________________________ 211
Aula 31 - Introdução aos hormônios ___________________________ 223
Aula 32 - Glucagon e adrenalina _____________________________ 235
Aula 33 - Insulina e glicocorticóides ___________________________ 249
Gabarito _______________________________________________ 265
AULA
Respiração celular
12
BIOQUÍMICA II | Respiração celular
DA ANTIGUIDADE AO INÍCIO DA MODERNIDADE
A Química da Antiguidade é essencialmente uma técnica:
fabricação de cores, de bebidas fermentadas, de preparação de metais
etc. Alguns produtos, como a cal e o enxofre, já eram conhecidos. Nessa
época, os homens assumiam que a natureza era composta por quatro
elementos fundamentais: fogo, ar, terra e água (os quatro elementos
de Aristóteles); estes quatro elementos estavam associados a quatro
qualidades: calor, frio, secura e umidade.
No fim da Antiguidade surge a Alquimia (século IX). O grande
Figura 12.1: Símbolo
alquímico. Uma cobra
devorando a própria
cauda. O círculo formado simboliza o
infinito.
objetivo dos alquimistas era a busca do ouro, a transmutação dos
metais. A interpretação das reações químicas acontecia através de um
“pensamento mágico”. Apesar do seu misticismo, a Alquimia teve um
papel central no progresso da Química.
Figura 12.2: Um laboratório alquímico.
A vontade de experimentar se acentua em meados do século XVII.
A noção de ácido (chamado spiritus salis por Livabius) é um pouco mais
bem definida por Robert Boyle. O antagonismo entre ácidos e bases é
mais bem estudado. A existência dos gases é revelada (chamado spiritus
sylvestris ou espírito indomável por Van Helmont). Torricelli e Pascal
demonstram a existência do vácuo.
Os “químicos” dessa época começaram a duvidar se as substâncias
seriam compostas apenas pelos quatro elementos e tentaram explicar por
que quando um corpo queimava suas propriedades físicas e químicas
se alteravam.
8 CEDERJ
12 MÓDULO 4
AULA
Surgiu, então, em 1760, a Teoria do Flogístico ou Princípio do
Fogo, postulada por Georg Ernst Sthal, que unificava o pensamento da
época. Esta teoria propunha que todo corpo suscetível à combustão
contém um princípio de inflamabilidade (flogístico) que era liberado
durante a queima.
Assim, o flogístico existia não só na matéria inanimada como
também nos seres vivos. Neste caso, o flogístico ou alma da matéria
seria liberado durante a respiração no decorrer da vida, levando ao
envelhecimento.
E
E
P
P
TERRA (Pobre em flogístico)
P
METAL (Rico em flogístico)
FOGO (Flogiston)
Figura 12.3: Representação resumida da Teoria do Flogístico. A Terra
era considerada um elemento pobre em flogístico, enquanto o metal
era um elemento rico em flogístico.
Outra verdade da época era a concepção de que o ar era único.
Contudo, já se faziam referências quanto à qualidade do ar, atribuindo-se
características de ar bom (deflogisticado) e ar ruim (flogisticado), encontrados
nas montanhas e em ambientes confinados, respectivamente.
CEDERJ 9
BIOQUÍMICA II | Respiração celular
LAVOISIER
Nesse contexto, o francês, economista e servidor público, Antoine
Laurent Lavoisier, iniciou, como hobby, seus estudos na área da Chymica.
Tido como conservador e metódico, introduziu métodos de trabalho
que lançaram as bases para a química moderna. Graças ao seu poder
econômico, pôde montar um laboratório, com instrumentos de precisão
bastante sofisticados para a época e, até então, nunca utilizados em
pesquisa.
Lavoisier, interessado em entender os mecanismos da combustão
de diferentes substâncias, realizou diversos experimentos, entre os quais
um chamou particularmente sua atenção, conforme o enunciado que se
segue:
“Por volta de oito dias atrás, eu descobri que o enxofre, ao ser
queimado, em vez de perder peso, ao contrário, ganha peso; o
mesmo acontece com o fósforo; este aumento de peso se deve a
uma prodigiosa quantidade de ar que é fixado durante a combustão
e se combina com os vapores.
Esta descoberta, que eu tenho estabelecido por experimentos que
eu considero como decisivos, tem me levado a pensar que o que
é observado na combustão do enxofre e fósforo pode acontecer
no caso de todas as substâncias que ganham peso por combustão
e calcinação; e eu estou convencido de que o aumento no peso de
calxes metálicos é devido à mesma causa.”
Nota selada depositada na Secretaria da Academia Francesa
em 1º de novembro de 1772.
Para saber mais, acesse:
Teoria do Flogístico - http://www.hcc.hawaii.edu/hccinfo/instruct/
div5/sci/sci122/atomic/skepchem/phloggen.html
Lavoisier: Principais contribuições para a Ciência Moderna - http:
//www.lucknow.com/horus/guide/ec109.html#ec1092
Alquimia - http://143.107.237.20/~edsonro/index.htm
10 CEDERJ
Figura 12.4: Antoine Laurent
Lavoisier, cientista francês
considerado o pai da química
moderna. Lavoisier foi guilhotinado durante a Revolução
Francesa.
Para saber mais consulte:
http://scienceworld.
wolfram.com/biography/
lavoisier.html
obtidos, pense sobre o que esses resultados indicam em relação à Teoria
do Flogístico.
Intrigado com a Teoria do Flogístico, Lavoisier resolve estudála mais profundamente. Realiza experimentos com velas acesas e
camundongos confinados em campânulas separadas e hermeticamente
fechadas. Observa que os camundongos em pouco tempo morriam e que
as velas rapidamente se apagavam.
Figura 12.5: Experimento inicial de Lavoisier. Campânulas são cubas
de vidro que não deixam passar ar do meio externo para o ambiente
onde estão a vela e o rato.
Pense
sobre isso!
A que conclusões você acredita que Lavoisier deve ter chegado?
Intrigado com a função química do “ar ruim”, Lavoisier é
convidado para participar de uma Reunião Anual da Academia de
Ciências da França. Durante o encontro com o professor e presbítero
inglês Joseph Priestley, ele ficou bastante interessado nos experimentos
do colega, que apresentamos a seguir.
CEDERJ 11
12 MÓDULO 4
Conhecendo o contexto em que os resultados de Lavoisier foram
AULA
Pense
sobre isso!
BIOQUÍMICA II | Respiração celular
Experimentos de Priestley
1. Calcinação
Hg
+
metal de
O2
2HgO
óxido de
oxigênio
mercúrio
mercúrio
2. Decomposição do óxido
2HgO
2Hg
óxido de
metal de
mercúrio
mercúrio
+
O2
oxigênio
3. Redução com adição de carvão
(também chamada de redução com phogistoal)
2HgO
+
C
2Hg
óxido de
carvão
metal de
dióxido de carbono
mercúrio
(carbono)
mercúrio
ou “ar fixado”
Símbolo utilizado
para representar
aquecimento
brando.
12 CEDERJ
Símbolo utilizado
para representar
aquecimento
intenso.
+
CO2
12 MÓDULO 4
O que você faria se fosse Lavoisier?
Paralelamente às experiências de caracterização do “ar bom” e do
“ar ruim”, Lavoisier observou que a queima de velas de tamanhos iguais
originava velas menores e de tamanhos diferentes quando aprisionadas
em campânulas de dimensões variadas.
Esse resultado despertou no cientista o interesse em relacionar o
tamanho da vela com a liberação do flogiston. Assim, percebeu que o
critério de pesar a vela poderia ser de grande utilidade.
Com balança de alta precisão, pôde realizar diversos experimentos
de medidas de peso e obteve a seguinte tabela:
Tabela 12.1: Resultados do peso do sistema vela + ar + campânula antes e após a
queima da vela.
Peso antes da queima
Peso depois da queima
CONJUNTO
X
X
VELA + AR*
Y
< Y (perde peso)
CAMPÂNULA
W
> W (ganha peso)
* ar antes = deflogisticado; ar depois = flogisticado
Pense
sobre isso!
Que fenômeno deve estar ocorrendo?
A partir desse resultado, Lavoisier formula a seguinte reação:
matéria orgânica + ar respirável
CO2 + água + calor
Lavoisier, dessa forma, postula que “Na natureza nada se cria, nada
se perde, tudo se transforma” ou “a energia não pode ser criada nem
destruída, a vida se mantém graças à transformação de energia”.
Posteriormente, esta idéia é firmada cientificamente como a Teoria
da Conservação das Massas.
Nessa época, Lavoisier trabalha com seu aplicado aluno La Place.
Nos meses que se seguiram, ambos dedicaram-se a comprovar a idéia
de que a combustão da vela e a respiração eram na realidade o mesmo
fenômeno.
Pense
sobre isso!
Considerando a reação descrita acima, que componente faltava ser
verificado para que Lavoisier e La Place resolvessem esse problema?
CEDERJ 13
AULA
Pense
sobre isso!
BIOQUÍMICA II | Respiração celular
Após diversas tentativas de observar o calor na forma de luz nos
órgãos respiratórios de camundongos e moribundos, Lavoisier percebe
que o calor liberado pela respiração não poderia ser medido com os
aparelhos que possuía, e resolve construir o equipamento abaixo:
1
2
3
a
b
Figura 12.6: Calorímetro de Lavoisier e La Place. O aparelho apresenta três câmaras: a mais interna (1) é a câmara que abriga a vela ou a cobaia; a do meio (2) é
preenchida por gelo e contém uma saída (a) por onde escoa o gelo derretido pelo
calor liberado pela queima ou pela respiração; a câmara mais externa (3), também
é preenchida por gelo e apresenta uma saída (b) para escoar o gelo derretido.
Este é o calorímetro de gelo de Lavoisier e La Place (Figura 12.6);
aparelho utilizado para obter medidas quantitativas do calor produzido
durante a queima de uma vela e da respiração de uma cobaia (geralmente
utilizavam porquinho-da-índia).
Após realizar diversos experimentos com tempos de queima e de
respiração fixos, os cientistas obtiveram o seguinte resultado (Tabela 12.2):
Tabela 12.2: Relação entre produção de CO2 e peso derretido após a queima de
matéria orgânica e a respiração de uma cobaia.
14 CEDERJ
Produção de CO2
Gelo derretido
Gelo/ CO2
Matéria orgânica
112,35g
2998g
26,69g
Cobaia
11,87g
330,30g
27,80g
em relação à combustão e à respiração?
12 MÓDULO 4
Pense
sobre isso!
AULA
Esses resultados foram capazes de esclarecer a dúvida que restava
Descreva sua opinião sobre os dois fenômenos, baseada nos
resultados mostrados até aqui.
Esta aula foi baseada no material organizado pelo Departamento de Bioquímica Médica, CCS, UFRJ.
RESUMO
Nesta aula você acompanhou como Lavoisier chegou à equação geral da respiração
celular, aceita até hoje (matéria orgânica + ar respirável
CO2 + água + calor).
INFORMAÇÕES SOBRE A PRÓXIMA AULA
Na próxima aula, nós continuamos a história. Falaremos mais especificamente
do ciclo do ácido cítrico e como ele foi sendo elucidado. Com as informações
apresentadas na Aula 13, você mesmo construirá o ciclo, antes de ser apresentado
a ele, o que ocorrerá na Aula 14. Foi o que Krebs fez e, por isso, o ciclo do ácido
cítrico é chamado ciclo de Krebs. Então, vamos lá...
CEDERJ 15
AULA
Ciclo de Krebs - Parte 1
13
BIOQUÍMICA II | Ciclo de Krebs - Parte 1
INTRODUÇÃO
Como vimos na aula anterior, o resultado da genialidade de Lavoisier, somada
ao trabalho de Laplace e Priestley, resultou na seguinte equação geral da
respiração celular:
Matéria orgânica + O2
CO2 + H2O + ENERGIA
Mas a história não parou por aí. A partir de agora você conhecerá outros
personagens da história da Bioquímica. Eles contribuíram para a descoberta
dos passos da respiração celular.
A HISTÓRIA DO CICLO DO ÁCIDO CÍTRICO
Comecemos com O TTO W ARBURG , um eminente bioquímico
alemão durante a primeira metade do século XX. Filho de militar da
mais alta patente do exército, era possuidor de uma disciplina rígida e
personalidade forte. Alguns relatos contam que, para dar continuidade
a seus experimentos no período recessivo da Primeira Grande Guerra,
dividia boa parte de seus ganhos com a alimentação de suas cobaias.
Estava interessado em entender as etapas da equação de Lavoisier,
OTTO HEINRICH
WARBURG
Prêmio Nobel de
Fisiologia e Medicina
em 1931, por suas
descobertas a respeito
da natureza e do
modo de ação das
enzimas respiratórias.
em diferentes tecidos. Para esta finalidade, desenvolveu, por volta de
1918, um método manométrico (baseado em medidas de pressão) para
medir o consumo de oxigênio e a produção de CO2. Este aparelho foi,
mais tarde, batizado de respirômetro de Warburg, em sua homenagem
(Figura 13.1).
O respirômetro de Warburg teve ampla aplicação na Bioquímica e,
ainda hoje, é utilizado na determinação de CO2 produzido por diferentes
preparações biológicas.
Em 1935, Albert Szent-Györgyi, um pesquisador húngaro,
começou a publicar uma série de importantes trabalhos sobre a
respiração de suspensões de músculo de peito de pombo. Sendo um
músculo muito solicitado no vôo, ele requer muita energia e possui uma
capacidade oxidante excepcionalmente alta. Szent-Györgyi estudou, em
particular, o comportamento metabólico dos ácidos dicarboxílicos C4
(ácidos com quatro carbonos que possuem dois grupos carboxílicos). Ele
também estava interessado em estabelecer a conexão entre fermentação
e oxidação, como fica claro na seguinte passagem:
18 CEDERJ
13 MÓDULO 4
AULA
OXIDAÇÃO E FERMENTAÇÃO
Tomemos como exemplo a fermentação láctica em células
musculares. Neste processo, a molécula de hexose é fragmentada
em duas moléculas de ácido láctico. Juntas, estas duas moléculas
ALBERT SZENTGYÖRGYI
Nasceu em Budapeste.
Em 1937 recebeu
o Prêmio Nobel
em Fisiologia e
Medicina por suas
descobertas na área
dos processos de
combustão biológica,
particularmente com
respeito à vitamina C e
ao ácido fumárico. Ele
não é uma gracinha? É
o meu favorito.
de ácido láctico contêm menos energia que a molécula de hexose
original. Esta pequena diferença de energia é o ganho da célula.
Alternativamente a molécula de hexose pode ser submetida
à combustão, gerando CO2 e H2O. No último caso, grande
quantidade de energia livre é desperdiçada.
A fermentação é o mais simples dos dois processos. Ao mesmo
tempo ele é pouco econômico, pois a maior parte da energia da
molécula de hexose permanece nas moléculas de ácido láctico.
Por volta de 30 vezes mais energia é liberada por oxidação.
Conseqüentemente, a fermentação pode manter somente as formas
de vida mais simples. Nesse ponto, pode existir uma pequena dúvida
de que a fermentação não é somente o mais simples, mas também
o processo mais antigo, precedendo a oxidação na história da vida.
O desenvolvimento de formas de vida mais complexas tornou-se
possível somente depois que a oxidação pelo oxigênio molecular foi
“inventada” pela natureza. Esta seqüência de eventos se reflete em
nossas células, nas quais nós encontramos oxidação e fermentação
intimamente misturadas e entrelaçadas em um sistema produtor
de energia.
A íntima relação entre os dois processos tem ocupado muitos
bioquímicos, como Pasteur, a descobrir suas interdependências
quantitativas, agora conhecidas como “Reação de Pasteur”. Pasteur
descobriu que existe algum tipo de equilíbrio entre oxidação e
fermentação. Se a oxidação é suprimida por remoção do oxigênio,
a fermentação se inicia. Se nós promovemos outra vez a oxidação,
a fermentação cessa. O mecanismo desta relação tem sido um dos
mais atraentes quebra-cabeças da Bioquímica desde então.
ALBERT VON SZENT-GYÖRGYI, Ph. D., M.D.
Professor de Química Orgânica e Biológica,
Universidade de Szeged, Hungria.
CEDERJ 19
BIOQUÍMICA II | Ciclo de Krebs - Parte 1
HANS ADOLF KREBS, um bioquímico alemão, testou os mesmos ácidos
orgânicos que Szent-Györgyi (ácidos dicarboxílicos C4) em fatias de
córtex de rim e obteve o seguinte resultado (veja a Tabela 13.1):
Tabela 13.1: Oxidação e formação de bicarbonato a partir de ácidos orgânicos em
lâminas de rins de porquinho-da-índia.
Substrato adicionado
SIR HANS ADOLF
KREBS
Nasceu em
Hildesheim,
Alemanha. Prêmio
Nobel de Fisiologia e
Medicina em 1953.
Consumo de O2
(µmols/g de peso seco)
Bicarbonato formado
(µmols/g de peso seco)
Sem adição
670
0
Acetato
1340
393
Succinato
1520
555
Fumarato
1290
705
Malato
1340
756
Piruvato
1070
318
Note que Krebs usou o respirômetro de Warburg e mediu tanto o
consumo de O2, pela diminuição da pressão e conseqüente deslocamento
da coluna do respirômetro, quanto a formação de CO2, pela medida da
!
O que sugere este
experimento?
quantidade de bicarbonato formada no poço central do respirômetro.
Desta forma, Krebs mostrou que qualquer um dos substratos utilizados
aumentava a taxa de respiração em relação ao controle (sem adição do
substrato). Como nos músculos de pombo de Szent-Györgyi, Krebs viu
que o rim também era capaz de respirar, utilizando como substratos
ácidos dicarboxílicos de quatro carbonos (succinato, fumarato e malato),
além de acetato (dois carbonos) e piruvato (três carbonos).
Enquanto isso, no laboratório de Warburg, após um acidente
experimental com um de seus respirômetros, os tecidos de músculo foram
carbonizados e, por descuido do seu técnico, o mesmo respirômetro foi
utilizado em um outro experimento. Qual não foi a surpresa de Otto
Warburg, quando constatou um grande aumento na respiração do tecido.
Análises do material contido nas paredes do respirômetro mostraram
altos níveis de um composto orgânico associado ao ferro. Warburg
prosseguiu seus estudos com a intenção de identificar este fator, que
chamou “Atmungsferment” (enzima), pois, uma vez inativado, todo o
processo de respiração cessava.
20 CEDERJ
13 MÓDULO 4
Keilin, em 1925, que redescobriu uma substância que ele denominou
cytochrome (CITOCROMO). Esta substância, como o Atmungsferment,
CITOCROMOS
estava intimamente ligada aos processos oxidativos. Segundo Keilin, o
Os citocromos foram
primeiro descritos
como mio-hematina
e histo-hematina
por MacMunn. Essa
história você verá
com mais detalhes na
Aula 15.
citocromo era diretamente oxidado na sua forma divalente para a forma
trivalente (férrica). Os dois sistemas, Atmungsferment e Cytochrome,
foram denominados sistemas W.K. (sistema Warburg-Keilin).
Szent-Györgyi sabia do envolvimento do O2 nos processos
oxidativos e ficou intrigado com o fato de que a oxidação do succinato
era especialmente bloqueada por um ácido dicarboxílico (C3), o ácido
malônico. Resolveu, então, investigar o que aconteceria com a respiração
em duas situações: 1) ao bloquear a oxidação do succinato; 2) ao incluir
pequenas quantidades de fumarato, normalmente presente no tecido.
Assim Szent-Györgyi descreveu seus resultados:
“Os resultados foram surpreendentes. Pequenas quantidades de
malonato envenenam a respiração quase como o cianeto. Ácido
fumárico estimula fortemente a respiração. A respiração rapidamente
declinante dos tecidos in vitro pode ser mantida constante por
longos períodos pelo ácido fumárico. Como Baumann & Stare têm
mostrado no Laboratório de Keilin, igualmente alguns poucos γ de
fumarato (γ = uma milionésima parte do grama) foram ativos.
Foram consumidos vários anos de trabalho pesado para ajustar as
observações contraditórias em uma teoria. A teoria é esta: os ácidos
dicarboxílicos C4 são uma ligação na cadeia respiratória entre o
alimento e o sistema W.K. Sua função é transferir o hidrogênio
do alimento ao citocromo e reduzir por este hidrogênio seu ferro
trivalente à forma divalente. Falando mais precisamente, o citocromo
oxida dois átomos de hidrogênio da molécula de ácido succínico.
Pela perda de dois átomos de hidrogênio, o ácido succínico é
convertido a ácido fumárico. Estes dois átomos de H perdidos são
recolocados novamente por hidrogênios oriundos do alimento. O
alimento, entretanto, não cede seus dois hidrogênios imediatamente
ao ácido fumárico. Ele cede seus 2 átomos de hidrogênio para o
ácido oxaloacético, que é também um ácido dicarboxílico (C4). Por
tomar 2H, o ácido oxaloacético volta a ácido málico. Ácido málico,
então, cede seus dois hidrogênios ao ácido fumárico, e, assim, o
ácido fumárico é convertido a ácido succínico. Este pode ser outra
vez oxidado por citocromo, enquanto o ácido málico, após ceder
seus 2Hs, torna-se ácido oxaloacético, que pode tomar hidrogênio
do alimento novamente, e assim o jogo recomeça, hidrogênios
sendo transmitidos todo o tempo do alimento via oxaloacético
– málico – fumárico – succínico ao sistema W.K.”
CEDERJ 21
AULA
A próxima etapa desse quebra-cabeça foi resolvida por David
BIOQUÍMICA II | Ciclo de Krebs - Parte 1
O resumo esquemático da história está a seguir:
Fermentação
Ácido láctico
C
O
HCOH
Esquema 13.1: Esse esquema geral você já conhece.
Respiração
Esquema 13.2
!
Levando em conta o esquema proposto por Szent-Györgyi, que transformações você verifica em cada
etapa desta seqüência de reações?
Qual o papel das trioses nos processos fermentativos e oxidativos propostos por Szent-Györgyi?
O que ocorreria nesta seqüência de reações na presença e na ausência de O2?
22 CEDERJ
13 MÓDULO 4
AULA
Chegamos então ao primeiro esquema que tentava explicar como
ocorre a respiração celular (ver Esquema 13.2). O próximo passo foi a
observação de que a adição de pequenas quantidades de ácidos orgânicos
ativava tremendamente essa via. Este efeito, chamado efeito catalítico, já
havia sido observado por Krebs durante a descoberta do ciclo da uréia
(que você conhecerá na Aula 18).
A respeito da oxidação dos ácidos orgânicos e o efeito catalítico
do ácido succínico, Krebs escreveu:
Szent-Györgyi reportou experimentos em 1935 e 1936 que sugeriam
que o ácido succínico e seus derivados ácido fumárico, ácido málico
e ácido oxaloacético cataliticamente promovem oxidação em
tecidos musculares. Provas conclusivas deste efeito catalítico foram
apresentadas por Stare & Baumann em dezembro de 1936. Estes
autores mostraram que pequenas quantidades destas substâncias
eram suficientes para provocar um aumento na respiração e que o
aumento é um múltiplo da quantidade de oxigênio necessária para
a oxidação das substâncias adicionadas. Além disso, a substância
adicionada não foi usada, mas pode ser subseqüentemente
detectada no meio. Assim, não permanece nenhuma dúvida de
que o ácido succínico e substâncias relacionadas podem atuar como
catalisadores na respiração.
Fonte: KREBS H. A.; CAMBRIDGE, M. A.; HAMBURG M. D.
The intermediate metabolism of carbohidrates.
!
De acordo com esta passagem, tal efeito catalítico exercido pelos ácidos orgânicos C4 pode ser explicado
com a seqüência de reações proposta por Szent-Györgyi?
A seqüência de reações de Szent-Györgyi explica convenientemente a equação de Lavoisier?
EFEITO CATALÍTICO DO ÁCIDO CÍTRICO
O passo seguinte foi a descoberta de que o ácido cítrico também
atua como ativador catalítico (Krebs e Johnson, 1937). Adicionado ao
músculo em pequenas quantidades, ele acelera a oxidação de carboidratos
da mesma maneira que o ácido succínico. A análise experimental deste
efeito revelou não somente o mecanismo da ação catalítica do ácido
cítrico, mas também do ácido succínico e compostos relacionados. Em
adição, isto levou à elucidação dos principais passos na degradação
oxidativa de carboidratos.
CEDERJ 23
BIOQUÍMICA II | Ciclo de Krebs - Parte 1
O DESTINO DO ÁCIDO CÍTRICO
O ácido cítrico, por longo tempo, foi conhecido como sendo
facilmente oxidável em tecidos vivos, embora os detalhes de seu
metabolismo intermediário tenham permanecido obscuros até março de
1937, quando Martius e Knoop descobriram que o ácido α-cetoglutárico
é um produto da oxidação do ácido cítrico.
O destino do ácido no corpo já era bem conhecido. Esta substância
tinha grande interesse fisiológico, já que apareceu como um intermediário
na degradação de ácido glutâmico, de prolina e de histidina. Já se sabia
que ele forma, na oxidação, ácido succínico e dióxido de carbono.
24 CEDERJ
é possível passar do ácido cítrico ao ácido succínico, e esta reação pode
ÁCIDO
MALÔNICO
Ou malonato é um
inibidor da respiração
celular, no passo
de formação do
succinato no ciclo do
ácido cítrico.
ser diretamente demonstrada se ácido malônico é adicionado. ÁCIDO
MALÔNICO
inibe especificamente a oxidação do ácido succínico, mas não
inibe a degradação do ácido cítrico e ácido α-cetoglutárico.
!
Qual a relação entre tais reações e a seqüência
de reações de Szent-Györgyi?
Krebs sabia que a síntese de ácido cítrico, a partir de ácido
oxaloacético, era conduzida pela condensação com uma segunda
substância, cuja natureza química não era ainda conhecida. Supunha-se
que a segunda substância fosse derivada de um carboidrato e apostava-se
que seria o ácido pirúvico. A condensação desta segunda substância com
o acido oxaloacético para formar ácido cítrico foi formulada da seguinte
maneira por Krebs (veja reação a seguir):
3
PS. A nomenclatura das moléculas apresentadas é aquela utilizada nos trabalhos da época.
CEDERJ 25
13 MÓDULO 4
AULA
Considerando a junção das duas reações imediatamente anteriores,
BIOQUÍMICA II | Ciclo de Krebs - Parte 1
“Este esquema, ainda que suportado por evidência experimental,
é, em parte, hipotético e, por esta razão, vamos abster-nos da
discussão de detalhes; mas deve ser enfatizado que o efeito final,
que é a síntese de ácido cítrico na presença de ácido oxaloacético,
é um fato experimental.
Martius e Knoop
!
Baseado nos resultados mostrados acima e nas
citações, proponha um esquema de reações que
explique o efeito catalítico do ácido cítrico e
do α-cetoglutarato, integrando as trioses nesta
seqüência.
A SUBSEQÜENTE ELABORAÇÃO DO CICLO DOS ÁCIDOS
TRICARBOXÍLICOS
O esquema básico de 1937 tem resistido ao teste do tempo.
Existem evidentemente grandes vazios em relação ao mecanismo da
formação do citrato a partir de oxaloacetato e piruvato.
Citado em H. Krebs (1970) The history of the tricarboxylic acid
cycle. Perspect. Biol. Med. 14: 151-170
A solução deste problema esperou pela descoberta da coenzima A
(CoA) por Lipmann, na década de 1940. No mesmo período, Ochoa e
Lynem mostraram que a acetil- coenzima A (acetil-CoA) é o intermediário
que reage com o oxaloacetato para formar citrato.
26 CEDERJ
13 MÓDULO 4
Além disso, a coenzima A foi também encontrada como
AULA
participante na formação de succinato a partir de α-cetoglutarato,
formando succinil coenzima A (succinil-CoA) como intermediário.
!
Com base nessas informações, construa o seu esquema representando o ciclo
do ácido cítrico.
Se você acompanhou o texto e conseguiu construir seu ciclo
com base nas informações apresentadas, parabéns. Isso não é fácil. Se
você não conseguiu, consulte os tutores de Bioquímica e discuta suas
dificuldades com eles. Ao chegar ao final desta aula, você já conhece o
ciclo do ácido cítrico ou grande parte dele. Neste caso, a próxima aula
será apenas para detalhar o que você já sabe. Nela você verá cada reação,
o nome das enzimas, co-fatores e outros papéis metabólicos que o ciclo
apresenta. Não esqueça que os exercícios virão no final do módulo.
RESUMO
Nesta aula nós vimos a história do ciclo do ácido cítrico, seus principais personagens
e as etapas iniciais de elucidação dessa via. A evolução do conceito de Lavoisier
até chegar aos principais intermediários e reações do ciclo.
CEDERJ 27
objetivos
Ao final desta aula, você deverá ser capaz de:
• Conhecer a origem da molécula de acetato,
na forma de acetil-CoA, a qual inicia o Ciclo
de Krebs.
• Aprender a importância das vitaminas
hidrossolúveis como formadoras de
coenzimas, importantes para a atividade de
complexos multienzimáticos.
• Conhecer as reações do Ciclo de Krebs.
• Caracterizar as enzimas envolvidas nessas
reações.
• Identificar as etapas de conservação da
energia gerada durante as reações do Ciclo
de Krebs.
• Conhecer as vias de reposição de
componentes do ciclo.
AULA
Ciclo de Krebs - Parte 2
14
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
INTRODUÇÃO
Como você viu na Aula 12 o ciclo do ácido cítrico foi descoberto por Hans
Krebs e, portanto, é também denominado de Ciclo de Krebs.
Você viu nas Aulas 9 e 10 que algumas células obtêm energia por processos
fermentativos em que a molécula de glicose é quebrada na ausência de
oxigênio. Para a maioria das células eucarióticas e para algumas bactérias, sob
condições aeróbicas, seus combustíveis orgânicos são transformados em CO2
mais água, sendo a glicólise o primeiro estágio da degradação completa da
glicose. Após esse estágio, você viu que a molécula de piruvato poderia seguir
diversos caminhos metabólicos; entre eles, podia ser convertida em etanol e em
lactato, se a célula estivesse na ausência de oxigênio. No entanto, a molécula
de piruvato pode também ser convertida a acetil-CoA. Na realidade, o grupo
acetil, na forma de acetil-CoA, é um intermediário comum ao metabolismo de
quase todos os compostos biológicos. Ele pode ser formado a partir de glicídios,
lipídeos e proteínas (veja a Figura 14.1).
Figura 14.1: Esquema de formação de acetil-CoA.
Lembre-se de que o metabolismo pode ser dividido em três estágios. Você
verá que o Ciclo de Krebs é um desses estágios. Não se preocupe ainda com
os nomes das moléculas que aparecerão no estágio 2 (Figura 14.2), ou seja,
no Ciclo de Krebs, pois é sobre isso que falaremos nesta aula. O estágio 3 será
estudado nas Aulas 15 e 16.
30 CEDERJ
14 MÓDULO 4
AULA
graxos
Figura 14.2: Estágios do metabolismo.
CEDERJ 31
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
A oxidação de grupos acetila é um dos principais processos metabólicos, e mais
de dois terços dos ATPs utilizados pelas células são produzidos como resultado
da transferência de elétrons de grupos acetila para o oxigênio molecular na
mitocôndria.
Durante o metabolismo, os grupos acetila são ligados como tioéster à coenzima
A, um tiol que tem como função transportar grupos acetil dentro da célula.
Qualquer que seja a fonte, grande parte da molécula de acetil é convertida
em CO2 mais água, mas qualquer excesso pode ser utilizado para a síntese de
ácidos graxos, corpos cetônicos e colesterol.
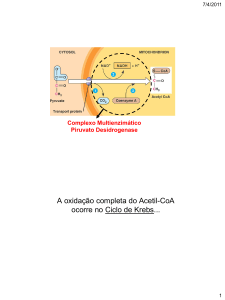
A oxidação completa de acetil-CoA para CO2 e água ocorre em uma série de
reações conhecidas como ciclo do ácido cítrico, ciclo do ácido tricarboxílico ou
Ciclo de Krebs. É sobre essas transformações que falaremos nesta aula, que
começa com a conversão da molécula de piruvato em acetil-CoA e pela entrada
dos grupos acetil no Ciclo de Krebs. Nós então analisaremos as reações do Ciclo
de Krebs e as enzimas que as catalisam. Como alguns desses intermediários
podem também ser usados por outras vias, nós falaremos de algumas vias de
reposição desses intermediários.
PRODUÇÃO DE ACETATO – FORMAÇÃO DA MOLÉCULA DE
ACETIL-COA
Em organismos aeróbicos, glicose e outros açúcares, ácidos
graxos e muitos aminoácidos são oxidados em CO2 e água via ciclo do
ácido cítrico e cadeia respiratória. Antes de entrar no Ciclo de Krebs
os esqueletos dessas moléculas são degradados aos grupos de acetil da
molécula de acetil-CoA, a forma por que o ciclo aceita a maioria do seu
combustível.
Os aminoácidos podem entrar no Ciclo de Krebs através de outros
intermediários do Krebs, como veremos mais adiante.
A estrutura da coenzima A e o processo de formação da
molécula de acetil-CoA são mostrados na Figura 14.3. Essa coenzima
complexa é abreviada como CoA ou CoASH. Ela é composta por βmercaptoetanolamina, pela vitamina ácido pantotênico, pela adenosina
difosfato (ADP). A coenzima A existe na forma reduzida (CoASH) e atua
como transportadora de grupos acil.
32 CEDERJ
14 MÓDULO 4
AULA
β- Mercaptoe
tanolamina
Coenzima A (CoA ou CoASH)
Figura 14.3: Estrutura da coenzima e formação da molécula de acetil-CoA.
Nós vamos inicialmente enfocar nossa atenção na molécula de
piruvato, derivado de glicose e de outros açúcares. Ela é oxidada em acetilCoA pelo complexo enzimático piruvato desidrogenase. Esse complexo
enzimático está localizado exclusivamente na matriz mitocondrial. Está
presente em altas concentrações em tecidos como o músculo cardíaco e
os rins. Nas condições fisiológicas o ΔGo é muito negativo e portanto a
reação é irreversível.
A reação catalisada pelo complexo piruvato desidrogenase é
esquematizada abaixo.
Piruvato + NAD + CoASH
piruvato desidrogenase
Acetil-CoA + CO2 + NADH + H +
(ΔGo= - 8kcal\mol)
Esta reação é uma descarboxilação oxidativa, um processo
irreversível no qual o grupo carboxila é removido do piruvato como
uma molécula de CO2 e os dois carbonos, remanescentes formam o
grupo acetil da molécula de acetil-CoA.
Como vimos, nessa reação ocorre a formação de uma molécula de
NADH. Os elétrons transportados por essa molécula serão transferidos
para o oxigênio na cadeia transportadora de elétrons, levando à formação
de ATP. Esse assunto você estudará nas Aulas 14 e 15.
A desidrogenação combinada com a descarboxilação da molécula
de piruvato em acetil-CoA requer a ação seqüencial de três enzimas e
cinco coenzimas diferentes ou grupos prostéticos, que são: 1) tiamina
pirofosfato (TPP); 2) flavino adenino dinucleotídeo (FAD); 3) coenzima
A (CoA); 4) nicotinamida adenina dinucleotídeo (NAD); 5) ácido lipóico.
Veja a Figura 14.4.
CEDERJ 33
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Quatro vitaminas hidrossolúveis diferentes são necessárias na
nutrição humana e são componentes vitais neste sistema. Essas vitaminas
são: 1) tiamina na TPP; 2) riboflavina no FAD; 3) niacina no NAD; 4)
pantotenato na CoA.
NAD e FAD são transportadoras de hidrogênios, a tiamina tem um
papel importante na clivagem de ligações adjacentes a grupos carbonila.
A coenzima A contém pantotenato, que possui um grupamento tiol
reativo. Esse grupamento é crítico na formação de um tioéster com
grupamentos acila. É através dessa associação que os grupamentos
acila são transportados. A energia de hidrólise da ligação tioéster é
relativamente alta, permitindo a doação de grupamentos acila para
diversos compostos. Assim, podemos dizer que a molécula de coenzima
A associada com grupamentos acila atua como uma molécula ativada
para transferência desses grupos.
O quinto co-fator da piruvato desidrogenase, o lipoato, possui
dois grupos tióis (SH) que são importantes na oxidação reversível de uma
ponte de enxofre, semelhante àquelas das cisteínas em proteínas.
Assim, o complexo piruvato desidrogenase contém três enzimas, a
piruvato desidrogenase (E1), a diidrolipoil transacetilase (E2) a diidrolipoil
desidrogenase (E3). Cada uma delas está presente em múltiplas cópias.
A Figura 14.5 mostra esquematicamente como o complexo piruvato
desidrogenase conduz as cinco reações consecutivas na descarboxilação
e desidrogenação da molécula de piruvato. Na etapa 1 o piruvato é
descarboxilado e, na forma de aldeído, é ligado ao grupamento hidroxila
da tiamina. Na etapa 2 o grupamento aldeído é oxidado em acetato. Os
dois elétrons removidos nessa oxidação reduzem o grupamento –S–S– de
um grupo lipoil na enzima E2 a dois grupamentos tióis (-SH). O acetato
produzido nessa reação de óxido-redução é esterificado em um grupo SH
do lipoil e então transesterificado em coenzima A para formar o acetilCoA (etapa 3). A energia de oxidação leva à formação de um tioéster
de alta energia do acetato. As reações remanescentes catalisadas pelo
complexo piruvato desidrogenase (etapas 4 e 5) são de transferências de
elétrons necessárias para regenerar a forma oxidada do grupo lipoil da
enzima E2 e assim preparar a enzima do complexo para um novo ciclo
de oxidação. Os elétrons removidos do grupo hidóxil-etil derivado do
piruvato passa através do FAD para o NADH.
34 CEDERJ
14 MÓDULO 4
AULA
Acetaldeído
ativado
Figura 14.4: Co-fatores do complexo piruvato desidrogenase.
CEDERJ 35
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Figura 14.5: Representação do complexo piruvato desidrogenase e das etapas de descarboxilação da molécula
de piruvato.
36 CEDERJ
14 MÓDULO 4
AULA
AS REAÇÕES DO CICLO DE KREBS
Para começar a primeira volta do ciclo, a molécula de acetilCoA doa seu grupo acetil para um composto de quatro carbonos, o
oxaloacetato, para formar a molécula de citrato com seis carbonos.
Citrato é então transformado em isocitrato, uma molécula também com
seis carbonos. Essa molécula é desidrogenada, com perda de CO2 para
produzir um composto com cinco carbonos, o α-cetoglutarato. Essa
molécula perde CO2, produzindo um composto com quatro carbonos,
chamado succinato. O succinato é então convertido enzimaticamente, em
três etapas, regenerando a molécula de oxaloacetato, a qual está pronta
para reagir novamente com outra molécula de acetil-CoA. Como você
pôde ver, duas moléculas de CO2 foram formadas e serão eliminadas.
Uma molécula de oxaloacetato foi utilizada, mas foi regenerada ao final
do processo. Assim, em teoria, uma molécula de oxaloacetato poderia
ser utilizada infinitamente no ciclo; de fato, oxaloacetato está presente
nas células em baixíssimas concentrações. Quatro das oito etapas desse
ciclo são oxidações nas quais a energia de oxidação é conservada na
forma das coenzimas reduzidas NADH e FADH2. Um resumo dessas
etapas é apresentado na Figura 14.6.
succinil-CoA
Figura 14.6: Etapas do
Ciclo de Krebs.
CEDERJ 37
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Embora o Ciclo de Krebs possua um papel fundamental nas vias
metabólicas produtoras de energia, alguns intermediários com quatro
e cinco carbonos podem ser utilizados como precursores de outras
moléculas. Para repor compostos do ciclo, as células empregam reações
anapleróticas (reposição) que serão apresentadas no final desta aula.
Agora, nós vamos examinar cada uma das oito etapas do ciclo com
maior detalhe, dando ênfase às transformações químicas, observando as
etapas de oxidação com formação de CO2 e de coenzimas reduzidas.
Etapa 1 – Formação do citrato
A primeira etapa ou reação do ciclo é a condensação do acetil-CoA
com oxaloacetato para formar citrato, catalisada pela citrato sintase.
Nesta reação, o grupamento metil (CH3) do grupo acetil é ligado ao grupo
carbonila do oxaloacetato, formando um intermediário instável, o citroil
CoA, que permanece ligado ao sítio ativo da enzima. Esse intermediário
é rapidamente hidrolisado, liberando a coenzima A e uma molécula de
citrato. A hidrólise desse tioéster de alta energia torna a reação altamente
exergônica. A grande variação de energia livre nesta reação é essencial
para o funcionamento do ciclo, pois, como vimos anteriormente, a
concentração de oxaloacetato é muito baixa. A coenzima A liberada
nessa etapa é reciclada para participar de outra reação de descarboxilação
oxidativa de uma molécula de piruvato. Veja a Figura 14.7:
Figura 14.7: Primeira etapa do Ciclo Reação de formação do citrato.
Etapa 2 – Formação do isocitrato via cis-aconitato
O citrato contém um álcool terciário que é muito difícil de ser
oxidado, por isso essa molécula é convertida no seu isômero, isocitrato,
pela enzima aconitase. Essa enzima catalisa a transformação reversível
do citrato em isocitrato, que é mais fácil de ser oxidado.
38 CEDERJ
14 MÓDULO 4
AULA
A reação envolve sucessiva desidratação e hidratação, através da
formação de um intermediário, o cis-aconitato, que normalmente não
se dissocia do sítio ativo da enzima.
Essa reação é impulsionada no sentido de formação do isocitrato,
pois essa molécula é constantemente consumida na etapa seguinte do
ciclo. Veja Figura 14.8.
Figura 14.8: Reação de formação do isocitrato.
Etapa 3 – Oxidação do isocitrato a α-cetoglutarato e CO2
Nesta etapa, a isocitrato desidrogenase catalisa a descarboxilação
oxidativa do isocitrato para formar α-cetoglutarato. Existem duas
diferenças entre a piruvato desidrogenase e a isocitrato desidrogenase:
a primeira requer NAD como aceptor de elétrons e a segunda pode
utilizar tanto NAD como NADP; a piruvato desidrogenase, dependente
de NAD, ocorre somente na matriz mitocondrial, enquanto a isocitrato
desidrogenase ocorre na matriz e no citosol. Na matriz ela atende ao
Ciclo de Krebs e no citosol ela é importante para regenerar a molécula
de NADPH, que é essencial para as reações redutivas anabólicas. Veja
a Figura 14.9.
Figura 14.9: Reação de formação do α-cetoglutarato.
CEDERJ 39
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Etapa 4 – Oxidação do α-cetoglutarato a succinil-CoA e CO2
Nesta etapa, ocorre uma outra descarboxilação oxidativa, na
qual o α-cetoglutarato é convertido em succnil CoA e CO2, pela ação
do complexo α-cetoglutarato desidrogenase. Nessa reação o NAD serve
como aceptor de elétrons e a coenzima A como um carreador do grupo
succinil. A energia de oxidação do α-cetoglutarato é conservada na
formação do tioéster da molécula de succinil-CoA.
Essa reação é semelhante à reação catalisada pelo complexo
piruvato desidrogenase, tanto na estrutura quanto na função. Ele inclui
enzimas e coenzimas homólogas às do complexo piruvato desidrogenase
(Figura 14.10).
Figura 14.10: Reação de formação do succinil-CoA.
Etapa 5 – Conversão do succnil-CoA a succinato – fosforilação
em nível de substrato
A molécula de succinil-CoA tem uma ligação tioéster semelhante à
da molécula de acetil-CoA, ou seja, uma ligação com uma forte energia
livre padrão de hidrólise (ΔGo = -36kJ/mol) . A energia liberada na quebra
desta ligação é utilizada para a síntese de uma ligação fosfoanidrido de
uma molécula de ATP ou de GTP (guanosino trifosfato), liberando ainda
2,9 kJ/mol. O succinato é formado nesse processo. A enzima que catalisa
essa reação é a succinil CoA sintetase.
A formação de ATP ou de GTP à custa da energia liberada na
descarboxilação oxidativa do α-cetoglutarato é uma fosforilação em
nível de substrato, semelhante às reações de síntese de ATP que você viu
na via glicolítica. O GTP formado nessa reação perde seu grupamento
fosforil terminal para uma molécula de ADP, formando uma molécula
de ATP. Veja as Figuras 14.11 e 14.12.
40 CEDERJ
14 MÓDULO 4
AULA
Figura 14.11: Reação de formação do succinato.
Succinato
Figura 14.12: Esquema representativo da reação onde ocorre a fosforilação em
nível de substrato.
CEDERJ 41
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Etapa 6 – Oxidação do succinato a fumarato – desidrogenação
flavino-dependente
O succinato é oxidado em fumarato pela flavoproteína succinato
desidrogenase (Figura 14.13). Em eucarióticos, a succinato desidrogenase
está fortemente associada à membrana interna mitocondrial. Em
procarióticos, está associada à membrana plasmática. Ela é a única enzima
do Ciclo de Krebs associada à membrana. Ela possui uma flavino adenino
dinucleotídeo (FAD) ligada covalentemente. A estrutura dessa coenzima
nos estados reduzido e oxidado é apresentada na Figura 14.14.
Os elétrons passam do succinato através do FAD por centros ferroenxofre (Fe – S) antes de entrar na cadeia de transporte de elétrons. Você
verá o funcionamento da cadeia de transporte de elétrons e a formação
de ATPs decorrentes da fosforilação oxidativa nas próximas aulas.
Figura 14.13: Reação de formação do fumarato.
Figura 14.14: Estrutura da coenzima FAD reduzida e oxidada.
42 CEDERJ
14 MÓDULO 4
AULA
Etapa 7 – Hidratação do fumarato a malato
A hidratação do fumarato que resulta em malato é catalisada pela
enzima fumarase (Figura 14.15).
Figura 14.15: Reação de formação do malato.
Etapa 8 – Regeneração do oxaloacetato
Na última reação do ciclo, a enzima malato desidrogenase, ligada
ao NAD, catalisa a oxidação do malato em oxaloacetato.
O equilíbrio dessa reação fica muito longe das condições de
equilíbrio termodinâmico, mas como nas células intactas o oxaloacetato
é constantemente removido, pela reação seguinte, catalisada pela citrato
sintase e altamente exergônica (etapa 1), as concentrações de oxaloacetato
permanecem muito baixas, impulsionando a reação catalisada pela
malato desidrogenase no sentido de formação do oxaloacetato. Veja a
Figura 14.16.
L-malato
oxaloacetato
Figura 14.16: Reação de formação do oxaloacetato.
CEDERJ 43
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
A energia de oxidação do ciclo é conservada de modo
muito eficiente
A Figura 14.17 apresenta as oito etapas do Ciclo de Krebs
ressaltando as estruturas dos compostos formados. Podemos verificar
que um grupo com dois carbonos, na forma de acetil-CoA, entra no ciclo
por combinação com o oxaloacetato. Os dois carbonos emergem do ciclo,
na forma de CO2, na descarboxilação do isocitrato e do α-cetoglutarato.
A energia liberada dessas descarboxilações foi conservada na redução de
três NAD+ e um FAD e na produção de um ATP ou GTP. No final do
ciclo uma molécula de oxaloacetato foi regenerada. Embora somente um
ATP tenha sido formado em nível de substrato, as coenzimas reduzidas,
três NADH e um FADH, fornecem um grande fluxo de elétrons na cadeia
de transporte de elétrons, formando um grande número de moléculas de
ATP durante a fosforilação oxidativa.
Um processo cíclico, com oito etapas, parece, à primeira vista,
ser uma via muito complexa para a oxidação de uma molécula de dois
carbonos em CO2. No entanto, o papel do ciclo do ácido cítrico não está
confinado à oxidação do acetato. Essa via desempenha um papel central
no metabolismo intermediário; seus produtos de quatro e cinco carbonos
em determinadas circunstâncias metabólicas servem como combustíveis
para outras vias. Podem, por outro lado, ser pontos de entrada de
intermediários formados em outras vias de degradação; por exemplo,
oxaloacetato e α-cetoglutarato são produzidos a partir do aspartato e do
glutamato, respectivamente, quando proteínas são degradadas.
O ciclo do ácido cítrico, como outras vias metabólicas, é
produto da evolução onde uma boa parte ocorreu antes do advento
dos organismos aeróbicos. Ele não representa o caminho mais curto do
acetato até CO2, mas é a via que confere maior vantagem seletiva. Alguns
seres anaeróbicos usaram algumas das reações dessa via em processos
biossintéticos; alguns microorganismos modernos ainda usam o Ciclo
de Krebs de modo incompleto não como fonte de energia, mas como
precursor biossintético. Tais microorganismos usam as três primeiras
reações do ciclo para produzirem α-cetoglutarato, mas não têm a enzima
α-cetoglutarato desidrogenase e, portanto, não dão prosseguimento ao
ciclo. Eles usam o composto formado para vias biossintéticas. Eles
possuem as enzimas que catalisam as etapas reversíveis de conversão de
oxaloacetato a succinil-CoA.
44 CEDERJ
14 MÓDULO 4
AULA
Condensação
acetil
succinil-CoA
Figura 14.17: Etapas do Ciclo de Krebs e estrutura dos componentes formados.
REAÇÕES ANAPLERÓTICAS
São reações para a reposição de intermediários do ciclo que são
removidos para vias biossintéticas.
Em mamíferos, a reação mais importante para reposição de
intermediários do Krebs é a reação catalisada pela piruvato carboxilase.
Ela ocorre no fígado e nos rins.
Em organismos aeróbicos, o ciclo do ácido cítrico é uma via
anfibólica, ou seja, serve tanto para processos catabólicos como para
processos anfibólicos. Além de seu papel no catabolismo oxidativo de
carboidratos, ácidos graxos e aminoácidos, o ciclo fornece precursores
para muitas vias biossintéticas. Como podemos observar na Figura 14.19,
α-cetoglutarato e oxaloacetato servem como precursores dos aminoácidos
glutamato e aspartato. Esses aminoácidos podem ser usados para síntese
de outros aminoácidos ou para síntese de bases nitrogenadas, purinas e
CEDERJ 45
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
pirimidinas. Oxaloacetato pode ser convertido a glicose, em processos
gliconeogênicos (formação de glicose) quando os níveis de glicose
estão abaixo daqueles considerados normais. Esse aspecto será mais
bem estudado nas últimas aulas desta disciplina. O succinil-CoA é o
intermediário central na síntese do anel porfirínico de grupos heme que
atuam como transportadores de oxigênio. Grupos heme fazem parte das
moléculas de hemoglobina, da mioglobina e de carreadores de elétrons,
como os citocromos.
Figura 14.18: Principais papéis biossintéticos do ciclo de Krebs.
46 CEDERJ
14 MÓDULO 4
AULA
Regulação do ciclo do ácido cítrico
A regulação das enzimas-chave em vias metabólicas, por
efetores alostéricos e por modulação covalente, assegura a produção de
intermediários e de produtos na velocidade requerida para manter a célula
em um estado estável, evitando a superprodução de um intermediário. O
fluxo de átomos de carbono do piruvato é finamente regulado em dois
níveis: em nível de formação do acetil-CoA e em nível de formação de
citrato. O ciclo é também regulado em nível das reações catalisadas pelas
enzimas isocitrato desidrogenase e da α-cetoglutarato desidrogenase.
Veja a Figura 14.20.
O complexo piruvato desidrogenase é modulado por dois tipos de
regulação. Primeiro, dois produtos da reação da piruvato desidrogenase,
acetil-CoA e NADH, inibem o complexo (Figura 14.21). Segundo, o
complexo piruvato desidrogenase existe de duas formas: 1) um ativo,
desfosforilado; 2) um inativo, fosforilado (Figura 14.21). A inativação
do complexo é feita por uma proteína quinase que está fortemente ligada
ao complexo. A reativação é catalisada por uma proteína fosfatase que
desfosforila o complexo (Figura 14.21).
Resumindo esse processo de regulação, podemos dizer que quando
a situação energética da célula é alta, ou seja, quando os níveis de ATP,
acetil-CoA e NADH são altos, os produtos de reação catalisados por esse
complexo enzimático, o complexo enzimático é inibido. O que também
ocorre quando os níveis de ácidos graxos estão aumentados. Essa inibição
ocorre porque ácidos graxos podem ser convertidos em acetil-CoA no
processo de β-oxidação que você irá estudar na Aula 22 desta disciplina.
Por outro lado, quando os níveis energéticos da célula estão baixos, ou
seja, quando os níveis de AMP (adenosina monofosfato), NAD+ e CoA
estão reduzidos, ocorre uma ativação alostérica do complexo piruvato
desidrogenase.
CEDERJ 47
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Figura 14.19: Principais fatores reguladores do ciclo do ácido cítrico.
48 CEDERJ
14 MÓDULO 4
AULA
Figura 14.20: Regulação do complexo piruvato desidrogenase por fosforilação e por desfosforilação.
CEDERJ 49
BIOQUÍMICA II | Ciclo de Krebs - Parte 2
Ciclo do glioxalato – uma variante anabólica do ciclo
Metabolicamente, células vegetais e microorganismos diferem em
muitos aspectos importantes. De interesse neste momento é que as células
vegetais e microorganismos não podem sintetizar carboidratos a partir de
gorduras. Essa conversão é crucial para o desenvolvimento das sementes,
pois estas apresentam reservas de triacilgliceróis. Quando as sementes
germinam, triacilgliceróis são quebrados para serem convertidos em
açúcares, para servir de fonte de energia para o crescimento da planta. As
plantas sintetizam açúcares usando o ciclo do glioxalato, o qual pode ser
considerado um variante anabólico do Ciclo de Krebs (Figura 14.21).
Figura 14.21: Ciclo do glioxalato.
50 CEDERJ
AULA
Metabolismo de
carboidratos I
15
BIOQUÍMICA II | Metabolismo de carboidratos I
RESPIRAÇÃO CELULAR
Agora, que você conhece o ciclo do ácido cítrico, sua história e o
conhecimento atual, vamos acompanhar um pouco da descoberta dos
citocromos e da cadeia transportadora de elétrons mitocondrial. Esta
etapa é fundamental para entender o processo completo da respiração
celular, uma forma mais eficiente de extração de energia utilizada pelos
organismos aeróbicos. É nesta etapa que os NADHs e os FADH2s
reduzidos no ciclo do ácido cítrico se reoxidam gerando energia para a
síntese de aproximadamente 30 moléculas de ATP.
O conhecimento de como isto acontece, veio aos poucos.
Acompanhe nesta aula os passos históricos fundamentais e, na
próxima, acompanhe o processo completo, tal como é entendido
hoje. Nesta aula, você irá encontrar questões que não tem uma
resposta correta, que pode ser mais ou menos elaborada e, por isso,
não apresentamos gabarito. A aula não é essencial para entender o
tema (respiração celular), mas é importante que você tente entender a
história, mergulhando nela. Discuta com seu tutor e seus colegas. Fica
muito mais interessante.
A DESCOBERTA DOS CITOCROMOS
No final do século passado, um pesquisador inglês chamado
MacMunn descreveu, sob os nomes mio-hematina e histo-hematina,
um tipo de pigmento respiratório, identificado em músculos e outros
tecidos de animais das mais diferentes espécies. Ele observou que este
ESPECTRO
pigmento, no estado reduzido, apresentava um
Ver na aula de
fotossíntese (Aula 6) o
espectro de luz visível.
composto por quatro bandas de absorção. No estado oxidado, o
ESPECTRO
característico
mesmo não apresentava as mesmas bandas. Em 1889, Levy reproduziu
cuidadosamente os experimentos de MacMunn, obtendo os mesmos
resultados. Entretanto, Levy interpretou o pigmento encontrado por
MacMunn como uma hemoglobina. Esta interpretação dos resultados
de Levy foi apoiada por Hoope Seyler que observou a presença de CO
na preparação de derivados de hemoglobina. Apesar de insistentes
réplicas e argumentos de MacMunn, a discussão foi encerrada e o
pigmento respiratório de MacMunn foi gradualmente esquecido.
52 CEDERJ
15 MÓDULO 4
No lugar de MacMunn, o que você faria para ratificar sua descoberta frente às críticas sobre uma provável
contaminação dos tecidos analisados, com derivados da hemoglobina?
Espectro de
absorção
Prisma
Lente
Lente
Objeto
Estágio do
microscópio
Fonte de luz
Figura 15.1: As observações de MacMunn se basearam no espectro observado
quando um feixe de luz visível atravessa o material biológico e é decomposto por
um prisma.
Na segunda década do século XX, David Keilin, durante seus
estudos sobre a respiração em vermes e insetos parasitas, mostrou
que o pigmento mio-hematina ou histo-hematina não só existia, como
também possuía distribuição e importância bem maiores que as supostas
anteriormente por MacMunn!
Após meticuloso estudo de microespectroscopia em células e
tecidos de insetos, vermes, aracnídeos, moluscos, levedura e vegetais
superiores, Keilin propôs o nome Cytochrome (que significa pigmento
celular), para definir o ubíquo composto que representava claramente um
característico espectro de absorção composto por quatro bandas, as quais
denominou a, b, c e d, correspondentes ao estado reduzido do citocromo.
O espectro do pigmento no estado oxidado não apresentava bandas
distintas de absorção. A Figura 15.1 mostra, de forma esquemática,
o dispositivo experimental de Keilin, usando um microespectroscópio
ocular de Zeiss para estudar o espectro nos músculos torácicos de um
inseto (abelha). Na Figura 15.2 você vai encontrar o resultado observado
por Keilin.
CEDERJ 53
AULA
!
BIOQUÍMICA II | Metabolismo de carboidratos I
a
b
Figura 15.2: Espectro de absorção da luz visível de músculos de abelha (a). As linhas
mais escuras são as linhas de absorção que aparecem sobre um espectro de luz visível
de fundo característico (b).
!
Sabendo-se da propriedade oxirredutora dos citocromos e do possível envolvimento com o fenômeno da
respiração, o que você espera que aconteça com o espectro de absorção quando a abelha movimenta as
asas e quando esta permanece quieta?
Keilin também trabalhou com suspensão de levedura. O que você espera ter acontecido quando Keilin
borbulhou ar na cubeta contendo uma suspensão de levedura?
Keilin verificou ainda que o aparecimento ou não das bandas
era grandemente afetado pela presença de agentes como o monóxido
de carbono e o cianeto. Alguns anos mais tarde, Keilin e Hartree, um
de seus colaboradores, utilizando estes inibidores observaram que cada
conjunto de faixas do espectro de absorção não surgia ou desaparecia
ao mesmo tempo. Perceberam que após a adição de cianeto existia uma
ordem seqüencial para o aparecimento das bandas que sempre se repetia:
d, a, c e b.
!
No lugar de Keilin e Hartree, o que você concluiria a partir destas
observações?
Qual o destino final dos elétrons após o último citocromo?
O envolvimento dos citocromos no processo de oxidação dos
açúcares e consumo de oxigênio começava a ser desvendado. Os
citocromos foram designados posteriormente, na ordem de sua seqüência
no processo de transporte de elétrons como: citocromo b, citocromo c,
citocromo a e citocromo a3 (ou citocromo oxidase).
54 CEDERJ
15 MÓDULO 4
AULA
Pouco tempo depois, o ciclo dos ácidos tricarboxílicos (ciclo
do ácido cítrico) foi elucidado por Sir Hans Krebs, mas ainda havia
muita discussão sobre os mecanismos que acoplavam as oxidações ao
fornecimento de energia para os seres vivos.
Neste contexto, dois pesquisadores russos, Belitser e Tsybakova,
em 1939, estabeleceram uma possível relação entre a glicólise e as reações
de oxidação e redução associadas à fosforilação. Suas descobertas foram
assim descritas:
O MECANISMO DE FOSFORILAÇÃO ASSOCIADO À RESPIRAÇÃO
V. A. Belitser e E. T. Trybakova
Laboratório de Química Fisiológica, Universidade de Moscou,
U.S.S.R. (Submetido em 10 de junho de 1939)
A síntese de adenosinatrifosfato e fosfagen (fosfocreatina) ocorre no
músculo à custa da energia derivada da glicólise ou da respiração
celular. Entretanto, através de algumas descobertas indiretas,
parece que alguns processos oxidativos podem estar ligados com
a fosforilação sem ter qualquer conexão direta com a glicólise.
Braunshteyn e Severin mostraram que a oxidação do ácido pirúvico,
cetobutírico e ácido glutâmico, bem como de alanina, causa uma
estabilização da adenosina trifosfato em eritrócitos nucleados.
Grimlund encontrou que a oxidação do ácido lático, ácido pirúvico
e ácido succínico aumenta a capacidade de trabalho de um músculo
no qual a glicólise foi obliterada. Isto também foi encontrado por
Meyerhof e seus colaboradores para o caso do ácido lático e
também declarou que a oxidação lática causa a estabilização do
fosfagen em músculos envenenados por iodoacetato.
!
Levando em consideração estes achados em que etapa está ocorrendo
o armazenamento de energia na forma de “fosfagen” (ésteres de
fosfato)?
CEDERJ 55
BIOQUÍMICA II | Metabolismo de carboidratos I
Assim, Belitser e Tsybakova interessados em investigar a síntese
de ésteres de fosfato (fosfagen) realizaram o seguinte experimento:
incubaram preparações de músculos de pombo na presença ou ausência de
ácido pirúvico (o substrato respiratório) e mediram fosfagen sintetizado
e taxa respiratória (Figura 15.3).
Fosfagen, mgP2O5
6,0
5,0
4,0
3,0
2,0
Respiração, LO2
1,0
100,0
I
II
III
V
200,0
300,0
400,0
IV
500,0
Figura 15.3: Síntese de Fosfagen na presença de ácido pirúvico (músculo de pombo).
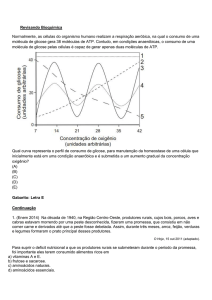
I: antes da incubação; II: em N2 sem ácido pirúvico; III: o mesmo com ácido pirúvico;
IV: in O2 com ácido pirúvico; V: o mesmo sem ácido pirúvico. Nesta e nas ilustrações
seguintes, o fosfagen sintetizado é expresso em mg de P2O5 e a taxa respiratória é
expressa em µL de O2 por 30 minutos, por grama de tecido.
!
O que sugere este resultado?
Observe que na presença de ácido pirúvico e O2 (IV) tanto a síntese
de fosfagen quanto a taxa de respiração celular são maiores que nas
outras situações experimentais e, além disso, são proporcionais.
Os mesmos autores também mostraram, no mesmo trabalho, que
praticamente todo o ácido pirúvico era oxidado durante a respiração.
Além disso, eles investigaram o efeito de outros substratos
respiratórios (ácido cítrico, ácido fumárico, α-cetoglutarato e ácido
succínico) na síntese de fosfagem e no consumo de oxigênio, como
mostrado abaixo (Tabela 15.1).
56 CEDERJ
Datas dos
Experimentos
Tecido
Substrato
15 MÓDULO 4
Respiração em µL O2 Aumento de
por 1 g de tecido por fosfagem em mg de
30 minutos
P3O2 por g de tecido
Sem
Com
Sem
Com
substrato substrato substrato substrato
1939
1° de abril
Coração de coelho Ácido cítrico
19 de abril
263
399
4,00
7,25
Coração de coelho Ácido Fumárico
95
386
0,20
5,62*
05 de maio
Coração de coelho α - cetoglutarato
120
540
0,45
3,40*
07 de abril
Coração de coelho Ácido Succínico
206
956
2,30
4,26
03 de junho
Músculo de pombo Ácido málico
280
420
0
1,84
16 de maio
Músculo de pombo Ácido lático
252
387
0
1,56
26 de outubro Músculo de pombo Ácido pirúvico
214
420
0
2,34
10 maio
170
153
0
0
1938
Músculo de pombo Ácido acético
* na presença de 0,02 de NaF
Que conclusões você tiraria deste experimento?
Repare que na presença do substrato há um aumento na síntese de
fosfagen e na taxa respiratória. Apenas quando o substrato respiratório
era o ácido acético não foi observado um aumento significativo na
presença do substrato.
Cerca de dois anos mais tarde, 1941, Fritz Lipmann postulava o
conceito de “ligação fosfato rica em energia”, como descreveu a seguir.
CEDERJ 57
AULA
Tabela 15.1: Síntese de fosfagen ligada à oxidação de vários substratos.
BIOQUÍMICA II | Metabolismo de carboidratos I
GERAÇÃO METABÓLICA E UTILIZAÇÃO DA ENERGIA
LIGADA AO FOSFATO
Fritz Lipmann
Laboratório de Pesquisa Bioquímica, Hospital Geral de
Massachusetts e Departamento de Química Biológica – Escola
Médica de Harvard, Boston, Massachusetts
I- Introdução Histórica
Por um longo período a descoberta de Harden e Young, a
fosforilação de hexose na fermentação alcoólica, foi considerada
com significado apenas como uma forma de modelar a molécula
de hexose para ajusta-lá à quebra fermentativa. Entretanto, como
resultado de um estudo intensivo das reações intermediárias da
fermentação e a relação entre ação muscular e metabolismo,
tornou-se evidente que a ligação éster fosfato primária da hexose
transforma-se metabolicamente em um novo tipo de ligação
fosfato de alta energia. (...) Durante vários processos metabólicos
o fosfato é introduzido em compostos não meramente, ou no
mínimo não somente, para facilitar sua quebra, mas como um
provável carreador de energia. Resumir a geração metabólica e
a circulação deste peculiar tipo de energia química é a proposta
primária deste trabalho.
!
Logo foi reconhecido o papel do ATP como um carreador de energia nos
processos metabólicos. Mas, qual o sítio de síntese de ATP na célula? O que
você faria para responder a esta questão?
Em 1949, devido ao desenvolvimento tecnológico propiciado
pela Segunda Grande Guerra, E. P. Kennedy e A. L. Lehninger utilizam
centrífugas refrigeradas e submetem variando de 1.500 X g (1g = 9,8m/s2,
aceleração da gravidade) até 20.000 g.
58 CEDERJ
1.000 X g:
Precipita células íntegras e núcleo.
15 MÓDULO 4
FRAÇÃO CELULAR
AULA
ACELERAÇÃO
de 5.000 até 15.000 X g:Precipita grandes vacúolos, cloroplastos e mitocôndrias.
de 50.000 até 150.000 X g:
Precipita microssomas de retículo endoplasmático.
Acima de 500.000 X g:
Precipita algumas proteínas solúveis.
Desta forma, Kennedy e Lehninger isolam diferentes frações e
obtêm o seguinte resultado (Tabela 15.2):
Tabela 15.2: Atividade das frações subcelulares de fígado de rato na oxidação de
compostos intermediários do ciclo de Krebs.
Fração
Mitocôndria
Substrato
Citrato
7,1
α-cetoglutarato
6,3
Piruvato + oxaloacetato
7,1
Nada
0,18
Precipitado Nuclear Citrato
Sobrenadante
Consumo de
oxigênio (µM)
1,9
α-cetoglutarato
1,7
Piruvato + oxaloacetato
0,98
Nada
0,0
Citrato
0,54
α-cetoglutarato
0,0
Piruvato + oxaloacetato
1,4
Nada
0,31
!
Comparando a taxa respiratória (consumo de oxigênio) das três frações obtidas (mitocôndria, precipitado
nuclear e sobrenadante), qual das frações celulares está envolvida com a respiração, e como você integraria
os resultados obtidos por Keilin e Belitser & Tsybakova?
Como você comprovaria o seu esquema?
CEDERJ 59
BIOQUÍMICA II | Metabolismo de carboidratos I
Kennedy e Lehninger mediram paralelamente o consumo de
oxigênio e o fosfato esterificado, utilizando vários substratos respiratórios.
A Tabela 15.3 apresenta estes resultados. Observe que, em comparação
com o controle (sem adição de substrato), existe um aumento tanto na
taxa respiratória quanto no fosfato esterificado quando são utilizados
citrato, alfa-cetoglutarato, piruvato + oxaloacetato ou octanoato como
substratos.
Tabela 15.3: Esterificação de fosfato acoplado à oxidação na mitocôndria.
Consumo de
oxigênio
Fosfato
esterificado
32
Pi
esterificado
µM
y
%
Nada
0,18
24,2
0,67
Citrato
7,1
106
31,3
α−cetoglutarato
6,3
113
39,3
Piruvato + oxaloacetato
7,1
113
32,6
Nada (0,0001 M malato presente)
0,5
37
3,2
Octanoato
4,5
121
27,8
Experimento
1
2
Substrato
Anos mais tarde, no laboratório de A.L. Lehninger, foi verificado
que nucleotídeos de diidro-difosfopiridina (DNPH2 na nomenclatura
antiga, atualmente conhecido como NADH) aumentavam a incorporação
de 32Pi (fosfato inorgânico radioativo) em um composto com a propriedade
como a adenosina trifosfato (ATP). Tal incorporação não
ÁCIDO LÁBIL
ÁCIDO LÁBIL
Propriedade “ácido
lábil” significa que o
composto é sensível a
meios ácidos. Usa-se
lábil em contraposição
a resistente. Temos
ainda termolábil
em contraposição a
termorresistente.
ocorria na presença de N2 ou na ausência de íons Mg2+.
60 CEDERJ
Consumo de O2 por DPNH2
Utilizando preparação mitocondrial de fígado de rato, Lehninger
fez os experimentos mostrados nas Figuras 15.4 e 15.5. No primeiro
experimento (Figura 15.4), ele testou o efeito da concentração de
citocromo c na velocidade de consumo. (lembre que é NADH).
15 MÓDULO 4
Microátomos de oxigênio consumido
2 – adição de 5 x 10-6 M
AULA
1 – sem adição de citocromo
3 – 1,0 x 10–5 M
4 – 5 x 10–5 M
5 – 1,5 x 10-4 M
10
20
30
40
tempo em minutos
50
Figura 15.4: Efeito da concentração de citocromo c na velocidade de oxidação de DPNH2.
!
O que sugere o experimento da Figura 15.4?
Os resultados mostram que, na ausência de citocromo, o consumo
de oxigênio é basal e que a adição de citocromos à preparação de
mitocôndria de fígado de rato aumenta a taxa respiratória.
No segundo experimento (Figura 15.5), ele testou o efeito da
concentração de citocromo c na velocidade de oxidação de DPNH2
(lembre que é NADH).
Microátomos de O2 consumido
Micromols DPN formado ou DPNH2
desaparecido
Consumo de O2 / DNPH2 adicionado
0
5
10
15
20
tempo em minutos
25
30
Figura 15.5: Correlação entre o consumo de oxigênio, o desaparecimento de DNPH2
e o aparecimento de DPN durante a oxidação do DNPH2.
CEDERJ 61
BIOQUÍMICA II | Metabolismo de carboidratos I
!
Qual a relação entre o desaparecimento de NADH2 e o
consumo de oxigênio na Figura 15.5?
A seguir, Lehninger mediu simultaneamente a relação entre DPNH2
e fosfato (orto-fosfato) no ensaio de respiração (Tabela 15.4).
Tabela 15.4: Medidas da razão Pi/DPNH2.
Experimento
número
2
Tipo de
enzima
Tempo
Orto-fosfato DPNH2 P/DPNH2
Citocromo
(minutos)
c (M)
(µM)
(µM)
0
4,72
4,94
8
2,81
3,92
1,89
0,003M
15
1,96
3,13
1,52
DPN
0
7,43
17
7,27
H2O
4 X 10-4
Tubos duplicados contendo 0,005M de MgCl2, 0,005M de KCl, 0,002M a 0,004M de ADP, 0,02M de
tampão glicil-glicina pH 7,4, citocromo c, ortofosfato, DPNH2, na concentração indicada na tabela e
0,03M de NaF. Cada tubo recebeu 0,30 ml da suspensão da partícula indicada (partículas derivadas
de 50 mg de fígado de rato) para um volume total de 2,0 mL. A temperatura nos diferentes experimentos variou de 17 – 24o C.
!
Observando as medidas de A.L. Lehninger na Tabela 15.4,
sugira o papel do NADH2 durante a oxidação da glicose e
relacione com a síntese de ATP.
Observe que a concentração de DPNH 2 cai e a de fosfato
também, conforme aumenta o tempo de ensaio. Entretanto, a relação
fosfato e DPNH2 parece não ser muito alterada, o que sugere que
a utilização do fosfato (provavelmente para a síntese de ATP) e a
diminuição na concentração de DPNH2 (provavelmente oxidado a
DPN) são eventos acoplados.
62 CEDERJ
15 MÓDULO 4
investigando o acoplamento entre o consumo de oxigênio e
a fosforilação, com o efeito do 2,4-dinitrofenol (DNP):
Figura 15.6: A estrutura do 2,4-dinitrofenol
(DNP), um veneno metabólico.
Tabela 15.5: Efeito do DNP no consumo de oxigênio e fosfato em homogenatos de
rim de coelhos.
Adições
Consumo de Consumo
de fosfato
oxigênio
Razão
Pi: O
Nenhuma
8,0
17,5
2,2
8 X 10 -4 MDNP
7,9
1,3
0,2
Todas as amostras contêm 10 ml da preparação de uma enzima similar àquela de
Green et al., preparada por centrifugação de homogenato de rim de coelho em
tampão KCl-NaHCO3 e lavagem do resíduo 2 vezes com o tampão fresco. A isto foi
adicionado 0,1 ml de hexoquinase de levedura e 0,0067M de MgCl2.
Clinon foi o primeiro a mostrar que o dinitrofenol em baixas
concentrações bloqueia completamente as reações sintéticas sem
interferir na oxidação. Outros autores têm mostrado que esta droga
inibe a assimilação de nitrogênio, crescimento e diferenciação, a
formação de enzimas adaptativas, e Hotchkiss tem reportado
dados prelimirares mostrando que o DNP previne consumo de
fosfato durante a respiração de células de levedura. Estes resultados
parecem indicar que DNP atua no mecanismo básico da célula
pelo qual a geração de ligações fosfato está acoplada a reações de
oxidação.
Loomis & Lipman, 1948
!
Que conclusões você tiraria destes dados?
CEDERJ 63
AULA
Em 1948, Loomis e Lipmann publicam um trabalho
BIOQUÍMICA II | Metabolismo de carboidratos I
É interessante que o DNP (Tabela 15.5) não afeta o consumo de
oxigênio, mas inibe drasticamente o consumo de fosfato. Isso significa
que, embora os dois processos estejam acoplados, eles são independentes
(ver hipóteses de acoplamento de energia na próxima aula).
!
Durante muitos anos, o DNP foi prescrito para uso em tratamento da obesidade, pois os pacientes que o
utilizavam mostravam uma rápida diminuição em seu peso. Como você explicaria este fenômeno do ponto
de vista bioquímico? Você acharia adequado tal tratamento?
Os resultados mostrados até aqui dão uma idéia do que ocorre
na mitocôndria e que resulta em transformação da energia química do
alimento em energia química da molécula de ATP. Este processo é vital
para os organismos aeróbicos. Na aula seguinte, vamos mostrar como
isso acontece. Não esqueça que o que sabemos é resultado desta história
e de muitas outras que não caberiam aqui. Muita gente trabalhou e
continua trabalhando para entender como este processo ocorre.
64 CEDERJ
objetivos
Ao final desta aula, você deverá ser capaz de:
• Entender os processos de oxirredução dos
componentes da cadeia transportadora de elétrons.
• Compreender o processo de síntese de ATP.
AULA
Metabolismo de
carboidratos II
16
BIOQUÍMICA II | Metabolismo de carboidratos II
INTRODUÇÃO
Da história contada na aula anterior podemos extrair as idéias fundamentais
que explicam como a energia contida no alimento pode ser transformada
em ATP nas células, na presença de oxigênio. O pigmento respiratório
de MacMunn ou os citocromos de Keilin; o processo de transferência de
elétrons; a relação entre a oxidação de hexoses e a fosforilação de Belitser
e Tsybakova; o conceito de ligações fosfato de alta energia de Lipmann; a
esterificação de fosfato acoplado à oxidação na mitocôndria de Kennedy
e Lehninger; o papel do NADH de Lehninger: esses são apenas alguns
personagens importantes e essas pistas nos dão uma idéia do que acontece
nas nossas células. Agora vamos passo a passo mostrar com mais detalhes
esse processo conhecido como cadeia transportadora de elétrons.
CONCEITOS INICIAIS
A cadeia transportadora de elétrons (CTE) é um conjunto de
reações que ocorre nas cristas mitocondriais (ver Aula 14) e fornece
energia para outro processo, a fosforilação oxidativa.
Alimento
Cadeia transportadora de elétrons e fosforilação oxidativa
são, portanto, eventos relacionados, ou melhor, acoplados.
Entretanto, cada um deles pode ocorrer independentemente e
tem componentes e produtos diferentes.
A cadeia transportadora de elétrons resulta na síntese de água
A fosforilação oxidativa resulta na síntese de ATP
Energia para
o corpo
Figura 16.1: O fluxograma
mostra que a energia
usada pelo corpo em suas
diversas atividades é, em
última análise, energia
química do alimento.
Esta energia é primeiro
convertida em NADH e
FADH 2 e, posteriormente,convertida em ATP.
ATP é energia química
disponível e acessível para
as atividades celulares.
A cadeia transportadora de elétrons utiliza os aceptores (NADH
e FADH2) reduzidos em outras vias metabólicas tais como glicólise
ou ciclo do ácido cítrico. A síntese de ATP por fosforilação oxidativa
é dependente da energia gerada durante o transporte de elétrons da
cadeia mitocondrial.
Antes de começar a explicar como isso acontece, vamos calcular
o saldo de NADHs, FADH2 e ATPs que temos no processo de respiração
celular após a quebra total de uma molécula de glicose (glicólise e ciclo
do ácido cítrico). Tente fazer isso, olhando as aulas anteriores de
glicólise (Aulas 10 e 11) e ciclo do ácido cítrico (Aula 14).
66 CEDERJ
16 MÓDULO 4
AULA
E agora confira o resultado que você encontrou.
Durante a glicólise – saldo de 2 ATPs e 2 NADHs.
No ciclo do ácido cítrico – saldo de 2 ATPs (1 para cada volta
no ciclo), 6 NADHs (3 para cada volta no ciclo) e 2 FADH2 (1 para
cada volta no ciclo).
O que foi gerado no ciclo do ácido cítrico encontra-se na matriz
mitocondrial, onde ele acontece. O que foi gerado na glicólise está no
citoplasma da célula. Portanto, para que o NADH, reduzido durante a
glicólise, possa estar disponível para a cadeia transportadora de elétrons,
ele precisa atravessar as membranas mitocondriais, particularmente
a interna, que é menos permeável. Para isso, existem transportadores
específicos na membrana interna mitocondrial. O NADH glicolítico pode
entrar na mitocôndria por dois caminhos diferentes, ou seja, existem dois
transportadores capazes de carregar esta molécula do citoplasma para
a matriz mitocondrial. Estes transportadores são chamados lançadeira
malato-aspartato e lançadeira do glicerofosfato.
AS LANÇADEIRAS
A lançadeira malato-aspartato
Este sistema usa as moléculas de malato e aspartato para
transportar os hidrogênios que estão associados ao NADH no citoplasma
da célula. Envolve também outras moléculas normalmente presentes na
matriz mitocondrial e no citoplasma. Um hidrogênio ligado ao NADH
é transferido para o oxaloacetato (que você já conhece), formando
malato no citoplasma da célula. A membrana interna mitocondrial tem
que leva o malato do
A N T I P O R TA
citoplasma para dentro da mitocôndria e, simultaneamente, transporta
Reveja as aulas de
transporte através
de membranas em
Biologia Celular I.
um transportador de malato do tipo
ANTIPORTA
α - cetoglutarato da matriz mitocondrial para o citoplasma. Na matriz
mitocondrial, o malato volta a oxaloacetato, transferindo o hidrogênio
para o NAD+ mitocondrial, formando novamente NADH. Note que
apenas os hidrogênios foram transportados. O NAD+ citoplasmático não
é capaz de atravessar a membrana interna mitocondrial. Como resultado
da transferência do hidrogênio para formar NADH, o malato volta a
ser oxaloacetato na matriz mitocondrial. Este oxaloacetato é convertido
em aspartato, que pode então sair da mitocôndria por um transportador
(antiporta) que, em troca, transfere glutamato do citoplasma para a
matriz mitocondrial (o resumo do mecanismo de transporte pode ser
CEDERJ 67
BIOQUÍMICA II | Metabolismo de carboidratos II
visto na Figura 16.2). Assim, todo NADH reduzido na glicólise (dois
NADH) pode estar disponível na matriz mitocondrial para participar
da cadeia transportadora de elétrons.
Figura 16.2: Lançadeira
malato-aspartato.
A lançadeira do glicerofosfato
O segundo caminho para entrada dos elétrons na matriz
mitocondrial é a lançadeira do glicerofosfato ou fosfoglicerol. Nesse
caso, os hidrogênios associados ao NADH reduzido na glicólise são
transferidos para a diidroxiacetona-fosfato (DHAP) formando o 3fosfoglicerol no citoplasma. A enzima que catalisa esta reação é a
3-fosfoglicerol desidrogenase. A enzima flavoproteína desidrogenase
catalisa a transferência deste hidrogênio para o FADH2 (o resumo do
mecanismo de transporte está na Figura 16.3).
Diidroxiacetona
fosfato
Figura 16.3: Lançadeira
do glicerolfosfato.
68 CEDERJ
16 MÓDULO 4
AULA
Assim, cada NADH reduzido na glicólise será transformado em
FADH2 para participar da CTE na mitocôndria. Neste caso, portanto,
temos uma diferença essencial quanto ao saldo de ATPs após a CTE.
Lembre que cada NADH gera energia suficiente para a síntese de 3 ATPs,
enquanto o FADH2 apenas para 2 ATPs.
Agora temos todo NADH na matriz mitocondrial. Além do
FADH2, é claro. Estes aceptores são o ponto de partida para a síntese
de ATP. Cada NADH que transfere seus hidrogênios para a cadeia
transportadora gera energia suficiente para a síntese de 3 moléculas de
ATP. Cada FADH2 gera energia para a síntese de apenas 2 moléculas
de ATP.
Agora faça os cálculos... quando uma molécula de glicose
sofre oxidação completa, quantas moléculas de ATP podem ser
geradas por fosforilação oxidativa?
Quantas moléculas foram geradas por fosforilação no nível
do substrato, na glicólise e no ciclo do ácido cítrico?
Qual o total de moléculas de ATP sintetizado por molécula
de glicose durante o processo completo de respiração celular?
Se você chegou a 38 moléculas de ATP, ótimo (veja Tabela 16.1).
Tabela 16.1: Balanço energético da respiração celular em cada uma das etapas a partir da
oxidação completa de uma molécula de glicose.
Etapa da respiração celular
Glicólise
Piruvato
Fosforilação
substrato
2 ATP
Acetil-CoA
Ciclo do ácido cítrico
Total = 38
2 ATP
4
Fosforilação oxidativa
2NADHx3= 6 ATP
2NADHx3= 6ATP
6NADHx3 = 18 ATP
2FADH2x2 = 4 ATP
34
Você já sabe que se o NADH gerado durante a glicólise for
transportado pela lançadeira do glicerofosfato, uma molécula de ATP
terá que ser utilizada para o transporte. Assim, dois ATPs serão gastos
para levar as duas moléculas de NADH reduzidas na glicólise para
a matriz mitocondrial. Neste caso, do total de 38 moléculas de ATP
teremos apenas 36 moléculas de ATP, após a degradação completa de
uma molécula de glicose. Você encontrará em alguns livros 36 ATPs e
CEDERJ 69
BIOQUÍMICA II | Metabolismo de carboidratos II
em outros 38 ATPs, como produto final da respiração celular. Agora,
você já sabe de onde vem esta aparente discrepância. Além disso, após
1991, verificou-se que a relação de 3 ATPs por NADH e 2 ATPs por
FADH2 não é exata. Alguns trabalhos mostraram que a relação é de 2,5
moléculas de ATP para cada NADH reoxidado na cadeia transportadora
de elétrons e de 1,5 molécula de ATP para cada FADH2.
A CADEIA TRANSPORTADORA DE ELÉTRONS (CTE)
Agora vamos à cadeia transportadora de elétrons mitocondrial.
Sua organização e seu mecanismo de funcionamento se assemelham à
cadeia transportadora de elétrons presente no cloroplasto que vimos
nas aulas de fotossíntese (Aula 6). Na membrana interna mitocondrial
existem partículas organizadas em uma seqüência definida. Esta organização
obedece a um padrão baseado no potencial redox de cada um dos
componentes. Alguns componentes são complexos protéicos integrais
de membrana, outros são componentes móveis.
Os componentes da cadeia transportadora de elétrons
Como já vimos anteriormente, a membrana interna mitocondrial
é rica em proteínas. A maior parte dessas proteínas é componente da
cadeia transportadora de elétrons. As proteínas estão organizadas em
quatro complexos protéicos responsáveis pelas reações de oxirredução
que ocorrem nesta membrana. São eles:
Complexo I – também chamado NADH desidrogenase ou
NADH: CoQ oxidorredutase.
Complexo II – também chamado succinato desidrogenase ou
succinato: CoQ oxidorredutase.
Complexo III – também chamado citocromo bc1.
Complexo IV – também chamado citocromo oxidase.
Além desses complexos protéicos, existem dois componentes
móveis da cadeia: a ubiquinona (também chamada coenzima Q e
representada como UQ ou CoQ) e o citocromo c.
70 CEDERJ
16 MÓDULO 4
AULA
A seqüência de transporte de elétrons
Vejamos agora mais detalhadamente cada um dos complexos
protéicos e o papel que eles desempenham na cadeia transportadora de
elétrons.
O complexo I - NADH desidrogenase ou NADH: CoQ oxidorredutase
O complexo I tem atividade NADH desidrogenase, ou seja,
usa NADH como substrato para uma reação de desidrogenação. Este
complexo apresenta, como co-fator, flavina mononucleotídeo (FMN),
além de centros ferro-enxofre. Sua estrutura protéica é composta
por mais de 30 subunidades totalizando uma massa molecular de
aproximadamente 850 kDa. No complexo o percurso dos elétrons é:
NADH
FMN
Fe-S
UQ
FeS
UQ
O alvo final dos elétrons é a ubiquinona (UQ). O complexo
transporta dois elétrons para a ubiquinona e quatro prótons da matriz
mitocondrial para o espaço intermembranar.
Figura 16.4: O complexo I da cadeia transportadora de elétrons. Os elétrons são transferidos
do NADH para o FMN, formando FMNH2. Dois elétrons percorrem ainda os centros ferroenxofre até atingirem a ubiquinona. Quatro prótons são bombeados da matriz mitocondrial
para o espaço entre as membranas interna e externa.
Fonte: Garret & Grisham. Biochemistry. 2ª ed. fig. 21.6. Saunders College Publishing.
Disponível online em: http://www.people.virignia.edu/~cmg/slides_download.html
CEDERJ 71
BIOQUÍMICA II | Metabolismo de carboidratos II
O complexo II - succinato desidrogenase ou succinato: CoQ oxidorredutase
O complexo II é um complexo independente, que aceita elétrons
apenas do FADH2 e os transfere também para a ubiquinona.
O complexo está presente na membrana interna mitocondrial
e também participa do ciclo de Krebs através de sua atividade
succinato desidrogenase. Na sua estrutura estão presentes quatro cadeias
polipeptídicas, incluindo duas proteínas ferro-enxofre e flavoproteínas
2 (FP2) onde o FAD (flavina dinucleotídeo) encontra-se covalentemente
ligado. Você já sabe, das aulas de fotossíntese, que existem diferentes
tipos de centros ferro-enxofre ligados a proteínas. Estes podem ser do
tipo 4Fe-4S, 3Fe-4S ou 2Fe-2S (ver ferredoxina, na Aula 6 do módulo
fotossíntese), dependendo do número de átomos de ferro e de enxofre
presentes nos complexos.
A reação que ocorre no complexo é a seguinte:
Succinato + UQ
Fumarato + UQH2
O percurso dos elétrons é o seguinte:
Succinato
FADH2
2Fe2+
UQH2
Figura 16.5: O complexo II da CTE.
Este complexo recebe os elétrons
do FADH2 reduzido no ciclo do
ácido cítrico e os transfere para a
ubiquinona através de seu centro
ferro-enxofre.
Fonte: Garret & Grisham.
Biochemistry. 2ª ed. fig. 21.6.
Saunders College Publishing.
Disponível online em:
http://www.people.virginia.edu/
cmg/slides_download.html
Entretanto, a ubiquinona (UQ) pode ser parcialmente reduzida
e formar um radical semiquinona (UQH*). A redução deste radical
leva à formação de ubiquinol (UQH2). Em condições fisiológicas,
a quantidade de semiquinona formada é muito pequena, pois toda
semiquinona é rapidamente convertida a ubiquinol (veja Figura 16.6).
72 CEDERJ
16 MÓDULO 4
AULA
Em situações especiais pode haver um acúmulo de semiquinona, que é
considerado um radical livre e, portanto, é capaz de reagir fortemente
com várias biomoléculas, causando danos à sua estrutura. A cadeia
transportadora de elétrons é, em potencial, um dos caminhos pelos
quais os radicais livres são gerados.
Figura 16.6: Ubiquinona é parcialmente reduzida formando
um radical semiquinona que é
novamente reduzido, formando
ubiquinol.
O complexo III - citocromo bc1
O principal componente do complexo III é uma proteína
transmembrana chamada citocromo b. Você conheceu a história
dos citocromos na aula anterior. Este citocromo se caracteriza por
apresentar como grupo prostético um grupamento heme bL e outro
!
Se você não se lembra
do conceito de grupo
prostético, volte às
aulas de proteínas,
em Bioquímica I.
grupamento heme bh. Estas moléculas são apresentadas na Figura 16.7
e distinguem-se pelos diferentes tipos de citocromo apenas nas cadeias
laterais (ver Figura 16.7).
A
B
C
Figura 16.7: O grupamento heme ou ferro-protoporfirina IX é o grupo
prostético dos citocromos.
A) molécula encontrada no citocromo b;
B) a molécula encontrada no citocromo c;
C) a molécula encontrada no citocromo.
CEDERJ 73
BIOQUÍMICA II | Metabolismo de carboidratos II
O ciclo Q
A coenzima Q (CoQ) ou ubiquinona (Q ou UQ) passa seus
elétrons para o citocromo c (e bombeia prótons) num ciclo redox único
!
Para relembrar o conceito
de unidades isoprenóides,
veja aula de outros lipídeos
em Bioquímica I.
chamado ciclo Q. A coenzima Q é uma benzoquinona ligada a várias
unidades isoprenóides (normalmente 10 em células de mamíferos e 6
em bactérias). A cauda isoprenóide dá à molécula seu caráter apolar,
que permite à CoQ difundir-se rapidamente pela membrana interna
mitocondrial. A CoQ tem a habilidade de aceitar um par de elétrons
(aceptor dieletrônico) e passá-los, um de cada vez, através de um
intermediário semiquinona até o complexo III. Isso ocorre em duas
etapas: a primeira etapa é a migração do ubiquinol (UQ2) para o sítio
Qp da citocromo c redutase. Dois elétrons e dois prótons são liberados,
resultando em uma oxidação a um intermediário semiquinona (UQH*)
e, finalmente, à ubiquinona (UQ), que pode deixar o sítio e entrar no
pool da membrana. Um elétron é passado a uma proteína ferro-enxofre
através do citocromo c1 e, finalmente, ao citocromo c móvel no espaço
intermembranas. O outro elétron passa através dos citocromos bL e
bH, reduzindo a ubiquinona a semiquinona no sítio Qn da enzima.
A primeira etapa do ciclo Q pode ser resumida através da
seguinte equação:
UQH2 + CITOCROMO C (oxidado)
UQH* + 2H + CITOCROMO C (reduzido)
Na segunda etapa do ciclo, outro ubiquinol (UQ2) entra no
sítio Qp e é oxidado a ubiquinona, doando um novo par de elétrons
para o citocromo c. Entretanto, desta vez o segundo elétron é usado
para reduzir o intermediário semiquinona a ubiquinol, bombeando
dois prótons da matriz para o espaço intermembranas e retornando
ubiquinol para o pool da membrana. O resultado final dessas reações
é o bombeamento de quatro prótons para cada molécula de ubiquinol
que é oxidada. A razão para a complexidade deste processo é que a
cadeia precisa transferir dois elétrons do ubiquinol para duas moléculas
carreadoras de um elétron (aceptor monoeletrônico), o citocromo c.
A segunda etapa do ciclo Q pode ser resumida na equação a seguir:
UQH2 + UQH*+ 2H+ + CITOCROMO (oxidado)
74 CEDERJ
UQH2 + 2H+ + UQ + CITOCROMO (reduzido)
UQH2 + CITOCROMO C (ox.)
16 MÓDULO 4
AULA
O resumo do ciclo está no Esquema 16.1, a seguir:
UQH* + 2H+fora + CITOCROMO C (reduz.)
UQH2 + UQH* + 2H+dentro+ CITOCROMO C (ox.)
UQH2 + 2H+dentro+ 2 CITOCROMO C (ox.)
2e-
UQH2 + 2H+fora + UQ + CITOCROMO C (reduz.)
4 H+fora + 2 CITOCROMO C (reduz.) + UQ
Na Figura 16.8, apresentamos um esquema do ciclo Q.
B
A
Figura 16.8: O ciclo Q.
Em A, a primeira etapa do
ciclo com a transferência de
dois elétrons do ubiquinol
para o citocromo c e a formação do intermediário
semiquinona.
Em B, a segunda etapa do
ciclo com a transferência
de elétrons de outro ubiquinol, formando ubiquinona.
Quatro prótons são bombeados da matriz para o
espaço intermembranas.
Cyt c = citocromo c.
O complexo IV - citocromo oxidase
Na seqüência da cadeia transportadora temos até agora dois
citocromos reduzidos. Eles são componentes móveis da cadeia que,
em seguida, sofrerão oxidação, enquanto passam seus elétrons para
o próximo componente, o complexo IV, também chamado citocromo
oxidase. Essa enzima é composta de dez subunidades, mas grande parte
da sua estrutura ainda hoje é desconhecida. Sabe-se que a citocromo
oxidase utiliza dois hemes (a e a3) e dois sítios de cobre. O papel da
citocromo oxidase é aceitar elétrons do citocromo c e usá-los para reduzir
o oxigênio, formando duas moléculas de água. O complexo é responsável
também pelo último ponto de bombeamento de prótons da cadeia.
4 CITOCROMO C (red.) + 4H+ + O2
4CITOCROMO (ox.) + 2H2O
CEDERJ 75
BIOQUÍMICA II | Metabolismo de carboidratos II
Figura 16.9.a: A organização
molecular do heme e átomos
de cobre no complexo IV.
Figura 16.9.b: O complexo IV ou
citocromo oxidase ou citocromo a, a
3.
A redução de uma molécula de oxigênio para formar duas
moléculas de água requer quatro elétrons. Entretanto, o citocromo
c, como vimos anteriormente, transporta apenas um elétron de cada
vez. A redução incompleta do oxigênio pode gerar peróxidos ou radicais
livres de oxigênio, espécies altamente reativas. O funcionamento eficiente
da citocromo oxidase impede a formação desses radicais pela incompleta
redução do oxigênio.
Figura 16.10: A função do citocromo oxidase.
Em resumo:
O oxigênio é o aceptor final dos elétrons na cadeia transportadora.
A redução do oxigênio resulta na síntese de água.
76 CEDERJ
16 MÓDULO 4
AULA
A FOSFORILAÇÃO OXIDATIVA
O COMPLEXO V - ATP SINTASE
O complexo V - ATP sintase
A ATP sintase é uma enzima que catalisa a síntese de ATP. Você
já viu uma enzima parecida na fotossíntese (veja fase clara, Aula 6).
No processo de respiração celular, esta enzima é responsável pela etapa
chamada FOSFORILAÇÃO OXIDATIVA. Nesta etapa, a energia do
fluxo de elétrons é convertida em ATP.
Até o complexo IV, o resultado da cadeia transportadora de
elétrons é a síntese de duas moléculas de água e um aumento da
concentração de prótons no espaço intermembranas. Lembre que esses
prótons foram bombeados pelos complexos I, III e IV. O bombeamento
de prótons estabelece um gradiente de prótons através da membrana
mitocondrial interna (veja na Figura 16.11).
Figura 16.11: Os pontos de bombeamento de prótons da matriz para o espaço
intermembranas durante a cadeia transportadora de elétrons.
Este gradiente protônico é também um gradiente eletroquímico,
pois ocorre uma diferença de potencial (ddp) entre um lado e outro da
membrana mitocondrial interna (Figura 16.12). Em outras palavras, a
P ETER D. M ITCHELL
concentração de prótons em um lado da membrana determina que este
Prêmio Nobel de
Química de 1978,
por sua contribuição
ao entendimento
dos processos de
transferência de
energia em sistemas
biológicos através da
formulação da Teoria
Quimiosmótica.
http://www.nobel.se/
chemistry/laureates/
1978/mitchellbio.html
lado seja mais positivo que o outro.
Figura 16.12: O gradiente dos prótons formado durante a cadeia transportadora de elétrons.
CEDERJ 77
BIOQUÍMICA II | Metabolismo de carboidratos II
A membrana mitocondrial interna não é permeável a prótons
e, portanto, qualquer movimento deles requer um transportador
específico. O complexo ATP sintase tem uma estrutura complexa: parte
da enzima funciona como um canal de prótons e é por ali que estes
retornarão à matriz mitocondrial, desfazendo o gradiente. Segundo
Peter Mitchell, a ATP sintase usa a energia do gradiente de prótons
para sintetizar ATP, a partir de ADP e Pi. Esta teoria é chamada Teoria
Quimiosmótica, e é a mais aceita nos dias de hoje.
Você lembra de quando dissemos, no início da aula, que a cadeia
transportadora de elétrons e a fosforilação oxidativa eram eventos
acoplados? Pois bem, veja um esquema completo, representando tal
acoplamento na Figura 16.13.
Figura 16.13: Acoplamento entre a cadeia transportadora de elétrons e a fosforilação oxidativa.
A ATP sintase é uma enzima constituída por duas partes com
atividades distintas, chamadas F1 e F0. Por este motivo ela também é
chamada F1- F0 – ATPase. A estrutura tridimensional da proteína pode
ser vista na Figura 16.14.
a
b
Figura 16.14: Estrutura tridimensional da ATP sintase. Em (a) uma vista lateral e em (b) uma visão frontal da
estrutura da proteína. Note o arranjo das subunidades.
Fonte: Biochemistry. 2a ed. Garrett e Grisham, Saunders College Publishing.
Disponível online em: http://www.people.virginia.edu/~cmg/slides_download.html
78 CEDERJ
16 MÓDULO 4
AULA
A SEQÜÊNCIA DA CADEIA DE TRANSPORTE DE ELÉTRONS
REFLETE OS POTENCIAIS REDOX DE SEUS COMPONENTES
Os componentes da cadeia transportadora de elétrons estão
organizados segundo seu potencial de oxirredução (Figura 16.15). O
potencial de redução padrão dos diferentes componentes da membrana
interna mitocondrial permite a progressiva passagem dos elétrons do
NADH e do FADH2 do menor ao maior potencial de redução padrão.
Conforme os elétrons atravessam sucessivamente os complexos I, II e
IV, é gerada energia livre suficiente para a síntese de uma molécula
de ATP. No caso do FADH2, o complexo II não é capaz de bombear
prótons. Assim, a energia livre gerada na reoxidação desta molécula é
menor, e portanto menos ATP é gerado por molécula de FADH2.
Figura 16.15: O potencial de redução padrão dos componentes móveis e dos complexos
é indicado pela escala à esquerda. Também estão indicados os pontos onde a energia
liberada é suficiente para sintetizar ATP e os sítios dos vários inibidores respiratórios
(rotenona, amital, antimiciana A e cianeto). Os complexos I, II e IV não sintetizam
diretamente ATP, mas capturam a energia livre necessária para a síntese de ATP pelo
bombeamento de prótons que gera o gradiente utilizado como força eletromotriz
pela ATP sintase.
CEDERJ 79
BIOQUÍMICA II | Metabolismo de carboidratos II
A REGULAÇÃO DA CADEIA TRANSPORTADORA DE
ELÉTRONS E FOSFORILAÇÃO OXIDATIVA
A cadeia transportadora de elétrons é regulada pela disponibilidade
dos substratos, NADH, FADH2, ADP, Pi e oxigênio. Assim, ela e a
fosforilação oxidativa estarão inibidas nas seguintes situações:
a) NADH/NAD+ – baixa – nesta situação o poder redutor é baixo
e existe uma baixa concentração de doadores de elétrons para a CTE.
ATP/ADP – alta – nesta situação a carga energética da célula é
alta, e, portanto, a síntese de ATP não precisa ser estimulada.
O2 – baixo – o oxigênio é o aceptor final dos elétrons e, na
ausência dele, os transportadores ficam saturados e não são mais
capazes de aceitar novos elétrons, paralisando a cadeia transportadora.
É por isso que precisamos respirar oxigênio.
DESACOPLAMENTO
Você já sabe que a CTE e a fosforilação oxidativa são eventos
acoplados, interdependentes. Para que a mitocôndria sintetize ATP, é
necessário que os elétrons passem através dos componentes da cadeia e
que os prótons sejam bombeados.
Entretanto, em alguns casos é possível desacoplar os dois processos.
Isso pode ocorrer com a utilização de substâncias químicas chamadas
desacopladores, como o 2,4-dinitrofenol (DNP) ou o carbonilcianeto-p-trif
luorometoxifenilhidrazona (FCCP) (ver Figura 16.16). Estas moléculas, por
serem capazes de atravessar facilmente a membrana interna mitocondrial
por difusão, podem levar os prótons do espaço intermembranas de volta
para a matriz, desfazendo o gradiente eletroquímico. Na presença dessas
substâncias, então, a cadeia transportadora de elétrons funciona sem que
haja síntese de ATP.
Figura 16.16: Mecanismo de ação
dos desacopladores DNP e FCCP.
80 CEDERJ
16 MÓDULO 4
AULA
O DNA foi utilizado, por algum tempo, no tratamento da
obesidade. Você pode imaginar por quê?
Você acha que este tipo de tratamento não é eficiente para
o que ele se propõe? Por quê?
Por outro lado, existem situações fisiológicas especiais em que
o desacoplamento ocorre. Esse é o caso do tecido adiposo marrom de
recém-nascidos e organismos hibernadores, nos quais o desacoplamento
é um importante mecanismo para manter o corpo aquecido. Nesses
tecidos, a membrana interna mitocondrial apresenta uma proteína
desacopladora conhecida como termogenina. Esta proteína é um canal
de prótons que, como os desacopladores químicos, deixa passar os
prótons de volta para a matriz mitocondrial, desfazendo o gradiente
eletroquímico. A energia, neste caso, é dissipada em forma de calor.
Figura 16.17: A termogenina, proteína
desacopladora presente na membrana
interna mitocondrial do tecido adiposo
marrom.
CEDERJ 81
BIOQUÍMICA II | Metabolismo de carboidratos II
RESUMO
A respiração celular é o processo pelo qual uma molécula de glicose é quebrada
totalmente em CO2 e H2O na presença de O2. Este processo resulta na conversão
da energia contida nas moléculas de glicose em ATP. A síntese de ATP ocorre nas
mitocôndrias por fosforilação oxidativa e é um evento dirigido pela energia do
gradiente de prótons formado na cadeia transportadora de elétrons mitocondrial.
A cadeia transportadora de elétrons (CTE) tem como substrato NADH e FADH2,
gerados no ciclo de Krebs e na glicólise. Os elétrons passam através dos componentes
da CTE, que estão organizados segundo seu potencial de oxirredução. O aceptor
final desses elétrons é o oxigênio, formando água. Os complexos I, III e IV da CTE
são também bombas de prótons. Estes complexos retiram os prótons da matriz
mitocondrial e jogam para o espaço intermembranas, gerando um gradiente
eletroquímico. A ATP sintase, presente na membrana interna mitocondrial, é
capaz de utilizar a energia deste gradiente eletroquímico e convertê-la em ATP. O
processo é regulado pela disponibilidade do substrato (ADP, Pi, NADH e FADH2).
EXERCÍCIOS
1. Descreva a rota seguida pelos elétrons da glicose até o O2.
2. Explique como se dá o acoplamento entre cadeia transportadora de elétrons
e fosforilação oxidativa.
3. Como os dois processos podem ser desacoplados?
4. Explique o caminho percorrido pelo NADH reduzido na glicólise até a cadeia
transportadora de elétrons.
5. Quais as vantagens e desvantagens do metabolismo baseado no oxigênio?
6. Faça um paralelo entre o metabolismo oxidativo de carboidratos (glicólise,
ciclo do ácido cítrico, cadeia transportadora de elétrons e fosforilação oxidativa)
e a fotossíntese, destacando diferenças e semelhanças. A que conclusões você
chegou a respeito dos princípios básicos que norteiam os mecanismos utilizados
pelos organismos para obtenção de energia?
7. Explique por que a mitocôndria de uma célula hepática contém menos cristas do
que a mitocôndria da célula do músculo cardíaco.
82 CEDERJ
objetivos
AULA
A oxidação dos
aminoácidos
e a produção de uréia
17
Ao final desta aula, você deverá ser capaz de:
• Identificar as situações metabólicas nas quais
ocorre o catabolismo dos aminoácidos.
• Conhecer o destino do grupamento amino
(NH3) presente nos aminoácidos.
• Conhecer o destino do esqueleto de carbonos
dos aminoácidos.
• Conhecer as principais vias de modificação do
grupamento amino, formado em tecidos extrahepáticos, e de seu transporte para o fígado.
Pré-requisitos
Conhecimento da estrutura e da simbologia dos
aminoácidos obtido em Bioquímica I
(Módulo 2, Aulas 8 a 10).
Conhecimento do ciclo de Krebs obtido nas
Aulas 13 e 14 desta disciplina.
BIOQUÍMICA II | A oxidação dos aminoácidos e a produção de uréia
INTRODUÇÃO
Agora, nós voltaremos nossa atenção para o processo de obtenção de energia
a partir da oxidação dos aminoácidos. A fração de energia metabólica que
pode ser obtida dos aminoácidos provenientes das proteínas da dieta ou das
proteínas musculares varia consideravelmente com o tipo do organismo e com
as condições metabólicas do mesmo. Carnívoros, logo após a alimentação,
podem obter até 90% dos seus requerimentos energéticos da oxidação dos
aminoácidos, enquanto os herbívoros podem obter pouca energia dessa rota
metabólica. Microorganismos podem obter aminoácidos do meio e aproveitá-los, já
as plantas raramente oxidam aminoácidos para obter energia; a maior parte da
sua energia metabólica é obtida da degradação de carboidratos. A concentração
dos aminoácidos nas plantas é ajustada para atender à síntese de proteínas, de
ácidos nucléicos e de outras moléculas necessárias ao seu crescimento.
Em animais, os aminoácidos sofrem o processo oxidativo em três diferentes
circunstâncias metabólicas:
1. Durante a síntese e degradação normal das proteínas, que recebe o nome
de turnover de proteínas, alguns aminoácidos obtidos pela degradação são
utilizados para a síntese de novas proteínas.
2. Quando a dieta é rica em proteínas, e a ingestão excede as necessidades
do corpo para a síntese de suas próprias proteínas (após um churrasco, por
exemplo), tal excesso é degradado, visto que os aminoácidos não podem
ser estocados.
3. Durante o jejum ou em doenças como a diabetes melito, quando os
carboidratos já não estão mais disponíveis ou não podem ser utilizados, as
proteínas celulares são utilizadas como combustível.
Em todas essas condições metabólicas, os aminoácidos perdem seus
grupamentos amino para formar alfa-cetoácidos (moléculas como aquelas
que você aprendeu ao estudar o ciclo de Krebs, Aula 14). Os “esqueletos de
carbonos”, ou seja, a cadeia carbônica dos aminoácidos, formam os α-cetoácidos.
Como você aprendeu (Aula 14), os alfa-cetoácidos podem ser degradados a
CO2 e H2O ou, com maior freqüência, podem fornecer esqueletos com três ou
quatro unidades de carbono que serão convertidos em moléculas de glicose,
combustível necessário ao cérebro, músculo e outros tecidos. Esse processo é
feito através de uma rota metabólica, denominada gliconeogênese, que você
aprenderá na Aula 30. As vias de degradação dos aminoácidos são muito
parecidas em diversos organismos; o foco desta aula será o catabolismo que
ocorre em vertebrados. De um modo geral, as vias de degradação convergem
para vias metabólicas centrais.
84 CEDERJ
17 MÓDULO 5
AULA
Você pôde observar, nas Aulas de 9 a 11, que a degradação dos carboidratos
forneceu piruvato, que, por sua vez, foi convertido a acetil-CoA; a degradação
de ácidos graxos também gerou moléculas de acetil-CoA que foi oxidada no
ciclo de Krebs.
Um ponto importante para distinguir o metabolismo dos aminoácidos
do processo de degradação dos ácidos graxos e dos carboidratos é que
todos os aminoácidos contêm grupamento amino; logo, seu processo
de degradação inclui uma etapa chave, na qual o grupamento amino
é separado do esqueleto de carbonos e desviado para vias específicas de
utilização de aminoácidos. Veja um resumo esquemático da transformação
dos aminoácidos na Figura 17.1. Nela, podemos observar que os aminoácidos
podem vir tanto da dieta quanto de outras proteínas intracelulares. A cadeia
de carbonos é utilizada em rotas metabólicas que você já conhece, enquanto a
parte nitrogenada dos aminoácidos, na forma de amônia, é processada
em uma via denominada “ciclo da uréia”, que será abordada em detalhes
na Aula 18.
Figura 17.1: Visão geral
do catabolismo dos aminoácidos em mamíferos.
CEDERJ 85
BIOQUÍMICA II | A oxidação dos aminoácidos e a produção de uréia
DESTINO METABÓLICO DOS GRUPAMENTOS AMINO
AMINOÁCIDOS
ESSENCIAIS
São aqueles que
devem ser ingeridos
na dieta. As células
não possuem enzimas
para sintetizar seu
esqueleto carbônico.
Em mamíferos são:
isoleucina, leucina,
valina, lisina,
treonina, triptofano,
fenilalanina, metionina
e histidina.
DESTINO
DO
O nitrogênio molecular existe na natureza, em bastante quantidade;
no entanto, antes de ser utilizado pelos animais, ele deve ser “fixado”,
isto é, reduzido da forma de N2 para NH3 por microorganismos e plantas.
A amônia é então incorporada, por esses organismos, em aminoácidos
e proteínas.
Você aprendeu em Bioquímica 1 que alguns
AMINOÁCIDOS
considerados ESSENCIAIS, pois não podem ser sintetizados pelo organismo,
e, portanto, devem ser ingeridos na dieta. Os não-essenciais podem ser
produzidos no nosso organismo a partir dos essenciais. Humanos não
podem sintetizar 11 dos 20 aminoácidos necessários à síntese de proteínas
endógenas. Os carbonos dos aminoácidos entram no metabolismo
ESQUELETO DE
intermediário em um dos pontos apresentados a seguir:
CARBONOS DOS
denominados
AMINOÁCIDOS
Os aminoácidos,
quando desaminados,
produzem αcetoácidos que,
diretamente ou
através de reações
adicionais, rendem
componentes do
ciclo de Krebs. Os
aminoácidos podem
ser agrupados
em duas classes:
glicogênicos e
cetogênicos.
Figura 17.2: Pontos de
entrada dos aminoácidos
no ciclo de Krebs. Nas
caixas estão registrados
os pontos de entrada
dos aminoácidos glicogênicos. Aminoácidos
cetogênicos produzem
acetil-CoA ou aceto-acetil-CoA. Em negrito estão
destacados os aminoácidos essenciais.
86 CEDERJ
são
GLICOGÊNICOS
AMINOÁCIDOS
(poderão formar glicose) são metabolizados
em piruvato, 3-fosfoglicerato, α-cetoglutarato, oxaloacetato, fumarato
ou succinil-CoA;
AMINOÁCIDOS CETOGÊNICOS
(que podem formar corpos
cetônicos) produzem acetil-CoA ou acetoacetato. O metabolismo de
alguns aminoácidos resulta em mais de um dos pontos apresentados e,
assim, alguns aminoácidos podem ser tanto glicogênicos como cetogênicos.
Veja, na Figura 17.2, os pontos de entrada dos aminoácidos glicogênicos
e cetogênicos nas rotas metabólicas.
serem utilizados como fonte de energia, perdem seus grupamentos amino
e são convertidos em intermediários do ciclo de Krebs e que a amônia
pode ser convertida em uréia para ser eliminada. Na realidade, a amônia
pode ser eliminada como amônia nos animais aquáticos, como ácido
úrico em aves e répteis e como uréia em muitos vertebrados terrestres.
Assim, daremos prosseguimento à nossa aula, apresentando inicialmente
as formas de transferência do grupamento amônia (NH3) e em seguida o
processo de formação da uréia, que será aprofundado na Aula 18.
Os aminoácidos da dieta são a principal fonte de grupos amino;
a maioria é metabolizada no fígado. Alguma amônia gerada nesse
processo é reciclada e usada em diversas vias biossintéticas. O excesso
é eliminado como uréia, amônia ou ácido úrico. O excesso de amônia
gerado em outros tecidos também é transportado para o fígado para ser
convertido em sua forma de excreção. Para entendermos o mecanismo
de oxidação dos aminoácidos, devemos considerar alguns aspectos
importantes que serão abordados de forma integrada; no entanto, você
deverá ler com atenção os tópicos destacados nas caixas laterais, para
fixá-los separadamente. Abordaremos os seguintes pontos:
1. A importância das transaminases e a formação do glutamato.
2. O papel da glutamina no processo de desintoxicação.
3. A importância da alanina para o transporte de grupamentos amino
gerados pelo catabolismo dos aminoácidos em tecidos extra-hepáticos,
como os músculos.
Glutamato e glutamina têm um papel crítico no metabolismo
do nitrogênio. A maioria dos grupamentos NH3 dos aminoácidos é
GLICOGÊNICOS
Os esqueletos
carbônicos dos
aminoácidos
glicogênicos
são degradados
em piruvato ou
intermediários, de
4 e 5 carbonos,
do ciclo de Krebs.
Os aminoácidos
glicogênicos são as
principais fontes
de carbono da
gliconeogênese
quando os níveis de
glicose caem. Eles
podem ser degradados
para produzir energia
ou ser convertidos em
glicogênio ou ácidos
graxos para estocar
energia.
AMINOÁCIDOS
CETOGÊNICOS
Os esqueletos
de carbonos dos
aminoácidos
cetogênicos são
degradados em acetilCoA e acetoacetato.
O esqueleto carbônico
dos aminoácidos
cetogênicos pode ser
catabolizado para a
produção de energia
ou ser convertido a
corpos cetônicos ou
ácidos graxos.
transferida para o alfa-cetoglutarato, formando o íon glutamato. O íon
glutamato é então transportado para a mitocôndria, onde o grupamento amino é removido para
formar o íon amônio (NH4+).
O excesso de amônia gerado em outros tecidos é convertido em grupamento amida da
glutamina, a qual passa para o citosol dos hepatócitos e desse para a mitocôndria do hepatócito.
Na maioria dos tecidos, glutamina ou glutamato ou ambos estão presentes em concentrações
maiores do que qualquer outro aminoácido.
No músculo, o excesso de grupamentos amino gerado é transferido para o piruvato,
formando alanina, uma outra molécula importante para o transporte de grupamentos amino
para o fígado. A transferência de grupamentos amino é catalisada por enzimas denominadas
aminotransferases ou transaminases. Observe um exemplo genérico dessas reações na Figura 17.3.
As transaminases apresentam outros papéis, que são destacados na caixa lateral.
CEDERJ 87
17 MÓDULO 5
AMINOÁCIDOS
AULA
Até este ponto da aula você aprendeu que os aminoácidos, para
BIOQUÍMICA II | A oxidação dos aminoácidos e a produção de uréia
DESAMINAÇÃO
DE AMINOÁCIDOS
Além de equilibrar os
grupamentos amino
entre α-cetoácidos,
as transaminases
recolhem o
grupamento amino
do excesso de
aminoácidos da dieta
e transferem para
aqueles aminoácidos
que podem ser
desaminados, como
por exemplo o
glutamato.
O esqueleto de
carbonos dos
aminoácidos,
que podem ser
desaminados, pode
ser catabolizado para
obter energia ou ser
usado para a síntese
de glicose ou ácidos
graxos para estocar
energia.
Somente alguns
aminoácidos podem
ser desaminados
diretamente.
Figura 17.3: Reação catalisada por uma transaminase ou
aminotransferase – enzimas que catalisam a transferência
reversível de um grupo amino entre dois α-cetoácidos.
Transaminases são enzimas que transferem grupamentos amino de
aminoácidos para α-cetoácidos.
Essas enzimas equilibram os grupamentos amino entre os α-cetoácidos.
Elas permitem a síntese de aminoácidos não-essenciais a partir de outros
aminoácidos. Assim, o balanço entre diferentes aminoácidos é mantido, e
várias proteínas podem ser sintetizadas.
A Figura 17.4 mostra como os amino grupos da alanina e do ácido
aspártico são transferidos para o α-cetoglutarato para formar glutamato.
Nessa reação, o piruvato produzido fornece carbonos para formar glicose
(gliconeogênese, você verá na Aula 30) ou pode ser descarboxilado a
acetil-CoA (Aula 14) para entrar no ciclo de
A
Krebs e gerar energia. A transaminação é a
reação mais comum envolvendo aminoácidos;
somente dois aminoácidos, lisina e treonina,
não participam de reações de transaminação.
Observe novamente a Figura 17.4 e note que
o par α-cetoglutarato e glutamato está sempre
presente; o que muda é o aminoácido a ser
transformado e, conseqüentemente, o novo α-
B
cetoácido formado.
Figura 17.4: A) Reação catalisada pela alanina
aminotransferase; B) Reação catalisada pela aspartato
aminotransferase. Observe em A que a alanina
doa seu grupamento amino sendo convertida no
α-cetoácido, o piruvato; em B o aspartato doa seu
grupamento amino sendo convertido no α-cetoácido,
o oxaloacetato; em ambas as reações o α-cetoglutarato recebe o grupamento amino, tornando-se o
aminoácido glutamato.
88 CEDERJ
17 MÓDULO 5
AULA
Assim, por exemplo, no caso da alanina o produto formado é o piruvato;
se o aminoácido for o ácido aspártico, na forma de aspartato, o produto
gerado será o oxaloacetato.
As transaminases são enzimas que apresentam como co-fator
o grupamento piridoxal fosfato, a forma funcional da vitamina B6. O
sítio ativo das transaminases contém piridoxal fosfato associado, por uma
ligação covalente, ao grupo ε-amino do aminoácido lisina, denominado
base de Schiff. É esse grupamento que se encarrega de transportar o
grupamento NH3 dos aminoácidos. A Figura 17.5 (letras “A”a“D”)
apresenta o esquema de formação da base de Schiff e do mecanismo de
reação catalisado por transaminases, o primeiro passo para o catabolismo
da maioria dos aminoácidos.
B
A
Figura 17.5: A) Estrutura do piridoxal
fosfato – O grupo prostético das
transaminases é o piridoxal fosfato
(PLP), um derivado da vitamina B6.
C
Figura 17.5: B) Enzima (Lys) – PLP – No
estado de repouso, o grupamento aldeído
do piridoxalfosfato está ligado ao grupamento ε-amino do resíduo de lisina da
transaminase.
D
Figura 17. 5: Aminoácido – PLP na forma de uma base de Schiff – C) O α-amino grupo do
substrato aminoácido desloca lisina da enzima, para formar uma base de Schiff com o PLP.
D) Esse tipo de ligação promove a posterior hidrólise, liberando o α-cetoácido derivado do
aminoácido, o piridoxal fosfato é convertido em uma piridoxaminafosfato.
CEDERJ 89
BIOQUÍMICA II | A oxidação dos aminoácidos e a produção de uréia
FUNÇÃO
Como vimos até aqui, o glutamato atua como o transportador da
DA
ENZIMA
amônia de muitos aminoácidos para o fígado. Como os amino grupos
L - G L U TA M AT O
do glutamato são removidos para serem excretados?
DESIDROGENASE
Retirar do
aminoácido glutamato
o íon amônio (NH3),
proveniente de
diversos aminoácidos,
para que amônia
tóxica seja utilizada
na formação da uréia.
Nos hepatócitos, o glutamato é transportado do citosol para
as mitocôndrias, onde sofre uma desaminação oxidativa (retirada do
grupamento amônia com perda de hidrogênios), catalisada pela ENZIMA
L-GLUTAMATO
+
DESIDROGENASE.
Em mamíferos, essa enzima pode utilizar
+
tanto NAD como NADP como aceptor de equivalentes redutores.
A reação catalisada pela L-glutamato desidrogenase é apresentada na
Figura 17.6.
MECANISMOS
POSTULADOS
PA R A A
TOXICIDADE DA
AMÔNIA
1 - Altas
concentrações de
amônia deslocam o
equilíbrio da reação
catalisada pela
glutamina sintetase no
sentido de formação
de glutamina. Isso
leva a um consumo
aumentado do
glutamato, um
neurotransmissor
e precursor para a
síntese de um outro
neurotransmissor, o
ácido gama-amino
butírico (GABA).
2 - O consumo de
glutamato e altas
concentrações de
amônia poderiam
deslocar o equilíbrio
da reação catalisada
pela glutamato
desidrogenase no
sentido reverso,
ou seja, no sentido
de consumir αcetoglutarato, um
intermediário essencial
para o ciclo de
Krebs. Isso limita o
metabolismo
energético do cérebro.
90 CEDERJ
Figura 17.6: Reação catalisada pela glutamato desidrogenase. A glutamato desidrogenase remove os grupamentos N do pool de aminoácidos.
Ela é uma das poucas enzimas que podem utilizar tanto NAD+ como
NADP+ como aceptor de elétrons.
A amônia é muito tóxica para o tecido animal. Em muitos animais
ela é convertida em componentes não-tóxicos antes de ser exportada dos
tecidos extra-hepáticos para o sangue, para ser levada para os rins ou
fígado. Novamente o glutamato é crítico nessa etapa. Ele recebe mais
um grupamento amino, sendo convertido em glutamina, a qual exerce
essa função de transporte. Observe que, nesse caso, houve a formação
de uma amida. Vale ressaltar que a amônia, gerada em muitos tecidos,
como o cérebro, por exemplo, pode ser produzida pelo metabolismo de
outras moléculas, como os nucleotídeos. A enzima que combina a amônia
livre com o glutamato para formar a glutamina é a glutamina sintetase.
Essa reação requer ATP (já que é uma reação de síntese, onde ligações
químicas são formadas) e ocorre em duas etapas. Veja a Figura 17.7.
17 MÓDULO 5
AULA
glutamato
Figura 17.7: Reação catalisada pelas enzimas glutamina sintetase e glutaminase. As duas primeiras
etapas são catalisadas pela enzima glutamina sintetase. Observe que há consumo de ATP na primeira.
A terceira etapa é catalisada pela enzima glutaminase.
CEDERJ 91
BIOQUÍMICA II | A oxidação dos aminoácidos e a produção de uréia
FUNÇÃO
DA
A glutamina não só transporta a amônia para ser eliminada como
ENZIMA
também pode ser usada como fonte de amônia para reações biossintéticas.
G L U TA M I N A
O nitrogênio na forma de amida é liberado como amônia por uma enzima
S I N T E TA S E
Introduzir um
grupamento NH3 no
aminoácido glutamato
para sintetizar o
aminoácido glutamina.
Esta reação ocorre para
reduzir a concentração
da amônia livre.
FUNÇÃO
DA
ENZIMA
G L U TA M I N A S E
Retirar a amônia
que estava sendo
transportada pela
glutamina. Essa reação
ocorre para alimentar
vias biossintéticas e para
alimentar o ciclo da
uréia.
denominada glutaminase (Figura 17.7), que está presente somente no
fígado e no rim. No fígado, essa enzima fornecerá o íon amônio (NH4+)
para alimentar o ciclo da uréia. O íon amônio liberado nos rins pela
ação da glutaminase não é transportado pelo sangue nem é convertido
em uréia, ele é eliminado diretamente na urina.
Devemos ressaltar ainda a importância do aminoácido alanina
no transporte de grupamentos NH3. O músculo, ao degradar uma de
suas reservas energéticas, o glicogênio, produz glicose. Esta por sua vez
é degradada a piruvato para produzir energia. Esse assunto foi abordado
nas Aulas de 9 a 11. O piruvato é uma molécula que pode ser utilizada
para regenerar glicose. Esse processo ocorre no fígado. Por outro lado,
o músculo degrada também proteínas, gerando aminoácidos. Uma
solução econômica, para transportar tanto o piruvato quanto a amônia
dos aminoácidos gerados nos músculos para o fígado, é sintetizar o
aminoácido alanina a partir desses componentes. Veja um resumo dessas
informações no ciclo glicose-alanina, apresentado na Figura 17.8.
92 CEDERJ
17 MÓDULO 5
AULA
Figura 17.8: Ciclo glicose-alanina. A alanina atua como um carreador de amônia e de esqueletos de carbonos do
piruvato dos músculos para o fígado. A amônia é excretada e o piruvato é reutilizado para formar glicose, a qual
retorna ao músculo.
RESUMO
• A amônia é extremamente tóxica para o organismo e, portanto, deve ser
eliminada.
• A amônia, apesar de solúvel em meio aquoso, por ser tóxica para o organismo,
não pode ser transportada livremente pelo sangue.
• Para ter sua toxicidade reduzida, o grupamento NH3 dos aminoácidos é
transportado associado ao α-cetoglutarato, formando o glutamato. Essa etapa é
catalisada por enzimas denominadas transaminases.
• O excesso de íons amônio é associado ao íon glutamato, formando o aminoácido
glutamina pela ação da enzima glutamino sintetase.
CEDERJ 93
BIOQUÍMICA II | A oxidação dos aminoácidos e a produção de uréia
• Os grupamentos NH3 provenientes do catabolismo dos aminoácidos das
proteínas musculares podem ser transferidos para o piruvato, composto gerado
pela degradação de glicose, formando o aminoácido alanina. A alanina é então
transportada para o fígado e lá pode liberar o íon amônio, que será convertido
em uréia e eliminado na urina, enquanto o esqueleto de carbonos poderá ser
reutilizado para formar glicose.
EXERCÍCIOS
1. Faça uma distinção entre aminoácidos essenciais e aminoácidos não-essenciais.
Indique os principais pontos de entrada desses aminoácidos no ciclo de Krebs.
2. O que são aminoácidos glicogênicos e cetogênicos? Dê exemplos.
3. Represente reações catalisadas por transaminases, glutamato desidrogenase,
glutamina sintetase. Escreva sobre a importância de cada uma dessas enzimas.
4. Pesquise, em outras fontes, razões que expliquem a toxicidade dos íons amônia.
5. Pense no tipo de alimento e no ambiente em que vivem os peixes, aves e
mamíferos e procure responder: por que esses animais eliminam a amônia de
diversas maneiras, ou seja, peixes como amônia; aves como ácido úrico; mamíferos
como uréia?
INFORMAÇÃO SOBRE A PRÓXIMA AULA
Na próxima aula, nós detalharemos o processo de desintoxicação da amônia que
ocorre em mamíferos e em muitos outros animais vertebrados; nós estudaremos
a formação da uréia que ocorre em um processo cíclico e, portanto, denominado
“ciclo da uréia”.
94 CEDERJ
objetivo
AULA
Ciclo da uréia
18
Ao final desta aula, você deverá ser capaz de:
• Entender as etapas de formação da uréia.
Pré-requisito
Conhecimentos adquiridos na Aula 17.
BIOQUÍMICA II | Ciclo da uréia
INTRODUÇÃO
Na Aula 17, você aprendeu que a amônia é um composto tóxico e que precisa
ser eliminada pelo organismo. Vimos que em vários animais o produto de
excreção é a uréia. Na aula anterior, foram apresentadas algumas reações
para a canalização de íons amônio, de diversos aminoácidos, até o fígado,
local onde o processo de desintoxicação ocorre. Falamos da importância das
reações de transaminação, desaminação oxidativa e do transporte da amônia
na forma de alanina e glutamina. Nesta aula, discutiremos sobre as reações de
formação da uréia, o principal produto final do catabolismo do nitrogênio, no
homem. Um indivíduo humano consome em torno de 300g de carboidratos,
100g de gordura e 100g de proteínas, diariamente; excreta cerca de 16,5g
de nitrogênio, sendo 95% na urina e 5% nas fezes. A uréia pode constituir
cerca de 90% do nitrogênio excretado. O ciclo da uréia e o ciclo dos ácidos
tricarboxílicos (TCA) foram descobertos por Hans Krebs e colaboradores. De
fato, o ciclo da uréia foi descrito antes do ciclo TCA. Em mamíferos, o ciclo da
Figura 18.1: Estrutura da
uréia.
uréia é o mecanismo de escolha para a excreção de amônia. Veja a estrutura
da uréia na Figura 18.1.
VISÃO GERAL DO PROCESSO DE SÍNTESE DA URÉIA
A síntese de 1 mol de uréia requer 4 moles de ATP. Os dois
nitrogênios de uma molécula de uréia (Figura 18.1) são derivados de duas
fontes: amônia livre e amino grupo do aspartato. Cinco enzimas catalisam
o processo de formação da uréia. Seis aminoácidos são intermediários
do ciclo. Alguns deles você já conhece: arginina e aspartato. Citrulina,
ornitina e argino-succinato não são aminoácidos protéicos; existem
somente como aminoácidos livres no organismo. N-acetil glutamato
funciona somente como um ativador enzimático. Os outros funcionam
como carreadores dos átomos que finalmente formam a uréia.
A amônia, primeira fonte de nitrogênio, entra no ciclo após a
condensação com o bicarbonato para formar carbamoil-fosfato, o qual
reage com a ornitina para formar citrulina. O aspartato, segundo doador
de nitrogênio para formar uréia, reage com a citrulina para formar arginosuccinato, o qual é clivado para formar arginina e fumarato. A arginina
é hidrolisada para formar uréia e regenerar a ornitina. Como veremos,
a biossíntese da uréia é um processo cíclico, ou seja, um dos compostos (a
ornitina) é consumido em uma reação e é regenerado em outra (reações 2
e 5, respectivamente, conforme apresentaremos mais adiante, nesta aula).
96 CEDERJ
18 MÓDULO 5
AULA
Não há perda ou ganho efetivo de ornitina, de citrulina, argino-succinato
e arginina. Todavia, íon amônio, CO2, aspartato e ATP são consumidos.
Algumas reações da síntese da uréia ocorrem na mitocôndria, enquanto
outras ocorrem no citosol. A uréia é então transportada para o rim e
eliminada na urina.
REAÇÕES DO CICLO DA URÉIA
1a reação: síntese do carbamoil-fosfato
A biossíntese da uréia começa com a condensação do dióxido de
carbono, com a amônia, utilizando ATP para formar carbamoil-fosfato.
Tal reação é catalisada pela carbamoil-fosfato sintase I (Figura 18.2).
A formação de carbamoil-fosfato requer dois moles de ATP.
Um ATP ativa o bicarbonato e o outro doa o grupo fosfato para formar
o carbamoil-fosfato. A carbamoil-fosfato sintase I ocorre na matriz
mitocondrial, usa amônia como doador de nitrogênio e é absolutamente
dependente de N-acetil glutamato para a sua atividade.
A ação conjugada da glutamato desidrogenase e da carbamoil-
!
Se você tiver dúvidas sobre
composto rico em energia,
releia as Aulas 1 e 2.
fosfato sintase I forma um intermediário com alto potencial de
transferência de grupo, ou seja, um composto rico em energia.
A síntese do carbamoil-fosfato, aparentemente
complexa, ocorre em etapas, como descrito a seguir. Na
primeira etapa, ocorre a reação do bicarbonato com o
ATP formando o carbonil-fosfato e ADP. Na segunda
etapa, a amônia desloca o ADP, formando carbamato
e ortofosfato. Finalmente, ocorre a fosforilação do
carbamato pelo segundo ATP, formando o carbamoilfosfato. A carbamoil-fosfato sintase I é a enzima do
ciclo da uréia, limitante da velocidade, ou marcapasso.
Essa enzima regulatória é ativa somente na presença do
ativador alostérico N-acetil-glutamato, cuja ligação induz
uma mudança conformacional, que aumenta a afinidade
da enzima pelo ATP. Veja a Figura 18.2.
Figura 18.2: Reação catalisada pela carbamoil-fosfato sintase tipo I. A enzima
catalisa a reação em três etapas.
CEDERJ 97
BIOQUÍMICA II | Ciclo da uréia
2a reação: carbamoil-fosfato mais ornitina formam a citrulina
A síntese da citrulina ocorre na mitocôndria e é catalisada pela
L-ornitina transcarbamoilase. Esta enzima catalisa a transferência do
grupo carbamoil-fosfato para a ornitina, e com isso forma a citrulina.
Nesta reação, ocorre a liberação de fosfato inorgânico (Pi). Observe a
etapa 2 da Figura 18.3. A citrulina é transportada da mitocôndria para o
citosol, onde ocorrem as outras reações do ciclo. A citrulina, o composto
utilizado nesta reação, foi formada no citosol e de lá foi transportada para
a mitocôndria. Tanto a entrada da ornitina para a mitocôndria quanto a
saída da citrulina da mesma mitocôndria, portanto, envolvem sistemas
de transporte pela membrana interna mitocondrial (Figura 18.4).
Figura 18.3: Ciclo da uréia.
A reação 1, catalisada pela carbamoil-fosfato sintase I, foi apresentada na figura
anterior. As outras reações encontram-se enumeradas de 2 a 5; a reação 2 ocorre
na mitocôndria e é catalisada pela ornitina transcarbamilase; as reações de 3 a
5 ocorrem no citosol e são catalisadas pelas enzimas do citosol: respectivamente
arginino-succinato sintase; arginino succinase; arginase.
98 CEDERJ
3a reação: citrulina mais aspartato formam argino-succinato
A 3a reação é catalisada pela argino-succinato sintase, que liga
o aspartato à citrulina, via aminogrupo do aspartato (Figura 18.3),
e fornece o segundo nitrogênio. Tal reação requer ATP e envolve a
formação intermediária de citrulil-AMP. O deslocamento subseqüente
do AMP pelo aspartato, então, forma o argino-succinato. Esta é uma
reação de condensação, onde a argino-succinato sintase requer a hidrólise
de um ATP, o qual é hidrolisado em adenosina monofosfato (AMP) mais
pirofosfato inorgânico (Ppi).
4a reação: a clivagem do argino-succinato forma arginina
e fumarato
A clivagem do argino-succinato, catalisada pela argino-succinase,
retém nitrogênio no produto arginina e libera o esqueleto aspartato
como fumarato (Figura 18.3). A adição de água ao fumarato forma
o L-malato, e a oxidação subseqüente do malato, uma reação NAD+
dependente, forma o oxaloacetato. Essas duas reações, embora análogas
às do ciclo de Krebs (Aula 14), são catalisadas pela fumarase e pela
malato desidrogenase citosólicas. A transaminação do oxaloacetato pelo
glutamato, então, forma novamente o aspartato. O esqueleto carbônico,
tanto de aspartato como de fumarato, atua como um carreador no
transporte de nitrogênio do glutamato para um precursor da uréia.
CEDERJ 99
18 MÓDULO 5
AULA
Figura 18.4:
Transporte de citrulina e de ornitina.
Em cada ciclo, a citrulina deixa a
mitocôndria e a ornitina entra na
matriz mitocondrial. Proteínas carreadoras presentes na membrana interna
mitocondrial facilitam o fluxo transmembrana de citrulina e de ornitina.
BIOQUÍMICA II | Ciclo da uréia
5a reação: a clivagem da arginina libera uréia e regenera
ornitina
A reação final do ciclo da uréia, a clivagem hidrolítica do grupo
guanidino da arginina, catalisada pela arginase hepática, libera uréia.
O outro produto, a ornitina, torna a penetrar na mitocôndria hepática,
para participar das etapas adicionais do ciclo da uréia. Veja a etapa 5
da Figura 18.3. Quantidades menores de arginase também ocorrem no
tecido renal, no cérebro, nas glândulas mamárias e na pele.
Regulação da síntese de uréia
A carbamoil-fosfato sintetase requer N-acetil glutamato como
ativador alostérico. Este composto é sintetizado a partir do glutamato
e do acetil-CoA, pela enzima N-acetil glutamato sintetase, a qual, por
sua vez, é ativada por arginina. Acetil-CoA, glutamato e arginina são
necessários para fornecer intermediários ou energia para o ciclo da
uréia, e a presença de N-acetil-glutamato indica que todos eles estão
disponíveis.
A indução das enzimas do ciclo da uréia ocorre (10 a 20
vezes) quando a liberação de amônia ou de aminoácidos para o
fígado aumenta. A concentração dos intermediários também tem um
papel importante nessa regulação. Um alto teor de proteínas na dieta
(excesso de fornecimento de aminoácidos), bem como situações de
jejum (aumento da degradação de proteínas endógenas) resultam na
indução de enzimas do ciclo da uréia.
100 CEDERJ
18 MÓDULO 5
AULA
RESUMO
• A maioria dos animais terrestres converte o excesso de nitrogênio em uréia
antes de excretá-lo.
• A uréia é menos tóxica do que a amônia.
• O ciclo da uréia ocorre principalmente no fígado.
• Os dois átomos de nitrogênio entram no ciclo da uréia como NH3, produzido
principalmente pela glutamato desidrogenase e como N do aspartato.
• A amônia (NH3) e o bicarbonato (HCO3-) que irão formar a uréia são incorporados
inicialmente ao carbamoil-fosfato.
• O ciclo da uréia é composto por cinco reações.
• A biossíntese da uréia é um processo cíclico, ou seja, um dos compostos (a ornitina)
é consumido no início do processo e é regenerado na última reação. Não há perda
ou ganhos efetivos de ornitina, de citrulina, argino-succinato e arginina.
• O íon amônio, o CO2, o aspartato e ATPs são consumidos.
• Algumas reações da síntese da uréia ocorrem na mitocôndria, enquanto outras
ocorrem no citosol.
• A uréia é formada no fígado, transportada para o rim e eliminada na urina.
EXERCÍCIOS
1. Que composto formado no ciclo da uréia pode ser utilizado no ciclo de Krebs?
2. Explique a razão pela qual são consumidas moléculas de ATP no processo de
formação da uréia.
3. Pesquise algumas explicações para que os animais tenham escolhido diferentes
compostos para eliminar o “nitrogênio tóxico”: amônia em animais aquáticos;
uréia em vertebrados e na maioria dos animais terrestres; ácido úrico em aves.
4. Faça um resumo das reações do ciclo da uréia.
CEDERJ 101
objetivos
Ao final desta aula, você deverá ser capaz de:
• Conhecer alguns erros do metabolismo geral
dos aminoácidos e suas conseqüências.
• Conhecer experiências que permitam
demonstrar que a uréia é sintetizada no fígado,
que os aminoácidos fornecem nitrogênio
para a molécula de uréia, que a partir dos
aminoácidos se forma a amônia e a partir da
amônia é sintetizada a uréia.
• Analisar criticamente os resultados obtidos
em experiências realizadas ao longo do século
passado sobre o ciclo da uréia, relacionando-os.
• Explicar mudanças na atividade das
transaminases no soro, relacionando-as com
possíveis lesões celulares hepáticas, cardíacas e
erros metabólicos.
AULA
Metabolismo
de aminoácidos
19
BIOQUÍMICA II | Metabolismo de aminoácidos
INTRODUÇÃO
Na última aula, vimos os principais caminhos pelos quais o esqueleto
carbonado de aminoácidos pode ser obtido e como o nitrogênio é excretado
em mamíferos. Agora, conheceremos alguns defeitos metabólicos relacionados
ao ciclo da uréia e suas conseqüências. Ao final, apresentaremos uma série
de temas para discussão. Estes temas são importantes, pois reproduzem
vários experimentos científicos a partir dos quais você entenderá como o
ciclo da uréia foi descoberto e por que o metabolismo de aminoácidos é tão
importante. Como em aulas anteriores, o conteúdo das discussões não é
Figura 19.1: Você sabe o
que é o teste do pezinho
e o que ele tem a ver com
o metabolismo de aminoácidos? Veja em: http:
//www.yourgenesyourh
ealth.org/ygyh/mason/
gyh.html.syndrome=pku
essencial para se entender o ciclo da uréia ou os erros inatos do metabolismo.
É apenas uma oportunidade de refletir e pensar sobre o universo científico,
sua lógica e suas histórias.
ERROS INATOS DO METABOLISMO DE AMINOÁCIDOS E
SUAS CONSEQÜÊNCIAS
Desordens do ciclo da uréia
A ausência completa de qualquer uma das enzimas do ciclo da
uréia resulta na morte do indivíduo pouco tempo após o seu nascimento.
Entretanto, em indivíduos vivos, têm sido identificados quadros clínicos
Figura 19.2: Recém-nascidos são vítimas preferenciais das desordens
do ciclo da uréia, que
podem acarretar danos
cerebrais ou mesmo levar
à morte.
que resultam da deficiência dessas enzimas, quer seja por uma redução
no nível de expressão, quer seja por uma alteração na atividade. Essas
deficiências são chamadas desordens do ciclo da uréia ou simplesmente
DCUs, erros inatos do metabolismo. Em geral esses erros são doenças
raras, mas representam causa substancial de danos cerebrais e morte entre
recém-nascidos e crianças. A estimativa exata da incidência de DCUs
é desconhecida e, provavelmente, subestimada, pois ainda hoje existe
grande dificuldade em diagnosticar tais desordens, e muitas crianças
morrem antes de um diagnóstico definitivo.
104 CEDERJ
19 MÓDULO 5
AULA
Os sintomas aparecem nas primeiras 24 horas de vida. O recémnascido mostra-se inicialmente irritado e, a seguir, aparecem vômitos
e um aumento da letargia. Logo depois, observa-se hipotonia (tônus
muscular deficiente) e angústia respiratória que podem levar ao coma.
Em alguns casos, os sintomas podem aparecer tardiamente durante a
infância ou mesmo durante a vida adulta.
Existem sete principais DCUs. Cada uma delas recebe uma
denominação relacionada às iniciais da enzima deficiente. Assim:
• CPS- deficiência na carbamoil-fosfato sintetase.
• NAGS- deficiência na N-acetilglutamato sintetase.
• OTC- deficiência na ornitina transcarbamilase.
• AS- deficiência na ácido arginino-succínico sintetase (citrulinemia).
• AL/ASA- deficiência na arginino-succinato liase (arginino-succínico
aciduria).
• AG- deficiência na arginase.
• AO- deficiência na ornitina aminotransferase.
As deficiências são, quase todas, conhecidas como hiperamonemias, porque o diagnóstico detecta um alto nível de amônia no sangue.
Isso não ocorre apenas no caso da deficiência de ornitina aminotransferase.
Na página http://www3.ncbi.nlm.nih.gov/Omim/searchomim.html você
pode entrar com o nome da doença genética (em inglês) e ver sintomas,
características metabólicas e diagnóstico laboratorial. Esse é um banco de
dados do National Center for Biotechnology Information. Neste centro
de informações, você pode acessar o Online Mendelian Inheritance in
Man da Johns Hopkins University. Dê uma olhada quando puder.
CEDERJ 105
BIOQUÍMICA II | Metabolismo de aminoácidos
Veja na Tabela 19.1, um resumo de algumas dessas desordens.
Tabela 19.1: Principais DCUs.
DCU
Enzima Deficiência
Sintomas/Comentários
Hiperamonemia do
tipo I - CPS
Carbamoil-fosfato
sintetase I
24h - 72h após o nascimento o recém-nascido torna-se letárgico,
necessitando de estímulo para comer, apresentando vômito,
aumento da letargia, hipotermia e hiperventilação; o recémnascido irá morrer caso não ocorra o diagnóstico por medidas
do nível de amônia sérica e intervenção apropriada: tratamento
com arginina que ativa N-acetilglutamato sintetase.
Deficiência de Nacetilglutamato
sintetase - NAGS
N-acetilglutamato
sintetase
Hiperamonemia severa; hiperamonemia suave associada com
coma profundo, acidose, diarréia recorrente, ataxia, hipoglicemia, hiperornitinemia. Tratamento inclui administração de
carbamoil-glutamato para ativar a CPS.
Hiperamonemia do
Tipo 2 - CPS
Ornitina transcarbamilase
A DCU mais comum é ligada ao cromossomo X. Níveis de amônia
e aminoácidos elevados no soro; aumento do ácido orótico no
soro devido ao carbamoil-fosfato mitocondrial ser liberado no
citoplasma e incorporado em nucleotídeos do tipo pirimidina,
o que leva a um excesso de produção de produtos catabólicos.
Tratamento com dieta rica em carboidratos e pobre em proteínas; detoxificação de amônia com fenilacetato de sódio ou
benzoato de sódio.
Citrulinemia
clássica - AS
Arginino-succinato
sintetase
Hiperamonemia episódica, vômito, letargia, ataxia, convulsão,
coma eventual. Tratamento com administração de arginina para
aumentar a excreção de citrulina e também com benzoato de
sódio para detoxificação de amônia.
Arginino-succínico
acidúria - AL/ASA
Arginino-succinato
liase (argininosuccinase)
Sintomas episódicos similares à citrulinemia clássica; níveis de
argino-succinato elevados no plasma e fluido espinhal cerebral.
Tratamento com arginina e benzoato de sódio.
HiperargininemiaAG
Arginase
DCU rara, quadriplegia progressiva e retardo mental; alto
nível de amônia e arginina no fluido espinhal e no soro; altos
níveis de arginina, lisina e ornitina na urina. Tratamento inclui
dieta de aminoácidos essenciais, excluindo arginina e dieta
pobre em proteínas.
Neurotoxicidade associada à amônia
Os efeitos do aumento dos níveis de amônia circulante são vários.
A alteração do pH do sangue é apenas um deles. Mas, o mais importante
é que a amônia pode atravessar a barreira hematoencefálica (BHE).
No cérebro, ela pode ser convertida em glutamato, por ação da enzima
Figura 19.3: A barreira
hematoencefálica (BHE).
glutamato desidrogenase. Entretanto, essa ação “depleta”, ou seja, faz
com que o cérebro perca substâncias importantes como α-cetoglutamato,
o substrato da enzima. Como conseqüência deste fato, há uma diminuição
dos níveis de oxaloacetato e uma queda drástica na atividade do ciclo do
ácido cítrico. Você pode imaginar o que isso significa para o cérebro?...
A queda da atividade respiratória causa sérios e irreparáveis danos aos
tecidos neurais, levando-os à morte. Além disso, o excesso de glutamato
106 CEDERJ
19 MÓDULO 5
AULA
posteriormente ativa a formação de glutamina. Isso resulta numa queda
da concentração dos estoques de glutamato. O glutamato é, no tecido
neural, um neurotransmissor e também um substrato para a síntese de
outro neurotransmissor, o γ-aminobutirato.
Fenilcetonúria (PKU)
Além dos erros inatos ligados diretamente às enzimas do ciclo da
uréia, algumas outras doenças genéticas são conseqüências de outras
Figura 19.4: Fenilcetonúria é a incapacidade
de converter fenilalanina
em tirosina.
alterações no metabolismo de aminoácidos. A fenilcetonúria (PKU) é
uma delas, que se caracteriza por uma inabilidade do corpo de utilizar
o aminoácido essencial, fenilalanina. A PKU ocorre quando a criança
herda dois genes mutantes para a enzima fenilalanina hidroxilase
(PAH). Essa enzima, normalmente, converte moléculas de fenilalanina
em tirosina. Tal reação usa O2 como substrato e requer o co-fator tetrahidrobiopterina (THB) como agente redutor. Fenilalanina é hidroxilada
produzindo tirosina, enquanto o THB transfere átomos de hidrogênio
Figura 19.5: A estrutura
da fenilalanina hidroxilase (PAH).
para reduzir um segundo átomo de hidrogênio em água. No processo,
o THB é oxidado a diidrobiopterina (DHB).
!
Sem esta enzima, a fenilalanina e os produtos de sua
Uma das causas do autismo
é a PKU não tratada!
Para saber mais sobre
autismo, ver
h t t p : / / w w w. a u t i s m society.org
quebra por outra rota enzimática se acumulam no sangue
e nos tecidos do corpo. Um aumento na concentração
de fenilalanina no sangue leva à sua transaminação em
fenilpiruvato ou descarboxilação a feniltilamina.
Figura 19.6: Estrutura da
biopterina, co-fator da PAH.
CEDERJ 107
BIOQUÍMICA II | Metabolismo de aminoácidos
Uma deficiência da fenilalanina hidroxilase causa acúmulo de
fenilalanina, de ácido fenilpirúvico, de fenilacetato e outros derivados. Um
excesso de fenilalanina bloqueia o
seqüestro de outros aminoácidos
no cérebro. O ácido fenilpirúvico
inibe a piruvato descarboxilase no
cérebro e interfere na formação
de mielina.
A inabilidade de remover
o excesso de fenilalanina do
sangue, e o conseqüente acúmulo
daqueles produtos durante a infância, produz uma variedade de problemas, incluindo o retardo
mental. Felizmente, um teste simples (o teste do pezinho) feito logo após o nascimento pode
identificar esse defeito genético e, com muita atenção à quantidade de fenilalanina em sua dieta,
a criança pode desenvolver-se normalmente.
Fenilalanina
Figura 19.7: Produtos catabólicos da fenilalanina que
são acumulados na fenilcetonúria.
108 CEDERJ
A seguir apresentaremos alguns temas para você pensar em
casa e discutir com seus colegas ou com seu tutor no pólo. Vários
dos experimentos que serão apresentados são parte da história que
nos levou ao conhecimento mostrado, nas aulas anteriores, sobre o
metabolismo de aminoácidos. A idéia dessas discussões, como você já
sabe, é desenvolver a lógica e o pensamento científico. Encare como
um quebra-cabeça e então, divirta-se...
Figura 19.8: Cães foram
e são até hoje utilizados
para experimentos como
este apresentado na
questão.
Tema 1. Suponha uma população de animais que requerem fenilalanina
na dieta, mas não requerem tirosina para o seu crescimento normal. Antes
do início da experiência, eles foram mantidos com uma dieta carente em
tirosina e fenilalanina.
1.1. Desenhe as curvas que você esperaria encontrar, mostrando a
evolução do peso médio da população de animais, nos seguintes
casos:
a) Administração de uma dieta de tirosina e uma semana após uma dieta
de fenilalanina.
Para lembrar
Bioquímica I...
Sabendo-se que o ácido
glutâmico é um aminoácido e o ácido pirúvico
não, identifique quem
é quem nas duas figuras
abaixo.
b) Administração de uma dieta de fenilalanina e uma semana após,
supressão dessa dieta e administração de uma dieta de tirosina.
c) Administração dos dois aminoácidos juntos e supressão de ambos
após uma semana.
d) Administração dos dois aminoácidos juntos e supressão de fenilalanina
após uma semana.
e) Administração dos dois aminoácidos juntos e supressão de tirosina
após uma semana.
1.2. Discuta os conceitos de aminoácidos essenciais e não-essenciais,
lembrando as aulas de Bioquímica I e com base nas informações
dadas no início da questão.
CEDERJ 109
19 MÓDULO 5
Pense
sobre isso!
AULA
Temas para reflexão e discussão e um pouco da história
BIOQUÍMICA II | Metabolismo de aminoácidos
Tema 2. Incubando-se homogeneizados de diferentes tecidos com os
ácidos glutâmico e pirúvico, observa-se que:
a) O ácido glutâmico desaparece em parte, e aparece o aminoácido
alanina.
b) O ácido pirúvico também desaparece em parte, e aparece o ácido
α-cetoglutarato. A velocidade desta reação é aumentada após a adição
de fosfato de piridoxal (vitamina B6), que não é consumido durante a
reação.
2.1. Monte o esquema de reação que os dados sugerem e analise o
provável papel da vitamina B6.
2.2. A constante de equilíbrio desta reação é próxima de 1. Qual seria
a conseqüência deste fato?
Tema 3. A enzima L-glutamato desidrogenase apresenta um comportamento
alostérico, existindo em duas formas (monomérica – menos ativa, e
polimérica – mais ativa) e sendo regulada por ATP, GTP, ADP e GDP. Dois
desses moduladores são ativadores e induzem a polimerização da enzima.
3.1. Diga quais e por quê.
3.2. Faça um gráfico de velocidade enzimática, em função da concentração
de ácido glutâmico na presença e na ausência de ativador. Discutir
o papel dessa enzima na economia metabólica.
Tema 4. Qual o significado da elevação do nível de transaminases no
Figura 19.9: Estrutura
tridimensional da aspartato aminotransferase.
http://cwx.prenhall.com/
horton/medialib/media_
portfolio/17.html
soro? Faça um gráfico mostrando a evolução do nível de GTP no soro de
um paciente com hepatite, que primeiro vai melhorando e após um mês
sofre uma recaída. Discuta o papel das transaminases no metabolismo
geral dos aminoácidos.
Tema 5. Quando o fígado de um cachorro é extirpado, ele pode viver alguns
dias, desde que alimentado com uma dieta sem proteínas. No entanto,
morre rapidamente se a carne é incorporada à dieta. Na hora da morte,
ele apresenta elevadas concentrações de NH4+ no sangue e na urina e,
praticamente, nada de uréia nos mesmos líquidos biológicos. O que sugerem
estes dados? Que experiências você proporia para testar sua hipótese?
110 CEDERJ
19 MÓDULO 5
AULA
Tema 6. Observe a seqüência de resultados abaixo:
a) Entre 1894-1897, CHARLES RICHET verificou que o fígado que foi
macerado e deixado para apodrecer formava uréia, cuja quantidade
aumentava à medida que o tempo transcorria, com simultânea e notável
liberação de arginina.
b) Em 1904, Kossel e Darkin mostraram a existência de um fermento obtido
a partir de conteúdo intestinal, capaz de catalisar a reação a seguir:
c) Na mesma época, Antônio Clementi mostrou que esse fermento
(enzima) estava presente no fígado de mamíferos (nos quais a uréia é
a principal forma de excreção de nitrogênio) e ausente em pássaros e
répteis (que eliminam nitrogênio sob forma de ácido úrico).
d) Em 1917, Wilhelm Loffler mostrou que a produção de uréia estava
associada ao consumo de oxigênio no fígado.
e) Em 1931, Kase não teve êxito quando tentou produzir uréia numa
preparação acelular de fígado.
6.1. Que conclusões você tiraria dessas experiências?
Na época, embora o papel e a relevância da arginase na formação de
uréia fossem evidentes, não era quantitativamente possível acreditar que
a grande formação de uréia no fígado se processasse somente através da
hidrólise da arginina presente nas proteínas. Por outro lado, existiam
dados que indicavam que outros aminoácidos eram a fonte de uréia e
que esta podia ser sintetizada a partir de amônia.
CHARLES RICHET
Nasceu em Paris em
1850. Tornou-se
doutor em Medicina
em 1869, doutor em
Ciências em 1878 e
professor de Fisiologia
da Faculdade de
Medicina em 1887.
Ganhou o prêmio
Nobel de Medicina
em 1913.
http://www.nobel.se/
medicine/laureates/
1913/richet-bio.html
6.2. Discuta esses dados e sugira uma hipótese.
Figura 19.10: A estrutura
do ácido úrico, principal
forma de excreção de
nitrogênio em pássaros
e répteis.
CEDERJ 111
BIOQUÍMICA II | Metabolismo de aminoácidos
Tema 7. Em 1932, Hans Krebs e Kurt Henseleit fizeram um conjunto
de experiências memoráveis para testar essa hipótese. Eles incubaram
fatias de fígado num aparelho de Warburg, na presença de lactato e de
tampão bicarbonato a pH 7,4 e adicionaram quantidades conhecidas de
diferentes aminoácidos. Observaram que a produção de uréia ocorria,
como esperado, de acordo com o conteúdo de N da molécula dos
diferentes aminoácidos. No caso da arginina, no entanto, a produção
ESTEQUIOMETRIA
A palavra
estequiometria deriva
do grego stoicheon,
que significa “a
medida dos elementos
químicos”, ou seja,
as quantidades
envolvidas de cada
substância em uma
reação química. Veja
a discussão da página
http://www.cdcc.sc.
usp.br/quimica/
experimentos/
estequi.html
de uréia era superior àquela observada pela ESTEQUIOMETRIA da reação.
O que sugerem esses dados? Que experiência você faria? Pense
bem antes de passar ao ponto seguinte.
Tema 8. Numa outra experiência, o resultado foi mais surpreendente
ainda. Incubando fatias de fígado na presença de lactato, e adicionando
12mg/ml de amônia, eles encontraram uma produção de uréia de
1,94mm3 de uréia-CO2 por mg de tecido seco por hora (determinada
manometricamente após hidrólise com urease que libera CO2 e NH3).
Quando adicionaram ornitina (2mg/ml) a produção de uréia subiu para
9,32mm3.
8.1. Por que este resultado era inesperado? O que você postularia então?
8.2. Olhe agora para as moléculas de arginina e ornitina, cujas estruturas
estão na atividade 6b. Como encaixar esses resultados com os já
discutidos até agora?
8.3. Torne a olhar as moléculas de arginina e ornitina. O que você
procuraria agora? Por quê?
112 CEDERJ
19 MÓDULO 5
AULA
Tema 9. Em 1930, Mitsouri Tada chegou à fórmula de um composto
chamado citrulina, que já havia sido isolado do suco da melancia em
1924.
9.1. O que, nesta estrutura, chama a atenção?
9.2. O que você faria com esta informação, ou seja, com aquilo que lhe
chamou a atenção?
9.3. Proponha uma experiência predizendo seu resultado.
9.4. Compare agora as fórmulas da citrulina e da arginina e tire uma
nova conclusão.
9.5. Descreva o processo de formação de uréia no fígado, empregando
apenas os conhecimentos obtidos até aqui.
Tema 10. Continuando a história... Em 1954, Sarah Rathner mostrou
que, na conversão de citrulina em arginina, o nitrogênio adicionado não
era proveniente diretamente do NH4, mas de uma transferência catalisada
enzimaticamente. O grupo amino do ácido aspártico era exclusivamente
responsável por um dos nitrogênios da molécula, numa reação que
requeria ATP. Nesta reação, forma-se um composto intermediário não
fosforilado, AMP e pirofosfato (PPi), que é rapidamente hidrolisado por
uma pirofosfatase.
Em 1955, Mary Ellen Jones, Leonard Spector e FRITZ LIPMANN
mostraram que a ornitina não reagia diretamente com NH3 e CO2 para
dar citrulina, mas com o carbamil-fosfato, um intermediário fosforilado
formado a partir de NH3,CO2 e ATP.
Utilize o conhecimento adquirido até agora, para descrever
todo o processo.
FRITZ ALBERT
LIPMANN
Nasceu na Alemanha
em 1899. Cientista
e médico ganhador
do prêmio Nobel de
Fisiologia e Medicina
de 1953.
http://www.nobel.se/
medicine/laureates/
1953/lipmannbio.html
CEDERJ 113
BIOQUÍMICA II | Metabolismo de aminoácidos
RESUMO
Você viu nesta aula alguns dos erros inatos do metabolismo de aminoácidos que
levam a doenças que, em muitos casos, acarretam a morte de recém-nascidos,
crianças e adultos. A maior parte dos danos provocados por estas desordens
do ciclo da uréia é conseqüência da toxicidade dos altos níveis de amônia
(hiperamonemias), principalmente no cérebro. Nesta aula, pudemos também
discutir aspectos experimentais do ciclo da uréia, mostrando os principais pontos
da história da elucidação desta via metabólica.
Nesta aula não apresentaremos exercícios: você já usou neurônios suficientes
por ora.
114 CEDERJ
objetivo
AULAS
Degradação
de lipídeos
20/21
Ao final desta aula, você deverá ser capaz de:
• Conhecer os mecanismos e as reações envolvidas
na degradação dos ácidos graxos, em especial do
palmitato.
BIOQUÍMICA II | Degradação de lipídeos
INTRODUÇÃO
Vimos em Bioquímica I como é extenso o grupo dos lipídeos. Existem vitaminas
de natureza lipídica, como as vitaminas A, D; existem o colesterol e outros
fosfolipídeos que formam as membranas das células; existe a testosterona, as
ceras, os sais biliares, enfim, uma enorme variedade de lipídeos.
Nesta aula, vamos conhecer como os lipídeos são degradados quando nosso
organismo precisa de energia. Entretanto, ao contrário do que era de se esperar,
não são todos os lipídeos que são metabolizados com o intuito de fornecer
energia para o nosso organismo, mas sim um grupo particular de lipídeos
denominado ácidos graxos. Os ácidos graxos (AG) ficam acumulados no tecido
adiposo. Lá estão aquelas gordurinhas ou “pneuzinhos” que tanto incomodam
a gente! Quando fazemos regime e, portanto, comemos menos calorias do
que precisamos, nosso organismo vai buscar energia nas suas reservas, isto é,
nas gorduras do tecido adiposo. Estas gorduras são “quebradas” e utilizadas
como fonte de energia. Nesse caso, a gente até emagrece!
Funciona igualzinho a uma caderneta de poupança. Quando nosso salário
é menor do que nossas contas a pagar, precisamos usar nossas reservas de
dinheiro para saldar nossas dívidas. O organismo faz o mesmo: se comemos
menos do que o necessário para nos mantermos funcionando, não tenha
dúvida! Utilizamos nossas reservas de energia e é aí que entram os lipídeos,
mais especificamente os ácidos graxos!
Agora vamos mergulhar nas nossas células e ver como a coisa acontece!
116 CEDERJ
MÓDULO 6
20/21
OS ÁCIDOS GRAXOS SÃO ESTOCADOS NOS ADIPÓCITOS
AULAS
O tecido adiposo é formado por células que se chamam adipócitos.
Estas células são curiosas, ao microscópio eletrônico, pois possuem
uma enorme vesícula cheia de gordura dentro do seu citoplasma. Veja
a figura abaixo:
Figura 20.1: Adipócito.
Nestas gotas fica armazenado o triacil glicerol (TAG). Você já
estudou esta molécula em Bioquímica I, na Aula 27. Se estiver esquecido,
dê uma olhada rápida nessa aula.
O TAG nada mais é do que três moléculas de ácido graxo unidas
a uma molécula de glicerol. O próprio nome já diz isso para a gente:
triacil glicerol! Veja na figura abaixo o TAG.
Figura 20.2: Triacil glicerol.
CEDERJ 117
BIOQUÍMICA II | Degradação de lipídeos
Quando precisamos de energia, nosso organismo libera um
hormônio chamado glucagon. Este hormônio age como uma espécie
de maestro sinalizando para o organismo que é a hora de utilizar suas
reservas. Nesta situação, o glicogênio e os lipídeos devem passar a ser
utilizados como combustível. Poderíamos dizer, então, que o glucagon
é o hormônio da fome, isto é, ele é liberado quando nosso organismo
está com fome. Mas não se preocupe com isto agora, pois, mais à frente,
você estudará melhor este hormônio e o que ele faz no nosso organismo
quando é liberado pelo pâncreas e cai na corrente sangüínea. No momento,
precisamos saber que esse hormônio é liberado tão logo a glicemia (taxa
de açúcar no sangue) cai.
O glucagon circulante no sangue, então, se liga a um receptor
(proteína) presente na membrana do adipócito e dispara uma série de
reações que levam à ativação de uma enzima chamada lipase, que está
dentro do adipócito. Também veremos em aulas mais à frente que reações
são essas disparadas pelo glucagon. Aguarde!
Mas o que então acontece quando esta lipase é ativada pelo glucagon? A lipase é uma enzima que degrada os TAG. Em outras palavras,
poderíamos dizer que a lipase é uma espécie de tesoura que corta o TAG
em pedaços. Veja:
triacil glicerol lipase
3 ácidos graxos + 1 glicerol
Conforme vimos na aula de lipídeos em Bioquímica I (Aula 26),
os AG também são um grupo muito grande de moléculas, podendo ter
4, 5, 6, 7, 8,... 22, 23, 24... átomos de carbono. Além disto, eles podem
possuir apenas ligações simples (AG saturados) ou podem possuir dupla
ligação (AG insaturados). No caso da espécie humana, o AG majoritário
estocado como reserva é o palmitato. O palmitato é um AG que possui
16 átomos de carbono e nenhuma dupla ligação. Passaremos a utilizar
o palmitato como exemplo a partir daqui, pois é ele que é degradado na
espécie humana quando precisamos de energia.
118 CEDERJ
MÓDULO 6
20/21
AULAS
Veja a Figura 20.3, que resume o até então descrito:
Figura 20.3: O glucagon
se liga a um receptor
de membrana e ativa a
lipase. Veja a molécula
do palmitato.
Agora, o palmitato livre sai dos adipócitos e cai na corrente sangüínea.
Como os AG de um modo geral são insolúveis em solução aquosa (e o
sangue é uma solução aquosa), eles não podem “viajar” livremente pela
corrente sangüínea. Existe uma proteína chamada albumina que possui
uma espécie de bolso que aloja o palmitato, de modo que eles se escondem
da água e viajam tranqüilamente pelo sangue. Poderíamos dizer que a
albumina funciona como uma espécie de ônibus para o palmitato.
O palmitato é, então, distribuído por todos os tecidos do corpo.
Vamos agora tomar como exemplos o fígado e o músculo para
estudar o destino do palmitato que lá chega.
CEDERJ 119
BIOQUÍMICA II | Degradação de lipídeos
Os AG chegam aos hepatócitos e aos miócitos
Depois de passar pela membrana dos hepatócitos (célula hepática)
e dos miócitos (célula muscular), o palmitato é levado para a mitocôndria,
que é o local da célula onde ele será degradado. Nas mitocôndrias, estão as
enzimas responsáveis pelo processo de quebra ou degradação dos AG.
Entretanto, a entrada do palmitato para dentro das mitocôndrias
ocorre de maneira curiosa. Vejamos: ainda fora da mitocôndria, o palmitato sofre ativação recebendo uma molécula de coenzima A. Quem “pendura” esta molécula de coenzima A (CoA) no palmitato é uma proteína
chamada acil-CoA sintase. Entretanto, esta reação ocorre com o consumo
simultâneo de uma molécula de ATP, ou seja, pendurar a coenzima A no
palmitato não é de graça, não! A célula precisa pagar um preço para isso
e, nesse caso, utiliza um ATP. O palmitato com a coenzima A pendurada
passa a se chamar palmitoil-CoA. Veja como é a reação:
Acil-CoA sintase
palmitato + CoA + ATP
palmitoil-CoA + AMP + PPi
Observe que o ATP é quebrado em AMP e PPi (pirofosfato), o que
indica que duas ligações de alta energia são consumidas para pendurar a CoA
no palmitato. (O ATP tem três ligações de alta energia. Se uma for utilizada,
forma-se ADP + Pi. Se duas forem utilizadas, forma-se AMP + PPi).
Embora o palmitato já esteja ativado, ou seja, na forma de
palmitoil-CoA, ele ainda necessita passar por outras reações antes de
entrar, de fato, na matriz mitocondrial.
Existe uma outra enzima que fica próxima à membrana interna
da mitocôndria que se chama carnitina-acil transferase I (CAT I). Essa
enzima reconhece o palmitoil-CoA e troca a CoA, que está pendurada
no palmitoil, por carnitina. Forma-se, então, palmitato-carnitina e a
CoA é liberada no citoplasma da célula, podendo ser usada outra vez
pela acil-CoA sintase. Veja.
CAT I
palmitoil-CoA + carnitina
palmitato-carnitina + CoA
Agora, temos o palmitato ligado à carnitina. A carnitina é
uma pequena molécula conforme mostrado ao lado. Este complexo
(palmitatocarnitina) é reconhecido por um translocador, que está presente
na membrana interna da mitocôndria.
120 CEDERJ
MÓDULO 6
20/21
Esse translocador, como o próprio nome diz, transloca o palmitato-
AULAS
carnitina para dentro da mitocôndria, colocando, ao mesmo tempo,
carnitina livre para fora da mitocôndria.
Ufa!!! Após esta seqüência de reações, o palmitato-carnitina finalmente chega dentro da mitocôndria. Vale a pena lembrar que isto ocorre
porque a mitocôndria possui duas membranas e, portanto, o palmitato
precisa cruzar essas duas membranas antes de chegar à matriz mitocondrial e se encontrar com as enzimas responsáveis pela sua degradação.
Dentro da mitocôndria, o palmitato-carnitina que chega precisa
ser reconvertido em palmitoil-CoA de novo e, para isso, precisa perder
a carnitina e ganhar novamente uma coenzima A (CoA).
Dentro da mitocôndria existe uma enzima chamada carnitina
acil transferase II (CAT II) que faz essa reação. Veja:
CAT II
palmitato-carnitina + coenzima A
palmitoil-CoA + carnitina
Veja a figura abaixo que traduz o até então descrito.
Figura 20.4: Entrada do palmitato para dentro da mitocôndria.
Para tentar compreender melhor a entrada do palmitato na
mitocôndria, poderíamos imaginar que, para fazer isso, a molécula
precise “comprar um passaporte”, da mesma forma que nós precisamos
desse documento para viajar para o exterior. Assim, primeiro o palmitato
é ativado, e para isso a célula gasta energia na forma de ATP. Em
seguida, o palmitato recebe o “passaporte”, ou seja, a carnitina, que
permite sua entrada na mitocôndria, já que a Polícia Federal (no caso
o translocador) só permite que moléculas entrem na mitocôndria se
possuírem passaporte.
CEDERJ 121
BIOQUÍMICA II | Degradação de lipídeos
Obviamente, a pergunta que não quer calar é: por que o palmitato não
entra na mitocôndria ligado à CoA, já que lá dentro ele vai se ligar
novamente a essa coenzima? Se olharmos a molécula de coenzima A,
veremos como ela é enorme! Seu tamanho faz com que ela não atravesse
as membranas biológicas. Logo, o palmitoil-CoA que se forma fora da
mitocôndria não poderia jamais entrar nessa organela devido ao tamanho
da coenzima A. Além disso, veremos, com o passar das aulas, a importância da coenzima A nas reações metabólicas da célula. Existe uma
população de coenzima A no citoplasma e outra dentro da mitôcondria.
A célula não mistura essas duas populações para não prejudicar as
reações que lá ocorrem. Se o palmitoil-CoA entrasse na mitocôndria
na forma de palmitoil-CoA, levaria consigo a CoA do citoplasma para
dentro da mitocôndria, misturando as populações de CoA. Sendo assim,
a CoA é pendurada na molécula do palmitato apenas para que a CAT I
possa trocá-la por carnitina, despejando de volta a CoA do citoplasma
no citoplasma.
Agora temos palmitoil-CoA dentro da mitocôndria pronto para
seguir seu destino. Vejamos.
122 CEDERJ
MÓDULO 6
20/21
AULAS
O destino do palmitoil-CoA dentro da mitocôndria:
a β-oxidação
Uma vez na matriz mitocondrial, o palmitoil-CoA passará por
uma seqüência de quatro reações, conhecida como β-oxidação, conforme
Figura 20.5:
Figura 20.5: A β-oxidação.
Em cada reação, preste
atenção na caixa em torno
do pedaço da molécula que
sofre transformação.
CEDERJ 123
BIOQUÍMICA II | Degradação de lipídeos
Na primeira reação, uma enzima chamada acil-CoA desidrogenase
retira dois H da molécula do palmitoil-CoA e os entrega para o FAD (flavina
adenina dinucleotídeo), formando FADH2. Dizemos que a molécula que
perde os H sofre oxidação, ao passo que a molécula que recebe esses H
sofre redução. Assim, o palmitoil-CoA se oxida enquanto o FAD se reduz.
Como produto desta primeira reação, forma-se o trans-Δ2-enoil-CoA.
Este Δ indica que se forma uma dupla ligação entre os carbonos 2 e 3
da molécula do palmitoil-CoA.
Na segunda reação, a enzima enoil-CoA hidratase, conforme seu próprio nome sugere, hidrata o enoil-CoA formando o L-3-hidroxiacil-CoA.
Observe que nesta hidratação, a molécula de água é inserida de modo que
a hidroxila (OH) fica pendurada no carbono 3 e o H no carbono 2. Assim,
a dupla ligação se desfaz. Veja com atenção a Figura 21.5.
Na terceira reação da β-oxidação, a enzima L-3-hidroxiacil-CoA
desidrogenase oxida mais uma vez a molécula, mas, neste caso, utiliza NAD+,
que, ao receber os H da molécula do hidroxiacil-CoA, passa a NADH + H+.
Observe que se forma uma nova dupla ligação na molécula, agora entre o
carbono 3 e o oxigênio. Este composto se chama 3-cetoacil-CoA.
Até agora, após estas três reações, o palmitoil-CoA continua com
seus 16 carbonos, não tendo sofrido nenhuma quebra em sua molécula.
É justamente na quarta e última reação da β-oxidação que se dá a quebra
da molécula propriamente dita. Esta reação é catalisada pela β-ceto tiolase
ou tiolase. Como produtos desta reação temos o miristoil-CoA (ácido
graxo com 14 átomos de carbono) e o acetil-CoA, que tem dois átomos
de carbono. Observe que a tiolase, ao introduzir uma nova coenzima
A na molécula, é capaz de quebrar a molécula do 3-cetoacil CoA, que
tem 16 átomos de carbono. Esta enzima recebe esse nome porque ela é
capaz de fazer uma lise (quebra) através da inserção de um grupamento
tiol (no caso, a CoA). Lembre-se que uma hidrolase é, por analogia, uma
enzima capaz de fazer uma lise pela entrada de uma molécula de água,
assim como uma fosforilase é uma enzima capaz de fazer uma lise pela
entrada de um grupamento fosforil.
Poderíamos resumir as quatro reações da β-oxidação da seguinte
maneira:
1o – oxidação mediada pelo FAD
2o – hidratação
3o – oxidação mediada pelo NAD+
4o – tiólise
124 CEDERJ
MÓDULO 6
20/21
E agora? O que fazemos com o novo ácido graxo formado, que
AULAS
tem 14 átomos de carbono (miristoil-CoA)? Ele passa por uma nova
seqüência de quatro reações, idênticas às que acabamos de descrever, e,
no final, forma-se uma nova molécula de acetil-CoA (que possui dois carbonos) e um ácido graxo com 12 átomos de carbono. E agora? A mesma
coisa! Esse ácido graxo com 12 carbonos passa por uma nova rodada
de β-oxidação, gerando uma nova acetil-CoA e um outro ácido graxo
com 10 carbonos e assim sucessivamente até que todo o palmitoil-CoA
vire uma “sopa” de acetil-CoA. Uma vez que o palmitoil-CoA apresenta
16 carbonos, podemos dizer que a sua completa oxidação através da
β-oxidação gera 8 moléculas de acetil-CoA (8 x 2 =16); 7 moléculas de
FADH2 e 7 moléculas de NADH + H+. Em suma temos:
Palmitoil-CoA + 7 FAD + 7 NAD+ + 7 CoA + 7 H2O
8 acetil-CoA + 7 FADH2 + 7 NADH + 7 H+
DESTINOS DOS PRODUTOS DA β-OXIDAÇÃO
Podemos dizer que os produtos da β-oxidação são todos os
compostos que estão escritos no lado direito da equação acima. Vejamos
agora o destino de cada uma dessas moléculas:
• Acetil-CoA: conforme você já viu na aula sobre metabolismo de
açúcares, o acetil-CoA é uma molécula central no metabolismo celular. O
acetil-CoA é a porta de entrada do ciclo de Krebs, juntando-se ao oxalacetato (que tem 4 carbonos) para formar o citrato (que tem 6 carbonos).
Esta é a primeira reação deste ciclo. Desta forma, o acetil-CoA formado
a partir da β-oxidação pode entrar no ciclo de Krebs, mas para que isto
ocorra é necessário que haja oxalacetato disponível. Esta informação é
muito importante, conforme veremos a seguir.
Vamos agora investigar o que acontece com o acetil- CoA que se
forma no músculo e no fígado a partir da β-oxidação. Lembre-se que
estes tecidos são capazes de degradar ácidos graxos no jejum ou em
intenso exercício, quando a demanda de energia é muito grande, como
no caso do músculo.
CEDERJ 125
BIOQUÍMICA II | Degradação de lipídeos
Nesse caso, todo o acetil-CoA formado a partir do palmitoil-CoA
é jogado no ciclo de Krebs, uma vez que a concentração de oxalacetato
lá presente permite que isto ocorra. A entrada do acetil-CoA no ciclo
de Krebs vai gerar NADH+ + H+ e FADH2, que vão para a cadeia de
transporte de elétrons transferir seus elétrons gerando ATP, conforme
já vimos em aulas anteriores.
No fígado, acontece uma situação muito particular, já que este
órgão, no momento de jejum, utiliza o oxalacetato para produzir glicose,
conforme veremos na aula sobre gliconeogênese mais à frente. Desta
forma, o acetil-CoA que vem da oxidação do palmitato no fígado não
pode ser jogado no ciclo de Krebs, já que, conforme vimos, para que
isso ocorra é necessário que haja oxalacetato disponível. O que fazer,
então, com este acetil-CoA formado? O acetil-CoA é transformado em
corpos cetônicos, conforme veremos logo a seguir.
• FADH2 e NADH: antes de vermos como se formam os corpos
cetônicos no fígado, vamos analisar o destino dos 7 FADH2 e 7 NADH
formados durante a β-oxidação. Você teria alguma sugestão para esta
questão? Ou seja, qual será o destino destas duas coenzimas, o FADH2
e o NADH? A resposta é simples. Essas coenzimas, na forma reduzida,
são direcionadas para a cadeia de transporte de elétrons, onde entregarão
seus elétrons para formar ATP, ou seja energia para a célula.
126 CEDERJ
MÓDULO 6
20/21
FORMAÇÃO DOS CORPOS CETÔNICOS
AULAS
Uma vez que no fígado a concentração de oxalacetato é muito baixa,
já que esta molécula é utilizada na produção de glicose, o acetil-CoA vindo
da β-oxidação tem outro destino: a formação de corpos cetônicos.
Corpos cetônicos (CC) são compostos solúveis em água e consistem
basicamente de acetoacetato e β-hidroxibutirato. Veja essas duas moléculas
na figura abaixo.
Figura 20.6: Acetoacetato e β-hidroxibutirato.
A formação dos CC também ocorre dentro da mitocôndria e se
dá da seguinte forma.
Primeiro, duas moléculas de acetil-CoA se condensam (juntam)
e formam acetoacil-CoA (contém 4 carbonos). A enzima que catalisa
esta reação é a β-cetotiolase. O acetoacil-CoA se condensa com uma
nova molécula de acetil-CoA, formando β-hidroxi-β-metilglutaril-CoA
(HMG-CoA) através da enzima HMG-CoA sintase. Este composto
sofre clivagem pela enzima HMG-CoA liase formando acetil-CoA e
acetoacetato. O acetoacetato sofre redução gerando β-hidroxibutirato
através da enzima β-hidroxibutirato desidrogenase. Parte do acetoacetato
sofre descarboxilação espontânea, gerando acetona. A Figura 20.7
resume o que foi descrito.
CEDERJ 127
BIOQUÍMICA II | Degradação de lipídeos
Figura 20.7: Formação de corpos cetônicos.
Tanto o acetoacetato quanto o β-hidroxibutirato são lançados
na corrente sangüínea, viajando livremente pelo sangue, já que são
altamente solúveis. Os “tecidos famintos”, incluindo músculo cardíaco
e esquelético, pulmão e tecido nervoso, captam esses compostos e os
transformam de volta em acetil-CoA, que é, então, lançado no ciclo de
Krebs, gerando energia para esses “tecidos famintos”.
128 CEDERJ
MÓDULO 6
20/21
Estamos aqui chamando os tecidos de “famintos” pois estamos numa
AULAS
situação de fome, ou seja, baixa de energia nas células e no organismo
como um todo. Veja as reações de transformação do acetoacetato em
acetil-CoA na Figura 20.8.
Figura 20.8: Transformação do acetoacetato em acetil-CoA nos “tecidos famintos”.
CEDERJ 129
BIOQUÍMICA II | Degradação de lipídeos
DEGRADAÇÃO DOS DEMAIS ÁCIDOS GRAXOS
Até agora estudamos como o palmitato, que é um ácido graxo com
16 átomos de carbono, é degradado. Entretanto, existem outros ácidos
graxos maiores e menores que o palmitato, ou que possuem dupla ligação
e que também precisam ser degradados. O que acontece nesses casos?
A maioria dos ácidos graxos insaturados de origem biológica
contém apenas ligações duplas nas posições entre os carbonos 9 e 10.
Um exemplo de ácidos graxos insaturados é o ácido oléico. Veja este
ácido na Figura 20.9.
Figura 20.9: Ácido oléico.
Esses ácidos também são oxidados através da β-oxidação.
Entretanto, para que isto ocorra, a dupla ligação precisa ser removida.
Para tal, existem enzimas, como a enoil-CoA-isomerase, que modificam
estas duplas ligações transformando as moléculas em substratos naturais
para as enzimas da β-oxidação que vimos anteriormente.
Além dos ácidos graxos com dupla ligação (ácidos insaturados),
ainda temos os ácidos graxos com número ímpar de átomos de carbono.
Esses ácidos são freqüentes em plantas e organismos marinhos, por
exemplo. E neste caso? Será que esses ácidos também podem ser
quebrados através da β-oxidação? A resposta é positiva. Todos os ácidos
graxos são oxidados nas células pela β-oxidação.
130 CEDERJ
MÓDULO 6
20/21
Entretanto, o que vai diferir neste caso é o produto da última volta da
AULAS
β-oxidação. Vejamos. Tomemos como exemplo um ácido graxo com 15
átomos de carbonos. Depois da primeira rodada de β-oxidação (que
envolve as quatro reações mencionadas anteriormente), o ácido graxo
passa a ter 13 átomos de carbono (pois haverá perdido uma molécula de
acetil-CoA). Esse ácido com 13 átomos de carbono vai passar por uma
nova rodada de β-oxidação, gerando um ácido graxo com 11 átomos de
carbono e assim por diante, até que se formará um ácido com 5 átomos de
carbono. Agora é que temos a diferença. Esse composto com 5 átomos de
carbono é quebrado em acetil-CoA (2 carbonos) e propionil-CoA (3 átomos
de carbono). O propionil-CoA, no entanto, não pode mais passar por uma
nova rodada de β-oxidação. O propionil-CoA é convertido a succinil-CoA
(4 carbonos), conforme reações mostradas na Figura 20.10.
Figura 20.10: Conversão de propionil-CoA em succinil-Col-A. Observe que há gasto
de ATP na primeira reação catalisada pela propionil-CoA-carboxilase.
CEDERJ 131
BIOQUÍMICA II | Degradação de lipídeos
Se nos recordarmos da aula sobre ciclo de Krebs, veremos que o
succinil-CoA é um intermediário deste ciclo. Logo, quando se forma
o succinil-CoA a partir do propionil-CoA, temos um aumento da
concentração dos intermediários do ciclo de Krebs e, por conseguinte, de
oxalacetato. Agora temos a seguinte situação: um ácido graxo de número
ímpar sendo quebrado pela β-oxidação que gera acetil-CoA. Além disso,
a quebra desse ácido graxo gera propionil-CoA, que se transforma em
succinil-CoA, que se transforma em oxalacetato. Em suma, temos a
formação de acetil-CoA e a formação em última instância de oxalacetato.
O que ocorre, então, com a produção de corpos cetônicos? Vimos que
os corpos cetônicos são produzidos quando falta oxalacetato. Se há um
excesso de oxalacetato, há um grande decréscimo na produção de corpos
cetônicos quando um ácido graxo de número ímpar é metabolizado. Veja
a Figura 20.11 que resume o que acabamos de descrever.
Figura 20.11: O acetil-CoA tem duas “portas de entrada”: o ciclo de Krebs (porta 1) e a
formação de corpos cetônicos (porta 2). A porta 1 ficará fechada se falta oxalacetato.
Neste caso, o acetil-CoA entrará pela porta 2 formando corpos cetônicos. Se houver
grande disponibilidade de oxalacetato, a porta preferencial será a 1 e, com isso, a
produção de corpos cetônicos diminui. Isso ocorre, por exemplo, quando o fígado
oxida ácidos graxos com número ímpar de átomos de carbono.
132 CEDERJ
MÓDULO 6
20/21
Na aula de hoje vimos as reações envolvidas na oxidação do palmitato. Lembre-se
que oxidar um composto significa “quebrá-lo” em compostos menores. No caso
do palmitato, vimos que este composto é quebrado em 8 moléculas de acetil-CoA
gerando, durante esta quebra, 7 moléculas de FADH2 e 7 moléculas de NADH. Essas
coenzimas reduzidas vão para a cadeia de transporte de elétrons entregar seus elétrons
para formar ATP. O acetil-CoA (2 carbonos), ao se juntar ao oxalacetato (4 carbonos)
forma o citrato (6 carbonos), que roda no ciclo de Krebs, gerando mais FADH2 e NADH,
que também vão formar mais ATP na cadeia de transporte de elétrons. Entretanto, no
fígado, devido à ausência de oxalacetato (irá formar glicose na gliconeogênense), o
acetil-CoA formado na β-oxidação é transformado em corpos cetônicos (acetoacetato
e β-hidroxibutirato). Esses compostos, por serem altamente solúveis, “viajam” pelo
sangue, sendo captados pelos demais tecidos. Lá, eles são reconvertidos em acetil-CoA,
que roda, então, no ciclo de Krebs, gerando energia. Quando ácidos graxos de número
ímpar de átomos de carbono são quebrados no fígado, há uma menor produção de
corpos cetônicos, já que temos a formação de oxalacetato que acaba por consumir o
acetil-CoA que seria utilizado na formação dos corpos cetônicos.
EXERCÍCIOS
Reflita e responda:
1. Vimos que, no fígado, o acetil-CoA formado pela β-oxidação do palmitato forma
corpos cetônicos e não entra no ciclo de Krebs, conforme o esperado para o acetil-CoA.
Se o ciclo de Krebs não está funcionando no fígado, neste momento, como o
fígado consegue energia para “se manter vivo” no momento do jejum?
2. Por que o fígado não manda para os “tecidos famintos” o acetil-CoA formado
na β-oxidação, mas sim acetoacetato e β-hidroxibutirato?
3. Explique com suas palavras por que os ácidos graxos com número ímpar geram
menos corpos cetônicos que os ácidos graxos de número par?
4. Na sua opinião, qual é a importância, do ponto de vista energético, da última
volta da β-oxidação, ou seja, da tiólise? Compare a reação catalisada pela tiolase
com a reação catalisada pela acil-CoA sintase, que é a enzima que pendura CoA
no palmitato quando este precisa entrar na mitocôndria.
CEDERJ 133
AULAS
RESUMO
objetivo
AULAS
Síntese de
ácidos graxos
22/23
Ao final desta aula, você deverá ser capaz de:
• Conhecer as principais reações envolvidas na síntese
de ácidos graxos, em especial, do palmitato.
BIOQUÍMICA II | Síntese de ácidos graxos
ASPECTOS HISTÓRICOS
A síntese de ácidos graxos foi desvendada depois que as principais
reações da β-oxidação haviam sido descritas. Só para lembrar, é através da
β-oxidação que o palmitato é quebrado em acetil-CoA. A β – oxidação é
composta por quatro reações: desidrogenação dependente de FAD; hidratação;
desidrogenação dependente de NAD+ e tiólise. Você se lembra?
Os pesquisadores interessados em conhecer a síntese de ácidos
graxos acreditavam que esta via era o reverso da β-oxidação, ou seja,
eles acreditavam que havia um único conjunto de enzimas que era capaz
de quebrar o palmitato em determinadas situações, ou fazer o palmitato
em outras. Essa crença baseava-se no fato de que as quatro enzimas
envolvidas na degradação do palmitato mostraram-se reversíveis quando
purificadas. Logo, parecia simples: se as enzimas da β-oxidação podem
catalisar reações reversíveis (substrato
produto), então, elas também
deveriam ser capazes de sintetizar o palmitato. Entretanto, embora se
tenha tentado sintetizar palmitato incubando-se o acetato (composto
com 2 carbonos) com as mitocôndrias (lembre-se que é na mitocôndria
que ocorre a β-oxidação), nunca se observou o aparecimento deste ácido
graxo. Logo, havia algo de errado com aquela crença inicial.
O impasse foi resolvido quando Stadman & Barker e Brady & Gurin,
na década de 1950, observaram a síntese de palmitato em uma fração solúvel
da célula, ou seja, no citoplasma das células. Pôde-se, então, concluir que a
síntese de palmitato ocorria no citoplasma, ao passo que a degradação do
palmitato (β-oxidação) ocorria nas mitocôndrias. O que demonstrava que
a síntese e a degradação eram vias totalmente distintas!
Agora que já vimos um pouco o aspecto histórico da descoberta
da síntese, vamos responder à seguinte pergunta: em que situação o
nosso organismo vai sintetizar ácido graxo (palmitato)? Se pararmos para
pensar, os ácidos graxos são as reservas do nosso organismo, junto com
o glicogênio. Se fizermos uma analogia com a caderneta de poupança,
concluiremos que nosso organismo vai sintetizar suas reservas quando
houver excesso de nutriente. Nós também só guardamos dinheiro na
caderneta de poupança depois que pagamos todas as nossas contas do
mês. Ninguém deposita dinheiro na poupança se estiver devendo alguma
coisa. O organismo é assim também. Vai produzir suas reservas depois
que a demanda de energia das células já estiver suprida. E é por isso que
a gente engorda!
136 CEDERJ
MÓDULO 6
22/23
Quando comemos mais do que o necessário, o excesso é convertido em
AULAS
ácidos graxos (palmitato) que se acumulam no tecido adiposo, formando
aqueles “pneuzinhos” na barriga que a gente tanto detesta...
Vamos estudar agora como ocorre a síntese do palmitato (e a
formação dos tais pneuzinhos...). Então, mãos à obra!
SÍNTESE DO PALMITATO
O citrato
A síntese do palmitato ocorre a partir do acetil-CoA (2 átomos
de carbono). Entretanto, o acetil-CoA é uma molécula mitocondrial e,
conforme acabamos de ver, a síntese do palmitato ocorre no citoplasma
das células. Logo, o acetil-CoA precisa chegar ao citoplasma para que
haja a síntese do palmitato.
Conforme discutimos na aula passada, a coenzima A é muito
grande para atravessar as membranas biológicas e, por isso, o acetilCoA não pode cruzar as membranas da mitocôndria para chegar ao
citoplasma. Como, então, o acetil-CoA chega ao citoplasma para dar
início à síntese do palmitato? Vejamos.
Quando comemos muito açúcar, a taxa de glicose do nosso sangue fica
elevada. A glicose (6 átomos de carbono) entra nas células e é degradada
pela glicólise, dando origem a duas moléculas de piruvato (3 átomos de
carbono). Se você não se recorda bem de como ocorre a glicólise, reveja
a aula sobre esse assunto.
O piruvato formado no citoplasma entra na mitocôndria através
de um translocador localizado na membrana interna mitocondrial.
Na mitocôndria, o piruvato é convertido em acetil-CoA através da
piruvato desidrogenase. O acetil-CoA (2 átomos de carbono) se junta
ao oxalacetato (4 átomos de carbono) para formar o citrato (6 átomos
de carbono) que segue pelo ciclo de Krebs.
Quando há excesso de glicose, todas essas reações aqui descritas
ocorrem em grande abundância, já que há excesso e fartura de glicose.
Nesta situação, há uma grande formação de citrato, que se acumula
dentro da mitocôndria. A concentração de citrato aumenta tanto que o
citrato acaba vazando da mitocôndria, caindo no citoplasma.
CEDERJ 137
BIOQUÍMICA II | Síntese de ácidos graxos
A saída do citrato da mitocôndria se dá através de um translocador de
citrato localizado na membrana mitocondrial interna.
No citoplasma, o citrato é quebrado em acetil-CoA e oxalacetato
pela ação da citrato liase. Veja:
citrato + ATP + CoA
acetil-CoA + oxalacetato + ADP + Pi
Agora sim! Temos acetil-CoA no citoplasma para ser utilizado
na síntese do palmitato. Podemos, então, concluir que o acetil-CoA sai
da mitocôndria “disfarçado” de citrato. O citrato, quando chega no
citoplasma, é quebrado formando o acetil-CoA e o oxalacetato (lembre
que o citrato é formado pelo união do acetil-CoA com o oxalacetato.
Logo, a quebra do citrato gera acetil-CoA e oxalacetato).
O destino do acetil-CoA
Agora, temos o acetil-CoA no citoplasma! Entretanto, a síntese do
palmitato utiliza o malonil-CoA (composto com 3 átomos de carbono).
Desta forma, o acetil-CoA será convertido em malonil-CoA
pela ação da enzima acetil-CoA carboxilase. Essa é a primeira enzima
envolvida na síntese do palmitato. Como o próprio nome diz, a
acetil-CoA carboxilase “pendura” um CO2 no acetil-CoA, isto é,
ela “carboxila” o acetil-CoA, que passa a formar malonil-CoA, um
composto com 3 átomos de carbono. Veja:
acetil-CoA + CO2 + ATP
malonil-CoA + ADP + Pi
A acetil-CoA carboxilase é uma enzima dependente de biotina.
A biotina (veja ao lado) está presente em todas as carboxilases, pois é o
grupo que se especializou na carboxilação de determinadas moléculas.
A Figura 22.1 mostra a saída do citrato da mitocôndria e a
formação de acetil-CoA e oxalacetato. Alguns detalhes desta figura
serão descritos mais à frente.
138 CEDERJ
MÓDULO 6
22/23
AULAS
Citosol
oxalacetato
oxalacetato
Figura 22.1: Saída do citrato na mitocôndria e formação de acetil-CoA no citoplasma.
O complexo do ácido graxo sintase
A segunda enzima que participa da síntese de lipídeos é o complexo
do ácido graxo sintase (AGS). Esta enzima é bastante grande, sendo capaz
de desempenhar diversas funções, conforme veremos a seguir.
A AGS possui dois grupamentos funcionais: uma fosfopantoteína
e uma cisteína. A fosfopantoteína fica ligada à proteína carreadora de
acilas (PCA). Veja a Figura 22.2.
Figura 22.2: Complexo do ácido graxo
sintase e a fosfopantoteína.
CEDERJ 139
BIOQUÍMICA II | Síntese de ácidos graxos
A fosfopantoteína e a cisteína possuem grupamentos SH que servem
para ligar os diversos substratos dessa enzima. O funcionamento dessa
enzima é sensacional! Vejamos.
Primeiro, um acetil-CoA se liga à cisteína. Em seguida, o malonil-CoA
se liga à fosfopantoteína. Vale ressaltar que, no momento da ligação, tanto
o acetil-CoA quanto o malonil-CoA perdem a CoA antes de se ligar à
AGS e se ligam como acetato e malonato. Nesse momento, a enzima está
carregada com seus dois substratos principais: o acetato (ligado à cisteína)
e o malonato (ligado à fosfopantoteína). Em seguida, o acetato “pula”
para cima do malonato com a ajuda de um componente do complexo
chamado enzima de condensação. O produto desta condensação seria um
composto com 5 átomos de carbono, já que o acetato possui 2 átomos de
carbono e o malonato possui 3 átomos de carbono. Entretanto, ao mesmo
tempo que ocorre essa condensação, ocorre uma descarboxilação e, com
isso, o produto formado possui 4 átomos de carbono (2 + 3 = 5 – 1 = 4).
Vale ressaltar que este produto se forma sobre a fosfopantoteína e, por
isso, se chama acetoacetil-PCA.
Em seguida, o acetoacetil-PCA sofre uma redução dependente
de NADPH (veja o NADPH ao lado). Quem catalisa essa reação é uma
redutase presente no complexo da AGS. O NADPH cede seus H para o
acetoacetil formando NADP+. E o produto formado se chama hidroxibutiril-PCA (já que ainda está ligado à fosfopantoteína da PCA).
Agora, o hidroxibutiril sofre uma desidratação também catalisada
por uma desidratase presente no complexo da AGS. O produto desta
reação é o butenenoil-PCA.
A quarta reação é uma nova redução catalisada por uma outra
redutase presente no complexo. Esta redutase também utiliza NADPH,
formando NADP+ e butiril-PCA.
Todas essas quatro reações ocorrem com o composto de quatro
carbonos ligado à fosfopantoteína. Entretanto, até agora, o composto
tem apenas 4 átomos de carbono e, conforme sabemos, o palmitato
tem 16 átomos de carbono. Falta, portanto, que o butiril cresça até
formar o palmitato.
Desta forma, o butiril-PCA é transferido para a cisteína, deixando a
fosfopantoteína livre para a entrada de uma nova molécula de malonato.
140 CEDERJ
MÓDULO 6
22/23
Na segunda rodada do complexo, a situação é a seguinte: o butiril
AULAS
(composto com 4 átomos de carbono) se encontra ligado à cisteína e o
malonil-CoA perde seu CoA e se liga como malonato à fosfopantoteína.
Em seguida, o butiril “pula” para cima do malonato com a
ajuda da enzima de condensação. Ocorre uma nova descarboxilação
do malonato dando origem a um composto com 6 átomos de carbono
(4 + 3 = 7 – 1 = 6).
Da mesma forma que descrito anteriormente, esse composto vai
sofrer uma redução dependente de NADPH, uma desidratação e uma
nova redução dependente de NADPH.
Tudo isso ocorre sobre a fosfopantoteína. Agora, esse composto
com 6 átomos de carbono é transferido de volta para cisteína deixando
a fosfopantoteína livre para a entrada de um novo malonil-CoA.
Esse processo se repete 7 vezes, até que o palmitato se forma dentro
do complexo da AGS. Como o palmitato é uma molécula muito grande
(16 átomos de carbono), a afinidade do complexo AGS por ele é muito
pequena e, com isso, o complexo libera o palmitato. Esse palmitato pode
ser transportado para o tecido adiposo onde permanecerá até que seja
necessária a sua utilização como reserva energética.
CEDERJ 141
BIOQUÍMICA II | Síntese de ácidos graxos
Veja a Figura 22.3 que resume o que foi descrito.
Figura 22.3: A síntese do palmitato no complexo do ácido graxo sintase.
Conforme vimos, a primeira reação catalisada pelo complexo da AGS
é a união de um acetil-CoA com um malonil-CoA. A partir daí, em cada
rodada do complexo, uma nova molécula de malonil-CoA é consumida,
fazendo o composto crescer até ficar com 16 átomos de carbono.
Podemos concluir, então, que para haver síntese de palmitato é
necessário que haja muito malonil-CoA disponível. É aí que entra a acetilCoA carboxilase. Conforme vimos anteriormente, a acetil-CoA carboxilase
é “uma fábrica” de malonil-CoA. Esse malonil-CoA é utilizado pelo complexo da AGS. Se faltar malonil-CoA, não há síntese de palmitato!
142 CEDERJ
MÓDULO 6
22/23
Desta forma, o produto da acetil-CoA carboxilase (malonil-CoA)
Acetil-CoA carboxilase
AULAS
é substrato da AGS. Veja.
complexo AGS
Acetil-CoA
malonil-CoA
substrato
produto
substrato
palmitato
produto
Não podemos deixar de mencionar, mais uma vez, que o
complexo da AGS utiliza acetil-CoA apenas na primeira reação.
Logo, o acetil-CoA que vem da quebra do citrato serve tanto como
substrato da acetil-CoA carboxilase quanto como substrato do
complexo da AGS.
Em resumo, a síntese do palmitato, a partir do acetil-CoA e do
malonil-CoA, envolve as seguintes reações:
1- condensação
2- redução dependente de NADPH
3- desidratação
4- redução dependente de NADPH
Regulação da síntese de palmitato
Conforme mencionado anteriormente, a síntese de palmitato
ocorre quando há fartura de nutrientes. Vimos acima que a glicose
excedente é convertida em piruvato, que se transforma em citrato, que,
por sua vez, é convertido em acetil-CoA, que serve de matéria-prima
para a síntese de palmitato. Fica claro, então, por que quando comemos
muito açúcar engordamos. O açúcar excedente se transforma em gordura
(palmitato) que se acumula no tecido adiposo.
Conforme podemos prever, a síntese de palmitato precisa ocorrer
na hora correta. Obviamente, só podemos sintetizar palmitato quando
existem nutrientes em excesso, e por isso, a célula precisa controlar
precisamente as enzimas envolvidas com a síntese.
A acetil-CoA carboxilase é altamente controlada, já que é ela
que vai gerar o malonil-CoA, que é o principal substrato para a síntese
de palmitato.
CEDERJ 143
BIOQUÍMICA II | Síntese de ácidos graxos
A acetil-CoA carboxilase sofre dois controles. O primeiro é
exercido pelo próprio citrato, que atua como um modulador da atividade
desta enzima. A acetil-CoA carboxilase possui um sítio de ligação ao
citrato (sítio alostérico). Quando o citrato ocupa este sítio, a acetilCoA carboxilase sofre uma mudança conformacional que resulta na sua
polimerização. Na verdade, a acetil-CoA carboxilase existe na forma de
monômeros isolados, quando não há citrato no citoplasma da célula.
Mediante ligação ao citrato, esses monômeros “dão as mãos”, formando
um filamento longo, conforme visto na Figura 22.4. A polimerização
funciona exatamente como se fosse um colar de pérolas: as pérolas
isoladas seriam os monômeros de acetil-CoA carboxilase e o colar
de pérola inteiro seria o filamento.
Figura 22.4: Microscopia eletrônica dos filamentos da acetilCoA carboxilase obtidos na
presença de citrato.
Entretanto, curiosamente, a acetil-CoA carboxilase, na forma
filamentosa, apresenta uma atividade bem maior do que a acetil-CoA
carboxilase na forma de monômeros.
Dessa forma, podemos concluir, que o citrato é capaz de ativar
a acetil-CoA carboxilase ao induzir sua polimerização. Quando, então,
o citrato chega ao citoplasma, uma pequena parte dele se liga à acetilCoA carboxilase, ocasionando a polimerização da enzima com a sua
concomitante ativação.
citrato
monômeros da acetil-CoA
filamento
carboxilase
(muito ativo)
(pouco ativos)
144 CEDERJ
MÓDULO 6
22/23
O segundo controle da acetil-CoA carboxilase é a fosforilação
AULAS
induzida pelo hormônio glucagon. Conforme você verá nas aulas de regulação hormonal, o glucagon, um hormônio que é liberado no momento do
jejum, ativa uma proteína cinase que fosforila (pendura um grupamento
fosfato) diversas enzimas, dentre as quais a acetil-CoA carboxilase.
Quando fosforilada, a acetil-CoA carboxilase passa a ficar inibida.
Desta forma, quando estamos em jejum sob a ação do glucagon, a acetil-CoA
carboxilase está completamente inibida, já que se encontra fosforilada.
enzima defosforilada
-P
enzima fosforilada
ativa
inibida
Em resumo, podemos dizer que a acetil-CoA carboxilase possui
dois controles: o citrato, que ativa a enzima, e a fosforilação induzida
por glucagon, que leva à sua inativação.
NADPH
Antes de terminarmos, falta compreender de onde vem tanto NADPH
que é necessário para manter a síntese do palmitato. Lembre-se de que em
cada rodada do complexo da AGS há consumo de duas moléculas
de NADPH.
Vimos anteriormente que, quando a concentração de citrato
está muito aumentada na mitocôndria, o citrato vaza, alcançando o
citoplasma.
Esse citrato é convertido em acetil-CoA e oxalacetato pela ação
da citrato liase. O acetil-CoA ou será convertido em malonil-CoA pela
acetil-CoA carboxilase ou será utilizado na primeira rodada do complexo
da AGS para formar palmitato.
E o oxalacetato (OA)? Qual o destino desta molécula?
O
OA pode ser convertido em malato pela malato
desidrogenase, que utiliza NADH. O malato formado pode ser
convertido em piruvato por uma enzima chamada enzima málica.
Na conversão de OA em piruvato, há formação de NADPH. Veja:
OA + NADP+
piruvato + CO2 + NADPH
CEDERJ 145
BIOQUÍMICA II | Síntese de ácidos graxos
Este NADPH formado a partir da enzima málica pode ser
utilizado na síntese do palmitato. Entretanto, esse NADPH não é
suficiente para manter a síntese, havendo necessidade de mais NADPH.
Conforme veremos em aulas mais à frente, existe uma via chamada via
das pentoses fosfato, que ocorre junto com a síntese de palmitato, e
que forma NADPH para manter a síntese do palmitato. Desta forma,
parte do NADPH necessário para a síntese do palmitato vem da enzima
málica, e outra parte, da via das pentoses fosfato.
Tanto o piruvato quanto o malato podem voltar para a mitocôndria
através de transportadores específicos, sendo reconvertidos em OA. Veja
a Figura 22.5.
Citosol
oxalacetato
oxalacetato
Figura 22.5: O transporte de citrato para fora da mitocôndria gera OA, que, ao
retornar para a mitocôndria na forma de piruvato, gera poder redutor (NADPH)
para a síntese do palmitato.
146 CEDERJ
MÓDULO 6
22/23
Síntese de palmitato x degradação do palmitato
AULAS
Antes de terminarmos, vale a pena comparar a síntese de palmitato
com a sua degradação (β-oxidação).
Tabela 22.1: Comparação da síntese do palmitato e sua degradação.
β-oxidação
Síntese do palmitato
1. oxidação dependente de FAD
1. condensação
2. hidratação
2. redução dependente de NADPH
3. oxidação dependente de NAD+
3. desidratação
4. tiólise (quebra)
4. redução dependente de NADPH
Se pararmos para pensar, podemos concluir que a síntese do palmitato
envolve reações químicas que são o contrário das reações da β-oxidação.
Não estamos dizendo que a síntese é o reverso da β-oxidação, mas apenas
que essas duas vias são quimicamente o reverso uma da outra.
Não poderia ser diferente, pois, quando sintetizamos o palmitato, que
é uma molécula com vários grupos CH2, utilizamos o malonato, que é uma
molécula que possui carbono ligado ao oxigênio. Esse oxigênio precisa sair
da molécula para a entrada de H e formação do CH2. É por isso que ocorrem
reduções com o uso de NADPH, que cede seus H gerando NADP+.
Na β-oxidação a situação é o contrário. Temos o palmitato,
rico em grupos CH2, e queremos formar o acetil-CoA, uma molécula
que possui oxigênio ligado ao carbono. Logo, neste caso, precisamos
inserir oxigênio na molécula, ou seja, precisamos oxidar a molécula.
É por isso que precisamos de FAD e NAD+, que recebem os H vindos
do palmitato formando FADH2 e NADH. Além disto, na síntese do
palmitato há uma reação de desidratação que remove o oxigênio da
molécula, ao passo que na β-oxidação há uma etapa de hidratação que
insere oxigênio na molécula. Por fim, enquanto na β-oxidação temos a
tiólise, ou seja, a quebra do palmitato em unidades de dois carbonos
(acetil-CoA), na síntese do palmitato temos a condensação de moléculas
pequenas, como o malonil-CoA, visando formar uma molécula grande
como o palmitato.
CEDERJ 147
BIOQUÍMICA II | Síntese de ácidos graxos
RESUMO
Nesta aula, vimos como o palmitato é sintetizado a partir de precursores pequenos
como o acetil-CoA e o malonil-CoA. Existem duas enzimas-chave que participam
do processo de síntese do palmitato: a acetil-CoA carboxilase e o complexo da
ácido graxo sintase (AGS). A acetil-CoA carboxilase sintetiza malonil-CoA com
gasto de ATP. O complexo da AGS possui dois grupamentos muito importantes,
que são a fosfopantoteína e uma cisteína. O acetil-CoA se liga como acetato à
cisteína, ao passo que o malonil-CoA se liga como malonato à fosfopantoteína.
Há uma reação de condensação que é acompanhada de uma descarboxilação, o
que resulta na formação de um composto com quatro átomos de carbono. Esse
composto sofre redução dependente de NADPH, desidratação, e uma nova redução
dependente de NADPH.
Em seguida o composto, já reduzido na forma de butiril, passa para a cisteína,
deixando livre a fosfopantoteína para a entrada de um novo malonil-CoA. Esse
ciclo se repete até que o palmitato se forme dentro do complexo da AGS, sendo,
em seguida, liberado para o meio.
EXERCÍCIOS
1. Descreva com suas próprias palavras o processo de síntese de palmitato a partir
do acetil-CoA.
2. Como o acetil-CoA chega ao citoplasma, local onde ocorre a síntese de
lipídeos?
3. Quais são os controles da síntese de lipídeos?
148 CEDERJ
objetivos
AULA
Via das pentoses-fosfato
24
Nesta aula, você vai conhecer a via das
pentoses-fosfato, um desvio da via glicolítica
necessário às células que realizam reações de
biossíntese redutoras. Você vai ser apresentado
a todas as reações que fazem parte desta via,
mas o mais importante é que você aprenda
como o poder redutor é garantido nos
momentos de biossíntese, como é sintetizado o
NADPH e como pentoses são fornecidas para a
formação de nucleotídeos.
Pré-requisitos
Seria interessante que você relesse as aulas sobre
glicólise, ciclo de Krebs e síntese de ácidos graxos
antes de começar. Vamos retomar alguns pontos
dessas vias metabólicas nesta aula.
BIOQUÍMICA II | Via das pentoses-fosfato
INTRODUÇÃO
O ATP é considerado a “moeda energética” da célula. A incorporação do fosfato
à molécula de ADP, formando o ATP, se dá às custas da energia liberada na
oxidação dos nutrientes, enquanto a síntese das biomoléculas muitas vezes
depende da hidrólise do ATP. Entretanto, como vimos quando estudamos a
síntese de ácidos graxos, nem sempre apenas o ATP é suficiente para as reações
de biossíntese. Uma outra “moeda” também é necessária: o poder redutor.
Muitas reações celulares, como a síntese de ácidos graxos e de colesterol,
requerem NADPH além do ATP.
Atenção! Você não deve confundir NADH com NADPH. Estas duas coenzimas
diferem apenas pela presença de um grupamento fosfato a mais na molécula
de NADPH. Entretanto, elas desempenham papéis bastante diferentes na célula.
O NADH participa indiretamente da síntese do ATP, transferindo os elétrons
liberados nas reações de oxidação dos nutrientes para a cadeia transportadora
de elétrons. O NADPH está envolvido na utilização da energia livre das reações
de oxidação para as reações de biossíntese redutivas. Esta diferenciação é
possível graças à especificidade das enzimas por suas coenzimas.
Para relembrar
como são as reações
catalisadas pelas
desidrogenases, você
pode retornar às
aulas que trataram
das reações da
glicólise e do ciclo de
Krebs, e observar as
reações catalisadas
pelas enzimas
gliceraldeído-3fosfato desidrogenase,
isocitrato
desidrogenase,
α-cetoglutarato
desidrogenase, ou
malato desidrogenase.
Bem, voltando às reações de biossíntese, estávamos dizendo que elas
requerem, além da energia armazenada na molécula de ATP, o poder
redutor do NADPH.
Na aula de hoje, você vai aprender como o NADPH é formado
nas células.
Você já aprendeu que o NAD+ é reduzido a NADH em uma
série de reações de oxidação catalisadas por enzimas chamadas
desidrogenases. O NADPH também é reduzido em reações de oxidação
catalisadas por desidrogenases; neste caso, outras desidrogenases que
usam como coenzima o NADP+ e não o NAD+. Vamos, agora, conhecer
estas reações, que fazem parte da via metabólica que chamamos via das
pentoses-fosfato.
Para simplificar, vamos
substituir a palavra
fosfato pela letra P
nas nomenclaturas
usadas a partir de
agora. Assim, glicose6-fosfato passa a ser
denominada glicose-6P,
frutose-6-fosfato passa
a ser frutose-6P, ribose5-fosfato passa a ser
ribose-5P e assim por
diante.
A via das pentoses-fosfato pode ser dividida em duas etapas, o ramo
oxidativo e o ramo não-oxidativo. O ramo oxidativo começa com a glicose6-fosfato (glicose-6P), que é desviada da via glicolítica, sendo convertida a
uma pentose-fosfato. Como o nome diz, pentoses são açúcares contendo
5 carbonos. Você já sabe que a glicose-6P possui 6 carbonos. Então, tente
responder: que tipo de reação deve ocorrer no ramo oxidativo da via das
pentoses de forma a gerar um açúcar de 5 carbonos?
A glicose-6P deve perder 1 carbono, o que ocorre através de uma
reação de descarboxilação.
150 CEDERJ
24 MÓDULO 7
AULA
O RAMO OXIDATIVO DA VIA DAS PENTOSES-FOSFATO
Observe, em seguida, as reações que compõem o ramo oxidativo
da via das pentoses-fosfato na Figura 24.1:
Como você pode observar, no ramo oxidativo ocorrem duas
reações de oxidação, cujas enzimas usam o NADP+ como coenzima,
sendo a última uma reação de descarboxilação também.
6-fosfogluconato
Figura 24.1: Reações do ramo oxidativo da via das pentoses-fosfato.
A primeira reação é catalisada pela enzima glicose-6P desidrogenase,
que converte a glicose-6P em 6-fosfoglucono-δ-lactona. Esta enzima é
específica para NADP+ e esta reação é a etapa mais regulada da via, como
veremos mais à frente. Em seguida, na segunda reação do ramo oxidativo,
a 6-fosfoglucono-δ-lactona é hidrolisada, formando 6-fosfogluconato.
Esta reação é catalisada pela enzima 6-fosfogluconolactanase. A última
reação do ramo oxidativo é uma descarboxilação oxidativa catalisada
pela enzima fosfogluconato desidrogenase, levando à redução de NADP+,
à liberação de CO2 e à formação da pentose ribulose-5P. Esta reação
é irreversível em condições fisiológicas (no ambiente intracelular, a
conversão de ribulose-5P de volta a 6-fosfogluconato não ocorre).
Assim, o ramo oxidativo da via das pentoses gera duas moléculas
A descarboxilação
oxidativa catalisada
pela enzima
fosfogluconato
desidrogenase
é semelhante à
reação catalisada
pela isocitrato
desidrogenase, enzima
do ciclo de Krebs.
de NADPH para cada molécula de glicose-6P.
CEDERJ 151
BIOQUÍMICA II | Via das pentoses-fosfato
O RAMO NÃO-OXIDATIVO DA VIA DAS PENTOSESFOSFATO
O ramo não-oxidativo é composto por uma série de reações, todas
elas reversíveis. Ele começa com a conversão de moléculas de ribulose-5P
em duas outras pentoses: a ribose-5P ou a xilulose-5P, como mostrado
na Figura 24.2:
isomerase
Figura 24.2: Conversão de ribulose-5P em ribose-5P e xilulose-5P.
A ribose-5P é um componente dos nucleotídeos, podendo ser usada
na formação destes compostos. Entretanto, nem sempre o requerimento
de poder redutor para as reações de biossíntese coincide com a necessidade
de ribose-5P. Assim, as reações do ramo não-oxidativo são responsáveis
pela conversão das pentoses formadas em intermediários comuns do
metabolismo, que podem ser usados em outras vias metabólicas.
Mas como isso ocorre?
As pentoses-fosfato são convertidas em intermediários da via
glicolítica através de uma série de reações de rearranjo. Essas reações
consistem na clivagem e na formação de ligações C – C, como veremos a
seguir. Em última análise, duas moléculas de xilulose-5P e uma molécula
de ribose-5P são convertidas em duas moléculas de frutose-6P e uma
molécula de gliceraldeído-3P, ambos intermediários da glicólise.
152 CEDERJ
24 MÓDULO 7
AULA
Assim, os 15 carbonos presentes nas três pentoses são rearranjados
como duas moléculas de 6 carbonos (2 frutose-6P) e uma molécula de 3
carbonos (o gliceraldeído-3P), somando 15 carbonos. Estas reações são
catalisadas por dois tipos de enzimas, as transaldolases e as transcetolases.
As transaldolases transferem fragmentos de 3 carbonos e as transcetolases
transferem fragmentos de 2 carbonos. Acompanhe a série de reações
mostradas na Figura 24.3:
gluconolactona
ribulose P
isomerase
sedoheptulose
gliceraldeído 3P
Figura 24.3: Reações do
ramo não-oxidativo da
via das pentoses-fosfato.
4P
CEDERJ 153
BIOQUÍMICA II | Via das pentoses-fosfato
À primeira vista, este conjunto de reações assusta, pois parece muito
complicado. Mas se você prestar atenção, o que ocorre nada mais é do que
a troca de pedaços entre uma molécula e outra. Primeiro, um fragmento de
2 carbonos é transferido da xilulose-5P para a ribose-5P. Esta transferência
resulta em uma molécula de 7 carbonos, a sedoheptulose-7P, e uma
molécula de 3 carbonos, o gliceraldeído-3P. Então, um fragmento de
3 carbonos é transferido da sedoheptulose-7P para o gliceraldeído-3P,
formando uma molécula de 4 carbonos, a eritrose-4P, e uma molécula
de 6 carbonos, a frutose-6P. Finalmente, o fragmento de 2 carbonos é
transferido de outra molécula de xilulose-5P para a eritrose-4P, formada
na reação anterior, gerando mais uma molécula de gliceraldeído-3P e mais
uma molécula de frutose-6P. O resultado final, como já mencionamos, é
a conversão de 3 pentoses-fosfato em duas moléculas de frutose-6P e uma
molécula de gliceraldeído-3P, que podem seguir pela via glicolítica.
Veja, agora, o esquema geral de como isso ocorre dentro da célula
na Figura 24.4.
Figura 24.4: Visão esquemática da via das pentoses-fosfato na célula.
154 CEDERJ
24 MÓDULO 7
AULA
REGULAÇÃO DA VIA DAS PENTOSES-FOSFATO
O fluxo através da via das pentoses-fosfato e, conseqüentemente, a
taxa de redução de NADP+ a NADPH são regulados essencialmente pela
atividade da glicose-6P desidrogenase. Esta enzima é regulada pelos níveis
de NADP+, um de seus substratos. Quando a célula consome NADPH,
quando começa a sintetizar lipídeos, por exemplo, a concentração de
NADP+ aumenta, favorecendo a atividade da glicose-6P desidrogenase,
regenerando o NADPH.
Um outro aspecto importante da regulação desta via requer uma
visão mais integrada do metabolismo. Vamos relembrar o que ocorre
durante a síntese de ácidos graxos. O citrato, em excesso na mitocôndria,
é transportado para o citoplasma, onde irá fornecer acetil-CoA para o
início da síntese de ácidos graxos. Ao mesmo tempo, o citrato funciona
também como um regulador da atividade de duas enzimas citoplasmáticas:
Se você tiver
dificuldade de
acompanhar esta parte,
volte à aula que trata
da síntese de ácidos
graxos e relembre
os principais pontos
abordados.
a acetil-CoA carboxilase, que se polimeriza na presença de citrato, se
tornando ativa; e a fosfofrutocinase (PFK), enzima da glicólise, que é
inibida por citrato. A inibição da PFK permite o acúmulo de glicose-6P,
que pode, então, seguir pela via das pentoses-fosfato. Para compreender e
integrar melhor todas estas informações, observe com cuidado o esquema
mostrado na Figura 24.5.
Figura 24.5: Integração
da via das pentoses-fosfato à glicólise e à síntese
de ácidos graxos.
CEDERJ 155
BIOQUÍMICA II | Via das pentoses-fosfato
A VIA DAS PENTOSES EM DIFERENTES TECIDOS E
DIFERENTES SITUAÇÕES FISIOLÓGICAS
Os principais produtos da via das pentoses-fosfato são NADPH e
ribose-5P. As reações das enzimas transaldolases e transcetolases servem
para converter o excesso de ribose-5P em intermediários da glicólise, quando
há mais requerimento de NADPH do que de ribose-5P. A frutose-6P e
o gliceraldeído-3P podem seguir a via glicolítica, sendo completamente
oxidados. Isto ocorre quando há predominância da síntese de ácidos
graxos na célula em relação ao requerimento de nucleotídeos, nos
principais tecidos que realizam a síntese de ácidos graxos, como o
fígado, as glândulas mamárias em lactação e tecido adiposo, ou em
tecidos que sintetizam hormônios esteróides (que são lipídeos), como
os testículos ou o córtex da glândula adrenal. Por outro lado, o músculo,
por exemplo, não realiza síntese de lipídeos, e não necessita, portanto de
NADPH. Neste tecido, a ribose-5P necessária para a síntese de nucleotídeos
é formada a partir de frutose-6P e gliceraldeído-3P, através das reações
do ramo não-oxidativo da via das pentoses-fosfato, que ocorrem no
sentido inverso.
Um outro tipo celular precisa muito da via das pentoses-fosfato:
as hemácias. Estas células apresentam altos níveis de glutationa, um
antioxidante fundamental para a proteção dos fosfolipídios de sua
membrana frente a danos oxidativos. A síntese de glutationa depende
de NADPH, fornecido pela vias das pentoses. Por isso, a via das pentoses
é muito ativa nas hemácias, garantindo a integridade destas células.
DEFICIÊNCIA NA GLICOSE-6P DESIDROGENASE
Quando algumas drogas aparentemente não perigosas, como drogas
antimalária, antipiréticos ou antibióticos de sulfa, são administradas em
alguns pacientes, uma anemia hemolítica aguda pode ocorrer após 48
a 96 horas. Isso pode acontecer devido a uma deficiência genética na
enzima glicose-6P desidrogenase. Estas drogas atacam a membrana das
hemácias, cuja integridade depende da manutenção da glutationa reduzida,
que, por sua vez, depende do NADPH produzido na via das pentoses,
como comentamos anteriormente. Assim, as hemácias de indivíduos com
deficiência na glicose-6P desidrogenase não são capazes de se proteger da
hemólise causada pelas drogas em questão.
156 CEDERJ
24 MÓDULO 7
AULA
RESUMO
As células usam NAD+ nas reações oxidativas e NADPH nas biossínteses redutivas.
O NADPH é sintetizado através de um caminho alternativo de oxidação da
glicose, a via das pentoses-fosfato. Esta via pode ser dividida em duas fases: o
ramo oxidativo e o ramo não-oxidativo. O ramo oxidativo tem como função a
redução de NADPH para as reações de biossíntese, assim como a formação de
pentoses-fosfato para a síntese de nucleotídeos, através da oxidação da glicose6P. A velocidade desta via é determinada pela atividade da enzima glicose-6P
desidrogenase, controlada basicamente pelos níveis de NADP+. A capacidade das
enzimas de distinguirem NADH (que é essencialmente utilizado no metabolismo
energético) de NADPH (utilizado essencialmente como poder redutor das reações
biossintéticas) permite que as reações de síntese e de degradação sejam reguladas
independentemente. O ramo não-oxidativo permite a conversão das pentoses
formadas em intermediários da via glicolítica, possibilitando sua utilização em
outras vias do metabolismo da célula.
EXERCÍCIOS
1. Em que tecidos a via das pentoses-fosfato pode ocorrer?
2. Imagine um hepatócito sintetizando ácidos graxos ativamente. De que maneira
a via das pentoses-fosfato contribui para este processo e quais os produtos por
ela gerados nesta situação?
3. As células musculares não realizam a síntese de ácidos graxos, mas podem
precisar de nucleotídeos. A ribose-5P, um dos produtos da via das pentoses, é
um dos componentes dos nucleotídeos. Explique como a ribose-5P é formada no
músculo sem que haja produção concomitante de NADPH.
4. Qual é a importância da via das pentoses-fosfato nas hemácias?
CEDERJ 157
objetivo
AULA
Degradação do glicogênio
25
Ao final desta aula, você deverá ser capaz de:
• Compreender as vias de degradação do
glicogênio.
Pré-requisitos
Ter compreendido a estrutura da célula vegetal
(Aula 5) e ter pleno conhecimento da organização
dos meristemas primários e secundários (Aula 6),
bem como dos sistemas fundamental (Aula 8) e
vascular – xilema (Aula 9).
BIOQUÍMICA II | Degradação do glicogênio
INTRODUÇÃO
A degradação do glicogênio em glicose ou glicose-1P denomina-se
glicogenólise e a glicogênese refere-se à síntese do glicogênio. Esses
processos são de extrema importância em quase todos os tecidos, mas
especialmente no fígado e nos músculos.
O fígado é o principal órgão para estocar o glicogênio. Em humanos bem
alimentados, o conteúdo de glicogênio do fígado pode contribuir para cerca de
6% a 10% do peso seco deste órgão. Os músculos estocam uma quantidade
menor, em torno de 1 a 2% do seu peso seco. Entretanto, como a massa
muscular é maior do que a massa hepática, na maioria das pessoas o teor
de glicogênio muscular pode corresponder a cerca de duas a quatro vezes o
teor de glicogênio hepático. Veja a Tabela 25.1.
Tabela 25.1: Armazenamento de carboidratos em homens adultos normais (70 kg)
(MURRAY, Robert K. et al. Haper : Bioquímica. 8. ed. São Paulo: Atheneu, 1998.)
Glicogênio hepático
4,0 %
72g1
Glicogênio muscular
0,7 %
245g2
Glicogênio extracelular
0,1%
10g3
1
Peso do fígado = 1800g
Massa muscular = 35 kg
3
Volume total = 10l
2
Os estoques de glicogênio hepático e muscular apresentam papéis diferentes.
No músculo, o glicogênio serve como combustível para a síntese de ATP,
enquanto o glicogênio do fígado funciona como uma reserva de glicose para
a manutenção dos níveis sangüíneos desta substância. Os níveis de glicogênio
hepático variam com a ingestão de alimento, acumulando altos níveis logo após
a alimentação. Após 12 a 18 horas de jejum, o fígado torna-se quase totalmente
desprovido de glicogênio (veja a Figura 25.1), já o glicogênio do músculo só
diminui após exercício vigoroso prolongado. As reservas de glicogênio hepático
são, portanto, úteis para o intervalo entre as refeições.
Elas mantêm-se um pouco mais elevadas para atender o jejum noturno.
160 CEDERJ
25 MÓDULO 7
AULA
O glicogênio do músculo é uma fonte de ATP para aumentar a atividade
muscular. A maioria da glicose do glicogênio muscular é consumida dentro
das células musculares sem a formação de glicose livre como intermediário.
O glicogênio do fígado é convertido em glicose para que esta alcance
a corrente sangüínea no momento de jejum. A conversão de glicose em
glicogênio no músculo é mais importante do que a glicogênese hepática para
diminuir os níveis de glicose sangüínea após as refeições.
Os grânulos de glicogênio são abundantes no fígado de animais bem
alimentados, mas são bem reduzidos no fígado de animais após 24 horas
de jejum. Veja a Figura 25.1. Exercícios intensos causam a mesma perda de
glicogênio muscular. Os grânulos de glicogênio correspondem a agregados de
moléculas de glicogênio e possuem massa molecular em torno de 2x107 Da.
Figura 25.1: Micrografia eletrônica mostrando grânulos de glicogênio (pontos
pretos) no fígado de um rato bem alimentado (a) e a ausência relativa de
tais grânulos no fígado de um rato em jejum por 24 horas (b).
(DEVLIN, Thomas M. Textbook of Biochemistry : with clinical correlations.
4.ed. New York: Wiley-Liss, 1997.)
A figura foi originalmente fornecida pelo Dr. Robert R. Cardell do Department of Anatomy at the University of Cincinnati.
CEDERJ 161
BIOQUÍMICA II | Degradação do glicogênio
GLICOGENÓLISE
A glicogênio fosforilase catalisa a primeira etapa da degradação
do glicogênio
A glicogênio fosforilase catalisa a fosforólise (clivagem pela entrada
de um fosfato) do glicogênio, uma reação na qual um Pi é usado na
clivagem de uma ligação α-1,4-glicosídica para render glicose 1-fosfato
(Figura 25.2). Essa clivagem sempre ocorre no terminal não-redutor da
molécula de glicogênio.
não-redutor
Glicogênio fosforilase
Figura 25.2: Reação catalisada pela glicogênio fosforilase.
A próxima etapa da degradação do glicogênio é catalisada pela
enzima fosfoglicomutase, uma enzima que transfere o fosfato da posição 1 da
molécula de glicose1-P para a posição 6, formando uma molécula de glicose
6-P. Essa reação permanece próxima ao equilíbrio em condições celulares,
permitindo que ela ocorra tanto no sentido de formação de glicose 1-P
(quando a síntese de glicogênio é necessária) ou no sentido de formação de
glicose 6-P quando há necessidade glicose na corrente sangüínea ou quando
a glicólise para a produção de energia é necessária (Figura 25.3).
162 CEDERJ
25 MÓDULO 7
AULA
Figura 25.3: Reação catalisada pela enzima fosfo-glicomutase.
A próxima enzima envolvida na glicogenólise depende do tecido
em consideração, veja a Figura 25.4. No fígado, a glicose-6-fosfato é
hidrolisada em glicose e Pi. Desse modo a glicose liberada pode ser
transportada da célula hepática para a corrente sangüínea e ser conduzida
para diversos tecidos extra-hepáticos. O músculo não possui a enzima
glicose-6-fosfatase; por isso a glicose-6-P formada
é utilizada pela própria célula muscular. A
Figura 25.4 mostra um esquema da glicogenólise,
destacando o destino dos produtos de degradação
do glicogênio no fígado e nos tecidos periféricos.
Note que o piruvato formado pode ser degradado
em CO2 + H2O (o que ocorre nos músculos
que operam em aerobiose como o coração,
por exemplo) ou em lactato, o que ocorre nos
músculos que recebem menos oxigênio.
Como você deve
se lembrar, pois foi visto
em Bioquímica I, o glicogênio é uma molécula
ramificada. A primeira
enzima envolvida na
de gra dação do glicogênio, a glicogênio fosforilase, é específica para
ligações glicosídicas α-1,4. Entretanto ela deixa de
atuar quando se aproxima (4 resíduos antes) dos
pontos de ramificação (ligações glicosídicas α-1,6).
A molécula residual da hidrólise do glicogênio
pela enzima glicogênio fosforilase é denominada
dextrina limite.
Figura 25.4: Glicogenólise
no fígado e em tecidos
periféricos.
CEDERJ 163
BIOQUÍMICA II | Degradação do glicogênio
Para que a clivagem dessa dextrina limite ocorra, faz-se necessária a ação
de uma enzima desramificadora. A enzima desramificadora é uma enzima
bifuncional, que catalisa duas reações necessárias para desramificar o
glicogênio. A primeira ação é uma atividade 4-α-D-glicanotransferase
na qual uma fita com três resíduos glicosil é removida do quarto resíduo
a partir da ramificação da molécula de glicogênio (Figura 25.5). A fita
permanece covalentemente ligada à enzima até que ela seja transferida
para o grupo 4-hidroxil de um resíduo glicosil do terminal da mesma
molécula de glicogênio ou de uma molécula adjacente. O resultado é
a formação de uma cadeia maior de amilose com somente um resíduo
glicosil permanecendo em uma ligação α-1,4. Essa ligação é
clivada pela segunda ação da enzima desramificadora,
que é uma atividade amilo-α-1,6 glicosidase. A
ação cooperativa entre a glicogênio fosforilase
e a enzima desramificadora resulta em
completa fosforólise e hidrólise do
glicogênio. As doenças de
estoque de glicogênio
ocorrem quando
uma dessas
enzimas é
deficiente.
Figura 25.5: Ação da enzima desramificadora.
164 CEDERJ
25 MÓDULO 7
AULA
RESUMO
A degradação dos estoques de glicogênio (glicogenólise) ocorre através da ação
da glicogênio fosforilase. A ação desta enzima é remover fosforoliticamente
um resíduo de glicose a partir da quebra de uma ligação α1,4 da molécula de
glicogênio. O produto desta reação é a glicose-1-fosfato.
A glicose-1-fosfato produzida pela ação da fosforilase é convertida em glicose-6fosfato pela fosfoglicomutase.
A conversão de glicose-6-fosfato em glicose, que ocorre no fígado, rim e intestinos,
pela ação da glicose 6-fosfatase, não acontece no músculo esquelético devido à
falta desta enzima. No fígado, a ação desta enzima conduz a glicogenólise para
geração de glicose livre e a manutenção da concentração desta no sangue.
A fosforilase não remove resíduos de glicose a partir das ligações α1,6 do
glicogênio. A atividade da fosforilase cessa a quatro resíduos de glicose do
ponto de ramificação. Para a remoção de glicose destes pontos é necessária a
ação da enzima desramificadora (também conhecida por glucan transferase), que
contém duas atividades: glicotransferase e glicosidase. A atividade de transferase
remove um bloco de três grupamentos glicosil de uma ramificação para outra. A
glicose em uma ligação α1,6 da ramificação é removida pela ação da glicosidase.
Teoricamente, a glicogenólise ocorre no músculo esquelético e pode gerar alguma
glicose livre para entrar na corrente sangüínea. No entanto, a glicose livre é
imediatamente fosforilada e entra na via glicolítica para produzir ATP quando a
demanda energética é baixa.
Os exercícios referentes às Aulas 25, 26 e 27 serão propostos após a Aula 27.
CEDERJ 165
objetivo
AULA
Biossíntese do glicogênio
26
Ao final desta aula, você deverá ser capaz de:
• Compreender as vias de biossíntese do
glicogênio.
Pré-requisito
É fundamental rever os assuntos ligados à
estrutura e função dos carboidratos, abordados
nas Aulas 32, 33 e 34 de Bioquímica I.
BIOQUÍMICA II | Biossíntese do glicogênio
INTRODUÇÃO
Em diversos organismos, o excesso de glicose é convertido em formas poliméricas
para fins de estoque e em dissacarídeos para fins de transporte. Como você
aprendeu em Bioquímica I, a principal forma de estoque de glicose em
vertebrados e em microorganismos é o glicogênio, enquanto em plantas
é o amido. Em vertebrados, a própria glicose é transportada no sangue; em
plantas, a forma de transporte é a sacarose; e em insetos é a trealose.
Muitas das reações nas quais as hexoses são transformadas ou polimerizadas
envolvem nucleotídeos ligados a açúcares, compostos nos quais o carbono
anomérico do açúcar é ativado pela ligação do nucleotídeo, através de uma
ligação fosfo-diéster. Assim, os açúcares-nucleotídeo são os substratos para a
polimerização dos monossacarídeos em dissacarídeos e polissacarídeos.
168 CEDERJ
26 MÓDULO 7
AULA
A BIOSSÍNTESE DO GLICOGÊNIO ENVOLVE UM
NUCLEOTÍDEO ESPECIAL DA GLICOSE
A glicose é fosforilada a glicose 6-fosfato (=glicose 6-P), uma
reação que é comum à primeira reação da via glicolítica. Esta reação é
catalisada pela hexoquinase no músculo e pela glicoquinase no fígado.
Então a glicose 6-P é convertida em glicose-1-P na reação catalisada pela
fosfoglicomutase. Esta enzima, a fosfoglimutase, é fosforilada e o grupo
fosfato participa na reação reversível em que a glicose-1,6-bifosfato é
um intermediário da reação. Veja a reação abaixo:
P
ENZ-P + Glicose-6-P
ENZ + Glicose-1,6-biP
Enz-P + glicose-1-P
A seguir, a glicose 1-P reage com a uridinatrifosfato (UTP) para
formar o nucleotídeo ativo, a uridina-difosfato-glicose (UDPGlicose, ou
UDPGlc). Essa reação é catalisada pela enzima UDP-Glc-pirofosforilase.
Veja a estrutura da UDPGlicose na Figura 26.1. Observe a reação:
UTP + Glicose-1P
UDP Glicose + PPi
Figura 26.1: Estrutura da UDP glicose (Uridina difosfato – glicose).
CEDERJ 169
BIOQUÍMICA II | Biossíntese do glicogênio
A hidrólise subseqüente do pirofosfato inorgânico (PPi) pela
pirofosfatase inorgânica desloca o equilíbrio da reação para a direita
da equação.
Pela enzima glicogênio sintase, o carbono 1 da glicose ativada,
UDPGlc, forma uma ligação glicosídica com o carbono 4 da glicose
terminal do glicogênio que está sendo formado, liberando uma uridina
difosfato (UDP). Um resumo da via de síntese do glicogênio é apresentado
na Figura 26.2. Uma molécula de glicogênio preexistente, ou primer de
glicogênio, deve estar presente para iniciar a reação.
Figura 26.2: Via de síntese do glicogênio.
170 CEDERJ
26 MÓDULO 7
AULA
Até recentemente, a fonte da primeira molécula de glicogênio
que podia atuar como um primer na sua síntese era desconhecida.
Recentemente, foi descoberto que uma proteína conhecida como
glicogenina e que está localizada no centro da molécula de glicogênio,
pode ajudar nesta questão. A glicogenina tem uma propriedade
incomum: a de catalisar a sua própria glicosilação, fixando o carbono-1
da UDP glicose a um resíduo de tirosina na enzima. A glicose fixada
pode servir como um primer requerido pela glicose sintase.
UDPGlicose
+
(C6)n
UDP
(primer do glicogênio)
+
(C6)n+1
(glicogênio)
CRESCIMENTO DA RAMIFICAÇÃO DA CADEIA DE
GLICOGÊNIO
A adição de um resíduo de glicose em uma cadeia de glicogênio
preexistente, ou primer, ocorre na extremidade não redutora da molécula,
de modo que as ramificações da árvore de glicogênio tornam-se alongadas
pela formação de ligações de glicose α1
4 sucessivas (veja Figura
26.3). Quando a cadeia for alongada em 11 resíduos de glicose, uma outra
enzima, a enzima de ramificação, isto é, a (amido [1
transglicosidase) transfere parte da cadeia 1
4
1
6]
4 (mínimo de seis resíduos
de glicose) para uma cadeia adjacente, para formar uma ligação 1
6,
estabelecendo assim um ponto de ramificação na molécula. As ramificações
crescem por novas adições de unidades de glicose 1
4 e formam-se
novas ramificações. Como aumenta o número de resíduos terminais não
redutores, também aumenta o numero total de sítios reativos da molécula,
acelerando tanto a glicogênese como a glicogenólise.
A glicogenólise e a glicogênese ocorrem no citosol das células
hepáticas e musculares. Assim, como o intermediário glicose-1P é
gerado na glicogenólise e este mesmo intermediário pode ser usado para
a glicogênese, há necessidade de um mecanismo de regulação muito
ajustado para que sítios fúteis (degradação e biossíntese de glicogênio
simultaneamente) não ocorram em uma mesma célula. É sobre esse
processo de regulação que falaremos na Aula 27.
CEDERJ 171
BIOQUÍMICA II | Biossíntese do glicogênio
(7) UDP glicose
Figura 26.3: Ação da enzima ramificadora.
172 CEDERJ
26 MÓDULO 7
AULA
RESUMO
• A síntese do glicogênio a partir da glicose é executada pela glicogênio sintase.
Esta enzima utiliza como substratos: a UDP glicose e o estado final não reduzido
do glicogênio com outro substrato.
• A ativação de glicose, para ser usada pela síntese de glicogênio, é executada
pela UDP glicose-pirofosforilase. Esta enzima troca o fosfato do carbono-1 da
glicose-1-fosfato por UDP. A energia da ligação fosfoglicosil da UDP glicose é
utilizada pela glicogênio-sintase para catalisar a incorporação de glicose em uma
molécula preexistente do glicogênio. A molécula de UDP é subseqüentemente
liberada da enzima. As ramificações α-(1,6) na glicose são formadas pela ação da
amilo-(1,4-1,6)-transglicosilase, também designada por enzima de ramificação.
Esta transfere um fragmento terminal dos resíduos 6-7 da glicose (de um
polímero de no mínimo 11 resíduos de glicose) para um resíduo interno na
posição hidroxil C-6.
• A glicogenina, uma proteína de 37 kDa, atua como um primer para a síntese
do glicogênio.
Detalhes sobre as Aulas 25 e 26 podem ser obtidos no site:
http://www.icb.ufmg.br/~lbcd/prodabi3/grupos/grupo5/grupo5.html
CEDERJ 173
objetivos
AULA
Regulação do metabolismo
do glicogênio
27
Ao final desta aula, você deverá ser capaz de:
• Aprender sobre as vias de regulação do
metabolismo de glicogênio.
• Reforçar os conceitos adquiridos sobre
regulação alostérica, regulação por
modulação covalente e regulação hormonal.
Pré-requisito
Conhecimentos adquiridos nas
Aulas 2, 3, 25 e 26 de Bioquímica II.
BIOQUÍMICA II | Regulação do metabolismo do glicogênio
INTRODUÇÃO
Na Aula 25 você viu uma figura (25.1) que comparava os grânulos de glicogênio,
presentes no citosol de um hepatócito de rato bem alimentado, com os grânulos
existentes em um hepatócito de um rato em jejum. Você aprendeu, nas Aulas
25 e 26, que a degradação do glicogênio e a sua síntese ocorrem próximo a
estes grânulos, e, portanto, no citosol. Assim, podemos deduzir que as duas
enzimas chaves do metabolismo do glicogênio, a glicogênio fosforilase e a
glicogênio sintase, estejam distribuídas no citosol.
Agora pensemos juntos...
Durante a degradação do glicogênio liberamos glicose-1-fosfato pela ação
da glicogênio fosforilase; esta molécula é usada na síntese do glicogênio,
pela ação da glicogênio sintase. Uma célula precisa, portanto, de sistemas de
regulação muito aprimorados para impedir a realização de ciclos fúteis, ou
seja, reações que aparentemente não conduziriam a lugar algum. Neste caso,
a glicose 1-P gerada na degradação do glicogênio para atender a necessidade
de aumento dos níveis de glicose sangüínea ou para alimentar a via glicolítica
poderia ser imediatamente utilizada para repor as reservas de glicogênio. Para
impedir tal ciclo fútil, nosso organismo desenvolveu mecanismos de controle
simultâneos para cada uma destas duas enzimas. São estes mecanismos que
serão abordados nesta aula.
176 CEDERJ
27 MÓDULO 7
AULA
REGULAÇÃO DA GLICOGÊNIO FOSFORILASE
Como você deve ter aprendido na Aula 25, a glicogênio fosforilase
degrada glicogênio para gerar glicose quando os níveis desta, na corrente
sangüínea, estão baixos. Assim, utilizamos glicogênio durante o jejum
(como, por exemplo, no intervalo entre as refeições) ou ainda quando
necessitamos de energia. Um indicativo para a célula de que a demanda
energética está baixa pode ser visualizado por aumentos nos níveis de
AMP ou por decréscimo na concentração de ATP. Em função destas
observações, é fácil compreendermos que a glicogênio fosforilase esteja
sujeita à ativação alostérica por AMP cíclico e à inibição por glicose e
ATP. Além da regulação alostérica, a glicogênio fosforilase está sujeita
também a uma regulação por modulação covalente.
A glicogênio fosforilase existe em uma forma “a”, ativa, e
em uma forma “b” que é inativa. Estas formas são interconvertidas
pela ação das enzimas glicogênio fosforilase quinase e fosfo proteína
fosfatase. A primeira enzima catalisa a adição de um fosfato na enzima
glicogênio fosforilase (lembre-se de que toda enzima classificada como
quinase catalisa reações de fosforilação), enquanto a fosfo-proteína
fosfatase retira este fosfato adicionado. Você pode então observar
que a glicogênio fosforilase quinase ativa a glicogênio fosforilase, e a
fosfo-proteína fosfatase inibe a glicogênio fosforilase. Essas reações de
fosforilação ou de desfosforilação (um tipo particular de modulação
covalente) promovem mudanças conformacionais na glicogênio
fosforilase, que têm como conseqüências a transformação da enzima
para um estágio catalítico mais ativo, quando fosforilada, ou um estágio
!
Se você teve dúvida sobre o
que é regulação alostérica
e regulação por modulação
covalente, leia novamente
a Aula 3.
catalítico menos ativo, quando desfosforilada. Observe um resumo
destas informações na Figura 27.1.
CEDERJ 177
BIOQUÍMICA II | Regulação do metabolismo do glicogênio
Figura 27.1: Regulação da glicogênio fosforilase e da glicogênio fosforilase quinase por
modulação covalente.
A fosforilação converte as enzimas glicogênio
fosforilase e glicogênio fosforilase quinase em
suas formas ativas: glicogênio fosforilase (a) e
glicogênio fosforilase quinase (a).
A enzima glicogênio fosforilase quinase catalisa a reação de
adição de um fosfato, doado pelo ATP, à enzima glicogênio fosforilase,
sendo, portanto, responsável pela ativação desta ultima enzima.
Entretanto, a glicogênio fosforilase quinase está também sujeita à
regulação por uma proteína quinase A. Olhe novamente para a Figura
27.1 e observe estas afirmações. Você pôde reparar que a glicogênio
fosforilase quinase também existe nas formas (a) e (b). A mudança da
forma (b) para a forma (a) ocorreu após a fosforilação catalisada pela
proteína quinase. Novamente o fosfato inorgânico (Pi) adicionado
veio de uma molécula de ATP.
Agora pense comigo: “Se a proteína quinase A estivesse sempre
ativa na célula, provavelmente ela ativaria a glicogênio fosforilase
quinase, que por sua vez ativaria a glicogênio fosforilase. Com a
glicogênio fosforilase ativa seria praticamente impossível estocar
glicogênio.” Logo, com certeza, deve haver um mecanismo para
regular a proteína quinase A, a enzima responsável por disparar o
processo de regulação das duas outras enzimas; é este o mecanismo
que estudaremos agora.
178 CEDERJ
27 MÓDULO 7
AULA
REGULAÇÃO DA PROTEÍNA QUINASE A
A proteína quinase A é formada por quatro cadeias polipeptídicas,
ou seja, é um tetrâmero com duas subunidades reguladoras e duas
subunidades catalíticas que se encontram associadas, quando a enzima
está na forma inativa. Quatro moléculas de AMP cíclico (adenosina
mono-fosfato cíclica – cAMP) se ligam às subunidades reguladoras,
sendo duas por subunidade. Após a associação das moléculas de AMP
cíclico às subunidades reguladoras, as duas subunidades catalíticas são
liberadas, expondo seus sítios ativos. Neste caso dizemos que a proteína
quinase foi então ativada. Veja a Figura 27.2.
Figura 27. 2: Ativação da proteína quinase.
Todo o processo de ativação estaria resolvido se você soubesse quem
é a molécula AMP cíclico e como ela é formada. Vamos então conhecer
o processo de formação do AMP cíclico, uma molécula conhecida como
um segundo mensageiro celular.
CEDERJ 179
BIOQUÍMICA II | Regulação do metabolismo do glicogênio
FORMAÇÃO DO AMP CÍCLICO
Antes de falarmos exatamente sobre a formação do AMP cíclico
é importante que você relembre as situações metabólicas nas quais um
organismo necessita utilizar suas reservas de glicogênio. Duas são as
principais situações: a primeira é no intervalo entre as refeições, onde
o glicogênio hepático é consumido para manter os níveis da glicose
sangüínea em valores normais; a segunda ocorre nos momentos em que
o organismo precisa de energia para movimentos, como por exemplo
durante o exercício, ou em uma situação de alerta. No primeiro caso,
normalmente o sinal endógeno é queda nos níveis de glicose sangüínea,
situação à qual o organismo responde liberando o hormônio glucagon; no
segundo caso o hormônio adrenalina é liberado. Os hormônios glucagon
e adrenalina são, portanto, os primeiros mensageiros. Estes hormônios
são liberados na circulação, se dirigem aos órgãos- alvos, mas não podem
atravessar a membrana celular. Assim, glucagon e adrenalina se ligam aos
receptores presentes no fígado, no caso do glucagon, e no músculo, no
caso da adrenalina. Os receptores de membrana estão associados a uma
proteína que pode se ligar ao nucleotídeo guanosina trifosfato (proteína
G). Após esta ligação, a proteína G se desloca através da membrana e
ativa uma enzima, a adenilato ciclase, que se encontra associada a esta
membrana. A adenilato ciclase converte ATP em AMP cíclico no citosol
das células hepáticas e musculares. Veja a estrutura do AMP cíclico na
Figura 27.3 e o seu processo de formação na Figura 27.4.
Figura 27.3: Estrutura da adenosina monofosfato (AMP Cíclico).
180 CEDERJ
27 MÓDULO 7
AULA
Figura 27.4: Processo de formação do AMP cíclico.
CEDERJ 181
BIOQUÍMICA II | Regulação do metabolismo do glicogênio
Para dar prosseguimento às reações catalisadas pela proteína
quinase A, uma molécula de ATP se associa ao sítio catalítico que foi
exposto em cada uma das duas subunidades, permitindo que a proteína
a ser fosforilada receba um fosfato desta molécula de ATP. A proteína
quinase fosforilada se dissocia da subunidade catalítica e está pronta
para ativar outras proteínas no interior da célula. No caso em análise,
a proteína a ser fosforilada para ser ativada é a glicogênio fosforilase
quinase. Esta enzima catalisa a ativação da glicogênio fosforilase que
atua diretamente sobre o glicogênio. Observe esta cascata de ativações
na Figura 27.5.
Figura 27.5: Cascata de ativação da
glicogênio fosforilase.
182 CEDERJ
27 MÓDULO 7
AULA
REGULAÇÃO DA GLICOGÊNIO SINTASE
Bem, você já sabe que a glicogênio sintase catalisa a síntese da
molécula de glicogênio e que usa os componentes que são gerados na
degradação. Assim, a glicogênio sintase deve ser ativada no mesmo
momento em que a glicogênio fosforilase for inativada para que ciclos
de reação fúteis não ocorram na célula. Veja a forma eficiente que a
célula adotou para solucionar esta situação: a mesma proteína quinase
que fosforila a glicogênio fosforilase quinase, ativando-a, fosforila a
glicogênio sintase, tornando-a inativa.
Podemos concluir então que os hormônios que dispararam o
processo de ativação das enzimas envolvidas nas etapas de degradação
do glicogênio, no caso o glucagon e a adrenalina, são capazes de inibir
a enzima-chave do processo de biossíntese.
Se você observar cuidadosamente a parte inferior das Figuras 27.1
e 27.6, notará que o hormônio insulina ativa a fosfoproteína fosfatase,
uma enzima que catalisa a hidrólise da ligação éster-fosfato de proteínas
que foram fosforiladas, tanto glicogênio sintase quanto glicogênio
fosforilase. Assim, a insulina é um hormônio que possui uma
ação sobre o metabolismo do glicogênio, antagônica ao
glucagon e à adrenalina. Ou seja, ela estimula os
processos que levem à síntese do glicogênio.
Este hormônio é liberado pelo nosso
organismo logo após as refeições para
que os estoques de glicogênio sejam
repostos. Este assunto será também
abordado nas Aulas 30, 31 e 32.
Figura 27.6: Regulação da glicogênio sintase
por modulação covalente.
A fosforilação converte glicogênio sintase a
(ativa) em glicogênio sintase b (inativa).
CEDERJ 183
BIOQUÍMICA II | Regulação do metabolismo do glicogênio
RESUMO
• A degradação do glicogênio muscular ocorre quando a situação energética da
célula é baixa, ou seja, quando os níveis de ATP estão baixos e os níveis de AMP
estão elevados.
• O glicogênio hepático é utilizado no intervalo entre as refeições.
• A enzima chave do processo de glicogenólise é a glicogênio fosforilase. Esta
enzima é regulada por efetores alostéricos, por modulação covalente do tipo
fosforilação e por regulação hormonal.
• O AMP é um efetor positivo (ativador) da glicogênio fosforilase; já a glicose e
o ATP são efetores negativos.
• A glicogênio fosforilase existe em duas conformações: uma inativa, desfosforilada,
a forma b; uma forma ativa, fosforilada, a forma a. A enzima responsável por esta
fosforilação é a glicogênio fosforilase quinase.
• A enzima glicogênio fosforilase quinase é ativada por uma cascata de reações
disparada pelo aumento dos níveis de AMP cíclico dentro da célula.
• Os hormônios glucagon e adrenalina apresentam um mecanismo de ação
mediado por AMP cíclico. São hormônios cuja ação final é acelerar o processo de
glicogenólise.
• A insulina é um hormônio que ativa a fosfo-proteína fosfatase, a enzima que
catalisa a reação de retirada de um fosfato da enzima glicogênio fosforilase,
inativando-a. A insulina é, portanto, um hormônio que interrompe o processo de
glicogenólise e ativa o processo de glicogênese.
A enzima chave do processo de glicogênese é a glicogênio sintase, a qual é
regulada também por fosforilação. No entanto, de maneira oposta à glicogênio
fosforilase, a glicogênio sintase é inibida por fosforilação. Ambas as enzimas estão
presentes no citosol e necessitam da proteína quinase A para serem fosforiladas.
Assim, o fato de a glicogênio fosforilase ser ativada por um mesmo processo que
inativa a glicogênio sintase permitiu à célula coordenar processos de degradação e
biossíntese do glicogênio, passando por intermediários comuns, dentro do mesmo
compartimento celular.
184 CEDERJ
27 MÓDULO 7
1. Explique como as seguintes observações identificam o ponto de regulação da
síntese de glicogênio no músculo esquelético.
a) A medida da atividade da glicogênio sintase no músculo em repouso, expressa
em micromoles de UDP glicose usada por grama por minuto, é menor do que a
atividade da fosfo glicomutase medida também como micromoles de substrato
transformada por grama por minuto.
b) O estímulo da síntese de glicogênio leva a um decréscimo na concentração de
glicose 6-fosfato, a um grande decréscimo na concentração de UDP glicose e a
um substancial aumento de UDP.
Relacione as seguintes enzimas às situações apresentadas nas questões 2 a 5
(justifique cada resposta).
A- Glicogênio fosforilase
B- Enzima desramificadora
C- Proteína quinase
D- Adenilato ciclase
E- Glicose 6-fosfatase
2. Quando os níveis de glucagon sangüíneo aumentam, quais enzimas aumentam?
3. Qual enzima é bifuncional?
4. Qual enzima não está presente nos músculos mas está presente no fígado?
CEDERJ 185
AULA
EXERCÍCIOS REFERENTES ÀS AULAS 25, 26 E 27
BIOQUÍMICA II | Regulação do metabolismo do glicogênio
5. Qual enzima catalisa a retirada de uma molécula de glicose1-P do glicogênio?
6. Quando os níveis de glicose são diminuídos há uma ativação da glicogênio
fosforilase. Faça um esquema desse processo.
7. Discuta sobre o processo que permite a síntese do glicogênio.
8. A fosforilação ativa quais das seguintes enzimas?
(justifique cada resposta)
A- Glicogênio fosforilase.
B- Proteína quinase.
C- Fosforilase quinase.
D- Glicogênio sintase.
186 CEDERJ
objetivo
AULA
Introdução à
gliconeogênese
28
Ao final desta aula, você deverá ser capaz de:
• Conhecer uma importante via metabólica
que tem como função a manutenção dos
níveis sangüíneos de glicose. Entretanto, o
objetivo mais importante desta aula não
será estudarmos em detalhe as reações que
fazem parte desta via, mas sim começarmos a
entender o metabolismo de nosso organismo
de forma mais integrada.
Pré-requisito
Você deve ter acompanhado bem a matéria até
agora, pois vai ser necessário retornar a vários
pontos explorados anteriormente.
BIOQUÍMICA II | Introdução à gliconeogênese
INTRODUÇÃO
Até agora, você conheceu diversos caminhos metabólicos responsáveis tanto
pela degradação dos nutrientes com conseqüente síntese de ATP, como
também pela síntese de macromoléculas fundamentais para o funcionamento
das células e do organismo. Para terminarmos nosso curso, ainda precisamos
estudar mais uma via metabólica, chamada gliconeogênese, que é o tema
de nossas próximas aulas. Entretanto, faremos isso de uma forma um pouco
diferente, pois usaremos o estudo desta via para começarmos a integrar todo
o conhecimento adquirido até agora, de forma que você consiga construir
uma visão de como funciona nosso corpo. Por isso, talvez, muitas vezes seja
necessário voltar às aulas anteriores para consultas, o que você deve fazer
sempre que sentir necessidade. Assim, esta parte da matéria também permitirá
que você revise e sedimente vários pontos anteriormente estudados.
Vamos começar com uma atividade que servirá para você relembrar os principais
aspectos relacionados à utilização de nutrientes pelo organismo e também para
introduzir o tema da aula.
ESTUDOS SOBRE O JEJUM PROLONGADO
Na década de 1960, uma corrente da Medicina pregava que a
melhor forma de tratar a obesidade era submeter os pacientes obesos a um
jejum prolongado assistido. Com isso, muitos indivíduos se internaram
por cerca de seis semanas, as quais passaram sem se alimentar. Além de
promover de fato o emagrecimento dos pacientes, esse tipo de tratamento
permitiu a obtenção de uma série de dados a respeito do comportamento
do organismo em decorrência da falta de alimentação. Desta forma, o
estudo do metabolismo durante o jejum possibilitou a compreensão
de uma série de regulações e adaptações metabólicas essenciais para
o entendimento do funcionamento do nosso corpo, mesmo em outras
situações bem mais freqüentes.
188 CEDERJ
28 MÓDULO 7
AULA
Vamos, agora, observar a Tabela 28.1. Ela mostra algumas
medidas obtidas a partir do acompanhamento dos pacientes obesos
em tratamento.
Tabela 28.1: Variações das concentrações plasmáticas de glicose e ácidos graxos e do conteúdo de glicogênio
hepático de um paciente em jejum prolongado.
0
5,5
glicose] (mM)
0,3
[ácidos graxos] (mM)
Glicogênio hepático (g) 97
2h
4h
5,4
0,35
84
5,0
0,4
70
1 dia 3 dias 7 dias 8 dias 10 dias 28 dias
4,4
0,5
14
3,8
1,18
3
3,6
1,15
--
3,5
1,58
--
3,8
1,36
--
3,6
1,44
--
Tente construir, a partir dos dados apresentados na tabela, um
gráfico que relacione o tempo em jejum com a concentração sangüínea de
Conteúdo de glicogênio hepático
(g)
hepático (g)
glicose e de ácidos graxos e com a quantidade de glicogênio no fígado.
CEDERJ 189
BIOQUÍMICA II | Introdução à gliconeogênese
Confira se o gráfico construído por você ficou igual ao gráfico
Conteúdo de glicogênio hepático (g)
mostrado na Figura 28.1.
Figura 28.1: Variações das concentrações plasmáticas de glicose e ácidos graxos e do
conteúdo de glicogênio hepático de um paciente em jejum prolongado.
VARIAÇÕES NA CONCENTRAÇÃO SANGÜÍNEA DE ÁCIDOS
GRAXOS DURANTE O JEJUM
Vamos começar analisando o que ocorre com a concentração de
ácidos graxos circulantes. Observando o gráfico, vemos que ocorre um
aumento da concentração sangüínea dessas moléculas logo no início
do jejum. Isso se dá, como já vimos na aula que trata da degradação
dos ácidos graxos, devido à ativação da lipólise no tecido adiposo,
resultando na hidrólise dos triacilgliceróis armazenados e na liberação,
para a corrente sangüínea, de glicerol e ácidos graxos. Estes últimos
passam a ser utilizados como fonte energética exclusiva pela maioria dos
órgãos e tecidos, incluindo o fígado, os músculos e os rins. O aumento
da lipólise ocorre pela ativação da enzima lipase sensível a hormônio
(LHS) no tecido adiposo.
Até o momento ficou claro o motivo do aumento da concentração
de ácidos graxos circulantes no início do jejum.
190 CEDERJ
28 MÓDULO 7
AULA
Mas, e após alguns dias? Vemos no gráfico que os níveis dessas moléculas se
estabilizam, permanecendo constantes ao longo de todo o jejum. Como você
explicaria essa observação? Será que o organismo de repente pára de usar os
ácidos graxos?
Não. O motivo da estabilização é que, ao mesmo tempo em que
está ocorrendo a hidrólise dos triacilgliceróis e a liberação de ácidos
graxos do tecido adiposo, vários órgãos e tecidos estão consumindo esses
nutrientes como fonte de energia. É o caso do fígado, dos músculos, do
próprio tecido adiposo, dos rins etc. Por isso, ao longo de todo o jejum,
os triacilgliceróis vão sendo consumidos, de forma que o tecido adiposo
vai diminuindo e o indivíduo vai emagrecendo. Observe na Tabela 28.2
a perda de peso de vários indivíduos submetidos ao jejum como forma
de tratamento da obesidade na década de 1960.
Tabela 28.2: Caracterização dos indivíduos submetidos ao jejum prolongado.
Indivíduo Idade (anos)
1
2
3
4
5
19
21
28
16
20
Sexo
M
M
M
F
F
Peso (kg)
Inicial
Final
Diferença
125,2
160,6
178,6
104,1
108,9
101,8
138,2
159,6
88,4
93,0
23,4
22,4
15,7
15,7
15,9
Lembre-se de que as
reações da β-oxidação
dos ácidos graxos
levam à produção de
1 NADH e 1 FADH2
por cada dois carbonos
retirados da cadeia
do ácido graxo. Essas
coenzimas reduzidas
levam elétrons para
a cadeia respiratória,
contribuindo para
a síntese de ATP.
Além disso, as
várias moléculas de
acetil-CoA formadas
também podem
ser completamente
oxidadas no ciclo de
Krebs, gerando mais
ATPs.
Agora que você entendeu bem a utilização dos ácidos graxos ao
longo do jejum, podemos levantar uma outra questão.
Será que todas as nossas células estão usando os ácidos graxos como fonte de
energia nessa situação?
CEDERJ 191
BIOQUÍMICA II | Introdução à gliconeogênese
Para responder a essa pergunta, você precisa primeiro relembrar
mais alguns aspectos relacionados à β-oxidação dos ácidos graxos.
As enzimas que catalisam as reações dessa via se localizam na matriz
mitocondrial, onde se encontra todo o aparato oxidativo da célula.
Entretanto, nem todas as nossas células possuem mitocôndrias. O exemplo
mais conhecido é o das hemácias, que perdem todas as suas organelas ao
longo de seu amadurecimento. Podemos citar também algumas células
do olho, que, por estarem envolvidas com a captação de luz, não podem
conter muitas moléculas que absorvem luz na faixa do visível, como os
citocromos, uma vez que estes poderiam interferir no processo da visão.
Assim, estas células possuem pouquíssimas mitocôndrias.
Logo, essas células, por não possuírem mitocôndrias, não podem
Para tirar qualquer
duvida sobre
fermentação
consulte as Aulas
10 e 11.
realizar a β-oxidação nem o metabolismo oxidativo, e sintetizam suas
moléculas de ATP através do processo de fermentação láctica, cujo
substrato é a glicose.
Mas não são apenas as células sem
Como você aprendeu em Bioquímica I, os
mitocôndrias que realizam o metabolismo
lipídeos, por serem moléculas apolares, e,
anaeróbico, que são incapazes de utilizar
portanto, não solúveis em meio aquoso, circulam
os ácidos graxos como fonte de energia. As
no sangue associados a proteínas, formando
células do tecido nervoso se encontram isoladas
as lipoproteínas plasmáticas. Diferentes
lipoproteínas são responsáveis pelo transporte
por um tecido especializado, chamado barreira
dos lipídeos, dependendo da origem do lipídeo.
hemato-encefálica, que filtra o sangue antes que
Os lipídeos obtidos da alimentação circulam
este atinja o cérebro. Os ácidos graxos, que
associados aos quilomícrons; os lipídeos
sintetizados no fígado circulam associados às
circulam associados à albumina, não conseguem
LDL ou VLDL (lipoproteína de densidade baixa
atravessar essa barreira, e, por isso, não chegam
ou muito baixa, respectivamente); os ácidos
ao cérebro. Assim, o nutriente disponível para
o metabolismo cerebral é a glicose.
192 CEDERJ
graxos liberados do tecido adiposo circulam
associados à albumina.
28 MÓDULO 7
AULA
VARIAÇÕES NA CONCENTRAÇÃO SANGÜÍNEA DE GLICOSE
DURANTE O JEJUM
Vamos voltar ao nosso gráfico.
Agora que você já sabe que existem alguns tipos celulares que,
por serem incapazes de usar os ácidos graxos, requerem a glicose como
fonte de energia, tente explicar a curva de variação da concentração de
glicose no sangue dos indivíduos em jejum.
Observe que, no início, a GLICEMIA cai um pouco. Entretanto, logo
GLICEMIA
após esse período inicial de jejum, a concentração sangüínea de glicose
Concentração de
glicose no sangue.
se mantém estável.
De fato, a concentração sangüínea de glicose é sempre mantida
dentro de limites bastante estreitos, independentemente de qual seja o
consumo deste nutriente pelo organismo. Essa homeostase de glicose se
dá devido a uma série de mecanismos reguladores, que vamos estudar
em aulas mais à frente. Estes mecanismos são extremamente importantes,
já que disfunções na capacidade de manter a glicemia levam a graves
conseqüências: a diminuição acentuada dos níveis de glicose no sangue,
mesmo que por períodos curtos, pode causar graves distúrbios no cérebro,
e, se for prolongada, pode levar até à morte. E não é só durante o
jejum que a glicemia é mantida constante. A hiperglicemia por longos
períodos também provoca vários problemas metabólicos, como aqueles
observados em quadros de diabetes. Estudaremos também este aspecto
da homeostase de glicose em aulas mais à frente.
Mas como a glicemia é mantida?
Você já aprendeu que possuímos uma
reserva de glicose armazenada no fígado:
o
GLICOGÊNIO ,
um polímero de glicose. A
degradação do glicogênio hepático leva à
liberação de glicose na corrente sangüínea.
Poderíamos pensar, então, que a degradação
Para tirar qualquer
dúvida consulte
a aula sobre a
degradação de
GLICOGÊNIO.
do glicogênio hepático seria o mecanismo
responsável pela manutenção da glicemia
durante o jejum.
Será que isso é verdade?
CEDERJ 193
BIOQUÍMICA II | Introdução à gliconeogênese
VARIAÇÕES NA QUANTIDADE DE GLICOGÊNIO HEPÁTICO
AO LONGO DO JEJUM
Observe outra vez o gráfico que você construiu. O que ocorre
com o glicogênio hepático do paciente em jejum?
Como você pode observar, a quantidade de glicogênio no fígado
Não confunda
as palavras
GLICONEOGÊNESE, que
quer dizer síntese
(gênese) da nova
(neo) glicose, com
glicogenólise, que
significa quebra ou
degradação (lise) do
glicogênio.
diminui rapidamente, se esgotando no primeiro dia do jejum. Assim,
embora o glicogênio contribua para a manutenção da glicemia logo
nos primeiros momentos, uma outra via é necessária após períodos
maiores nos quais carboidratos não são ingeridos. Esta via é chamada
GLICONEOGÊNESE, que significa “síntese da nova glicose”, e, nos mamíferos,
ocorre no fígado e no córtex renal.
A VIA GLICONEOGÊNICA
Na década de 1930, um casal de pesquisadores chamados Carl e
Gerti Cori, conhecidos como o casal Cori, começou a estudar a síntese
de glicose por células hepáticas. Eles prepararam um homogeneizado de
fígado, ou seja, bateram um fígado em uma espécie de liquidificador, de
forma que todas as células eram rompidas, obtendo-se uma suspensão
contendo todo o meio intracelular: organelas, enzimas, metabólitos etc.
Colocaram esse homogeneizado em um tubo de ensaio e adicionaram
lactato marcado radioativamente. Após um tempo, identificaram os
compostos radioativos presentes no tubo de ensaio com o objetivo de
determinar qual era o destino metabólico do lactato nas células hepáticas.
Observaram que a radioatividade estava presente principalmente em
moléculas de glicose. A conclusão desta experiência foi que o lactato
podia ser transformado em glicose no fígado.
194 CEDERJ
Já se sabia, na época, que o lactato podia ser convertido em
piruvato através de reação reversível catalisada pela enzima lactato
desidrogenase, presente em vários tipos celulares, inclusive no fígado.
Veja a reação na Figura 28.2:
Figura 28.2: Reação catalisada pela enzima lactato desidrogenase.
Logo, o que estava de fato ocorrendo no homogeneizado preparado pelo casal Cori era a transformação de piruvato em glicose.
Esses achados levantavam a hipótese de que a via de formação de
glicose, ou seja, a gliconeogênese, seria a inversão da via glicolítica, que, como
(levando a diferentes
afinidades) para
seus substratos. Por
exemplo, a isoforma
presente no músculo
esquelético possui mais
afinidade pelo piruvato
do que pelo lactato.
Por isso, quando o
músculo entra em
alta atividade, logo
após um pequeno
acúmulo de piruvato,
que não pode ser
completamente
oxidado devido a um
aporte insuficiente de
oxigênio, o lactato é
produzido. Por outro
lado, a isoforma
hepática tem maior
afinidade pelo lactato,
transformando este
em piruvato quando
sua disponibilidade
aumenta.
você já sabe, converte a glicose em duas moléculas de piruvato. Entretanto, se
observamos atentamente as reações da glicólise, podemos encontrar algumas
que são irreversíveis nas condições fisiológicas. Veja a Figura 28.3, que
contém as variações de energia livre de Gibbs (ΔG) envolvidas em cada
reação da glicólise. Lembre-se de que quanto mais negativo forem os valores
de ΔG, mais energia é liberada na reação, e, conseqüentemente, mais difícil
será a sua inversão nas condições da medida.
CEDERJ 195
28 MÓDULO 7
A lactato desidrogenase
apresenta isoformas
expressas nos
diferentes tecidos.
Estas isoformas se
diferenciam com
relação ao seu KM
AULA
E como isso ocorria?
BIOQUÍMICA II | Introdução à gliconeogênese
Piruvato
Figura 28.3: Resumo esquemático da via glicolítica mostrando os valores de ΔG
(Kcal/mol) para cada uma das reações.
Analisando a Figura 28.3, podemos concluir que três reações da
glicólise não podem ser revertidas nas condições fisiológicas: a conversão
de glicose em glicose-6P, catalisada pela enzima hexocinase; a conversão de
frutose em frutose-6P, catalisada pela enzima fosfofrutocinase-1 (PFK-1);
e a conversão de fosfoenolpiruvato (PEP) em piruvato, catalisada pela
enzima piruvato cinase. Portanto, essas etapas devem ser contornadas por
outras reações para que a gliconeogênese possa ocorrer. E é exatamente
isso que ocorre! A glicose é sintetizada através das mesmas reações da
glicólise, exceto pelas reações irreversíveis, que são contornadas por
outras reações, como veremos na próxima aula.
196 CEDERJ
28 MÓDULO 7
AULA
RESUMO
Embora muitos órgãos e tecidos possam manter seus níveis de ATP essencialmente
através da oxidação de ácidos graxos, alguns tipos celulares dependem
exclusivamente ou preferencialmente da glicose como nutriente. Este é o caso
do cérebro, das hemácias e de algumas outras células em menor número no
organismo. Para a sobrevivência dessas células em situações nas quais a ingestão de
carboidratos é baixa ou nula, é necessária a síntese de glicose a partir de precursores
não-glicídicos, através de uma via metabólica chamada gliconeogênese.
A gliconeogênese pode ser considerada uma reversão parcial da via glicolítica,
uma vez que várias reações da glicólise são usadas na síntese de glicose. As reações
irreversíveis da glicólise, catalisadas pelas enzimas hexocinase, PFK-1 e piruvato
cinase, são substituídas por reações diferentes, catalisadas por outras enzimas,
na gliconeogênese.
EXERCÍCIOS
1. A homeostase de glicose é extremamente importante para nosso organismo.
Um dos motivos é a existência de alguns tipos celulares que requerem
exclusivamente ou preferencialmente a glicose como nutriente. Dê exemplos
de células que se comportam assim e justifique a dependência que elas têm
da glicose.
2. Justifique o emagrecimento de um indivíduo mantido em jejum.
3. Por que a gliconeogênese não pode ser uma simples reversão da glicose?
CEDERJ 197
objetivo
AULA
A via gliconeogênica
29
• Na aula passada, você aprendeu que a
manutenção da glicemia é extremamente
importante para a nossa sobrevivência.
Você aprendeu, também, que isso é possível
graças à gliconeogênese, uma via metabólica
responsável pela síntese de glicose a partir
de precursores não glicídios. Essa via é uma
reversão parcial da via glicolítica, já que as
reações reversíveis da glicólise são usadas
no sentido inverso para a síntese de glicose.
Entretanto, reações adicionais são necessárias
para que as reações irreversíveis da glicólise
sejam contornadas. Hoje aprenderemos que
reações são essas.
Pré-requisito
Para seguir bem esta aula, você deve estar
com uma boa visão geral das seguintes vias
metabólicas: glicólise, ciclo de Krebs,
degradação de aminoácidos, síntese e
degradação de ácidos graxos.
BIOQUÍMICA II | A via gliconeogênica
A CONVERSÃO DE PIRUVATO A FOSFOENOLPIRUVATO (PEP)
A primeira reação da glicólise que deve ser contornada é a
conversão de fosfoenolpiruvato (PEP) a piruvato, catalisada pela enzima
piruvato cinase. A formação de PEP a partir de piruvato envolve uma
grande barreira energética, que para que seja superada necessita de duas
etapas. Na primeira, o piruvato é convertido em oxalacetato, através
da sua carboxilação, catalisada pela enzima piruvato carboxilase. Na
segunda, o oxalacetato é convertido a PEP, através de reação catalisada
pela enzima PEP carboxicinase (PEPCK).
Veja um esquema dessas duas reações na Figura 29.1:
Figura 29.1: Conversão de piruvato em oxalacetato e, então, em PEP.
Assim como ocorre
com a acetil-CoA
carboxilase, a piruvato
carboxilase contém
biotina como grupo
prostético. A biotina
funciona como um
carreador de CO2 nessas
reações.
Repare que o CO2 usado na formação de oxalacetato é, em seguida,
eliminado na formação de PEP. Isso parece um desperdício à primeira
vista, mas, na verdade, é uma forma de “ativação” do piruvato para que
seja possível sua conversão em um composto de mais alta energia, o PEP.
Essa ativação se dá à custa da hidrólise de um ATP, como mostrado na
Figura 29.1. A reação da piruvato carboxilase é bastante semelhante a
uma outra reação de carboxilação já estudada por você: a reação da
A conversão de
piruvato em PEP na
gliconeogênese custa
para a célula duas
moléculas de ATP,
enquanto a conversão
de PEP em piruvato
durante a glicólise gera
apenas uma molécula
de ATP.
200 CEDERJ
acetil-CoA carboxilase, na síntese de ácidos graxos.
A conversão de oxalacetato em PEP requer a hidrólise de um
GTP, com incorporação do fosfato à molécula do PEP. A hidrólise de
um GTP equivale à hidrólise de um ATP, uma vez que essas moléculas
se interconvertem. Dessa forma, para que seja contornada a reação da
piruvato cinase são gastas duas moléculas de ATP.
29 MÓDULO 7
AULA
A LOCALIZAÇÃO INTRACELULAR DAS DUAS PRIMEIRAS
ETAPAS DA GLICONEOGÊNESE
A piruvato carboxilase é uma enzima de localização essencialmente
mitocondrial, de modo que a formação de oxalacetato a partir de piruvato
ocorre dentro da mitocôndria.
A localização da PEPCK varia entre as diferentes espécies.
No fígado de camundongos e ratos, ela se localiza exclusivamente
no citosol, enquanto em fígado de coelhos e pombos essa enzima é
mitocondrial. Já em humanos, a PEPCK é igualmente distribuída no
citosol e na mitocôndria das células hepáticas.
Quando a PEPCK usada é a isoforma mitocondrial, o oxalacetato
pode ser diretamente convertido a PEP dentro da mitocôndria, sendo
este transportado para o citosol através de uma proteína transportadora
presente na membrana mitocondrial. O PEP, então, segue pelas reações
reversíveis da via glicolítica, cujas enzimas se localizam no citosol, até
formar frutose-1,6-bisfosfato (frutose-1,6-BP).
Quando a PEPCK usada é a isoforma citoplasmática, o oxalacetato,
primeiramente, deve ser transportado para o citosol. Entretanto, não
existe transportador de oxalacetato na membrana mitocondrial. Assim,
neste caso, o que acontece é um pouco mais complicado. O oxalacetato
deve ser convertido em outra molécula, antes de ser transportado para o
lado de fora da mitocôndria. Isso pode ocorrer de duas maneiras, como
mostrado na Figura 29.2.
CEDERJ 201
BIOQUÍMICA II | A via gliconeogênica
Figura 29.2: Transporte do oxalacetato da mitocôndria para o citosol. O oxalacetato pode ser transportado
através de sua conversão em aspartato (1) ou em malato (2). O caso 2 envolve oxidação de NADH mitocondrial
com concomitante redução de NAD+ citoplasmático, levando ao transporte simultâneo de equivalente de NADH
da mitocôndria para o citosol.
Você já aprendeu esta
reação na aula que
tratou do metabolismo
dos aminoácidos.
As transaminases são
enzimas amplamente
distribuídas nos
diversos tipos celulares,
ocorrendo tanto no
citoplasma como na
mitocôndria. Assim,
se torna possível o
transporte indireto
do oxalacetato da
mitocôndria para o
citosol.
Uma possibilidade é a conversão do oxalacetato em aminoácido
aspartato pela ação da enzima aspartato aminotransferase. O aspartato
é, então, transportado para o citosol, onde é reconvertido em oxalacetato
pela mesma enzima, podendo finalmente ser convertido a PEP.
A outra forma de o oxalacetato ser transportado para o
citosol requer sua conversão em malato, através da ação da enzima
malato desidrogenase. Essa reação envolve a oxidação de um NADH
mitocondrial, formando NAD+, além de malato. O malato pode ser
transportado para o citosol, onde é reconvertido a oxalacetato. Nesse
momento, ocorre redução de NAD+ citoplasmático. Analise atentamente
a Figura 29.2 para compreender bem todas essas etapas.
A reação da malato desidrogenase é uma das reações
do ciclo de Krebs, já estudada por você. Nesse caso,
entretanto, ela ocorre no sentido inverso. Isso é
possível graças ao aumento da concentração de
oxalacetato em decorrência da ativação da reação
piruvato carboxilase.
202 CEDERJ
29 MÓDULO 7
AULA
OS PRECURSORES PARA A GLICONEOGÊNESE
Vamos montar um esquema com o que já sabemos até agora para
que fique mais fácil a visualização da gliconeogênese, tornando possível
a identificação dos precursores não glicídios usados na síntese de glicose.
Observe a Figura 29.3. Com base nos conhecimentos que você já adquiriu
nas aulas anteriores desta disciplina, tente sugerir possíveis precursores que
poderiam entrar na via gliconeogênica. Pense um pouco e tente responder
sozinho antes de prosseguir a leitura.
Fosfoenolpiruvato
Oxalacetato
Oxalacetato
Figura 29.3: Esquema das etapas da gliconeogênese estudadas até o momento.
Se você se lembrou da experiência realizada pelo casal Cori (descrita
na aula passada), você foi capaz de identificar o lactato como um dos
precursores. A enzima lactato desidrogenase, presente no citosol das células
hepáticas, converte o lactato em piruvato (veja a reação na Aula 28), e este
pode seguir o caminho metabólico discutido ao longo desta aula. Mas, de
onde vem esse lactato?
CEDERJ 203
BIOQUÍMICA II | A via gliconeogênica
O lactato é produzido no metabolismo anaeróbico da glicose.
Na ausência de oxigênio, o piruvato não pode ser completamente
oxidado. Além disso, o NADH produzido na reação catalisada pela
gliceraldeído-3P desidrogenase, na glicólise, precisa ser reoxidado para
que esta via não pare por falta de NAD+. Assim, a reação da lactato
desidrogenase promove a reoxidação dos NADHs e produz lactato,
que é secretado pela célula (Figura 29.4). Este tipo de metabolização
da glicose ocorre nas células que não possuem mitocôndrias, como as
hemácias, ou quando o aporte de oxigênio não é suficiente para sustentar
o metabolismo aeróbico, como nos músculos em intensa atividade.
Figura 29.4: Esquema resumido da fermentação láctica.
Olhando para nosso esquema, podemos perceber que a formação
de oxalacetato é uma etapa crucial da gliconeogênese. Então, moléculas
que possam gerar oxalacetato no seu metabolismo seriam inevitavelmente
precursoras para a síntese de glicose.
204 CEDERJ
29 MÓDULO 7
AULA
Você já aprendeu que a maioria dos aminoácidos gera intermediários
do ciclo de Krebs quando transaminados. Esses intermediários podem ser
convertidos em oxalacetato se seguirem pelas reações do ciclo de Krebs.
Assim, todos os aminoácidos que gerem intermediários do ciclo de Krebs,
ou piruvato, após sua transaminação, são precursores para a síntese de
glicose. As únicas exceções são a leucina e a lisina, cujo metabolismo gera
acetil-CoA. Veja um esquema mostrando os produtos da transaminação
dos aminoácidos na Figura 29.5. Os aminoácidos usados na síntese de
glicose podem ser provenientes da alimentação, ou mobilizados a partir
da degradação das proteínas musculares.
Figura 29.5: Transaminação dos aminoácidos.
CEDERJ 205
BIOQUÍMICA II | A via gliconeogênica
Quando o ácido
graxo é oxidado,
os carbonos são
retirados de dois em
dois, gerando várias
moléculas de acetilCoA. Se o ácido
graxo possui número
ímpar de carbonos,
uma molécula de três
carbonos, o propionilCoA, sobra ao final.
Além dos aminoácidos, uma outra molécula também pode ser
convertida em um intermediário do ciclo de Krebs, e conseqüentemente
formar oxalacetato: o propionil-CoA proveniente da β-oxidação de
ácidos graxos de cadeia ímpar. O propionil-CoA é convertido a succinilCoA dentro da mitocôndria, entrando no ciclo de Krebs.
Por último, temos o glicerol. Essa molécula é liberada do tecido
adiposo durante a hidrólise dos triacilgliceróis e segue para o fígado,
onde é transformada em di-hidroxiacetona-P (DHAP), um intermediário
da glicólise, que pode seguir a via gliconeogênica.
Antes de prosseguir a leitura, copie, em uma folha à parte, o esquema
metabólico apresentado na Figura 29.3, e tente acrescentar a ele as reações
de entrada dos precursores na via gliconeogênica recém-discutidas. Agora,
compare o seu esquema com o mostrado na Figura 29.6.
Figura 29.6: Esquema da entrada dos precursores na via gliconeogênica.
206 CEDERJ
29 MÓDULO 7
AULA
VOLTANDO AO TRANSPORTE DO OXALACETATO PARA
O CITOSOL
Agora que você já descobriu quais são as moléculas que podem
ser usadas como precursoras para a síntese de glicose, vamos voltar ao
ponto onde estávamos quando discutíamos a Figura 29.2.
É bem provável que naquele momento você tenha pensado: “Isso
tudo parece muito complicado! Por que haveria necessidade de
termos duas maneiras diferentes de transportar o oxalacetato
para o citosol?”
Vamos, agora, tentar responder a essa questão.
Observe novamente a Figura 29.6. Se você prestar atenção, verá que
para que a reação catalisada pela enzima gliceraldeído-3P desidrogenase
seja revertida, é necessário que haja tanto 1,3-bisfosfoglicerato como
também NADH. Porém, lembre-se de que a maioria das reações de
oxidação, que levam à redução de NAD+ formando NADH, ocorre
na mitocôndria. A principal reação que reduz NAD+ no citoplasma
é justamente a reação catalisada pela gliceraldeído-3P desidrogenase
durante a glicólise. Para ser possível reverter esta reação, é necessário,
então, que exista uma outra fonte de NADH no citoplasma.
NADH pode ser formado no citoplasma durante a reação de
conversão do lactato em piruvato. Então, quando o lactato é o precursor
para a síntese de glicose, o problema está resolvido. Entretanto, quando
outros precursores são usados, não haveria maneira de se obter NADH no
citoplasma. Esse problema é resolvido justamente através do transporte
do oxalacetato para o citosol. Preste atenção na Figura 29.2 e veja que,
quando o oxalacetato é transportado via formação de malato, um NAD+
é reduzido no citosol.
CEDERJ 207
BIOQUÍMICA II | A via gliconeogênica
Concluindo: quando o precursor para a gliconeogênese é o lactato,
o PEP pode ser formado pela PEPCK mitocondrial e ser transportado
diretamente para o citosol, ou o oxalacetato pode ser transportado via
formação de aspartato. Por outro lado, quando os precursores são os
aminoácidos, o propionil-CoA ou o glicerol, o oxalacetato deve ser
transportado por intermédio da formação de malato, garantindo a
redução de NAD+ no citosol. Veja o esquema na Figura 29.7.
Figura 29.7: O transporte do oxalacetato e o balanço dos NADs.
208 CEDERJ
29 MÓDULO 7
AULA
AS OUTRAS REAÇÕES CONTORNADAS: AS CONVERSÕES
DE FRUTOSE-1,6-BP EM FRUTOSE-6P E DE GLICOSE-6P
EM GLICOSE
Agora que você entendeu
a via gliconeogênica até este
ponto, ficou faltando aprender
como outras reações irreversíveis
da glicólise, catalisadas pela
PFK e pela hexocinase, são
contornadas. Em vez de estas
duas reações serem revertidas
gerando ATP, o que seria
energeticamente desfavorável,
ocorre apenas a hidrólise
dos grupos fosfato, como
mostrado na Figura 29.8. As
enzimas que catalisam essas
reações são chamadas frutose1,6-bisfosfatase (FBPase) e
glicose-6-fosfatase (G6Pase),
respectivamente. Veja um
esquema da via gliconeogênica
completa na Figura 29.8.
contornada
Figura 29.8: A via gliconeogênica.
CEDERJ 209
BIOQUÍMICA II | A via gliconeogênica
RESUMO
Alguns precursores, como lactato, glicerol e aminoácidos glicogênicos, podem
ser usados para sintetizar glicose através da via gliconeogênica, que ocorre, nos
mamíferos, no fígado e no rim. Esses precursores são convertidos em oxalacetato,
que então é convertido em fosfoenolpiruvato (PEP). A formação de glicose a partir
de PEP se dá através de uma série de reações, muitas delas consistindo na reversão
das reações da via glicolítica. Apenas as reações da glicólise, que são irreversíveis
em condições fisiológicas, aquelas catalisadas pela PFK e pela hexocinase, são
substituídas por reações de hidrólise, catalisadas pela frutose-1,6-bisfosfatase
(FBPase) e pela glicose-6-fosfatase (G6Pase), respectivamente.
EXERCÍCIO
1. O consumo de álcool, especialmente por um indivíduo mal alimentado, pode
causar hipoglicemia. O álcool ingerido é convertido em acetaldeído no citoplasma
do hepatócito, em reação catalisada pela álcool desidrogenase:
NAD+
NADH
CH3−CH2−OH
CH3−COH
Utilizando seus conhecimentos sobre a gliconeogênese, tente justificar a
hipoglicemia causada pela ingestão de álcool.
210 CEDERJ
objetivo
AULA
Regulação da
gliconeogênese
30
• Nesta aula, você vai compreender como é
regulada a síntese de glicose no organismo,
que funciona para garantir a produção de
glicose em situações nas quais seus níveis, no
sangue, estejam diminuídos.
Pré-requisitos
Para seguir esta aula, você deve ter
compreendido bem as aulas sobre glicólise e as
aulas sobre gliconeogênese. Tenha-as em mãos
para eventuais consultas ao longo da leitura.
BIOQUÍMICA II | Regulação da gliconeogênese
A REGULAÇÃO DA GLICONEOGÊNESE É NECESSÁRIA?
Imagine se a glicólise e a gliconeogênese ocorressem de uma forma
incontrolada. Uma das conseqüências seria um gasto desnecessário
As enzimas hexoquinase
e fosfofrutoquinase
catalisam duas etapas
da glicólise.
de ATP. Os ATPs utilizados nas reações catalisadas pelas enzimas
hexoquinase (a conversão de glicose em glicose-6P) e fosfofrutoquinase
(a conversão de frutose-6P em frutose-1,6BP) não seriam ressintetizados
durante a gliconeogênese. Isto porque as reações que revertem estas etapas
Em todo este trecho,
estamos comparando as
reações da glicólise com
as da gliconeogênese,
principalmente
com relação ao
requerimento
energético de cada
etapa. Tenha as duas
vias em mãos para
compreender o que está
sendo discutido.
(as duas conversões), e que são catalisadas pela G6Pase (conversão de
glicose-6P em glicose) e pela FBPase (conversão de frutose-1,6BP em
frutose-6P), não levam à síntese de ATP. O ATP sintetizado durante a
reação da fosfoglicerato quinase na glicólise seria gasto quando esta
reação fosse revertida na gliconeogênese. A síntese de PEP a partir de
piruvato gasta um ATP e um GTP, enquanto a reação da piruvato quinase
na glicólise leva à síntese de apenas um ATP. Assim, a ausência de um
controle sobre a glicólise e a gliconeogênese poderia levar a grandes
desperdícios de energia.
De fato, isso não ocorre. Ao contrário: a glicólise e a gliconeogênese
são reguladas reciprocamente, de acordo com as necessidades do
organismo.
Logo após a alimentação, os níveis de glicose no sangue se encontram
elevados, e nossas células metabolizam esse nutriente através da glicólise,
garantindo os níveis adequados de ATP e armazenando o excesso de
energia a partir da síntese de nossas reservas. No fígado, o glicogênio
é sintetizado, a glicólise é ativada, e o excesso de acetil-CoA produzido
segue, através da formação de citrato, para a síntese de ácidos graxos.
Por outro lado, quando não ingerimos carboidratos, o fígado
mantém os níveis sangüíneos de glicose, tanto através da degradação do
glicogênio como pela produção de glicose, graças à inibição da glicólise
e à ativação da gliconeogênese.
212 CEDERJ
30 MÓDULO 7
AULA
PRINCIPAIS PONTOS DE REGULAÇÃO DA GLICONEOGÊNESE
Regulação da piruvato carboxilase
É importante assinalar: o controle da gliconeogênese começa com
a definição do destino do piruvato dentro da mitocôndria.
Você já aprendeu que a completa oxidação do piruvato começa
com sua conversão em acetil-CoA, catalisada pela PIRUVATO DESIDROGENASE.
Por outro lado, o direcionamento do piruvato para a formação de glicose
pela via gliconeogênica depende, inicialmente, de sua conversão em
Se você se esqueceu da
reação catalisada pela
PIRUVATO DESIDROGENASE,
consulte a aula de ciclo
de Krebs.
oxalacetato, catalisada pela piruvato carboxilase, como vimos na aula
passada. Veja o esquema mostrado na Figura 30.1.
Oxalacetato
Figura 30.1: Destinos do piruvato no interior da mitocôndria.
As duas enzimas, a piruvato desidrogenase e a piruvato carboxilase,
são reguladas pelo mesmo modulador: acetil-CoA. De forma a construir
um esquema metabólico coerente, procure determinar qual das enzimas
deve ser ativada e qual deve ser inibida por essa molécula. Reflita um
pouco antes de prosseguir a leitura.
A piruvato desidrogenase é inibida por acetil-CoA e a piruvato
carboxilase depende inteiramente da presença deste modulador para
funcionar. Vamos ver se isso faz sentido.
CEDERJ 213
BIOQUÍMICA II | Regulação da gliconeogênese
Quando a glicose está disponível e entra em uma célula capaz de
realizar o metabolismo oxidativo, ela segue pela via glicolítica até ser
convertida em piruvato. Este entra na mitocôndria, onde se transforma
em acetil-CoA, que entra no ciclo de Krebs, sendo condensado com o
oxalacetato, formando citrato, e assim por diante, como você já estudou.
Enquanto o ciclo de Krebs funcionar, os níveis mitocondriais de acetilCoA estarão baixos, e, conseqüentemente, a piruvato desidrogenase
continuará ativa e a piruvato carboxilase estará inibida (Figura 30.2).
Figura 30.2: Esquema da regulação do destino do piruvato durante o metabolismo
oxidativo da glicose.
Quando os níveis de glicose no sangue começam a diminuir, uma
das primeiras respostas do organismo é o início da mobilização dos ácidos
graxos, que estão armazenados no tecido adiposo. Os ácidos graxos entram
nas diversas células e são transportados para o interior da mitocôndria,
onde são β-oxidados, formando acetil-CoA. No fígado, o oxalacetato está
sendo desviado, nessa situação, para a via gliconeogênica, de forma que o
acetil-CoA proveniente da β-oxidação não pode seguir pelo ciclo de Krebs
e, então, acumula-se no interior da mitocôndria.
214 CEDERJ
30 MÓDULO 7
AULA
Assim, a piruvato desidrogenase fica inibida e a piruvato carboxilase fica
ativa, possibilitando a síntese de mais oxalacetato para a gliconeogênese
(Figura 30.3).
Oxalacetato
Oxalacetato
Figura 30.3: Esquema da regulação do destino do piruvato durante situações de baixa glicemia.
Destino do acetil-CoA no fígado: formação dos corpos cetônicos
Como acabamos de discutir, o desvio
do oxalacetato para a síntese de glicose leva
a um acúmulo de acetil-CoA na mitocôndria
dos hepatócitos. O excesso de acetil-CoA
é, então, convertido nos chamados corpos
cetônicos – acetoacetato, β-hidroxibutirato
e acetona, que são secretados pelo fígado,
caindo na circulação. Veja, na Figura
30.4, como os níveis sangüíneos de corpos
cetônicos aumentam em um indivíduo
mantido em jejum.
Você estudou as reações de formação dos corpos
cetônicos na aula de oxidação dos ácidos graxos.
Figura 30.4: Variação da concentração plasmática de corpos
cetônicos em um paciente em jejum prolongado.
CEDERJ 215
BIOQUÍMICA II | Regulação da gliconeogênese
Os corpos cetônicos são compostos ácidos, de forma que, caso eles
atinjam concentrações acima da capacidade tamponante do sangue, podem
levar a uma diminuição do pH sangüíneo, levando ao que chamamos
acidose metabólica. A acidose metabólica pode se tornar bastante grave,
levando a sérias conseqüências, especialmente em casos de diabetes, nos
quais o quadro pode evoluir para o óbito do paciente.
Regulação da PFK e da FBPase
O principal ponto de controle da glicólise e da gliconeogênese se dá
sobre as enzimas PFK e FBPase. Vamos ver como isso foi descoberto.
Em 1980, um pesquisador chamado van Schaftingen e seus
colaboradores descobriram uma substância capaz de modificar a atividade
da PFK isolada de fígado, como mostra a Figura 30.5.
Mais à frente você vai
saber que substância
é esta. Por enquanto,
preste atenção apenas
em seus efeitos.
Figura 30.5: Efeito do modulador isolado por van Schaftingen e colaboradores
sobre a atividade da PFK.
Veja que, em concentrações baixas de frutose-6P, que é o substrato
da PFK, a presença da substância descoberta alterava dramaticamente a
velocidade da reação catalisada pela PFK, levando a uma grande ativação
desta enzima.
216 CEDERJ
30 MÓDULO 7
AULA
Eles descobriram que essa substância é formada no fígado e
pode atingir concentrações bem altas em animais bem alimentados.
Por outro lado, ela é destruída após dietas pobres em
carboidratos. Observou-se ainda que esta mesma substância era
capaz de inibir a FBPase, quando em concentrações semelhantes
àquelas necessárias para levar à ativação da PFK.
Assim, esta substância é capaz de regular antagonicamente
a glicólise e a gliconeogênese, ou seja, enquanto uma via está
ativada, a outra está inibida e vice-versa.
Depois de muito tempo tentando identificar esta
molécula ativadora da PFK, o grupo de van Schaftingen
conseguiu mostrar que era frutose-2,6-bisfosfato, que a partir
de agora vamos designar por F2,6BP.
Cuidado, agora, para não fazer confusão! Esta molécula é
diferente do intermediário frutose-1,6-bisfosfato e não participa
diretamente nem da glicólise nem da gliconeogênese. A diferença
entre estas duas moléculas está apenas no carbono ao qual está
associado o grupamento fosfato.
Analise esses dados e procure integrá-los a um esquema
metabólico mais geral. Depois de refletir um pouco sozinho,
observe o esquema mostrado na Figura 30.6.
Figura 30.6: Papel da frutose-2,6-bisfosfato na regulação recíproca da glicólise e da gliconeogênese.
CEDERJ 217
BIOQUÍMICA II | Regulação da gliconeogênese
Agora que você entendeu o papel da F2,6BP no controle das enzimas
PFK e FBPase, você deve estar se perguntando: como essa substância é
sintetizada ou degradada?
Os mesmos pesquisadores descobriram, em 1981, uma enzima
capaz de sintetizar F2,6BP a partir de frutose-6P à custa de ATP, à
semelhança do que ocorria na reação catalisada pela PFK anteriormente
conhecida. Para evitar confusão, as enzimas foram denominadas a partir
daí fosfofrutoquinase-1 (PFK-1), a clássica, e fosfofrutoquinase-2 (PFK-2),
a que sintetiza F2,6BP.
Além disso, o mesmo grupo de trabalho, em 1982, purificou, de
fígado de rato, uma enzima capaz de transformar F2,6BP em frutose-6P
e denominaram-na enzima frutose-2,6-bisfosfatase (F2,6B Pase). Assim,
ficou claro que a ação coordenada das enzimas PFK-2 e F2,6BPase
determinava o nível de F2,6BP na célula e, conseqüentemente, direcionava
o fluxo metabólico no sentido da glicólise ou da gliconeogênese.
Por muitos anos tentou-se isolar as duas enzimas, mas, finalmente,
descobriu-se que se tratava de uma única cadeia polipeptídica que
A atividade das enzimas
pode ser regulada por
moduladores alostéricos
ou por modificação
covalente reversível. Os
moduladores alostéricos
se associam a regiões
da enzima diferentes do
sítio ativo, provocando
uma mudança em sua
estrutura que resulta
na modificação da sua
atividade. A regulação
por modificação
covalente reversível se
dá pela ligação covalente
de determinados
grupamentos às cadeias
laterais de alguns
aminoácidos, resultando
também na mudança
conformacional da
enzima e na modificação
de sua atividade.
Dentre as modificações
covalentes mais comuns
está a fosforilação
e defosforilação de
enzimas.
continha dois sítios ativos diferentes, um com atividade PFK-2 e outro
com atividade F2,6B Pase. Esta enzima bifuncional era capaz de catalisar
uma ou outra reação.
Surge, então, a pergunta: o que vai determinar se esta enzima vai
apresentar atividade PFK-2 ou F2,6BPase em um determinado momento?
Para compreender a aula a partir daqui, você vai ter que relembrar
o mecanismo de controle do metabolismo do glicogênio. Vamos fazer
uma pequena recapitulação do que vai ser importante agora.
Você aprendeu que as enzimas do metabolismo do glicogênio
são reguladas através de um mecanismo conhecido como modificação
covalente. Da mesma forma que ocorre com as enzimas do metabolismo
do glicogênio, a ligação covalente de um grupamento fosfato na enzima
bifuncional leva a uma modificação de sua atividade: a enzima fosforilada
apresenta atividade F2,6BPase, uma vez que a fosforilação provoca uma
mudança estrutural na enzima, expondo seu sítio fosfatásico e escondendo
seu sítio quinásico. Já a defosforilação da enzima bifuncional expõe o
sítio quinásico e esconde seu sítio fosfatásico.
Assim, a atividade da PFK2/F2,6BPase depende do seu estado
de fosforilação.
218 CEDERJ
30 MÓDULO 7
AULA
A fosforilação da enzima bifuncional PFK-2/F2,6BPase é catalisada
por uma importante proteína quinase, a proteína quinase dependente de
AMPc (PKA). Como seu nome diz, esta proteína quinase é regulada por
AMPc. Os níveis de AMPc aumentam dentro da célula em função de
um estímulo hormonal. Esse modulador, então, se liga às subunidades
regulatórias da PKA, liberando as subunidades catalíticas que fosforilam
uma série de proteínas, dentre as quais a PFK2/F2,6BPase.
Dentre os hormônios que regulam os níveis de AMPc dentro da
célula, podemos citar o GLUCAGON. Este hormônio é liberado pelo pâncreas
em decorrência da diminuição da concentração sangüínea de glicose.
Você vai aprender mais
sobre o GLUCAGON na
Aula 31.
Com esses novos dados, procure analisar o quadro metabólico quando a
gliconeogênese se encontra ativada ou inibida, levando em consideração
todas as informações fornecidas. Faça um resumo e mostre ao tutor. Essa
é uma boa maneira de estudar! Na próxima aula, quando estivermos
falando de glucagon, voltaremos a esse ponto.
Regulação da piruvato quinase
A piruvato quinase, enzima que catalisa a conversão de PEP em
piruvato na glicólise, também é regulada por fosforilação pela PKA. Tente
atribuir, antes de prosseguir a leitura, um papel ativador ou inibitório à
fosforilação. Depois de refletir um pouco, continue.
Observe a Figura 30.7 para relembrar como
o piruvato é convertido em PEP na
gliconeogênese.
Figura 30.7: Conversão
de piruvato em PEP na
gliconeogênese.
CEDERJ 219
BIOQUÍMICA II | Regulação da gliconeogênese
Como você viu na Aula 29, para que a reversão da reação da
piruvato quinase ocorra, são necessárias duas reações e são gastos
dois equivalentes de ATPs. O PEP formado no citoplasma poderia ser
reconvertido em piruvato pela ação da piruvato quinase se esta enzima
não estivesse inibida nesse momento. Assim, a inibição da piruvato
quinase através da sua fosforilação garante que todo o PEP formado
seja realmente convertido em glicose.
RESUMO
Nesta aula, você aprendeu como a glicólise e a gliconeogênese são reguladas,
garantindo que não haja desperdícios energéticos nas células capazes de realizar
essas duas vias metabólicas. Os principais pontos de regulação são as reações
catalisadas pelas enzimas piruvato carboxilase, PFK e FBPase, e piruvato quinase.
A piruvato carboxilase é ativada alostericamente por acetil-CoA. PFK e FBPase
são reciprocamente reguladas por frutose-2,6BP, que ativa a primeira e inibe a
segunda. Frutose-2,6BP é sintetizada e degradada por uma enzima bifuncional,
a PFK-2/F2,6B Pase, cujas atividades são reguladas por fosforilação desencadeada
pela ação de hormônios. A atividade da piruvato quinase também está sob controle
hormonal, sendo inibida por fosforilação.
220 CEDERJ
30 MÓDULO 7
1. Indique ao lado do nome de cada enzima listada seu regulador alostérico e o
efeito promovido por ele na atividade enzimática (inibição ou ativação):
• piruvato carboxilase
• piruvato desidrogenase
• PFK
• FBPase
2. Correlacione a presença do composto frutose-2,6BP à regulação das vias
glicolítica e gliconeogênica. Agora explique como essa substância é formada e
degradada.
3. A figura abaixo foi retirada de um artigo científico publicado por Hue e
colaboradores, em 1981. Eles estudaram os efeitos do hormônio glucagon no
metabolismo de glicídeos em células isoladas de fígado de rato. Verificaram alterações
dose-dependentes nos níveis de frutose-2,6BP e na atividade da enzima que catalisa
a degradação do glicogênio, a fosforilase a. Interprete a figura, ressaltando os efeitos
metabólicos no fígado em função dos resultados observados.
CEDERJ 221
AULA
EXERCÍCIOS
objetivo
AULA
Introdução aos hormônios
31
• Na última parte de nosso curso, vamos
conhecer melhor os hormônios, importantes
substâncias responsáveis pela comunicação
entre os diferentes tipos celulares de um
organismo.
Pré-requisitos
As Aulas 13 e 14 de Biologia Celular I tratam de
temas complementares aos que vamos abordar
aqui. Seria interessante que você relesse essas
aulas antes de começar.
BIOQUÍMICA II | Introdução aos hormônios
INTRODUÇÃO
Vamos começar esta aula com uma apresentação dos hormônios e de suas
características. Nas próximas duas aulas, vamos falar especificamente dos quatro
hormônios que são os principais reguladores do metabolismo energético:
o glucagon, a adrenalina, a insulina e os glicocorticóides.
Uma característica essencial dos organismos multicelulares é a diferenciação
celular, que resulta na divisão de atividades entre seus órgãos e tecidos, que
desta forma desempenham funções especializadas. Para entendermos o papel
das diferentes vias metabólicas e de sua regulação, é preciso considerá-las
durante o funcionamento do organismo como um todo. A capacidade de os
tecidos especializados funcionarem de uma maneira integrada foi possível,
em grande parte, pelo aparecimento do sistema endócrino, que, juntamente
com o sistema nervoso, promove a coordenação das atividades metabólicas
dos organismos complexos, otimizando a distribuição de nutrientes e de
precursores para os diferentes órgãos e tecidos. Essa integração é mediada
H ORMÔNIOS
Esta terminologia foi
utilizada inicialmente
para definir apenas
as substâncias
sintetizadas pelas
glândulas endócrinas
e secretadas
na circulação,
levando a respostas
específicas de um
ou mais tecidosalvo. Atualmente,
o termo se refere a
qualquer molécula
sinalizadora, capaz
de gerar uma resposta
em determinada
célula. Assim,
podemos classificar os
hormônios como: (a)
endócrinos – aqueles
que circulam pelo
corpo até atingirem
o órgão-alvo; (b)
parácrinos – aqueles
que interagem com
células vizinhas;
e (c) autócrinos
– aqueles que atuam
sobre a própria
célula secretora. Ou
seja, os hormônios
são classificados de
acordo com seu raio
de ação.
por uma importante classe de mensageiros químicos, os HORMÔNIOS.
NATUREZA QUÍMICA DOS HORMÔNIOS
Os hormônios podem ser peptídeos, lipídeos ou derivados de
aminoácidos.
Os hormônios peptídicos são assim denominados por apresentarem
de 3 até 2.000 resíduos de aminoácidos. Variam com relação a tamanho,
composição, número de cadeias e grupos modificados. Podemos citar
como exemplo o glucagon, que apresenta uma única cadeia polipeptídica,
e a insulina, formada por duas cadeias polipeptídicas derivadas do
processamento proteolítico de um único produto gênico (pró-insulina)
(Figura 31.1).
Insulina
Glucagon
Figura 31.1: Exemplos de hormônios peptídicos: glucagon e insulina.
224 CEDERJ
31 MÓDULO 7
AULA
Os hormônios esteróides e as prostaglandinas são derivados dos
lipídeos colesterol e ácido aracdônico, respectivamente. Veja na Figura
31.2 alguns exemplos de esteróides derivados do colesterol.
CH3
CH3
Colestanos: 27 carbonos
ex: colesterol
CH3
CH3
Ácidos cólicos: 24 carbonos
COOH
CH3
Pregnanos: 21 carbonos
ex: progesterona
CH3
CH3
Andranos: 19 carbonos
ex: testosterona
CH3
CH3
Estranos: 18 carbonos
ex: estradiol
CH3
Figura 31.2: Exemplos de hormônios esteróides.
Os derivados de aminoácidos incluem a adrenalina, a noradrenalina, a dopamina e os hormônios da tireóide, todos formados a partir
da tirosina (Figura 31.3).
Adrenalina
Noradrenalina
OH
OH
OH
OH
CH
CH
OH
OH
CH2
CH2
NH
NH2
CH3
Hormônios da tireóide
I
HO
B
I
I
5
3
O
5
A
I
H2N
I
CO2H
O
HO
3
Tiroxina (T4)
H2N
CO2H
I
I
Triiodotironina (T3)
Figura 31.3: Exemplos de hormônios derivados de aminoácidos.
CEDERJ 225
BIOQUÍMICA II | Introdução aos hormônios
SÍNTESE, LIBERAÇÃO E DEGRADAÇÃO DOS HORMÔNIOS
A liberação dos hormônios na circulação depende, muitas vezes,
apenas da sua produção. Esse é o caso dos esteróides, cuja liberação ocorre
imediatamente após sua síntese. Por outro lado, algumas glândulas possuem a
capacidade de armazenar quantidades consideráveis de hormônios, servindo
como reservatórios dessas moléculas. As células β do pâncreas, por exemplo,
podem armazenar insulina por vários dias.
!
Os hormônios da tireóide (T3 e T4), que não serão estudados no nosso curso,
também são armazenados. Eles são produzidos a partir da clivagem de uma
proteína, a tireoglobulina. Essa proteína possui vários resíduos de tirosina que
são modificados pela adição de iodo, formando T3 e T4. Grandes quantidades
de tireoglobulina podem ser armazenadas na tireóide, garantindo a produção
de T4 mesmo em longos períodos de falta de iodo.
Os hormônios liberados podem circular livres ou associados a
proteínas transportadoras. Hormônios solúveis em água, em princípio,
podem circular sem necessitar de um sistema transportador específico,
já que o sangue é um meio aquoso. Os insolúveis em água circulam
associados a proteínas plasmáticas, que garantem o acesso dessas
P ROTEÍNAS
moléculas a todas as células. Algumas
TRANSPORTADORAS
específicas para determinados hormônios, enquanto outros hormônios
DE HORMÔNIOS
Específicas:
• globulina ligadora de
tiroxina (TBG)
• globulina ligadora de
corticosteróides (CBG)
Não-específicas:
• albumina
• transtirretina
PROTEÍNAS TRANSPORTADORAS
são
se ligam a sistemas gerais de transporte.
A fração ligada dos hormônios está sempre em equilíbrio dinâmico
com pequenas quantidades de hormônio livre, que, na maior parte dos
casos, é a fração biologicamente ativa. Dessa forma, as proteínas
transportadoras podem muitas vezes ser encaradas como reservatórios
circulantes de hormônios.
A degradação dos hormônios liberados na circulação é crítica para
a regulação de seus níveis em resposta às várias necessidades. A meia-vida
dos hormônios pode variar de poucos minutos (como nos casos da insulina,
do hormônio adrenocorticotrófico (ACTH) e da adrenalina), a horas (como
ocorre com os hormônios esteróides), ou a dias (como a tiroxina).
226 CEDERJ
Para atuar, os hormônios devem interagir com sítios específicos,
altamente seletivos, presentes nas células-alvo: os receptores. Estes
devem desempenhar pelo menos duas funções: ter a capacidade de ligar
os hormônios com alta afinidade e especificidade, distinguindo essas
moléculas entre as outras substâncias presentes; e também transmitir a
informação, levando ao desencadeamento da resposta celular. Entretanto,
a resposta a um determinado hormônio não depende apenas da presença
do receptor, mas também da presença dos sistemas de TRANSDUÇÃO DO SINAL
hormonal na célula-alvo.
A ação hormonal em tecidos específicos pode ser direcionada ou
amplificada por vários mecanismos. A distribuição dos receptores pode
variar consideravelmente: enquanto o receptor da insulina está presente
em todos os tipos celulares, os receptores para mineralocorticóides são
DE SINAL
Para que uma
célula responda a
um determinado
hormônio, é
necessário que a
ligação do hormônio
a seu receptor
desencadeie uma
série de reações
intracelulares que
levem à modificação
do metabolismo da
célula. Os eritrócitos,
por exemplo, possuem
receptores para
insulina, mas, pela
falta de moléculas
necessárias à sua
ação, não exibem
respostas típicas a esse
hormônio.
encontrados apenas em células renais. A liberação de hormônios dentro
de um sistema de circulação restrita consiste em um outro mecanismo de
direcionamento hormonal. O fígado recebe mais insulina que os demais
tecidos, uma vez que a quantidade desse hormônio que chega ao tecido
hepático pelo SISTEMA PORTA é bem maior do que a que atinge os tecidos
extra-hepáticos pela circulação sistêmica.
Receptores hormonais podem ser subdivididos em dois grupos
principais: aqueles que se encontram na superfície celular, que vão mediar
respostas citoplasmáticas, e aqueles de localização intracelular, que vão
atuar geralmente no núcleo da célula-alvo (Figura 31.4).
Hormônios esteróides
Hormônios tireoideanos
Vitamina D
Receptor de
membrana
AMPc
Receptor
citoplasmático
Receptor
nuclear
Transmissores
Hormônios peptídeos
O sangue proveniente
do trato gastrointestinal chega ao
fígado pela veia
porta-hepática, cujas
ramificações banham
os lóbulos hepáticos.
Assim, os nutrientes
provenientes da
alimentação são
“filtrados” pelo fígado
antes de atingirem a
circulação sistêmica.
O mesmo ocorre
com o hormônio
insulina, que também
é liberado do pâncreas
na veia portahepática.
Ca2+
Fosforilação
RNAm
Síntese de proteína
SISTEMA
P O R TA - H E P Á T I C O
Regulação
enzimática
Figura 31.4: Mecanismos de ativação de uma célulaalvo pelos hormônios. Receptores de membrana
para hormônios hidrossolúveis transmitem o sinal
hormonal através de mensageiros intracelulares,
como o AMPc ou o cálcio. Isso resulta na ativação
de proteínas quinases que catalisam a fosforilação
de diversas enzimas do metabolismo, regulando sua
atividade. Hormônios lipossolúveis ativam receptores
intracelulares que se ligam ao DNA, regulando a
expressão gênica.
CEDERJ 227
31 MÓDULO 7
TRANSDUÇÃO
AULA
MECANISMOS DE AÇÃO DOS HORMÔNIOS
BIOQUÍMICA II | Introdução aos hormônios
Os hormônios peptídicos, as catecolaminas e as prostaglandinas
se ligam a receptores na superfície da célula-alvo, e a transmissão dessa
informação se dá através de mediadores intracelulares. Já os hormônios
da tireóide e os esteróides, devido à sua natureza hidrofóbica, são capazes
de atravessar a membrana plasmática, encontrando seus receptores no
interior da célula-alvo, onde o complexo hormônio-receptor interage
com elementos específicos do DNA, induzindo mudanças na expressão
de determinados genes.
Hormônios que interagem com a superfície celular
Os experimentos de E. Sutherland foram importantíssimos para
!
Earl W. Sutherland Jr. (19151974) e sua equipe isolaram
o AMPc em 1958, e assim o
chamaram porque os átomos
do único grupo fosfato da
molécula de AMPc estão
arranjados sob a forma de
um anel. Sutherland Jr. foi
agraciado com o Prêmio
Nobel em Fisiologia e Medicina em 1971.
a compreensão do mecanismo de ação de hormônios que atuam na
superfície celular. Esse pesquisador, ao descobrir o AMPc e seu papel
mediador da resposta dos hormônios glucagon e adrenalina, desenvolveu
o conceito de segundo mensageiro. O segundo mensageiro funciona
como um mediador intracelular do sinal extracelular, transmitindo o
sinal hormonal para a maquinaria enzimática celular.
Inicialmente, acreditava-se que o segundo mensageiro era sempre
uma pequena molécula orgânica, como AMPc, GMPc ou inositol fosfato,
mas atualmente sabe-se que pode ser um íon, como cálcio ou hidrogênio,
ou mesmo uma enzima que catalisa a fosforilação de proteínas, ou seja,
uma proteína cinase.
Muitas estruturas de receptores hormonais de membrana já foram
elucidadas, revelando quatro tipos básicos de receptores:
(a) receptores acoplados à proteína G;
(b) receptores que funcionam como canais iônicos;
(c) receptores com atividade enzimática intrínseca;
(d) receptores que interagem diretamente com enzimas intra-celulares.
Veja o esquema mostrado na Figura 31.5. Em todos os casos,
a ação do hormônio depende de segundos mensageiros.
228 CEDERJ
Ligantes
Receptores associados
a cinases
Receptores acoplados
à proteína G
Receptores associados
a canais iônicos
Insulina, fatores
de crescimento
Hormônio do
crescimento,
prolactina, citocinas
Insulina, fatores
de crescimento
Neurotransmissores,
aminoácidos
Estrutura
Proteína tirosina ou
serina cinase
Tirosina cinase
associada ao receptor
Segundo mensageiro
(AMPC IP3 íon)
Íon
Proteínas cinases
citoplasmáticas
Efeitos mediados por fosforilação
Efeitos não-mediados por fosforilação
Figura 31.5: Principais classes de receptores de membrana para hormônios e neurotransmissores. A insulina e
muitos fatores de crescimento se ligam a receptores de membrana que atuam como tirosinas cinases, catalisando a
fosforilação de proteínas em seus resíduos de tirosina; o hormônio do crescimento, a prolactina e muitas citocinas
se ligam a receptores que se associam a tirosinas cinases citoplasmáticas; uma terceira classe de agonistas se liga
a receptores (R) que se acoplam a um efetor (geralmente enzimas que produzirão segundos mensageiros) (E)
através de proteínas G (G); a quarta classe de receptores inclui aqueles associados a canais iônicos.
Como a concentração dos hormônios peptídicos na circulação está
em torno de 10-12 a 10-9 M, as células-alvo devem não só reconhecer o
hormônio com alta afinidade e especificidade como também devem ser
capazes de amplificar o sinal hormonal, já que os processos metabólicos
operam na faixa de concentração milimolar (10-3 M). As cascatas de
mediadores intracelulares possibilitam essa enorme amplificação do sinal
extracelular, como exemplificado na Figura 31.6.
CEDERJ 229
31 MÓDULO 7
Receptor com
atividade cinásica
AULA
Classe
BIOQUÍMICA II | Introdução aos hormônios
1 molécula
do sinalizador
Cada receptor ativa
muitas proteínas G, que
podem ativar muitas
adenilato ciclases
GTP
Receptor
Amplificação
Adenilato ciclase ativada
GTP
Cada adenilato ciclase
forma muitas moléculas
de AMPC
Proteína G
ATP
GTP
Amplificação
AMPC
Cada AMPC ativa uma
proteína cinase
Proteínacinase
Cada cinase fosforila
muitas cópias de uma
enzima
Amplificação
Enzima X
Cada enzima fosforilada
catalisa a formação de
muitas moléculas do
produto
Amplificação
Produtos da
enzima X
Figura 31.6: Amplificação do sinal após o estímulo de um receptor associado à
proteína G.
A Figura 31.6 mostra o mecanismo de ação de um ligante cujo
receptor promove indiretamente o aumento dos níveis intracelulares de
AMPc, como, por exemplo, o glucagon ou a adrenalina. As proteínas
intermediárias que acoplam esses receptores a seus sistemas efetores são
chamadas proteínas G, por dependerem de GTP para sua ação regulatória.
As proteínas G são heterotrímeros compostos por subunidades α, β e γ.
A ligação da molécula sinalizadora promove uma mudança
conformacional no receptor que, por sua vez, induz a ligação de GTP
à subunidade α da proteína G, que se dissocia das outras subunidades.
A subunidade α, então, migra através da membrana e interage com uma
enzima, a adenilato ciclase, ativando-a. A adenilato ciclase catalisa a
conversão de ATP em AMPc. Dessa forma, moléculas como o glucagon
ou a adrenalina promovem um grande aumento na concentração de
AMPc no interior de células que apresentem seus respectivos receptores.
230 CEDERJ
31 MÓDULO 7
AULA
A subunidade α apresenta atividade GTPásica,
convertendo o GTP em GDP, tornando-se
inativa e dissociando-se da adenilato ciclase.
Cada receptor pode interagir e ativar muitas
ATP
moléculas de proteína G, cada qual podendo
ativar uma molécula de adenilato ciclase.
Como cada molécula de proteína G permanece
na forma ativa por alguns segundos antes de
Adenilato ciclase
hidrolisar o GTP e voltar à forma inativa, a
adenilato ciclase também permanece ativa por
alguns segundos, o que permite a produção de
um grande número de moléculas de AMPc.
AMPC
O AMPc se liga às subunidades regulatórias de
uma importante proteína quinase, a proteína
quinase AMPc dependente (PKA). Esta enzima
é um tetrâmero formado por duas subunidades
Fosfodiesterase
catalíticas e duas regulatórias que, quando
ligadas ao AMPc, se dissociam das subunidades
catalíticas, ativando-as. A PKA catalisa a
fosforilação de um grande número de enzimas,
AMP
estando, dessa forma, envolvida no controle de
diversas vias metabólicas. Assim, uma única
molécula sinalizadora extracelular pode causar
a alteração da atividade de milhares de enzimas nas células-alvo. Quando
o estímulo cessa, os níveis de AMPc diminuem em função da atividade da
enzima fosfodiesterase, que catalisa a hidrólise do AMPc, convertendo-o
em 5’-AMP.
!
Você já viu exemplos de enzimas reguladas através de fosforilação catalisada
pela PKA em aulas anteriores.
Hormônios que afetam a expressão gênica
Os hormônios de natureza química apolar ou hidrofóbica como,
por exemplo, os hormônios esteróides, hormônios da tireóide, a vitamina
D e o ácido retinóico, atuam de forma bastante diferente da daqueles
descritos até agora. Eles funcionam como fatores de regulação da
expressão gênica (Figura 31.7).
CEDERJ 231
BIOQUÍMICA II | Introdução aos hormônios
R
PT
R
R
R
R
R
RNAm
R
Proteína
hsp
Efeitos fisiológicos
Figura 31.7: Mecanismo de ação de hormônios esteróides. O esteróide (▲) chega à célula-alvo associado a uma
proteína transportadora (PT). Os receptores (R) são proteínas intracelulares presentes no núcleo ou no citoplasma
associados a proteínas de choque térmico (heat shock proteins, hsp), quando não ligados ao hormônio. O complexo
hormônio-receptor se liga ao DNA em regiões específicas, modulando a expressão gênica.
Esses hormônios atravessam a membrana plasmática da maioria
das células por difusão, embora mecanismos ativos de captação possam
ocorrer em alguns sistemas. Nas células-alvo, ou seja, células sensíveis
a esses hormônios, eles se ligam a receptores específicos intracelulares,
localizados no citoplasma ou no núcleo. A ligação do hormônio promove
mudanças conformacionais no receptor, resultando na formação de um
complexo ativado, com alta afinidade por determinados sítios do DNA.
Geralmente, a ligação do complexo hormônio-receptor a esses elementos
regulatórios afeta a expressão gênica, induzindo ou reprimindo a iniciação
da transcrição de genes específicos. Os produtos da tradução dos RNA
mensageiros de síntese regulada por esses hormônios promoverão efeitos
metabólicos nas células-alvo como, por exemplo, o aumento dos níveis de
determinadas enzimas, como ocorre com a expressão dos genes de algumas
enzimas gliconeogênicas em células tratadas com glicocorticóides, levando,
neste caso, a um aumento da produção de glicose por essas células.
232 CEDERJ
31 MÓDULO 7
AULA
RESUMO
Nesta aula, você aprendeu que a comunicação entre as diferentes células de um
organismo, para que ele funcione de forma integrada, se dá graças aos hormônios.
Estas moléculas podem ser peptídeos, como é o caso da insulina e do glucagon;
lipídeos, como os hormônios esteróides; ou derivados de aminoácidos, como, por
exemplo, a adrenalina e os hormônios da tireóide. Você viu, também, que os
mecanismos de síntese, secreção e degradação dos hormônios podem ser muito
variados. Para fins didáticos, os hormônios podem ser agrupados em duas grandes
classes, de acordo com seu mecanismo de ação: aqueles cuja ação se dá a partir de
sua ligação à superfície celular e aqueles que se ligam a receptores intracelulares
e atuam sobre a expressão gênica.
EXERCÍCIOS
Os exercícios referentes às Aulas 31, 32 e 33 serão apresentados em conjunto ao
final da Aula 33.
CEDERJ 233
objetivos
AULA
Glucagon e adrenalina
32
Ao final desta aula, você deverá ser capaz de:
• Apresentar dois hormônios: glucagon e
adrenalina.
• Conhecer o mecanismo de ação desses
hormônios.
• Estudar seus efeitos nos diferentes tecidos.
Pré-requisitos
Esta aula e a próxima vão explorar a
integração hormonal do metabolismo. Por
isso, será importante que você tenha uma
visão geral bem clara do metabolismo e das
várias vias que o compõem. Aproveite para
adiantar o estudo de toda a matéria antes
de começar a ler estas aulas. Assim, elas
servirão para reforçar seus conhecimentos e
poderão fornecer uma visão mais ampla do
funcionamento do nosso organismo.
BIOQUÍMICA II | Glucagon e adrenalina
INTRODUÇÃO
Nesta aula, vamos falar especificamente de dois hormônios: o glucagon e a
adrenalina. Agrupamos estes dois hormônios na mesma aula, porque ambos
compartilham o mesmo mecanismo de ação. Entretanto, você vai ver que
estes hormônios vão atuar em resposta a situações diferentes, algumas vezes
em tecidos distintos.
GLUCAGON
Natureza química, síntese e secreção do glucagon
O glucagon é um hormônio peptídico secretado pelo
PÂNCREAS
PÂNCREAS,
Para fins didáticos,
o pâncreas pode ser
estudado em duas
porções:
glândula de fundamental importância para a digestão dos alimentos e
Pâncreas exógeno:
sintetiza e secreta
enzimas responsáveis
pela digestão de
proteínas (tripsina,
quimotripsina e
carboxipeptidase),
carboidratos (amilase)
e lipídeos (lipase)
provenientes da dieta,
além de secretar
bicarbonato de sódio.
de Langerhans. Nas Ilhotas de Langerhans, existem três subpopulações
para a regulação do metabolismo de macronutrientes.
O pâncreas contém um grupo de células especializadas, as Ilhotas
de células distintas, as células α, as células β e as células γ, que são
responsáveis pela síntese e secreção dos hormônios glucagon, insulina e
somatostatina, respectivamente.
Uma vez sintetizado, o glucagon pode ser secretado diretamente ou ficar
estocado dentro de vesículas secretórias no interior das células α. Os principais
controladores fisiológicos da liberação de glucagon são a hipoglicemia, a
hiperaminoacidemia (aumento dos níveis de aminoácidos no sangue; neste
Pâncreas endógeno:
sintetiza e secreta
os hormônios
glucagon, insulina e
somatostatina.
caso, principalmente aumento de arginina), baixos níveis circulantes de ácidos
graxos e estímulo do sistema adrenal (estresse ou exercício).
O receptor de glucagon
O glucagon, assim como os demais hormônios peptídicos, exerce
seus efeitos através da ligação a um receptor localizado na membrana
plasmática das células-alvo. O receptor de glucagon pertence à
superfamília dos receptores acoplados à proteína G (Figura 32.1).
!
Você aprendeu sobre receptores acoplados à proteína G na Aula 31 de
Bioquímica II e na Aula 14 de Biologia Celular I.
236 CEDERJ
32 MÓDULO 7
AULA
Figura 32.1: Representação esquemática do receptor de glucagon. As sete hélices
transmembrana são exemplificadas na figura. A região superior corresponde às
regiões extracelulares do receptor, enquanto a região inferior representa a porção
intracelular. Associadas ao receptor estão esquematizadas as três subunidades da
proteína G.
Ainda não temos uma definição exata de que tecidos apresentam
receptores de glucagon. Diversos trabalhos científicos vêm mostrando que
os maiores níveis de expressão do receptor de glucagon são encontrados
no fígado, nos rins e nas ilhotas pancreáticas. Níveis intermediários de
expressão podem ser detectados no coração, tecido adiposo, duodeno
e estômago.
Mecanismo de ação do glucagon
Os principais efeitos conhecidos do glucagon são mediados por
um aumento dos níveis intracelulares de AMPc. Isso ocorre porque
o receptor de glucagon encontra-se associado a uma família muito
particular de proteínas, conhecida como família das proteínas G, como
já comentamos anteriormente.
!
Para relembrar o que são as proteínas G e como os níveis intracelulares de
AMPc são controlados por elas, releia o final da Aula 31 de Bioquímica II e a
Aula 14 de Biologia Celular I.
A Figura 32.2 mostra a seqüência de eventos desencadeados pela
ligação do glucagon a seu receptor presente na superfície celular.
CEDERJ 237
BIOQUÍMICA II | Glucagon e adrenalina
Adenilato ciclase
ATP
Proteína G
AMPc
PKA
Figura 32.2: Eventos desencadeados pela ligação do glucagon a seu receptor presente na superfície celular.
Mas como o aumento da concentração intracelular de AMPc vai
promover a alteração do metabolismo celular?
O AMPc se liga a uma importante proteína cinase, a proteína
cinase dependente de AMPc (PKA). Esta proteína é composta por quatro
subunidades: duas regulatórias, onde estão os sítios de ligação do AMPc,
e duas catalíticas, que podem fosforilar várias
enzimas do metabolismo. Quando a PKA está
R
R
na sua forma tetramérica, as subunidades
PKA inativa
C
regulatórias impedem a atividade das
subunidades catalíticas. Quando o AMPc se
C
liga, as subunidades regulatórias se dissociam
4 AMPC
4 AMPC
das subunidades catalíticas, levando à ativação
dessa enzima. Veja o esquema na Figura 32.3.
Uma vez ativada, a PKA poderá catalisar
R
a fosforilação de diversas proteínas no interior
R
da célula, levando assim à ativação/inativação
de enzimas.
C
C
PKA ativa
Figura 32.3: Esquema da regulação da PKA pelo AMPc.
238 CEDERJ
32 MÓDULO 7
AULA
Agora você deve estar se perguntando: afinal, que enzimas são
essas e quais são os efeitos do glucagon no metabolismo energético?
Vamos responder a essa pergunta a seguir.
Ação do glucagon sobre o fígado
Sem dúvida, o principal órgão a sofrer os efeitos da liberação
de glucagon é o fígado. Em resposta a elevações bastante sutis nas
concentrações sanguíneas de glucagon, esse órgão modifica seu
metabolismo drasticamente. Graças a isso, o organismo é capaz de adaptarse a diferentes situações metabólicas, principalmente à hipoglicemia. As
principais vias metabólicas afetadas pelo glucagon no fígado são:
O metabolismo de glicogênio
Após uma refeição balanceada, cerca de 25% da glicose ingerida
é convertida em glicogênio no fígado. Os níveis de glicogênio no interior
de um hepatócito podem variar entre 1 e 100mg/g de tecido hepático
durante um ciclo normal de jejum/alimentação.
!
Antes de ser batizado com seu nome atual, o glucagon era conhecido como “fator hiperglicemiante
glicogenolítico”. Isso se deveu a algumas experiências realizadas entre 1921 e 1938, que mostraram que
extratos pancreáticos injetados em animais sem pâncreas provocavam rapidamente hiperglicemia, em
decorrência da mobilização do glicogênio hepático. De fato, o primeiro efeito conhecido do glucagon foi
o estímulo da degradação do glicogênio.
Como vimos anteriormente, a
SÍNTESE E DEGRADAÇÃO DE GLICOGÊNIO
devem ser conjuntamente reguladas, de modo a evitar desperdícios de
energia decorrentes da realização de ciclos fúteis.
Através da ativação da PKA, um dos primeiros efeitos do glucagon
sobre a síntese de glicogênio é a inativação da enzima glicogênio sintase.
Aparentemente, tanto a própria PKA quanto as cinases ativadas por ela,
principalmente a glicogênio sintase cinase 3 (GSK-3), são capazes de
SÍNTESE
E
DEGRADAÇÃO DE
GLICOGÊNIO
Se precisar, reveja
as vias de síntese
e de degradação
do glicogênio, assim
como sua regulação,
nas Aulas 25, 26 e 27.
fosforilar esta enzima. Essa fosforilação faz com que a glicogênio sintase
passe de sua forma a (ativa) para a forma b (inativa).
A fosforilase cinase também é fosforilada pela PKA, tornando-se
ativa. Essa enzima catalisa a fosforilação da glicogênio fosforilase, a
enzima-chave da degradação do glicogênio. Quando fosforilada, a
glicogênio fosforilase sofre uma mudança conformacional, passando
da forma b (inativa) para a forma a (ativa).
Veja um esquema da regulação da síntese e da degradação do
glicogênio na Figura 32.4.
CEDERJ 239
BIOQUÍMICA II | Glucagon e adrenalina
Glicogênio sintase
a (ativa)
Glicogênio
fosforilase b
(inativa)
Proteína cinase
Fosfoproteína fosfatase
P
Glicogênio
fosforilase b
(inativa)
P
P
Glicogênio
fosforilase a (ativa)
P
Figura 32.4: Esquema da regulação das enzimas-chave da síntese (glicogênio sintase) e da degradação (glicogênio
fosforilase) em resposta à ação do glucagon.
Assim, quando os níveis sanguíneos de glucagon aumentam,
a síntese de glicogênio é drasticamente diminuída e sua degradação
muito aumentada.
A degradação do glicogênio gera glicose-1-fosfato que, pela
ação da enzima fosfoglucomutase, é convertida em glicose-6-fosfato,
que por sua vez é substrato para a glicose-6-fosfatase presente no retículo
endoplasmático dos hepatócitos, formando, assim, glicose livre que pode
ser enviada para a corrente sangüínea.
Alteração da relação glicólise/gliconeogênese
Você já aprendeu que o fígado é o principal órgão dos mamíferos a
!
Reveja as reações e
a regulação da via
gliconeogênica nas
Aulas 29 e 30.
realizar a gliconeogênese. Por isso, é importante a existência, nesse órgão,
de um controle integrado da relação glicólise/gliconeogênese, de forma a
minimizar a ocorrência de ciclos fúteis e a perda de energia. O glucagon
desempenha um papel extremamente importante nessa regulação.
240 CEDERJ
32 MÓDULO 7
AULA
O principal efeito do glucagon sobre a glicólise/gliconeogênese acontece
sobre a enzima bifuncional fosfofrutocinase-2/frutose-2,6-bisfosfatase.
Como você já aprendeu na Aula 30, essa enzima catalisa duas reações distintas:
a conversão de frutose-6-fosfato (frutose-6P) em frutose-2,6-bisfosfato
(F2,6BP) e a reação reversa, a conversão de F2,6BP em frutose-6P.
A fosforilação da enzima bifuncional pela PKA leva a uma
modificação de sua atividade. A enzima fosforilada apresenta atividade
F2,6BPase, enquanto sua defosforilação inibe essa atividade fosfatásica
e ativa a porção PFK2 da enzima.
Mas o que faz F2,6BP? Tente lembrar e confira se sua resposta
estava correta lendo o texto a seguir.
F2,6BP é um potente ativador da fosfofrutocinase-1 (PFK-1),
enzima-chave da glicólise. Ao mesmo tempo, essa substância também
inibe a frutose-1,6-bisfosfatase, enzima da gliconeogênese.
Assim, quando a PKA é ativada devido à ação do glucagon, os
níveis intracelulares de F2,6BP diminuem, levando à inibição da PFK-1
e, conseqüentemente, da glicólise, e à ativação da frutose-1,6-bisfosfatase e,
conseqüentemente, da gliconeogênese.
Outro efeito importante do glucagon sobre a glicólise é a regulação
da enzima piruvato cinase (PK). Essa enzima catalisa a última reação
da glicólise, a conversão de fosfoenolpiruvato (PEP) em piruvato com
concomitante síntese de uma molécula de ATP. A fosforilação da PK
hepática é catalisada pela PKA e leva a uma drástica redução de sua
atividade. Com isso, a glicólise fica inibida. Essa regulação também
é importante para garantir que o PEP, formado na primeira etapa da
gliconeogênese, não seja reconvertido em piruvato (você já viu isso em
mais detalhes na Aula 30; se achar necessário, volte até lá).
O metabolismo dos ácidos graxos
Os ácidos graxos derivados dos triacilglicerídeos e estocados nos
adipócitos são a fonte de energia mais importante para os mamíferos.
O glucagon exerce um importante papel na regulação do metabolismo
de ácidos graxos, como veremos a seguir.
A primeira etapa da
SÍNTESE DE ÁCIDOS GRAXOS
é o transporte das
unidades de acetil-CoA, derivadas da oxidação da glicose ou dos
aminoácidos, da mitocôndria para o citoplasma. Estas unidades de
acetil-CoA saem da mitocôndria na forma de citrato, que no citoplasma
SÍNTESE
DE
ÁCIDOS GRAXOS
Reveja a síntese de
ácidos graxos em
detalhes nas
Aulas 22 e 23.
é convertido a oxaloacetato e acetil-CoA novamente.
CEDERJ 241
BIOQUÍMICA II | Glucagon e adrenalina
Uma vez no citoplasma, a etapa seguinte da síntese de ácidos
graxos seria a conversão de acetil-CoA em malonil-CoA, catalisada pela
acetil-CoA carboxilase. Esta enzima-chave da biossíntese de ácidos graxos
é inibida por glucagon através de um mecanismo também dependente
de PKA, que catalisa a fosforilação dessa enzima, mantendo-a na sua
forma protomérica inativa.
Ação do glucagon sobre o adipócito
A mobilização das reservas de triacilgliceróis estocadas nos adipócitos
se dá através da ativação da lipase sensível a hormônio. Esta enzima catalisa
a hidrólise das ligações éster dos triacilgliceróis, gerando glicerol e ácidos
graxos, que seguirão pela corrente sangüínea associados à albumina até o
fígado ou outros tecidos capazes de realizar a β-oxidação.
A lipase sensível a hormônio é ativada por fosforilação catalisada
pela PKA. Embora ainda exista certa controvérsia na literatura científica a
respeito da presença ou não de receptores de glucagon no tecido adiposo,
uma série de dados vêm sustentando que, quando os níveis sanguíneos
de glucagon aumentam, a cascata de sinalização desencadeada por esse
hormônio promove a hidrólise dos triacilgliceróis, com conseqüente
liberação de glicerol e ácidos graxos por estas células.
Desta forma, podemos concluir que a liberação do glucagon na corrente
sanguínea promove a mobilização dos ácidos graxos, que passam a servir
como fonte de energia para a maioria dos tecidos. Por outro lado, o glucagon
também vai promover a liberação hepática de glicose, seja proveniente da
degradação do glicogênio, seja produzida pela via gliconeogênica. Veja, na
Figura 32.5, um esquema da integração do metabolismo dos vários tecidos
do nosso corpo durante uma situação de hipoglicemia.
242 CEDERJ
32 MÓDULO 7
AULA
Pâncreas
(células α)
Glucagon
Proteína
Intestino
Fígado
Aminoácido
Glicerol
Veia porta
Glicose
Enterócitos
Lactato
Alanina
Uréia
Corpos
cetônicos
Alanina
Cérebro
Glicerol
CO2 + H2O
Alanina
Ácidos graxos
Lactato
Lipídeos
Hemácias
Glutamina
Tecido adiposo
Aminoácido
CO2 + H2O
Proteína
Tecido muscular
Figura 32.5: Esquema do metabolismo em resposta à liberação de glucagon durante a hipoglicemia.
ADRENALINA
Natureza química e secreção da adrenalina
A adrenalina faz parte de um grupo de substâncias denominadas
catecolaminas, por suas estruturas derivarem do catecol (Figura 32.6).
CEDERJ 243
BIOQUÍMICA II | Glucagon e adrenalina
Dopamina
Catecol
Norepinefrina
Epinefrina
Figura 32.6: Estrutura do catecol e das catecolaminas.
A adrenalina é secretada pela glândula ADRENAL (de onde vem seu
ADRENAL
A adrenal pode
ser dividida em
duas partes: o
córtex, que secreta
glicocorticóides e
mineralocorticóides
(falaremos desses
hormônios na Aula
33); e a medula, cujo
principal produto
de secreção é a
adrenalina.
nome), que se localiza acima dos rins e, por isso, é também conhecida
como glândula supra-renal.
Em resposta a situações de estresse agudo (estresse psicológico,
cansaço físico, jejum prolongado ou hipoglicemia, perda sangüínea e
diversas condições patológicas), ocorre ativação do sistema nervoso
simpático, que é parte integrante do sistema nervoso autônomo.
Como parte dessa resposta adaptativa, há aumento da liberação de
catecolaminas pela adrenal. A liberação dessas substâncias no sangue e
sua atuação em órgãos periféricos, principalmente no caso da adrenalina,
promovem as conhecidas reações de “fuga ou luta”. Essas reações são
caracterizadas por dilatação pupilar, taquicardia, sudorese, tremores,
aumento da glicemia.
!
As ações dos produtos secretados pela adrenal têm grande correlação com as
funções do sistema nervoso simpático. Dessa forma, freqüentemente usamos
o termo sistema simpático-adrenal para ressaltar as inter-relações existentes
entre o sistema nervoso autônomo e o sistema endócrino representado pela
adrenal.
244 CEDERJ
32 MÓDULO 7
AULA
Receptores adrenérgicos
A adrenalina é uma molécula polar e solúvel em meio aquoso e,
portanto, incapaz de atravessar a membrana plasmática das células.
Assim, uma vez liberada na circulação, a adrenalina exerce seus efeitos
intracelulares por intermédio da ação de receptores de membrana,
os chamados receptores α e β-adrenérgicos. Os receptores adrenérgicos,
assim como os receptores de glucagon, se encontram associados à
proteína G. Como você já deve estar suspeitando, a seqüência de eventos
que ocorrem a partir da ligação da adrenalina a seu receptor é semelhante
àquela descrita para a ação do glucagon.
É isso mesmo! Entretanto, a distribuição dos receptores
adrenérgicos entre os tecidos é diferente da distribuição dos receptores
de glucagon, de forma que os efeitos gerais sobre o metabolismo também
vão ser diferentes frente a um estímulo de adrenalina ou de glucagon.
Efeitos da adrenalina sobre o metabolismo hepático
Os principais efeitos da adrenalina no fígado são o resultado de
β-ADRENÉRGICOS, com conseqüente aumento das
RECEPTORES
concentrações intracelulares de AMPc e a regulação de processos como
ADRENÉRGICOS
sua ligação a
RECEPTORES
o metabolismo de glicogênio e o fluxo glicólise/gliconeogênese.
Os efeitos da adrenalina sobre a síntese e a degradação do glicogênio
no fígado são muito semelhantes aos já descritos para a ação do glucagon.
Na verdade, o papel de ambos os hormônios foi elucidado na mesma série
de trabalhos, desenvolvidos ao longo da década de 1950 por Sutherland
e diversos colaboradores. Nesses trabalhos, os pesquisadores, utilizando
fatias de fígado de coelho, demonstraram que tanto o chamado “fator
hiperglicemiante” (glucagon) quanto a adrenalina eram capazes de causar
um aumento na atividade glicogenolítica hepática, in vivo e in vitro.
Os efeitos sobre a glicólise e a gliconeogênese, assim como sobre
a síntese de lipídeos, também são semelhantes àqueles desencadeados
pelo glucagon.
São divididos em
vários subtipos.
Primeiramente, são
divididos em dois
grandes grupos:
os receptores α e
β-adrenérgicos.
Os receptores β se
dividem nos subtipos
β1, β2, β3, este
último exclusivo
do tecido adiposo.
Os receptores α são
divididos em α1 ou
α2. Os receptores
α1 podem ainda
ser subdivididos
em vários outros
subtipos: α1A,
α1B etc.
Assim, podemos concluir que, no fígado, adrenalina e glucagon
causam os mesmos efeitos metabólicos.
CEDERJ 245
BIOQUÍMICA II | Glucagon e adrenalina
Efeitos da adrenalina sobre o músculo esquelético
Efeitos sobre o metabolismo do glicogênio
Nas células do músculo esquelético, assim como no tecido muscular
cardíaco, a adrenalina também exerce seus efeitos sobre o metabolismo
do glicogênio. Como já vimos no caso do fígado, a adrenalina promove
a ativação da glicogênio fosforilase muscular através da sua fosforilação.
A principal diferença entre os dois tecidos reside no destino da glicose-1fosfato produzida na fosforólise do glicogênio. As células musculares não
apresentam a enzima glicose-6-fosfatase, resultando no aprisionamento
da glicose-6-fosfato produzida pela reação da fosfoglicomutase. Esta
é uma importante adaptação funcional, uma vez que o coração e os
músculos, ao contrário do fígado, necessitam da glicose para a produção
de ATP para contração, em resposta a situações de estresse ou risco
iminente (que disparam o estímulo adrenérgico), e não têm papel na
manutenção da glicose plasmática. Assim, a glicose-6-fostato resultante
da degradação do glicogênio no músculo segue a via glicolítica, como
veremos a seguir.
Ação sobre o fluxo glicolítico
Uma diferença fundamental ocorre entre o tecido muscular e o
tecido hepático, com relação ao papel da adrenalina sobre a glicólise.
No músculo, a enzima bifuncional PFK-2/F2,6BPase responde de maneira
totalmente inversa à fosforilação
promovida pela PKA; ou seja, no
Lipídeos
músculo, a PFK-2 estará ativa quando
Tecido adiposo
Glicogênio
Fígado
a enzima estiver fosforilada, enquanto
a atividade da F2,6BPase fica inibida.
Ácidos
graxos
Isso resulta em efeitos inversos da
adrenalina sobre as vias glicolíticas
Corpos
cetônicos
Glicose
Glicose
muscular e hepática (Figura 32.7).
CO2
CO2
Lactato
Tecido muscular
Glicogênio
246 CEDERJ
Figura 32.7: Ação da adrenalina sobre o
metabolismo do glicogênio e sobre o fluxo
glicolítico muscular e hepático.
32 MÓDULO 7
AULA
Efeitos da adrenalina sobre o músculo cardíaco
A adrenalina exerce efeitos bem característicos no músculo
cardíaco. Como já comentamos, situações de estresse muitas vezes
tornam necessário o aumento da freqüência cardíaca, o aumento da força
de contração e, por conseguinte, maior efetividade no bombeamento
de sangue, com oxigênio e nutrientes para todo o organismo. Isso só
é possível se ocorrer um aumento na taxa de metabolismo basal do
cardiomiócito, ou seja, aumento no consumo de oxigênio e aumento na
produção de ATP. Torna-se óbvio então que, nessa situação, ao contrário
do que ocorre em nível hepático, é necessário que a adrenalina promova
um aumento da glicólise cardíaca, a fim de maximizar a produção de
energia para a contração muscular.
No cardiomiócito, a adrenalina também age via receptor
β-adrenérgico, com ativação da adenilato ciclase e de todos os outros
efeitos atrelados ao aumento nos níveis de AMPc, resultando na ativação
da PFK-1 pela F2,6BP, como ocorre no músculo esquelético.
Estudos recentes mostraram que, no tecido muscular cardíaco
sob influência de adrenalina, o glicogênio é utilizado preferencialmente,
seguido pela glicose exógena e, finalmente, pela oxidação de ácidos
graxos, que ocorre em níveis muito inferiores. Entretanto, a oxidação de
ácidos graxos continua sendo muito importante no suprimento energético
de outros tecidos, principalmente durante o jejum.
Efeitos da adrenalina sobre o tecido adiposo
No tecido adiposo, a adrenalina apresenta um importante papel
no processo de degradação dos triacilgliceróis armazenados. Como
comentamos anteriormente, a enzima lipase sensível a hormônio pode ser
substrato da fosforilação catalisada pela PKA. Essa fosforilação promove
a ativação da enzima. O resultado final da sinalização da adrenalina é a
liberação de glicerol e de ácidos graxos dos adipócitos para o plasma.
Esses ácidos graxos serão transportados para utilização em diversos
tecidos, como importante fonte energética.
Outra enzima encontrada em adipócitos, que responde aos efeitos
da adrenalina, é a acetil-CoA carboxilase. Essa enzima catalisa o primeiro
passo comprometido da biossíntese de ácidos graxos, sendo regulada
tanto por efetores alostéricos (citrato), como pela inativação induzida
por fosforilação.
CEDERJ 247
BIOQUÍMICA II | Glucagon e adrenalina
Assim, podemos concluir que a adrenalina estimula a lipólise no
tecido adiposo, a glicogenólise e a glicólise muscular, além de aumentar
as concentrações plasmáticas de glicose, ao estimular a glicogenólise e
a gliconeogênese no fígado.
RESUMO
Nesta aula, abordamos os principais aspectos relacionados aos hormônios glucagon
e adrenalina. Embora sejam secretados por glândulas diferentes, em resposta a
estímulos distintos, esses dois hormônios compartilham o mesmo mecanismo de
ação. Ambos se ligam a receptores associados à proteína G, ativando a produção
intracelular de AMPc, que, por sua vez, ativa a PKA. Essa proteína cinase vai catalisar
a fosforilação de uma série de enzimas, levando à modificação de sua atividade.
O glucagon é secretado pelas células α das Ilhotas de Langerhans do pâncreas,
em resposta à diminuição da glicemia. Ele age principalmente sobre o fígado
e também sobre o tecido adiposo. No fígado, os principais efeitos metabólicos
são: a ativação da degradação do glicogênio e da gliconeogênese, resultando na
produção de glicose, que é liberada na circulação sangüínea. No tecido adiposo,
a fosforilação da lipase leva à hidrólise dos triacilgliceróis, liberando ácidos graxos
e glicerol na circulação.
A adrenalina é secretada pela medula da glândula adrenal, em resposta a
estímulos do sistema nervoso. Os principais tecidos-alvo são o fígado, o músculo
e o tecido adiposo. No fígado e no tecido adiposo, os efeitos são semelhantes aos
do glucagon. No músculo, que não responde ao glucagon devido à ausência de
receptores, a adrenalina provoca a degradação do glicogênio e ativa a glicólise,
permitindo que as células musculares sintetizem ATP em anaerobiose.
EXERCÍCIOS
Os exercícios referentes às Aulas 31, 32 e 33 serão apresentados em conjunto ao
final da Aula 33.
248 CEDERJ
objetivo
AULA
Insulina e glicocorticóides
33
• Chegamos ao final do nosso curso.
Nesta aula, vamos terminar o estudo
do metabolismo, falando especificamente
de outros dois hormônios importantes
na regulação do metabolismo energético:
a insulina e os glicocorticóides. Com isso,
acreditamos que você terá uma visão bem
ampla do funcionamento do nosso organismo.
Pré-requisito
Esta aula também vai explorar a integração
hormonal do metabolismo. Por isso, será
importante, novamente, adiantar o estudo de
toda a matéria antes de começar a ler a aula, de
forma que você tenha uma boa visão geral do
metabolismo e das várias vias que o compõem.
BIOQUÍMICA II | Insulina e glicocorticóides
INSULINA
Características químicas da insulina
A insulina é uma pequena proteína com 51 resíduos de aminoácidos,
secretada pelas células β das Ilhotas de Langerhans do pâncreas. Ela é
sintetizada como uma forma inativa, chamada pré-pró-insulina. Essa
!
proteína apresenta uma única cadeia polipeptídica, tendo em sua porção
Na Aula 32, falamos sobre
as células que compõem
as Ilhotas de Langerhans
do pâncreas.
N-terminal uma seqüência de sinalização (Figura 33.1). Quando essa
seqüência é clivada devido à ação de proteases, há formação de três pontes
dissulfeto, dando origem à pró-insulina. Essa, então, é direcionada para
o Complexo de Golgi, onde será armazenada em vesículas.
Quando há estímulo para a secreção de insulina, enzimas específicas,
denominadas pró-hormônios convertases 1, 2 e 3 (PC 1, 2 e 3), promovem
a hidrólise de duas ligações peptídicas na cadeia da pró-insulina, dando
origem à insulina madura e ao peptídeo C (Figura 33.1).
A forma ativa do hormônio, agora, apresenta duas cadeias peptídicas
unidas por pontes dissulfeto, e é transportada pelas vesículas secretórias
através do Complexo de Golgi, que é extremamente desenvolvido nas
Ilhotas de Langerhans, até a membrana plasmática onde será exocitada.
Pró-insulina
Pré-pró-insulina
Insulina madura
+
NH3
+
NH3
Seqüência
de sinalização
S
C
B
B
SS
+
H3N
+
NH3
S
Cadeia A
S
S S
SS
COO-
Cadeia B
S
S S
COO-
COO-
-
OOC
Seqüência de sinalização
Peptídeo C
Figura 33.1: Processo de formação da insulina. A insulina madura é formada a partir de seu precursor pré-pró-insulina
através de sucessivas reações de proteólise. A remoção de 23 aminoácidos (seqüência de sinalização) na região
animo-terminal da pré-pró-insulina e a formação de três pontes dissulfeto produzem a pró-insulina. Posteriormente,
nova proteólise remove o peptídeo C, formando a insulina madura, composta por duas cadeias – A e B.
250 CEDERJ
33 MÓDULO 7
AULA
Secreção de insulina pelas células β
As células β do pâncreas secretam quantidades precisas de insulina
em resposta a sutis aumentos na concentração basal de glicose plasmática.
O principal estímulo fisiológico para a secreção de insulina é, portanto,
a glicose.
Quando nos alimentamos, a absorção dos nutrientes é um processo
gradual e contínuo, que se inicia aproximadamente 20 minutos após o
início da refeição. Os níveis plasmáticos de glicose após uma refeição
podem chegar a mais de 10mM, ou seja, o dobro dos níveis basais.
!
Existem algumas drogas,
utilizadas no tratamento
do diabetes, denominadas
hipoglicemiantes orais,
que também estimulam
a secreção de insulina
(estímulo clínico).
Portanto, é de suma importância que a secreção de insulina seja um
processo também gradual, acompanhando as oscilações dos níveis
plasmáticos de glicose.
Receptor e mecanismos de ação
O receptor de insulina faz parte da grande família dos receptores
tirosina cinase. É uma glicoproteína composta de duas subunidades
α, que contêm sítios de ligação para a insulina, e duas subunidades β,
que atravessam a membrana plasmática da célula e apresentam atividade
tirosina cinase em seus domínios citosólicos (Figura 33.2).
Insulina ligada
α
α
β
β
ATP
Tyr
Tyr
P
P
Proteína-alvo
Domínio Tyr
tirosina cinase
Sítio de autofosforilação
ADP
Tyr
Efeitos intracelulares
Figura 33.2: Diagrama esquemático do receptor da insulina. Os sítios de ligação da
insulina estão mostrados na subunidade α e os sítios de fosforilação na subunidade β.
CEDERJ 251
BIOQUÍMICA II | Insulina e glicocorticóides
As subunidades α e β encontram-se unidas através de pontes
dissulfeto. Após a ligação da insulina no sítio das subunidades α, uma
rápida mudança conformacional se segue, provocando a autofosforilação
de vários resíduos de tirosina na porção citosólica das subunidades β.
A autofosforilação resulta no aumento da atividade tirosina
cinásica do receptor de insulina, iniciando a propagação de sinal através
de interações proteína-proteína.
Atualmente, a insulina é um dos hormônios mais bem estudados.
Entretanto, seu mecanismo de ação ainda está longe de ser completamente
esclarecido. Sabe-se que a cascata de sinalização da insulina é muito
complexa e cada vez mais novas proteínas são descritas.
!
Os estudos referentes ao mecanismo de ação da insulina têm grande
importância face à alta prevalência de diabetes mellitus em todo o mundo.
O diabetes é a terceira maior enfermidade, que acomete pelo menos 3% da
população européia e norte-americana e 100 milhões de pessoas em todo o
mundo.
Uma classe de proteínas, conhecidas como IRS (Insulin Receptor
Substrate, ou Substrato para o Receptor de Insulina), é diretamente
!
Você aprendeu as características e a importância dos
fosfolipídeos na disciplina
Bioquímica I.
fosforilada pelo receptor em seus resíduos de tirosina. Quando essas
proteínas são fosforiladas, elas se associam a uma série de outras proteínas
presentes na célula, modificando sua atividade. Uma das principais enzimas
cuja atividade é modificada pela ligação ao IRS-1 é a fosfatidilinositol-3cinase (PI3K). Essa enzima introduz um grupamento fosfato na posição 3
do anel inositol dos fosfoinositídeos, que são fosfolipídeos localizados nas
membranas plasmáticas ou de organelas. A PI3K apresenta uma subunidade
Insulina
regulatória (mais bem descrita) de 85kDa (p85α),
e uma subunidade catalítica de 110kDa (p110).
Membrana plasmática
Receptor
de insulina
A subunidade p85α associa-se ao IRS-1 e
também à p110. A subunidade catalítica p110
é estimulada pela ligação à p85 α e, ainda mais,
ATP
quando esta última está associada ao IRS-1
Fosforilação nos resíduos de tirosina
p110
p85α
Fosfoditil
inositol-3-cinase
Citoplasma
252 CEDERJ
IRS-1
(Figura 33.3).
Figura 33.3: Esquema da transdução de sinal da insulina.
O receptor da insulina ativo se liga temporariamente
à IRS-1, fosforilando-a, e esta última se liga à
subunidade regulatória p85α da PI3K. O complexo
IRS-1/PI3K transloca-se para membranas, promovendo
a fosforilação do fosfatidilinositol.
33 MÓDULO 7
AULA
Efeitos da insulina sobre a captação de glicose
Um dos principais efeitos promovidos pela PI3K é o aumento da
captação de glicose por determinadas células, principalmente células
musculares e células do tecido adiposo. Isso evita um aumento indesejável
da concentração plasmática desse açúcar. Mas como isso ocorre?
A entrada de glicose nas células se dá através de proteínas
transportadoras de glicose, que são chamadas GLUT (Glucose
Transporter, ou seja, transportador de glicose). Os diferentes tecidos
expressam diferentes tipos de GLUT (Tabela 33.1).
Tabela 33.1: Características dos transportadores de glicose
Transportador
KM aproximado
para glicose (mM)
Distribuição
Características
SGLT-1
0,2-0,5
Intestino e rim
Transporte dependente de Na+; concentra glicose através da membrana
epitelial apical
GLUT-1
10
Ampla distribuição, alta concentração nos eritrócitos e no endotélio
Transportador constitutivo de glicose
GLUT-2
20-42
Fígado, células β do pâncreas, rim e
intestino delgado
Transportador de baixa afinidade
e alta capacidade de transporte;
funciona como um sensor de glicose
GLUT-3
1-5
Neurônios, placenta
Transportador de alta afinidade
GLUT-4
2-10
Músculo esquelético e cardíaco,
tecido adiposo
Transportador dependente de
insulina
GLUT-5
---
Intestino delgado, esperma, rim,
cérebro, adipócitos e músculo
Transportador de frutose; afinidade
muito baixa para glicose
GLUT-7
---
Hepatócitos
Transporta glicose através da membrana do retículo endoplasmático
durante a gliconeogênese
Dentre os transportadores de glicose conhecidos, os GLUTs 4, que
são expressos nas células do tecido adiposo e do músculo esquelético,
são dependentes de insulina para captarem glicose. Isso se dá da seguinte
forma: em células não estimuladas com insulina, esses transportadores encontram-se confinados em vesículas, localizadas no citosol.
CEDERJ 253
BIOQUÍMICA II | Insulina e glicocorticóides
A estimulação celular pela insulina promove a exocitose e translocação
das vesículas contendo GLUT4 para a membrana plasmática, resultando
em um aumento de até 30 vezes na captação de glicose por essas
células. Ainda não está muito bem esclarecido como esse mecanismo
ocorre. Alguns estudos mostraram que a associação da p110 da PI3K
às vesículas é uma possível resposta (Figura 33.4). Como os tecidos
adiposo e muscular correspondem, juntos, a aproximadamente 60%
da massa corporal, o controle exercido pela insulina sobre a captação
e utilização de glicose pelas células desses tecidos é fundamental para a
normalização da glicemia no período absortivo.
Estimulação do
tranporte de glicose
Exercício
GLUT-4
Membrana
plasmática
Insulina
Receptor
de insulina
ATP
Cinase ativada
por AMP
?
?
Proteínas
cinase B
(Akt)
Fosforilação nos resíduos de tirosina
Cinases
dependentes de
fosfatidil inositol
Translocação
para
membrana
plasmática
?
Proteínas
cinase C
atípica
p110
p85
Fosfoditil
inositol-3-cinase
IRS-1
Domínios SH2
Citoplasma
Vesículas contendo
GLUT-4 (responsivos
ao exercício)
Vesículas contendo
GLUT-4 (responsivos
à insulina)
Figura 33.4: Efeito da insulina sobre os GLUT4. A ligação da insulina a seu receptor induz um aumento da atividade
tirosina cinásica deste último. Um dos principais substratos desse receptor é a proteína IRS-1 que, fosforilada, vai ativar
a PI3K. A fosforilação do fosfatidilinositol na posição 3, catalisada por essa enzima, levará à migração das vesículas
contendo GLUT4 para a superfície das células adiposas e musculares. Quando a insulina se desliga dos receptores, os
transportadores de glicose GLUT4 são internalizados por endocitose e armazenados em vesículas citoplasmáticas.
Outros efeitos da insulina no metabolismo
Além de estimular a captação de glicose pelo músculo e pelo
tecido adiposo, a insulina provoca uma série de outros efeitos sobre
o metabolismo de diversos tipos celulares. Os mecanismos envolvidos
nesses efeitos não estão todos completamente elucidados. Optamos,
então, por listar apenas os efeitos finais, sem descrever as etapas
enzimáticas diretamente envolvidas na regulação pela insulina. Cabe
ressaltar que grande parte desses efeitos resulta da ativação de fosfatases
que defosforilam as enzimas que são fosforiladas pela PKA. Segue a lista
com os principais efeitos da insulina em diferentes tecidos:
254 CEDERJ
33 MÓDULO 7
AULA
Fígado:
– Ativação da glicólise e inibição da gliconeogênese;
– Ativação da síntese de glicogênio e inibição da sua degradação;
– Ativação da síntese de ácidos graxos;
– Ativação da via das pentoses.
Músculo:
– Aumento da captação de glicose;
– Ativação da síntese de glicogênio e inibição da sua degradação.
Tecido adiposo:
– Aumento da captação de glicose;
– Ativação da síntese de ácidos graxos;
– Ativação da via das pentoses.
Repare que todos os resultados da ação da insulina sobre as vias
metabólicas resultam em uma maior utilização da glicose, permitindo
uma rápida redução da glicemia e a produção de reservas energéticas
com o excedente de glicose.
CÓRTEX
GLICOCORTICÓIDES
Os corticóides são hormônios esteróides sintetizados exclusivamente
no CÓRTEX das glândulas supra-renais (adrenais). Esses hormônios podem
ser divididos em duas classes principais, os mineralocorticóides, assim
denominados por estarem envolvidos com a regulação do equilíbrio de
íons, principalmente sódio e potássio, dos quais não falaremos nesta aula,
e os glicocorticóides, assim denominados devido ao seu papel central
na regulação do metabolismo de carboidratos, mas que também estão
envolvidos na regulação de diversas outras vias metabólicas, como a via
de síntese e degradação de ácidos graxos, além de desempenharem papel
central na mediação da resposta imunológica.
Natureza química dos glicocorticóides
Os glicocorticóides são sintetizados a partir do colesterol por uma
série de reações químicas complexas que não serão exploradas nesta
aula. Os glicocorticóides naturais mais importantes são o cortisol e a
corticosterona (Figura 33.5). Um homem adulto produz diariamente de
10 a 30mg de cortisol e de 2 a 4mg de corticosterona.
Em um indivíduo
adulto, o córtex
compreende 90%
do tamanho total da
glândula supra-renal,
sendo os outros 10%
constituídos pela
medula. Do ponto de
vista histológico, o
córtex supra-renal pode
ser dividido em três
zonas: (a) a zona mais
externa, chamada zona
glomerular, responsável
pela síntese dos
mineralocorticóides;
(b) a zona média,
chamada zona
fasciculada, que é a
maior das três zonas,
constituindo cerca de
75% do córtex suprarenal; e (c) a zona mais
interna, denominada
zona reticular.
As duas últimas
são responsáveis
pela síntese dos
glicocorticóides,
dos androgênios
e dos estrogênios
supra-renais.
CEDERJ 255
BIOQUÍMICA II | Insulina e glicocorticóides
CH2OH
CH3
HO
C
O
OH
CH3
O
Figura 33.5: Estrutura química do cortisol.
Secreção de glicocorticóides
A produção de glicocorticóides é regulada pelo hormônio
GLÂNDULA
PITUITÁRIA
A glândula pituitária,
também conhecida
como hipófise, às
vezes recebe também
o nome de glândula
“mestra” do sistema
endócrino, por
controlar as funções
das outras glândulas
endócrinas. A
glândula pituitária
está localizada na base
do cérebro, unida
ao hipotálamo (uma
parte do cérebro que
influi na glândula
pituitária) por meio
de fibras nervosas.
Vários hormônios
são produzidos
pela hipófise,
como o hormônio
do crescimento,
a prolactina,
o hormônio
adrenocorticotrófico
(ACTH), o hormônio
estimulante da tireóide
(TSH), o hormônio
folículo-estimulante
(FSH), o hormônio
luteinizante (LH),
o hormônio
estimulante dos
melanócitos,
o hormônio
antidiurético (ADH) e
a oxitocina.
256 CEDERJ
adrenocorticotrófico (ACTH), um hormônio peptídico produzido pela
GLÂNDULA PITUITÁRIA.
O controle da secreção de glicocorticóides se dá principalmente
em dois níveis. O primeiro nível pode ser considerado constitutivo,
e determina o ritmo circadiano de secreção dos glicocorticóides. Todos os
mamíferos apresentam um pico de secreção de ACTH (e posteriormente
de glicocorticóides) algumas horas antes do despertar. O horário dessa
secreção pode ser reajustado em poucos dias, adaptando-se a mudanças
nos hábitos noturno e diurno do indivíduo. Um segundo nível de controle
de secreção de glicocorticóides se relaciona à resposta ao estresse. Sabe-se
que estresses de qualquer natureza, como alimentar, hídrico, choques e
traumas, dentre outros, disparam a secreção de glicocorticóides.
A liberação de ACTH pela glândula pituitária, por sua vez, pode
ser regulada por um outro hormônio peptídico, o hormônio liberador de
corticotrofina (CRH) (corticotrophin releasing hormone). Esse hormônio
é produzido no hipotálamo e levado à adeno-hipófise por um sistema
de vasos do tipo porta. Assim, diz-se que a produção e a secreção dos
glicocorticóides se encontram sob o controle do eixo hipotálamopituitária-adrenal.
33 MÓDULO 7
AULA
Mecanismo de ação dos glicocorticóides
Ao contrário dos hormônios peptídicos, os glicocorticóides não
necessitam ligar-se a receptores na membrana celular para desempenhar
seus principais papéis. Por serem lipídeos, esses hormônios apresentam
natureza hidrofóbica, podendo assim atravessar a membrana e encontrar
receptores específicos intracelulares, localizados no citoplasma ou no
núcleo das células-alvo. A ligação do hormônio promove mudanças
conformacionais no receptor, resultando na formação de um complexo
ativado, com alta afinidade por determinados sítios do DNA, chamados
elementos regulatórios. Geralmente, a ligação do complexo hormônioreceptor a esses elementos regulatórios afeta a expressão gênica,
induzindo ou reprimindo a iniciação da transcrição de genes específicos.
Os produtos da tradução dos RNA mensageiros de síntese regulada por
esses hormônios promoverão efeitos metabólicos nas células-alvo.
!
Lembre-se! Você já aprendeu na Aula 31 que receptores hormonais podem ser
subdivididos em dois grupos principais: aqueles que se encontram na superfície
celular e vão mediar respostas citoplasmáticas e aqueles de localização intracelular
e que vão atuar geralmente no núcleo da célula-alvo.
Efeitos dos glicocorticóides no metabolismo
Um dos principais efeitos dos glicocorticóides se dá sobre a via gliconeogênica. Analise os resultados experimentais descritos a seguir e tire suas
conclusões sobre os efeitos dos glicocorticóides sobre essa via metabólica.
Nesta experiência, Viru e colaboradores mediram a concentração
de glicose sangüínea em ratos-controle e ratos adrenalectomizados (cuja
adrenal foi retirada), antes e após um exercício intenso, obtendo os
resultados mostrados na Tabela 33.2.
Tabela 33.2: Efeito do exercício na glicemia de ratos-controle e adrenalectomizados.
Concentração de glicose sanguínea (mM)
Condição
controle
adrenalectomizado
Repouso
6,12 ± 0,22
4,88 ± 0,38
Pós-exercício
5,63 ± 0,29
2,95 ± 0,41
CEDERJ 257
BIOQUÍMICA II | Insulina e glicocorticóides
Esses resultados demonstram, de forma bastante clara, que a glicemia
é significativamente menor nos ratos adrenalectomizados, sugerindo um
papel importante dos glicocorticóides na ativação da via gliconeogênica.
Mas quais seriam os mecanismos responsáveis por esse aumento
da atividade gliconeogênica induzida por glicocorticóides?
Vamos analisar outros resultados experimentais. Em 1960, Weber
e colaboradores estudaram os efeitos dos corticóides na atividade de
G L I C O S E -6-
duas enzimas-chave das gliconeogênicas:
F O S F ATA S E E
1,6
F R U T O S E -1,6
BIFOSFATASE.
GLICOSE-6-FOSFATASE E FRUTOSE-
Após administração de um glicocorticóide (dia sim,
dia não), eles sacrificavam animais de três lotes (controle, tratados
B I F O S F ATA S E
Caso você tenha
esquecido a
importância das
enzimas glicose-6fosfatase e frutose1,6 bifosfatase na
gliconeogênese, volte
às Aulas 29 e 30.
com glicocorticóide e tratados com glicocorticóide + actinomicina D,
um inibidor de transcrição). Extraíam o fígado e faziam os ensaios da
atividade enzimática no homogenato. Nos animais remanescentes,
continuavam a injetar cronicamente o glicocorticóide até o fim da
experiência no 13º dia. Os resultados por eles obtidos podem ser
observados na Figura 33.6.
Glicose-6-fosfatase
Frutose-1,6-bifosfatase
300
% atividade
% atividade
300
200
100
200
100
0
0
0.0
2.5
5.0
7.5
Dias de tratamento
10.0
12.5
0.0
2.5
5.0
7.5
10.0
12.5
Dias de tratamento
Figura 33.6: Atividade das enzimas gliconeogênicas durante tratamento com glicocorticóides. 100%: atividades
obtidas nos animais controle; ( • ) tratados com glicocorticóide; ( o ) tratado com glicocorticóide + actinomicina D.
Que conclusões você pode tirar dessa experiência?
Agora, observe os resultados obtidos em outra experiência.
Você sabe que a gliconeogênese é uma via metabólica para
síntese de glicose a partir de precursores não glicídicos que têm,
como uma de suas etapas limitantes, a conversão de oxaloacetato em
fosfoenolpiruvato (PEP), catalisada pela enzima fosfoenolpiruvato
carboxicinase (PEPCK). Em 1986, Hoppner e colaboradores mediram
os níveis de RNA mensageiro para a PEPCK, em cultura de hepatócitos,
na presença ou ausência de dexametasona (um glicocorticóide sintético),
obtendo os resultados mostrados na Tabela 33.3.
258 CEDERJ
Condição
RNA da PEPCK (% mRNA total)
Controle
0,023 ± 0,005
Dexametasona
0,052 ± 0,004
33 MÓDULO 7
AULA
Tabela 33.3: Níveis de RNA mensageiro para a PEPCK de hepatócitos em cultura,
mantidos na presença ou ausência de glicocorticóides.
Com este experimento, podemos compreender que os glicocorticóides são capazes de ativar a gliconeogênese através da indução da
transcrição e síntese da PEPCK, levando, assim, a um aumento dos níveis
celulares totais dessa enzima.
Além de ativarem a gliconeogênese, os glicocorticóides também
agem sobre o metabolismo de aminoácidos e proteínas.
O tratamento de células musculares com glicocorticóides aumenta
em, pelo menos, 20% a degradação de proteínas. Imagina-se que os
aminoácidos resultantes sejam secretados pelo músculo para a corrente
sangüínea, ficando assim disponíveis para outros órgãos, principalmente
o fígado. Neste órgão, os aminoácidos podem ser utilizados como
substrato para a gliconeogênese ou como substratos para a síntese das
diversas proteínas hepáticas, cuja produção é justamente estimulada
pelos glicocorticóides.
A expressão de importantes enzimas relacionadas ao metabolismo
de aminoácidos, as
TRANSAMINASES,
também pode ser estimulada pelos
TRANSAMINASES
glicocorticóides. O aumento da síntese dessas enzimas pode ser observado
Você aprendeu sobre
as transaminases nas
Aulas 17, 18 e 19.
em diversos tecidos, mas principalmente no músculo e no fígado.
No músculo, acredita-se que esse efeito esteja relacionado ao aumento da
secreção de alanina e glutamina. Uma vez no plasma, esses aminoácidos
podem ser então captados pelo fígado e, com a ajuda das transaminases
recém-sintetizadas, convertidos a piruvato ou a intermediários do
ciclo de Krebs que podem ser utilizados como substratos para a
gliconeogênese.
CEDERJ 259
BIOQUÍMICA II | Insulina e glicocorticóides
RESUMO
Nesta aula, abordamos os principais aspectos relacionados aos hormônios insulina
e glicocorticóides.
A insulina é uma pequena proteína secretada pelas células β das Ilhotas de
Langerhans do pâncreas, em resposta ao aumento da glicemia. O receptor da
insulina tem atividade tirosina cinase que é ativada pela ligação da insulina.
O receptor se autofosforila e, então, fosforila algumas proteínas intracelulares em
seus resíduos de tirosina. A principal proteína fosforilada é o IRS-1. Essa proteína
se associa a várias enzimas, modificando sua atividade. Uma das principais enzimas
com atividade modulada pela ligação do IRS-1 é a PI3K. Os efeitos da insulina sobre
o metabolismo estão relacionados a um aumento na captação e utilização da
glicose pelas diferentes células do organismo. A captação de glicose pelo músculo
e pelo tecido adiposo é aumentada em muitas vezes. Esses tecidos passam a usar a
glicose e a produzir suas reservas, o glicogênio e os triacilgliceróis, respectivamente.
A utilização da glicose também é aumentada no fígado, que repõe suas reservas
de glicogênio e sintetiza ácidos graxos.
Os glicocorticóides são secretados pelo córtex da glândula adrenal em resposta
ao aumento nos níveis sangüíneos de ACTH, que, por sua vez, aumentam por um
estímulo do hipotálamo em decorrência de vários tipos de estresse. O principal
glicocorticóide humano é o cortisol. Por sua natureza lipídica, esses hormônios
atravessam a membrana da célula, ligam-se a receptores intracelulares e atuam
sobre a expressão gênica. As principais enzimas cujos genes são regulados pelos
glicocorticóides são as transaminases e as enzimas gliconeogênicas PEPCK, frutose1,6-bifosfatase e glicose-6-fosfatase. O resultado de sua ação é, principalmente,
o aumento da produção de glicose pelo fígado, especialmente a partir de
aminoácidos provenientes da degradação de proteínas musculares.
260 CEDERJ
33 MÓDULO 7
1. A meia-vida da maioria dos hormônios no sangue é relativamente curta. Por
exemplo, se injetarmos insulina marcada radioativamente em um animal, metade
do hormônio desaparecerá do sangue após 30min.
a) Qual é a importância dessa inativação relativamente rápida dos hormônios
circulantes?
b) Tendo em vista essa rápida inativação, como o nível de hormônios circulantes
se mantém constante em condições normais?
c) De que maneira é possível a ocorrência de mudanças nas concentrações de
hormônios circulantes?
2. Com base em suas propriedades químicas, os hormônios podem ser classificados
em duas categorias: aqueles que são muito solúveis em água, mas relativamente insolúveis em lipídeos (por exemplo, a adrenalina); e aqueles que são
relativamente insolúveis em água, mas muito solúveis em lipídeos (por exemplo,
os hormônios esteróides). Comente as implicações entre as características químicas
dessas duas classes de hormônios e seu mecanismo de ação.
3. Ramachandran e colaboradores, em 1983, perfundiram fígados de rato com
diferentes concentrações de glucagon e determinaram a atividade da glicogênio
sintase, bem como o conteúdo de fosfato associado a ela. Os resultados estão
Aumento no conteúdo de
32
p (pmol/unidade)
Atividade da glicogênio
sintase (%)
mostrados na figura a seguir:
50
40
30
20
0
10-9
10-8
10-7
10-6
120
80
40
0
0
10-9
Glucagon (M)
10-8
10-7
10-6
Glucagon (M)
a) Interprete a figura, correlacionando os resultados dos dois gráficos.
b) Quais seriam os resultados obtidos se fossem medidos os níveis de frutose2,6-bifosfato e a atividade da glicogênio fosforilase?
CEDERJ 261
AULA
EXERCÍCIOS REFERENTES ÀS AULAS 31, 32 E 33
BIOQUÍMICA II | Insulina e glicocorticóides
4. A adrenalina é um hormônio sintetizado na medula da glândula adrenal a
partir do aminoácido tirosina. Esse hormônio é secretado em resposta a diferentes
tipos de estresse. Os gráficos a seguir mostram o resultado de uma experiência na
qual células de músculo esquelético de rato foram incubadas com concentrações
crescentes de adrenalina.
2,8
0,4
0,2
12
Frutose-2,6-bifosfato
2,4
10
2,0
8
nmoles/g
AMPc
nmoles/g
nmoles/g
0,6
1,6
1,2
Lactato
6
4
0,8
2
0,4
0
0,0
0,0
0
10 20 30 40 50 60 70 80
0
Adrenalina
10 20 30 40 50 60 70 80
Adrenalina
0
10 20 30 40 50 60 70 80
Adrenalina
a) Justifique as alterações observadas nos níveis intracelulares dos diferentes
metabólitos.
b) Quais seriam as variações observadas, se essas células fossem incubadas com
glucagon? Justifique.
5. Durante situações de “fuga ou luta”, a liberação de adrenalina promove a
degradação do glicogênio no fígado, no músculo esquelético e no coração.
O produto final da quebra do glicogênio no fígado é a glicose, enquanto no
músculo é piruvato ou lactato.
a) Por que são observados diferentes produtos da degradação do glicogênio
nos dois tecidos?
b) Para o organismo, qual é a vantagem adaptativa de existirem esses dois
diferentes destinos do glicogênio em situações de “fuga ou luta”?
6. Com base nos conhecimentos adquiridos a respeito da ação da insulina sobre a
captação de glicose por alguns tipos celulares, explique os resultados obtidos no
experimento descrito a seguir:
Por volta de 1985, diversos pesquisadores fizeram culturas de diferentes tipos de
tecidos para estudar a captação de glicose por essas células. Os ensaios foram
realizados a partir da adição de 3-metil-glicose (um análogo não metabolizado
da glicose) ao meio de cultura, contendo ou não insulina. Os resultados estão
dispostos na tabela seguinte:
262 CEDERJ
g/dia
µmol/g
tecido/min
g/dia
µmol/g
tecido/min
Fígado
107
0,3
104
0,3
Cérebro
110
0,31
112
0,3
Músculo esquelético
98
0,01
980
0,1
7. Descreva dois efeitos da insulina sobre o metabolismo energético diferentes
daqueles descritos no exercício anterior.
8. No gráfico abaixo, a linha tracejada indica a administração de um composto
hipoglicemiante (diminui a concentração sangüínea de glicose).
Concentrção de Cortisol (mg/dl)
50,0
10,0
5,0
1,0
0,5
-80
-40
0
40
80
120
Tempo (min)
a) Relacione a hipoglicemia com a variação observada na concentração de cortisol.
b) Descreva o mecanismo de ação dos glicocorticóides, ressaltando seu papel
na utilização de aminoácidos para a reposição da glicose sangüínea.
CEDERJ 263
33 MÓDULO 7
3-metil-glicose + insulina
AULA
3-metil-glicose
Tipo Celular
Gabarito
Bioquímica II
Aulas 31, 32 e 33
1. a) A inativação fornece uma maneira rápida de mudar a concentração sangüínea
do hormônio, permitindo um controle preciso de seus efeitos.
b) Os níveis dos hormônios podem ser mantidos constantes se suas taxas de síntese
e degradação são equivalentes.
c) Outras maneiras de variar a concentração de hormônios no sangue são o controle
sobre as taxas de liberação dos estoques intracelulares, de transporte, e de
conversão de um precursor do hormônio em sua forma ativa.
2. Os hormônios solúveis em água exercem seus efeitos a partir de sua ligação a
receptores presentes na superfície externa da célula, desencadeando a formação
de um segundo mensageiro no interior da célula; geralmente levam à modificação da
atividade de enzimas pré-existentes. Os hormônios lipossolúveis atravessam a
membrana celular e agem sobre moléculas-alvo ou receptores diretamente;
geralmente levam à modificação da expressão gênica, modificando o número de
enzimas disponíveis.
3. a) À medida que a concentração de glucagon no meio de perfusão aumenta, a
atividade da glicogênio sintase diminui, e a quantidade de fosfato associado
essa enzima aumenta. Isso ocorre porque o glucagon, ao se ligar ao seu receptor
na superfície dos hepatócitos, desencadeia uma série de eventos que culminam
com a ativação da PKA. Esta enzima catalisa a fosforilação de diversas enzimas,
dentre as quais a glicogênio sintase. Por isso, o conteúdo de fosfato associado
à enzima aumenta. A fosforilação da glicogênio sintase inibe sua atividade,
justificando o primeiro gráfico.
b) A concentração hepática de frutose-2,6-bifosfato diminuiria, já que a fosforilação
da enzima bifuncional fosfofrutocinase2/frutose-2,6-bifosfatase ativa sua
porção frutose-2,6-bifosfatase, levando à conversão de frutose-2,6-bifosfato
em frutose-6-fosfato. A atividade da glicogênio fosforilase aumentaria, pois
esta enzima também é substrato para a PKA, sendo o efeito da sua fosforilação
a sua ativação.
266 CEDERJ
4. a) Os níveis de AMPc aumentam em resposta ao aumento da concentração de
adrenalina no meio de incubação. Isso ocorre porque a ligação da adrenalina
ao seu receptor celular desencadeia mudanças conformacionais no receptor que
alteram sua interação com a proteína G associada a ele, levando à dissociação
da subunidade α, que passa a interagir com a adenilato ciclase, ativando-a.
A adenilato ciclase catalisa a conversão de ATP em AMPc, aumentando, assim,
os níveis intracelulares deste metabólito.
Os níveis de F2,6BP aumentam em resposta ao aumento da concentração
de adrenalina no meio de incubação. Isso ocorre porque o AMPc se liga às
subunidades regulatórias da PKA, levando a sua dissociação das subunidades
catalíticas. Estas últimas passam a catalisar a fosforilação de uma série de
proteínas celulares, dentre as quais a enzima bifuncional PFK2/F2,6Bpase.
A fosforilação da isoforma muscular desta enzima promove a ativação de sua
atividade PFK e a inibição de sua atividade F2,6Bpase, levando à conversão de
F6P em F2,6BP.
Os níveis de lactato aumentam em resposta ao aumento da concentração de
adrenalina no meio de incubação. Isso ocorre porque F2,6BP é um potente ativador
da enzima glicolítica PFK, aumentando, assim, o fluxo glicolítico. Como o aporte de
oxigênio é insuficiente para a completa oxidação da glicose, o excesso de piruvato
formado na via glicolítica é convertido em lactato, permitindo a reoxidação dos
NADH formados na glicólise e a continuidade do metabolismo anaeróbico.
b) Não seria observado nenhum efeito já que as células musculares não possuem
receptores para glucagon.
5. a) As células do coração e do músculo esquelético não possuem a enzima glicose6-fosfatase. Assim, a glicose-6-fosfato produzida entra na via glicolítica, e,
em condições de deficiência de oxigênio, é convertida a lactato via piruvato.
Cabe ressaltar, ainda, que a via glicolítica se torna bastante ativada pela
ação da adrenalina, uma vez que a isoforma muscular da enzima bifuncional
(fosfofrutocinase2/frutose-2,6-bifostase) passa a ter atividade fosfofrutocinase2
em decorrência de sua fosforilação pela PKA, levando a um aumento da
concentração de frutose-2,6-bifosfato, que, por sua vez, ativa a enzima-chave
da glicólise fosfofrutocinase1.
CEDERJ 267
b) Intermediários fosforilados não podem sair da célula porque a membrana
não é permeável a moléculas carregadas. Em situações de “fuga ou luta”,
a concentração de precursores glicolíticos devem ser altas para garantir a
atividade muscular em anaerobiose. O fígado, por outro lado, deve liberar a
glicose necessária para manter a glicemia. A glicose-6-fosfato formada no fígado
é convertida em glicose pela enzima hepática glicose-6-fosfatase sendo, então,
liberada na corrente sangüínea.
6. A presença de insulina no meio de incubação promove um grande aumento
na captação de glicose pelas células musculares (~10 vezes), enquanto nenhuma
alteração é observada na captação de glicose pelo fígado ou pelo cérebro.
Os transportadores de glicose expressos nas células do músculo esquelético, os GLUTs
4, são dependentes de insulina para captarem glicose. Isso se dá da seguinte forma:
em células não estimuladas com insulina, esses transportadores encontram-se
confinados em vesículas, localizadas no citosol. A estimulação celular pela insulina
promove a autofosforilação do receptor da insulina, o que resulta no aumento da sua
atividade tirosina cinase. O receptor catalisa, então, a fosforilação da proteína IRS-1,
que, quando fosforilada, associa-se a várias proteínas celulares, dentre as quais, a
PI3K. Esta enzima se torna ativa e catalisa a fosforilação do fosfatidilinositol presente
em membranas celulares. Este sinal leva à translocação das vesículas contendo GLUT4
para a membrana plasmática, resultando em um aumento na captação de glicose
por essas células.
Os GLUTs presentes nas células hepática e cerebrais se encontram constantemente na
superfície celular, possibilitando a captação de glicose mesmo na ausência de insulina.
7. Grande parte dos efeitos resulta da ativação de fosfatases que defosforilam as
enzimas que são fosforiladas pela PKA. Uma das conseqüências é a ativação da
glicogênio sintase e inibição da glicogênio fosforilase, resultando no aumento
da síntese de glicogênio e inibição da sua degradação, tanto no fígado como no
músculo. Podemos citar também a ativação da acetil-CoA carboxilase devido à sua
defosforilação. Isso resulta na ativação da síntese de ácidos graxos, tanto no fígado
como no tecido adiposo. De uma maneira geral, os resultados da ação da insulina
sobre as vias metabólicas resultam em uma maior utilização da glicose, permitindo
uma rápida redução da glicemia e a produção de reservas energéticas com o excedente
de glicose.
268 CEDERJ
8. a) A secreção de glicocorticóides pode se desencadeada em resposta a estresses
de diferentes naturezas, dentre os quais, a hipoglicemia. A baixa concentração
sanguínea de glicose é percebida por uma região especializada do hipotálamo,
induzindo a secreção de um hormônio peptídico, o hormônio liberador de
corticotrofina (CRH) (corticotrophin releasing hormone). Este hormônio induz a
liberação de ACTH pela glândula pituitária. O ACTH atua na glândula adrenal,
estimulando a produção de glicocorticóides.
b) Os glicocorticóides são hormônios lipídicos, podendo atravessar a membrana
da célula e ligar a receptores intracelulares. O complexo formado pelo glicocorticóide associado ao seu receptor atua sobre a expressão gênica. Assim, esses
hormônios são capazes de induzir a expressão de uma série de enzimas, dentre
as quais as transaminases, importantes enzimas relacionadas ao metabolismo
de aminoácidos. Isso favorece a conversão dos aminoácidos a piruvato ou a
intermediários do ciclo de Krebs, que podem ser utilizados como substratos
para a gliconeogênese. Os glicocorticóides também induzem a transcrição e a
síntese de várias enzimas da gliconeogênese, como a PEPCK, a F1,6BPase e a
G6Pase, levando, assim, a um aumento dos níveis celulares totais dessas enzimas.
Assim, o resultado da ação dos glicocorticóides é, principalmente, o aumento
da produção de glicose pelo fígado, especialmente a partir de aminoácidos
provenientes da degradação de proteínas musculares.
CEDERJ 269
I SBN 85 - 89200 - 46 - 9
código
de barras
9 788589 200462