Cursinho Pré-Universitário Popular
Capítulo 1 – Introdução à Química Orgânica
Prof.: Maria Patrícia
Química 4
Nitrogênio(N): é trivalente e suas ligações
podem ser representadas por ― N ―, = N ― e
Conceito:
│
É o ramo da química que estuda os compostos
do carbono. Como estes compostos são
encontrados nos seres vivos, a Química Orgânica
ficou sendo conhecida como “a química da vida.”
≡ N.
Oxigênio(O): é bivalente, ― O ― e O =.
Halogênios: flúor (F), cloro(Cl), bromo(Br) e iodo
(I), são todos monovalentes, F ―, Cl ―, Br ― e
O Carbono:
No sáculo XIX, Kekulé percebeu que o átomo de
carbono apresentava certas propriedades que o
diferenciava
de
outros
átomos.
Essas
propriedades são:
a) O carbono é tetravalente:
Como o carbono apresenta 4 elétrons
na última camada eletrônica, quando se
liga a outro átomo compartilha esses 4
elétrons formando portanto 4 ligações
covalentes.
b) O carbono forma cadeias:
O átomo de carbono pode ligar-se a
outros átomos de carbono, formando
cadeias com várias disposições e
tamanhos.
Essa propriedade é a principal
responsável pela existência de milhares
de compostos orgânicos.
c) As 4 ligações sigma (σ) de um carbono
são iguais.
I ―.
Enxofre(S): é bivalente: ― S ― e S =.
Representação dos compostos orgânicos:
Os compostos orgânicos possuem uma
variedade de fórmulas utilizadas para representálos. São elas:
Estrutural:
H
H
│
│
H―C―C―H
│
│
H
H
Condensada:
H3C – CH3
Molecular:
C2H6
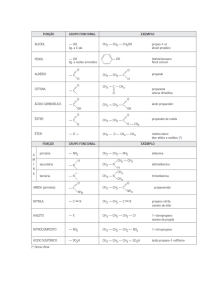
Compostos orgânicos:
Nos compostos orgânicos, a presença do
carbono (C) é obrigatória. Suas ligações podem
ser representadas das seguintes maneiras:
│
― C ―, = C =, ≡ C ― e = C ―.
│
│
Atualmente, a representação mais simplificada
seria a de zigue-zague. As pontas correspondem
a CH3, a junção de dois traços ao grupo CH2, a
junção de três traços ao grupo CH e a junção de
quatro traços a um carbono quaternário. Em
inglês essa nomenclatura é dita Bond Line
Formula.
Exemplos:
Além do carbono são encontrados outros
elementos como:
Hidrogênio(H): é monovalente, efetua uma
única ligação que é representada por H ―.
108
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
CH2 – CH3
H
4- Carbono quaternário:
Está ligado diretamente a apenas átomos
de carbono.
Cadeias carbônicas:
As cadeias carbônicas possuem
classificações
de
acordo
com
características.
algumas
algumas
a) Classificação do carbono na cadeia:
H
CH3
│
│
H ― C ― C* ― CH2 – CH3
Os átomos de carbono numa cadeia podem ser
classificadas de acordo com o número de átomos
de carbono ligados diretamente a eles.
│
│
CH2 – CH3
H
1- Carbono primário:
É aquele ligado a no máximo um átomo
de carbono diretamente.
H
H
│
│
5- Classificação das cadeias carbônicas:
H―C―C―H
│
│
H
H
As cadeias carbônicas podem
classificadas segundo 3 critérios:
ser
1- Disposição
carbono:
de
I)
2- Carbono secundário:
É aquele ligado diretamente a dois
átomos de carbono.
H
│
CH3
H ― C ― C* ― H
│
H
H
3- Carbono terciário:
átomos
Cadeia aberta, acíclica ou
alifática:
Apresenta pelo menos duas
extremidades e nenhum ciclo
ou anel.
Se divide em:
│
│
dos
Normal, reta ou linear:
Apresenta apenas carbonos primários e
secundários.
│ │ │ │
-C–C–C–C–
│ │ │ │
Ramificada:
Apresenta
carbonos
secundários.
terciários
e
Está ligado a três átomos de carbono.
H
CH3
│
│
H ― C ― C* ― H
│
│
II)
Cadeia fechada ou cíclica:
Não apresenta extremidades
e os átomos apresentam um
ou mais ciclos.
109
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
2- Tipo de ligação entre os átomos de
carbono:
Se divide em:
I)
Aromática:
Apresenta
benzênico.
Química 4
pelo
menos
um
anel
Saturada:
Apresenta
somente
ligações simples entre os
átomos de carbono na
cadeia.
│
-C│ │ │ │
-C–C–C–C│
│
│
│
Anel ou núcleo benzênico é uma das
cadeias mais importantes da Química Orgânica.
Esse nome é derivado do composto mais simples
que apresenta esse núcleo, o benzeno (C6H6).
Esse anel forma os compostos aromáticos que
se subdividem em:
Compostos
aromáticos
mononucleares ou mononucleados:
contêm um único anel benzênico.
Compostos aromáticos polinucleares
ou polinucleados: contêm mais de
um anel benzênico. Pode ser:
Polinuclear isolado: quando os anéis
não contêm átomos de carbono em
comum.
E polinuclear condensado: quando
os anéis contêm átomos de carbono
em comum.
Alicíclica, não-aromática ou cicloalifática:
Não apresentam o núcleo aromático ou
anel benzênico.
II)
Insaturada:
Apresenta pelo menos
uma dupla ou tripla ligação
entre átomos de carbono na
cadeia.
│
│
│
-C–C=C=C│
│
3- Natureza dos átomos que compõe
a cadeia:
I)
Homogênea:
É constituída apenas de
átomos de carbono.
│
-C│ │ │ │
-C–C–C–C│
│
│
│
110
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
2) Um quimioterápico utilizado no tratamento
do câncer é a sarcomicina, cuja fórmula
estrutural pode ser representada por:
II)
Heterogênea:
Apresenta pelo menos um
heteroátomo na cadeia.
│
- C│ │
│ │
-C–C-O-C–C│
│
│
│
O = heteroátomo
OBS.: Heteroátomo: átomo diferente de
carbono que esteja posicionado entre dois
átomos de carbono.
Escreva sua fórmula molecular e indique o
número de carbonos secundários presentes na
estrutura.
3) Determine número de carbonos primários,
secundários, terciários e quaternários
existentes em cada uma das estruturas a
seguir e escreva suas fórmulas moleculares:
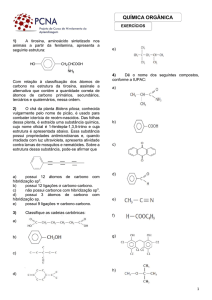
Exercícios:
1) Identifique quais são os carbonos primários,
secundários e terciários nos compostos a
seguir:
4) A cadeia abaixo é:
a) Aberta, heterogênea, saturada e normal;
b) Acíclica, homogênea, insaturada e
normal;
c) Aromática, homogênea, insaturada e
ramificada;
d) Alifática, homogênea, insaturada e
ramificada;
e) Cíclica e aromática.
5) Identifique a cadeia carbônica ramificada,
homogênea e saturada:
111
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
Prefixo: Indica o número de átomos de
carbono.
Infixo: Indica o tipo de ligação entre
carbonos.
Sufixo: Indica o grupo funcional.
Radicais
monovalentes
hidrocarbonetos:
derivados
de
6) Um grupo de compostos, denominados
ácidos graxos, constitui a mais importante
fonte de energia na dieta do Homem. Um
exemplo destes é o ácido linoleico, presente
no leite humano. A sua fórmula estrutural
simplificada é:
CH3(CH2)4(CH)2CH2(CH)2(CH2)7COOH
Sua cadeia carbônica é classificada como:
a) Aberta, normal, saturada e homogênea;
b) Aberta,
normal,
insaturada
e
heterogênea;
c) Aberta,
ramificada,
insaturada
e
heterogênea;
d) Aberta,
ramificada,
saturada
e
homogênea;
e) Aberta, normal, insaturada e homogênea.
Prefixos:
1 C: met
7 C: hept
2 C: et
8 C: oct
3 C: prop
9 C: non
4 C: but
10 C: dec
5 C: pent
11 C: undec
6 C: hex
12 C: dodec, etc.
Gabarito: 4-d; 5- b;6- e.
Capítulo 2 – Hidrocarbonetos:
São compostos formados apenas de carbono e
hidrogênio.
Fórmula geral: CXHY.
Nomenclatura:
I)
II)
Cada composto orgânico deve ter um
nome diferente.
A partir do nome deve ser possível
escrever a fórmula do composto
orgânico e vice-versa.
a) Alcanos:
São hidrocarbonetos acíclicos e saturados,
ou seja, possuem cadeias abertas e ligações
simples entre os carbonos.
As três partes do nome:
O nome dos compostos orgânicos de cadeia
normal e não-aromáticos é dividido em três
partes.
Fórmula geral: CnH2n+2.
OBS.: n = número de carbonos.
112
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
Nomenclatura: Prefixo indicativo ao número
de carbonos + an +o.
Ramificação:
Escolhe-se a cadeia principal (a maior
sequência de carbonos), entre duas ou
mais possibilidades escolhe-se a cadeia
mais ramificada;
Para numerá-los parte-se de uma das
extremidades
de
forma
que
as
ramificações possuam os menores
números;
Os radicais precedem o nome da cadeia
principal e seguem a ordem de
complexidade ou em caso de igual
complexidade, a ordem alfabética.
b) Alcenos:
Fórmula geral: CnH2n-2.
Nomenclatura: Prefixo indicativo ao
número de carbonos + in + o.
Ramificação: A nomenclatura da
alcinos ramificados é semelhante a de
alcenos ramificados.
d) Alcadienos:
São hidrocarbonetos acíclicos com
duas duplas ligações.
São hidrocarbonetos acíclicos que
possui uma única dupla ligação.
Fórmula geral: CnH2n-2.
Fórmula geral: CnH2n.
Nomenclatura: Prefixo indicativo ao
número de carbonos + en + o.
Ramificação:
A cadeia principal é a maior
sequência de carbonos que
contenha a dupla ligação;
A sua numeração começa da
extremidade mais próxima da
dupla ligação;
Os radicais devem ser colocados
em ordem de complexidade.
c) Alcinos:
Nomenclatura: Prefixo indicativo ao
número de carbonos + a + DIENO.
Ramificação:
A cadeia principal é aquela que
possui a maior sequência de
carbonos e que contenha as duas
duplas ligações;
A sua numeração começa da
extremidade mais próxima das
duas duplas ligações.
e) Ciclanos:
São hidrocarbonetos cíclicos contendo
apenas ligações simples entre os carbonos da
cadeia.
São
hidrocarbonetos
acíclicos,
contendo uma única tripla ligação.
Fórmula geral: CnH2n.
113
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
Nomenclatura: Palavra CICLO + prefixo
indicativo ao número de carbonos do ciclo + an +
o.
Ramificação:
f)
A numeração começa pelo carbono que
possui o menor radical no sentido horário
e anti-horário;
Os radicais ficam com os menores
números.
Classificação:
1) Aromáticos
mononucleares
monocíclicos:
Hidrocarbonetos que possuem
um único anel benzênico. Se divide
em:
Benzênicos
ou
com
ramificações saturadas:
Fórmula geral: CnH2n-6 com
n ≥ 6.
Com
ramificações
insaturadas (contêm ligação
dupla ou tripla).
2) Aromáticos
polinucleares
ou
policíclicos:
Ciclenos:
São hidrocarbonetos cíclicos contendo
uma ligação dupla.
Fórmula geral: CnH2n-2.
Nomenclatura: Palavra CICLO + prefixo
indicativo ao número de carbonos do ciclo + en +
o.
Hidrocarbonetos que possuem
mais de um anel benzênico.
Núcleos isolados:
Núcleos condensados:
Ramificação:
Coloca-se a dupla ligação entre os
números 1 e 2 e faz a numeração no
sentido horário e anti-horário;
Os radicais ficam com os menores
números.
g) Hidrocarbonetos aromáticos:
São hidrocarbonetos que possuem
pelo menos um anel benzênico.
ou
Nomenclatura:
Ramificação:
Citar os nomes das ramificações e
terminar com a palavra benzeno. A numeração
parte da ramificação mais simples e segue o
sentido que dê os menores números possíveis.
Exercícios:
1) Os hidrocarbonetos são os principais
constituintes do petróleo. A respeito dos
hidrocarbonetos, cujos nomes estão relacionados
a seguir:
I
– ciclopenteno
II – 2-buteno
III – propadieno
IV – hexano
V – 3 – heptino
114
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
VI – ciclobutano
Química 4
apresentam em sua constituição os elementos
químicos:
Indique a fórmula estrutural plana que se encaixa
o composto.
2) (UFSC) Um alcano encontrado nas folhas de
repolho contém em sua fórmula 64 átomos de
Hidrogênio. O número de átomos de Carbono na
fórmula é:
(A)29
(B)32
(C)30
(D)33
(E)31
a) hidrogênio, carbono e oxigênio.
b) Hidrogênio, carbono e nitrogênio.
c) Hidrogênio e carbono.
d) Hidrogênio, carbono, oxigênio e nitrogênio.
e) Hidrogênio, carbono, oxigênio, enxofre e
nitrogênio
3) Dê o nome e a fórmula molecular dos
seguintes ciclos:
6) (RRN) Um composto orgânico cuja fórmula
geral é representada por C nH2n pertence à classe
do:
a) Alceno ou cicloalceno.
b) Alcano ou cicloalcano.
a)
b)
c)
c) Alceno ou cicloparafina.
4) (FAFI-MG)
d) Alcino ou alcadieno.
e) Alcino ou aromático.
I
7) Escreva a fórmula estrutural de um
hidrocarboneto que apresenta as seguintes
características:
II
a) Possui 4 C, 1 dupla ligação e 1 ramificação.
Sobre o benzeno, C6H6, estão corretas as
seguintes afirmações, exceto:
a) Possui três pares de elétrons deslocalizados.
b) É uma molécula plana, com forma de
hexágono regular, confirmada por estudos
espectroscópicos e de cristalografia por raios X.
c) Todos os ângulos de ligação valem 120°
devido à equivalência de todas as ligações
carbono-carbono.
d) O benzeno não apresenta estrutura de
ressonância.
e) Os seis elétrons p estão espalhados
igualmente nos seis carbonos e não localizados
entre os pares de átomos de carbono
5) (OSEC-SP) Os compostos classificados como
hidrocarbonetos fazem parte de misturas que
compõem alguns combustíveis. Esses compostos
b) Possui 6 C, 2 duplas ligações e 2 ramificações.
Gabarito: 2- e; 4- d; 5- c.
Capítulo 3 – Funções Orgânicas:
Função orgânica é um conjunto de substâncias
que ap.resentam semelhanças em suas
propriedades químicas, chamadas propriedades
funcionais. Decorrido o fato de possuírem a
mesma fórmula estrutural.
O átomo ou grupo de átomos responsáveis por
essas propriedades, ou seja, que caracteriza a
fórmula estrutural é chamado grupo funcional.
a) Álcoois:
São compostos orgânicos que contêm um
ou mais grupos hidroxila (OH) ligados
diretamente a um carbono saturado.
Fórmula geral: R – OH.
115
Cursinho Pré-Universitário Popular
Nomenclatura:
I.U.P.A.C.: Prefixo indicativo ao número
de carbonos + an, en ou in + ol.
USUAL: Palavra ÁLCOOL + prefixo
indicativo ao número de carbonos + ÍLICO.
Ramificação:
A cadeia principal é a maior
sequência
de
carbonos
que
contenha o carbono ligado a
hidroxila (OH);
A
numeração
começa
pela
extremidade mais próxima a hidroxila
(OH).
Exemplo:
Prof.: Maria Patrícia
Química 4
Os álcoois podem ser classificados
segundo alguns critérios:
1 – número de hidroxilas:
Monoálcool ou monol: possui uma
hidroxila.
Diálcool ou diol: possui duas
hidroxilas.
Triálcool ou triol: possui três
hidroxilas. E assim por diante.
2 – Posição da hidroxila:
Álcool primário: hidroxila ligada a
carbono primário.
Álcool secundário: hidroxila ligada a
carbono secundário.
Álcool terciário: hidroxila ligada a
carbono terciário.
b) Fenóis:
São compostos orgânicos que possuem
a hidroxila (OH) ligada diretamente ao anel
aromático.
Obs.:Quando um álcool apresentar
mais do que dois átomos de carbono, indicamos a
posição do OH numerando a cadeia a partir da
extremidade mais próxima do carbono que
contém a hidroxila.
Fórmula geral: Ar – OH.
Nomenclatura: Palavra HIDROXI + nome
do aromático correspondente.
Ramificação:
A numeração começa pela hidroxila
no sentido em que os radicais fiquem
com os menores números.
Exemplo:
Obs.: Os alcoóis são constituídos por
radicais de hidrocarbonetos ligados a uma ou
mais hidroxilas. Entretanto, nunca podem ser
considerados bases de Arrhenius (pois não
liberam essa hidroxila em meio aquoso).
Classificação:
116
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
A numeração começa por esse
grupo de forma que os radicais
fiquem com os menores números.
Exemplo:
c) Éteres:
São compostos em que o oxigênio está
posicionado entre dois carbonos.
Fórmula geral: R – O – R1.
Nomenclatura:
I.U.P.A.C.: Prefixo indicativo ao menor
número de carbonos + OXI + nome do
hidrocarboneto correspondente ao maior número
de carbonos.
USUAL: Palavra ÉTER + nome do menor
grupo + nome do maior grupo + ICO.
Exemplo:
e) Cetonas:
São compostos que possuem o grupo
funcional ou – CO – entre carbonos.
Fórmula geral: R – CO – R1.
Nomenclatura:
d) Aldeídos:
São compostos orgânicos que apresentam
o grupo carbonilo.
I.U.P.A.C.: Prefixo indicativo ao número
de carbonos + an ou en + ona.
USUAL: Nome do menor radical + nome
do maior radical + CETONA.
Grupo carbonilo:
Ramificação: Semelhante a nomenclatura
de aldeídos, substituindo o grupo – CHO
pelo grupo – CO - .
ou – CHO.
Fórmula geral: R – CHO.
Nomenclatura: Prefixo indicativo
número de carbonos + an ou en + al.
Exemplo:
ao
Ramificação:
A cadeia principal é a maior
sequência de carbonos que possui o
carbono com o grupo – CHO.
117
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
g) Ésteres:
São compostos orgânicos derivados de
ácidos carboxílicos pela substituição do
hidrogênio do grupo OH por um radical
orgânico (R).
f)
Ácidos carboxílicos:
São compostos que possuem o grupo
carboxila.
Grupo carboxila:
Fórmula geral:
ou - COOH.
Fórmula geral: R – COOH.
Nomenclatura: Palavra ÁCIDO + prefixo
indicativo ao número de carbonos + an, en, ou in
+ ÓICO.
Nomenclatura:
Nome
do
ácido
carboxílico – ICO + ATO + DE + nome do
radical com terminação A.
Exemplo:
Ramificação: Semelhante a dos aldeídos
ramificados.
Exemplo:
Flavorizantes são substâncias que
apresentam sabor e aroma característicos,
geralmente agradáveis. Muitos flavorizantes
pertencem à função éster. Segue abaixo de 2
ésteres empregados como essências em vários
produtos alimentícios. Exemplos:
118
Cursinho Pré-Universitário Popular
h) Aminas:
São compostos derivados da amônia
(NH3) pela substituição de um, dois ou três
hidrogênios por radicais.
Fórmula geral:
Prof.: Maria Patrícia
Química 4
Exercícios:
1) (Univ). S. Judas Tadeu - (SP) O manitol é
um tipo de açúcar utilizado na fabricação
de condensadores de eletrólitos secos,
que
são
utilizados
em
rádios,
videocassetes e televisores; por isso, em
tais aparelhos, podem aparecer alguns
insetos, principalmente formigas. Se a
fórmula estrutural é:
Exemplos:
Qual o nome oficial desse açúcar?
(A) Hexanol
(B) Hexanol-1,6
(C) 1,2,3-Hexanotriol
Nomenclatura: Nome dos radicais em
ordem de complexidade + AMINA.
(D) 1,2,3,4-tetra-Hidróxi-Hexano
(E) 1,2,3,4,5,6-Hexanohexol
i)
Amidas:
Compostos com o grupo funcional:
Nomenclatura: Nome do hidrocarboneto
que lhe deu origem – óico + AMIDA.
Exemplos:
2) A fórmula abaixo se refere a um composto que
pertence à função:
a) cetona
b) aldeído
c) ácido
d) éster
e) éter.
3) (PUCRS/1-2000) 9) Considerando a estrutura
do ácido salicílico, usado na preparação do
salicilato de sódio, analgésico e antipirético,
selecione a alternativa que apresenta as palavras
119
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
que completam corretamente as lacunas no texto
a seguir.
O ácido salicílico pode ser considerado uma
molécula de ________ com um grupo
________.
funções orgânicas I e II, circuladas na estrutura
do citrato de sildenafil, são
(A) cetona e amina.
(B) cetona e amida.
(C) éter e amina.
A) aldeído fenólico
(D) éter e amida.
B) cetona carbonila
(E) éster e amida.
C) fenol carboxila
D) álcool
E) éster
4) (PUCRS/2-2001) A cerveja é fabricada a partir
dos grãos de cevada. Seu sabor amargo deve-se
à adição das folhas de lúpulo, que contêm uma
substância chamada mirceno, de fórmula
6) O aspartame, estrutura representada a seguir, é
uma substância que tem sabor doce ao paladar.
Pequenas quantidades dessa substância são
suficientes para causar a doçura aos alimentos
preparados, já que esta é cerca de duzentas
vezes mais doce do que a sacarose.
Essa substância pode ser classificada como
A) álcool.
B) ácido carboxílico.
As funções orgânicas presentes na molécula
desse adoçante são, apenas,
C) aminoácido.
(A) éter, amida, amina e cetona.
D) hidrocarboneto.
(B) éter, amida, amina e ácido carboxílico.
E) aldeído.
(C) aldeído, amida, amina e ácido carboxílico.
5) Em 1998, o lançamento de um remédio para
disfunção erétil causou revolução no tratamento
para impotência. O medicamento em questão era
o Viagra®. O princípio ativo dessa droga é o
(D) éster, amida, amina e cetona.
A aspoxicilina, abaixo representada, é uma citrato
de sildenafil, cuja estrutura é representada na
figura:
(E) éster, amida, amina e ácido carboxílico.
7) substância utilizada no tratamento de infecções
bacterianas. As funções 1, 2, 3 e 4 marcadas na
estrutura são, respectivamente:
120
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
As funções orgânicas, presentes na fórmula estrutural
do ácido mencionado, são:
(A) cetona e álcool
(A) amida, fenol, amina, ácido carboxílico.
(B) amida, amina, álcool, éster.
(C) amina, fenol, amida, aldeído.
(D) amina, álcool, nitrila, ácido carboxílico.
(E) amida, nitrila, fenol, éster.
(B) álcool e aldeído
(C) ácido carboxílico e álcool
(D) ácido carboxílico e aldeído
(E) cetona e éster
10) Observe a estrutura da muscona:
8) O composto antibacteriano ácido oxalínico é
representado pela fórmula estrutural:
e apresenta as seguintes funções:
(A) éster, cetona, amina e éter
(B) éter, cetona, amina e ácido carboxílico
(C) éster, amida, amina e ácido carboxílico
(D) éster, amina, fenol e cetona
(E) éter, amida, éster e amina
9) Os xampus, muito utilizados para limpar e
embelezar os cabelos, de modo geral, contêm em
sua constituição, no mínimo, as seguintes
substâncias: detergente, corante, bactericida,
essência e ácido cítrico (regula o pH).
Esta substância é utilizada em indústrias
farmacêuticas, alimentícias e cosméticas, tendo
sua maior aplicação em perfumaria. É o princípio
ativo de uma secreção glandular externa produzida
por uma espécie de veado que habita a Ásia Central:
os almiscareiros .
Os machos dessa espécie produzem a muscona
(almíscar), com a finalidade de atrair as fêmeas na
época do acasalamento. Em perfumaria, a sua
principal aplicação é como fixador de essências.
Marque a alternativa que corresponde à função
orgânica que caracteriza a muscona:
(A) Ácido carboxílico
(B) Aldeído
(C) Cetona
(D) Éter
(E) Fenol
11) O acebutolol pertence a uma classe de fármacos
utilizada no tratamento da hipertensão. Estão
121
Cursinho Pré-Universitário Popular
presentes na estrutura do acebutolol as seguintes
funções:
Prof.: Maria Patrícia
Química 4
Capítulo 4 – Isomeria:
Isômeros são dois ou mais compostos de
mesma fórmula molecular mas diferentes
fórmulas estruturais.
O fenômeno da isomeria causa diferença nas
propriedades dos compostos isômeros.
A isomeria pode ser dividida em isomeria
plana e espacial.
a) Isomeria Plana:
(A) éster, álcool, amina, amida, alqueno.
(B) amida, alqueno, álcool, amina, fenol.
(C) amina, fenol, aldeído, éter, álcool.
(D) cetona, álcool, amida, amina, alqueno.
(E) amida, cetona, éter, álcool, amina.
12) Associe os nomes comerciais de alguns
compostos orgânicos e suas fórmulas condensadas
na coluna de cima com os nomes oficiais na coluna
de baixo.
Ocorre quando os isômeros podem
ser
diferenciados
pelas
fórmulas
estruturais planas.
São cinco os casos mais comuns.
1) Isomeria de cadeia ou núcleo: Os
isômeros pertencem a mesma
função, mas possuem cadeias
carbônicas diferentes.
I. Formol (CH2O)
II. Acetileno
III. Vinagre (CH3 – COOH)
IV. Glicerina (CH2OH – CHOH – CH2OH)
(P) Propanotriol
(Q) Ácido etanóico
2) Isomeria de posição: Os isômeros
pertencem à mesma função química,
possuem a mesma cadeia carbônica,
mas diferem pela posição de uma
ramificação ou instauração.
(R) Metanal
(S) Fenil amina
(T) Etino
A associação correta entre as duas colunas é
(A) I-P, II-T, II-Q, IV-R
(B) I-Q, II-R, II-T, IV-P
(C) I-Q, II-T, III-P, IV-R
(D) I-R, II-T, III-Q, IV-P
(E) I-S, II-R, III-P, IV-Q
3) Isomeria
de
compensação
ou
metameria: Os isômeros pertencem a
mesma função química, possuem a
mesma cadeia carbônica, mas
diferem pela posição de um
Gabarito: 1- e; 2- e; 3- c; 4- d; 5- c; 6- e; 7- a; 8b; 9- c; 10- c; 11- e; 12- d.
122
Cursinho Pré-Universitário Popular
heteroátomo
Prof.: Maria Patrícia
Química 4
Se divide em geométrica e óptica.
1) Isomeria geométrica ou cis-trans:
Ocorre em dois casos.
1.1) Em compostos com ligações
duplas:
1.2) Em compostos cíclicos:
4) Isomeria de função: Os isômeros
pertencem a funções químicas
diferentes.
2) Isomeria óptica:
5) Tautomeria: É um caso particular da
isomeria funcional. Os dois isômeros
ficam em equilíbrio químico dinâmico.
Os casos mais comuns ocorrem
entre:
Aldeído e enol:
Cetona e enol:
Todos os isômeros possuem propriedades
físicas diferentes, tais como PF, PE e densidade,
mas os isômeros ópticos não possuem esta
diferença, ou seja, as propriedades físicas dos
isômeros ópticos são as mesmas. Então o que
faz eles serem diferentes? É possível diferenciálos? Sim, é possível diferenciá-los, mas quando
eles estão frente à luz polarizada. Luz polarizada
é um conjunto de ondas eletromagnéticas que se
propagam em apenas uma direção. Uma lâmpada
incandescente é um exemplo de fonte de luz não
polarizada, pois a luz é emitida em todas as
direções. É possível polarizar luz não polarizada,
bastando utilizar um polarizador, que terá função
de direcionar apenas uma direção da luz.
b) Isomeria Espacial:
Também chamada de estereoisomeria,
ocorre quando as diferenças entre os isômeros só
podem ser explicadas pelas fórmulas estruturais
espaciais. (As fórmulas estruturais planas são as
mesmas).
123
Cursinho Pré-Universitário Popular
Esta seta de duas pontas significa a
propagação da onda eletromagnética (luz
polarizada) vista de frente.
Isômeros
ópticos:
Enantiômeros:
Os
isômeros ópticos são capazes de desviar a luz
polarizada. Caso o isômero óptico provoque um
giro da luz polarizada para a direita, o
enantiômero é denominado dextrógiro (d, +).
Caso o enantiômero provoque o giro da luz
polarizada para a esquerda, o composto é
chamado levógiro (l, -). É necessário atenção pois
os enantiômeros não são superponíveis, assim
como o levógiro não se superpõe ao dextrógiro. O
fato de um composto provocar o giro da luz
polarizada, faz com que ele possua atividade
óptica. Atividade óptica só é possível em
moléculas assimétricas, ou seja, moléculas que
possuem carbono quiral (ou estereocentro).
Prof.: Maria Patrícia
Química 4
Temos que o isômero dextrógiro desviará o
plano da luz de +a, enquanto o isômero levógiro
desviará o plano daluz de –a. Temos ainda a
mistura racêmica (d + l = +a-a= 0) que é
opticamente inativa.
2.2) Isomeria com 2 carbonos assimétricos iguais:
2.3)
Isomeria com 2 carbonos assimétricos
diferentes:
2.1) Isomeria óptica com 1 carbono
assimétrico ou quiral:
Obs.:
Van’t Hoff formula que moléculas com n
n
carbonos assimétricos possuem 2
n
isômeros dextrógiros e 2 isômeros
n-1
levógiros. E ainda, 2
misturas
racêmicas.
Compostos
enantioméricos,
um
é
imagem especular do outro, ou seja, um é
imagem refletida do outro. No entanto,
eles não são superponíveis. Um exemplo
disso, são as mãos, direita e esquerda.
Uma é a imagem da outra, mas não são
superponíveis. Tente verificar este fato
com suas mãos, coloque uma na frente
da outra. (Uma será imagem da outra).
124
Cursinho Pré-Universitário Popular
Agora tente colocar umasobre a outra.
(As mãos não são superponíveis, ou seja,
os dedos polegares não ficam um sobre o
outro). Considere isto como um exemplo
para entender o fato da assimetria
molecular.
Mistura racêmica é uma mistura de
isômeros ópticos, ou seja, é uma mistura
de 50% de levógiro e de 50% de
dextrógiro.
Prof.: Maria Patrícia
Química 4
Os terpenos são o resultado da união de duas ou
mais unidades do isopreno, como se pode ver a
seguir:
Exercícios:
Em relação ao isopreno, podemos afirmar que
1) A respeito dos seguintes compostos,
pode-se afirmar que
(A) a nomenclatura do isopreno, segundo a
IUPAC, é 2-metil-1-buteno.
(B) o
isopreno
insaturados.
não
apresenta
carbonos
(C) o isopreno é isômero de cadeia do 4-metil-2pentino.
(A) são isômeros de posição.
(B) são metâmeros.
(C) são isômeros funcionais.
(D) ambos são ácidos carboxílicos.
(E) o composto I é um ácido carboxílico, e o
composto II é um éter.
2) As substâncias A, B e C têm a mesma
fórmula molecular (C3H8O). O componente A tem
apenas um hidrogênio ligado a um carbono
secundário e é isômero de posição de C. Tanto A
quanto C são isômeros de função de B. As
substâncias A, B e C são, respectivamente,
(A) 1-propanol, 2-propanol e metoxietano.
(B) etoxietano, 2-propanol e metoxietano.
(C) isopropanol, 1-propanol e metoxietano.
(D) metoxietano, isopropanol e 1-propanol.
(E) 2-propanol, metoxietano e 1-propanol.
3)
O odor de muitos vegetais, como o
louro, a cânfora, o cedro, a losna, e a
cor de outros, como a cenoura e o
tomate, são devidos à presença de
terpenoides (terpenos).
(D) segundo a IUPAC (União Internacional de
Química Pura e Aplicada), a nomenclatura do
isopreno é 2-metil-1,3-butadieno.
(E) o isopreno pode apresentar isômeros de
cadeia, funcionais e tautômeros.
4) O butanoato de etila é um líquido incolor,
empregado como essência artificial em algumas
frutas, como, por exemplo, o abacaxi e a banana,
sendo isômero do ácido hexanoico. O tipo de
isomeria plana presente entre o butanoato de etila
e o ácido hexanoico é de
(A) cadeia.
(B) posição.
(C) função.
(D) metameria.
(E) tautomeria.
5) Com a fórmula molecular C7H8O existem vários
compostos aromáticos, como, por exemplo,
Considerando os compostos acima, afirma-se
que:
I. "X" pertence à função química éter.
125
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
II. "Y" apresenta cadeia carbônica heterogênea.
(A) I e II; posição
III. "Z" apresenta isômeros de posição.
(B) I e III; cadeia
IV. "X", "Y" e "Z" apresentam em comum o grupo
benzila.
(C) II e III; função
Pela análise das afirmativas, conclui-se que
somente estão corretas
(A) I e II
Química 4
(D) II e IV; cadeia
(E) I, III e IV; cadeia
8) Em uma aula de química orgânica, o professor
escreveu no quadro a fórmula C4H8O e perguntou
a quatro alunos que composto tal fórmula poderia
representar. As respostas foram
(B) I e III
(C) II e IV
(D) I, III e IV
(E) II, III e IV
6) Assinale a alternativa que relaciona corretamente
o par de isômeros dados com o tipo de isomeria
que apresenta.
O professor considerou certas as respostas
dadas pelos alunos
(A) 1 e 2
(B) 1 e 3
(C) 2 e 4
(D) 3 e 4
(E) 1, 2 e 3
9) Para responder à questão, analise as afirmativas
a seguir.
7) Considerando os compostos
numerados de I a IV
orgânicos
I. Propanal é um isômero do ácido propanoico.
II. Ácido propanoico é um isômero do etanoato de
metila.
III. Etil-metil-éter é um isômero do 2-propanol.
IV. Propanal é um isômero do 1-propanol.
Pela análise das afirmativas, conclui-se que
somente estão corretas
(A) I e III
(B) II e III
(C) II e IV
NÃO é correto afirmar que _________ são
isômeros de __________.
(D) I, II e III
126
Cursinho Pré-Universitário Popular
(E) II, III e IV
10) A proteína do leite apresenta uma composição
variada em aminoácidos essenciais, isto é,
aminoácidos que o organismo necessita na sua
dieta, por não ter capacidade de sintetizar a partir
de outras estruturas orgânicas. A tabela a seguir
apresenta a composição em aminoácidos
essenciais no leite de vaca.
Dos aminoácidos relacionados, podemos afirmar
que
(A) isoleucina e valina são isômeros de cadeia e,
por apresentarem carbono assimétrico ambos são
opticamente ativos.
(B) leucina e isoleucina são isômeros de posição
e, por terem carbono assimétrico, apresentam
isomeria óptica.
(C) leucina e valina são isômeros de função e, por
apresentarem carbono assimétrico, ambos têm
um par de enantiomeros.
Prof.: Maria Patrícia
Química 4
os alcoóis. As principais bases orgânicas são as
aminas.
a) Ácidos carboxílicos: São ácidos de
Arrhenius, e ao se dissolverem em água
ionizam-se, formando íons carboxilato.
Os ácidos orgânicos são ácidos fracos, ou
seja, apresentam pequeno grau de ionização.É
interessante notar que o efeito indutivo pode
facilitar ou dificultar a ionização do ácido,
tornando-o
mais
forte
ou
mais
fraco,
respectivamente. Os grupos elétron-repelentes
ligados
à
carboxila
empurram
elétrons,
aumentando a densidade eletrônica do oxigênio
da hidroxila. Isto favorece a manutenção da
ligação elétron do hidrogênio (situação que ocorre
+
na ionização). Assim a formação do H é
dificultada e a força do átomo diminui. Os grupos
elétron-atraentes retiram elétrons da carboxila,
diminuindo a densidade eletrônica do oxigênio da
hidroxila. Isso dificulta a manutenção da ligação
O-H, tornando-a mais fraca, porque o oxigênio
precisa retirar o elétron do hidrogênio. A força do
ácido aumenta. Podemos ainda, analisar a
natureza, a posição e a quantidade desses
substituintes.O-H, tornando-a mais forte, porque o
oxigênio não precisa retirar o elétron do
hidrogênio. A força do ácido aumenta. Podemos
ainda, analisar a natureza, a posição e a
quantidade desses substituintes.
(D) leucina e isoleucina são isômeros de função e
não são opticamente ativos.
(E) valina e isoleucina são isômeros de cadeia,
porém somente a valina é opticamente ativa.
Gabarito: 1- c; 2- e; 3- d; 4- c; 5- b; 6- c; 7- c; 8- b;
9- b; 10- b.
Os grupos CH3 e CH2CH3 são elétronrepelentes. O ácido metanóico é mais forte que o
etanóico; este é mais forte que o propanóico e
assim por diante.
Capítulo 5 – Ácidos e bases orgânicos:
Os ácidos e as bases constituem duas
classes muito importantes e compostos químicos,
inclusive porque reagem facilmente entre si. Na
química orgânica existem várias funções com
caráter ácido mais ou menos acentuados; as
principais são os ácidos carboxílicos, os fenóis e
127
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
Como qualquer efeito elétrico, o efeito
indutivo diminui com o aumento da distância. O
ácido 4-cloro-butanóico é o mais fraco da série.
Quanto mais afastado do grupo substituinte,
menor a influência sobre a acidez. Os efeitos são
aditivos, quanto maior a quantidade de grupos
substituintes, mais forte a influência sobre a
acidez.
b) Fenóis: Também
Arrhenius.
são
ácidos
de
Como o grupo alquila apresenta efeito
indutivo positivo, que diminui a acidez, podemos
dizer que:
Ál.3º<Ál.2º<Ál.1º<Metanol
d) Aminas: São bases de Lewis, pois
Da mesma forma que nos ácidos
carboxílicos, o efeito indutivo pode aumentar ou
diminuir a força ácida.
Obs.: Efeito indutivo negativo (I-) ⇒
atração de elétrons em uma ligação sigma.
Diminui a densidade eletrônica da cadeia.Os
principais átomos e grupos que promovem esse
efeito nas moléculas orgânicas são , em ordem
decrescente de intensidade:
-F > -Cl > -Br > -I > -OR > -NH2
Os principais grupos que promovem efeito
indutivo positivo são os grupos alquilas.
Obs:
●
A intensidade do efeito indutivo diminui ao
longo da cadeia, à medida que aumenta a
distância do átomo do átomo que o provoca.
c) Alcoóis: São compostos anfóteros.
Quanto maior a polarização da ligação COH na direção de OH, maior a capacidade de
-.
formar OH Quanto maior a quantidade de
radicais ligados ao carbono do grupo funcional,
maior a sua densidade eletrônica, maior a
polarização da ligação C-OH sobre a hidroxila.
apresentam um par de elétrons não
compartilhado no átomo de Nitrogênio.
As condições que enriquecem o
nitrogênio em elétrons provocam um
aumento de basicidade. Como os
grupos alquila têm exatamente esse
efeito, notamos que as aminas primárias
são bases mais fortes que a amônia. As
aminas secundárias apresentam dois
grupos R doadores de elétrons e, por
isso, são bases mais fortes que as
aminas primárias. As aminas terciárias
possuem três grupos R, o que poderia
nos levar a concluir serem estas as mais
básicas. Isto porém não ocorre. A
existência de três grupos alquila R,
muito maiores que o hidrogênio, em
volta do nitrogênio, deixa “pouco
espaço” livre para aproximação de um
ácido de Lewis e formação de ligação
dativa característica. Este fenômeno é
conhecido pelo nome de impedimento
espacial ou impedimento estérico.
Assim, para aminas alifáticas temos:
Am.3ª<Amônia<Am.1ª<Am.2ª
As aminas aromáticas são bases
fraquíssimas (ainda mais fracas que as aminas
alifáticas terciárias). Como sabemos, o par de
elétrons não compartilhado do nitrogênio é o
responsável pela basicidade.
Capítulo 6 – Reações Orgânicas:
Cisão ou ruptura das ligações: Uma
ligação covalente sempre é formada por um par
de elétrons. Se essa ligação for desfeita, esses
elétrons podem apresentar destinos diferentes,
128
Cursinho Pré-Universitário Popular
dependendo dos elementos que se ligam e de
agentes como calor, luz, solventes, etc.
Cisão homolítica ou homólise: A
ruptura ocorre de modo que os elétrons
da ligação são igualmente repartidos
entre os átomos ligantes. Os resultantes
de uma homólise denominam-se radicais
livres. Esses radicais têm carga elétrica
nula e, por apresentarem elétron
desemparelhado, são muito instáveis e
reativos.
Cisão heterolítica ou heterólise: A
ruptura ocorre de modo que os elétrons
da ligação ficam com apenas um dos
átomos ligantes. Os resultantes de uma
heterólise são cátions e ânions. Esses
íons formados podem ser estáveis ou
muito instáveis, sendo que maior
instabilidade significa maior capacidade
de reação.
Prof.: Maria Patrícia
a) Reações de substituição:
Um átomo ou grupo de átomos de
uma molécula orgânica é substituído por
outro átomo ou grupo de átomos.
1) Alcanos:
Os
alcanos
possuem
baixa
tendência de reagir, mas sob
condições vigororsas (luz e calor),
eles sofrem reações de substituição.
Ordem de reatividade:
F2 > Cl2 > Br2 > I2
Os halogênios utilizados nas
reações de substituição devem ser o
cloro (Cl) e o bromo (Br). Reações
com flúor (F) são muito perigosas
devido a alta reatividade deste
elemento e com o iodo (I) as reçoes
tornam-se muito lentas.
Os reagentes que se combinam com os
compostos orgânicos podem ser classificados
como eletrofílicos ou nucleofílicos, conforme sua
capacidade de utilizar ou fornecer elétrons para o
reagente orgânico.
Reagente Eletrófilo: É um reagente que
se apresenta com deficiência de elétrons
e que, por isso, procura ligar-se a um
átomo capaz de oferecer-lhe elétrons. O
reagente eletrófilo é um reagente que
procura elétrons.
Neste processo, um hidrogênio (H)
é substituído por um halogênio.
CH4 + Cl2 → CH3 – Cl + HCl
CH3 – CH3 + Br2 →CH3 – CH2 – Br +
HBr
O composto orgânico que recebe o
reagente é normalmente denominado substrato
(S). Quando um reagente eletrófilo combina-se
com um substrato, temos uma reação eletrofílica.
Reagente nucleófilo: É um reagente que
apresenta um par de elétrons disponível
para efetuar uma ligação e que, por isso,
procura ligar-se a um átomo capaz de
aceitar esses elétrons. O reagente
nucleofílico é um reagente que cede
elétrons.
Existem na natureza milhões de
substâncias orgânicas. A quantidade de reações
químicas que podem ocorrer com estas
substâncias é enorme.
Halogenação:
É a reação entre um alcano e um
halogênio.
Classificação dos reagentes:
Química 4
Nitração:
Reação entre um alcano e o ácido
nítrico (HNO3).
Neste processo, um hidrogênio (H)
é substituído por um grupo – NO2.
CH4 +HO – NO2 → H3C – NO2 + HOH
Sulfonação:
É a reação entre um alcano e o ácido
sulfúrico (H2SO4).
CH4 + HO – SO3H → H3C – SO3H + HOH
Facilidade de substituição:
Cterciário > Csecundário > Cprimário
129
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Também podemos chamar esta reação de
reação de Sabatier-Senderens.
2) Aromáticos:
Na indústria química de alimentos é muito
conhecida. Serve de base para a produção de
margarinas a partir de óleos vegetais.
Halogenação:
É catalisada por AlCl3 ou FeBr3.
Os óleos vegetais possuem ligações
duplas. A reação de adição, hidrogenação
catalítica, transforma esses óleos, que são
líquidos em gorduras, que é sólida.
Nitração:
É catalisada por H2SO4 concentrado.
Sulfonação:
Alceno:
É catalisada por H2SO4 fumegante, ou
seja contem SO3 dissolvido.
Um hidrogênio é substituído por um grupo
Alquilação de Friedel-Crafts:
Um hidrogênio é substituído por um grupo
A alquilação e a acilação de Friadel-Crafts
foram descobertas em 1877 pelo francês Charles
Friedel e pelo americano James Crafts. E nos
dois casos, o AlCl3 são usados como
catalisadores.
Dirigência
aromáticos:
da
HC ≡ CH + H – H → H2C = CH2 (proporção de
1:1)
H2C = CH2 + H – H → H3C – CH3 (proporção de
1:2)
alquila.
H2C = CH2 + H – H → H3C – CH3
Alcino: Pode sofrer uma ou duas ligações,
dependendo da quantidade de reagente.
Acilação de Friedel-Crafts:
acila.
substituição
Halogenação:
Adição de halogênio (Cl2 ou Br2) ao alceno,
alcadieno ou alcino.
Alceno:
H2C = CH2 + Cl – Cl → H2C - CH2
nos
Alguns grupos ligados ao anel aromático
dirigem a substituição para que o produto
formado seja uma mistura dos isômeros orto e
para ou para a produção de um produto na
posição meta.
Ocorrem quando um átomo proveniente de
uma substância orgânica ou inorgânica se
adiciona à uma substância orgânica.
São caracterizadas
ligações duplas e triplas.
pela
quebra
das
Hidrogenação catalítica:
Ocorre em alcenos e alcinos. O gás
hidrogênio (H2) é adicionado com a ajuda de um
catalisador. Pode ser usado o metal níquel (Ni) ou
platina (Pt).
│
│
Cl
Cl
Alcino:
HC ≡ CH + Br – Br → HC = CH
b) Reações de adição:
Química 4
│
│
Br
Br
Segue os mesmos moldes da hidrogenação
catalítica.
Alcadieno:
H2C = C = CH2 + Cl – Cl → H2C - C = CH2
│
│
Cl Cl
130
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Cl Cl
Química 4
o produto formado um enol, que por ser instável
se transforma em aldeído ou cetona.
│ │
HC ≡ CH + H – OH → HC = CH
H2C = C = CH2 + 2 Cl – Cl → H2C - C - CH2
│
│
│
│
H
OH
Cl Cl
Regra de Markovnikov:
Adição de haletos de hidrogênio (HX):
Adição de HCl, HBr ou HI. Os
+
próprios íons H liberados pelo haleto de
hidrogênio
são
usados
como
catalisadores.
”Nas reações de adição, o hidrogênio é
adicionado ao carbono mais hidrogenado da
ligação dupla.”
Alcenos:
Esta regra serve somente para o cloro. ``Para
o bromo, serve a regra Antimarkovnikov, que é o
inverso da Markovnikov.
H2C = CH2 + H – Cl → H2C - CH2
Markovnikov:
│
H
H3C – CH = CH2 + H – Cl → H3C – CH - CH2
│
Cl
Alcinos:
│
H
Cl
H2C = C = CH2 + H – Cl → H2C - C = CH2
H
│
│
│
H
Br
Esta regra também é válida para alcinos.
c) Reações de eliminação:
São as reações onde alguns átomos
ou grupo de átomos são eliminados da
molécula orgânica.
H Cl
Cl
H3C – CH = CH2 + H – Br → H3C – CH - CH2
Alcadienos:
│
│
Antimarkovnikov:
HC ≡ CH + H – Cl → HC = CH
│
│
Adição de água:
É o inverso das reações de adição.
Têm grande importância para a indústria
química, na produção de polietileno que é
a matéria-prima para a obtenção de
plásticos.
Também chamada de hidratação. Esta
+
reação é catalisada por ácido (H ).
Alceno:
H2C = CH2 + H – OH→ H2C - CH2
│
H
│
OH
Alcino:
Não acontece a segunda adição, nem mesmo
utilizando excesso de água. Devido o fato de ser
Eliminação
de
Desidrogenação
Hidrogênio
ou
A partir de alcano é possível obter um
alceno, catalisado por calor.
Exemplo:
131
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
1 molécula álcool = desidratação intramolecular =
alceno
2 moléculas álcool = desidratação intermolecular
= éter
Eliminação de
Halogenação
Halogênio
ou
De-
Di-haletos vicinais regindo com zinco
catalisado por um álcool formam alcenos.
A Reação de saponificação também é
conhecida como hidrólise alcalina, através dela é
que se torna possível o feitio do sabão. Falando
quimicamente, seria a mistura de um éster
(proveniente de um ácido graxo) e uma base
(hidróxido de sódio) para se obter sabão (sal
orgânico).
Exemplo:
A equação abaixo demonstra este processo:
Éster + base forte → sabão + glicerol
Praticamente todos os ésteres são retirados
de óleos e gorduras, daí o porquê das donas de
casa usarem o óleo comestível para o feitio do
sabão
caseiro.
Eliminação de Halogenidretos
Equação
genérica
da
hidrólise
alcalina:
Halogenidretos, como HCl, HBr e HI
podem ser eliminados a partir de um haleto de
alquila, catalisado por uma base, que pode ser o
KOH e um álcool.
Exemplo:
Eliminação de Água
A desidratação intramolecular de álcool
catalisada por ácido sulfúrico concentrado e calor
(170°C) ocorre com a eliminação de água e
alceno.
A equação acima representa a hidrólise
alcalina de um óleo (glicerídeo). Dizemos que é
uma hidrólise em razão da presença de água
(H2O) e que é alcalina pela presença da base
NaOH (soda cáustica). O símbolo ∆ indica que
houve aquecimento durante o processo. Produtos
da reação de Saponificação: sabão e glicerol
(álcool).
Reação
de
esterificação
A reação de esterificação é considerada uma
reação reversível de álcool junto com um ácido
orgânico ou inorgânico, produzindo éster e água.
Já quando areação é inversa, ela é denominada
hidrólise do éster.
Outra desidratação que pode ocorrer é a
intermolecular de dois álcoois formando éter e
eliminando água. A reação deve ser catalisada
por ácido sulfúrico concentrado e calor (140°C).
Então:
O equilíbrio pode ser deslocado para o
lado do éster, quando se ajunta com o
desidratante. Durante o experimento ficou
comprovado que na reação de esterificação o
oxigênio do grupo OH do álcool continua na
132
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
molécula do éster e o oxigênio do grupo OH do
ácido é eliminado sob a forma de H2O (água),
produzindo a reação de um álcool marcado:
Química 4
Oxidação energética de alcenos:
Reação com um agente oxidante que
seja capaz de quebrar a molécula na
ligação dupla.
Ligação dupla no meio da cadeia:
H3C – C = CH – CH3 → H3C – C = O
│
Com ácido, observa-se a forma do éster
marcado, e não água, contendo assim O – 18.
│
CH3
CH3
+ O = C – CH3
│
OH
Para acelerar a reação, usa-se o ácido como
catalisador.
Forma-se ácido carboxílico e cetona.
Ligação dupla na ponta da cadeia:
H3C – H2C – CH = CH2 → H3C – H2C – CH =O
│
OH
+ O = C – OH → CO2 + H2O
│
Há basicamente dois tipos de hidrólise de
ésteres: ácida e básica.
A hidrólise ácida ocorre em meio ácido e é
um processo reversível, gerando um álcool e um
ácido carboxílico:
R-COO-R1 + HOH
R-COOH + HO-R1
A hidrólise básica, ou saponificação, é
realizada em meio básico. Trata-se de um
processo irreversível, gerando álcool e um sal de
ácido carboxílico:
-
OH
Forma-se ácido carboxílico e o CH2 se
transforma em ácido carbônico que é instável e
por sua vez se transforma em CO2 + H2O.
Oxidação branda do alceno:
O agente oxidante causa uma adição a
ligação dupla, há entrada de uma hidroxila em
cada um dos carbonos da dupla ligação.
OH OH
│
+
│
R-COO-R1 + BOH(aq) → R-COO B + HO-R1
H3C – C = CH – CH3 → H3C – C – CH – CH3
Onde BOH é uma base, por exemplo, KOH
│
d) Reações de oxidação:
As reações de oxidação
substâncias
orgânicas
devem
catalisadas por um agente oxidante.
│
CH3
das
ser
CH3
Ozonólise:
Há quebre da ligação dupla causada pelo
ozônio (O3). Necessita de pó de zinco e deve ser
133
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
feita em meio aquoso. Um átomo de hidrogênio é
adicionado a cada lado da dupla ligação.
Química 4
Exercícios:
1) Das ligações abaixo, qual terá maior tendência
a sofrer ruptura heterolítica?
a) CH3 – H.
H3C – C = CH – CH3 → → H3C – C = O
│
CH3
b) CH3 – CH3.
│
c) CH3 – NO2.
CH3
d) CH3 – NH2.
+ + O = C – CH3 + H2O2
e) CH3 – F.
│
2) Indique,
eletrofílico:
entre
os
reagentes
abaixo,
o
H
a) NH3.
Forma-se cetona e aldeído.
b) HCN.
Oxidação de álcoois primários:
+
c) H3O .
Os álcoois primários se oxidam com
agentes
oxidantes
energéticos,
como
o
permanganato de potássio e o dicromato de
potássio, em meio sulfúrico. O produto desta
oxidação é um aldeído. Com mais quantidade de
agente oxidante, obtemos um ácido carboxílico.
Esta reação explica porque o vinho
fica com gosto de vinagre quando deixamos
muito tempo em contato com o ar (oxigênio). O
álcool sofre uma oxidação e transforma-se em
vinagre, que é um ácido carboxílico.
H
H
OH
│
│
│
H3C – C – H → H3C – C = O → H3C – C = O
e) H2O.
3) Entre as afirmativas citadas abaixo a única
falsa é:
a) Radicais livres são átomos ou grupos de
átomos que possuem pelo menos um elétron
livre.
b) Cisão homolítica (ou homólise) corresponde
a uma quebra de ligação, em que cada átomo fica
com seus elétrons, formando radicais livres.
c) Um carbono carregado negativamente é
chamado de carboânion ou íon carbânion.
d) Na cisão heterolítica o átomo mais
eletronegativo fica com o par de elétrons antes
compartilhado, formando-se assim íons.
│
OH
d) ROH.
Oxidação de álcoois secundários:
Obtêm como produtos as cetonas.
OH
CH3
│
│
H3C – C – CH3 → H3C – C = O → Não reage.
e) Reagente eletrófilo é toda espécie química
que, cedendo um par de elétrons, é capaz de
formar uma nova ligação.
4) A monocloração de um alcano, em presença
de luz ultravioleta, produziu os compostos 1-cloro2-metil-propano e 2-cloro-2-metil-propano. O
nome do alcano é:
│
a) isopropano.
OH
b) metil-butano.
134
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
Química 4
c) metano.
d) desidratação
d) butano.
e) hidrogenação
e) metil-propano.
9) Na hidrogenação catalítica do propeno, obtémse:
5) Das alternativas a seguir, a que contém
somente grupos orientadores META é:
a) propino, cuja fórmula geral é CnH2n – 2.
a) NO2, Cl, Br.
b) ciclopropano.
b) CH3, NO2, COOH.
c) propano.
c) CHO, NH2, CH3.
d) propadieno.
d) SO3H, NO2, COOH.
e) 2-propanol.
e) CH3, Cl, NH2.
10) Com respeito à equação:
6) (UFSE) A mononitração do tolueno (metilbenzeno) produz, além de água:
X + HBr → C6H13Br
a) somente o-nitrotolueno.
b) somente m-nitrotolueno.
c) somente p-nitrotolueno.
d) mistura de o-nitrotolueno e p-nitrotolueno.
e) mistura de o-nitrotolueno e m-nitrotolueno.
Pode-se afirmar que X é um:
a) alcano e a reação é de adição.
b) alceno e a reação de substituição.
c) alceno e a reação é de adição eletrofílica.
d) alcano e a reação é de substituição eletrofílica.
e) alceno e a reação é de substituição.
7) O grupo amino (– NH2), ligado ao anel
benzênico, nas reações de substituição aromática
é orientador:
11) A adição do brometo de hidrogênio ao 3,4dimetil-2-penteno forma o composto:
a) apenas orto.
a) 2-bromo-4-metil-hexano.
b) meta e para.
b) 2-bromo-3-etil-pentano.
c) apenas meta.
c) 3-bromo-2,3-dimetil-pentano.
d) orto e meta.
d) 3-bromo-3-metil-hexano.
e) orto e para.
e) 3-bromo-3,4-dimetil-pentano.
8) Os lipídeos podem ser classificados como
óleos ou gorduras: nos óleos predominam
cadeias insaturadas e nas gorduras predominam
cadeias saturadas. Com base nessa afirmação,
um
óleo
é
transformado
em
gordura,
respectivamente, através de um processo, no
qual ocorre reação de:
12)
(Fuvest-SP)
Dois
hidrocarbonetos
insaturados,
que
são
isômeros,
foram
submetidos, separadamente, à hidrogenação
catalítica. Cada um deles reagiu com H2 na
proporção, em mols, de 1:1, obtendo-se, em cada
caso, um hidrocarboneto de fórmula C4H10. Os
hidrocarbonetos
que
foram
hidrogenados
poderiam ser:
a) saponificação
b) hidrólise ácida
c) esterificação
a) 1-butino e 1-buteno.
b) 1,3-butadieno e ciclobutano.
c) 2-buteno e 2-metil-propeno.
135
Cursinho Pré-Universitário Popular
Prof.: Maria Patrícia
d) 2-butino e 1-buteno.
a) aldeído.
e) 2-buteno e 2-metil-propano.
b) ácido carboxílico.
13) Na desidratação intramolecular do etanol
obtém-se:
c) álcool terciário.
Química 4
d) álcool secundário.
a) eteno.
e) álcool primário.
b) propeno.
c) etoxietano (éter dietílico).
16) A reação de ozonólise dos alcenos produzirá
como produto moléculas de:
d) metoximetano (éter dimetílico).
a) diálcoois ou ácidos carboxílicos.
e) 2-buteno.
b) álcoois ou fenóis.
14) (Covest-2002) Álcoois não são utilizados
somente como combustíveis, mas também na
produção de derivados do petróleo, como, por
exemplo, alquenos. Qual dos álcoois abaixo
produzirá propeno a partir da desidratação em
meio ácido?
c) cetonas ou aldeídos.
a) 2-metil-2-propanol.
b) etanol.
c) 2-propanol.
d) 2-butanol.
e) 2-metil-1-propanol.
15) (Unitau-SP) Para que a oxidação de uma
substância orgânica com “n” átomos de carbono
por molécula forneça uma cetona com igual
número de átomos de carbono, essa substância
pode ser um:
d) cetonas ou ácidos carboxílicos.
e) álcoois ou ácidos carboxílicos.
17) O reativo de Baeyer é utilizado para
diferenciar ciclanos de:
a) alcano.
b) alceno.
c) ácido carboxílico.
d) éter.
e) éster.
Gabarito: 1-e; 2- c; 3- e; 4- a; 5- d; 6- d; 7- c; 8- e;
9- c; 10- c; 11- e; 12- c; 13- a; 14- c; 15- d; 16- c;
17-b;18-a.
Bibliografia:
Feltre, R; Fundamentos da química;
volume único; 3ª edição revista e
ampliada; editora Moderna; São Paulo;
S.P.; 2001.
Solomons, T.W.G; Química orgânica I;
volume 1; 7ª edição; editora LTC; Rio de
Janeiro; R.J.; 2000.
Apostila do curso pré-vestibular do
Colégio Imaculada Conceição – 2007.
http: // www.brasilescola.com
Tito e Canto; Química na abordagem do
cotidiano; 2ª edição; volume 3; editora
Moderna.
Feltre; Química Orgânica; 5ª edição;
volume 3; editora Moderna.
136