PIBIC-UFU, CNPq & FAPEMIG
Universidade Federal de Uberlândia
Pró-Reitoria de Pesquisa e Pós-Graduação
DIRETORIA DE PESQUISA
CONEXÕES EFÁTICAS
Rafael L. Lima 1
Universidade Federal de Uberlândia/ Faculdade de Engenharia Mecânica
Avenida João Naves de Ávila, 2121 Bloco 1M Campus Santa Mônica – 38400 -902 – Uberlândia – MG, Brasil.
[email protected]
Henrique F. Rodrigues 2
Universidade Federal de Uberlândia/ Instituto de Ciências Biomédicas
Rua Acre Bloco 2E Campus Umuarama – Uberlândia – MG, Brasil.
[email protected]
Ricardo de C. Lopes 3
Universidade Federal de Uberlândia/ Faculdade de Engenharia Elétrica
Avenida João Naves de Ávila, 2121 Bloco 1E Campus Santa Mônica – 38400 -902 – Uberlândia – MG, Brasil.
[email protected]
João Batista D. Filho 4
Universidade Federal de Uberlândia/ Faculdade de Engenharia Elétrica
Avenida João Naves de Ávila, 2121 Bloco 1E Campus Santa Mônica – 38400 -902 – Uberlândia – MG, Brasil.
[email protected]
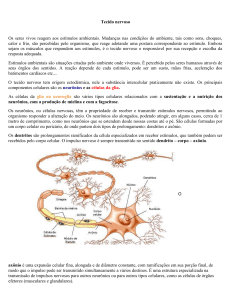
Resumo – Esse trabalho irá tratar sobre conexões efáticas, um novo meio de comunicação entre
grupos de neurônios, descrevendo suas características principais e como ela pode modular a
sincronização da atividade neural, bem como características gerais sobre processamento de
informação no axônio. Serão apresentados procedimentos experimentais relativos ao estudo destas
conexões, descrevendo uma simulação de computador sobre conexões efáticas e também um
experimento que detectou limiares de interação com campos elétricos da ordem de 100 µV/mm em
fatias do hipocampo de ratos.
Palavras-Chave – Conexões efáticas, sincronização neural, limiar de interação, campos elétricos,
simulação neuronal.
1. Introdução
Neste trabalho falaremos sobre as conexões efáticas, que são impulsos em fibras nervosas
mielinizadas que estão paralelas e próximas entre si, de modo que a eletrodinâmica de uma pode
influenciar a de outra e vice-versa [Binczak, 2001].
A interação efática é o fenômeno onde a passagem de um impulso através de um axônio
provoca uma mudança na excitabilidade da membrana de outro axônio adjacente. Isso ocorre
porque a passagem do impulso altera o potencial extracelular local. Este tipo de interação contribui
para sincronizar a atividade elétrica em grupos de neurônios [Debanne, 2004].
O conceito de interação efática difere da transmissão sináptica comum (elétrica e química)
por não haver um sítio especializado (fenda sináptica) por onde o impulso elétrico é conduzido para
o neurônio pós-sináptico. Além disso, na interação efática, a distância física entre as duas células
comunicantes é muito maior que a dimensão média de uma fenda sináptica [Krnjevic, 1986].
É importante distinguir efeitos de campo e comunicação efática. O primeiro está
relacionado com comunicação elétrica entre neurônios, possibilitada por campos elétricos de
magnitude elevada gerados pela atividade simultânea de vários neurônios. O segundo é um efeito
1 – Acadêmico do Curso de Engenharia Mecânica
2 – Acadêmico do Curso de Biomedicina
3 – Acadêmico do Curso de Engenharia Biomédica
4 - Orientador
bem mais localizado, envolvendo uma quantidade de células e campos elétricos menores que para o
efeito de campo, que incluem uma variedade de mecanismos. [Kamermans, 2004].
2. Justificativa para se estudar conexões efáticas
Campos elétricos fracos modulam a atividade neural, e o conhecimento do limiar de
interação é importante para entender sincronização neural e para desenvolvimento de neuroimplantes. O uso crônico de tais aparelhos pode causar danos teciduais, portanto o objetivo seria
conhecer o campo elétrico mínimo necessário para uma resposta terapêutica eficiente e que, ao
mesmo tempo, não cause danos significativos para o paciente [Francis, 2003].
È importante também entender o limiar de interação de campos elétricos exógenos com
sistemas biológicos, e considerar interação do campo elétrico endógeno com o sistema nervoso
[Francis, 2003].
A sincronização neural é importante para diversas situações. Nos neurônios motores, ela
ajusta os tempos entre impulsos acoplados, permitindo a estimulação coordenada de células
musculares. Além disso, em grupos de axônios ópticos ou auditórios, no sistema nervoso central ela
assegura que as cronometragens necessárias para serem feitos cálculos nos campos dendríticos dos
neurônios subseqüentes aconteçam ao mesmo tempo [Binczak, 2001].
Em grupos de neurônios adjacentes no corpo caloso (o que provém canais de comunicação
entre os dois hemisférios do cérebro), a sincronização poderia ser um mecanismo para a transmissão
das mensagens entre os dois hemisférios do cérebro [Binczak, 2001].
Nos gânglios da raiz dorsal, onde as células estão isoladas e distantes umas das outras, foi
observado que quando os neurônios são repetitivamente estimulados, as células vizinhas aumentam
a probabilidade de gerar um spike [Amir, 1996]. Acredita-se que isso pode ser resultado de uma
interação efática, que se acredita estar relacionada com muitos outros processos fisiológicos.
3. Generalidades sobre processamento de informação no axônio [Debanne, 2004]
Até pouco tempo atrás, acreditava-se que a função do axônio era simplesmente conduzir o
potencial de ação até os terminais axônicos para estimular o neurônio pós-sináptico. Os canais de
sódio são os responsáveis pela geração e propagação do potencial de ação e os canais de potássio
possuem a função de repolarizar a célula para o potencial de repouso. Porém, já foi descoberto que
o axônio realiza outras funções importantes, como ajudar a promover uma sincronização da
atividade neural, através da modulação do potencial de ação que passa por ele ou que passa por um
axônio vizinho.
Durante repetitivas estimulações, o potencial de ação pode ter sua amplitude ou duração
alteradas. Nessa situação os canais de sódio e potássio voltagem-dependentes sofrem inativação, e
como eles são responsáveis pela saída de sódio e repolarização da célula, respectivamente, o
potencial de ação terá sua amplitude reduzida e duração aumentada.
Outro fator que afeta a condução do potencial de ação é a morfologia do axônio. Este não é
regular, em certos pontos sua espessura varia ou ele se divide em dois axônios (pontos de
ramificação). Definimos razão geométrica como soma do diâmetro dos ramos-filhos dividido pelo
diâmetro do ramo de origem.
Quando a razão geométrica desses pontos aumenta repentinamente, podem ocorrer três
fenômenos importantes para o potencial de ação: atraso, falha e reflexão.
* Os atrasos acontecem quando o potencial de ação, partindo da zona de gatilho, atinge um
local do axônio em que ele reduz sua velocidade repentinamente. A condução no axônio representa
um atraso na propagação da informação, porém sua arborização permite que o potencial de ação
atinja os terminais axônicos em diferentes rotas, cada uma com uma velocidade de condução
diferente.
2
* As falhas são fenômenos em que o potencial de ação pára e nenhum sinal alcança o
terminal axônico para estimular o neurônio pós-sináptico.
* A reflexão ocorre quando o potencial de ação sofre um atraso elevado nesses pontos, de tal
forma que o tempo do atraso seja maior que o período refratário absoluto da membrana, o axônio é
estimulado nos dois sentidos, em direção ao terminal axônico e de volta para o corpo celular.
Os três fenômenos discutidos anteriormente também podem ser causados por repetidas
estimulações, por causa da hiperpolarização da membrana devido ao efluxo intenso de potássio.
Acredita-se que esses fenômenos atuam no sentido de manter a atividade neural sincronizada.
Além disso, os axônios podem comunicar entre si de forma rápida através das junções gap
(sinapse elétrica) e conexões efáticas, que serão aprofundadas a seguir.
4. Características gerais de conexões efáticas
Por causa da bainha de mielina e da baixa resistência extracelular entre os axônios,
acreditava-se que esse fenômeno ocorresse apenas em algumas patologias como esclerose múltipla,
onde a bainha de mielina dos axônios é danificada [Kamermans, 2004].
Porém alguns estudos sugerem que a comunicação efática no axônio pode ocorrer em
algumas situações fisiológicas, onde estes estão densamente agregados, paralelamente espaçados,
são amielínicos e apresentam uma quantidade reduzida de células da glia (que atuam como barreira
para a passagem da corrente elétrica) [Krnjevic, 1986; Kamermans, 2004]. Exemplos de locais onde
este fenômeno foi observado são: nervo olfatório, motoneurônios espinhais e neurônios piramidais
do hipocampo [Krnjevic, 1986].
Para ocorrer uma interação efática é necessário que a resistência extracelular seja alta, para
que o fluxo de corrente flua através dos neurônios vizinhos e então mude sua excitabilidade
[Krnjevic, 1986]. A posição dos nódulos de Ranvier também influencia a ocorrência de interação
efática [Debanne, 2004].
A função dessa interação seria a de promover ativação sincronizada de grandes grupos de
neurônios. Quanto mais neurônios são ativados, maior será a intensidade da corrente efática,
resultando em uma resposta eferente bem maior [Krnjevic, 1986].
5. Tipos de comunicação efática [Kamermans, 2004]
Existem três tipos principais de interação efática. A primeira é a interação axo-axônica, a
mais conhecida, que ocorre quando um spike gerado em um axônio altera a excitabilidade de um
axônio vizinho.
O segundo tipo (figura 1) é a modulação do limiar do spike, ela ocorre quando um plexo
denso de interneurônios altera o limiar do potencial de ação ao redor da zona de gatilho de outro
neurônio. Quando um impulso elétrico passa pelos interneurônios, a região em volta da zona de
gatilho fica hiperpolarizada, caracterizando uma interação inibitória. Essa interação foi observada
nas células de Purkinje do cerebelo.
3
Figura 1: Modulação do limiar do spike [Kamermans, 2004].
O terceiro tipo é a comunicação efática na sinapse química, que está restrita a apenas um
terminal sináptico. Estudos com a sinapse fotorreceptora da retina (entre cones, células bipolares e
células horizontais, Figura 2) mostram que o mecanismo de feedback de liberação de
neurotransmissores é mediado por uma interação efática. Nas células horizontais, uma corrente
elétrica passa através dos hemichannels (metade de uma junção gap), que causa uma queda no
potencial elétrico do espaço intersináptico. A queda no potencial, por sua vez, diminui o limiar de
abertura dos canais de cálcio voltagem-dependentes do cone, que respondem à despolarização,
provocando mais influxo de cálcio, que provoca maior liberação de neurotransmissores e maior
excitação da célula pós-sináptica.
Figura 2: Comunicação efática na sinapse química; cone em amarelo, célula horizontal em azul,
célula bipolar em verde, hemichannels (barra azul), canais de cálcio voltagem-dependente
(vermelho), vesículas com neurotransmissor (círculos brancos), resistência elétrica (barra branca), a
seta representa a corrente elétrica [Kamermans, 2004].
6. Condução contínua e condução saltatória nas conexões efáticas, e o alinhamento internodal
[Binczak, 2001]
Uma simples fibra nervosa mielinizada pode ser representada pelas seguintes equações
diferenciais
Vn – Vn+1 = (Ri + Ro) In (1) e
dV
In-1 – In = C n + Iion,n (2)
dt
G
Vn(Vn – Va)(Vn - Vb) (3)
Iion,n =
Vb (Vb V a )
4
Onde o n representa os nódulos de Ranvier sucessivos, nos quais existe uma tensão
transversa através da membrana (Vn), e uma corrente fluindo longitudinalmente através da fibra
saindo do nódulo n para o nódulo n+1. A equação 1 é apenas uma aplicação da lei de ohm,
relacionando a diferença de potencial entre dois nódulos adjacentes com a corrente fluindo entre
eles e a resistência interna (Ri) e a resistência externa ao neurônio (Ro).
A equação 2 mostra que a corrente fluindo em um nódulo n a partir de um nódulo (n-1) (In-1)
menos a corrente fluindo para o nódulo (n+1) (In) é igual aos dois componentes da corrente
transversa que estão abandonando o nódulo: a corrente capacitiva CdVn/dt, e a corrente iônica que
compõe as perdas pelos componentes sódio e potássio no nódulo (Iion,n).
Na equação 3, Va é a tensão mínima na qual a corrente de sódio começa a fluir em um
nódulo de Ranvier, e Vb é a tensão na qual a corrente de íons retorna a zero. A condutância iônica
próxima de Vb é G.
A propagação do impulso nervoso pode ocorrer de duas maneiras, através da condução
contínua ou da saltatória. Caso o processo de condução seja contínuo ele deve obedecer à inequação
|(vn+1 - vn)/vn| << 1, que mostra que a tensão e a corrente são funções da distância. Caso |(vn+1 vn)/vn| >> 1 o processo de condução é saltatório, onde o impulso salta de um nódulo de Ranvier para
o outro de maneira descontínua, onde vn=Vn/Vb.
Rf
Para simplificar os cálculos utilizamos um parâmetro discreto D
, onde Rf é a
R
resistência internodal de um neurônio e R (Ri+Ro), sendo Ri a resistência interna e Ro a resistência
externa ao neurônio.
Caso D>>1, esse processo irá ocorrer do modo contínuo, e caso D<<1 esse processo irá
ocorrer de forma saltatória, podendo ocorrer falhas para valores de D próximos a 0,2.
O parâmetro D também está diretamente relacionado à distância entre os nódulos de Ranvier
do neurônio, pois nos organismos vivos a condução saltatória começa a ocorrer a partir de uma
s
distância so, portanto poderíamos calcular D o , que para distâncias internodais bem maiores
s
que so o neurônio opera seguindo a condução saltatória, e para distâncias bem menores a condução
contínua.
Podemos destacar também que na condução saltatória a propagação do impulso em
neurônios mielinizados é mais rápida, possui um diâmetro menor e as células gastam muito menos
energia para transmitir um impulso, porém as fibras mielinizadas também apresentam a
possibilidade de falhar na propagação do impulso caso a distância entre dois nódulos atinja um
a 2
*
Rf G
D
valor que faça com que D ultrapasse D*.
4 , onde 1 a , e a Vn / Vb .
Figura 3: Velocidade do impulso em um neurônio mielinizado em função do parâmetro discreto D.
5
Como características das conexões efáticas, devemos destacar o alinhamento entre os
nódulos de dois neurônios efaticamente conectados, ou seja, deve-se levar em conta como estão
dispostos os nódulos de Ranvier de um neurônio em relação ao outro, e esse alinhamento será
medido em função do parâmetro de alinhamento A. A região onde os nódulos estão exatamente
alinhados será A=1, e o ponto onde os nódulos estiverem perfeitamente escalonados será A=1/2.
Esse alinhamento tem um papel fundamental para diversos processos, pois ele apresenta
uma tendência de sincronizar mais forte para A=1, e aceita maiores distâncias nodais se A=1/2,
indicando uma conexão mais robusta. Mas caso as fibras sejam menores, a necessidade da
sincronização rápida deve exigir um alinhamento nodal, entretanto a sincronização rápida é menos
importante para fibras longas.
7. Experimentação
Uma maneira de se estudar a interação efática é expondo as fatias do hipocampo a um meio
livre de cálcio e enriquecido com magnésio, dessa forma impedindo a transmissão sináptica
química. Esses experimentos mostraram que os impulsos originados das fatias foram sincronizados.
Na impossibilidade de realizar sinapses químicas e sabendo que as células em questão não fazem
junções gap (impossibilitando a sinapse elétrica), esse sincronismo foi explicado pelo fenômeno da
interação efática [Krnjevic, 1986].
Em experimentos usando campo externo senoidal com adição de ruído de magnitude 2,5
mV/mm, foram detectadas interações entre os neurônios da região CA1 do hipocampo. Porém,
acredita-se que neurônios mais longos possuem limiar de interação da ordem de 100 µV/mm,
teoricamente [Francis, 2003].
Um experimento realizado detectou um limiar de interação com campos elétricos (ou seja, o
campo elétrico mínimo com o qual as células respondem significativamente) próximo do limite
teórico esperado. No experimento, foram utilizadas fatias longitudinais da região CA1 e CA3 do
hipocampo de ratos expostas a um aparelho gerador de campo elétrico, que simulou a freqüência e
amplitude padrões do spike normal de um neurônio. A atividade elétrica foi registrada com
eletrodos de micropipeta em comparação com um eletrodo de referência [Francis, 2003].
Os experimentos foram feitos na rede de neurônios da região CA3, rede de neurônios da
região CA1 e neurônios isolados da região CA1. Na região CA3, em particular, a população
apresenta atividade de bursts intensa, sendo assim o aparelho também foi programado para simular
tal atividade, com perturbação de fase. Além disso, foi realizado o experimento sham (grupo de
controle) para todas as amostras, no intuito de possibilitar representatividade estatística [Francis,
2003].
Os experimentos detectaram limiares de interação variados nas diferentes regiões: 370
µV/mm para a população da região CA3, 140 µV/mm para a população da região CA1 e 185
µV/mm para neurônios isolados da região CA1. Esses dados valem tanto para campos elétricos
excitatórios quanto para inibitórios [Francis, 2003].
Através desse experimento concluiu-se que a região CA1 é mais sensível a campos
elétricos do que a região CA3, e que populações de neurônios interagem melhor com campos
elétricos fracos do que neurônios isolados [Francis, 2003].
Através de experimentos no nervo mielinizado de sapos, foram medidas as velocidades de
condução nos seus axônios, e esse experimento também foi utilizado para uma descrição
experimental de uma fibra mielinizada real [Binczak, 2001].
Além disso, através de simulações percebeu-se também que o alinhamento entre os nódulos
de dois neurônios efaticamente conectados influencia de maneira significativa em como a conexão
efática ocorre [Binczak, 2001].
6
8. Modelos de simulações
O grau de conexão efática entre axônios vizinhos (ou coeficiente de acoplamento) é
determinado pela relação entre, resistência extracelular, resistência intracelular, resistência da
membrana dos axônios e pelo número de axônios no fascículo. Estudos com modelos de simulação
no nervo olfatório levaram ao desenvolvimento de dois modelos para o estudo de interações
efáticas: O modelo de campo médio e o modelo geométrico [Bokil, 2001].
No modelo de campo médio, adotamos axônios com diâmetro d, resistência intracelular por
unidade de comprimento ri = 4Ri/(πd²), resistência da membrana por unidade de comprimento rm =
Rm/(πd), onde Ri (Ω.cm) é a resistividade citoplasmática e Rm (Ω.cm²) é a resistência específica da
membrana. Sendo β, a razão entre as áreas seccionais extra e intracelular, a resistência extracelular
longitudinal por unidade de comprimento re = ri/(N.β), onde N é o número de axônios em um
fascículo [Bokil, 2001].
Visto que a resistência transversa por unidade de comprimento rt <<< rm, foi assumido que
cada secção transversal do espaço extracelular é equipotencial (rt=0). Isto sugere o seguinte modelo
de campo médio: considerando N axônios em um fascículo, sendo todos como cabos
unidimensionais no eixo x e assumindo que apenas um axônio é estimulado. Então os restantes (N1) axônios terão o mesmo potencial de membrana. Definindo o potencial de membrana do axônio
estimulado VA e o potencial de membrana do restante dos axônios como VB, a teoria do cabo leva
às seguintes equações:
onde cm (µF/cm) é a capacitância da membrana por unidade de comprimento, IAíon e IBíon denota as
correntes de membrana e Istim é a corrente estimulante. a11 = ri + re(N-1), a12 = re(N-1), a21 = re,
a22 = ri + re, e D = ri² + N.ri.re. As equações acima podem ser escritas em termos de variáveis
adimensionais, implicando que elas se aplicam para axônios de diâmetro arbitrário [Bokil, 2001].
Um segundo tipo de modelo foi testado, devido ao fato de o modelo de campo médio ignorar
as relações espaciais entre os axônios vizinhos, por exemplo, distinguir vizinhos próximos e
vizinhos distantes. Para esse modelo foram considerados 19 axônios organizados em uma grade
triangular e o espaço extracelular modelado como 24 cabos unidimensionais situados nos locais do
triângulo no interstício, cada um com uma resistência longitudinal 24re por unidade de comprimento
e os cabos adjacentes estão conectados através de uma resistência transversa rt = 10Ri por unidade
de comprimento (Figura 4) [Bokil, 2001].
Para β=0,05, quando N=2 e o axônio A é estimulado para iniciar um único potencial de
ação, um potencial de ação é iniciado simultaneamente no axônio B. Quando β=10,0 o potencial de
membrana no axônio B permanece sublimiar. Porém esta onda de despolarização sublimiar se
propaga na mesma velocidade que o potencial de ação do axônio A [Bokil, 2001].
7
Figura 4: Esquema ilustrando o modelo geométrico [Bokil, 2001].
Para β=0,05, quando N > 7 a despolarização induzida nos axônios não-estimulados é
sublimiar, mas quando 2 < N < 8 ocorre um atraso no início do potencial de ação nos axônios
vizinhos [Bokil, 2001].
Levando em consideração que as interações efáticas podem afetar o tempo de disparo dos
potenciais de ação foi realizado um experimento provocando potenciais de ações em axônios
diferentes em diferentes freqüências. Em axônios não acoplados (β = 1.000.000), o axônio A
disparava a 66 Hz e o axônio B a 33 Hz, quando estes axônios foram acoplados (β = 0,1), ambos
sincronizaram seus disparos a 66 Hz. Esse experimento mostrou que interações efáticas podem
sincronizar os disparos em axônios vizinhos, portanto contribuindo para a decodificação da
informação sensorial [Bokil, 2001].
Barr e col. realizaram uma simulação computacional com o objetivo de estabelecer um
modelo simples para analisar como a atividade elétrica de um neurônio afeta a atividade de outro
vizinho, no quesito velocidade de propagação do impulso. O modelo consiste de duas fibras A e B,
representadas por um fio condutor dentro de um volume extracelular restrito, que foram estimuladas
simultaneamente. Através do experimento confirmou-se que a velocidade de propagação é
dependente do ambiente elétrico ao redor do axônio [Barr, 1992].
9. Epilepsia e conexões efáticas
Crises epilépticas são distúrbios na função cerebral causadas por um disparo síncrono
anormal dos neurônios corticais. As epilepsias são um grupo de desordens caracterizadas por crises
recorrentes. Em algumas formas de epilepsia, a base genética é evidente. Em outros são causadas
por uma danificação cerebral causada por batidas, traumas, uma lesão de massa, ou infecção
[Ganong, 1997].
A atividade neuronal normal ocorre de uma maneira não-sincronizada, com grupos de
neurônios inibidos e excitados seqüencialmente durante a transferência de informação entre áreas
cerebrais diferentes. Crises ocorrem quando neurônios em uma determinada região ou em todo o
cérebro são ativadas sincronamente. O tipo de crise depende do local da atividade anormal e do
padrão de espalhamento para diferentes partes do cérebro [Ganong, 1997].
A ressonância magnética de correntes neurais (nc MRI), o método da detecção direta das
mudanças do campo magnético local da atividade neuronal através das correntes induzidas, seria
benéfico para o tratamento da epilepsia, já que ela permitir um mapeamento pré-operativo preciso e
não invasivo da zona epiléptica [Cassarà, 2008].
Acredita-se que as conexões efáticas possam ser uma das causas da epilepsia, pois como já
foi dito, crises epilépticas ocorrem quando neurônios em uma determinada região ou em todo o
8
cérebro são ativadas sincronamente [Ganong, 1997], e dependendo de como os nódulos de Ranvier
de vários neurônios de uma determinada região estiverem alinhados eles podem levar à uma
sincronização de vários potenciais de ação [Binczak, 2001], gerando uma crise epiléptica. Esse
alinhamento internodal anormal entre vários neurônios pode ter sido causado por alguma herança
genética, ou por algum acidente que tenha modificado a estrutura de alguma região do cérebro
[Ganong, 1997].
Entretanto a nc MRI, ainda não é totalmente funcional com a tecnologia existente, pois
apenas variações maiores que uma pequena porcentagem podem ser detectadas. Além disso, a
viabilidade desse método depende da identificação das condições ótimas que geram o maior efeito
de sinal, como a geometria e o tamanho da voxel experimental. Acredita-se que para serem
calculadas essas condições ótimas também devem ser levadas em conta as conseqüências das
conexões efáticas, além da morfologia, propriedades biofísicas, dentre outras, durante as simulações
que foram feitas para se descobrir se a nc MRI é aplicável na vida real [Cassarà, 2008].
10. Conclusão
O conceito de interação efática difere da transmissão sináptica comum (elétrica e química)
por não haver um sítio especializado (fenda sináptica) por onde o impulso elétrico é conduzido. Este
tipo de interação contribui para sincronizar a atividade elétrica em grupos de neurônios [Krnjevic,
1986].
Para ocorrer uma interação efática é necessário que a resistência extracelular seja alta, para
que o fluxo de corrente flua através dos neurônios vizinhos e então mudar sua excitabilidade
[Krnjevic, 1986]. A posição dos nódulos de Ranvier parece influenciar a conexão efática [Debanne,
2004].
Na condução contínua a conexão efática permite uma interação entre dois impulsos que faz
com que eles se propaguem com a mesma velocidade. Já na condução saltatória, ela pode funcionar
de várias maneiras, dependendo do alinhamento entre os nódulos dos neurônios efaticamente
conectados. A tendência de sincronização será mais forte para A=1; serão aceitas maiores distâncias
nodais se A=1/2, indicando uma conexão mais robusta. Mas caso as fibras sejam menores, a
necessidade da sincronização rápida deve exigir um alinhamento nodal, entretanto tal sincronização
é menos importante para fibras longas [Binczak, 2001].
Uma maneira de se estudar a interação efática é expondo as fatias do hipocampo a um meio
livre de cálcio e enriquecido com magnésio, dessa forma impedindo a transmissão sináptica
química. Esses experimentos mostraram que os impulsos foram sincronizados. Na impossibilidade
de realizar sinapses químicas e sabendo que as células em questão não fazem junções gap
(impossibilitando a sinapse elétrica), esse sincronismo foi explicado pelo fenômeno da interação
efática [Krnjevic, 1986].
As interações efáticas parecem mediar o mecanismo de feedback dependente de
hemichannels na sinapse fotorreceptora. Experimentalmente, os hemichannels podem ser
bloqueados com carbenoxolona, por acidificação intracelular ou com solução 100 µM de cobalto.
Uma evidência que confirma que o mecanismo de feedback é de natureza efática é devido a este ser
dependente da corrente que passa através dos canais na célula horizontal, e não do tipo de íon
transportado. Além disso, as condições da sinapse fotorreceptora estão em concordância com
aquelas necessárias para uma comunicação efática [Kamermans, 2004].
Em experimentos expondo fatias de hipocampo a um aparelho gerador de campo de
entrada simulando a freqüência e amplitude padrões dos spikes, foi observado um sincronismo
significativo a um campo elétrico de no mínimo, 370 µV/mm para a região CA3 e, 140 µV/mm
para populações de neurônios e 185 µV/mm para neurônios singulares da região CA1. Indicando
que a região CA1 é mais sensível a campos elétricos do que a região CA3, e que redes de neurônios
interagem melhor a campos elétricos do que neurônios singulares. Esses limiares valem tanto para
campos elétricos excitatórios quanto para inibitórios. O menor limiar de interação da região CA1
9
talvez possa ser explicado pela consistência de sua árvore dendrítica e maior proximidade das
células [Francis, 2003].
Experimentos sugerem que o campo elétrico endógeno pode modular a excitabilidade de
neurônios não conectados sinapticamente e que não estão em potencial de ação, porém, em virtude
das barreiras biológicas, os campos elétricos do ambiente externo são atenuados abaixo do limiar de
interação [Francis, 2003].
As conexões efáticas podem estar relacionadas às causas da epilepsia, devida à
sincronização dos impulsos que elas podem gerar, que é justamente uma das características do
ataque epiléptico [Ganong, 1997]. Isso pode ser útil para ajudar em métodos de mapeamento como
a nc MRI, servindo como um dos parâmetros para que sejam descobertas as condições ótimas para
o cálculo das correntes neurais [Cassarà, 2008].
Finalmente, é extremamente necessário investigar outras possíveis regiões associadas à
morfologia neuronal que sirvam de modelo para futuros estudos sobre o assunto, por exemplo,
regiões que apresentam uma alta resistência intercelular, que é uma condição muito importante para
ocorrência de comunicação efática. Ou também se pode procurar, usando imunocitoquímica, por
regiões que apresentam alta concentração de hemichannels, para confirmar a sua importância no
mecanismo de feedback [Kamermans, 2004].
11. Referências
[1]M. Kamermans, I. Fahrenfort, “Ephaptic interactions within a chemical synapse: hemichannelmediated ephaptic inhibition in the retina”, Current Opinion in Neurobiology, 14:531-541,
September 11, 2004.
[2]K. Krnjevic, “Ephaptic interactions: A significant mode of communications in the brain”, News
in Physiological Sciences volume 1, p. 28-29, February 1986.
[3]D. Debanne, “Information processing in the axon”, Nature Publishing Group volume 5, p. 304316, April 2004.
[4]J. T. Francis, B. J. Gluckman, S. J. Schiff, “Sensitivity of Neurons to Weak Electric Fields”, The
Journal of Neuroscience, 23(19):7255 – 7261, August 13, 2003.
[5] S. Binczak, J. C. Eilbeck and A. C. Scott, “Ephatic Coupling of Myelinated Nerve Fibers”,
Physica D: Nonlinear Phenomen, volume 148, 159-174, January 1, 2001.
[6] W. Ganong, V. R. Lingappa, S. J. McPhee and J. D. Lange, Pathophysiology of Disease An
Introduction to Clinical Medicine, 2ª Edição, Appleton & Lange , 1997.
[7] A. M. Cassarà, G. E. Hagberg, M. Bianciardi, M. Migliore and B. Maraviglia, “Realistic
simulations of neuronal activity: A contribution to the debate on direct detection of neuronal
currents by MRI”, NeuroImage, volume 39, 87-106, 2008.
[8] R. Amir, M. Devor, “Chemically Mediated Cross-Excitation in Rat Dorsal Root Ganglia”, The
Journal of Neuroscience, 16(15):4733 – 4741, August 1, 1996.
[9] H. Bokil, N. Laaris, K. Blinder, M. Ennis, A. Keller. “Ephaptic interactions in the mammalian
olfactory system”, The Journal of Neuroscience, volume 21 RC173(1-5), July 26, 2001.
[10] R. C. Barr, R. Plonsey. “Propagation under the influence of interstitial potentials”, Proceedings
of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society,
volume 14 (598-599), 1992.
10
Ephaptic Coupling
Rafael L. Lima
Universidade Federal de Uberlândia/ Faculdade de Engenharia Mecânica/ Engenharia Mecânica
Avenida João Naves de Ávila, 2121 Bloco 1M Campus Santa Mônica – 38400 -902 – Uberlândia – MG, Brasil.
[email protected]
Henrique F. Rodrigues
**Universidade Federal de Uberlândia/ Instituto de Ciências Biomédicas/ Biomedicina
Rua Acre Bloco 2E Campus Umuarama – Uberlândia – MG, Brasil.
[email protected]
Ricardo de Camargos
Universidade Federal de Uberlândia/ Faculdade de Engenharia Elétrica/ Engenharia Biomédica
Avenida João Naves de Ávila, 2121 Bloco 1E Campus Santa Mônica – 38400 -902 – Uberlândia – MG, Brasil.
[email protected]
João Batista D. Filho
Universidade Federal de Uberlândia/ Faculdade de Engenharia Elétrica/ Engenharia Biomédica
Avenida João Naves de Ávila, 2121 Bloco 1E Campus Santa Mônica – 38400 -902 – Uberlândia – MG, Brasil.
[email protected]
Abstract – This work will focus on ephaptic interactions, which is new way of communication
between neurons, describing its main characteristics and how it can modulate the
synchronization of the neural activity, as well as general characteristics about information
processing in the axon. It will be presented experimental proceedings relative to the study of
these interactions, describing a computational simulation on ephaptic coupling and an
experiment that detected interaction thresholds with electric fields as low as 100 µV/mm in rats
hippocampus slices.
1
Keywords – Ephaptic coupling, neural synchronization, interaction threshold, electric fields,
neuronal simulation.
11