ANÁLISE DOS MECANISMOS CELULARES DURANTE A
OSSEOINTEGRAÇÃO DOS IMPLANTES
Carlos Nelson Elias, Viviane de Souza L. de Vasconcellos, Celso R de Souza Resende
Engenharia Mecânica e Ciência dos Materiais, Instituto Militar de Engenharia, Rio de Janeiro, RJ, Brasil
E-mail: [email protected]
Resumo
Existem diferenças nos índices de sucesso dos implantes dentários disponíveis no mercado. Estas diferenças
podem estar associadas às características na escala macro e nanométrica dos implantes. As diferenças
macrométricas envolvem o material usado na fabricação, a forma do corpo do implante, o perfil dos filetes de
rosca, dimensões dos implantes e o modo de fixação dos componentes protéticos. As diferenças nas escalas
micro e nanométrica são identificadas na morfologia da superfície do implante, as quais influenciam nos
mecanismos de interação com células durante o período de cicatrização e reparo dos tecidos. O objetivo do
presente trabalho é analisar os diferentes mecanismos envolvidos na osseointegração e as interações das células
com a superfície dos implantes osseointegráveis de titânio comercialmente puro. A análise do envolvimento das
proteínas da matriz extracelular, da membrana celular e do citoesqueleto permitirá entender a razão que o titânio
com e sem tratamento da superfície apresenta osseointegração e este fenômeno não é obervado em outros metais. As
fases de adesão, proliferação e diferenciação das células ósseas e a adesão de proteínas ao titânio estão
intimamente relacionadas com as propriedades da superfície dos implantes, como rugosidade, composição química,
molhabilidade e energia de superfície.
Palavras-chave: osseointegração, proteínas, adesão de células, interação de células,
implantes dentários
1.
Introdução
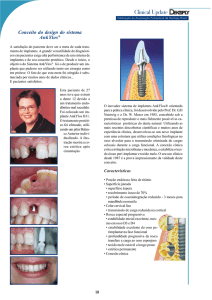
Conforme mostrado na Figura 1, existem no mercado várias formas de implantes
dentários. Entre as formas mostradas, os implantes cilíndricos com roscas foram os primeiros
a serem usados. Com o entendimento da biomecânica, verificou-se que os implantes cônicos
possuem maior capacidade de compactação do osso durante a inserção e apresentam maior
estabilidade primária. Ainda, na tentativa de aumentar o índice de sucesso dos implantes, temse adotado o controle da rugosidade da superfície com o objetivo de selecionar o tipo de
célula que irá interagir com o implante. Sabe-se que as células osteoblásticas aderem mais
rapidamente em superfícies rugosas de titânio onde há proliferação mais acentuada da síntese
da matriz extracelular, do que em superfícies lisas1. Mesmo assim, apesar dos avanços da
implantodontia, a explicação da influencia da superfície dos implantes na osseointegração
permanece incompleta. As novas superfícies melhoram os resultados das aplicações clínicas
em casos com baixa qualidade e quantidade de osso. No entanto, ainda existem perdas
inexplicáveis de implantes. O mercado atual dos implantes dentários no Brasil é da ordem de
1,5 milhão por ano com perda da ordem de 3%, o que significa que cerca de 45.000 implantes
por ano são perdidos por razões que envolvem a técnica cirúrgica, qualidade do osso,
características da superfície do implante, resposta inadequado do organismo, seleção errônea
do tipo do implante, biomecânicos e razões desconhecidas. As pesquisas são realizadas com o
objetivo de solucionar estes problemas e entender os mecanismos que envolvem a
cicatrização e a osseointegração.
Figura 1: Exemplos de formas de implantes dentários comercializados.
Após a confirmação que os implantes dentários de titânio comercialmente puro
possuem osseointegração, a reabilitação estética e funcional tornou-se possível e hoje é uma
realidade difundida e comprovada clínica e cientificamente. Atualmente, com o advento e
domínio da biologia molecular, da engenharia genética e das pesquisas de diferenciação
celular com células-tronco, a odontologia entra em uma nova fase, onde os tratamentos de
regeneração tecidual devem ser cada vez mais previsíveis, com melhores resultados e
procedimentos menos invasivos. Para tanto, é necessário um conhecimento do fisiologismo
humano cada vez maior. Entender o metabolismo celular, a síntese de proteínas, as
substâncias reguladoras das células e a gênese das mesmas devem ser o caminho a ser
percorrido.
O objetivo do presente trabalho é analisar os diferentes mecanismos envolvidos na
osseointegração e as interações das células com a superfície dos implantes osseointegráveis de
titânio comercialmente puro.
2.
Mecanismos envolvidos na cicatrização óssea
Para fins de análise, os mecanismos envolvidos na cicatrização óssea peri-implantar
após a prepração do leito cirúrgico e instalação dos implantes de titânio podem ser divididos em
três fases: osteocondução (migração de células osteogênicas para a superfície do implante através
de um arcabouço temporário de tecido conjuntivo), formação de osso “de novo” (deposição na
superfície do implante de uma matriz interfacial mineralizada, equivalente às linhas de cemento
do tecido ósseo natural) e remodelação óssea. A osteogênese por sua vez pode ser de contato e a
distânia. Na osteogênese de contato, o osso é formado na superfície do implante, diferentemente
da osteogênese à distância, em que o osso novo se forma na superfície do osso do sítio periimplantar após a atividade osteoclástica.
Para ocorrer a osseointegração há necessidade da estabilidade primária, a qual depende
da forma do implante. Logo após a instalção do implante os mecanismos celulares que culminam
com a osseoibtegração são iniciados, nesta fase as características da superfície do implante
exercem uma grande influência. A morfologia da superfície é crítica no fenômeno “bone
bonding” concomitante à formação de osso “de novo”. Esta é a razão que as empresas e
pesquisadores procuram alterar o acabamento superficial dos implantes para otimizar as
respostas biológicas2.
A análise do fenômeno “bone bonding”, ou a habilidade do tecido ósseo se ligar à
superfície de um material sintético, exige o enetendimento tanto dos processos de reabsorção
óssea quanto a formação da linha de cemento. O recrutamento e migração de uma população de
células potencialmente osteogênicas não são suficientes para ocorrer a formação do osso na
superfície do implante, há necessidade que ocorra a diferenciação dessa população em células
secretoras maduras. Tais células migram através do coágulo sanguíneo e alcançam a superfície
do implante ou do osso antigo, onde iniciam a síntese de matriz em uma superfície sólida. Em
seguida, elas se diferenciam e formam o osso “de novo” pela secreção da matriz da linha de
cemento, que contém proteínas ósseas não colagenosas, proteoglicanas e cristalitos de fosfato de
cálcio. Para favorecer os mecanismos envolvidos no fenômeno “bone bonding”, é necessário que
o implante tenha característica micro e nanotopográficas que permitam as ligações do cemento
com a superfície3.
Existem diferença nos mecanismos que levam a osteoindução, osteocondução e
osseointegração. Os conceitos envolvidos nestes três fenômenos foram definidos por Albrektsson
e Johansson4. A osteoindução é o processo que induz à osteogênese, através do recrutamento de
células imaturas e estímulo dessas células para se desenvolverem em pré-osteoblastos. É
observada na parte inicial de qualquer tipo de cicatrização óssea. Já a osteocondução é um
fenômeno que ocorre nos implantes endósseos e significa que o osso está crescendo em uma
superfície. O termo osseointegração é baseado na ancoragem estável de um implante alcançada
através do contato direto osso-implante e depende de prévia osteoindução e osteocondução.
Tanto a osteocondução quanto a osseointegração dependem da resposta a um corpo estranho. A
resposta à osteocondução deve ser curta, porém bem sucedida para que a osseointegração seja
mantida por um longo período. Dependendo do material usado na fabricação dos implantes, estes
fenômenos podemn ou não serem obervados.
As diferentes fases da osseointegração dos implantes dentários foram descritas por
Berglundh5. Inicialmente ocorre a formação do coágulo e de um tecido de granulação, que
substitui a matriz provisória. A formação óssea é iniciada durante a primeira semana e, após 1 a 2
semanas, o tecido ósseo formado nas regiões de contato com o implante é reabsorvido e
sustituído por um novo osso viável. O osso primário constituído por trabéculas de osso imaturo é
substituído por osso e medula lamelares. Assim, concluíram que a osseointegração é um
processo dinâmico, tanto na fase de estabelecimento, quanto na fase de manutenção. Na fase de
estabelecimento, há uma interação entre reabsorção óssea nas regiões de contato e formação de
osso nas áreas livres de contato. Durante a fase de manutenção, a osseointegração é garantida
pela contínua remodelação e adaptação à função.
Durante a cicatrização perimplantar, enquanto o osso cortical cicatriza-se através de
remodelação osteonal, o osso trabecular invoca os fenômenos da osteocondução e formação de
osso “de novo”, que combinados resultam na osteogênese de contato. O osso trabecular, muitas
vezes caracterizado como osso de “baixa qualidade” para os implantes, na verdade é um tecido
biologicamente superior, pois apresenta uma rápida cicatrização em relação ao osso cortical,
explicada por sua maior vascularização. Deve-se considerar ainda que a osteocondução ocorre
através de uma espécie de resíduo transitório do coágulo sanguíneo peri-implantar, a matriz
biológica tridimensional de fibrina, por onde as células osteogênicas migram em direção ao
implante. A morfologia da superfície do implante é fundamental na retenção desta matriz de
fibrina que, por sua vez induz a atividades celulares, como a ativação de plaquetas e de
leucócitos, além de servir como guia para que as células osteogênicas possam migrar em direção
ao implante, num fenômeno chamado de osteocondução. Portanto, os resultados clínicos
dependem das características da superfície dos implantes6.
Após o preparo do leito cirúrgico e instalção do implante, o primeiro tecido a entrar em
contato com o implante é o coágulo sanguíneo, particularmente as plaquetas e a fibrina.
Dependendo da morfologia da superficie dos implantes e das propriedades indutoras, no primeiro
dia da implantação, células mesenquimais, pré-osteoblastos e osteoblastos se aderem à superfície
do implante, coberta por uma camada calcificada afibrilar, para produzir fibras de colágeno do
tecido osteóide. Após alguns dias, osso imaturo, também conhecido como “woven bone”, e osso
trabecular reparador estão presentes no espaço entre o implante e o tecido ósseo. Esse osso
trabecular é gradualmente substituído por osso lamelar maduro, sofrendo constantes
modificações através dos processos de osteogênese e reabsorção óssea, caracterizando a
osseointegração.
3.
Adesão das células na superfície dos biomateriais
A resposta celular aos biomateriais depende inicialmente da interação de receptores de
adesão com proteínas adsorvidas à sua superfície, que podem ser detectadas rapidamente após
exposição ao sangue, formando uma monocamada de proteínas adsorvidas em minutos. A
fibronectina, a vitronectina e fibrinogênio são proteínas pró-adesivas e reconhecidas por várias
integrinas celulares e plaquetas. As proteínas plasmáticas desempenham um papel principal no
recrutamento de células para a superfície do biomaterial7.
A biocompatibilidade de um material está estreitamente relacionada ao comportamento
das células em contato com a superfície, especialmente a adesão celular. As propriedades da
superfície do material influenciam no processo de adesão dos osteoblastos8. Quando um implante
é instalado em um defeito tecidual ou em um meio de cultura in vitro, inicia-se um processo de
adsorção de proteínas em sua superfície. Essa camada de proteínas controla a interação das
células do tecido adjacente com a superfície do implante. As moléculas responsáveis pela adesão
e envolvidas nesse processo são as integrinas, que podem transmitir as informações da matriz
extracelular para a célula, assim como da célula para o meio extracelular. Tais vias de sinalização
regulam o comportamento celular em contato com os biomateriais.
Após a implantação dos biomateriais, o evento quase imediato que ocorre é a adsorção de
proteínas. A natureza deste “filme condicionante” depositado nos biomateriais é responsável pela
resposta do hospedeiro, que inclui uma série de eventos celulares e da matriz, culminando na
aposição de osso no biomaterial, isto é, na osseointegração9.
3.1. Proteínas da matriz extracelular
A matriz extracelular do osso é composta por 90% de proteínas colagenosas (sendo 97%
de colágeno tipo I e 3% de colágeno tipo V) e 10% de proteínas não colagenosas (20% de
osteocalcina, 20% de osteonectina, 12% de sialoproteínas ósseas, 10% de proteoglicanas,
osteopontinas, fibronectinas, fatores de crescimento, proteínas morfogenéticas do osso). Os
osteoblastos sintetizam todas essas proteínas e a maioria delas está envolvida no processo de
adesão. Algumas dessas proteínas (fibronectinas, osteopontinas, sialoproteínas ósseas, colágeno
tipo I, vitronectinas) têm propriedades adesivas ou quimiotáticas, principalmente porque elas
contêm a sequência RGD (Arg-Gly-Asp) que é específica para a fixação de receptores de
membrana celulares como as integrinas. Diversos trabalhos consideram a importância de
peptídeos com a seqüência RGD para promoverem a adesão de células ósseas, havendo a
possibilidade de melhoria dos biomateriais, através da adsorção preliminar desses peptídeos8.
Uma das mais importantes proteínas da matriz extracelular é a fibronectina, uma
glicoproteína encontrada em solução em fluidos corporais e imobilizada em vários tecidos. Essa
grande proteína dimérica é conhecida por promover adesão e espalhamento celular em diversas
superfícies de materiais10. A fibronectina é um dímero de alto peso molecular, que se liga
principalmente às integrinas, podendo interagir com uma série de moléculas como colágeno,
proteoglicanas, fibrina, heparina, ácido hialurônico, trombospondina, plasmina, bem como com
ela mesma.
Apenas o reconhecimento do tripeptídeo RGD presente na fibronectina não satisfaz a
condição para que as células sejam instruídas a formar tecidos. Ou seja, no vocabulário da matriz
extracelular (MEC), as células respondem ao ler a palavra inteira “fibronectina”, ao invés de
lerem apenas a seqüência RGD. Os osteoblastos reconhecem e se aderem à fibronectina
adsorvida na superfície do biomaterial, porém o espalhamento celular ocorre mais rapidamente
sobre os revestimentos com fibronectina a um pH de 4,554. Existem indícios que, neste pH, a
palavra fibronectina expõe todas as suas sílabas aos osteoblastos, para que seja reconhecida por
receptores das superfícies celulares. A tradução das informações contidas na palavra
“fibronectina” e a resposta dos osteoblastos à leitura resultariam no espalhamento ou na
incorporação das células às superfícies do titânio comercialmente puro11.
A presença de alguns componentes da matriz extracelular ou de peptídeos relacionados
(RGD) na superfície do implante ativam o processo de osseointegração, pois servem como um
sinal e transmitem instruções para as células, tais como: aderir à superfície, espraiar, diferenciar e
induzir a formação de tecido ósseo12.
Além da fibronectina, outra proteína importante envolvida na osseointegração é a
sialoproteína óssea, a qual é encontrada em tecidos mineralizados, incluindo osso, dentina,
cemento. Essa proteína contém uma seqüência terminal de adesão celular (RGD) e dois domínios
de ácido glutâmico. Nucleia a formação de hidroxiapatita e estimula a remodelação óssea, bem
como promove a mediação da adesão de fibroblastos, osteoblastos e osteoclastos13.
3.2. Proteínas do citoesqueleto
Os sítios de adesão entre as células e o substrato são chamados de contatos focais ou
placas de adesão, sendo a distância de união entre ambos em torno de 10-15 nm. As faces
externas dos contatos focais apresentam proteínas receptoras específicas como as integrinas. Na
face interna, proteínas como as talinas, paxilinas, vinculinas e tensinas são conhecidas por
mediarem as interações entre filamentos de actina e integrinas. A formação de contatos focais
geralmente ocorre em células com baixa motilidade e pode ser produzida in vitro através de
proteínas da matriz extracelular como as fibronectinas ou vitronectinas8.
3.3. Proteínas da membrana celular
As moléculas de adesão são caracterizadas pela capacidade de interagirem com ligantes
específicos, que podem estar situados na membrana de células vizinhas ou serem proteínas da
matriz extracelular. Essas moléculas de adesão pertencem a diferentes famílias. Porém, em
relação aos osteoblastos, são consideradas as caderinas e integrinas. As adesões entre as células
são mediadas pelas caderinas, glicoproteínas transmembranares que agem com os parceiros
intracelulares chamados cateninas, as quais interagem com as proteínas intracelulares.
As comunicações intercelulares podem ocorrer através da troca direta de íons via “gap
junctions” ou através de sinais produzidos pela ação das caderinas. “Gap junctions” são
derivados da família de proteínas chamadas conexinas. Junções bem aderentes e apertadas ou
desmossomas fornecem uma ancoragem para as células e permitem a troca de íons ou de
pequenas moléculas entre as mesmas. Já a adesão entre célula e substrato é realizada pela família
das integrinas, que é composta por 22 heterodímeros de 2 tipos de sub-unidades e , ligadas
não covalentemente entre si. Essa diversidade de estruturas ocorre devido às várias
possibilidades de ligantes (colágeno, laminina, fibronectina, osteopontina, vitronectina,
sialoproteína, trombospondina). As integrinas agem na interface entre os meios intra e
extracelulares, podendo traduzir a adsorção de ligantes externos em informações internas que
induzem à adesão, espalhamento ou migração celulares e, conseqüentemente regulam o
crescimento e a diferenciação celulares8.
As integrinas se ligam aos sítios de ligação específicos dentro das proteínas da matriz
extracelular, principalmente à seqüência do tripeptídeos RGD. Essa interação das integrinas com
as proteínas do meio extracelular (MEC) é necessária para a expressão gênica dos osteoblastos.
Após a ligação, as integrinas se agrupam em contatos focais, áreas de contato íntimo entre
células e MEC, onde moléculas sinalizadoras e do citoesqueleto são recrutadas e ativadas. Além
disso, a ativação das integrinas também resulta na modificação do citoesqueleto, afetando a
adesão e a mobilidade celulares. Quando as integrinas são agrupadas e ativadas pelas proteínas
do MEC, também recrutam os receptores de fatores de crescimento, ampliando os efeitos
sinalizadores dos fatores de crescimento. Tanto a composição química do material, quanto sua
topografia, influenciam na interação das integrinas com o substrato e das integrinas com o
comportamento celular14.
A migração celular requer uma integração entre célula, substrato e citoesqueleto.
Primeiramente, as células desenvolvem uma protrusão formando o lamelipódio e, em seguida,
utilizam as interações adesivas para gerar tração e energia para o movimento. Por último, ocorre
a liberação dos pontos de adesões, seguida pelo destacamento e retração. As integrinas são
envolvidas nesse migração celular8.
4.
Fatores envolvidos na adesão celular
As propriedades da superfície do material como topografia, rugosidade, composição
química, cargas da superfície, energia superficial e molhabilidade são determinantes na adesão
celular e, subseqüentemente, no seu comportamento1. Em consequência o processo de
osseointegração depende das propriedades da superfície do biomatewrial. O contato das células
com a superfície do implante e a adesão celular à superfície varia que a molhabilidade da
superfície do implante e esta influencia o comportamento das células. Contudo, a adesão celular
à superfície de implantes não é suficiente para garantir a osseointegração. As células devem
receber alguns sinais ou informações para induzi-las a diferenciar e proliferar. Neste sistema, as
características da superfície do material são importantes. A topografia do implante, a energia de
superfície e a composição química desempenham um papel essencial na adesão celular em
implantes dentários, especialmente em termos de adesão de osteoblastos. Assim, adsorção,
adesão e espalhamento são as primeiras fases de interação entre a célula e o biomaterial. A
qualidade desta primeira fase irá influenciar na capacidade das células em contato com o
material, em proliferarem e diferenciarem12.
4.1. Topografia e rugosidade
Existem dúvidas quanto ao procedimento que deve ser usado para obter a melhor
resposta biológica do Ti cp, uma vez que existem vários parâmetros que influenciam no
sucesso do tratamento com implantes osseointegráveis. Quando se analisa a importância da
superfície do implante para ocorrer a osseointegração, deve-se separar a análise da influência
da forma do implante (design), morfologia da superfície, da técnica cirúrgica, condições de
carregamento e condições do osso. Na análise da influência da forma consideram-se as
dimensões do implante (comprimento, diâmetro, espessura das paredes), perfil (cilíndrico,
cônico, híbrido, coneiforme), tipo das roscas (triangular, quadrada, trapezoidal, arredondada,
microroscas, “groove”), altura dos filetes das roscas, ângulo dos filetes da rosca, passo da
rosca e tipo de conexão (hexágono externo, conexão interna na forma de hexágono, cone
Morse, star grip). Estes parâmetros influenciam na estabilidade primária, na distribuição das
forças e na resistência mecânica do implante. Quanto à morfologia da superfície devem-se
analisar a macro, micro e nanomicroestrutura, bem como a homogeneidade da superfície, as
propriedades químicas e físicas.
Segundo Cooper15, o aumento da área das superfícies de titânio melhora o contato ossoimplante e as propriedades mecânicas da interface. Em modelos de cultura, o aumento da
superfície afeta positivamente nas atividades celulares pro-osteogênicas. Em animais, aumentam
o contato osso-implante. Em superfícies rugosas existe maior quantidade de proteínas séricas e
fibronectina, comparados às superfícies lisas. Essa maior adesão celular em superfícies rugosas
de titânio pode ser explicada pela adsorção preferencial de fibronectina ao substrato rugoso16.
A morfologia da superfície do implante afeta a biocompatibilidade do titânio e a função
celular. A rugosidade altera a força de adesão celular na superfície e modifica a conexão entre
ambos. Essa força de adesão pode ser modificada pela presença de diferentes células, que são
mais numerosas quando a fibronectina está presente na superfície do implante. As diferentes
rugosidades influenciam na formação de osteoblastos e osteoclastos12.
Embora as nanoestruturas das superfícies possam regular a proliferação de osteoblastos, a
diferenciação de osteoblastos não é sensivelmente afetada na ausência de rugosidades em
microescala. No entanto, a combinação de rugosidade de superfície em escala micro e sub-micro
com uma alta densidade de estruturas em nanoescala resultam em um aditivo na diferenciação
celular e produção de fatores locais17.
4.2. Energia de superfície e molhabilidade
A medida do ângulo de contato de um líquido com a superfície é uma das formas de
quantificar a energia livre superficial dos sólidos ou a capacidade do líquido molhar o sólido.
Quando o ângulo de contato é maior que 90 graus a superfície é hidrofóbica, ao contrário
quando menor que 90 graus a superfície é hidrofílica. A diferença na molhabilidade entre
líquidos para a mesma superfície deve-se ao fato que quando uma gota é colocada em contato
com a superfície de um sólido existe a interação entre os átomos do líquido, do sólido e do ar
circunvizinho, esta interação é observada na forma de força de atração entre os átomos dos
três materiais. Quanto maior a interação do líquido com a superfície, maior é o achatamento
da gota. A gota colocada em uma superfície inclinada poderá movimentar-se ou não em
função da intensidade da força de atração entre os átomos do líquido e do sólido. Na situação
de equilíbrio, a relação entre as energias dos átomos da superfície do líquido com o ar (la), a
energia na interface do sólido com o líquido (sl) e a energia superficial sólido-ar (sa) são
correlacionadas pela equação proposta por Young:
sa = sl + la cos
Nesta equação, o valor de θ representa o ângulo de contato. O ângulo de contato, medido
experimentalmente em goniômetro, é o parâmetro empregado para quantificar a
molhabilidade.
A energia da superfície medida pela molhabilidade envolve as interações celulares com o
biomaterial, afetando vários eventos biológicos a nível celular e sub-celular, como a adsorção de
proteínas, adesão e espalhamento celulares18. A manutenção da arquitetura da camada de células
endoteliais requer adesões estáveis não somente entre células vizinhas, mas também entre células
e matriz extracelular. Enquanto a influência da molhabilidade da superfície dos biomateriais na
adesão célula-substrato tem sido bastante estudada, seu impacto na coesão célula-célula não é
muito investigada. Um modelo consistindo em vidros hidrofóbicos e hidrofílicos recobertos por
fibronectina e fibrinogênio foi utilizado para estudar a molhabilidade nas adesões celulares. Foi
demonstrado que a molhabilidade do substrato controla a adesão e organização do citoesqueleto
de células endoteliais, tendo um impacto na habilidade das células em estabelecer coesões célulacélula, devido à acessibilidade de domínios específicos de adsorção de proteínas. Enquanto que
em substrato hidrofóbico ocorreu maior coesão célula-célula, em substrato hidrofílico
predominou a adesão celular ao substrato18. Segundo Lim ET al19, as superfícies hidrofílicas
induzem o crescimento de osteoblastos e a deposição de minerais com homogeneidade espacial,
aumentando a quantidade e qualidade de mineralização em relação às superfícies hidrofóbicas.
Além disso, a energia de superfície afeta a diferenciação osteoblástica e especialmente a
mineralização.
5.
Conclusões
a) as características da superfície dos implantes dentários, como rugosidade, energia de
superfície e composição química, influenciam no comportamento das células;
b) o modo de adesão das células influencia na diferenciação, proliferação, diferenciação e
formação da matriz extracelular;
c) as características topográficas, rugosidade, energia e composição química modificam o
crescimento e alteram a função das células nos estágios iniciais de osseointegração;
d) há necessidade de pesquisas para melhorar a descrição da interação das células com as
superfícies dos implantes, bem como a análise da influencia dos diferentes parâmetros
na interação com as proteínas, estímulo na formação de osso, emprego de terapêutica
individualizada e capaz de apresentar resposta diferenciada para os pacientes
considerados críticos.
Referências
1. Elias, CN. Factors Affecting the Success of Dental Implants. In Cap 14 Implant
Dentistry A Rapidly Evolving Practice. Edited by Ilser Turkyilmaz, INTECH 2011,
p319-364.
2. Davies, J.E. Mechanisms of endosseous integration. The International Journal of
Prosthodontics. V.11. n.5. p.391-401, 1998.
3. Davies, J. E. Bone bonding at natural and biomaterial surfaces. Biomaterials. V.28.
p.5058–5067, 2007.
4. Albrektsson, T., Joahansson, C. Osteoinduction, osteoconduction and osseointegration.
Eur Spine J. V.10. p. S96-S10, 2001.
5. Berglundgh, T., Abrahamsson, I., Lang, NP., Lindhe, J. De novo alveolar bone
formation adjacent to endosseous implants. A model study in the dog. Clinical Oral
Implants Research. V.14. p.251-262, 2003.
6. Davies, J.E. Understanding peri-implant endosseous healing. Journal of Dental
Education. V. 67. n.8. p. 932-949, 2003.
7. Clem, W.C., Chowdhury, S., Mesenchymal stem cell interaction with ultra-smooth
nanostructured diamond for wear-resistant orthopaedic implants. Biomaterials. V.29.
p.3461–3468, 2008.
8. Anselme, K. Osteoblast adhesion on biomaterials. Biomaterials. V.21. p.667-681, 2000.
9. Puleo, DA., Nanci, A. Understanding and controlling the bone-implant surface.
Biomaterials. V.20. p.2311-2321, 1999.
10. Hindié, M., Degat, M., Gaudiére, F. Pre-osteoblasts on poly(L-lactic acid) and silicon
oxide: Influence of fibronectin and albumin adsorption. Acta Biomaterialia. V.7. p. 387–
394, 2011.
11. Gil, LM., Ladeira, TC, Menezes, GC., Silva Filho, F.C. A interface célula-matriz
extracelular-biomaterial e a biocompatibilidade de implantes de titânio. Innovation
Implant Journal. V.4. p.58-64, 2009.
12. Elias, CN., Oshida, Y., Lima, JHC., Muller, C.A. Relationship between surface
properties (roughness, wettability and morphology) of titanium and dental implant
removal torque. Journal of the Mechanical Behavior of Biomedical Materials. V.1. p.
234-242, 2008.
13. Rapuano, BE., Wu, C., Mac Donald, DE. Osteoblast-like cell adhesion to bone
sialoprotein peptides. Journal of Orthopaedic Research. V.22. p.353–361, 2004.
14. Feng, B., Weng, J., Yang, BC. Characterization of surface oxide films on titanium and
adhesion of osteoblast. Biomaterials. V.24. p.4663-4670, 2003.
15. Cooper, LF. A role for surface topography in creating and maintaining bone at titanium
endosseous implants. The Journal of Prosthetic Dentistry. V.84. p.522-534, 2000.
16. Deligiani, DD., Katsala, N., Ladas, S. Effect of surface roughness of the titanium alloy
Ti-6Al-4V on human bone marrow cell response and on protein adsorption.
Biomaterials. V.22. p. 241-1251, 2001.
17. Gittens, RA., Mclachlan, T., Olivares-Navarrete, R. The effects of combined micron/submicron-scale surface roughness and nanoscale features on cell proliferation and
differentiation. Biomaterials.V.32. p.3395-3403, 2011.
18. Tzoneva, R., Faucheux, N., Groth, T. Wettability of substrata controls cell–substrate and
cell–cell adhesions. Biochimica et Biophysica Acta. V.1770. p.1538-1547, 2007.
19. Lim, JY., Shaughnessy, MC., Zhou, Z. Surface energy effects on osteoblast spatial
growth and mineralization. Biomaterials. V.29. p.1776-1784, 2008.
ANALYSIS OF CELLULAR MECHANISMS OF IMPLANTS DURING
OSSEOINTEGRATION
Carlos Nelson Elias, Viviane de Souza L. de Vasconcellos, Celso R de Souza Resende
Engenharia Mecânica e Ciência dos Materiais, Instituto Militar de Engenharia, Rio de Janeiro, RJ, Brasil
E-mail: [email protected]
There are differences in success rates of dental implants available. These differences may be
associated with the characteristics on the macro and nano scale of the implants. The macro
differences is the material, design, the profile of the screw threads, dimensions of the implants
and fixation of prosthetic components. The differences in the micro and nano scale are
identified in the morphology of the implant surface, which influence the mechanisms of
interaction with cells during healing and tissue repair. The objective of this study is to
analyze the different mechanisms involved in osseointegration and the interactions of cells
with the surface of dental implants of commercially pure titanium. The analysis of the
extracellular matrix proteins, cell membrane and cytoskeletal explain why the titanium with
or without surface treatment has osseointegration and this phenomenon is not observable on
other metals. The layers of adhesion, proliferation and differentiation of bone cells and
adhesion proteins are closely related to the titanium with surface properties of implants, such
as roughness, chemical composition, surface energy and wettability.
Keywords: osseointegration, proteins, cell adhesion, cell interactions, dental implants