ÍNDICE
1. REAÇÕES QUÍMICAS
1.1. Aspetos qualitativos de uma reação química
1.2. Aspetos quantitativos de uma reação química
2. ASPETOS ENERGÉTICOS DE UMA REAÇÃO QUÍMICA
8
8
18
25
2.1. Energia envolvida numa reação química
25
2.2. Reações endotérmicas e exotérmicas
29
3. REAÇÕES INCOMPLETAS E EQUILÍBRIO QUÍMICO
32
3.1. Reversibilidade das reações químicas
32
3.2. Aspetos quantitativos do equilíbrio químico
34
3.3. Equilíbrios e desequilíbrios de um sistema reacional
42
Atividade experimental 1
50
Atividade experimental 2
51
EXTENSÃO E.Q3 – EQUILÍBRIO QUÍMICO HETEROGÉNEO
1. EQUILÍBRIO QUÍMICO HETEROGÉNEO
55
1.1. Equilíbrio de solubilidade
55
1.2. Alguns fatores que alteram o equilíbrio de solubilidade
60
1.3. A importância do equilíbrio de solubilidade
62
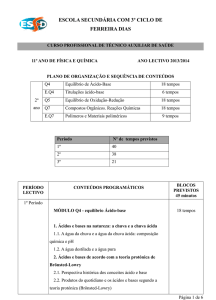
MÓDULO Q4 – EQUILÍBRIO ÁCIDO-BASE
1. ÁCIDOS E BASES NA NATUREZA: A CHUVA E A CHUVA ÁCIDA
66
1.1. A água da chuva e a água da chuva ácida: composição química e pH
66
1.2. A água destilada e a água pura
67
2. ÁCIDOS E BASES DE ACORDO COM A TEORIA PROTÓNICA DE BRÖNSTED-LOWRY
68
2.1. Perspetiva histórica dos conceitos ácido e base
68
2.2. Produtos do quotidiano e os ácidos e bases segundo a teoria protónica (Brönsted-Lowry)
69
3. IONIZAÇÃO E DISSOCIAÇÃO
3.1. Reações de ionização/dissociação
4. AUTOIONIZAÇÃO DA ÁGUA
70
70
72
4.1. Constante de equilíbrio para a reação de ionização da água: produto iónico da água – Kw
72
4.2. Relação entre as concentrações de ião hidrónio e de ião hidroxilo: o pH e o pOH
74
5. EQUILÍBRIO DE ÁCIDO-BASE
76
5.1. Constante de acidez, Ka, e constante de basicidade, Kb
76
5.2. Força relativa de ácidos e de bases
77
6. COMPORTAMENTO ÁCIDO, BÁSICO OU NEUTRO DE ALGUMAS SOLUÇÕES DE SAIS
81
6.1. Formação de sais por meio de reações ácido-base; reações de neutralização
81
6.2. Comportamento ácido-base de aniões e de catiões em solução aquosa
82
7. INDICADORES DE ÁCIDO-BASE E MEDIÇÃO DE pH
85
7.1. Indicadores colorimétricos de ácido-base
85
7.2. Aparelho medidor de pH; sensor de pH
86
Atividade experimental 1
87
Atividade experimental 2
89
Atividade experimental 3
89
CPQ345 © Porto Editora
MÓDULO Q3 – REAÇÕES QUÍMICAS. EQUILÍBRIO QUÍMICO HOMOGÉNEO
EXTENSÃO E.Q4 – TITULAÇÕES ÁCIDO-BASE
1. TITULAÇÕES ÁCIDO-BASE
1.1. Caracterização das volumetrias de ácido-base
1.2. Carácter ácido, básico ou neutro da solução titulada no ponto de equivalência
1.3. Indicadores ácido-base
Atividade experimental 1
Atividade experimental 2
92
92
92
93
98
101
MÓDULO Q5 – EQUILÍBRIO DE OXIDAÇÃO-REDUÇÃO
1. REAÇÕES DE OXIDAÇÃO-REDUÇÃO
1.1.
1.2.
1.3.
1.4.
1.5.
1.6.
1.7.
1.8.
Perspetiva histórica dos conceitos de oxidação e redução
Estados de oxidação e Tabela Periódica
Regras para a determinação dos números de oxidação
Espécie oxidada ou redutor e espécie reduzida ou oxidante
Semirreação de oxidação e semirreação de redução
Escrita e acerto de equações de oxidação-redução
Pares conjugados de oxidação-redução
Reação de dismutação
2. A COMPETIÇÃO PELA TRANSFERÊNCIA DE ELETRÕES
2.1. Forças relativas de oxidantes e de redutores: poder oxidante e poder redutor
2.2. Série eletroquímica
2.3. Constante de equilíbrio de reações de oxidação-redução: extensão da reação
3. AS REAÇÕES DE OXIDAÇÃO-REDUÇÃO NA NATUREZA, NO QUOTIDIANO E NA INDÚSTRIA
3.1. O metabolismo, a fotossíntese e a respiração como processos biológicos naturais de oxidação-redução
3.2. A importância das reações de oxidação-redução em situações do quotidiano
3.3. Extração de metais a partir dos respetivos minérios
Atividade experimental 1
Atividade experimental 2
104
104
105
106
108
108
109
112
112
113
113
114
117
117
117
118
118
121
121
EXTENSÃO E.Q5 – ELETROQUÍMICA
1. CÉLULAS ELETROQUÍMICAS
1.1.
1.2.
1.3.
1.4.
1.5.
1.6.
1.7.
1.8.
1.9.
Perspetiva histórica
Constituição de um elemento de pilha
Reações de elétrodo e representação esquemática do elemento de pilha
Elétrodo-padrão de hidrogénio
Potencial-padrão de elétrodo
Força eletromotriz de um elemento de pilha
Tabela de potenciais-padrão de elétrodo
Células de combustível
Corrosão e sua prevenção
CPQ345 © Porto Editora
2. ELETRÓLISE
2.1. Reações de oxidação-redução provocadas por uma corrente elétrica
2.2. Eletrólise de sais em fusão
2.3. Eletrólise de soluções aquosas
2.4. Aplicações industriais da eletrólise
2.5. Lei de Faraday para a eletrólise
Atividade experimental 1
Atividade experimental 2
124
124
125
125
126
127
128
129
130
131
132
132
133
134
134
135
136
138
SOLUÇÕES
139
ANEXOS
142