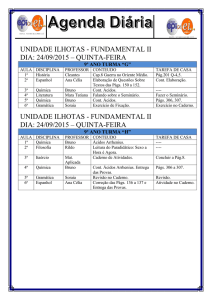
Transformações Químicas e o Mundo à Nossa Volta
E S C O L A
BÁSICA 3/S
A N T E R O
DE QUENTAL
Nome:______________________ Nº _____ Turma ____ Data ___/___/___
NOTA HISTÓRICA SOBRE AS NOÇÕES DE ÁCIDO E BASE
Ao longo dos séculos, ácidos e bases foram definidos tendo em conta algumas propriedades
detectadas pelos sentidos. O termo ácido (do latim acidus) está associado ao sabor azedo, amargo de certas
substâncias. Os povos da Antiguidade conheciam apenas uma substância ácida, o vinagre. Se colocarmos
uma gota de limão ou de vinagre na língua, sente-se um sabor “azedo” ou “amargo”. O termo base,
sinónimo de alcali (do árabe al Kali), que significa cinzas de plantas, referia-se inicialmente a parte do
composto, o alcali dá a sua “base” ao sal.
Desde o séc. XII D.C., que os árabes da Península Ibérica preparavam o óleo de vitríolo (ácido
sulfúrico), a água forte (ácido nítrico) e a água régida (mistura dos ácidos nítrico e clorídrico). Das bases
preparavam-se a potassa (carbonato de potássio), a partir de cinzas de plantas e a cal (óxido de cálcio), por
aquecimento de conchas marinhas.
No séc. XVII D.C., Glauber preparou o ácido muriático (ácido clorídrico) por reacção do ácido
sulfúrico com o sal marinho. O outro produto da reacção (sulfato de sódio) ficou conhecido por sal de
Glauber.
No final do séc. XVIII D.C., Lavoisier sugeriu que os ácidos eram compostos oxigenados, que
avermelham o tornesol e se combinam com as bases originando sais. Foi Lavoisier quem deu nome ao
oxigénio. Oxigénio quer dizer gerador de ácidos.
No início do séc. XIX D.C., Humphry Davy provou a hipótese de Bertholet (segundo a qual
existiam ácidos que não continham oxigénio), ao descobrir o cloro e a composição do chamado ácido
muriático (ácido clorídrico). Assim, os trabalhos de Lavoisier e de Davy levaram ao estabelecimento de
duas classes de ácidos, os oxoácidos que contêm oxigénio e os hidrácidos que não contêm oxigénio.
Em 1838, J. Von Liebig, define ácido como toda a substância que contenha hidrogénio capaz de ser
substituído por metais.
Em 1887, o químico sueco Svante Arrhenius, baseando-se nos seus trabalhos
sobre electrólito, apresenta uma nova teoria sobre ácidos e bases. Segundo
Arrhenius, os ácidos produzem iões H+ em solução aquosa e as bases produzem iões
OH- em solução aquosa.
A teoria de Arrhenius veio mostrar-se muito útil no estudo quantitativo dos
ácidos e bases, mas apresenta algumas limitações, só é aplicável em solução aquosa,
não explica o comportamento alcalino de substâncias que não possuem iões OH-,
nem o comportamento ácido de substâncias que não produzem hidrogénio. Como por
exemplo, a amónia (NH3 ) não contém iões hidroxilo, porém em solução aquosa ela
Svante Arrhenius
pode produzir iões hidroxilo reagindo com a água.
Um conceito mais geral de ácidos e bases foi apresentado em 1923, pelo
químico dinamarquês Joannes BrØnsted e pelo químico inglês Thomas Lowry. Na teoria de BrØnstedLowry, um ácido é um dador de protões e uma base é receptor de protões. Esta teoria é aplicável,
independentemente do solvente, ou seja, ao contrário das definições de Arrhenius, as definições de
BrØnsted não restringem o comportamento dos ácidos e bases às soluções aquosas.
Ainda em 1923, G. N. Lewis propôs outra generalização para o comportamento ácido-base. Assim,
ácido de Lewis é um receptor de pares de electrões e base de Lewis é um dador de pares de electrões.
Transformações Químicas e o Mundo à Nossa Volta
Questões:
1- Qual a origem da palavra ácido?
_____________________________________________________________________________________
_____________________________________________________________________________________
2- Indica o nome actual das seguintes soluções?
Óleo de vitríolo - _______________________________________
Água forte - ___________________________________________
Água régida - __________________________________________
Potassa - ______________________________________________
Ácido muriático - _______________________________________
Sal de Glauber - ________________________________________
3- Os trabalhos de Lavoisier e de Davy levaram ao estabelecimento de duas classes de ácidos, indique-as?
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
4- Define ácido e base segundo Arrhenius?
_____________________________________________________________________________________
_____________________________________________________________________________________
5- Indica algumas das limitações da teoria de Arrhenius?
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
Bom trabalho!!!
Adaptado de: FARIA, A. M. M.; et al. (1993). Química 10ºAno. (1ªEdição). pp. 154. Amadora: RAIZ Editora; TEODORO, V. D.,
SANTOS, A. M. N. dos (1994). Química 10ºAno. (1ª Edição). pp. 147. Lisboa: Didáctica Editora, LAVORENTI, A. (2002).
Conceito de Ácidos e Bases. pp. 1-7. Piracicaba: Publicação Destinada ao Ensino de Ciências – Química e GIL, Victor M. S.
(1996). Química – 12º Ano. (1º Edição). pp. 300. Lisboa: Plátano Editora.
Transformações Químicas e o Mundo à Nossa Volta
Resolução
Questões:
6- Qual a origem da palavra ácido?
O termo ácido provém do latim acidus, e está associado ao sabor azedo de certas substâncias.
7- Indica o nome actual das seguintes soluções?
Óleo de vitríolo - ácido sulfúrico
Água forte - ácido nítrico
Água régida - mistura dos ácidos nítrico e clorídrico
Potassa - carbonato de potássio
Ácido muriático - ácido clorídrico
Sal de Glauber - sulfato de sódio
8- Os trabalhos de Lavoisier e de Davy levaram ao estabelecimento de duas classes de ácidos, indique-as?
Os oxoácidos que contém oxigénio e os hidrácidos que não contém oxigénio.
9- Define ácido e base segundo Arrhenius?
Os ácidos segundo Arrhenius produzem iões H+ em solução aquosa e as bases produzem iões OHem solução aquosa.
10- Indica algumas das limitações da teoria de Arrhenius?
O facto de só ser aplicável em solução aquosa, não explica o comportamento alcalino de
substâncias que não possuem iões OH-, nem o comportamento ácido de substâncias que não
produzem hidrogénio.
Bom trabalho!!!