Universidade Federal Rural do Semi­Árido – UFERSA 1. Reações de Alcenos 1.1 Reações de Adição Eletrofílica Diferentemente dos alcanos (que sofrem reações de substituição) os alcenos sofrem reações de adição eletrofílica. Este tipo de reação são características de compostos insaturados. Exemplo Geral: C
C
+
A
B
adição
A
C
C
B
Duas características da ligação dupla ajudam a compreender porque tais reações de adição ocorrem: a) Uma reação de adição é o resultado da conversão de uma ligação pi (π) e uma ligação sigma (σ) em duas ligações sigma. O calor liberado ao se fazer duas ligações σ excede o calor necessário para quebrar uma ligação σ e uma ligação π (porque ligações π são mais fracas) e, assim, as reações de adição são geralmente exotérmicas C
C
ligação pi
+
X
Y
adição
C
C
X
Y
duas ligações sigmas
ligação sigma
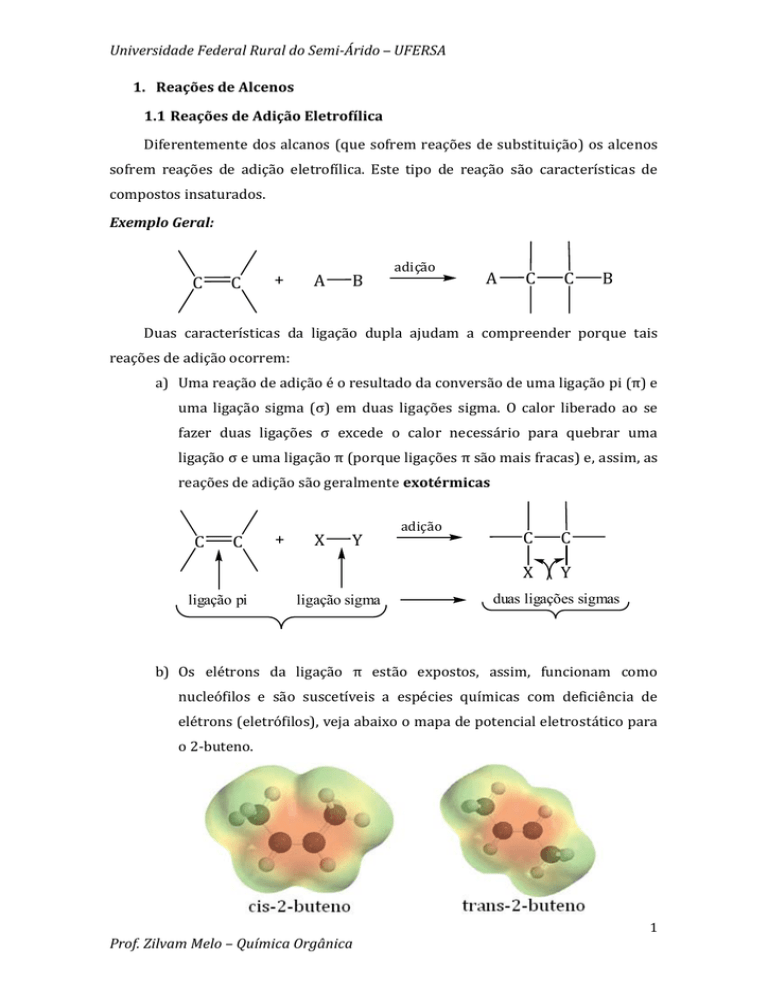
b) Os elétrons da ligação π estão expostos, assim, funcionam como nucleófilos e são suscetíveis a espécies químicas com deficiência de elétrons (eletrófilos), veja abaixo o mapa de potencial eletrostático para o 2‐buteno. Prof. Zilvam Melo – Química Orgânica 1 Universidade Federal Rural do Semi­Árido – UFERSA De acordo com o mapa de potencial eletrostático, quanto mais vermelha for a região na molécula maior é a concentração de carga negativa. Esta concentração de carga negativa é devido a ligação π. Assim, ligações π podem atacar centros deficientes de elétrons. Essa reatividade faz de alcenos uma importante classe de substâncias orgânicas porque pode ser usado para sintetizar uma grande variedade de outras substâncias, por exemplo, haletos de alquila, alcoóis, éteres e alcanos. O tipo de produto obtido depende somente do eletrófilo e do nucleófilo utilizado. 1.2 Adição Iônica de Haletos de Hidrogênio a Alcenos Simétricos Os haletos de hidrogênio (HI, HBr, HCl e HF) se adicionam à ligação dupla dos alcanos: C
+
C
HX
C
C
H
X
A adição de HX a um alceno simétrico ocorre adicionando o eletrófilo (H+) ao carbono da dupla ligação (sp2) e o nucleófilo (X‐) é adicionado ao outro carbono da dupla ligação. Não faz nenhuma diferença em qual carbono o eletrófilo se liga porque será obtido o mesmo produto em qualquer caso. Exemplo 1: Adição de HBr ao eteno. H
H
C
+
C
H
HBr
H
H
H
H
C
C
H
Br
H
bromoetano eteno
Exemplo 2: Adição de HI ao eteno. H
+
HI
I
cicloexeno
iodocicloexano 2 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Mecanismo: O mecanismo é definido por duas etapas. Na primeira etapa ocorre o ataque ao eletrófilo. Como o hidrogênio do HBr é menos eletronegativo do que o bromo então ele fica deficiente de elétrons, por tanto, nesta reação o H+ é o eletrófilo. A dupla ligação, como já foi visto, é o nucleófilo. O ponto principal da primeira etapa é a formação do carbocátion. A formação do carbocátion é a etapa lenta da reação o que determina a velocidade da reação. o
1 Etapa
H2C
δ+
H
CH2
δ−
H2C
Br
H
+
CH2
Na segunda etapa, ocorre o ataque do bromo no carbocátion. Esta é a etapa rápida da reação. 2o Etapa
H2 C
+
CH2
Br
H
H2 C
CH2
H
Br 1.3 Adição Iônica de Haletos de Hidrogênio a Alcenos Assimétricos: A Regra de Markovnikov A adição de HX a um alceno assimétrico poderia ocorrer alternativamente por dois modos, mas na prática só um predomina. Exemplo 3: Adição de HBr ao propeno H2C
CHCH3 + HBr
CH3CHCH3
Br
2‐bromopropano
(muito formado)
+
CH3CH2CH2Br
bromopropano
(muito formado)
Para entender qual produto será o majoritário devemos descrever o mecanismo desta reação. 3 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Mecanismo: H
H
δ+
H
CH3
C
C
H
H
+
C
C
H
H
CH3
Br
Br H
H
C
C
H
H
H
Br
C
C
H
H
CH3
δ−
Br
Lenta
H
H
H
C
+
C
H
H
Primeira etapa:
formação do carbocátion
CH3
Br
H
CH3
Segunda etapa:
ataque do Br ‐ ao carbocátion
Este comportamento é explicado pela Regra de Markovnikov que diz que a adição iônica de um reagente assimétrico à dupla ligação, a porção positiva do reagente de adição se liga ao átomo de carbono da ligação dupla de modo a formar o carbocátion mais estável. Assim, Na adição de um haleto de hidrogênio a um alceno, pode‐se, vulgarmente, dizer que o átomo de hidrogênio irá se adicionar ao átomo de carbono com maior número de átomos de hidrogênio ligados diretamente ao carbono da dupla ligação. Átomo de carbono
com maior número de
átomos de hidrogênio
H2C
H
CHCH3
Br
H2C
CHCH3
H
Br
Produto da Adição
de Markovnikov
Quanto mais estável for o estado de transição (carbocátion), menor será a energia livre de ativação, e, por tanto, mais rápida a reação. Como a energia livre de ativação para a formação do carbocátion secundário é menor (mais estável) do 4 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA que para a formação do carbocátion primário, o carbocátion secundário será formado mais rapidamente. Então, em uma reação de adição eletrofílica, o carbocátion mais estável será formado mais rapidamente. Como a formação do carbocátion é a etapa determinante da velocidade da reação, as velocidades relativas de formação de dois carbocátions determinam as quantidades relativas dos produtos que serão formados. Figura 01: mostra as energias livres de ativação para dois estados de transição (carbocátions). Se a diferença das velocidades for pequena, os dois produtos se formarão, mas o produto majoritário será o formado pela reação do nucleófilo pelo carbocátion mais estável. Se a diferença das velocidades for suficientemente grande, o produto formado pela reação do nucleófilo com o carbocátion mais estável será o único produto formado. Por exemplo, quando HCl se adiciona ao 2‐
metilpropeno, as velocidades de formação de dois carbocátions intermediários – um primário e outro terciário – são suficientemente diferentes para fazer com que o 2‐cloro‐2‐metilpropano seja o único produto da reação, veja abaixo: CH3
H3C
C
CH3
CH3
CH2
+ HCl
H3 C
C
CH3
Cl
único produto
formado
H3C
C
H
CH2Cl
não se forma
5 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA 2. Outros Tipos de Reações de Adição Eletrofílica a Alcenos De forma análoga ao mesmo mecanismo que acabamos de estudar, alcenos podem sofrer reações de adição H
C
OSO3H
H OH
HA (cat.)
C
H
C
C
OSO 3H
H
C
C
OH
X
C
C
X
bissulfato
de alquila
álcool
Alceno
X
X
dialeto de alquila
Na adição de halogênios, e diferença nos mecanismos é que forma‐se o íon bromônio em vez do carbocátion, devido este ser mais estável. Veja o mecanismo para a adição de bromo (Br2) ao eteno. δ−
Br
δ+
Br
1o Etapa
H2C
CH2
H2 C
CH2
+
+
Mapa de potencial eletrostático do íon bromônio no 2‐buteno +
Br
Br
2o Etapa
H2C
CH2
+
Br
-
H
Br
-
H
Br
C
C
Br
H
H
3. Adição de Radicais Livres Aos Alcenos: Adição Anti­Markovnikov do Brometo de Hidrogênio Após inúmeras pesquisas os cientistas descobriram que a adição de HBr a alcenos poderiam ocorrer de forma inversa à adição de Markovnikov. Este comportamento ocorre devido presença de peróxidos orgânicos nos alcenos, 6 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA gerando radicais livres. Este tipo de reação foi chamado de reações de adição anti­
Markovnikov. Descobriu‐se também que este tipo de reação só funciona para o HBr. Sob estas condições, o propeno, por exemplo, produz 1‐Bromopropeno. Na ausência de peróxidos, ou na presença de compostos que “capturam” os radicais, ocorre a adição de Markovnikov normal. R O O H
um hidroperóxido orgânico
R O O R
um peróxido orgânico
CH3CH
CH2
+ HBr
CH3CH
CH2
+ HBr
ROOR
CH3CH2CH2Br adição anti‐Markovnikov
sem
peróxido
CH3CHCH3
adição Markovnikov
Br
Mecanismo: 1o Etapa
R
OO
Calor
R
2R
O
o calor provoca a clivagem homolítica da ligação fraca
oxigênio‐oxigênio
2o Etapa
R
R
O + H Br
OH +
Br
o radical alcoxila (RO) extrai um átomo do HBr,
produzindo um átomo de bromo radical.
3o Etapa
Br
+
H2C
C
CH3
Br CH2
C
H
H
um átomo de bromo une‐se à ligação dupla para produzir o
radical secundário mais estável
CH3
7 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA 4o Etapa Br
CH2
C
CH2 +
H Br
Br
CH2
H
H
C
CH3
H
o radical secundário extrai um átomo de hidrogênio do HBr.
Isso leva a produzir e regenerar um átomo de bromo radical.
Depois as repetições das etapas 3 e 4 levam à reação em cadeia.
4. Reação de Adição de Hidrogênios (Hidrogenação) Na presença de catalisadores metálicos como platina, paládio ou níquel, o hidrogênio (H2) se adiciona à ligação dupla de um alceno para formar um alcano. Os detalhes do mecanismo da hidrogenação catalítica não são completamente compreendidos. Sabe‐se que o hidrogênio é adsorvido na superfície do metal e que o alceno se complexa com o metal sobrepondo seus orbitais p aos orbitais vazios do metal. As quebras das ligações π do alceno e a ligação σ do H2, bem como a formação das ligações σ C‐H, ocorrem na superfície do metal. O alcano produzido se difunde da superfície do metal ao ser formado. 5. Polimerização de Alcenos Via Adição Radicalar Os polímeros (do grego: poli = muitos e meros = parte) são substância que consistem em moléculas muito grandes chamados macromoléculas que são constituídas de várias subunidades que se repetem. As subunidades moleculares que são usadas para sintetizar os polímeros são chamadas de monômeros, e as 8 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA reações para obtenção de polímeros são chamadas de polimerização. Os plásticos, as borrachas, as proteínas, os DNA’s e RNA’s são exemplos de polímeros. Muitas reações de polimerizações são iniciadas por radicais. O etileno (eteno), por exemplo, é o monômero que é usado para sintetizar o conhecido polietileno. unidades
monoméricas
m H2C
CH2
polimerização
etileno
(monômero)
CH2CH2
CH2CH2
n
polietileno
(polímero)
CH2CH2
onde m e n são números muito grandes. Como os polímeros tais como o polietileno são feitos por reações de adição, são chamados de polímeros de crescimento de cadeia. A tabela abaixo mostra alguns polímeros deste tipo: 9 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA 6. Oxidação de Alcenos Os alcenos sofrem várias reações em que a ligação dupla carbono‐carbono é oxidada. A seguir, mostraremos varias reações como estas. 5.1 Oxidação de Alcenos Por Permanganato de Potássio (KMnO4) O permanganato de potássio pode ser utilizado para oxidar os alcenos a 1,2­
diois que são, comumente, chamados de glicóis. Este processe se dá em soluções básicas a frio. H2C
CH2
frio
OH‐, H2O
+ KMnO4
eteno
HC
CH
OH OH
1,2‐etanodiol
(etilenoglicol) O mecanismo para a formação de glicóis através das oxidações pelos íons permanganato envolve, inicialmente, a formação de intermediários cíclicos. Em seguida, ocorrem, em diversas etapas, a clivagens na ligação metal oxigênio (representadas pelas linhas tracejadas a seguir), produzindo‐se, por fim, o glicol e MnO2. Mecanismo Simplificado: 5.2 Clivagem Oxidativa dos Alcenos Os alcenos com átomos de carbono monosubstituídos são clivados (quebrados) oxidativamente a sais de ácidos carboxílicos por soluções básicas de 10 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA permanganato de potássio a quente. Podemos ilustrar esta reação com a clivagem oxidativa do cis ou trans‐2buteno, formando dois equivalentes molares do íon acetato. A acidificação da mistura, depois da oxidação estar completa, produz 2 mols de ácido acético para cada mol de 2‐buteno. O grupo CH2 é totalmente oxidado a dióxido de carbono (CO2) e água pela solução básica de permanganato de potássio a quente. O átomo de carbono dissubstituído de uma ligação dupla torna‐se o grupo carbonila de uma cetona. 5.3 Oxidação de Alcenos por Ozonólise Um método amplamente usado para localizar a ligação dupla de alcenos envolve o uso do ozônio (O3). O ozônio reage vigorosamente com os alcenos gerando compostos instáveis de baixo peso molecular que muitas vezes explodem violentamente. Devido a esta propriedade eles normalmente não são isolados, mas sim reduzidos diretamente por tratamento com zinco e ácido acético (ácido etanóico ‐ HOAc). A redução gera a formação de compostos carbonílicos (aldeídos ou cetonas) que podem ser isolados e identificados com segurança. 11 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Exemplo 1: Exemplo 2: 5.4 Oxidação de Alcenos por Combustão Como visto anteriormente, a combustão completa de qualquer composto orgânico necessita da presença de oxigênio e gera dióxido de carbono (CO2), água e calor. Veja a seção 2.2. Exemplo: A combustão do etileno (eteno). H
H
C
H
+
C
3O2
2CO2
+
H
2H2O
6 Referências 1. SOLOMONS, T. W.; GRAHAM; CRAIG FRYHLE. Química Orgânica. 8. ed. Rio de Janeiro: LTC, 2005. 1 e 2 v. 2. BRUICE, P. Y. Química Orgânica. 4. ed. São Paulo: Pearson, 2006 3. ALLINGER, N. L. Química Orgânica. 2. ed. Rio de Janeiro: Guanabara, 1978. 12 Prof. Zilvam Melo – Química Orgânica