www.visbrasil.blog.br
COMENTÁRIOS
TECNOLOGIA PARA RASTREABILIDADE DE MEDICAMENTOS ESTÁ DEFINIDA
Brasília , 25 de novembro de 2009
O código de barras bidimensional, também chamado Datamatrix, será a tecnologia usada para garantir a
rastreabilidade dos medicamentos comercializados no Brasil. A definição consta da RDC 59, publicada nesta
quarta-feira (25), que implanta o Sistema Nacional de Controle de Medicamentos. A tecnologia será a principal
ferramenta para garantir a rastreabilidade desses produtos, ou seja, vai permitir recuperar informações históricas
e geográficas sobre o caminho percorrido pelos medicamentos desde sua produção até a entrega ao
consumidor. Ao contrário do código de barras comum, que é visível e contém apenas um número, o
bidimensional pode armazenar milhares de informações ao mesmo tempo, como números, letras e outros dados.
Todas as informações vão estar reunidas no Identificador Único de Medicamento (IUM), que estará em cada
unidade de medicamento comercializada e será impresso em etiquetas de segurança produzidas
especificamente para esse fim. Além de permitir uma gestão mais eficaz dos riscos na cadeia dos produtos
farmacêuticos e dar ao consumidor a garantia de segurança, o código vai permitir identificar fontes de desvios de
qualidade e reduzir os custos logísticos dos fabricantes. Etiquetas de segurança Também nesta quarta-feira
(25) a Anvisa assinou um termo de cooperação com a Casa da Moeda, que deverá ser a instituição responsável
pela produção e distribuição das etiquetas que vão garantir a segurança do sistema de rastreamento e nas quais
estará impresso o IUM. Histórico Para aprimorar continuamente os mecanismos de rastreabilidade e
autenticidade de medicamentos no país foi criado o Sistema Nacional de Controle de Medicamentos, por meio da
lei 11903/09. A lei prevê que o Sistema será implantado gradualmente em até três anos, sendo o primeiro ano
destinado à definição dos requisitos que envolvem os fabricantes e fornecedores de medicamentos
Ascom/Assessoria de Imprensa da Anvisa
LEI nº 11.903, DE 14 DE JANEIRO DE 2009
DOU 15 de janeiro de 2009
Dispõe sobre o rastreamento da produção e do consumo de medicamentos por meio de tecnologia de captura,
armazenamento e transmissão eletrônica de dados.
O PRESIDENTE DA REPÚBLICA
Faço saber que o Congresso Nacional decreta e eu sanciono a seguinte Lei:
Art. 1o É criado o Sistema Nacional de Controle de Medicamentos, envolvendo a produção, comercialização,
dispensação e a prescrição médica, odontológica e veterinária, assim como os demais tipos de movimentação
previstos pelos controles sanitários.
Art. 2o Todo e qualquer medicamento produzido, dispensado ou vendido no território nacional será controlado
por meio do Sistema Nacional de Controle de Medicamentos.
Parágrafo único. O controle aplica-se igualmente às prescrições médicas, odontológicas e veterinárias.
Art. 3o O controle será realizado por meio de sistema de identificação exclusivo dos produtos, prestadores de
serviços e usuários, com o emprego de tecnologias de captura, armazenamento e transmissão eletrônica de
dados.
§ 1o Os produtos e seus distribuidores receberão identificação específica baseada em sistema de captura de
dados por via eletrônica, para os seguintes componentes do Sistema Nacional de Controle de Medicamentos:
I – fabricante (autorização de funcionamento, licença estadual e alvará sanitário municipal dos estabelecimentos
fabricantes);
II – fornecedor (atacadistas, varejistas, exportadores e importadores de medicamentos);
III – comprador (inclusive estabelecimentos requisitantes de produtos não aviados em receitas com múltiplos
produtos);
IV – produto (produto aviado ou dispensado e sua quantidade);
V – unidades de transporte/logísticas;
VI – consumidor/paciente;
VII – prescrição (inclusive produtos não aviados numa receita com múltiplos produtos);
VIII – médico, odontólogo e veterinário (inscrição no conselho de classe dos profissionais prescritores).
§ 2o Além dos listados nos incisos do § 1o deste artigo, poderão ser incluídos pelo órgão de vigilância sanitária
federal outros componentes ligados à produção, distribuição, importação, exportação, comercialização,
prescrição e uso de medicamentos.
Art. 4o O órgão de vigilância sanitária federal competente implantará e coordenará o Sistema Nacional de
Controle de Medicamentos.
www.visbrasil.blog.br
COMENTÁRIOS
Parágrafo único. O órgão definirá o conteúdo, a periodicidade e a responsabilidade pelo recebimento e auditoria
dos balanços das transações comerciais necessários para o controle de que trata o art. 3o desta Lei.
Art. 5o O órgão de vigilância sanitária federal competente implantará o sistema no prazo gradual de 3 (três) anos,
sendo a inclusão dos componentes referentes ao art. 3o desta Lei feita da seguinte forma:
I – no primeiro ano, os referentes aos incisos I e II do § 1o;
II – no segundo ano, os referentes aos incisos III, IV e V do § 1o;
III – no terceiro ano, os referentes aos incisos VI, VII e VIII do § 1o.
Art. 6o O órgão de vigilância sanitária federal competente estabelecerá as listas de medicamentos de venda livre,
de venda sob prescrição e retenção de receita e de venda sob responsabilidade do farmacêutico, sem retenção
de receita.
Art. 7o Esta Lei entra em vigor na data de sua publicação.
Brasília, 14 de janeiro de 2009; 188o da Independência e 121o da República.
Luiz Inácio Lula da Silva
A Lei 11.903/09 é sucinta, possui apenas sete artigos.
A sua principal finalidade é dar instrumentos legais para a ANVISA fazer cumprir o
que outras leis já determinam: os medicamentos só devem ser vendidos ou dispensados
mediante a prescrição médica. Isto para evitar as iatrogenias que se entendem como:
Lacaz, Corbett e Teixeira (1970)
“Doenças e manifestações desencadeadas pelo emprego dos
medicamentos em geral (aplicados de modo criterioso ou
inadequado), das radiações, do sangue, dos contrastes radiológicos,
dos anestésicos e, por outro lado, as que podem ser induzidas por
atos cirúrgicos ou pela ação pouco prudente do médico, por
mecanismo de sugestão, através de impactos emocionais,
constituindo este grupo as chamadas doenças psicogênicas”
Reações Adversas às Drogas (RAD)
“Efeito indesejado produzido por uma droga administrada em doses
padrão, que tipicamente necessita de redução ou interrupção do
agente suspeito e que muitas vezes requer tratamento para seus
efeitos deletérios. Está implícito um maior risco de prejuízos ao
paciente se continuada a terapia com a droga ou aplicada
futuramente”. (Diasio, 1995)
Considerando-se que a automedicação é prática prevalente em nosso país,
alguns problemas decorrentes do uso abusivo de medicamentos não se enquadram nas
definições de iatrogenias e RAD, visto que não foram de responsabilidade do médico
prescritor. O conjunto destas definições, mais os efeitos indesejáveis e nocivos decorrentes
da automedicação, podem ser classificados como “doenças ou manifestações fármacoiatrogênicas ou farmacoses” ( Liberalli, 1970 ).
COMENTÁRIOS
www.visbrasil.blog.br
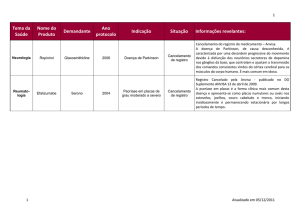
Farmacoses:
Todas as farmacoses
IATROGENIAS
REAÇÕES ADVERSAS
AUTOMEDICAÇÃO
As iatrogenias são tão importantes que a Lei n.º 6.360/76 no artigo 79 determina:
“Todos os informes sobre acidentes ou reações nocivas causadas por
medicamentos serão transmitidos à autoridade competente.
Parágrafo único. As mudanças operadas na qualidade dos
medicamentos e qualquer alteração de suas características físicas
serão investigadas com todos os detalhes e, uma vez comprovadas,
serão objeto das medidas corretivas cabíveis”
Foi Paracelsus quem primeiro estabeleceu o conceito de reação adversa:
“Todas as substâncias são venenos; não existe nada que não seja veneno. Somente a
dose correta diferencia o veneno do remédio.”
Paracelsus (1493-1541)
A lei 11.903/09 aproveita os sistemas e procedimentos já existentes para,
reordenando-os, atender aos propósitos do Sistema Nacional de Controle de
Medicamentos.
•
O código de barras para identificação de produtos e empresas já existe
oficialmente há décadas, inclusive para medicamentos,.
•
As informações sobre data de produção, prazo de validade e lote
correspondente já constam obrigatoriamente das embalagens dos produtos
e nas etiquetas ditas “logísticas” apensadas nos grandes pacotes de venda
no atacado já vêm impresso o código de barras.
•
Todos os estabelecimentos na cadeia de produção, distribuição, venda e
dispensação podem ser identificados pelo respectivo nº do CNPJ.
www.visbrasil.blog.br
COMENTÁRIOS
•
Todos os prescritores, médicos, farmacêuticos, odontólogos, veterinários ou
demais profissionais de saúde têm nº de CPF e a maioria dos consumidores
também.
•
As transações comerciais são atualmente registradas pela Nota Fiscal
eletrônica, de caráter obrigatório.
•
A indústria e comércio já trabalham com sistemas em tempo real para
contabilização e reposição de mercadorias e o Ministério da Saúde tem um
sistema “on line” funcionando para o Programa da Farmácia Popular do
Brasil.
O que é atribuído à responsabilidade da ANVISA no Art. 4º da lei 11.903/09
pretende que o órgão não tenha maiores dificuldades para implantar o que de resto já está em
vigor. Coisa simples e fácil de fazer.
Mas...
Durante o seminário sobre o Sistema Nacional de Controle de Medicamentos
acontecido no dia 20 de agosto de 2009 no Senado Federal
(http://www.integrabrasil.com.br/seminario%20agosto%202.htm)
ficou evidente que duas situações estão ligadas à implantação desse sistema: o uso
adequado de medicamentos e o combate às fraudes. E pelo que se depreende das
exposições dos interessados, principalmente a indústria e o comércio, a ênfase maior é
referente ao combate às fraudes e contrafações de medicamentos.
Talvez motivada pelas preocupações do setor produtivo, embrenhou-se a ANVISA
na construção de um sistema anti-fraude e abandonou os objetivos da Lei 11.903/09. Tanto
que exumou do oblívio a proposta da criação de um “selo de segurança” para ser fixado nas
embalagens dos medicamentos.
O tal “selo” foi originalmente proposto há dez anos atrás pelo então ministro da
saúde José Serra após uma viagem que fizera aos E.E.U.U. onde ficara entusiasmado com a
apresentação de uma empresa americana de segurança que por coincidência era a única
fabricante de tal dispositivo.
Isto significaria, à época, um dispêndio adicional ao custo global de produção de
medicamentos da ordem de centenas de milhões de dólares. A idéia não prosperou no âmbito
da Direção Colegiada da ANVISA de então.
Mas eis que ressurge fortalecida e adotada, com instigantes detalhes como se
depreende do Art. 11 e seguintes da Resolução da Diretoria Colegiada nº 59 de 25/11/2009
http://www.in.gov.br/imprensa/visualiza/index.jsp?data=25/11/2009&jornal=1&pagina=58&totalArquivos=104.
Em primeiro lugar surge a figura do Identificador Único de Medicamento – IUM, algo
inopinadamente trazido para o âmbito da regulamentação da Lei sem explicação lógica para
sua existência.
E, em segundo lugar, a espantosa idéia de imprimir o código de barras na própria
etiqueta de segurança.
Veja-se o que provavelmente ocorrerá.
Segundo os dados da FEBRAFARMA em 2007 foram vendidas 1,65 bilhões de
unidades de medicamentos. Isto significa que a Casa da Moeda ou empresas por ela
sublocadas e autorizadas pela ANVISA deverão fornecer um número igual ou maior do que
este de etiquetas de segurança onde estarão impressos os dados do produto. Serão centenas
de milhões de etiquetas confeccionadas regularmente para atender às especificações da
apresentação do produto, nº de lote, datas de fabricação e de validade e tudo isto em volumes
imensos, em diferentes pontos geográficos, com a garantia que não haverá equívocos.
www.visbrasil.blog.br
COMENTÁRIOS
O combate às fraudes de medicamentos é um problema mundial mas o uso
indiscriminado de remédios no Brasil é alarmante com conseqüências sobejamente
conhecidas.
A Lei 11.903/09 por ser simples é perfeitamente aplicável nas formas preconizadas
mas a ANVISA preferiu complicá-la ao ponto de antes mesmo de ser cumprida ter a grande
possibilidade de se tornar ineficaz.
As empresas produtoras de etiquetas devem estar festejando.
É o caso de se perguntar, como faziam os antigos romanos:
QUI PRODESTE? (quem se beneficia?).