E.E.E.M.
1º Material de Física 3º anos
Profª. Adriana Martins
NOME:______________________Nº____TURMA:____
Uma visão humana da história do átomo
O homem busca desde seus primórdios saber do que e como as coisas que lhe
rodeiam são feitas. Durante muito tempo, filósofos acreditaram que as substâncias
eram formadas por só um elemento, este elemento era chamado por eles de arché.
A seguir destaco os archés de alguns desses filósofos. Para uma melhor
compreensão você pode ler o livro de Ático Chassot que se encontra na bibliografia.
Thales de Mileto (640-548a. C.) – O seu arché era a água. Sem
evocar poderes sobrenaturais deu uma explicação geral sobre a
natureza, dizendo que a água é o princípio formador de tudo.
Segundo ele encontrávamos água em tudo, numa folha de árvore,
num animal, etc.
Fig. 1 -Thales de Mileto
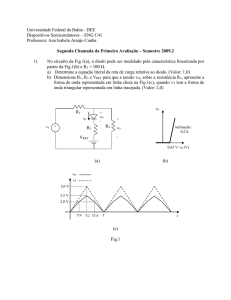
Anaxímenes (588-525 a.C.) – O seu arché era o ar. Discípulo de
Anaximandro, para este não poderia ser a água de Thales ou o
apeíron de Anaximandro, a substância originária para ele, era o ar
infinito (pneuma apeiron) que se apresentando ora mais denso, hora
menos denso formaria todas as coisas.
Fig.2 - Anaxímenes
Heráclitos (540-475 a.C.) – O seu arché era o fogo. “não nos
banhamos duas vezes no mesmo rio” ( a cada banho estamos
diferentes e o rio Também muda) frase de Heráclito para explicar que
tudo muda tudo flui. E o fogo provoca essas mudanças, o fogo tem,
nesse caso, um sentido de energia.
Fig.3 - Heráclitos
Xenófanes (570-480 a.C.) – O seu arché era a terra: “...tudo sai da terra
e tudo volta à terra...” ou em outra forma: tudo vem da terra e na terra
tudo termina...(http://www.filonet.pro.br/psocraticos/textos/xenofanes.rtf )
Fig.4 - Xenófanes
Já Anaximandro (610-547 a.C.), discípulo de Thales, acreditava que
o arché não se constitui de elementos materiais, como ar, água,
terra ou fogo, mas é um elemento indeterminado ou ilimitado apeiron - algo indefinido, infinito, universal, eterno e dotado de
movimento.
Fig.5 - Anaximandro
1
Outros filósofos acreditavam que a matéria era constituída por quatro
elementos: terra, água, ar e fogo. Entre estes se destaca Empédocles
(490-435 a.C.) e Aristóteles (384-322 a.C.) este acreditava que os
elementos possuíam lugar definido no universo. Suas idéias eram tão
profundas que durante muito tempo foram aceitas.
Fig.6 - Empédocles
Fig.7 - Aristóteles
Para Aristóteles o que era mais pesado ficava embaixo, a terra e a
água seriam os elementos que ele considerava mais pesados. Sendo
que a água ficava acima da terra. Já o ar e o fogo ficavam em cima,
uma vez que eram mais leves. O fogo ficava acima do ar. Desta forma
ele explicava que as diferentes substâncias do nosso mundo eram
resultadas de diferentes combinações destes quatro elementos, um
corpo era mais pesado porque continha mais terra ou mais leve por
conter mais fogo. Vale lembrar que a terra da qual falava Aristóteles
não é um punhado de terra comum e sim “uma substância mais
refinada e sublime, liberta das misturas e impurezas que caracterizam
a terra vulgar”.
As idéias de Pitágoras (582 - 497 a.C.) também perduraram muito
tempo sua unidade material era a mônada. Dela vem o elemento
indeterminado que serve de substrato material aos números. Dos
números nascem os pontos, as linhas, as formas, as figuras planas e as
espaciais, das quais procede tudo o que existe. Para Pitágoras os
números eram elementos concretos, e tudo é formado por eles.
Fig.8 - Pitágoras
Fig.9 -Demócrito
O primeiro pensador a usar a palavra átomo (do grego,
não divisível: a – não, tomo – divisão, parte) foi
Demócrito. Ele concordou com Leucipo de Mileto,
considerado o criador do atomismo. Leucipo
acreditava que se partíssemos a matéria várias vezes
chegaríamos a um pedaço que seria impossível partir
novamente.
Assim sendo, Demócrito deu nome a menor partícula
de Leucipo.
Fig.10 -Leucipo
E assim a humanidade continuou sua busca sempre tentando responder a perguntas
como:
- Como surgiu o mundo?
- Do que ele é constituído?
Na última página há um esquema que nos ajudará a formar uma idéia de como
foi a evolução destes pensamentos.
Você escolhe se verá primeiramente o esquema ou seguirá na leitura desse
texto.
2
O esquema conceitual da última página busca dar uma visão geral dos modelos
atômicos através da seqüência cronológica e breve descrição de cada um deles.
(Pense: O que é um modelo? Para que serve?).
A história dos modelos atômicos mostra que os cientistas não se preocupam
apenas em responder as antigas questões da origem, "funcionamento" e futuro do
Universo, mas também que esses modelos devem levar em conta as leis e princípios
bem estabelecidos na Física Clássica.
Por isso, a cada novo modelo estabelecido, antecede uma (ou algumas!)
questão que colocou em dúvida algum aspecto do modelo anterior.
Assim, os modelos atômicos foram se tornando construções humanas cada vez
mais complexas.
Acredita-se que a Física é uma ciência em permanente construção.
O modelo atual de átomo diz que toda matéria existente no Universo é formada
por combinações diferentes de seis quarks e seis léptons (Não se assuste!). Mas
nada garante que os cientistas nucleares tenham deixando de questionar algum ponto
chave na construção desse modelo.
As teorias e modelos surgem de perguntas.
Tentando responder essas perguntas, o homem-cientista construiu a Física, e
continua construindo.
Observando o esquema da última página, não devemos pensar que
os modelos ali apontados foram os únicos a surgir em cada época.
As teorias ali seqüenciadas sempre competiram com outras teorias
contemporâneas a si. Especialmente a teoria atômica do químico
John Dalton (1808), que como Demócrito acreditava que o átomo era
indivisível, encontrou oposições extremamente tenazes.
Fig.11 –John Dalton
Fig.12 – Willian Thomson
Havia outras teorias, só para citar: a teoria dos "turbilhões" de
William Thomson (Lorde Kelvin – da unidade de medida de
temperatura kelvin - K) e a da química "matemática" de Brodie
(pesquise sobre essas teorias). Muitos outros cientistas foram
contra as idéias de Dalton e se recusavam a aceitar a idéia de
moléculas. Mesmo depois de Mendeleev organizar a tabela
periódica dos elementos químicos e o elétron estar prestes a
entrar em cena, os antiatomistas recusavam a idéia de Dalton.
Dentre os químicos de renome da época, estava Saint-Claire
Deville, que mesmo após 1860, disse: "Não admito nem a lei de
Avogadro, nem os átomos, nem as moléculas; recuso-me a crer
naquilo que não posso ver nem imaginar”.
Fig.13 – Sant-Claire Deville
Ainda hoje, apesar de várias teorias atômicas já terem sido construídas, é no
mínimo surpreendente, para a maioria das pessoas, a idéia da construção desses
modelos sem que possamos observar sequer o átomo (que mede em torno de 10-10m,
ou seja; 0,0000000001m!!), muito menos poderíamos observar o núcleo (10-14m) e os
elétrons (<10-15m).
Aliás, muitos se perguntam: Como é possível medir aquilo que não podemos
ver?
3
Toda a Física Moderna - que inclui a Física de Partículas, a Relatividade
Especial e Geral e a Física Quântica - são previsões baseadas em leis e princípios.
O primeiro modelo propriamente dito a considerar o átomo
formado por partes, foi Thomson, em aproximadamente 1897.
O modelo de Thomson ficou conhecido como modelo do
“pudim de ameixas”, tendo a massa do pudim carga positiva
(não se falava em prótons nessa época) e os elétrons (muito
pequenos) eram as ameixas do pudim, ficando aleatoriamente
espalhados na massa possuindo carga negativa.
Fig.14 – Joseph John Thomson
Para verificar se a forma do átomo era mesmo
como a de um pudim de ameixas, a equipe de
Rutherford em 1911 (o elemento 104 da tabela
periódica recebeu o nome de rutherfórdio em sua
homenagem), bombardeou átomos de ouro com
partículas alfa ().
Fig.16 – Ernest Rutherford
Fig.15 – Modelo de Thomson
O polônio era a fonte dessas partículas , que na época não se sabia
exatamente o que eram. (Hoje sabemos que núcleos instáveis espontaneamente
decaem emitindo partículas , isso chamamos de Radiação). Existem três tipos de
partículas: (alfa), (beta) e (gama). Elas diferenciam-se principalmente pelo poder
de penetração na matéria, sendo a a menos penetrante e a a mais penetrante.)
Segundo as previsões de Rutherford, as partículas deveriam atravessar o átomo,
sendo apenas um pouco desviadas caso colidissem com algum elétron.
Na verdade, o que Rutherford verificou após
analisar o anteparo o qual as partículas eram
capturadas, após atravessar o átomo, é que
algumas dessas partículas voltavam ao invés de
serem apenas desviadas. Este resultado era por
demais surpreendente! Simule o experimento
de
Rutherford
no
seguinte
endereço:
http://ciencias.huascaran.edu.pe/modulos_brasil/qui
Fig.17 – Experimento de
mica/estrutura_atom/umolhar.htm
Rutherford
Como é possível um elétron refletir uma partícula ?
Era exatamente como se uma bola de canhão colidisse com uma folha de papel
e voltasse!
Rutherford imaginou então que uma colisão no interior do núcleo, com alguma
“coisa” muito massiva, fazia algumas partículas retornarem. Rutherford previu a
existência de um núcleo, onde estava concentrada quase toda a massa do átomo. Os
elétrons circundavam o núcleo, ocupando a maior parte do átomo.
Fig.18 – Partículas atravessando placa de ouro
segundo o modelo de átomo de J. J. Thomson
Fig.19 – Partículas atravessando placa de ouro
segundo o modelo de átomo de Rutherford
4
Se a maior parte do átomo é ocupada por elétrons, e se esses são muitas vezes
mais leves que o núcleo, concluiu-se que a maior parte do átomo é espaço vazio!!!
Com o objetivo de conhecer mais
profundamente o núcleo atômico Rutherford
os bombardeou também com partículas .
Ele constatou que essas partículas quando
colidiam com núcleos de nitrogênio, faziam
ejetar desse núcleo, além das partículas ,
partículas de hidrogênio. Isso levou à
constatação de que o núcleo de nitrogênio
era formado por núcleos de hidrogênio.
Esses núcleos de hidrogênio foram
chamados de prótons.
Fig.20 – Parece que esse átomo não gostou
de ter sido atravessado pela partícula !!!!!
Mas, o modelo de Rutherford tinha problemas. Devido à força Coulombiana, o
modelo não se apresentava estável, pois elétrons colapsariam para o núcleo! A força
Coulombiana recebe este nome por ter sido ‘descoberta’ e estudada por Charles
Coulomb, no século XVIII. Ela nos diz que cargas de mesmo sinal se repelem e que
cargas de sinais opostos se atraem (você lembra daquele ditado popular: os opostos
se atraem? E se não forem opostos, o que acontece?).
Além disso era também conhecimento da
época, da teoria eletromagnética de
Maxwell, que cargas em movimento
circular irradiam energia, ou seja , perdem
energia, dessa forma o elétron descreveria
órbitas cada vez menores até atingir o
núcleo o que acarretaria um colapso da
matéria.
Fig.21 - Colapso do elétron devido à perda de energia por
radiação.
Fig.22 – Max Karl Plank e Albert Einstein.
Através da idéias de Planck e
Einstein
sobre
a
Mecânica
Quântica, Bohr em 1913, propôs
órbitas
quantizadas
para
os
elétrons. Dessa forma eles só
podem ter valores bem definidos de
energia e mudar de órbitas através
de saltos quânticos, emitindo ou
absorvendo energia para conservar
sua energia total.
Fig.23 – Niels Bohr.
A Conservação da Energia nos diz que a energia não
vem do nada, ou seja, não surge sem que outra energia tenha
sido necessária para originá-la. E também que a energia não
desaparece, acaba, e sim que se transforma em outros tipos
de energia.
Fig.24 – Modelo de Bohr para o ouro, cada
camada tem uma quantidade específica de
energia. É a quantização do átomo.
5
Porém, o modelo de Bohr não dava conta de explicar por que o núcleo dos
átomos não explodia devido à repulsão entre os prótons coexistentes no núcleo, afinal
prótons tem cargas de mesmo sinal, positiva, e se repelem.
A partir de 1932, com a evidência experimental do nêutron por Chadwick (que
foi colaborador de Rutherford), foi também prevista a existência de uma nova força de
atração, que existia no núcleo dos átomos e era responsável pela interação entre
prótons do mesmo núcleo, permitindo que coexistissem confinados. Essa força foi
chamada de Força Forte, uma vez que tinha de ser maior que a repulsão
coulombiana, mas precisava ter curto alcance, só atuava dentro do núcleo.
O modelo atual atômico começou a ser construído a partir daí.
Fig.25 - Um átomo moderninho.
Hoje se aceita que o núcleo dos átomos é formado por prótons e nêutrons,
chamados nucleons e que os prótons e nêutrons também não são elementares. Ou
seja, são formados por outras partículas, chamadas partículas elementares.
O elétron, nosso principal personagem, dos nossos estudos futuros, é uma
dessas partículas elementares. Se você quiser saber mais especificamente sobre a
história do elétron, veja este site: http://www.ufpel.tche.br/ifm/histfis/cron-el.htm
Os elétrons formam uma nuvem ao redor do núcleo. Assim nós não sabemos onde
exatamente o elétron está em determinado instante e sim qual é a região de maior
probabilidade de encontrá-lo.
Fig.26 - Um átomo atual.
Fig.27 – A evolução do modelo do átomo.
Na última temos representada por pontos, as regiões de maior
probabilidade de se encontrar o elétron e no seu centro a equação da onda do
elétron – a equação de Schrödinger.
Linda não é?
Hoje, é muito mais fácil aceitarmos as novas previsões do que no início das
investigações sobre o átomo.
Prova disso é que foi necessário mais de 2000 anos para a comunidade
científica aceitar o átomo como formado por partes, e não unidade fundamental.
A maior dificuldade agora está em construir equipamentos para corroborar (para
enriquecer seu vocabulário procure no dicionário o significado desta palavra)
experimentalmente as previsões feitas pelo Modelo Atual.
6
Bibliografia
CHASSOT, Ático. A ciência através dos tempos. São Paulo: Moderna, 1994.
192 p.
PEDUZZI, L.O.Q. As Concepções Espontâneas, a Resolução de Problemas
e a História e a Filosofia da Ciência em um Curso de Mecânica. Florianópolis:
UFSC. Programa de Pós Graduação em Educação. 1998 (Tese de Doutorado).
OSTERMANN, Fernanda. Partículas Elementares e interações fundamentais.
Porto Alegre: Instituto de Física - UFRGS, 2001.
THUILLIER, Pierre. De Arquimedes a Enstein a face oculta da invenção
científica. Rio de Janeiro: Jorge Zahar, 1994. 257p.
RAMALHO JUNIOR, Francisco; FERRARO, Gilberto Nicolau; SOARES, Paulo
Antônio de Toledo. Os fundamentos da física 3. São Paulo: Moderna,2003. 460p.
HEWITT, Paul G. Física Conceitual. Porto Alegre: Bookman, 2002. 685 p.
Fig.1 – Thales de Mileto, fig.2 – Anaxímenes, fig.7 – Aristóteles, fig.8 – Pitágoras,
http://www.stenudd.com/myth/greek/anaximenes.htm
Fig.3 – Heraclitus:
http://faculty.frostburg.edu/phil/forum/Emerson.htm
Fig.4 – Xenófanes:
http://www.terramedia.co.uk/quotations/Quotes_X.htm
Fig.5 – Anaximandro:
http://schillermedien.de/forum/index.php?action=showthread&threadid=923&board=Schreibwerkstatt-Forum
Fig.6 – Empédocles:
http://cires.htmlplanet.com/BioE.htm
Fig.9 – Demócrito:
http://library.thinkquest.org/13394/angielsk/ancient.html
Fig.10 – Leucipo:
http://www.biografiasyvidas.com/biografia/l/leucipo.htm
Fig.11 – John Dalton:
http://chimie.scola.ac-paris.fr/sitedechimie/hist_chi/biographies/biog_dalton.htm
Fig.12 – Willian Thomson:
http://store.aip.org/OA_HTML/ibeCCtpItmDspRte.jsp?site=AIP&respid=50212&item=82125
Fig.13 – Saint-Claire Deville:
http://www.wsip.com.pl/serwisy/czaschem/c001stcl.html
Fig.14 – Joseph John Thomson:
http://www.physique.usherbrooke.ca/~dsenech/HS/figs/Thomson.jpg
7
Fig.15 – Modelo de Thomson:
http://educar.sc.usp.br/licenciatura/2001/modeloatomico/modelo_de_thomson.html
Fig.16 – Ernest Rutherford:
http://www.newgenevacenter.org/reference/20th-1st2.htm
Fig.17 – Experimento de Rutherford:
http://www.mundodoquimico.hpg.ig.com.br/modelo%20de%20rutherford.htm
Fig.18 – Partículas alfa no átomo de Thomson, Fig.19 – Partículas alfa no átomo
de Rutherford:
http://www.cecs.cl/web/cecs_index.php?area=educacion&dep=main&idioma=es&
pagina=mon_exp&id=27
Fig.20 – Átomo sendo bombardeado:
http://spiff.rit.edu/classes/phys314/images/rutherford.jpg
Fig.21 – Elétron ‘caindo’ em direção ao núcleo:
http://library.thinkquest.org/19662/low/eng/exp-rutherford.html
Fig.22 – Plank e Einstein:
http://www.th.physik.uni-frankfurt.de/~jr/gif/phys/einst_planck.jpg
Fig.23 – Niels Bohr:
http://nobelprize.org/physics/laureates/1922/bohr.gif
Fig.24 – Modelo Quantizado de Bohr:
http://www.archlsa.de/funde-der-monate/12.04/bilder/bohr-gold.jpg
Fig.25 - Um átomo moderninho.
http://www.kirlian.com.br/imagens/esquema_atomo.gif
Fig.26 – Um átomo atual, fig.27 – A evolução do modelo atômico:
HEWITT, Paul G. Física Conceitual. Porto Alegre: Bookman, 2002. 685 p.
8