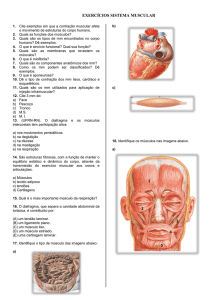
A UNIDADE MOTORA E SUAS SÍNDROMES
INTRODUÇÃO
A unidade motora (UM) é constituída por um conjunto de fibras musculares inervadas por um
motoneurônio, sendo essa a menor unidade funcional do aparelho locomotor. A UM é
considerada a via motora final comum voluntária e involuntária descrita por Charles Sherrington.
As estruturas
que estão envolvidas em uma unidade motora são compostas de dois
componentes: um muscular e um neural. O primeiro contém: o músculo, o sarcômero, o sistema
T e o retículo sarcoplasmático; e o segundo: o fuso muscular, a unidade motora propriamente
dita, o órgão neurotendíneo de Golgi, células de Renshaw, miótomos, o nervo periférico, a
junção neuromuscular e a asa anterior da medula espinhal.
MÚSCULOS
Um músculo é constituído por centenas a milhares de fibras musculares individuais. Cada fibra é
um sincício multinucleado de forma quase cilíndrica e envolvida numa cobertura de tecido
conectivo chamado de endomísio, o qual se estende por uma longa distância num fascículo
muscular. Em corte transversal as fibras são poligonais; seu diâmetro varia dependendo de vários
fatores, mas é relativamente constante num mesmo músculo. Um fascículo muscular é um grupo
de fibras musculares reunidas dentro de uma bainha denominada de perimísio, contendo no seu
interior, ramos nervosos intramusculares, capilares e fusos musculares. Já o epimísio separa
grupos de fascículos e também proporciona uma cobertura para todo o músculo. O epimísio de
superfície é contínuo com a fáscia, que cobre os músculos, e com os tendões que o ancora na
origem e na inserção. Os núcleos das fibras musculares situam-se em fileira na periferia da célula,
logo abaixo do sarcolema. A membrana basal encontra-se na parte externa do sarcolema e, entre
ambas as membranas, existem células satélites totipotenciais adormecidas, as quais podem
atuar na regeneração de lesão muscular. Cada fibra muscular é composta por milhares de
1
miofibrilas, as quais são compostas por milhares de miofilamentos ou elementos contráteis, que
constituem os sarcômeros (Fig.1).
Sarcômero
Fig. 01
O
sarcômero
unidade
é
a
bioquímica
contrátil do músculo
estriado
ou
(esquelético
cardíaco).
Cada
sarcômero é composto
de filamentos finos e
Lent, 05
grossos, interdigitados
entre
si, delimitado
por duas linhas perpendiculares chamadas de linhas Z, e cada linha Z divide uma banda I. O
filamento grosso é uma proteína chamada miosina, peso molecular de 500.000, constituída de
dois fragmentos: meromerosina pesada com atividade ATPásica, e a meromerosina leve que não
tem essa atividade. A miosina é uma proteína com forma que lembra um pequeno bastão de
golfe, com a cauda orientada para o centro do filamento e uma cabeça globular flexível orientada
para fora. Na cabeça globular existe atividade ATPásica e forma a base molecular da ponte
cruzada. O filamento fino é uma proteína chamada actina, peso molecular de 60.000, que se
origina em cada lado da linha Z e dirige-se para o centro do sarcômero, deixando um espaço
entre ambas. Outras proteínas estão associadas com a actina para regular o processo de
contração muscular: tropomiosina e troponina. As moléculas ou monômeros de actina são
ordenados no filamento fino de forma helicoidal.
Em resumo, veja na figura abaixo, os distintos níveis de organização estrutural de um músculo
esquelético. O músculo é constituído de fibras musculares. Cada fibra contém em seu citoplasma
miofibrilas. Essas são compostas por unidades que se repetem ao longo das miofibrilas, os
sarcômeros. Esses são formados por filamentos finos e grossos, interdigitados entre si. A
disposição típica desses filamentos origina as características bandas do sarcômero. Na banda I,
filamentos finos; na banda A, filamentos finos e grossos; na banda H, filamentos grossos; na
2
banda M, observam-se as conexões existentes
Fig. 02
entre os filamentos de miosina na parte
central do filamento grosso; na banda Z, existe
uma trama formada por filamentos Z que se
liga aos filamentos finos.
À direita, aparece
amplificada e em três dimensões, a disposição
relativa dos filamentos finos e grossos da
banda A. Cada filamento grosso encontra-se
circundado por seis filamentos finos, e cada
um desses, por três grossos (Fig.2).
As moléculas de tropomiosina, peso molecular
de 70.000, são longas e estão unidas entre si,
Cingollani, 05
estendendo-se ao longo de todo o filamento
fino por sete monômeros da molécula de
actina. A molécula de troponina é formada por três componentes, a troponina T, a I e a C. A
troponina T é a que une o complexo troponínico à tropomiosina; a I é assim denominada porque
inibe, junto com a tropomiosina, a interação entre actina e a miosina; a C recebe esse nome
porque tem a capacidade de unir-se ao íon cálcio, veja na figura abaixo. Além dessas proteínas
contráteis e reguladoras, existem outras proteínas associadas ao sarcômero como titina ou
conectina e nebulina. Cada molécula de titina estende-se ao longo de todo o seu filamento,
desde a linha Z a linha M, e forma um terceiro filamento no sarcômero. As moléculas de titina de
cada metade do sarcômero, o ancora na linha Z. As suas propriedades elásticas explicam parte da
tensão-comprimento do músculo estriado em repouso. A nebulina encontra-se desde a linha Z
até o extremo livre do filamento fino que contribui para o comprimento desse filamento (Fig.3).
Fig. 03
3
Cingollani, 05
Uma proteína chave do citoesqueleto é a distrofina, uma molécula grande que forma uma malha
de reforço imediatamente abaixo do sarcolema, ligando o sarcômero ao sarcolema e a matriz
extracelular. A distrofina não está diretamente conectada ao sarcolema, mas sim ancorada em
cada extremidade por um complexo glicoprotéico. A distrofina parece dar suporte mecânico ao
sarcolema, para ajudar a estabilização e dar-lhe firmeza contra as forças da contração muscular.
A distrofina é controlada por um gene, com pelo menos 2300 kb e 79 exons, que codifica uma
proteína com 3685 aminoácidos que produz quatro componentes distintos. O aminoácido
terminal está ligado aos filamentos citoplasmáticos de actina e no outro lado ligado a um
complexo de proteínas e glicoproteínas chamadas de proteínas associada à distrofina e
glicoproteínas associada a distrofina. Na transcrição, cada um com o seu próprio promotor, que a
distrofina influencia um número distinto de funções. A distrofina cortical é encontrada no
hipocampo, amígdala, tálamo, hipotálamo, neocórtex, e nas células de Purkinge do cerebelo.
Distúrbios genéticos dessas proteínas do citoesqueleto são subjacentes a muitas das distrofias
musculares. Veja na figura abaixo, um defeito na proteína distrofina, em uma menina de 13 anos,
com uma distrofia muscular forma de cinturas e, ao lado direito, existe infiltração de tecido
adiposo entremeando a musculatura (Fig.4).
Sarcolema,
sistema
T
e
retículo
Fig. 04
sarcoplasmático
A membrana da célula muscular, sarcolema,
apresenta
invaginações que penetram
no
interior da célula formando os túbulos T,
curiosamente sobre a Lina Z. Em volta do
sarcolema, existe uma membrana rica em
glicoproteína
e
mucopolissacarídeos,
chamada lâmina basal, veja na figura 1. O retículo sarcoplasmático (RS) é um conjunto de túbulos
anastomosados entre si, que envolvem as miofibrilas como um manguito. São orientados
longitudinalmente e anastomosam-se
na sua parte central e dilatam-se nas extremidades,
formando as cisternas terminais, orientadas em sentido transversal. As cisternas aparecem
formando pares em ambos os lados do túbulo T: essa estrutura recebe o nome de tríade. Entre
4
os túbulos T e o RS, existem estruturas denominadas de pés. As quais são formadas por uma
proteína que é conhecida como o canal liberador de cálcio do RS. Devido à alta afinidade por um
alcalóide, rianodina, essa proteína também é conhecida como receptor de rianodina. Esses
receptores são formados por quatro polipeptídeos, que lembra um trevo de quatro folhas, e em
cada unidade do trevo existe um sítio que se liga a uma molécula de cálcio e um onde a rianodina
se liga. Cada uma das unidades dos pés está associada a uma proteína denominada FKBP12,
responsáveis pela regulação dos canais de cálcio do RS. Para finalizar, existe uma proteína
chamada triadina que desempenha um papel importante no acoplamento excitação-contração
do músculo (Fig.5).
Contração muscular
Fig. 05
O
mecanismo
contração
básico
muscular
da
ocorre
devido à interação cíclica entre
as cabeças da miosina, pontes
cruzadas,
com
a
actina,
associada à hidrólise de ATP. As
forças geradas dessa interação
são
Cingollani, 05
as
que
causam
o
deslizamento dos filamentos de
actina sobre os de miosina. A
ponte cruzada liga-se ao filamento fino, gira sobre seu próprio eixo, de modo que desenvolve
tensão e traciona o filamento que, desliza sobre o filamento grosso e no final se desliga, para
voltar a ligar-se a outro ponto do filamento fino, reiniciando o ciclo. As pontes cruzadas das
metades opostas do sarcômero giram em direções opostas e, dessa maneira, aproximam do
centro cada metade do sarcômero. Uma molécula de ATP liga-se a cabeça da miosina que inibe a
união com a actina. A miosina hidrolisa o ATP em ADP+Pi, que não se dissociam imediatamente,
formando um complexo intermediário de miosina e ADP+Pi. Após a fase de repouso, a miosina
liga-se à actina e hidrolisa seu ATP em ADP e Pi livre, e grande quantidade de energia é liberada
para haver o deslizamento do filamento fino sobre o grosso, ocorrendo o estado de rigor
5
muscular. O complexo miosina-actina espera por outra molécula de ATP para voltar ao estado
ativo e iniciar nova contração.
Sem ATP o complexo miosina-actina possui baixo nível de energia, permanecendo estável até
que uma nova molécula de ATP se ligue à miosina. Cada sarcômero sem contração,
progressivamente adquire o estado de rigor mortis, que é a rigidez extrema vista após a morte. A
somação de sarcômeros sem contração atinge as fibrilas, em seguida as fibras musculares,
depois músculos para caracterizar o estado de rigor mortis: visto após a morte biológica. Durante
a vida existe a necessidade de inibição da contração provocada pela avidez de ATP que tem a
miosina. Isso não acontece devido à presença de duas proteínas: troponina e tropomiosina. O
músculo em repouso, o complexo troponina-tropomiosina encobre fisicamente o sítio ativo da
actina, bloqueando a interação entre miosina-actina. Após a excitação neural o cálcio intracelular
aumenta sua concentração e liga-se a troponina C. Essa ligação promove uma modificação do
complexo troponina-tropomiosina que determina o deslocamento da tropomiosina. O músculo
retorna ao estado de relaxamento quando a concentração de cálcio citoplasmático volta ao
normal.
FUSO MUSCULAR
São estruturas complexas descritas por Kühne em 1887, órgãos receptores, cuja função é
detectar as variações do comprimento do muscular, quando aumentado ou diminuído. Um fuso
muscular (FM) mede 4 a 7 mm de comprimento e 80 a 200 milimicra de diâmetro. O FM é
composto de 4 a 10 fibras musculares ou células musculares estriadas envoltas, na sua parte
mediana, por uma cápsula de tecido conectivo contendo líquido no interior. Esse líquido é uma
substância gelatinosa formada por acido hialurônico, que facilita o deslizamento das fibras
intrafusais (FIF) quando se contraem. Atua como uma proteção mecânica e isola o fuso das FEF,
mantendo constante a composição do meio que circunda as FIF: a alteração desse meio reduz as
respostas do fuso. Essa cápsula isola mecanicamente, as FIF ou fascículo de Weismann-Koelliker,
das fibras musculares esqueléticas ou extrafusais (FEF). O número de fuso é maior nos músculos
responsáveis pelos movimentos mais delicados. As FIF estão dispostas em paralelo com as FEF e
ambas se ligam, direta ou indiretamente, aos tendões. Cada FIF é fibra embrionária, delgada,
muito rica em citoplasma, contendo numerosos núcleos; apresentam dois pólos contráteis ricos
6
em miofibrilas separados por uma região equatorial desprovida de miofibrilas e onde se
localizam os núcleos. Distinguem-se dois tipos de FIF: as fibras com aglomerado nuclear com 6 a
10 mm de comprimento e 25 milimicra de diâmetro, e as fibras com núcleo em cadeia, com 3 a 4
mm de comprimento e 12 milimicra de diâmetro. O número de miofibrilas foi tomado como
índice qualitativo da viscosidade ou elasticidade relativo de uma dada região de fibra. Quanto
maior o número de miofibrilas, maior a viscosidade; de modo inverso, quanto menor o número
de miofibrilas, maior a elasticidade (Fig.6).
Fig. 06
Inervação sensitiva do fuso muscular
As terminações sensitivas primárias ou terminações anuloespirais ou em aglomerado nuclear,
presentes nos dois tipos de FIF são constituídas por diversas ramificações terminais que se
enrolam em torno da região central nucleada da fibra, sendo sensível à velocidade do
estiramento dessa fibra. As terminações secundárias ou em cacho situam-se nas fibras com
núcleo em cadeia, a distância variável da região equatorial se enrolam em torna da fibra,
reagindo às variações do comprimento. Os estímulos que se originam nessas terminações são
conduzidos pelas fibras Ia e II da classificação de Lloyd, respectivamente. Ambos os tipos de
terminações são sensíveis ao estiramento da parte central, não contrátil, da FIF, sendo que a
7
estimulação aumenta o estiramento da parte central e diminui quando decresce o estímulo pelas
FEF (veja figura1).
Ao abandonar o FM a fibra Ia e a II chegam à medula pelas raízes posteriores de maneira distinta,
inervando de forma monossináptica os motoneurônios α e β do músculo do qual provêm e,
assim, fecha um circuito que vai construir o reflexo miotático ou de estiramento: em repouso é
responsável pelo tônus muscular. A fibra tipo Ia estabelece sinapses com o motoneurônio
diretamente ou através de interneurônios. Essas sinapses são facilitadoras para os músculos em
ação e os agonistas e são inibidoras para os motoneurônios que inervam os músculos
antagonistas: princípio da inervação recíproca. A fibra tipo II estabelece sinapses com
interneurônios, sendo facilitadora ao motoneurônio que inerva a musculatura flexora e inibidora
para aqueles que inervam a musculatura extensora; quer os estímulos sejam provenientes de
músculos flexores ou extensores. Ambos os tipos de fibras da medula chegam ao cerebelo pelos
feixes espinocerebelar dorsal e anterior, sendo que a fibra Ia chega ao tálamo, córtex
sensitivomotor pelo sistema leminiscal que participa da batiestesia e palestesia, veja mais
adiante.
Mecanismo de transdução no fuso muscular
O FM encontra-se disperso dentro da massa muscular extrafusal. Filamentos tendinosos longos
têm origem nos pólos dos fusos e se estendem a cada extremo do músculo extrafusal, onde se
inserem sobre os tendões musculares. Diz-se que esse arranjo dá ao FM um relacionamento em
paralelo com as FEF. O estiramento passivo ou ativo do fuso, por contração das extremidades
contráteis das FIF, deforma a terminação primária e a secundária. Isso provoca a abertura de
canais de sódio e cálcio mecanodependentes, o que gera o potencial receptor. Como é um
receptor de adaptação lenta, o potencial receptor dura, o tempo de aplicação do estímulo. O
estiramento do FM produz uma rápida despolarização seguida de repolarização lenta. A primeira
fase é conhecida como resposta dinâmica, sua amplitude tem proporção à amplitude do
estiramento e à sua velocidade. A fase de repolarização chama-se resposta estática; sua
amplitude é proporcional à amplitude do estiramento e a sua duração ao tempo de aplicação do
estímulo. Ao cessar o estímulo ocorre uma hiperpolarização conhecida como pósestatica. A
terminação secundária não apresenta resposta dinâmica nem hiperpolarização pósestatica, mas
8
apresenta a resposta estática. A resposta dinâmica deve-se as FIF de aglomerado nuclear
dinâmica, que não se estiram de maneira uniforme devido as suas propriedades viscoelásticas.
Ao se estirarem, a região equatorial o faz mais que seus extremos, o que ativa rapidamente a
terminação primária que resulta na resposta dinâmica. Mas, após o estiramento das
extremidades da fibra, a região equatorial encurta-se
ligeiramente, o que diminui a
despolarização e origina resposta estática. Isso é conhecido como fenômeno de deslizamento:
veja acima.
Inervação motora das fibras intrafusais
É obtida por motoneurônios pequenos, chamados de γ, localizados no corno anterior da medula
espinhal junto aos motoneurônios α. Os axônios do motoneurônio γ são mielinizados e de
velocidade de condução relativamente baixa. Inervam as extremidades contráteis das FIF.
Existem três tipos de terminações motoras nessas extremidades: as placas p1, as placas p2 e as
terminações difusas. As p1 localizam-se próximas à extremidade das fibras em aglomerado
nuclear e são semelhantes às placas das FEF. As placas p2, formadas por terminações em buquê,
situam-se na parte média das fibras em aglomerado nuclear. As terminações difusas, formadas
por numerosas ramificações amielínicas de forma alongada, estabelecem múltiplos contatos com
as membranas dos dois tipos de FIF e situam-se principalmente na porção justaequatorial das
fibras com núcleos em cadeia. A inervação motora das FIF é devido aos axônios γ ou fusimotores,
cujos motoneurônios estão situados na coluna anterior da medula, constituindo 30% das fibras
da raiz anterior com velocidade de condução inferior a 50 m\s. Os axônios fusimotores provocam
a contração das porções polares das FIF e, essas, acarretam o estiramento da porção equatorial
não contrátil e, consequente, estimulação das terminações sensitivas.
Os axônios fusimotores podem ser divididos em γ dinâmico (γd) que aumentam a resposta, os γ
estático (γe) que reduzem a resposta e, ultimamente, os γβ ou fusimotores β que excitam tanto
as FIF como as FEF e ambas se contraem solidariamente. Os neurônios fusimotores estabelecem
sinapses colinérgicas e excitatórias, que funcionam do mesmo modo que as sinapses com as FEF.
Os axônios γd inervam apenas as fibras em aglomerado nuclear que através das placas p2
determinam potenciais de membrana nas FIF que necessitam estimulação repetida para
aumentar a resposta dinâmica do aferente primário. Os axônios γe inervam fibras com núcleos
9
em cadeia, através das terminações difusas, despolarizando as membranas e gerando potencial
de ação que leva à contração das fibras, aumentando a resposta estática do aferente secundário.
Acredita-se que a inervação motora γ determina a sensibilidade do FM ao estiramento. Os
axônios α ou β, com velocidade de condução superior a 50 m\s, inervam a musculatura extra e
intrafusal, inervando as fibras em aglomerado nuclear através das placas p1 (veja figura 1).
UNIDADE MOTORA
A unidade motora (UM) propriamente dita é constituída por fibras musculares de um mesmo
tipo. A UM classifica-se de acordo com dois parâmetros: a) o tempo necessário para desenvolver
a força máxima (isso ocorre devido ao processo de recrutamento iniciado pelos motoneurônios
pequenos); e b) a frequência de estimulação na qual ocorre fadiga. Todas as fibras musculares
pertencentes a UM possuem as mesmas propriedades funcionais e bioquímicas. De acordo com
isso existem três tipos de UM: 1) unidades fatigáveis e de contração rápida (FR); 2) unidades
resistentes à fadiga e de contração lenta (RL); e 3) unidades resistentes à fadiga e de contração
rápida (RR).
Unidades fatigáveis e de contração rápida (FR) - São constituídas de motoneurônios α grandes,
de alta velocidade de condução, com hiperpolarização póspotencial breve que lhes permitem
disparar em alta frequência. As fibras musculares são grossas e possuem pouca mioglobina, daí a
sua denominação de pálida ou branca; alcançam sua contração máxima em pouco tempo,
desenvolvem muita força e fadigam-se rapidamente. A relação de inervação é grande exceto nos
músculos extrínsecos dos olhos. Por exemplo, na miastenia gravis o paciente não consegue
manter os olhos elevados em posição tônica por mais de 30 seg.
Unidades resistentes à fadiga e de contração lenta (RL) - são formadas por motoneurônios
pequenos, de baixa velocidade de condução, com hiperpolarização póspotencial prolongada que
os impedem de disparar em alta frequência. Suas fibras musculares são de menores diâmetros
do que as pálidas, ricas em mioglobina e mitocôndrias, bem vascularizadas, portanto,
denominadas de vermelhas. Contraem-se lentamente, desenvolvem pouca força e são
resistentes à fadiga. Sua relação de inervação é menor do que a das FR.
10
Unidades resistentes à fadiga e de contração rápida (RR) – são constituídas por motoneurônios
α médios. Possuem propriedades intermediárias entre os motoneurônios grandes e pequenos.
As fibras musculares são pálidas ou brancas, contraem-se rapidamente, embora de forma mais
lenta do que as FR, e desenvolvem o dobro da força do que as RL. A resistência à fadiga é similar
à das RL. Por exemplo, uma bailarina consegue ficar na ponta dos pés por alguns minutos,
usando os músculos gêmeos.
Estudos histoquímicos mostraram que as fibras musculares estriadas são mais heterogêneas do
que indica sua divisão em brancas e vermelhas. Mediante a determinação da atividade da
succinodesidrogenase nos músculos rápidos e lentos, podem identificar: a) fibras A, brancas
clássicas; b) fibras B; c) fibras C, ambas vermelhas, mas diferentes entre si. Estudando a atividade
de várias enzimas, chegou-se a diferenciar até oito tipos diferentes de fibras. No plano funcional
é importante assinalar que a UM está em estreita relação com o tipo histoquímico de suas fibras.
Assim, a UM pode ser classificada em tipo 1 e tipo 2, e seus músculos em vermelho e branco. O
músculo vermelho contém fibras do tipo 1 com mioglobina, mitocôndrias, enzimas oxidativas e
uma rica rede vascular para liberação de oxigênio; destinam-se a contração contínua e de longa
duração em condições aeróbicas, como são usados em maratonas. Enquanto o músculo branco
possui a fibra tipo 2 que são ricas em glicogênio e enzimas glicolíticas, pobre em enzimas
aeróbicas, mitocôndrias e lipídios; destinam-se a surtos breves e intensos de atividade em
condições anaeróbicas, como são usados em corrida de curta distância de 100 metros. Estudos
recentes mostram que se utilizando uma coloração com miosina-ATPase identificou-se essas
duas populações distintas de fibras musculares, como tipo 1 e tipo 2 descritas acima, as quais
correspondem às UM do tipo 1 e do tipo 2. Mas, um ajuste adicional do Ph possibilitou a
separação das fibras musculares do tipo 2 em subtipos: 2A e 2B. As fibras tipo 2B são as clássicas
fibras ricas em glicogênio e enzimas glicolíticas, de contração rápida, sensíveis à fadiga, as
pálidas; enquanto as fibras 2A têm características intermediária entre tipo 1 e tipo 2B, com
alguma capacidade oxidativa, contração mais lenta e maior resistência a fadiga que as fibras 2B:
exemplo clínico envolvendo as fibras 2B encontra-se na doença de Thomsen, que ocorre por
agregação tubular e ausência de fibras 2B. A característica clínica dessa doença é a dificuldade de
iniciar o movimento após um período prolongado de repouso.
11
Um músculo médio contém cerca de 40% de fibras 1 e 60% de fibras tipo 2. Embora essa
proporção varie com a função e localização do músculo e músculos semelhantes podem variar
entre indivíduos. Todas as fibras de uma UM específica são as mesmas, e há boa correlação entre
as propriedades mecânicas e outros atributos de uma UM e as reações histoquímicas de suas
fibras musculares. A relação entre o número de fibras musculares e o motoneurônio α
denomina-se relação de inervação. Essa relação depende do tamanho do músculo e da precisão
do movimento que realiza. Uma relação baixa corresponde
aos músculos pequenos
encarregados de realizar movimentos precisos: os músculos extrínsecos dos olhos que têm uma
relação de 10:1, ou seja, um motoneurônio α inerva 10 fibras musculares; já os pequenos
músculos da mão têm relação de 100:1; e o gastrocnêmio ou gêmeos tem uma relação de
2000:1. Durante o desenvolvimento pósnatal as fibras musculares sofrem alterações na fisiologia
e nas características histoquímicas. Essas alterações nas propriedades de fibras musculares
individuais (velocidade de contração, fatigabilidade, tensão máxima, etc.) são provavelmente
devido a mudanças na atividade dos motoneurônios que as inervam. A UM sofre uma redução de
tamanho no período pósnatal, provavelmente porque cada fibra muscular está inicialmente
inervada por mais de um motoneurônio. Depois de adquirir o padrão adulto com somente um
axônio inervando cada fibra muscular, o tamanho da UM parece tornar-se constante.
A força que desenvolve uma fibra muscular é diretamente proporcional ao seu diâmetro,
independente de seu comprimento. As fibras de diâmetros iguais, ainda que de diferentes
comprimentos, desenvolvem a mesma força, mas a energia empregada será maior por parte da
fibra mais grossa. E, por sua vez, o deslocamento conseguido pela fibra mais grossa na contração
será indubitavelmente maior que na fibra curta. Nas condições ideais, um músculo deveria ser
apto a desenvolver tensões que variassem desde aquelas das contrações mais delicadas até as
das mais intensas, de forma gradual ou brusca, com máxima economia e sem apresentar fadiga,
além de estar sujeito a controle sobre sua atividade em todas as circunstâncias. Um músculo
homogêneo não é capaz de combinar tais funções, mas a maioria dos músculos esqueléticos é
constituída por fibras musculares com características estruturais e propriedades diferentes que
possibilitam ao músculo um desempenho que se aproxima do ideal. Assim, do mesmo modo que
a fibra rápida e lenta reflete a função de um músculo e de suas UM, também, o tipo de UM
predominante em cada músculo se correlaciona com a sua função. E os tipos de UM, por sua vez,
12
se relacionam com as fibras musculares que cada motoneurônio inerva: os motoneurônios α são
maiores e correlacionam-se com as fibras rápidas e, os γ que são menores, com as fibras lentas.
Os movimentos onde a UM vai atuar podem ser classificados em reflexos, automáticos e
voluntários. Os reflexos são respostas motoras rápidas, estereotipadas a estímulos específicos;
os automáticos combinam características dos movimentos reflexos e dos voluntários, no início e
no término sofrem a ação voluntária e durante a execução são reflexos e automáticos; os
voluntários são divididos em três tipos: lentos, rápidos e balísticos. Os lentos são aqueles que
ocorrem em média de um segundo. São assistidos porque durante a sua execução são corrigidos
e ajustados de acordo com as aferências periféricas: são movimentos precisos e habilidosos; os
rápidos são os que acontecem em 500 ms. Acredita-se que as aferências periféricas exerceram
certo controle sobre esse movimento, com base na informação de que o SNC processa uma
informação proprioceptiva em 120 ms; os balísticos são realizados em menos do que 500 ms. São
totalmente programados pelo SNC antes de ser iniciado e não sofrem influências de aferentes
periféricos.
Tônus muscular e reflexo miotático ou de estiramento - ao estirar o músculo por percussão de
seu tendão, são ativadas as terminações sensoriais do FM que excitam os motoneurônios α, os
quais produzem a contração do músculo, durante o qual o fuso relaxa. Isso suprime a ativação
das fibras Ia, levando ao relaxamento do músculo. Esse mecanismo inicia e termina o reflexo
miotático de estiramento, mas não é útil para a realização de movimentos voluntários porque
deixa o SNC sem informação dos receptores musculares, o que é importante para controle e a
percepção do movimento. Portanto, quando se realiza um movimento voluntário o SNC ativa,
simultaneamente os motoneurônios α e γ, fenômeno que se conhece como coativação α-γ, a
qual ocorre na maioria dos movimentos voluntários, com exceção dos balísticos, nos quais se faz
de forma deficiente. O tônus muscular desenvolve-se graças a alguns reflexos de estiramento
que estão ativados enquanto o músculo encontra-se em repouso. Esses correspondem aos FM
situados no equador do músculo, região que está estirada devido à inserção do músculo nos
ossos. Dessa forma, ao serem ativados alguns fusos, se produz a contração de certas UM,
estirando outros fusos que, por sua vez, são ativados. Esse mecanismo de contração reflexa, que
se repete alternativamente, constitui a base do tônus muscular. Também por ativação tônica dos
13
motoneurônios γ pode-se manter constante o comprimento do músculo. Se o músculo encurta
por contração, diminui a ativação dos motoneurônios α pelo relaxamento parcial dos fusos e o
músculo relaxa, voltando ao comprimento inicial. Ao estirar-se ocorre o inverso.
Regulação do tono postural
Em indivíduos normais, durante a manutenção da postura ereta, há silêncio elétrico nos
músculos da loja anterior da perna e que a atividade dos motoneurônios γ que os inervam é
desprezível. Quando o centro de gravidade é deslocado para trás, voluntária ou passivamente, há
aumento da frequência dos impulsos provenientes dos FM, especialmente os que vêm das
terminações primárias das fibras em aglomerado nuclear. Concomitantemente, ocorre contração
dos músculos esqueléticos da loja anterior da perna e, em seguida, há aumento da frequência de
descargas nas fibras vindas dos fusos desses músculos. A contração da musculatura esquelética
deveria reduzir a frequência de descargas dos receptores fusais dessa mesma musculatura e não
a aumentar. Esse fenômeno, aparentemente paradoxal, decorre da ativação simultânea dos
motoneurônios α e γ. A pequena latência observada entre o início da contração muscular
verificada à eletroneuromiografia e a acentuação das descargas provenientes dos fusos deve-se à
menor velocidade de condução nos axônios fusimotores. A co-ativação α-γ mostra que esse
reflexo postural é integrado em centros supra-segmentares, pois, quando são envolvidos
exclusivamente os mecanismos espinhais, há apenas ativação dos motoneurônios α em resposta
ao estiramento muscular.
Regulação do movimento voluntário
No movimento voluntário, a contração das FEF inicia-se antes que ocorra aumento das descargas
nas fibras Ia e II. Estudando o tempo de latência entre atividade da musculatura esquelética e o
aumento das descargas vindas dos receptores fusais, mostra-se que os motoneurônios α e γ são
ativados em simultâneo pelos sistemas supra-segmentares envolvidos no movimento voluntário
e que o tempo de latência se deve à menor velocidade de condução das fibras γ. A co-ativação αγ impede que exista abolição das descargas dos receptores fusais durante a contração da
musculatura esquelética sem que ocorra retardo no início do movimento. Para demonstrar a
importância desta co-ativação é interessante descrever o que ocorre durante um movimento
14
voluntário, em que a resistência aplicada externamente seja variável.
A ativação dos
motoneurônios α e γ é precisamente ajustada para a força e a velocidade requerida no
movimento. Caso exista aumento da resistência, as FEF irão contrair-se mais lentamente e o
movimento poderá tornar-se mais lento ou mesmo ser bloqueado. Enquanto isso, as FIF
continuarão a se contrair e, na ausência de contração das FEF, existirá acentuação das descargas
vindas dos fusos, o que produzirá maior atividade dos movimentos α, que irão opor-se à
resistência externa. Caso a resistência externa seja reduzida, o mesmo mecanismo irá
desencadear menor atividade dos motoneurônios α. As correções dos desalinhamentos entre o
comprimento previsto na contração e o comprimento real do músculo dependem dos níveis
segmentar e supra-segmentar. Aparentemente, o córtex sensitivomotor que recebe impulsos
vindos dos fusos é muito mais importante para as correções dos desalinhamentos que os
mecanismos segmentares.
No exato inicio da contração muscular há apenas uma UM visível no eletromiograma, ou seja, há
somente um único motoneurônio ativo na parte examinada do músculo. Quando a força de
contração aumenta, outra unidade aparece em acréscimo, então uma terceira, uma quarta e
assim por diante. Esse recrutamento das UM é usualmente encontrado segundo uma ordem fixa
de acordo com seu tamanho. A menor UM, que é solicitada em primeiro tempo, segundo se
constata, consiste histoquimicamente de fibras tipo 1ou vermelhas; deflagra com uma
frequência relativamente baixa, envolve baixa tensão, mas pode continuar trabalhando por um
tempo muito longo. Ela é a ultima a desaparecer do eletromiograma quando a força de
contração retrocede. As maiores UM, que consistem de fibras do tipo 2B ou brancas, são
normalmente recrutadas somente quando é necessária uma força de grande intensidade. Elas
deflagram com alta frequência e envolvem uma alta tensão, mas são facilmente fatigadas. Assim,
o aumento em intensidade de uma contração muscular voluntária é, pelo menos até certo
ponto, devido ao fato que cada vez mais motoneurônios descarregam impulsos nas fibras
musculares que suprem.
ÓRGÃO NEUROTENDÍNEO DE GOLGI
Esse é o receptor responsável pelo reflexo miotático inverso. O órgão neurotendíneo (ONT) de
Golgi é constituído por finas ramificações nervosas situadas na intimidade dos fascículos
15
tendíneos próximo a junção músculo-tendão e atuam em série com as FEF. O ONT de Golgi mede
700 milimicra de comprimento por 200 milimicra de diâmetro e encontra-se envolvido por uma
cápsula, dividida por diversos compartimentos longitudinais por faixas de tecido conjuntivo
derivados da cápsula. A cápsula é composta de diversas camadas de fibras de tecido conjuntivo e
de células de tipo endoltelial, sendo derivada da bainha de Henle do nervo. Em cada extremo do
ONT, a cápsula torna-se contínua com o tecido conjuntivo do músculo ou do tendão
embrionário. Outros receptores como as terminações de Ruffini e os corpúsculos paciniformes se
encontram na cápsula articular e são inervados por fibras de diâmetro médio. As terminações de
Ruffini respondem tanto ao movimento como a posição, enquanto que os corpúsculos
paciniformes respondem ao movimento. As terminações nervosas livres, inervadas pelas fibras
tipo C amielínicas, se encontram tanto no ligamento como nas cápsulas articulares, responsáveis
pelos movimentos dolorosos extremos da articulação. Mas, a inervação do ONT é feita pela fibra
Ib, um axônio mielinizado, cujo o corpo celular encontra-se no gânglio espinhal posterior da
medula ou dos nervos cranianos. Seus prolongamentos apicais se aproximam do ONT, a grossa
fibra aferente Ib apresenta segmentos internodais que se ramificam ao atingir a cápsula do
receptor. Ao penetrar na cápsula, a fibra Ib perde a mielina e ramifica-se em ramos amielínicos
secundários e terciários que se projetam sobre a superfície dos fascículos tendíneos como
expansões granulares em
forma de folhas ou de
garras. Provavelmente a
distorção
dessas
arborizações resulta em
descarga da fibra Ib, cujo
mecanismo de transdução
inicia-se pelo estiramento
ou
pela
compressão
dessas terminações
axonais, que abrem
os
canais de sódio e cálcio
mecanodependentes.
16
O
Fig. 07
ONT pode ser ativado pelo estiramento ou pela contração do músculo, sendo esse ultimo mais
eficaz (Fig.7).
A função do ONT de Golgi é informar sobre a tensão que o músculo desenvolve. Também
fornece um mecanismo de retroação negativa para regular a tensão muscular. Se essa diminui,
será menor a inibição dos motoneurônios, o que leva ao desenvolvimento de mais tensão. O
contrário ocorre quando a tensão é aumenta. O FM está em paralelo com a massa muscular: a
contração muscular relaxa o fuso enquanto o ONT o estira. Esse órgão exibe um limiar mais baixo
à contração muscular que ao estiramento passivo do músculo. Isso ocorre porque a força da
contração muscular é transferida mais eficazmente ao ONT que a força do estiramento muscular.
Durante o estiramento aplicado externamente, as fibras musculares alongam-se e, portanto,
absorvem muito das forças de estiramento, enquanto que durante a contração muscular
isométrica o tendão absorve a maior parte da força contrátil. No decorrer do estiramento
passivo,
o
comportamento
do
sistema
músculo-tendão
difere
mecanicamente
do
comportamento observado durante a contração ativa. O melhor exemplo de ação do sistema do
ONT é o da contração isométrica que varia a tensão, mas quase não varia o comprimento do
músculo. Ao contrário, ocorre na contração isotônica que varia no comprimento, mas quase não
varia na tensão (ação do FM).
Os impulsos são levados à medula por fibras grossas (Ib) onde irão inibir de forma bissináptica os
motoneurônios que inervam a musculatura antagonista. A tensão desenvolvida durante a
contração de uma dada unidade motora não dependerá apenas da frequência das descargas do
motoneurônio α. Para uma mesma frequência, a tensão vai depender do comprimento do
músculo (sendo menor se o comprimento do músculo for diferente do comprimento do
repouso), da velocidade de condução e do grau da fadiga. Consequentemente, a mesma
atividade α poderá desenvolver tensões diferentes, dependendo das condições do músculo. Por
outro lado, em virtude da atividade dos motoneurônios γ, a frequência de descarga dos
receptores fusais não guarda correspondência biunívoca com o comprimento muscular. Além das
aferências do ONT, convergem sobre os interneurônios Ib aferências cutâneas, articulares e das
vias descendentes que regulam sua atividade. Ao final de um movimento, quando a atividade
dos receptores articulares é máxima, eles facilitam a inibição das aferências Ib, o que contribui
17
para frear o movimento. As aferências cutâneas cumprem funções similares. Por exemplo, o
contato da mão com um objeto ativa essas aferências que aumentam a inibição - por meio dos
interneurônios Ib – dos motoneurônios que realizam o movimento e reduzem a força muscular, o
que permite um contato suave. Também as aferências descendentes regulam a intensidade da
inibição pelos interneurônios Ib, aumentando-a se o objeto a ser pegado é frágil, ou diminuindoa, caso se deseje um contato mais firme com o objeto.
Veja na figura abaixo, um esquema diagramático do reflexo miotático inverso, mostrando o
músculo bíceps braquial. Esse músculo realiza uma contração isométrica, que aumenta a tensão
do tendão estimulando os aferentes Ib dos ONT de Golgi. Na medula, esses aferentes Ib
terminam em interneurônios inibitórios (em vermelho) que causam o relaxamento do agonista, e
em interneurônios excitatórios (em azul) que provocam contração do antagonista (Fig.8).
CÉLULAS DE RENSHAW
Fig. 08
Existem alguns circuitos na
medula
que
realização da
ajudam
a
programação
motora segmentar, dentre os
mais importantes estão: 1)
inervação
recorrente,
facilitação recorrente,
2)
e 3)
circuitos reverberantes.
1) O circuito de inervação
recorrente
é realizado por
colaterais de
Lent, 05
axônios que
atuam sobre interneurônios,
os quais atuam
sobre
os
neurônios que deram origem a esses axônios. O exemplo mais importante é o encontrado nas
células de Renshaw. Essas células encontram-se na parte ventral da lâmina VII do corno anterior
da medula espinhal. São inibitórias, algumas utilizam como neurotransmisor à glicina e outras o
mediador GABA. São ativadas pelas colaterais dos axônios dos motoneurônios α fásicos e,
18
menos, pelo α tônico. Inibe mais os motoneurônios α tônico e γ estático em maior grau do que
os outros motoneurônios. Isso facilita a realização de movimentos rápidos, como correr ou
saltar. As células de Renshaw também inibem os interneurônios que intervêm na inibição dos
músculos antagonistas, os quais são ativados pelas fibras aferentes Ia dos fusos musculares. Isso
contribui para frear o movimento do músculo agonista. A célula de Renshaw também participa
do feed-back negativo através da sinapse inibitória dos motoneurônios α de se originou o
impulso: inibição recorrente. Outra das funções dos interneurônios de Renshaw é a de repassar
ao cerebelo o programa motor que está sendo executado pelos motoneurônios da asa anterior
da medula. Isso é obtido pela inibição dos neurônios que originam a via espinocerebelar anterior.
A inibição é proporcional à atividade dos motoneurônios. Quanto maior a atividade, maior a
inibição da via devido a uma maior ativação das células de Renshaw. Exemplo visto nas respostas
mais rápidas dos reflexos miotáticos.
2) A facilitação recíproca ocorre quando a contração de um músculo facilita a contração do outro
que tem a mesma função. Entretanto, os flexores e extensores podem atuar de forma sinérgica,
como ocorre no reflexo positivo de sustentação. Exemplificado pelo reflexo de postura e de
endireitamento.
3) Os circuitos reverberantes são os que permitem que uma resposta reflexa perdure mais do
que o estímulo que a ocasionou. Basicamente consistem em um interneurônio que se conecta
simultaneamente com um motoneurônio (ou outro interneurônio) e com um interneurônio ao
qual ativa. Esse, por sua vez, faz sinapse com o primeiro interneurônio. O exemplo clínico é
encontrado com a presença do clonus na síndrome piramidal de liberação.
O TONUS MUSCULAR EM VÁRIOS NÍVEIS DE ORGANIZAÇÃO DO SNC
O tônus muscular pode ser regulado pelos motoneurônios α e γ. Pode-se distinguir uma
regulação periférica e outra central.
1. Na regulação periférica participam aferências cutâneas, articulares e viscerais. Sua ação não é
exercida diretamente pelos motoneurônios, mas pelos interneurônios excitatórios e inibitórios.
As aferências vindas dos mecanorreceptores cutâneos facilitam a atividade do reflexo miotático
sob a área da pele onde se situam e inibem o reflexo dos correspondentes às áreas distantes. Os
19
nociceptores cutâneos ativam o tônus flexor e inibem o extensor, mas os localizados nos
músculos profundos ativam o músculo do qual provêm. Isso explica as contraturas dos músculos
lesados. Os mecanorreceptores articulares facilitam o tônus dos músculos que se inserem nas
respectivas articulações. As aferências viscerais têm efeitos inibitórios de longa duração sobre os
motoneurônios espinhais dos músculos flexores e extensores. Por exemplo, as aferências
nociceptivas pulmonares inibem os motoneurônios dos músculos intercostais e dos membros.
2. A regulação central existe na: a) formação reticular (FR), b) núcleos vestibulares, c) cerebelo,
d) núcleo rubro, e) núcleos da base, e f) córtex cerebral.
a) Na FR podem ser distinguidas duas regiões: uma situada na região media do bulbo central ou
FR ventromedial que corresponderia ao núcleo gigantocelular, e outra na ponte, representada
pelo núcleo reticular oral e o caudal da ponte. Ambas projetam-se para medula pelas vias
reticuloespinhais. A primeira região faz bilateralmente pela parte ventral do funículo lateral, para
inervar interneurônios que se conectam com os motoneurônios γ dos músculos flexores e
extensores, facilitando os primeiros e inibindo os segundos. A FR da ponte projeta-se pela via
reticuloespinhal medial que desce na medula pelo funículo anterior. Termina em interneurônios
que inervam os motoneurônios γ dos músculos flexores e extensores, inibindo os primeiros e
facilitando os segundos: trata-se de um efeito oposto ao do bulbo. Sobre a FR atuam aferências
corticais e subcorticais. As aferências provenientes do córtex motor suplementar inibem a FR da
ponte e facilitam a FR bulbar, gerando espasticidade. A FR bulbar também é facilitada por
algumas aferências vindas dos núcleos da base.
b) Entre os núcleos vestibulares, o que está diretamente relacionado ao controle do tônus
muscular é o núcleo vestibular lateral de Deiters. Recebe aferências do aparelho vestibular, do
paleocerebelo (inibitórias) do núcleo fastigial (excitatórias). Projeta-se na medula pelo trato
vestíbuoespinhal
lateral.
Facilita
a
atividade
dos
motoneurônios
α
extensores
e, secundariamente, dos motoneurônios γ.
c) No cerebelo podem ser encontradas
duas regiões que modulam o tônus muscular, o
paleocerebelo e o neocerebelo. O lobo anterior do paleocerebelo intervém na regulação do
tônus muscular extensor por sua ação direta sobre o núcleo de Deiters e indireta sobre o núcleo
20
fastigial. Uma lesão no lobo anterior ou uma estimulação no núcleo fastigial promovem
hipertonia muscular. Essa hipertonia é do tipo α porque quando as raízes anteriores da medula
são seccionadas ela desaparece, mas não desaparece quando são seccionadas as raízes
posteriores. O neocerebelo controla o tônus extensor por mecanismos que envolvem o córtex
motor primário. A lesão do neocerebelo causa hipotonia devido à drástica diminuição das
aferências Ia que inervam os FM, decorrente de uma diminuição da atividade dos motoneurônios
γ. Isso se deve a diminuição da ação tônica facilitadora do córtex motor primário sobre os
motoneurônios γ. A favor dessa hipótese está a comprovação de que a hipotonia produzida por
lesão piramidal não é modificada por uma lesão do neocerebelo. Isso indica que a ação desse
último ocorreria por meio do córtex motor primário, o qual é ativado pela via
cerebelotalamocortical. Outro fator é que a lesão do núcleo ventrolateral do tálamo também
produz hipotonia.
d) O núcleo rubro é uma estrutura mesencefálica que também participa na regulação do tônus
muscular por ação sobre os motoneurônios α e γ medulares. Projeta-se à medula pelo trato
rubroespinhal cruzado, que inerva unicamente os motoneurônios da intumescência cervical,
sobre os quais atua para modular o tônus muscular dos membros superiores.
e) Núcleos da base intervêm no controle do tônus muscular, sendo o caudado o núcleo mais bem
estudado. Sua ativação facilita o tônus dos músculos flexores e inibe os dos extensores por sua
ação ativadora sobre a FR ventromedial do bulbo. Essa ação é mediada pelos motoneurônios γ.
Na doença de Parkinson existe hipertonia γ.
f) Córtex cerebral descreve duas ações sobre o tônus muscular. O córtex motor primário ou área
4 de Brodmann pelo trato ortopiramidal facilita o tônus extensor pela ação sobre os
motoneurônios α e γ medulares. Sua lesão produz hipotonia extensora. O córtex motor
suplementar parte medial da área 6 de Brodmann tem um efeito oposto. Sua lesão produz
hipertonia extensora (espasticidade), e sua ativação, hipotonia. Acredita-se que essa ação seria
exercida pela inibição da FR da ponte e ativação da FR ventromedial do bulbo. Dessa forma,
facilitaria o tônus flexor e inibiria o extensor.
21
REFLEXOS MEDULARES PROPRIOCEPTIVOS
Os centros superiores do controle motor do encéfalo recebem informações dos FM e dos ONT de
Golgi, principalmente através das fibras do grupo I (Ia e Ib) das raízes espinhais posteriores. O
processamento central dessa informação proprioceptiva conduz a uniformidade da atividade
muscular e ao movimento coordenado normais. Inclusive sem um processamento superior, a
atividade do FM e do ONT podem funcionar diretamente a nível medular através das fibras
colaterais do grupo Ia e do grupo II dar lugar aos reflexos que se produzem quando existe uma
necessidade de compensar trocas rápidas de posição e orientação do corpo. Esse processamento
segmentar do sistema sensitivo e motor atuam de maneira eficaz inclusive quando existe uma
perda de conexão com os centros encefálicos. Quando os FM respondem a distensão ou a uma
variação de comprimento de um determinado músculo, se produz um aumento da atividade das
fibras aferentes Ia, que estimulam diretamente os neurônios motores α que inervam esse
músculo (a mesma fibra Ia que inibe os músculos antagonistas através de conexões
interneuronais). Pelo contrário, a atividade das fibras aferentes Ib causada pelos ONT, que
respondem a tensão muscular, estimulam os interneurônios espinhais para que inibam os
neurônios motores α que inervam um músculo particular.
Distensão passiva ocorre quando o músculo é alongado passivamente, se distendem tanto as FIF
como as FEF. Os FM são ativados, causando uma descarga de atividade das fibras dos grupos Ia e
II; esses provocam uma excitação reflexa dos neurônios motores α, que estimulam assim as FEF
para se contraírem e opor-se as
forças aplicadas. O ONT responde
pouco à distensão passiva. Quanto
mais rápida ou intensa a distensão
e variação do alongamento, mais
rápida ou intensa é a contração,
como o reflexo patelar. Veja na
figura abaixo,
uma
distensão
Fig. 09
passiva, quando se distendem um
tanto as FEF como as FIF; se ativam os fusos. Por via reflexa, a fibra Ia e os neurônios motores α
causam uma contração secundária. A distensão é muito fraca para ativar o ONT (Fig.9).
22
A contração ativa pode acontecer em uma situação em que existe uma estimulação superior
exclusivamente dos neurônios motores α que produz uma contração das FEF, que por sua vez
dar lugar a um encurtamento global do músculo e a um relaxamento das FIF. Isso dar lugar a uma
finalização da atividade no FM e fibras Ia. O aumento da tensão muscular, basta para ativar os
ONT e as fibras aferentes Ib que tratam de inibir os neurônios motores α através dos
interneurônios. Uma inibição Ib suficiente permitirá um relaxamento ou parada da contração
muscular. Na realidade, numa contração ativa, a excitação central dos neurônios motores α só
causa uma contração das FEF com consequente relaxamento das FIF; os FM não são ativados. A
tensão é baixa, não se adapta a resistência crescente. O ONT se ativa, causando relaxamento
(Fig.10).
Em uma situação
Fig. 10
anormal
uma
durante
contração
voluntária de um
músculo, as ordens
do encéfalo excitam
tantos os neurônios
motores α como os
γ, dando
lugar a
estimulação
encurtamento
e
das
FEF e FIF. Os FM se ativam e produzem uma descarga das fibras Ia, a qual reforça dessa forma a
estimulação superior dos neurônios motores α. Essa atividade reforçada dos neurônios motores
α aumenta a tensão do músculo que está se contraindo e facilitam sua adaptação as variações de
carga. As fibras aferentes Ib ativam os neurônios motores α através de um mecanismo de
retroativação que reduz a tensão e provoca uma relaxamento se a carga continua sendo
excessiva. Na contração ativa com co-ativação do sistema γ ocorre quando se contraem as FIF e
23
FEF; se ativam os FM, reforçando o estímulo de contração através das fibras Ia de acordo com a
resistência. Se ativa o ONT, causando relaxamento se a carga for excessiva (Fig.11).
O reflexo miotático
Fig. 11
fásico
ou
reflexos
profundos ou reflexos
apendiculares ocorre
quando um músculo
é
estirado
bruscamente
mediante percussão
do tendão por um
martelo de reflexos,
que
estimula
as
terminações primárias das fibras em aglomerado nuclear que são as mais diretamente
envolvidas. Já o reflexo local de postura ou reação paradoxal que ocorre ao se fazer a flexão
brusca e passiva de uma articulação, aparece contração tônica do músculo flexor, que se
mantém por longo tempo. As terminações secundárias são responsáveis porque inibem os
motoneurônios α da musculatura extensora, facilitando os seus antagonistas. Resumo do reflexo
miotático: 1) o estiramento do músculo faz estirar os fusos musculares, que se encontram
localizados em paralelo com as FEF. O estiramento é transmitido à porção central, elástica, do
fuso onde se encontram os terminais em espiral da fibra aferente do grupo Ia; 2) a deformação
desses terminais, causadas pelo estiramento, inicia uma sequência de potenciais de ação nas
fibras Ia que; 3) excitam, monossinapticamente, os motoneurônios medulares que inervam o
mesmo músculo. Sherrington descobriu que um terceiro ramo de fibra aferente destaca-se ao
penetrar na substância cinzenta da medula e estabelecem sinapses com interneurônios
inibitórios situados nessa região. Os axônios desses interneurônios estendem-se apenas até o
corno ventral próximo, arborizando em torno da população de motoneurônios α que comandam
os músculos antagonistas: princípio da inervação recíproca.
24
Veja na figura abaixo, um diagrama do reflexo miotático, mostrando o reflexo patelar e seu
circuito. A percussão da patela provoca um estiramento do músculo agonista, que estimula os
aferentes dos FM. Na medula, esses terminam em motoneurônios que ativam diretamente o
próprio agonista, e em interneurônios inibitórios que diminuem a ativação do antagonista
(Fig.12).
MIÓTOMO
Fig. 12
Consiste
em
todos
os músculos
inervados por uma raiz muscular
específica. A maioria dos músculos
esqueléticos recebe inervação de duas
ou mais raízes, e há uma variabilidade
intrínseca entre indivíduos quanto aos
padrões de miótomos. Na atualidade,
existem sete padrões de miótomos
derivados de dados eletromigráficos.
NERVO PERIFÉRICO
Os nervos periféricos são formados
Lent, 05
por milhares de axônios, envolvidos
por bainha de mielina de espessura
variável sustentados por células de Schwann e axônios não mielinizados, todos os componentes
incrustados em uma matriz de tecido conectivo ou endoneuro. Os nervos são divididos em
compartimentos fasciculares internos distintos pelo perineuro. A barreira hematovascular é uma
divisão fisiológica criada pelo perineuro e pelo endotélio dos capilares interfasciculares. As
extremidades terminais das fibras nervosas não são protegidas pelo perineuro, aspecto que está
envolvido na patogênese de algumas neuropatias periféricas. Tanto nos nervos periféricos como
nos cranianos a entrada ou saída no SNC é desprovida principalmente de mielina, facilitando a
dissociação entre os axônios mielinizados e os não mielinizados no mecanismo de controle de
dor: neuralgia com etiologia secundária. Os fascículos são unidos em troncos nervosos pelo
epineuro, uma dupla camada de tecido conectivo areolar frouxo que contém igualmente vasos
25
sanguíneos, vasos linfáticos e nervi nervorum. Pacientes portadores de vasculites ou diabete
melito podem apresentar isquemia ou enfarte nesses vasos sanguíneos, causando um quadro
clínico de neuropatia periférica, cuja diferença com as demais está no tempo. Os fascículos
bifurcam-se, unem-se a fascículos adjacentes, dividem-se novamente e recombinam-se para criar
uma complexa rede fascicular interna.
Os nervos podem ser classificados em tipos
monofascicular, oligofascicular e polifascicular, tendo esse último como exemplo: o plexo
braquial (Fig.13).
Fig. 13
Os
axônios
divididos
são
em
três
grandes grupos
de
tamanho:
grande
pequenos
mielinizados
(são três
vezes mais
numerosos),
mielinizados.
axônios
elementos
citoesqueleto,
e
e
não
Os
contêm
do
dos
neurofilamentos e neurotúbulos, que são sintetizados no corpo celular e se movem lentamente
pelo axônio a uma velocidade de 3 mm\dia. Os neurotúbulos são dímeros polimerizados de
proteína tubulina formando tubos ocos orientados longitudinalmente de cerca de 20 nonâmetro
de diâmetro e 1 mm de comprimento ligados aos neurofilamentos por pontes cruzadas. Os
neurofilamentos são organelas menores que mantêm a estrutura axonal. Os neurotúbulos são
responsáveis pelo transporte do axônio tanto anterógrado como retrógrado rápido.
Um axônio mielinizado tem uma única célula de Schwann que se enrola entorno de um
segmento internodal em camadas concêntricas. As incisuras de Schmidt-Lantermann são
pedaços de citoplasma das células de Schwann sequestrados entre camadas de mielina. A
membrana plasmática externa da célula de Schwann é contínua com a camada mais externa de
mielina; a membrana interna da célula de Schwann é adjacente à superfície externa do axolema.
26
A lâmina externa é uma condensação da matriz extracelular que circunda toda a superfície
externa da célula de Schwann. Os nodos de Ranvier são estrangulamentos cobertos com pouca
mielina, situados entre os territórios de duas células de Schwann. Nesses nodos, o limiar de
excitação é muito baixo ao sódio, local de onde se inicia o potencial de ação por transmissão
saltatória. A distancia entre os nodos varia de acordo com o tamanho da fibra, nas grossas é de 1
mm. Nos axônios não mielinizados, uma única célula de Schwann, chamada de célula de Remak,
envia processos para sustentar vários axônios adjacentes, emprestando a cada um deles, um
revestimento citoplasmático e um mínimo conteúdo de mielina. Vários axônios não mielinizados
e sua célula de Remak de sustentação são envolvidos por uma lâmina externa.
As fibras de nervos periféricos são classificadas de acordo com dois sistemas: o ABC e o sistema III-III-IV. A velocidade de condução de uma fibra depende de seu diâmetro e de seu grau de
mielinização. O potencial de ação separa as fibras em grupos com base na sua velocidade de
condução. Os motoneurônios Aα apresentam corpos celulares de tamanho grande e médio,
extensas arvores dendríticas e são eferentes. Os motoneurônios Aγ apresentam corpos celulares
e arvores dendríticas de tamanho pequeno.
Os motoneurônios Aβ têm propriedades
intermediárias, seus axônios bifurcam-se em ramos que inervam as fibras musculares comuns FIF
e FEF. Os motoneurônios Aς são aferentes cutâneas. As fibras do grupo B são préganglionares
autonômicas. As fibras nervosas do grupo C são fibras pósganglionares autonômicas, aferentes
viscerais e fibras de dor e temperatura. As fibras do sistema romano são aferentes. A fibra Ia se
origina no saco nuclear do FM e nos receptores articulares, a fibra Ib nos ONT de Golgi e a fibra II
da cadeia nuclear do FM. As fibras III são axônios cutâneos que correspondem a fibra Aς e fibras
do grupo IV correspondem a fibra C. Algumas neuropatias tem predileção por determinados
tipos de tamanhos de fibras. As neuropatias que comprometem as grandes fibras afetam a força,
os reflexos e a propriocepção, sendo relativamente poupadas as sensações de dor e
temperatura, enquanto as neuropatias de fibras finas afetam a dor, temperatura e função
autonômica. Diferenças imunológicas existem entre o tamanho das fibras. A proteína L2 é
expressa unicamente na célula de Schwann de axônios motores, e os nervos para os músculos
extraoculares são ricos em gangliosídeos GQ1b, o que pode estar relacionado com a síndrome de
Miller-Fisher.
27
O fluxo axonal anterógrado move-se do corpo celular para a periferia tem múltiplos
componentes.
Um transporte axonal lento de 1 mm\dia a 3mm\dia, leva proteínas do
citoesqueleto para à periferia para a manutenção
e renovação do axoplasma, juntos com
neurotransmissores, enzimas, etc. Transporte axonal rápido, de 400mm\dia, transporta vesículas
ligadas à membrana que são impelidas pela cinesina, uma ATPase associada aos microtúbulos.
Anormalidades no transporte axonal são importantes no mecanismo das neuropatias com
degeneração retrógrada ou dependente do comprimento. O fluxo retrógrado move materiais da
periferia de volta ao corpo celular; é através desse mecanismo que alguns vírus neurotrópicos
alcançam o SNC.
JUNÇÃO NEUROMUSCULAR
É uma sinapse especializada através de estímulos elétricos do nervo periférico são transformados
em estímulos químicos que induzem a despolarização da membrana muscular pósinaptica e,
consequente, contração muscular. Após entrar no músculo, o axônio de um neurônio motor
divide-se em muitos ramos finos. Cada desses ramos faz contato no meio de uma única fibra. Um
ramo intramuscular do nervo termina formando uma dilatação bulbosa ou botão terminal. No
telodendro, os axônios se dividem e forma um complexo de 50 vesículas, cada fazendo sinapse
com a célula muscular. A fenda sináptica primária separa o botão terminal da membrana
muscular pósinaptica, que é dividida em várias fendas sinápticas secundárias ou pregas
juncionais. Essa membrana é recoberta por denso arranjo de moléculas de receptores nicotínicos
Fig. 14
de acetilcolina (RNA). Esse
receptor
é uma estrutura
complexa composta de duas
subunidades
alfa
e
de
subunidades beta, gama e
delta, além de um canal
iônico. A região imunogênica
principal do RNA é a atacada
por
autoanticorpos
maioria
28
dos
casos
na
de
miastenia gravis. Existem moléculas de acetilcolinaesterase tanto na membrana pré como na
pósinaptica (Fig.14).
O botão terminal tem muita atividade metabólica. Repleto de proteína do citoesqueleto, além de
mitocôndrias e numerosos compostos químicos. Contém vesículas de acetilcolina presas à
membrana. No citoplasma do botão terminal, a molécula de acetilcolina é embalada em
vesículas, que migram e se reúnem em zonas ativas ou locais primários de liberação. Essas zonas
das membranas présinapticas tendem a se alinhar em oposição às fendas sinápticas secundárias
da membrana pósinapticas. Essas zonas são locais de exocitose de acetilcolina como de ingresso
de cálcio.
A membrana présinaptica contém canais de cálcio com portais de voltagem. Em resposta a
despolarização do nervo, esses canais permitem o influxo de cálcio no terminal présinaptico, o
que facilita a liberação do neurotransmissor com o impulso nervoso subseqüente. O magnésio
tem o efeito contrário e inibe a liberação do transmissor. Depois de um impulso nervoso, o cálcio
difunde-se para fora do terminal nervoso e praticamente desaparece dentro de 100 a 200
milessegundos. Os impulsos nervosos repetitivos também aumentam à mobilização de vesículas
de acetilcolina em direção as zonas ativas. Em consequência, uma contração muscular voluntária
contínua exerce um efeito facilitador transitório sobre a liberação do transmissor.
As vesículas de acetilcolina são liberadas esporadicamente e de maneira irregular enquanto a
membrana está em repouso e em jorros após despolarização do nervo. Cada vesícula contém
cerca de 5.000 a 10.000 moléculas de acetilcolina ou um quanta. A sinapsina, uma fosfoproteína
localizada nas vesículas, pode mediar a translocação das vesículas para a membrana. Mediante
ativação, as vesículas fundem-se com a membrana pósinaptica e despejam seu conteúdo de
acetilcolina na fenda sináptica primária. As moléculas de acetilcolina difundem-se rapidamente
através da fenda sináptica primária e para dentro das secundárias até realizar a exocitose.
O passo subseqüente envolve a união da acetilcolina com um complexo de proteínas
coletivamente referidas de SNARE. Nesse local atuam as toxinas do clostridium tetani, toxina
botulínica e toxina tetânica inibem o processo de exocitose por ação das proteases que vai se
unir as proteínas específicas da SNARE em diferentes sites, dependendo da toxina e de seu tipo.
Existem sete subtipos de toxina botulínica, mas só duas, A e B, são usadas clinicamente com
29
capacidade
para
inibir
a
liberação
de
acetilcolina
na
junção
neuromuscular
e,
consequentemente, libera espasmo muscular na distonia, espasticidade e desordens
relacionadas.
À medida que a acetilcolina encontra um receptor, abre-se um canal de sódio na membrana
pósinaptica, produzindo uma breve despolarização que não foi propagada. A somação de vários
mínimos potenciais e, após passar o limiar, geram potencial de ação da fibra muscular tipo tudo
ou nada. A acetilcolina desaparece por meio de dois processos: dissipação da junção através de
difusão e; destruição ou inativação pela acetilcolinaesterase em ácido acético e colina. A
atividade elétrica somada de centenas a milhares de potenciais de ação de fibras musculares
produz o potencial de ação da unidade motora, que pode ser registrado por eletromiograma com
agulha. A contração de fibras musculares isoladas não é graduada, mas sim a contração do
músculo como um todo.
SÍNDROMES DA ASA ANTERIOR DA MEDULA
Paralisia do neurônio motor inferior é o resultado direto da perda da função ou destruição das
células do corno anterior da medula ou de seus axônios nas raízes anteriores e nervos. Os sinais e
sintomas variam de acordo com a localização da lesão. O importante é descobrir se existe perda
sensitiva, caso exista, a topografia muda do corno anterior da medula para raízes anterior e
posterior ou nervos sensitivo e motor.
Essa síndrome não é exclusiva da asa anterior, mas também pode aparecer na lesão nos axônios
motores que derivam dos neurônios que se originam naquela asa. Paralisias devido à lesão no
neurônio motor inferior ocorrem quando todos ou praticamente todas as fibras motoras
periféricas são interrompidas, movimentos voluntários, posturais e reflexos daqueles músculos
são abolidos. Os músculos tornam-se relaxados e moles e não resiste ao estiramento passivo,
uma condição conhecida como flacidez. O tônus muscular – a discreta resistência que um
músculo relaxado oferece movimento passivo - reduzido apresenta-se como hipotonia ou atonia.
O músculo denervado mostra extrema atrofia, sendo reduzido em 20 a 30% de seu tamanho
original dentro de 3 a 4 meses. A reação do músculo a uma extensão aguda é perdida, como na
percussão de seu tendão com um martelo de reflexos, arreflexia. Lesão restrita a uma única
porção das fibras motoras que supre um músculo resulta em paresia, e uma proporcional
30
redução da força e da velocidade de contração. A atrofia será menor e o reflexo tendíneo
reduzido ao invés de perdida.
O eletroneurodiagnóstico da denervação depende do aparecimento de fibrilações, fasciculações
e outras anormalidades mostradas pelo eletrodo que está sendo examinado. Dentro de poucos
dias após a interrupção do nervo motor, a fibra muscular denervada começa a contrair
espontaneamente. Essa atividade isolada das fibras musculares individuais é chamada fibrilação.
A inabilidade da fibra isolada para manter um potencial de membrana estável é a sua
justificativa. As fibrilações são contrações musculares individuais, independentes e rítmicas (às
vezes de algumas fibras associadas sincronicamente), são tão finas que não podem ser vistas
através da pele à vista desarmada, que ocorrem de maneira espontânea em músculos
denervados e que habitualmente tem que atribuir a uma afecção das asas anteriores. Podem ser
registradas como um potencial de ação pequeno,
repetitivo de curta
duração
no
eletroneuromiograma (EMG). Quando o neurônio torna-se doente, como na atrofia espinhal
progressiva, pode manifestar irritação porque o axônio está instável e capaz de gerar impulsos
ectópicos e todas as fibras musculares que ele controla pode descarregar esporadicamente,
isolado de outras unidades. Seu aspecto ENMG é o de ondas bifásicas ou trifásicas, de aparição
espontânea, em repouso, de uma voltagem de 20 a 300 microvoltes em breve duração e de uma
frequência de descarga entre 2 e 30 por segundo.
Fasciculação é o resultado da contração de uma ou de várias unidades motoras que aparece
como um abalo visível. As fasciculações consistem de sacudidas contráteis em porções dos
músculos, visíveis através da pele e mucosa. Representam a classificação espontânea de uma UM
ou de um feixe de fibras musculares e se acompanham de potenciais de ação comparáveis em
seu tamanho aos da UM. O aspecto da ENMG é o de potenciais de ação comparáveis em seu
tamanho aos da UM. Sua morfologia é variável, em parte, devido aos efeitos da somação de
potenciais do número variável de fibras musculares que integram uma UM e, em parte, por estar
ativadas por descargas únicas ou repetidas que nascem dos diferentes segmentos do neurônio
motor inferior.
Mioquimia ocorre quando a contração simultânea ou seqüencial espontânea de múltiplas
unidades motoras causa ondulação do músculo.
31
Síndromes radiculopáticas
Lesões tanto dos nervos como raízes produzem fraqueza, atrofia, e às vezes fasciculações nos
músculos inervados pelas raízes afetadas, em alguns casos raízes múltiplas. A localização da raiz
afetada pela lesão requer um conhecimento de cada grupo de músculos supridos por uma
simples raiz anterior, miótomo, e cada área cutânea suprida pela raiz posterior, dermátomo. As
raízes dos nervos espinhais podem ser prejudicadas por trauma ou compressão por lesões de
tumores ou hérnias de discos. A mais comum radiculopatia é a que afeta a quinta e a sexta raízes
cervicais e a quinta lombar e primeira sacral.
Já que os músculos são inervados por mais do que uma raiz, pode ser difícil diferenciar uma raiz
C5 de C6 ou de C6 de C7 quando lesada. Por exemplo: a lesão de C6 pode deprimir tanto o
reflexo do bíceps como do tríceps. Diferenciando uma lesão de C5 da C7 é mais fácil porque a
lesão de C5 reduz o reflexo bicipital, enquanto que a de C7 reduz o reflexo tricipital. Na
extremidade inferior, a diferenciação de uma lesão da raiz de L5 da raiz de S1 é mais fácil
olhando o paciente andando de calcanhar ou na ponta dos pés. Fraqueza na dorsoflexão ao
andar com os calcanhares ocorre devido a uma lesão da raiz de L5, refletindo a ação do tibial
anterior. A dificuldade de andar na ponta dos pés devido à fraqueza dos músculos gêmeos
reflete a falta da raiz de S1, incluindo o reflexo aquileu.
Síndromes plexopáticas
As plexopatias braquiais apresentam uma variedade de síndromes clínicas que dependem em
parte do plexo envolvido. O trauma é a causa mais frequente de lesão, que geralmente resulta
da tração, compressão por tumores como de Pancoast ou linfonodos, estiramento do plexo,
radiação, ataques imunológicos (síndrome de Parsonage-Turner). A melhor pista da presença de
plexopatia é a de um déficit sensitivo e motor que envolve mais de uma raiz ou nervo periférico.
Os sinais motores (fraqueza, atrofia, e perda do reflexo tendíneo) são mais proeminentes do que
as alterações sensitivas. Para isso, veja na figura abaixo, um paciente do sexo masculino com
importante atrofia, assimétrica, nos músculos intrínsecos da mão direita, com o reflexo
estiloradial abolido à direita (Fig.15).
32
A
síndrome
de
Duchenne-Erb
é
caracterizada por lesão da parte mais
superior do plexo braquial que afeta as
raízes de C5-C6, durante o processo do
parto ou na neurite inflamatória na
síndrome
de
Parsonage-Turner.
A
síndrome
de
Dejerine-Klumpke
é
caracterizada por lesão da parte mais
Fig. 15
inferior do plexo braquial, lesando as
raízes de C8 e T1. Geralmente ocorre na síndrome do ápice pulmonar por compressão do tumor
de Pancoast. E, devido à passagem de fibras autonômicas simpáticas pode haver síndrome de
Claude-Bernard-Horner (veja o terceiro nervo craniano neste site).
Para distinguir uma lesão do plexo lombar de uma neuropatia femoral, uma cuidadosa pesquisa
deve ser feita com relação à fraqueza dos músculos adutores inervados pelo nervo obturador ou
perda sensitiva na região inguinal ou sobre a genitália, que estão fora da zona do nervo femoral.
Fraqueza na abdução e rotação interna da coxa e extensão do joelho, ou perda sensitiva da
região posterior da coxa na distribuição do nervo femoral cutâneo posterior, ajuda a distinguir
uma lesão do plexo sacral de uma paralisia ciática, que faltam esses sinais.
Neuropatia periférica
Já que um músculo é geralmente suprido por um único nervo periférico, a fraqueza no músculo é
geralmente mais fácil ser detectado do que na lesão de uma raiz porque o mesmo músculo é
suprido por dois ou mais miótomos. A localização é confirmada pelo padrão da perda sensitiva,
que na maioria dos casos difere da perda segmentar do dermátomo secundária a uma raiz
nervosa. Lesões de um único nervo são mais comumente devido a compressão, trauma ou
infecção do nervo secundária a diabete melito, ou uma vasculite. Quando um único nervo é
prejudicado chama-se mononeuropatia. Mononeuropatia multiplex refere ao envolvimento de
vários troncos nervosos em mais de um membro. Essa condição geralmente ocorre nas doenças
sistêmicas como vasculite autoimune, especialmente poliarterite nodosa e diabete melito.
33
Na polineuropatia, a característica essencial é o prejuízo na função de muitos nervos
simultâneos, causando perda simétrica da função começando na extremidade distal. As pernas
são afetadas antes dos braços. Hiporreflexia ou arreflexia precedem qualquer outro sintoma
motor ou sensitivo. O reflexo aquileu é afetado antes do reflexo patelar, depois é que ocorre
alteração nos reflexos dos braços. As polineuropatias podem ser principalmente sensitivas,
motoras ou mistas. O componente motor começa com fraqueza e atrofia nos músculos
intrínsecos dos pés; atrofia do extensor digitorum brevis é a primeira pista. Se o prejuízo motor
progredir, os próximos músculos afetados são os das pernas, produzindo fraqueza da extensão e
flexão plantares. Posterior, os músculos intrínsecos das mãos são afetados. As porções
musculares proximais são poupadas, exceto nos casos de Guillain-Barré e porfiria. As
polineuropatias simétricas distais lentamente progressivas são mais devido a problemas
sistêmicos como diabete melito, alcoolismo e uremia.
Veja na figura abaixo, um paciente do sexo masculino com neuropatia periférica tóxicocarencial,
tendo como agente agressor o uso abusivo crônico de bebida alcoólica. Observem a postura
típica das mãos e dos pés, além da alteração autonômica assimétrica em ambos os membros
inferiores (Fig.16).
Síndromes da junção neuromuscular
Fig. 16
O defeito na
transmissão
neuromuscular
na
miastenia gravis produz uma fraqueza muscular pura
sem atrofia, fasciculações ou alterações de reflexos.
A miastenia gravis também causa uma forma de
fraqueza nos músculos cranianos, diplopia, ptose
palpebral e fraqueza facial, além da fatigabilidade. A
fraqueza aumenta pela repetição dos movimentos,
mas após um repouso os músculos voltam ao
normal. Na diplopia e a ptose voltam quando o
paciente torna a usar seus respectivos músculos.
Observa-se ainda a voz nasalada, fala disártrica,
dificuldade de mastigar e engolir.
34
Na síndrome miastênica de Lambert-Eaton, apesar da fraqueza, a fadiga é menos importante. A
fraqueza dos músculos da faringe com disfagia é a única fraqueza da musculatura craniana.
Aparece disfunção autonômica e alteração de reflexos, sendo que o patelar está abolido. Surge
boca seca e perversão do paladar. Há o fenômeno de calor. Quando o músculo é estimulado
repetidamente, pode ganhar força, mas com a continuação a fadiga retorna. O baixo potencial de
ação inicial ocorre porque os anticorpos bloqueiam os canais de cálcio, causando lentidão na
entrada de cálcio no terminal présinaptico para iniciar a liberação das vesículas de acetilcolina.
Porque esse bloqueio é parcial, bastante cálcio eventualmente entra com despolarização
repetitiva o que permite a amplitude da resposta para aumentar a força, pelo menos temporária.
Em muitos casos, a síndrome de Lambert-Eaton ocorre por um câncer, portanto com freqüência
existe uma síndrome paraneoplásica.
Síndromes miopáticas
As doenças dos músculos, miopatias, caracterizam-se por apresentar fraqueza na cintura
escapular com força preservada na extremidade distal. Os reflexos são reduzidos na proporção
do grau de fraqueza, somente com fraqueza severa nos estágios finais os reflexos são abolidos.
Atrofia muscular pode ocorrer, mas de forma muito lente ao longo de vários anos. Em certas
distrofias musculares, especialmente de Duchenne, aparece pseudohipertrofia nas panturrilhas e
deltóides por infiltração de gordura nos músculos. Apresentam fácies típica com boca aberta e
imobilidade facial. Os músculos distais podem ser mais fracos do que os proximais na distrofia
miotônica e miosite por corpos de inclusão. Algumas miopatias afetam mais os músculos dos
pares cranianos do que os músculos dos membros, como na síndrome oftalmoplégica externa
progressiva crônica (SOEPC). Os olhos são simetricamente restritos e a diplopia não é uma
queixa. Algumas miopatias são congênitas, têm inicio mais tardio, curso mais benigno e uma
forma mais uniforme, como na distrofia facioescapuloumeral. Miopatias mitocondriais afetam
especialmente os músculos oculares e afetam outros órgãos sistêmicos. Miopatia infecciosa e
inflamatória afetam indivíduos mais idosos. A exceção é a dermatomiosite que pode ocorrer em
qualquer idade, mas é acompanhada de alterações na pele.
35
Veja na figura abaixo, um paciente com importante atrofia muscular nos deltóides e, ao lado, o
resultado da biópsia muscular mostrando importante infiltrado linfoplasmocitário compatível
com um quadro clínico de polimiosite (Fig.17).
Fig. 17
SÍNTESE DA NE UROREGULAÇÃO DA CONTRAÇÃO MUSCULAR
As fibras musculares esqueléticas são de dois tipos: as brancas ou pálidas e as vermelhas. A
contração das fibras pálidas é do tipo fásico de contração rápida e breve, enquanto as fibras
vermelhas são do tipo de contração lenta e prolongada. A diferença de aspecto entre ambas
deve-se à maior concentração de mioglobina nos músculos vermelhos, encarregados de
atividade que demanda maior suprimento de oxigênio. Mas, as estruturas
essenciais da
neuroregulação periférica da contração muscular são representadas por dois receptores
proprioceptivos: o fuso muscular e o órgão neurotendíneo de Golgi. Os fusos musculares estão
presentes em quase todos os músculos esqueléticos. O número de fusos por grama de músculo é
proporcional à riqueza e delicadeza de movimentos; assim essa cifra é de 29,3 para o abdutor
curto do polegar e de 1,4 para o grande dorsal.
O FM é uma estrutura complexa, neuromuscular, envolta por uma cápsula fibroelástica. É
constituído por delgadas fibras musculares estriadas ou FIF que se relacionam intimamente com
terminais nervosos sensitivos e motores. As FIF, em número médio de 10 por fuso, no homem
são de dois tipos: umas são longas e contêm na porção equatorial um aglomerado nuclear (FIFan); outras são mais curtas e numerosas e seus núcleos, na região equatorial, se dispõem como
as contas de um rosário, constituindo a cadeia nuclear (FIF-cn). A porção equatorial das FIF é
36
destituída de contratilidade, situando-se a porção ativa, dotada de miofibrilas, próximo aos pólos
da fibra. Cada fibra possui uma porção contrátil na extremidade.
Delgadas fibras motoras, as fibras γ, originadas nas colunas ventrais da medula ou em núcleos
motores de nervos cranianos, terminam nas áreas contráteis das FIF, seja mediante placas
motoras semelhantes às das fibras musculares comuns, FEF, seja por intermédio de delgadas
ramificações difusas. As primeiras são denominadas fibras γ1 ou dinâmicas, as segundas γ2 ou
estáticas. A região equatorial das FIF-an e FIF-cn é envolvida por terminais de grossas fibras
sensitivas tipo Ia de Lloyd, que constituem os receptores primários ou anuloespirais. Fibras
nervosas mais delgadas tipo II e, portanto, de condução mais lenta, se ramificam em buquê ou
receptores
secundários, situados nas regiões justaequatoriais e, por vezes e quase
exclusivamente nas FIF-cn, também na proximidade das zonas polares. Os neurônios γ2, estáticos
ou tônicos, exercem poderosa excitação dos receptores secundários, enquanto os neurônios γ1,
não atuam sobre eles, não obstante excitem intensamente o receptor primário. Os impulsos
provenientes dos receptores anuloespirais atingem a medula numa velocidade entre 100 a 120
m\s, onde vão estimular diretamente os motoneurônios α1, determinando uma contração fásica
das FEF, em sentido oposto ao estiramento. Essa resposta é auxiliada pela facilitação
monossináptica dos motoneurônios para os músculos sinérgicos e pela a inibição bissináptica dos
motoneurônios para os antagonistas. O reflexo tônico sensibiliza o FM e, além disso, é muito
mais dependente da inervação motora γ dos FM que o reflexo fásico, pois esta mantém a
sensitividade do receptor e determina uma corrente tetanizante de impulsos aferentes. Ou seja,
quando se estimula isoladamente as fibras γ não há contração direta das FEF, mas sim das FIF.
Como a porção miofibrilar dessas últimas se encontra em cada uma das extremidades da fibra,
sua contração provoca a distensão e a excitação dos receptores localizados na região equatorial,
proporcionando uma rajada sincrônica de impulsos aferentes, causadora da contração reflexa.
Essa contração das FEF descarrega o FM e, destarte, tende a contrapor-se à sua atividade.
Há estruturas que se relacionam com os fenômenos de inibição dos reflexos miotáticos ao nível
segmentar da medula. A primeira das estruturas é o ONT é um receptor proprioceptivo
constituído por finas ramificações nervosas situadas na intimidade dos fascículos tendíneos e,
que, por isso, captam a tensão muscular, sendo estimuladas tanto pelo estiramento como pela
37
contração das FEF. Seu limiar de excitação, 100 a 200 g de tensão, é bem maior que os dos FM, 1
a 3 g de tensão, e os impulsos são levados por fibras grossas ou Ib, à medula, onde irão inibir
bissinapticamente os motoneurônios α que se destinam aos músculos em que a tensão foi
elevada, ao mesmo tempo que facilitarão polissinapticamente os motoneurônios para os
antagonistas. A intervenção dos ONT explica a reação de alongamento observada no sinal do
canivete. A distensão passiva do músculo espástico provoca inicialmente intenso reflexo de
tração, que se contrapõe ao estiramento. Entretanto, se o grau de tensão for muito grande,
vencendo o elevado limiar do ONT, esse deflagra um influxo que vai inibir o reflexo de tração,
cessando totalmente a resistência muscular e assim evitando que o estiramento excessivo ponha
em risco a integridade do músculo. Por isso, a reação de alongamento é também chamada de
reflexo miotático invertido. A segunda das estruturas são os receptores em buquê, os quais não
são responsáveis pelo reflexo fásico de tração. A excitação das fibras sensitivas tipo II
provenientes dos receptores secundários determina discreta inibição dos motoneurônios α2 para
os músculos extensores e seus sinérgicos, assim como moderada facilitação dos motoneurônios
α2, para os antagonistas. A terceira das estruturas são os axônios dos motoneurônios α que
emitem, logo após sua origem, um ramo colateral que entra em sinapse com uma célula de
Renshaw, cujo axônio vai inibir os referidos motoneurônios.
Quanto ao destino suprasegmentar, as informações provenientes dos ONT e dos receptores
primários e secundários dos FM (fibras Ib, Ia e II, respectivamente) seguem pelos tratos
espinocerebelares dorsal e cuneocerebelar, enquanto os tratos espinocerebelares ventral e
rostral veiculam quase exclusivamente os impulsos oriundos dos ONT. Várias regiões facilitam a
atividade do FM como: córtex motor, tratos piramidais, cabeça do núcleo caudado, sistema
reticular do tronco cerebral e da medula, cerebelo e habênula. O tálamo ativa o sistema eferente
γ. Mas, a inibição da atividade do FM ocorre por destruição do sistema bulborreticular inibidor.
38
LEITURAS RECOMENDADAS
1. BARRAQUER-BORDAS, L. NEUROLOGÍA FUNDAMENTAL. TERCEIRA EDICIÓN. ESPANHA. TORAY.
1976. PG. 1144.
2. BRODAL, A. ANATOMIA NEUROLÓGICA. 3a. EDIÇÃO. SÃO PAULO. ROCA. 1984. PG. 888.
3. CAMPBELL, W.W. DeJONG: THE NEUROLOGIC EXAMINATION. SIXTH EDITION, PHILADELPHIA,
LIPPINCOTT WILLIAMS & WILKINS, 2005, p.671.
4. CANELAS, H.M; ASSIS, J.L; SCAFF, M. FISIOPATOLOGIA DO SISTEMA NERVOSO. SÃO PAULO.
SARVIER. 1983.PG.476.
5. CINGOLANI, H.E. & HOUSSAY, A.B. FISIOLOGIA HUMANA DE HOUSSAY. SÉTIMA EDIÇÃO. SÃO
PAULO. ARTMED. 2004. PG.1124.
6. EYZAQUIRRE, C & FIDONE, S.J. FISIOLOGIA DO SISTEMA NERVOSO. SEGUNDA EDIÇÃO.
GUANABARA KOOGAN. RIO DE JANEIRO. 1977. PG. 398.
7. GOETZ.C.G. TEXTBOOK OF CLINICAL NEUROLOGY. THIRD EDITION. SAUNDERS-ELSEVIER.
CHICAGO. 2007. PG. 1364.
8. LENT, R. CEM BILHÕES DE NEURÔNIOS: CONCEITOS FUNDAMENTAIS DE NEUROCIÊNCIAS. SÃO
PAULO, EDITORA ATHENEU, 2005, p. 698.
9. NETTER, F.H. COLECCIÓN CIBA DE ILUSTRACIONES MÉDICAS. TOMO I \1. ANATOMIA Y
FISIOLOGÍA. SALVAT EDITORES. BARCELONA. 1987. PG. 235.
10. TOLOSA, A; CANELAS, H. PROPEDÊUTICA NEUROLÓGICA. REIMPRESSÃO DA SEGUNDA
EDIÇÃO. SÃO PAULO. SARVIER. 1975. PG. 526.
11. WARWICK, R & WILLIAMS, P. L. GRAY ANATOMIA. TOMO II. 35a EDIÇÃO. RIO DE JANEIRO.
GUANABARA KOOGAN. 1979. PG.708-1375.
12. ROPPER, A.H & BROWN, R.H. PRINCIPLES OF NEUROLOGY. EIGHTH EDITION. NEW YORK.
McGRAW-HILL.2005.PG.1382.
39