1
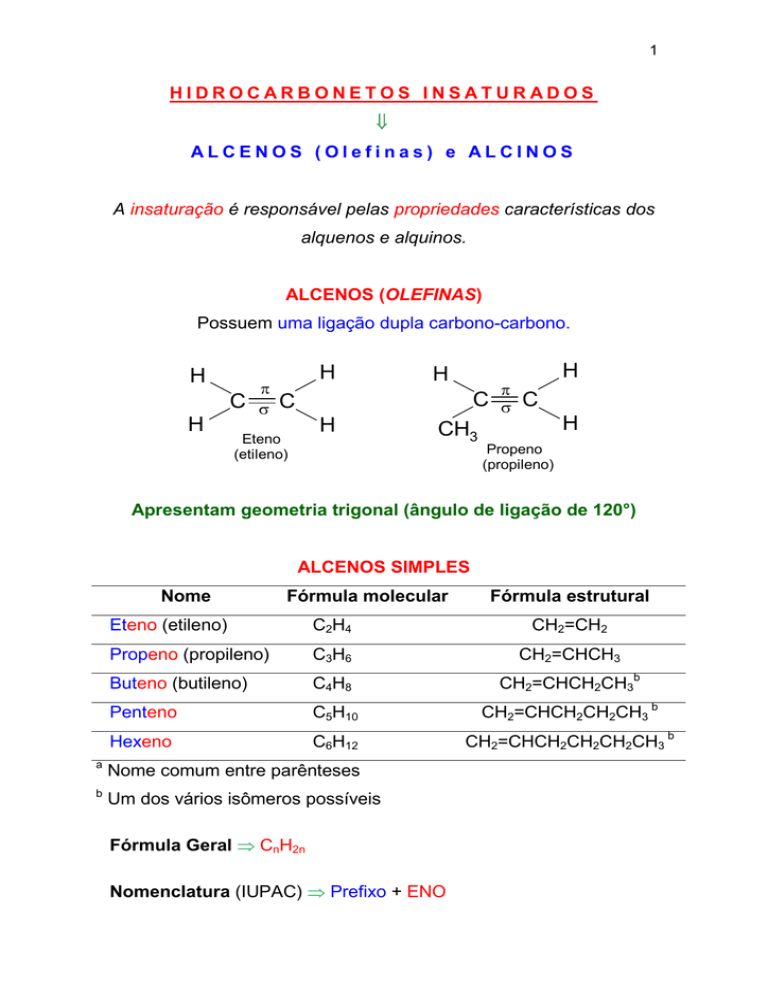
HIDROCARBONETOS INSATURADOS
ALCENOS (Olefinas) e ALCINOS
A insaturação é responsável pelas propriedades características dos
alquenos e alquinos.
ALCENOS (OLEFINAS)
Possuem uma ligação dupla carbono-carbono.
H
C
H
H
H
C
C
H
Eteno
(etileno)
CH3
H
C
H
Propeno
(propileno)
Apresentam geometria trigonal (ângulo de ligação de 120°)
ALCENOS SIMPLES
Nome
Fórmula molecular
Fórmula estrutural
Eteno (etileno)
C2H4
CH2=CH2
Propeno (propileno)
C3H6
CH2=CHCH3
Buteno (butileno)
C4H8
CH2=CHCH2CH3b
Penteno
C5H10
CH2=CHCH2CH2CH3 b
Hexeno
C6H12
CH2=CHCH2CH2CH2CH3 b
a
Nome comum entre parênteses
b
Um dos vários isômeros possíveis
Fórmula Geral CnH2n
Nomenclatura (IUPAC) Prefixo + ENO
2
Regras IUPAC a cadeia é numerada de modo que o átomo de
carbono da ligação dupla tenha o menor número possível.
Os alquenos podem formar isômeros.
Isomeria Geométrica (cis-trans ou E-Z) resultado da restrição da
rotação de grupos ligados aos carbonos da ligação dupla C=C. Os
isômeros diferem entre si no arranjo espacial de seus átomos e são
denominados ESTEREOISÔMEROS.
Cl
Cl
C
H
H
Cl
C
C
H
Cis-1,2-dicloro-eteno
H
C
Cl
Trans-1,2-dicloro-eteno
CH3
C
H
CH3
CH3
H
C
C
H
CH3
Cis-2-buteno
C
H
Trans-2-buteno
Estes pares de compostos são isômeros (possuem a mesma
fórmula molecular C2H2C2 e C4H8) e suas estruturas não são
superponíveis, no entanto, não são isômeros constitucionais (a
ordem de ligação dos átomos é a mesma em cada um).
Isômeros geométricos apresentam propriedades físicas diferentes
(TE e TF diferentes) e diferem bastante na grandeza de seus
momentos dipolares.
3
Exemplos:
H
Cl
C
C
H
1,1-dicloro-eteno
(Não há isomerismo cis-trans)
F
F
Cl
C
Cl
C
Cl
H
Cl
1,1-tricloro-eteno
(Não há isomerismo cis-trans)
F
C
Cl
Cl
C
Cl
Cis-1,2-difluoro-1,2-dicloro-eteno
C
Cl
C
F
Trans-1,2-difluoro-1,2-dicloro-eteno
A isomeria geométrica não ocorre se um átomo de carbono da
ligação dupla está ligado a dois grupos idênticos.
Propriedades físicas
Os alcenos apresentam propriedades físicas semelhantes as dos
alcanos.
Temperaturas de fusão e de ebulição são semelhantes aos
alcanos (com esqueleto carbônico semelhante), aumentam com o
tamanho da cadeia.
Solubilidade são insolúveis em H2O, mas bastante solúveis em
solventes apolares (benzeno, éter, CHCl3).
Densidade também são menos densos que a água.
Possuem momentos de dipolo maiores do que os alcanos (os
elétrons podem ser facilmente arrancados).
4
DIENO Alceno com duas ligações duplas. As posições das
duplas são indicadas por números. Por exemplo: 1,3-butadieno.
CH2
CH2
CH
CH
Obtenção dos alcenos
Os alcenos são comuns na natureza.
Os carotenos são compostos responsáveis pela cor do tomate, da
cenoura, do camarão fervido e das folhas das árvores no outono,
possuem várias duplas conjugadas. Os carotenos participam da
fotossíntese e são intermediários da biossíntese da vitamina A.
H3 C
CH3
CH3
H
C
C
H2 C
C
H2 C
C
C
H2
CH3
H
C
C
C
CH3 H
C
H
H
C
C
C
H
H
C
C
H
C
H
H
C
H
C
C
C
H
C
CH3
C
H3 C
H
C
C
C
H
CH3
CH3
H2
C
CH2
C
CH2
CH3
-caroteno
H
C
C
C
H2 C
H2 C
CH3
CH3
H3 C
CH3
H
C
C
C
H
C
H
H2
C OH
C
C
H
C
H
C
C
H2
CH3
Vitamina A1
Os terpenos são os componentes mais importantes dos óleos
essenciais (compostos de folhas, caules, flores ou ramos que
possuem o odor ou aroma da planta). A maioria deles contém 10,
15, 20 ou 30 átomos de carbono.
5
Antigamente acreditava-se que eram derivados do isopreno (metil1,3-butadieno)
CH3
CH2
C
CH
CH2
Limoneno Obtido do óleo de limão ou laranja é um terpeno
cíclico, formado por duas unidades de isopreno.
CH3
C
HC
CH2
H2C
CH2
H
C
Limoneno
C
H2C
CH3
A maioria dos terpenos é volátil, evapora facilmente (a exalação de
terpenos pelas plantas e árvores é uma fonte natural de
hidrocarbonetos na atmosfera).
O isopreno encontra-se também na borracha natural (látex). A
insaturação permite a vulcanização, ou seja, a formação de pontes
de enxôfre entre as diferentes cadeias.
6
Os alcenos e os alcinos são mais reativos do que os alcanos,
devido às insaturações que promovem as reações características
destes compostos.
Reações dos Alcenos
Adição = Ocorre ruptura da ligação (mais fraca) e formação de
duas ligações fortes. A adição pode ser iônica ou por radical livre.
Iônica Favorecida por solventes polares
C
C
+ -
C
C
Radical Favorecida por solventes apolares
C
C
. .C
C
Halogenação = Os alcenos são facilmente convertidos pelo cloro
ou pelo bromo em compostos saturados. Em geral, o iodo não
reage.
A adição do bromo é uma reação útil para detecção da ligação
dupla C=C. A solução de bromo em CC4 é vermelha; o di-haleto
como no alceno é incolor. A perda de cor numa solução de bromo é
característica de compostos que contêm a ligação dupla C=C.
7
CCl4
CH2 CH2 + Br2
H
H
Br
C
C
Br
H
Eteno
H
1,2-dibromo-etano
Mecanismo
A reação de halogenação de alcenos é possivelmente uma adição
eletrofílica.
Eletrófilo: Espécie deficiente em elétrons.
C
C
Br
+
C
C
C
Br
C
Br
C
C
Br
+
Br
Br
Br
-
Br
Foi sugerido um intermediário
alternativo, o íon bromônio
Br
C
C
C
Br
+
C
Br
Nesta etapa, a presença de outros
ânions, pode originar a formação
de produtos mistos.
A adição é facilitada pela presença de substituintes doadores de
elétrons nos átomos de carbono da ligação dupla.
H3C
CH3
H3C
CH3
CH2
H3C
C C
C C
H3C
CH3
CH2
H3C
CH2
CH
H
H3C
C C
H
C C
H
H3C
H
COOH
CH2
CHCl
H
H
8
A presença de núcleo benzênico acelera muito a reação
CH
+
X2
CH2
CH
CH2X
CH
CH2X
+
Adição de haletos de hidrogênio (HX)
Facilidade de adição: HF < HCl < HBr < HI
Se a olefina for assimétrica a adição pode ocorrer de duas formas.
H3C
C
H
+
H
+
H
C
H
+
H3C
H
H
Propileno
H
-
H
Cl
C C
H
H
H3C
C
H
+
C
H
H
H
H3C
H
C
C
Cl
H
H
-
Cl
Carbocátion
primário
H
H3C
H
C
C
H
Cl
Não acontece
(> tendência à formação
de um carbocátion
secundário)
Carbocátion
secundário
H
Regra Markovnikov: O grupo mais negativo se liga ao átomo mais
substituído da insaturação.
A adição de haletos de hidrogênio a olefinas apresenta dificuldades
experimentais, em solução aquosa ou solventes hidroxílicos, a
hidratação catalisada por ácidos constitui-se em reação competitiva.
Na presença de peróxidos, a adição de HBr inverte a regra de
Markovnikov.
9
Hidrogenação = Método útil na preparação de alcanos,
convertendo ligações duplas (C=C) em ligações simples (C-C).
Variando o catalisador e as condições de reação, pode-se
hidrogenar seletivamente uma ligação múltipla:
Uma ligação dupla C=C, mas não uma dupla C=O.
Uma ligação tripla, mas não uma ligação dupla.
Até mesmo uma determinada ligação dupla e não outra.
A hidrogenação é extremamente seletiva
Hidrogenação heterogênea Método clássico (o catalisador é um
metal finamente dividido, geralmente, Pt, Pd, Ni).
Agita-se uma solução de alqueno sob leve pressão de hidrogênio,
em presença de uma pequena porção de catalisador. A reação
processa-se rápida e suavemente. Após a reação estar concluída, o
catalisador insolúvel é separado do produto por filtração.
H2, Pd
CH3
CH3
CH3
CH3
cis-ciclohexano
1,2-dimetil-ciclohexeno
H3C
H3C
C
C
CH3
H2, Pd
C
H
Dimetil-acetileno
CH3
C
H
cis-2-buteno
10
Hidrogenação homogênea Muito mais recente, apresenta uma
flexibilidade que não é possível alcançar com os antigos
catalisadores.
Catalisadores são complexos orgânicos dos metais de transição
como ródio ou irídio. São solúveis em solventes orgânicos
produzindo a hidrogenação numa única fase. O inconveniente é a
separação do catalisador do produto da reação.
A reação é geralmente quantitativa e é fácil medir o volume de
hidrogênio consumido. Portanto, a hidrogenação é usada como
método de análise para determinar o número de ligações duplas
existentes num composto.
H
H
C
+
C
H
H2
H
H
H
H
C
C
H
H
H
A hidrogenação é exotérmica As duas ligações (C-H) que se
formam são, juntas, mais fortes que a ligação (H-H) e a ligação
que se rompem.
Hidratação = Adição de água (catalisada por ácidos) à dupla
ligação de um alceno, método conveniente para a preparação de
álcoois secundários e terciários.
Os ácidos normalmente usados para catalisar a hidratação dos
alquenos são: ácido sulfúrico e ácido fosfórico. (Normalmente não
se usam haletos de hidrogênio como fontes de prótons por sua
tendência a se adicionarem).
11
Os íons (HSO4)- produzidos pelo H2SO4 são fracamente nucleófilos
e se forem adicionados seriam facilmente eliminados (hidrolisados
pela H2O).
A adição de água à dupla ligação segue a regra de Markovnikov
(geralmente não se formam álcoois primários).
CH3
CH3
CH3
+
CH2
C
HOH
H+
CH3
25°C
2-metil-propeno
CH3
C
OH
álcool-t-butílico
Mecanismo
..
+
H (meio ácido)
HOH
..
CH3
CH3
C
CH3
H
CH2
+
H
O
+
CH3
H
C
+
H
H
CH3
+
O
..
Etapa predominante
da velocidade da reação
(formação de carbocátion)
H
O
+
CH3
CH3
H
H
+
CH3
C
CH3
OH
..
CH3
O+
O
H
CH3
C
H
H
H
Reação importante na conversão de frações de petróleo em
álcoois.
Oxidação = Os alquenos sofrem reações de oxidação da ligação
dupla carbono-carbono.
12
O permanganato de potássio (KMnO4) e o tetróxido de ósmio
(OsO4), podem ser usados para promover a oxidação de alquenos a
glicóis (equivalente à adição de 2 grupos hidroxila à ligação dupla)
+
CH2
CH2
a frio
KMnO4
OH -
Eteno
(etileno)
CH2
OH
OH
Etileno glicol
CH3
CH
CH2
OsO4
CH2
CH3
Na2SO4
Propeno
(propileno)
CH
CH2
OH
OH
Propileno glicol
Mecanismos
O
CH2
CH2
+
O
-
Mn
O
O
CH2
CH2
O
O
H2O
CH2
OH
OH
+
MnO2
Cis-1,2-diol
Mn
O
CH2
O
Os alquenos também podem ser oxidados com perácidos
(RCOOOH).
CH2
CH2
+
O
..O
C
O HO +
R
CH2
+
O
H
CH2
OH
H
H
CH2
CH2
OH
Trans-1,2-diol
É possível controlar estereoespecificamente a hidroxilação.
13
Halogenação de dienos conjugados = Os dienos conjugados
tendem a sofrer reações de adição mais facilmente do que os nãoconjugados.
Ex: Bromação do butadieno
CH2
CH
CH
CH2
Protonação favorecida
(carbocátion secundário
estabilizado por conjugação)
+
H
Br
CH2
+
CH
CH
CH2
Br-
H
CH2
CH
CH
H
CH2
CH
H
(adição 1,2)
CH
Br
+
CH2
CH2
CH2
CH
H
(adição 1,4)
CH
CH2
A presença de conjugação não torna obrigatória a adição 1,4
apenas a possibilita.
Adição 1,2 Tende a ocorrer a temperaturas baixas e solventes
apolares.
Adição 1,4 Tende a ocorrer a temperaturas elevadas e solventes
polares.
14
ALCINOS
Os alcinos se comportam de maneira similar aos alcenos. Nos
alcinos, duas moléculas do reagente podem reagir com cada
ligação tripla.
Hidrogenação do etino
H
C
C
H
2 H2
Ni, Pd
H
Alquino
H
H
C
C
H
H
H
Alcano
Utilizando-se condições apropriadas, a reação pode ficar limitada ao
primeiro estágio da reação e formar alcenos.
R
C
C
Na, Li
NH3
R'
C
H2
H
H2
H
R
C
R'
Trans
H
H
C
C
Catalisador de Lindlar
(Pd/CaCO3)
R
R'
Cis
Estas reações são estereosseletivas.
A estereoespecificidade dos alcenos é extremamente importante
em sistemas biológicos e é particularmente evidente na ação de
feromonas (compostos produzidos por um organismo com o fim de
comunicar-se com outro organismo da mesma espécie: para atrair
indivíduos do sexo oposto, para lançar o alarme, para assinalar
pistas de alimentos)
15
O isômero Z “puro” é totalmente inativo.
Adição de halogênios
C
X2
C
X2
C
C
X
H
X
X
X
C
C
X
X
H
(X2=Cl2 ; Br2)
Ex:
Br
CH3 C
CH
Br2
CH3 C
Br
CH
Br
Br2
Br
CH3 C
C
Br
Br
+
O intermediário formado é um cátion vinílico: CH3 C
H
CH
A adição de ácidos próticos aos alquinos produz-se praticamente à
mesma velocidade dos alquenos.
16
Frente à adição de halogênios, os alquinos são consideravelmente
menos reativos que os alquenos.
Nos alquenos forma-se um cátion halônio. Nos alquinos é mais
difícil se formarem estes intermediários cíclicos.
Hidratação = Os alquinos adicionam água facilmente quando a
reação é catalisada por ácidos fortes e íons mercúrio (Hg++). Pode
ocorrer tautomeria.
O álcool vinílico que é produzido inicialmente é geralmente instável,
e se rearranja rapidamente a um aldeído ou cetona.
C
C
+ H2O
HgSO4
H2SO4
H
CH
C
C
C
OH
H
O
álcool vinílico
aldeído ou cetona
O rearranjo envolve o deslocamento do próton para o carbono
adjacente.
“Tautomeria ceto-enólica”
C
C
H O
.. .
Forma enol
C
C
.O
..
H
+
+ H
* Existe efetivamente um equilibrio entre
as duas estruturas, mas geralmente
deslocado em favor da forma cetônica
Forma ceto
Oxidação = Alcinos tratados com permanganato de potássio
básico, sofrem quebra oxidativa, do mesmo modo que os alcenos.
Os produtos da reação são ácidos carboxílicos.
17
Os ácidos carboxílicos são facilmente identificáveis e a partir deles
é possível localizar a posição da ligação tripla de um alcino.
Ex: hex-3-ino
CH3CH2C
CCH2CH3
(1) KMnO4
OH , 25°C
(2)
H+
2 CH3CH2COOH
ácido propanóico
Hex-1-ino
CH3CH2CH2CH2C
CH
(1) KMnO4
OH , 25°C
(2) H+
CH3CH2CH2CH2COOH
+
CO2
áciodo pentanóico
Propriedades físicas
As propriedades físicas são muito semelhantes às dos alcenos e
dos alcanos.
Apenas ligeiramente solúveis em água. Solúveis em solventes de
baixa polaridade (tetracloreto de carbono, éter e alcanos).
Como os alcanos e alcenos, são menos densos que a água.
Os três primeiros alquinos são gases à temperatura ambiente.
18
HIDROCARBONETOS CÍCLICOS
Possuem anéis constituídos por átomos de carbono.
O cicloalcano mais simples possui três átomos de carbono.
CH2
H2C
Propano na forma de anel
CH2
O ciclopropano, um gás incolor de aroma adocicado, é um
anestésico largamente usado que age rapidamente, mas que pode
ser explosivo quando misturado com oxigênio.
Cicloalcanos
Fórmula molecular
Nome
Fórmula estrutural
CH2
C3H6
C4H8
Ciclopropano
Ciclobutano
H2C
CH2
H2C
CH2
H2C
CH2
CH 2
C5H10
Ciclopentano
H 2C
CH 2
H 2C
CH 2
CH2
H2C
CH2
H2C
CH2
( )
C6H12
Ciclo-hexano
*
CH2
O anel de 6 membros, representa o tamanho e a forma de anel
mais comum em moléculas orgânicas encontradas nos seres vivos.
19
Os cicloalcanos, especialmente os menores, são muito reativos
porque as ligações estão “tensas”. Os ângulos internos são
menores do que o ângulo normal (109,5°) do carbono tetraédrico.
Reações de adição de moléculas de hidrogênio para formar
alcanos lineares.
CH2
H2C
+
CH2
H2
Propano
Ciclopropano
H2C
CH2
+
H2C
CH3CH2CH3
CH2
Ciclobutano
H2
CH3CH2CH2CH3
Butano










