“RECUPERAÇÃO DE ZINCO, CÁDMIO E COBRE DE LICORES SULFÚRICOS
PROVENIENTES DE RESÍDUOS INDUSTRIAIS DA METALURGIA
EXTRATIVA DO ZINCO”
Ligiane Rios Gouvea
Dissertação apresentada como parte dos requisitos
para obtenção do grau de Mestre em Ciência e
Tecnologia das Radiações, Minerais e Materiais
2008
Comissão Nacional de Energia Nuclear
CENTRO DE DESENVOLVIMENTO DA TECNOLOGIA NUCLEAR
Programa de Pós-Graduação em Ciência e Tecnologia das
Radiações, Minerais e Materiais
“RECUPERAÇÃO DE ZINCO, CÁDMIO E COBRE DE LICORES SULFÚRICOS
PROVENIENTES DE RESÍDUOS INDUSTRIAIS DA METALURGIA
EXTRATIVA DO ZINCO”
Ligiane Rios Gouvea
Dissertação apresentada ao Curso de Pós-Graduação em Ciência e
Tecnologia das Radiações, Minerais e Materiais, como requisito parcial à
obtenção do Grau de Mestre
Área de concentração: Ciência e Tecnologia dos Minerais
Orientador: Dr. Carlos Antônio de Morais
Belo Horizonte
2008
COMISSÃO NACIONAL DE ENERGIA NUCLEAR
CENTRO DE DESENVOLVIMENTO DA TECNOLOGIA NUCLEAR
Curso de Pós-graduação em Ciência e Tecnologia
das Radiações, Minerais e Materiais
Ligiane Rios Gouvea
“RECUPERAÇÃO DE ZINCO, CÁDMIO E COBRE DE LICORES SULFÚRICOS
PROVENIENTES DE RESÍDUOS INDUSTRIAIS DA METALURGIA
EXTRATIVA DO ZINCO”
Dissertação de Mestrado apresentada ao Curso de Pós-graduação em
Ciência e Tecnologia das Radiações, Minerais e Materiais do
Centro de Desenvolvimento da Tecnologia Nuclear
Área de concentração: Ciência e Tecnologia dos Minerais
Orientador: Dr. Carlos Antônio de Morais
Belo Horizonte
2008
I
“A Deus, aos meus pais,
a Ane Laura e ao grande amor
da minha vida: Thiago.”
II
AGRADECIMENTOS
À Deus
O principal responsável por este trabalho.
Ao meu orientador
Prof. Dr. Carlos Antônio de Morais,
Pela experiência, apoio e dedicação no desenvolvimento de todas as etapas desta jornada.
Aos professores da pós-graduação
Pelo conhecimento transmitido, em especial a Ana Cláudia Queiroz Ladeira e Vanusa Maria
Feliciano Jacomino.
À FAPEMIG
Pela concessão da bolsa de pesquisa.
À CNEN e ao CDTN
Por permitir o uso das instalações para a realização deste trabalho.
À Companhia Paraibuna de Metais – CPM
Pelo fornecimento das amostras necessárias à realização deste trabalho.
III
As secretárias
Aparecida (Cida), Andréa e Roseli.
Pela convivência amiga e pelas conversas calorosas.
Aos Funcionários do CDTN
Pela colaboração no desenvolvimento de todas as etapas deste trabalho. Em especial:
Eugênio Miranda, grande colaborador nos testes de laboratório.
Marcos Antônio, responsável pela montagem e operação dos testes contínuos.
Luis Carlos, responsável pelo laboratório de análise química.
Elizabeth Kerpe e Ester Figueiredo, pelo apoio na correção deste texto.
Liliane Pacheco Tavares, por todas as análises realizadas com competência e dedicação e pela
convivência amiga.
A todos os colegas da pós-graduação
Pois juntos trilhamos uma etapa importante de nossas vidas.
Aos meus pais e irmã
Pela confiança e apoio.
Ao Thiago
Pela motivação, força e paciência.
Aos amigos e colegas
Pela vibração em relação a esta jornada.
IV
RECUPERAÇÃO DE ZINCO, CÁDMIO E COBRE DE RESÍDUOS INDUSTRIAIS
GERADOS NA METALURGIA EXTRATIVA DO ZINCO.
Ligiane Rios Gouvea
RESUMO
Este trabalho apresenta o desenvolvimento de técnicas hidrometalúrgicos para o
tratamento de licores gerados a partir de resíduos industriais da metalurgia extrativa do zinco. Um
dos licores (ZnCu) contém teores significativos de zinco e cobre (29,6 g/L Zn e 37,4 g/L Cu) e o
outro licor (ZnCd) contém elevados teores de zinco e cádmio (141 g/L Zn e 53,4 g/L Cd).
A recuperação dos metais Zn e Cd, a partir da amostra ZnCd, foi realizada pela técnica
de cementação. As variáveis de processo investigadas foram: temperatura, pH inicial do licor,
tempo de reação e o excesso de pó de zinco metálico. Após a definição das melhores condições,
foi obtida uma solução de sulfato de zinco com teor de 150 g/L de Zn e 0,005 g/L de Cd, passível
de alimentar a etapa de eletrólise para a obtenção do zinco metálico. O cádmio metálico obtido
apresentou pureza superior a 90% com uma recuperação de 99,9%.
No estudo com a amostra ZnCu utilizou-se a técnica de extração por solventes (extração
líquido-líquido). Foram realizados experimentos descontínuos e contínuos. Nos experimentos
descontínuos, investigou-se as seguintes variáveis de processo: tipo e concentração do agente
extratante, acidez da fase aquosa, relação volumétrica entre as fases e concentração do agente
reextratante (solução de ácido sulfúrico). Os experimentos foram realizados em temperatura
ambiente, (25 ± 2oC) e velocidade de agitação de 500 rotações por minuto (rpm). Foram testados
seis extratantes trocadores catiônicos. Três da classe dos extratantes ácidos (D2EHPA,
IONQUEST®801 e CYANEX®272) e três da classe dos extratantes quelantes (LIX®63,
LIX®984N e LIX®612N-LV). Todos os extratantes apresentaram elevados fatores de separação,
indicando alta potencialidade de obtenção dos metais zinco e cobre, separadamente, em elevada
pureza. Com os extratantes D2EHPA, IONQUEST e CYANEX, os fatores de separação Zn/Cu
foram 296, 323 e 361, respectivamente. Com o LIX®612N-LV, obteve-se um fator de separação
Cu/Zn 94, enquanto para o LIX®63 e o LIX®984N este fator foi de 62 e 37, respectivamente.
Dentre os extratantes testados, foi selecionado o D2EHPA para o estudo das variáveis de
processo e realização dos experimentos contínuos. O melhor resultado foi obtido com o D2EHPA
V
1 mol/L em pH de equilíbrio próximo de 2, em uma relação de fases A/O igual a 1 e tempo de
contato de 10 minutos. Os ensaios de reextração foram realizados com solução de H2SO4. Os
resultados mostraram que o cobre co-extraído, juntamente com o zinco, pode ser removido da
fase orgânica através de uma etapa de lavagem utilizando solução diluída de ácido sulfúrico e o
zinco reextraído com uma solução de H2SO4 mais concentrada (2 mol/L).
Depois de selecionadas as melhores condições de processo, foram realizados cinco
ensaios contínuos, até se atingir a condição ótima de separação dos metais Zn e Cu. Os
experimentos de 1 a 4 foram realizados com uma solução preparada no laboratório, simulando o
licor industrial. O experimento contínuo 5 foi realizado com a solução original, gerada na
lixiviação do resíduo industrial, contendo 29,6 g/L Zn, 37,4 g/L Cu, 1,94 g/L Cd, 0,127 g/L Co e
0,100 g/L Ni. O experimento foi realizado nas mesmas condições operacionais do experimento 4,
onde foi obtido o melhor resultado. O circuito de extração constou de 3 estágios de extração, 3
estágios de lavagem e 5 estágios de reextração. Neste experimento foi obtido um reextrato com
125 g/L Zn, 0,05 g/L Cu e teores de Cd, Co e Ni menores que 0,005 g/L. A concentração dos
metais no rafinado foi de 28,6 g/L Cu, 0,49 g/L Zn, 1,48 g/L Cd, 0,080 g/L Ni e 0,098 g/L Co.
VI
RECORY OF ZINC, CADMIUM AND COPPER FROM INDUSTRIAL RESIDUES IN THE
ZINC EXTRACTION MATALLURGY
Ligiane Rios Gouvea
Abstract
This paper presents a development of hydrometallurgic techniques for the treatment of
liquors obtained from industrial residues generated in the zinc extractive metallurgy. One of the
liquors (ZnCu) contains significant amounts of zinc and copper (29.6 g/L zn and 37.4 g/L Cu)
and the other (ZnCd) containing high levels of zinc and cadmium (141 g/L Zn and 53.4 g/L Cd).
The recovery of the Zn and Cd metals from the ZnCd sample was carried out using the
cementation technique. The process variables investigated were: temperature, initial pH of the
liquor, reaction time and the metallic zinc powder excess. After establishing the best conditions, a
zinc sulphate solution containing 150 g/L of Zn and 0.005 g/L of Cd was obtained. This solution
is capable of feeding the electrolysis stage in order to obtain metallic zinc. The level of purity of
the metallic cadmium obtained by the cementation technique was higher than 90%, and the
recovery rate was 99.9%.
The separation of zinc and copper from the ZnCu sample was carried out using the
solvent extraction technique. Non-continuous and continuous experiments were done.
In the
non-continuous experiment, the following process variables were investigated: type and
concentration of the extractants, acidity of the aqueous phase, volume relation between the phases
and the stripping agent concentration (sulphur acid solution). The experiments were carried out in
a room temperature (25 ± 2oC), and with an agitation of 500 rpm. Six cationic extractants were
investigated - three acid extractants (D2EHPA, IONQUEST®801 and CYANEX®272) as well as
three chelating extractants (LIX®63, LIX®984N and LIX®612N-LV). All extractants presented a
high separation factor and could be used in the separation process.
The Zn/Cu separation factor obtained with D2EHPA, IONQUEST and CYANEX was 296, 323
and 361 respectively. The Cu/Zn separation factor obtained with LIX®612N-LV was 94, whereas
the one obtained for LIX®63 and LIX®984N was 62 and 37 respectively.
Amongst the
extractants tested, the D2EHPA was the one selected for the study of the variables of this process.
The best result was attained with the D2EHPA 1 mol/L at an equilibrium pH near 2, and contact
VII
time of 10 minutes. The metal stripping was carried out with H2SO4. The results showed that the
co-extracted copper may be scrubbed from the organic phase through a diluted sulphuric acid
solution, and the zinc can be stripped with a more concentrated H2SO4 solution (2mol/L).
Fifth continuous experiments were realized until an optimal condition for the separation
of the metals Zn and Cu was achieved. The experiments from 1 to 4 were carried out with a
solution prepared in a laboratory simulating the industrial liquor. Experiment 5, was carried out
with the industrial liquor, in the same conditions of the experiment 4, which presented the best
results. It was carried out in three extraction stages, three scrubbing stages and 5 stripping stages.
In this experiment, a pregnant strip solution containing 125 g/L Zn, and 0.050 g/L Cu, with less
than 0.005 g/L Cd, Co and Ni, from a solution containing 29.6 g/L Zn, 37.4 g/L Cu, 1.94 g/L Cd,
0.127 g/L Co and 0.100 g/L Ni was obtained. The concentration of the metals in the raffinate was
28.6 g/L Cu, 0.49 g/L Zn, 1.48 g/L Cd, 0.080 g/L Ni and 0.098 g/L Co.
VIII
LISTA DE FIGURAS
FIGURA 3.1. Diagrama da produção de Zn metálico por via úmida............................................11
FIGURA 3.2. Tanques de rotação (Alemanha).............................................................................15
FIGURA 3.3. Processo de cementação em bateias (Anaconda)....................................................16
FIGURA 3.4. Reatores de precipitação (Kennecott).....................................................................17
FIGURA 3.5. Cementação do Cd..................................................................................................17
FIGURA 3.6. Esquema do processo de extração por solvente......................................................20
FIGURA 3.7. Diagrama de McCabe-Thiele para a extração.........................................................27
FIGURA 3.8 Extração por solvente em células de misturador-decantador em um sistema
contracorrente.................................................................................................................................28
FIGURA 3.9 Estrutura do D2EHPA.............................................................................................29
FIGURA 3.10 Estrutura molecular do dímero-D2EHPA..............................................................30
FIGURA 3.11 Extração de alguns metais com D2EHPA em soluções sulfatadas........................31
FIGURA 3.12 Estrutura do IONQUEST.......................................................................................33
FIGURA 3.13 Estrutura do CYANEX 272...................................................................................34
FIGURA 3.14 Extração de alguns metais com CYANEX 272 em soluções sulfatadas...............35
FIGURA 3.15 Estrutura do LIX 63...............................................................................................36
FIGURA 3.16 Extração de alguns metais com LIX 63.................................................................37
FIGURA 3.17 Formas isoméricas do LIX 63................................................................................38
FIGURA 4.1. Esquema utilizado em laboratório para a cementação do Cd.................................41
IX
FIGURA 4.2. Esquema utilizado em laboratório para a extração por solvente do Zn. ................43
FIGURA 4.3. Bateria de células misturador/ decantador usadas nos testes contínuos.................44
FIGURA 4.4. Circuito usado nos ensaios contínuos.....................................................................46
FIGURA 5.1. Influência da temperatura na cementação do Cd....................................................51
FIGURA 5.2. Influência do pH inicial do licor na cementação do Cd..........................................52
FIGURA 5.3. Influência do excesso de zinco em pó na cementação do Cd.................................54
FIGURA 6.1. Influência do pH de equilíbrio na extração de Zn e Cu..........................................59
FIGURA 6.2. Influência da concentração do D2EHPA na extração de Zn e Cu..........................60
FIGURA 6.3. Influência da relação de fases do Aquoso/ D2EHPA na extração de Zn e Cu.......61
FIGURA 6.4. Isoterma de extração do zinco; E = estágios teóricos de extração..........................62
FIGURA 6.5. Influência da concentração de H2SO4 na reextração de Zn e Cu............................63
FIGURA 6.6. Isoterma de reextração do zinco; E = estágios teóricos de extração.......................65
FIGURA 7.1. Instalação micro-piloto para a realização dos experimentos contínuos..................66
FIGURA 7.2. Esquema do circuito do ensaio contínuo 1.............................................................69
FIGURA 7.3. Perfil de extração e reextração de zinco no ensaio contínuo 1...............................70
FIGURA 7.4. Perfil de extração e reextração de cobre no ensaio contínuo 1...............................70
FIGURA 7.5. Esquema do circuito do ensaio contínuo 2.............................................................72
FIGURA 7.6. Perfil de extração e reextração de zinco no ensaio contínuo 2...............................74
FIGURA 7.7. Perfil de extração e reextração de cobre no ensaio contínuo 2...............................74
FIGURA 7.8. Perfil de extração e reextração de zinco no ensaio contínuo 3...............................77
X
FIGURA 7.9. Perfil de extração e reextração de cobre no ensaio contínuo 3...............................77
FIGURA 7.10. Perfil de extração e reextração de zinco no ensaio contínuo 4.............................80
FIGURA 7.11. Perfil de extração e reextração de cobre no ensaio contínuo 4.............................80
FIGURA 7.12. Perfil de extração e reextração de zinco no ensaio contínuo 5.............................82
FIGURA 7.13. Perfil de extração e reextração de cobre no ensaio contínuo 5.............................83
FIGURA 7.14. Extração por solvente multi-estágio em contracorrente no EC1..........................85
FIGURA 7.15. Extração por solvente multi-estágio em contracorrente no EC2..........................88
XI
LISTA DE TABELAS
TABELA 3.1. Composição química típica de uma solução purificada.........................................12
TABELA 3.2. Extratantes utilizados na Extração por Solventes..................................................23
TABELA 5.1. Caracterização química dos principais constituintes da amostra ZnCd.................50
TABELA 5.2. Caracterização química dos principais constituintes da amostra ZnCd diluída.....51
TABELA 5.3. Influência do tempo na cementação do cádmio.....................................................53
TABELA 5.4. Variação do potencial (Eh) em função do tempo ..................................................55
TABELA 6.1. Caracterização química dos principais constituintes da amostra ZnCu. ...............57
TABELA 6.2. Influência do agente extratante na extração de zinco e cobre. ..............................58
TABELA 6.3. Caracterização química dos principais constituintes do orgânico carregado.........63
TABELA 7.1. Caracterização química dos constituintes da fase de alimentação.........................67
TABELA 7.2. Condições operacionais do experimento contínuo 1 (EC1)...................................69
TABELA 7.3. Resultados obtidos após 30 horas de operação no experimento contínuo 1..........71
TABELA 7.4. Condições operacionais do experimento contínuo 2 (EC2)...................................73
TABELA 7.5. Resultados obtidos após 32 horas de operação no experimento contínuo 2......... 75
TABELA 7.6. Condições operacionais do experimento contínuo 3 (EC3). .................................76
TABELA 7.7. Resultados obtidos após 19 horas de operação no experimento contínuo 3..........78
TABELA 7.8. Condições operacionais do experimento contínuo 4 (EC4)...................................79
TABELA 7.9. Resultados obtidos após 13 horas de operação no experimento contínuo 4......... 81
TABELA 7.10. Resultados obtidos após 13 horas de operação no experimento contínuo 5........84
XII
TABELA 7.11. Comparação dos resultados obtidos no experimento contínuo 1.........................88
TABELA 7.12. Comparação dos resultados obtidos no experimento contínuo 2.........................91
TABELA 7.13. Comparação dos resultados obtidos no experimento contínuo 3.........................94
TABELA 7.14. Comparação dos resultados obtidos no experimento contínuo 4.........................96
TABELA 7.15. Comparação dos resultados obtidos no experimento contínuo 5.........................99
XIII
SUMÁRIO
DEDICATÓRIA ...........................................................................................................................I
AGRADECIMENTOS ................................................................................................................. II
RESUMO ................................................................................................................................ IV
ABSTRACT ............................................................................................................................. VI
LISTA DE FIGURAS .............................................................................................................. VIII
LISTA DE TABELAS ................................................................................................................ XI
SUMÁRIO ............................................................................................................................. XII
1.
INTRODUÇÃO............................................................................................................. 1
2.
OBJETIVO E RELEVÂNCIA .......................................................................................... 5
3.
REVISÃO BIBLIOGRÁFICA .......................................................................................... 6
3.1.
Zinco .......... ............................................................................................................ 6
3.2.
Cádmio e Cobre... ................................................................................................... 8
3.3.
Produção de Zinco... ............................................................................................. 10
3.4.
Processos de Separação e Purificação... ............................................................... 13
3.4.1. Cementação ......................................................................................................... 14
3.4.1.1. Cementação do Cádmio ........................................................................... 17
3.4.2. Extração Líquido - Líquido................................................................................. 18
3.4.2.1. Extração metálica por Extração Líquido - Líquido ................................. 20
3.4.2.2. Parâmetros para o controle do processso................................................. 24
3.5.
Extração de Zinco utilizando a Técnica de Extração por Solvente ... .................. 28
3.5.1. Sistema Zn- D2EHPA ......................................................................................... 29
3.5.2. Sistema Zn- IONQUEST .................................................................................... 33
3.5.3. Sistema Zn- CYANEX 272 ................................................................................ 34
3.5.4. Sistema Zn- LIX ................................................................................................. 36
TRABALHO EXPERIMENTAL .................................................................................... 40
4.
4.1.
Metodologia ........ ................................................................................................. 40
4.1.1. Cementação ......................................................................................................... 40
4.1.2. Extração po Solvente .......................................................................................... 42
4.2.
Soluções e reagentes... .......................................................................................... 46
4.2.1. Cementação ......................................................................................................... 46
XIV
4.2.2. Extração po Solvente .......................................................................................... 47
4.3.
Materiais e Equipamentos .................................................................................... 47
4.3.1. Cementação ......................................................................................................... 47
4.3.2. Extração po Solvente .......................................................................................... 48
4.4.
5.
Métodos Analíticos... ............................................................................................ 48
ENSAIOS DE CEMENTAÇÃO ..................................................................................... 50
5.1.
Cementação ........ ................................................................................................. 50
5.1.1. Efeito da Temperatura......................................................................................... 51
5.1.2. Efeito do pH ........................................................................................................ 52
5.1.3. Efeito do Tempo ................................................................................................. 53
5.1.4. Efeito do Excesso de Pó de Zinco Metálico ....................................................... 53
ENSAIOS DESCONTÍNUOS DE EXTRAÇÃO POR SOLVENTE ....................................... 56
6.
6.1.
Extração Líquido - Líquido ........ ......................................................................... 56
6.1.1. Ensaios de Extração ............................................................................................ 56
6.1.1.1. Definição do Agente Extratante .............................................................. 57
6.1.1.2. Variação do pH de equilíbrio................................................................... 58
6.1.1.3. Variação da concentração do extratante .................................................. 60
6.1.1.4. Variação da relação de fases .................................................................... 61
6.1.1.5. Curva de Equilíbrio ................................................................................. 61
6.1.2. Ensaios de Reextração ........................................................................................ 63
6.1.2.1. Variação da concentração do extratante .................................................. 63
6.1.2.2. Curva de Equilíbrio ................................................................................. 64
7.
ENSAIOS CONTÍNUOS DE EXTRAÇÃO POR SOLVENTE ............................................. 66
7.1.
Experimento Contínuo 1....................................................................................... 68
7.2.
Experimento Contínuo 2....................................................................................... 71
7.3.
Experimento Contínuo 3....................................................................................... 75
7.4.
Experimento Contínuo 4....................................................................................... 78
7.5.
Experimento Contínuo 5....................................................................................... 81
7.6.
Balanço de Massas........ ....................................................................................... 84
7.6.1. Experimento Contínuo 1 ..................................................................................... 84
7.6.2. Experimento Contínuo 2 ..................................................................................... 88
7.6.3. Experimento Contínuo 3 ..................................................................................... 92
7.6.4. Experimento Contínuo 4 ..................................................................................... 94
7.6.5. Experimento Contínuo 5 ..................................................................................... 96
XV
8.
CONCLUSÕES ........................................................................................................ 100
9.
SUGESTÕES PARA OS TRABALHOS FUTUROS ......................................................... 102
10.
PUBLICAÇÕES RELACIONADAS AO PRESENTE TRABALHO ..................................... 103
11.
REFERÊNCIAS BIBLIOGRÁFICAS.............................................................................104
INTRODUÇÃO
1
CAPÍTULO 1
1. INTRODUÇÃO
A Metalurgia Extrativa é responsável pela obtenção do metal puro a partir dos seus
minérios e é dividida em três eixos: a Hidrometalurgia, a Pirometalurgia e a Eletrometalurgia. A
Hidrometalurgia é definida como um conjunto de processos realizados em soluções aquosas com
o objetivo de extrair metais a partir de minérios, concentrados minerais e resíduos industriais. O
processo hidrometalúrgico é eficiente, ambientalmente satisfatório e pode ser usado até para
tratar resíduos com baixos teores e em pequena escala (HABASHI, 1993; JHA, KUMAR e
SINGH, 2001).
A primeira etapa do processo é o beneficiamento físico do minério. Esta etapa pode
envolver tratamentos físicos como britagem, moagem, classificação, separação gravimétrica,
flotação e outros, além de processos pirometalúrgicos como ustulação (ZnS → ZnO ) e préredução. Estes processos visam dar forma física, granulométrica e composição química adequada
a processos de extração posteriores. A segunda etapa do processo é a lixiviação (dissolução) do
minério, realizada em meio aquoso contendo ácidos, bases ou agentes complexantes e em
condições variadas de pressão e temperatura. A terceira etapa é o tratamento do licor através de
técnicas como precipitação, troca iônica, adsorção e extração por solvente. Finalmente, os íons
metálicos são reduzidos e recuperados na forma de metal puro, por meio dos processos de
eletrólise, redução por hidrogênio e cementação (CIMINELLI, 2004).
Em geral, os processamentos hidrometalúrgicos geram resíduos que, devido a alta
concentração de metais pesados, não podem ser descartados para o meio ambiente. Na indústria
de zinco, estes resíduos podem apresentar teores próximos de 22 % de zinco, 14% de cádmio e
5% de cobre. Tais resíduos permanecem acondicionados em barragens, gerando um grande
volume de passivo ambiental e de total responsabilidade da indústria. Teores tão elevados fazem
destes sítios de disposição valiosas fontes de metais sendo denominadas fontes secundárias.
Segundo Habashi (1997), podem ser citados como fontes secundárias de zinco: poeiras da
produção de aço (20 a 30% Zn), licor residual proveniente da eletrólise (25 a 30% Zn), escórias
geradas na fundição do chumbo (10 a 15% Zn), resíduos da produção térmica de zinco (8 a 12%
INTRODUÇÃO
2
Zn), resíduos da planta de galvanização (50 a 80% Zn), catalisadores exauridos (50 a 60% Zn),
poeiras da produção de latão (60 a 75% Zn).
O zinco está presente nas fontes secundárias na forma de metal, óxidos e/ou ligas. O
reaproveitamento destas fontes, contendo altos teores de zinco, cobre, cádmio, cobalto, entre
outros, tem sido conduzido através de técnicas de lixiviação com ácidos, oxidantes, cianeto e
amônia. Posteriormente, os metais são recuperados através das técnicas de extração por solventes,
cementação e/ou precipitação. Estas técnicas podem, além de minimizar o impacto ambiental,
trazer um retorno econômico para as indústrias, já que existe uma crescente demanda por metais
de elevada pureza e uma contínua redução de minérios com elevados teores dos minerais de
interesse (JHA, KUMAR e SINGH, 2001; OWUSU, 1998).
A única produtora de zinco metálico do país é a Votarantim Metais Zinco S/A (VM),
empresa de capital nacional integrante do Grupo Votarantim, cujas unidades industriais estão
localizadas no Estado de Minas Gerais. Há dois empreendimentos mineiros, em Vazante e
Paracatu, e duas usinas metalúrgicas, em Três Marias e Juiz de Fora. A produção do metal
começou em 1956 com a criação da Companhia Mineira de Metais (CMM), em Três Marias,
Minas Gerais. Em 2002, o grupo ampliou sua atuação com a aquisição da Companhia Paraibuna
de Metais (CPM), instalada em Juiz de Fora. Em 2006, a produção da VM foi de 402,5 mil
toneladas de zinco (BRASIL - DNPM-MG, 2001).
O processo de produção de zinco na VM começa com a extração do minério, que é
realizada tanto a céu aberto como em mina subterrânea. O minério extraído é britado para reduzir
a granulometria e, posteriormente, é submetido a um processo denominado flotação. Neste
processo, são adicionados reagentes e ar para se concentrar o zinco. Em seguida, há um processo
de separação sólido/ líquido (espessamento) da solução formada na etapa anterior. Nesta etapa é
formado o concentrado sulfetado de zinco. O concentrado é calcinado (queimado a 950°C) para a
obtenção do óxido, que é lixiviado com ácido sulfúrico. A lixívia obtida é purificada para a
separação dos diferentes componentes, principalmente o sulfato de zinco. Esta etapa é realizada
pela técnica de cementação, mediante adição de zinco metálico em pó. Após a cementação, o
cádmio é recuperado em forma de esponja e a partir da solução purificada de zinco, a solução de
INTRODUÇÃO
3
sulfato é submetida a um processo de eletrólise para a formação das placas de zinco. O zinco
obtido é fundido e transformado em lingotes para sua comercialização.
Para a realização deste trabalho, a CPM forneceu duas amostras de resíduos sólidos
industriais. Uma delas com alta concentração de Zn e Cd e outra com alta concentração de Zn e
Cu, ambas com traços de níquel e cobalto. As amostras são provenientes da purificação do licor,
gerado na etapa de lixiviação do minério de zinco.
Em estudos anteriores de lixiviação dos resíduos, produziram-se dois licores sulfúricos,
com elevados teores dos metais em questão (GOUVEA e MORAIS, 2005; MORAIS et al, 2005).
Com o intuito de recuperar o zinco metálico em ambas as amostras, além de diminuir o impacto
ambiental, foram selecionadas duas técnicas hidrometalúrgicas. Com o licor rico em Zn e Cd
utilizou-se a técnica de cementação. Com o licor rico em Zn e Cu utilizou-se a técnica de
extração por solventes.
Nos ensaios de cementação do cádmio foram investigados o efeito da temperatura, o pH
inicial do licor, o tempo de reação e o excesso de pó de zinco metálico utilizado como agente
redutor. Estes experimentos visaram: a recuperação do cádmio metálico com o maior grau de
pureza possível e uma solução de sulfato de zinco passível de retornar para a etapa de eletrólise
para a obtenção do zinco metálico.
Os ensaios descontínuos de extração por solventes, inicialmente, visaram à definição do
extratante mais adequado para a separação do zinco e cobre. Foram testados os extratantes
D2EHPA, IONQUEST®801, CIANEX®272, LIX®63, LIX®948N e LIX®612N-LV. Dentre este,
optou-se por utilizar o D2EHPA como agente extratante. Em seguida, foram investigadas as
variáveis de processo, ou seja, concentração do extratante e reextratante, pH de equilíbrio da fase
aquosa e relação entre os volumes das fases aquoso/orgânico. Posteriormente, foram construídas
as curvas de equilíbrio – diagrama de McCabe-Thiele para determinar a relação volumétrica entre
as fases aquosa e orgânica, bem como o número teórico de estágios das etapas de extração e
reextração, necessários para a realização dos ensaios contínuos.
Para confirmar e otimizar as condições definidas em laboratório, foram realizados 5
experimentos contínuos em circuito micro piloto. O circuito foi montado com baterias de células
INTRODUÇÃO
4
misturador/ decantador, construídas em policarbonato, com capacidade de 70 mL no misturador e
260 mL no decantador, com operação em sistema de contra-corrente e constou das etapas de
extração, lavagem e reextração. Os experimentos de 1 a 4 foram realizados com uma solução
preparada no laboratório, simulando o licor industrial. O experimento contínuo 5 foi realizado
com a solução original, gerada na lixiviação do resíduo industrial, utilizando as condições do
experimento 4.
OBJETIVO E RELEVÂNCIA
5
CAPÍTULO 2
2. OBJETIVO E RELEVÂNCIA
O objetivo geral deste trabalho é a recuperação seletiva dos metais zinco, cádmio e cobre,
presentes em licores sulfúricos, gerados a partir da lixiviação de resíduos industriais. Estes
resíduos são provenientes do processamento hidrometalúrgico do concentrado de minério de
zinco (esfarelita). A recuperação dos metais presentes agrega valor a estes resíduos e reduz o
impacto ambiental causado por eles.
O trabalho tem como objetivo específico o desenvolvimento de dois processos: um de
separação dos metais Zn e Cd, utilizando a técnica de cementação, e outro de separação dos
metais Zn e Cu, pela técnica de extração por solventes.
A destinação de efluentes líquidos e resíduos sólidos, gerados pelas indústrias, e a
preservação ambiental está presente em discussões em todo o mundo. Conforme estimativa da
Associação Brasileira de Empresas de Tratamento, Recuperação e Disposição de Resíduos
Especiais (ABETRE), dos 2,9 milhões de toneladas de resíduos industriais perigosos gerados
anualmente no Brasil, somente 600 mil toneladas, cerca de 22%, recebem tratamento adequado.
Os 78% restantes são depositados indevidamente em lixões, sem qualquer tipo de tratamento.
Tratar efluentes e resíduos sólidos, gerados por indústrias mineradoras e outras, em geral,
reduz o volume de passivo ambiental, diminuindo o impacto causado no meio ambiente pelos
metais presentes nestes resíduos. Além disso, através de técnicas hidrometalúrgicas adequadas,
são possíveis a recuperação e utilização posterior destes metais.
Os licores estudados neste trabalho são provenientes da lixiviação de resíduos sólidos da
Companhia Paraibuna de Metais – CPM. Estes resíduos são gerados na purificação do licor,
proveniente da lixiviação do concentrado de zinco, que alimenta a etapa de eletrólise para a
obtenção do zinco metálico. Porém, as técnicas aplicadas podem ser estendidas a outros tipos de
licores e efluentes industriais, gerados por mineradoras, indústrias hidrometalúrgicas, químicas e
siderúrgicas.
REVISÃO BIBLIOGRÁFICA
6
CAPÍTULO 3
3. REVISÃO BIBLIOGRÁFICA
3.1. Zinco
O zinco elementar (Zn) é um metal branco azulado brilhante de forma cristalina
hexagonal, massa molecular 65,38 g/mol e número atômico 30. Na natureza são encontrados
vários isótopos:
64
Zn (48,89%),
66
Zn (27,81%),
68
Zn (18,57%),
67
Zn (4,11%) e
70
Zn (27,81%),
presentes em vários sais de zinco como: acetato de zinco, cloreto de zinco, estearato de zinco,
sulfato de zinco, sulfeto de zinco e óxido de zinco. A densidade do zinco, a 25°C, é 7,14 g/cm3 e
a dureza, na escala de Mohs, é de 2,5 (AZEVEDO e CHASIN, 2003; BRASIL – DNPM - MG,
2001; BRASIL – DNPM – RJ, 1973).
O zinco é estável ao ar seco, porém é recoberto de carbonato básico quando exposto ao
ar úmido. Apresenta ponto de fusão de 419,5°C e ebulição de 920°C e ocorre principalmente no
estado de oxidação +2. A 100 – 150°C torna-se maleável e a 210°C torna-se quebradiço e
pulverizável. É solúvel em ácidos e é um dos metais pesados mais eletropositivo. Com exceção
de poucos metais como manganês, ferro e níquel, o Zn pode provocar a redução de outros metais
em solução (AZEVEDO e CHASIN, 2003; BRASIL – DNPM - MG, 2001; BRASIL – DNPM –
RJ, 1973).
O zinco é um nutriente essencial para os organismos vivos. É responsável pelo controle
dos sistemas imunológico, digestivo, e nervoso; diminui o risco de hemorragias; ajuda no
crescimento; controla diabetes, além de ser um importante constituinte das enzimas. Na
agricultura, o zinco é usado como suplemento nutritivo para promover o crescimento das plantas.
Embora o elemento não seja considerado tóxico, existem certos sais de zinco cuja ingestão
provoca náuseas e diarréia. A inalação de óxido de zinco pode provocar lesões em todo o sistema
respiratório (AZEVEDO e CHASIN, 2003; BRASIL – DNPM - MG, 2001).
A primeira extração e fundição do zinco impuro ocorreram na China, por volta do ano
1000 d.C. Existem ornamentos de zinco que datam de 2500 anos com cerca de 80 a 90 % de
zinco, contendo impurezas de ferro e antimônio. Como produto industrial, só começou a ser
REVISÃO BIBLIOGRÁFICA
7
produzido, em 1740, na Inglaterra (AZEVEDO e CHASIN, 2003; BRASIL – DNPM – RJ,
1973).
O zinco metálico é usado na produção de ligas ou na galvanização de estruturas de aço.
Utiliza-se a galvanização para dar resistência mecânica às estruturas de edifícios, partes
constituintes de automóveis, barcos e eletrodomésticos, chapas, tubos, entre outros materiais. O
zinco é também um aditivo de certas borrachas e tintas. Uma das ligas mais importantes de zinco
é o bronze, que consiste na mistura deste elemento com o cobre. O zinco pode ainda ser utilizado
como eletrodo nas pilhas secas (AZEVEDO e CHASIN, 2003; BRASIL – DNPM - MG, 2001).
Os compostos de zinco possuem diversas aplicações industriais, não são explosivos ou
inflamáveis. O óxido de zinco (ZnO) é utilizado nas indústrias cerâmicas, de borrachas e tintas. O
sulfato de zinco (ZnSO4) tem aplicação na indústria têxtil e no enriquecimento de solos pobres
em zinco. O cloreto de zinco é usado para preservar madeiras, como desodorizante em diversos
fluidos, em pilhas secas, tintas e herbicidas. Os compostos de zinco são também usados na
indústria de medicamentos (AZEVEDO e CHASIN, 2003; BRASIL – DNPM - MG, 2001).
O zinco é um dos elementos mais abundantes encontrados na Terra e pode ser
encontrado no ar, solo e água. É naturalmente encontrado nos alimentos. Distribui-se como
resultado de atividades como mineração; purificação do zinco, chumbo e cádmio; produção do
aço; queima de carvão e de lixo. Estes processos podem aumentar a concentração do metal na
atmosfera e a indisposição inadequada de resíduos industriais contendo o metal pode contaminar
o solo e as águas. Em geral, os minérios de zinco possuem baixos teores de Zn e diferentes
impurezas. Portanto, antes de produzir o zinco metálico, o minério passa por diversos tratamentos
físicos e químicos para concentrar (AZEVEDO e CHASIN, 2003).
Os minerais de zinco encontram-se na crosta terrestre, associado a outros metais como o
cobre, o chumbo, a prata e o ferro, sendo que os principais minerais são a blenda ou esfalerita
(ZnS), willemita (Zn2SiO4), smithsonita (ZnCO3), calamina ou hemimorfita (2ZnO.SiO2.H2O),
wurtzita (Zn,Fe)S, franklinita (Zn,Mn)Fe2O4, hidrozincita [2ZnO3.3Zn(OH)2] e zincita (ZnO). A
esfalerita ocorre em depósitos na forma de filões, sendo uma das fontes primárias mais
significativas de Zn no Brasil com, aproximadamente, 67% de Zn. Outros minérios importantes
são a calamina (54% de Zn) e willemita (59% de Zn) (BRASIL – DNPM - MG, 2001; BRASIL –
DNPM – RJ, 1973).
REVISÃO BIBLIOGRÁFICA
8
O zinco é obtido, principalmente, de concentrados sulfetados de zinco mas, também,
pode ser obtido de fontes secundárias. A obtenção do zinco metálico por fontes secundárias é
possível já que o metal ao ser reciclado não perde suas propriedades físicas e químicas. No
entanto, no Brasil, o mercado de metal secundário não é significativo (JHA, KUMAR e SINGH,
2001; BRASIL – DNPM - MG, 2001).
3.2. Cádmio e Cobre
O cádmio (Cd) e o cobre (Cu) e são importantes impurezas em licores gerados a partir
de minérios de zinco, sendo essencial a remoção de ambos os metais, antes da produção de zinco
metálico.
O cobre é um metal marrom avermelhado de massa molecular 63,55 g/mol e número
atômico 29. Possui quatro estados de oxidação: metálico (Cu0), íon cuproso (Cu+), íon cúprico
(Cu2+) e íon trivalente (Cu3+). Apresenta dois isótopos:
63
Cu (69,17%) e
65
Cu (30,83%). Como
propriedades físicas importantes, podem ser citadas a elevada condutividade térmica e elétrica,
maleabilidade e resistência à corrosão. O cobre no estado elementar é distribuído na natureza
como sulfetos, arsenitos, cloretos e carbonatos (AZEVEDO e CHASIN, 2003; BRASIL – DNPM
- DF, 1982).
Em ambientes secos, o cobre metálico é estável mas reage lentamente com a umidade do
ar, sendo coberto por uma camada verde de carbonato hidratado. No meio ambiente, o cobre
monovalente ou está complexado ou é rapidamente oxidado por qualquer agente oxidante.
Poucos compostos cuprosos são estáveis em água, porém são extremamente insolúveis. Por isso,
no meio ambiente aquático, o estado de oxidação bivalente é o normalmente encontrado. Os
compostos cúpricos e complexos de cobre são, geralmente, solúveis em água com coloração azul
ou verde. O cobre trivalente é um forte oxidante e ocorre em poucos compostos (AZEVEDO e
CHASIN, 2003; BRASIL – DNPM - DF, 1982).
O cobre é necessário para um bom crescimento das plantas e animais, sendo essencial na
atividade de algumas enzimas e proteínas. Nas enzimas, o cobre é responsável pela catálise de
reações de oxidação-redução. No metabolismo animal, a falta de cobre pode provocar anemia,
REVISÃO BIBLIOGRÁFICA
9
diarréia e distúrbios nervosos. Por outro lado, a ingestão excessiva do elemento pode causar
vômitos, cãibras, convulsões ou mesmo a morte (AZEVEDO e CHASIN, 2003).
Os compostos cuprosos (Cu+) e cúpricos (Cu2+) são diversos e com muitas aplicações. O
óxido de cobre é utilizado como catalisador, corante de cerâmicas, em baterias, eletrodos e
inseticidas. O cloreto cuproso é usado como desinfetante, na preservação da madeira, desodorante
e desulfurizante em destilados de petróleo, em fotografia, na purificação da água e como aditivo
alimentar. O cloreto cúprico é usado na tinturaria têxtil, como agente oxidante em corantes e
como fungicida. O nitrato cúprico é usado para sensibilizar superfícies à luz e o fluoreto se utiliza
como o pacificador em esmaltes, vidros e cerâmicas. O sulfato de cobre é usado em fungicidas,
inseticidas e como aditivo dos solos. O metal é utilizado na cunhagem de moedas, fabricação de
tubos de canalização, peças decorativas, etc. (AZEVEDO e CHASIN, 2003).
O cobre é, raramente, encontrado no estado puro. Normalmente, está associado a outros
elementos químicos, formando diversos minerais. Os minerais de cobre podem dividir-se em dois
grupos distintos: os primários ou sulfetados e os secundários ou oxidados. Os minerais primários
são depositados a grande profundidade e possuem origem ígnea. Os mais importantes são a
calcopirita (CuFeS2) com 34,6% de Cu e a calcocita (Cu2S) com 79,9%. Outros exemplos de
minerais sulfetados são a bornita (Cu5FeS4) com 63,3% e a enargita (Cu3As5S4) com 48,3%. O
segundo grupo é composto por minerais secundários resultantes da oxidação de sulfetos de cobre,
tais como a cuprita (Cu2O) com 88,8% de Cu, a malaquita (CuCO3.Cu(OH)2) com 57,5% e a
azurita (2CuCO3.Cu(OH)2) com 55,3%. Os minerais com maior interesse comercial são a
malaquita, a calcocita e a calcopirita (AZEVEDO e CHASIN, 2003; BRASIL – DNPM - DF,
1982).
O cádmio é um metal branco acinzentado de massa molecular 112,41 e número atômico
48. Pode se apresentar na cor prata esbranquiçada, azulada ou metálica. É dúctil e mole à
temperatura ambiente. É um elemento raro e não é encontrado na natureza em estado puro. A sua
abundância na crosta é estimada em torno de 0,1 a 0,2 partes por milhão. Possui oito isótopos
estáveis:
113
106
Cd (1,21%),
108
Cd (0,88%),
110
Cd (12,39%),
111
Cd (12,75%),
112
Cd (24,07%),
Cd(12,26%), 114Cd (28,86%), 116Cd (7,58%) e dois radioisótopos: 109Cd e 115Cd (AZEVEDO e
CHASIN, 2003).
O cádmio apresenta propriedades físico-químicas semelhantes ao zinco, porém é menos
reativo – não reage com o oxigênio do ar, mas forma o óxido quando aquecido. Esse metal não
REVISÃO BIBLIOGRÁFICA
10
reage com bases, porém reage com ácido clorídrico e sulfúrico a quente, sendo que apresenta
grande mobilidade na água (AZEVEDO e CHASIN, 2003).
A principal aplicação do cádmio consiste na eletrodeposição de uma película protetora
em torno de diversos objetos, aumentando a sua resistência à corrosão atmosférica. É também
utilizado na fabricação de pilhas e baterias de níquel-cádmio, com uma vida útil superior às
tradicionais. As principais ligas de cádmio são feitas com prata, cobre e zinco. Estas ligas são
usadas em trabalhos de solda, em condutores elétricos e em joalharia (AZEVEDO e CHASIN,
2003).
Não existem minérios que contenham cádmio em quantidades comerciais, obtendo-se
sempre como produto secundário da extração de zinco. A ocorrência dos dois metais juntos na
natureza deve-se ao fato de ambos possuírem propriedades físico-químicas semelhantes. Devido
ao exposto, o cádmio segue os níveis de produção do zinco. Quase todos os depósitos de zinco
contêm cádmio, apesar de a concentração deste elemento não ultrapassar cerca de 1%.
(AZEVEDO e CHASIN, 2003).
O cádmio é um metal altamente tóxico, sendo esta característica uma grande
preocupação das indústrias que utilizam este elemento ou um minério que o contenha. Em meios
industriais ricos em fumos e poeiras de cádmio, a principal via de absorção é a inalação. Uma
pequena exposição a elevadas concentrações de óxido de cádmio pode causar graves irritações
pulmonares ou mesmo a morte. Devem ser tomados cuidados especiais em ambientes industriais
que utilizam este elemento (AZEVEDO e CHASIN, 2003).
3.3. Produção de Zinco
A produção do zinco começa com a extração do minério que pode ser realizada a céu
aberto ou em minas subterrâneas. Os minérios extraídos são triturados e submetidos a um
processo, denominado flotação, para a obtenção do minério concentrado. Normalmente, os
minérios com altos teores de ferro são tratados por via seca. O concentrado é calcinado para
transformar o sulfeto em óxido (ustulação). O óxido obtido é reduzido, a 1100°C, para produzir
Zn metálico (AZEVEDO e CHASIN, 2003).
REVISÃO BIBLIOGRÁFICA
11
Na produção de zinco por via úmida (FIG. 3.1), o minério é calcinado para a obtenção
do óxido. Posteriormente, é lixiviado com ácido sulfúrico. O licor gerado, além do zinco, contém
outros metais como cádmio, cobre, níquel e cobalto. Para se obter o sulfato de zinco, livre de
impurezas, a lixívia obtida passa por uma etapa de purificação. Esta etapa é geralmente realizada
pela técnica de cementação, mediante adição de zinco metálico em pó e de sais de tartarato de
sódio e antimônio. A TAB. 3.1 contém a composição típica da solução purificada de usinas
hidrometalúrgicas de zinco.
FIGURA 3.1. Diagrama da produção de Zn metálico por via úmida.
Na etapa de cementação, o cádmio é recuperado em forma de esponja e a partir da
solução purificada, o zinco metálico é produzido por eletrorefino. O zinco obtido é fundido na
REVISÃO BIBLIOGRÁFICA
12
forma de lingotes, produto pronto para ser comercializado (PINA et al, 2002; AZEVEDO e
CHASIN, 2003).
TABELA 3.1
Composição química típica de uma solução purificada
Elemento
Concentração
Elemento
Concentração
Zn
128 - 177 g/L
Ni
0,004 - 0,2 mg/L
Cu
0,01 - <0,5 mg/L
Co
<0,01 - 0,3 mg/L
Cd
0,01 - <1,0 mg/L
Mg
3 -12 mg/L
Fe
0,1 - 7,2 mg/L
Cl
29 - 420 mg/L
Fonte: FEIJÓ, 2005.
Os tipos de zinco obtidos na produção do metal se classificam segundo a norma ASTM
(American Society for Testing and Materials) em função da sua pureza:
•
SHG, Special High Grade (99,99%)
•
HG, High Grade (99,90%)
•
PWG Prime Western Grade (98%)
Como subprodutos, diferentes metais são obtidos, como mercúrio, cádmio, ouro, prata,
cobre e chumbo, em função da composição dos minérios. O dióxido de enxofre obtido na
calcinação é usado para produzir o ácido sulfúrico utilizado na lixiviação. O excedente pode ser
comercializado.
O resíduo sólido gerado na etapa de purificação do eletrólito, geralmente contém
grandes quantidades de Zn, Cd, Cu, além de outros metais, como Pb, Ni, Co, etc. Esse resíduo é
uma fonte secundária de Zn que após lixiviado com ácido sulfúrico, gera um licor que, se
purificado, pode retornar ao circuito de lixiviação (JHA, KUMAR e SINGH, 2001).
REVISÃO BIBLIOGRÁFICA
13
3.4. Processos de Separação e Purificação
O processo de purificação e separação escolhido para gerar os eletrólitos livres de
contaminantes ou para tratar os resíduos industriais deve consumir pouca energia, ser fácil de
controlar e remover freqüentemente as espécies metálicas que não interessam e impedem a
formação do metal puro. Um método comum, muito utilizado, é a precipitação. A precipitação é
um processo de separação que ocorre, em geral, devido à supersaturação de uma solução e pode
ser afetada por fenômenos cinéticos. A precipitação pode ser física ou química. (HABASHI,
1993).
Na precipitação física, nenhum reagente é adicionado. A concentração e a temperatura
são ajustadas para ocorrer a cristalização do soluto. Este tipo de processo é comum para a
obtenção de sais puros (EQ. 3.1) (HABASHI, 1993).
yMx+ (aq) + xAy- (aq) + nH2O (l) → MyAx.nH2O (s)
(3.1)
A precipitação química pode ser iônica ou de redução. Neste caso, um reagente é
adicionado para precipitar um composto específico. A precipitação iônica baseia-se nas
diferenças de solubilidade entre as espécies presentes em solução. Em geral, após a adição de
precipitantes e/ou após a modificação de pH, os contaminantes são precipitados sob a forma de
sais, óxidos e hidróxidos. Já a precipitação por redução consiste na redução espontânea de um íon
metálico em solução. A reação decorrente do processo é denominada reação de oxi-redução. Um
exemplo desse processo é a cementação do cádmio e cobre com pó de zinco metálico na
purificação de licor de zinco. No entanto, a precipitação muitas vezes não consegue purificar a
solução lixiviada que produzirá o zinco metálico, sendo necessárias outras técnicas (HABASHI,
1993; REDDY e PRIYA, 2005).
Outro processo de purificação e/ou concentração eficiente é a extração líquido-líquido
ou extração por solventes. O processo, em geral, é eficaz na extração seletiva de metais pesados
de resíduos industriais e muito utilizado comercialmente (ALAMDARI et al, 2004; REDDY e
PRIYA, 2005).
REVISÃO BIBLIOGRÁFICA
14
Neste trabalho, foram avaliadas a precipitação por redução e a extração líquido-líquido.
Ambos os processos foram utilizados para a purificação de licores de zinco. A precipitação por
redução foi utilizada para a precipitação do cádmio a partir do licor rico em Zn e Cd. A extração
líquido-líquido foi utilizada para a separação do Zn/Cu a partir do licor rico em zinco e cobre.
3.4.1. Cementação
A técnica de cementação é uma reação de redução heterogênea e espontânea de um íon
metálico em solução na presença de um metal mais eletropositivo. Para que a reação ocorra, é
necessário que a diferença de potencial seja positiva. Assim, o cádmio e cobre podem ser
extraídos da solução com o uso de metal de zinco (EQ. 3.2). A recuperação do Cd é de primordial
importância devido, além suas aplicações industriais, de sua alta toxicidade. Já o cobre é um
importante contaminante de eletrólitos de zinco (JHA, KUMAR, e SINGH, 2001; HABASHI,
1993; AUROUSSEAU et al, 2004).
Zn (s) + M2+(aq) → Zn2+(aq) + M (s)
(3.2)
onde M (cemento) = Cu, Pb, Cd, Ni e Ag.
O processo eletroquímico de cementação é utilizado para a remoção de íons metálicos
nobres ou tóxicos de soluções e na purificação de eletrólitos. Posteriormente, a solução purificada
obtida pode ser usada para a obtenção do metal puro através de eletrorefino ou por cristalização
(JHA, KUMAR e SINGH, 2001; AUROUSSEAU et al, 2004).
Vários aspectos devem ser observados durante as reações de precipitação por redução
(HABASHI, 1993):
•
O metal que sofrerá precipitação pode se dissolver devido a reações secundárias, afetando a
precipitação;
•
Após a precipitação do metal de interesse, pode ocorrer a re-dissolução do precipitado;
REVISÃO BIBLIOGRÁFICA
•
15
O pH da solução deve ser controlado para evitar a precipitação de hidróxidos que podem
contaminar o metal precipitado;
•
Podem ser formados gases tóxicos;
•
Dependendo das condições, várias impurezas não desejadas podem ser formadas.
As reações de cementação em pequena escala são conduzidas em tanques com agitação
mecânica ou tanques de rotação (FIG.3.2). O licor é misturado, continuamente, a uma
determinada quantidade de pó metálico. Após o término da reação, o produto é filtrado para a
recuperação do metal. Este método é usado na recuperação de cádmio de soluções sulfúricas com
pó de zinco (HABASHI, 1993).
FIGURA 3.2. Tanques de rotação (Alemanha).
Fonte: HABASHI, 1993.
Em larga escala, reações de cementação são conduzidas, principalmente, em bateias ou
reatores para a recuperação de cobre em soluções diluídas, utilizando pó de ferro metálico. O
processo é considerado barato e rápido com ambos os equipamentos. No entanto, a recuperação
do metal é mais eficiente ao se usar reatores (HABASHI, 1993).
Nas bateias (FIG. 3.3), o pó metálico é continuamente adicionado e a alimentação por
gravidade flui por todo o tanque. Bombas hidráulicas são usadas para agitar o sistema e para
REVISÃO BIBLIOGRÁFICA
16
bombear a lama com o metal de interesse ao longo da bateia até o tanque de sedimento, onde é
coletado o cemento (HABASHI, 1993).
FIGURA 3.3. Processo de cementação em bateias (Anaconda).
Fonte: HABASHI, 1993.
Nos reatores (FIG.3.4), o suporte cônico possui uma série de esguichos de pressão de
forma a criar um remoinho quando a alimentação é adicionada. A pressão e a velocidade da
solução no cone movem o precipitado para cima e para fora da seção cônica até o tanque de
sedimento, onde é coletado o cemento (HABASHI, 1993).
REVISÃO BIBLIOGRÁFICA
17
FIGURA 3.4. Reatores de precipitação (Kennecott).
Fonte: HABASHI, 1993.
3.4.1.1. Cementação do Cádmio
A cinética da reação da cementação do cádmio é controlada pelo transporte de massa das
espécies cimentadas (FIG.3.5). O equilíbrio termodinâmico é atingido, a 25°C, quando a
constante de equilíbrio é igual a 1,5x1012 (KARAVASTEVA, 1997; AUROUSSEAU et al,
2004).
FIGURA 3.5. Cementação do Cd.
Fonte: HABASHI, 1993.
REVISÃO BIBLIOGRÁFICA
18
Pina et al (2002) realizaram ensaios de eletrodeposição com o intuito de separar zinco,
cobre e cádmio. Em uma primeira etapa, os autores separaram o cobre. O metal, por ser mais
eletropositivo, precipita primeiro. Em seguida, o cádmio foi reduzido utilizando pó de zinco. O
Cd obtido apresentou 99% de pureza.
Na cementação do Cd, os íons Cd2+ são reduzidos e recuperados na forma de Cd
metálico, pela adição de zinco metálico em pó de acordo com a EQ. 3.3 (PINA et al, 2002). De
acordo com Karavasteva (1997), a presença de cobre em uma solução de ZnSO4 pode melhorar a
cementação do Cd.
Cd2+(aq) + Zn (s)
Cd (s) + Zn2+(aq)
ΔE0298K = 0,36V
(3.3)
Em solução ácida, o controle do pH é extremamente importante na cementação do
cádmio, devido a reação secundária de redução do íon H+ pelo Zn metálico, o que contribui para
uma menor recuperação do Cd metálico (EQ.3.4). A produção de hidrogênio gasoso é favorecida
em pH baixo, provocando um aumento no consumo do agente redutor e uma elevação no pH da
solução de sulfato de zinco resultante.
2H+(aq) + Zn (s)
H2 (g) + Zn2+(aq)
ΔE0298K = 0,76V
(3.4)
3.4.2. Extração Líquido - Líquido
A extração líquido-líquido ou extração por solventes está se tornando uma técnica
hidrometalúrgica indispensável, devido a crescente necessidade de metais com elevada pureza
para atender o mercado; as leis ambientais cada vez mais exigentes; a necessidade de custos de
fabricação baixos e a redução contínua de minérios com elevados teores metálicos, que resultou
no tratamento dos minérios de teores baixos e com uma grande complexidade (OWUSU, 1998).
A extração por solvente é um processo de equilíbrio, que pode ser representada pela EQ.
3.5:
REVISÃO BIBLIOGRÁFICA
ME
M+E
19
(3.5)
onde: M é a espécie metálica na fase aquosa, E é o extratante orgânico e ME é o complexo
formado.
Para uma eficiente extração, é necessário que o equilíbrio esteja deslocado para a direita.
Posteriormente, a espécie metálica extraída é transferida da fase orgânica para uma fase aquosa.
Nesta fase, denominada reextração, o equilíbrio deve estar deslocado para a esquerda (RITCEY e
ASHBROOK, 1984).
A técnica consiste em contatar uma fase aquosa (licor de alimentação) e uma fase
orgânica (solvente extrator), imiscíveis entre si. A contactação ocorre, sob agitação, até que o
equilíbrio ou uma condição próxima seja atingido. Sendo assim, para ocorrer uma extração ou
reextração eficiente deve-se haver superfície de contato suficiente entre a fase aquosa e orgânica,
o que exige uma quantidade razoável de ambas as fases (RITCEY e ASHBROOK, 1984).
A extração líquido-líquido constitui-se basicamente de três etapas: extração, lavagem,
reextração, sendo que a etapa de lavagem pode ser dispensada. A extração consiste na passagem
da espécie a ser recuperada da fase aquosa para a fase orgânica. A fase orgânica saturada
(carregada) com o soluto de interesse e a fase aquosa, empobrecida do mesmo, são denominadas
extrato e rafinado, respectivamente. O rafinado, após a extração, pode ser descartado ou pode
retornar ao licor de alimentação e o extrato segue para a etapa de lavagem. A lavagem é a etapa
em que uma solução de lavagem é contatada com o solvente carregado para a remoção de
impurezas e espécies indesejadas co-extraídas da fase orgânica, durante a etapa de extração. A
fase aquosa resultante é denominada rafinado de lavagem, que pode ser descartada ou retornar ao
circuito de extração. Após a lavagem, o extrato lavado passa para a etapa de reextração, na qual a
espécie de interesse é transferida da fase orgânica para a fase aquosa. Nesta etapa, o extrato
lavado é contatado com uma solução reextratante ou de reextração. A fase aquosa, denominada
reextrato, é coletada. A fase orgânica é, finalmente, recuperada para ser reutilizada no processo
(FIG.3.6).
REVISÃO BIBLIOGRÁFICA
20
FIGURA 3.6. Esquema do processo de extração por solvente.
Fonte: RITCEY e ASHBROOK, 1984.
3.4.2.1. Separação metálica por Extração Líquido-Líquido
A separação de metais utilizando extração por solventes envolve uma reação química
entre íons metálicos ou espécies neutras, na fase aquosa, e uma espécie reativa na fase orgânica.
A fase orgânica (solvente) é constituída por uma mistura de 3 componentes: extratante, diluente e
modificador (HABASHI, 1993).
Extratante
O extratante é o componente ativo do solvente, responsável pela extração do soluto.
Possuem massa molecular entre 200 - 450 e são praticamente insolúveis em água (5 – 50 ppm).
REVISÃO BIBLIOGRÁFICA
21
Um extratante adequado deve possui os seguintes requisitos (RITCEY e ASHBROOK, 1984;
CERNA, 1995):
•
Ser seletivo para as espécies a serem extraídas;
•
Ter alta capacidade de extração;
•
Permitir facilmente a reextração das espécies extraídas;
•
Baixa viscosidade e pouca solubilidade em água;
•
Ser solúvel em diluentes alifáticos e aromáticos;
•
Fácil coalescência (separação de fases);
•
Não formar emulsão com a fase aquosa;
•
Ser quimicamente estável nas condições de processo, ou seja, não sofrer degradação ou poder
ser reciclado;
•
Não ser tóxico ou cancerígeno;
•
Não ser volátil ou inflamável;
•
Baixo custo e disponibilidade no mercado.
A reação química entre íons metálicos ou espécies neutras, na fase aquosa, com o
extratante, na fase orgânica, pode ocorrer na interface líquido-líquido ou em qualquer região de
ambas as fases, próximas à interface. A reação depende da interação entre metal e extratante.
Normalmente, os extratantes são agrupados com base nesta interação (RITCHEY E
ASHBRROK, 1984; THORTON, 1992):
•
Extratantes catiônicos: atuam segundo o mecanismo de formação de compostos que envolve a
troca de cátions entre a molécula do extratante e o metal presente na fase aquosa (troca
iônica):
- Extratantes ácidos: extraem espécies metálicas carregadas positivamente por uma reação
química em que ocorre a substituição de prótons de sua molécula por cátions metálicos presentes
na fase aquosa. Neste caso, o extratante forma complexos com a espécie a ser extraída.
REVISÃO BIBLIOGRÁFICA
22
- Extratantes quelantes: extratantes com capacidade de se ligar ao metal, formando complexos
multidentados com os íons metálicos.
•
Extratantes de solvatação: promovem a extração pela solvatação do íon doador de elétrons,
formando complexos neutros. Neste mecanismo, as moléculas de água de hidratação, que
envolvem as espécies metálicas na fase aquosa, são substituídas por compostos polares do
extratante (EQ.3.6). Normalmente, os extratantes de solvatação são menos seletivos,
extraindo um grande número de complexos neutros e ácidos livres.
(3.6)
onde: M é a espécie metálica, X é o ânion, MXp(H2O) é o sal hidratado e S é o extratante de
solvatação.
•
Extratantes aniônicos ou básicos, que envolvem a associação de íons: extração em que há a
associação do extratante com a espécie a ser extraída por forças atrativas entre espécies de
cargas opostas (EQ.3.7). Neste caso, não há troca iônica.
(3.7)
onde: n é a carga do ânion X, M é a espécie metálica, MY é o complexo metálico e P é a carga do
complexo aniônico MY.
Há um número muito grande de extratantes disponíveis no mercado (FLETT, 2005). A
opção pelo extratante deve considerar os requisitos citados e a eficiência de extração e reextração
do metal/ espécie a ser removida. Na TAB. 3.2 são apresentados alguns extratantes, sua utilização
comercial e exemplos.
REVISÃO BIBLIOGRÁFICA
23
TABELA 3.2
Extratantes utilizados na Extração por Solventes
Classes de Extratantes
Tipo
Exemplos
Ácidos Carboxílicos
Ácido Naftênico e Ácido
Versático
Ácidos Fosfóricos
M2EHPA, D2EHPA,
OPPA
Ácidos Fosfônicos
PC-88A
Extratantes Ácidos
Ácido Fosfínicos
Ácidos Sulfônicos
Hidroxioximas
β - dicetonas
Extratantes Quelantes
Ácidos Hidroxâmicos
Aminas Primárias
Aminas Secundárias
Extratantes de Associação
Iônica
Aminas Terciárias
Aminas Quaternárias
Ésteres Fosfóricos,
Fosfônicos e Fosfínicos
Extratantes de Solvatação
Álcoois, Cetonas,
Ésteres e Éteres, etc.
Fonte: GARDUCCI, 2006.
Uso Comercial
- Separação Cu/Ni
- Extração de Ni
- Recuperação de Y
- Extração de U
- Extração de Terras Raras
- Separação Co/Ni
- Extração de Zn, etc.
- Separação Co/Ni
- Extração de Zn e Fe
- Separação Co/Ni
- Separação de Terras Raras
- Extração de Mg
- Extração de Cu
LIX 63
- Extração de Ni
- Extração de Cu de soluções
LIX 54
amoniacais
- Proposto para o
reprocessamento de
combustível
nuclear
LIX 1104
- Extração de Fe
Primene JMT, Primane
- Nenhum uso comercial
81R
conhecido
- Extração de U
Amberlite LA-1 e LA-2 - Proposto para a extração de
VeW
- Extração de U
Várias Alaminas em
- Extração de Co em meio
particular a Alamina 336
clorídrico
- Extração de W, etc.
- Extração de V
Aliquat 336
- Separação Ir/Rh
- Refino de U3O8
- Reprocessamento de
combustível nuclear
- Extração de Fe
TBP, DBBP, TOPO,
Separação Zr/Hf
CYANEX 921,
Separação
Nb/Ta
CYANEX 923,
Separação
de
Terras
Raras
CYANEX 471X
- Extração de Au
- Separação de Nb/Ta
MIBK, etc.
- Separação de Zr/Hf
CYANEX 272,
CYANEX 301 e 302, P229
DNNSA
REVISÃO BIBLIOGRÁFICA
24
Diluente
O diluente é um líquido orgânico, que dissolve o extratante e o modificador. Para a
escolha do diluente deve-se considerar os seguintes requisitos (RITCEY e ASHBROOK, 1984):
•
Solubilidade do extratante;
•
Viscosidade;
•
Ponto de fulgor;
•
Volatilidade;
•
Toxicidade;
•
Baixo custo e disponibilidade no mercado.
Modificador
O modificador é uma substância que, às vezes, são adicionados ao solvente, para evitar a
formação de emulsão (dispersão de difícil separação) e aumentar a solubilidade do extratante.
(RITCEY e ASHBROOK, 1984).
3.4.2.2. Parâmetros para o controle do processo
Na aplicação da técnica de extração por solventes, alguns parâmetros são utilizados para
o controle do processo, como coeficiente de distribuição, porcentagem de extração e fator de
separação.
Coeficiente de Distribuição ou Coeficiente de Extração (D)
O coeficiente de distribuição, DM+, expressa a facilidade de transferência dos íons
metálicos para a fase orgânica e pode ser calculada de acordo com a EQ. 3.8:
REVISÃO BIBLIOGRÁFICA
DM n + =
[ M n + ] org
[ M n + ] aq
25
(3.8)
onde DM é o coeficiente de distribuição do metal extraído entre o orgânico e fase aquosa e [Mn+]
é a concentração do metal em uma das fases.
O coeficiente de distribuição é um número, não possui unidade e não é uma constante. O
valor de D depende do pH, da temperatura, da concentração do extratante e da espécie metálica
na fase aquosa, da relação de fases aquoso/ orgânico, etc. Para aplicações industriais, o
coeficiente de distribuição não é muito útil porque o valor de DM depende da concentração de
íons do metal na solução e, durante o carregamento do extratante, a concentração de íons do
metal no solvente orgânico não muda enquanto a concentração da fase aquosa aumenta. Para o
cálculo do coeficiente de extração, é necessário que não ocorra variações de volume das fases
aquosa e orgânica após o contato, formação de terceira fase ou acúmulo de partículas sólidas na
interface que se encontram inicialmente suspensas no licor (“crud”) (OWUSU, 1998; RITCEY e
ASHBROOK, 1984).
Fator de Separação (SM1/M2)
O fator de separação (EQ. 3.9), SM1/M2, expressa a seletividade de um metal em relação a
outro (RITCEY e ASHBROOK, 1984).
S M1/ M 2 =
DM 1
DM 2
(3.9)
onde DM1 é o coeficiente de distribuição do metal 1 (em geral, o metal de interesse) e DM2 é o
coeficiente de distribuição do metal 2 (contaminante).
Na indústria, o fator da separação é uma variável mais útil que o coeficiente de
distribuição, pois indica a facilidade relativa de extração seletiva de um determinado metal.
REVISÃO BIBLIOGRÁFICA
26
Quanto maior o fator da separação, mais fácil é executar a extração seletiva e menor é o número
de estágios teóricos requeridos para conseguir a concentração desejada no solvente carregado
(OWUSU, 1998).
Porcentagem de Extração (%E)
A porcentagem de extração é a quantidade relativa da espécie que é transferida da fase
aquosa para a fase orgânica e indica a eficiência de extração do metal de interesse. Pode ser
calculada de acordo com a EQ.3.10 (RITCEY e ASHBROOK, 1984):
%E = 100×
DM 1
V
DM 2 + a
Vb
(3.10)
onde Va e Vb são os volumes das fases aquosa e orgânica, respectivamente. DM1 é o coeficiente
de distribuição do metal 1 (em geral, o metal de interesse) e DM2 é o coeficiente de distribuição
do metal 2 (contaminante).
Curvas de Equilíbrio ou Isotermas de Extração e Reextração
Os dados experimentais de extração e reextração podem ser representados por dois tipos
de gráficos. Em uma das representações, a porcentagem de extração é uma função de uma
variável como pH, concentração do extratante ou reextratante, tempo, etc. Outra representação
são as isotermas ou curvas de equilíbrio (HABASHI, 1993).
As isotermas de extração são representações gráficas das concentrações de equilíbrio de
um soluto nas fases aquosa e orgânica sob determinadas condições de extração ou reextração.
Para a construção da curva de equilíbrio de extração é necessário carregar o orgânico até sua
saturação, ou seja, contactar sucessivamente o orgânico com a fase aquosa até a máxima extração
do metal de interesse (esgotamento do aquoso). Para a isoterma de reextração é necessário
carregar o aquoso (saturar o aquoso) e esgotar o orgânico.
REVISÃO BIBLIOGRÁFICA
27
Diagrama de McCabe-Thiele
O diagrama é a representação gráfica das concentrações de equilíbrio de um soluto nas
fases aquosa e orgânica sob determinadas condições de extração ou reextração. É construído a
partir da curva de equilíbrio. Para tal, adiciona-se uma linha de operação baseado na capacidade
de saturação do solvente na extração e do reextrato na reextração (FIG.3.7). Através deste é
possível se determinar a relação volumétrica entre as fases aquosa e orgânica (relação entre as
fases) e o número de estágios teóricos necessários nos experimentos contínuos em células de
misturador-decantador em um sistema contracorrente (FIG.3.8) (HABASHI, 1993).
FIGURA 3.7. Diagrama de McCabe-Thiele para a extração.
Fonte: HABASHI, 1993.
REVISÃO BIBLIOGRÁFICA
28
FIGURA 3.8 Extração por solvente em células de misturador-decantador em um sistema
contracorrente.
Fonte: HABASHI, 1993.
3.5. Extração de Zinco utilizando a Técnica de Extração por Solvente
Extração por solvente é um processo muito utilizado para a purificação de licores
contendo zinco. Para a extração deste metal, é muito comum a utilização do D2EHPA como
extratante, sendo possível também a utilização de outros reagentes orgânicos como o CYANEX
272, CYANEX 301, CYANEX 302, IONQUEST, entre outros (ALAMDARI et al, 2004).
De acordo com JHA e colaboradores (2001), a técnica pode ser empregada para a
purificação de licor de sulfato obtido de fontes secundárias, sendo que o zinco é seletivamente
extraído do licor (EQ.3.11). Posteriormente, o zinco é reextraído do extrato orgânico carregado
por um eletrólito de zinco, regenerando o orgânico (EQ.3.12).
2 (RH) (org) + Zn2+ (aq)
(R2Zn) (org) + 2H+ (aq)
(3.11)
(R2Zn) (org) + 2H+ (aq)
2 (RH) (org) + Zn2+ (aq)
(3.12)
REVISÃO BIBLIOGRÁFICA
29
Diaz e Martin recomenda a utilização da extração líquido-líquido com várias fontes
secundárias e descreve a extração seletiva de zinco como tecnologicamente possível e
satisfatório.
3.5.1. Sistema Zn-D2EHPA
O ácido di-2-etilhexil fosfórico, D2EHPA (FIG. 3.9), é um líquido incolor viscoso,
imiscível em água, solúvel em éter, álcool, tolueno e hidrocarbonetos. É considerado um bom
extratante devido a sua estabilidade química, a sua boa cinética de extração, baixa solubilidade na
fase aquosa, além de ser relativamente barato. Foi usado pela primeira vez em 1949 e, desde
então, é extensivamente usado na indústria nuclear para a extração de urânio. Industrialmente, é
utilizado para extrair urânio, terras raras, zinco, vanádio, berílio, molibdênio e na separação de
cobalto e níquel. (MELLAH e BENACHOUR, 2006; MORAIS e MANSUR, 2003).
FIGURA 3.9 Estrutura do D2EHPA.
Fonte: THORNTON, 1992.
O mecanismo de extração do D2EHPA e a natureza da formação dos complexos
metálicos dependem da concentração dos cátions metálicos, da natureza do solvente orgânico e
da acidez da fase aquosa. No entanto, o principal mecanismo de extração é a troca iônica. Neste
caso, o D2EHPA forma complexos com a espécie a ser extraída devido à substituição de prótons
da sua molécula com os íons metálicos presentes no meio aquoso (EQ. 3.13 e EQ. 3.14). Devido
a baixa solubilidade do extratante na solução aquosa, a reação entre D2EHPA e íons do metal
ocorre na interface líquido-líquido (THORNTON, 1992; MORAIS e MANSUR, 2003).
REVISÃO BIBLIOGRÁFICA
30
(3.13)
(3.14)
onde: Mn+ é o íon metálico, R é o radical orgânico e RH é ácido orgânico.
A EQ. 3.13 representa as moléculas do D2EHPA na forma de monômeros, predominantes
em diluentes aromáticos, e a EQ.3.14 na forma dimérica, predominantes quando diluído em
compostos alifáticos. Os dímeros são formados nas moléculas de D2EHPA devido a ligações de
hidrogênio (FIG. 3.10) (MORAIS e MANSUR, 2003).
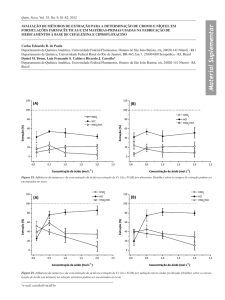
FIGURA 3.10 Estrutura molecular do dímero-D2EHPA.
Fonte: Morais e Mansur, 2004.
Os diluentes alifáticos (querosene purificado) são mais usados devido a sua menor
toxicidade. No entanto, os monômeros formados com estes diluentes são espécies menos ativas
interfacialmente com o D2EHPA (MORAIS e MANSUR, 2003).
Pode se observar pela EQ. 3.13 e EQ. 3.14, que a condição de equilíbrio do sistema
depende diretamente do pH da fase aquosa, ou seja, o equilíbrio é deslocado para a direita,
favorecendo a reação de extração, com o aumento do pH (menor concentração de H+). Portanto,
aumentar a concentração hidrogênica (menor pH) favorece a reação de extração, deslocando o
equilíbrio para a esquerda. No entanto, em um sistema complexo, vários íons metálicos são
encontrados e a extração seletiva destes íons depende da faixa de pH utilizada. A FIG. 3.11
mostra a extração de alguns metais, ao contatar o D2EHPA com uma solução sulfatada, em
REVISÃO BIBLIOGRÁFICA
31
função do pH. A ordem de extração dos íons neste sistema é: Fe3+> Zn2+> Cu2+> Co2+> Ni2+>
Mn2+> Mg2+> Ca2+. Observa-se que o Zn é extraído entre pH 1 e 2,5, aproximadamente, enquanto
o Cu é removido a partir do pH 2 (RITCEY e ASHBROOK, 1984).
FIGURA 3.11 Extração de alguns metais com D2EHPA em soluções sulfatadas.
Fonte: RITCEY e ASHBROOK, 1984.
Encontra-se na literatura muitos trabalhos de extração de Zn utilizando D2EHPA como
extratante. A extração da espécie metálica depende de diversos fatores como a composição da
amostra, o pH da fase aquosa, a concentração do extratante, a agitação, o tempo, entre outros.
Abaixo está apresentada uma descrição breve de alguns experimentos utilizando D2EHPA como
extratante para a extração de Zn.
Owusu (1998) estudou a extração seletiva de Zn e Cd de uma solução sulfatada
contendo 83,2 g/L de Zn, 52,8 g/L de Cd, 2 g/L de Co e 0,10 g/L de Ni usando D2EHPA como
extratante para gerar um eletrólito de sulfato de cádmio puro para o eletrorefino. Com o controle
do pH da extração, o zinco e o cádmio podem ser extraídos seletivamente em frações individuais,
permanecendo o cobalto e níquel no refinado. O autor extraiu seletivamente zinco em pH 2,0
REVISÃO BIBLIOGRÁFICA
32
seguido da extração de cádmio em pH 3,7. O orgânico carregado de Zn foi contactado com
solução de ZnSO4 para remover todos os contaminantes co-extraídos de cádmio e cobalto em pH
2 - 2,2. Observou-se que as co-extrações insignificantes de cobalto e cádmio ocorrem em pH < 3.
Assim, em pH < 3, o zinco pode ser extraído da solução eletrolítica com pouca contaminação. A
fase orgânica rica em Cd foi contatada com solução de CdSO4 para remover qualquer espécie coextraída de cobalto e níquel em pH 3,6-3,7. Em 3 < pH < 4,5, a extração do cádmio é
significativa mas a co-extração de cobalto é insignificante. O objetivo original era extrair
simultaneamente o zinco e o cádmio e, posteriormente, extrair seletivamente o Cd para gerar a
solução de CdSO4. No entanto, a concentração do zinco era muito elevada o que causava um
grande consumo do extratante orgânico.
A extração simultânea de Zn e Cd de uma solução sulfatada contendo 5 g/L de ambos os
metais também foi estudada por Alamdari et al (2004). Os autores utilizaram D2EHPA e
MEHPA como extratantes. Foi observado que com o aumento do pH há um aumento na extração
de zinco e cádmio com ambos os extratantes. De acordo com os autores, em condições
fortemente ácidas, durante o processo de extração, há a decomposição do extratante D2EHPA,
diminuindo a eficiência do processo. De acordo com os autores, para ser observado repetibilidade
nos testes de extração, as condições experimentais devem ser mantidas, pois a decomposição do
extratante causa problemas no processo de extração.
Mella e Benachour (2006) estudaram a extração de Zn e Cd de uma solução fosfórica
utilizando D2EHPA como extratante, diluído em querosene. Foram investigadas a concentração
do extratante, o pH de equilíbrio e a razão de fases aquoso/ orgânico. Os autores observaram que
a porcentagem de extração aumenta com o pH de equilíbrio, com a concentração do extratante e
com o tempo de contato, atingindo o equilíbrio depois de 25 minutos. Em 30 minutos, foram
obtidas 95,38% de extração de Zn e 65,46% de Cd, com uma razão de fases A/O de 1/1 e uma
concentração de 0,50 M de D2EHPA em pH 2 à temperatura ambiente. Neste trabalho foi
investigada a ordem de importância dos parâmetros para a extração de zinco e cádmio, sendo
obtida a seguinte ordem: concentração de D2EHPA > pH do equilíbrio > a relação de fase A/O.
REVISÃO BIBLIOGRÁFICA
33
3.5.2. Sistema Zn-IONQUEST
O IONQUEST 801 (FIG. 3.12), ácido 2-etilhexilfosfônico mono-2-etilhexil ester, é um
líquido incolor, viscoso e imiscível em água. Assim como o D2EHPA, o IONQUEST é um
composto organofosforado com ligações fósforo-oxigênio (P=O). A extração metálica ocorre
devido à substituição de prótons da sua molécula com os íons metálicos presentes no meio
(mecanismo de troca iônica). No entanto, o IONQUEST é um extratante menos ácido que o
D2EHPA e, por isso, extrai menos a espécie metálica nas mesmas condições operacionais. Tal
fato ocorre porque o D2EHPA possui dois átomos de oxigênio presentes nos radicais R da
molécula do D2EHPA (FIG.3.9), enquanto o IONQUEST possui apenas um (FIG.3.12). Assim,
os oxigênios presentes no D2EHPA atraem os elétrons com uma maior força, o que facilita a
dissociação do íon hidrogênico.
FIGURA 3.12 Estrutura do IONQUEST.
De acordo com Silva e colaboradores (2005) é possível a extração de Zn, em pH 4,
utilizando IONQUEST como extratante. No entanto, o D2EHPA apresenta maior eficiência para
extração do metal.
Apesar da possibilidade de extrair Zn com IONQUEST, o extratante é, principalmente,
usado na separação de cobalto e níquel, terras raras e extração de chumbo (SOLE et al, 2005;
NOGUEIRA e DELMAS, 2005; DRAA e BENAMOR, 2004, FLETT, 2005).
REVISÃO BIBLIOGRÁFICA
34
3.5.3. Sistema Zn-CYANEX 272
O CYANEX 272 (FIG.3.13), ácido bis-2,4,4-trimetilpentil-fosfínico, é um líquido incolor
viscoso e imiscível em água. Tem sido utilizado para a extração de muitos metais e pode ser
utilizado com soluções sulfúricas ou clorídricas. Industrialmente, é utilizado para extrair zinco e
ferro, separação de cobalto/ níquel e separação de terras raras (ALI, AHMAD e DAOUD, 2006;
RITCEY e ASHBROOK, 1984).
FIGURA 3.13 Estrutura do CYANEX 272.
Fonte: HABASHI, 1993.
Assim como o D2EHPA e o IONQUEST, o CYANEX 272 é um composto
organofosforado ácido. No entanto, o CYANEX 272 é um extratante menos ácido que os dois e,
por isso, extrai menos a espécie metálica nas mesmas condições operacionais. Tal fato ocorre
devido aos dois átomos de oxigênio presentes nos radicais R da molécula do D2EHPA (FIG.3.9),
que o CYANEX 272 não possui (FIG.3.12). Estes oxigênios exercem uma forte atração nos
elétrons, devido a sua alta eletronegatividade, o que facilita a dissociação do íon hidrogênico.
A FIG. 3.14 mostra a extração de alguns metais utilizando o CYANEX como extratante
com uma solução sulfatada, em função do pH. Observa-se que o Zn é extraído entre pH 1 e 3,0,
aproximadamente, enquanto o Cu é removido a partir do pH 3,5.
REVISÃO BIBLIOGRÁFICA
35
FIGURA 3.14 Extração de alguns metais com CYANEX 272 em soluções sulfatadas.
Fonte: HABASHI, 1993.
Assim como o D2EHPA, o CYANEX 272 tem sido utilizado a décadas como extratante
para a extração de zinco e há vários trabalhos experimentais disponíveis na literatura. Um resumo
de alguns experimentos encontra-se descrito abaixo.
Silva et al (2005) estudaram a separação de zinco e níquel de uma solução sulfúrica com
zinco, cobre, cádmio e crômio. Os autores testaram dois extratantes ácidos organofosforados:
D2EHPA e CYANEX 272. Foram testados o pH, o tempo de contato e a concentração do
extratante. Observou-se que ambos os extratantes são eficientes para a extração de Zn, mas a
extração do metal com o D2EHPA é maior. De acordo com os autores, o CYANEX extrai Fe, Zn,
Cr, Cu e Ni de soluções sulfúricas ou sulfatadas em pH 1,6, 3,0, 4,5, 4,6 e 7,05, respectivamente.
Ali e colaboradores (2006) investigaram a extração de Zn, utilizando CYANEX 272, de
soluções sulfatada, clorídrica e nítrica. A reextração do metal foi realizada com H2SO4, HCl e
HNO3, respectivamente. Com a solução sulfatada, a extração aumentou com a concentração do
extratante, e diminui com as demais soluções. A reextração do Zn foi eficiente com todos os
reextratantes. Experimentos variando a temperatura indicaram que a extração de Zn, neste
sistema, é um processo exotérmico. A eficiência de extração de Zn foi de 97% para uma solução
REVISÃO BIBLIOGRÁFICA
36
sulfúrica preparada artificialmente e 94% para a solução real, gerada na indústria metalúrgica. A
reextração teve eficiência de 96%.
3.5.4. Sistema Zn-LIX
Os reagentes da série LIX são extratantes quelantes, que contém grupos doadores capazes
de formar complexos multidentados com o metal. Esses extratantes, assim como os ácidos,
formam compostos solúveis em meio orgânico ao extrair o metal na troca de cátions entre as
fases líquidas. O principal uso industrial destes reagentes é na extração de Cu (EQ.3.15). Pode-se
citar como exemplos de extratantes LIX: LIX 63, LIX 984N e LIX 612N-LV. Estes extratantes
são aromáticos e sofrem degradação com calor (RITCEY e ASHBROOK, 1984).
(3.15)
LIX 63 (FIG.3.15) é uma α-hidroxioxima com o componente ativo 5,8-dietil-7hidroxidodecano-6-oxima. É um líquido amarelo claro, viscoso e imiscível em água. Forma
complexos com vários cátions metálicos e pode ser usado na extração de germânio e molibdênio
ou como aditivo cinético para outros reagentes quelantes (CHENG, 2006; RITCEY e
ASHBROOK, 1984).
FIGURA 3.15 Estrutura do LIX 63.
Fonte: HABASHI, 1993.
REVISÃO BIBLIOGRÁFICA
37
O LIX 63 foi usado pela primeira vez, comercialmente, em 1963. Apesar de grande
seletividade, em relação ao Cu, o extratante possui duas desvantagens (RITCEY e ASHBROOK,
1984):
•
Para haver uma significativa extração de Cu, o pH da fase aquosa deve ser maior que 2 (FIG.
3.15);
•
Caso haja na solução o íon férrico, o Fe3+ também será extraído (FIG. 3.15).
A FIG. 3.16 mostra a extração de alguns metais, ao se utilizar o LIX 63, em função do
pH. A ordem de extração dos íons neste sistema é: Cu2+> Fe3+> Ni+> Co2+> Zn2+. Observa-se que
o Zn é extraído a partir do pH 5, enquanto o Cu é completamente removido até pH 3. Portanto,
para a separação Zn/ Cu, o LIX 63 pode ser uma excelente escolha.
FIGURA 3.16 Extração de alguns metais com LIX 63.
Fonte: HABASHI, 1993.
O LIX 984N é uma mistura de LIX 860N (5-nonalsalicilaldoxima) e LIX 84-I (2-hidroxi5-nonalacetofenona), que forma complexos com vários cátions metálicos, de forma similar ao
REVISÃO BIBLIOGRÁFICA
38
complexo formado com o Cu (EQ.3.13). Assim como o LIX 984N, o LIX 612N-LV é um
reagente de cor âmbar que pode ser utilizado para a extração de cobre.
Todos os extratantes LIX são capazes de existir em duas formas isoméricas: “cis” e
“trans” (FIG.3.17). No entanto, somente o isômero “cis” forma um complexo metálico em
quantidade considerável em soluções ácidas. Em soluções alcalinas, o isômero trans reage mais
rápido com os íons metálicos (RITCEY e ASHBROOK, 1984).
FIGURA 3.17 Formas isoméricas do LIX 63.
Fonte: RITCEY e ASHBROOK, 1984.
Encontra-se na literatura muitos trabalhos de extração de Cu utilizando LIX 63, mas
vários derivados dele foram sintetizados com o intuito de melhorar a extração do metal
(HABASHI, 1993). Abaixo está apresentada uma descrição breve de alguns experimentos
utilizando reagentes da série LIX como extratante para a extração de Cu.
A separação de cobre, zinco e cobalto de resíduos industriais foi estudada por Banza e
colaboradores (2000). Segundo Banza e colaboradores, o cobre pode ser extraído separadamente
do zinco a partir de solução sulfúrica com 1,99 g/L de Cu, 1,04 g/L de Co, 12,58 g/L de Zn e 2,57
g/L de Fe. O LIX 984 foi utilizado como agente extratante para o Cu e o D2EHPA para o Zn e
Co. Após a extração do cobre, o ferro foi removido com carbonato de cálcio. Posteriormente, o
zinco foi extraído simultaneamente com o cobalto e separados durante a etapa de reextração.
Foram obtidos 80% de recuperação de Cu e 90% de recuperação de Co e Zn.
Reddy e Priya (2005) desenvolveram um processo de separação seletiva de Cu (II), Ni
(II) e Zn (II) de soluções sulfatadas utilizando LIX 84 I. De acordo com o autor, a extração destes
REVISÃO BIBLIOGRÁFICA
39
metais depende do pH de equilíbrio da fase aquosa e a extração seletiva é possível com o controle
desta variável. Com 0,005 M LIX 84 I, a extração de cobre começa em pH 0,5 e atinge o
equilíbrio em pH 4,0 com 99,4% de extração. A extração de Ni começa em pH 4,8 e em pH 7,5
há uma recuperação de 99%. Neste pH começa a extração do Zn, atingindo 99,5% de recuperação
em pH 9,0. De acordo com o autor LIX 87QN, LIX 54, LIX 973, LIX 984 e LIX 34 já foram
usados para a extração, separação e recuperação do zinco, cobre e níquel a partir de soluções de
sulfato de amônio, sendo que o LIX 84 I é usado comercialmente para extrair Cu.
San Miguel et al (1997) extraiu seletivamente cobre, ferro, níquel, cobalto, zinco, entre
outros elementos, de uma solução nítrica utilizando como extratante LIX 984. A extração dos
elementos foi possível devido ao controle de pH da fase aquosa. A ordem de extração observada,
em função do pH, foi: Cu2+> Fe3+> Ga3+> Ni2+> In3+> Co
> Zn2+ ≅ Pb2+. O cobre foi extraído,
2+
completamente, até o pH 2 e o zinco começou a ser extraído em pH 4,5.
TRABALHO EXPERIMENTAL
40
CAPÍTULO 4
4. TRABALHO EXPERIMENTAL
Os propósitos deste trabalho, conforme já apresentado anteriormente, são os tratamentos
dos licores gerados a partir dos resíduos sólidos, subprodutos da produção de zinco metálico da
CPM. Pretende-se agregar valor a esses licores, fontes secundárias de zinco, uma vez que,
constituem um problema ambiental para a empresa.
Para realizar a separação dos metais zinco/ cádmio e zinco/ cobre presentes nos licores,
duas alternativas foram consideradas: a precipitação por redução e a extração líquido-líquido.
Com a amostra rica em zinco e cádmio (ZnCd), foi utilizada a técnica de cementação para a
obtenção do cádmio metálico e com a amostra rica em zinco e cobre (ZnCu), foi utilizada a
extração por solventes para a separação de Zn/Cu.
4.1. Metodologia
4.1.1. Cementação
Os estudos de cementação do visaram investigar as seguintes variáveis de processo:
temperatura, pH inicial do licor, tempo de reação e excesso de pó de zinco metálico. Os ensaios
foram realizados em béquer de 150 mL, utilizando 100 mL do licor sulfúrico obtido na etapa de
lixiviação do resíduo ZnCd e pó de zinco metálico, com agitação mecânica (rotação de 300 rpm)
e temperatura controlada em banho maria (FIG.4.1).
TRABALHO EXPERIMENTAL
41
FIGURA 4.1. Esquema utilizado em laboratório para a cementação do Cd.
Nos ensaios de cementação, realizados a partir do licor sem diluição, obtido a partir da
lixiviação do resíduo, ocorreu cristalização do sulfato de zinco, devido a elevada concentração de
zinco na solução final. Para evitar este fato, os experimentos de cementação foram realizados
com o licor diluído em água, para a concentração de 120 g/L de Zn, o que correspondeu a uma
diluição de 1,175 vezes. Quando não especificado, os experimentos foram realizados com o
tempo de reação de 2 horas, temperatura de 50°C e 20% de excesso de pó de zinco.
O estudo experimental foi realizado da seguinte forma: (1) diluição da solução de
alimentação, (2) contato da solução com o pó de zinco por tempo e temperatura determinados, (3)
filtração, (4) análise dos metais de interesse no filtrado e (5) avaliação e tratamento dos dados,
com a construção de gráficos e tabelas.
Nos experimentos variando o pH do licor e concentração, foi utilizado solução de ácido
sulfúrico (2 mol/L) ou de hidróxido de amônio (3 mol/L). As soluções foram preparadas com
reagente de grau analítico e água destilada. Para o controle do potencial hidrogênico foi utilizado
um medidor digital de pH.
TRABALHO EXPERIMENTAL
42
4.1.2. Extração por solvente
O estudo com a amostra ZnCu foi dividido em duas etapas: testes descontínuos e testes
contínuos. Inicialmente, os testes descontínuos visaram à definição do extratante mais adequado
para a separação do zinco e cobre. Foram testados os extratantes ácidos organofosforados:
D2EHPA, IONQUEST®801 e CIANEX®272 e os extratantes da classe quelante: LIX®63,
LIX®948N e LIX®612N-LV. Após a escolha do extratante, foram realizados ensaios de extração
e reextração para definir as melhores condições de processo. Posteriormente, foram construídas
as curvas de equilíbrio – diagrama de McCabe Thiele – para determinar a relação volumétrica
entre as fases aquosa e orgânica, bem como o número teórico de estágios das etapas de extração e
reextração, necessários para a realização dos ensaios contínuos.
O estudo experimental, em escala de laboratório, foi realizado da seguinte forma: (1)
preparo das soluções aquosas e orgânicas, (2) contato das soluções por tempo suficiente para que
o equilíbrio entre as fases orgânica e aquosa seja atingido, ou seja, a estabilização das
concentrações dos metais nas duas fases, (3) separação das fases, (4) análise dos metais de
interesse nas duas fases e (5) avaliação e tratamento dos dados, com a construção de gráficos e
tabelas.
Os ensaios descontínuos de extração foram realizados em béquer de 150 mL à
temperatura ambiente (~25oC), com agitação mecânica (rotação de 500 rpm), que garantiu um
bom contato entre as fases. Para cada ensaio de extração, foram usados 20 mL da fase aquosa e
20 mL da fase orgânica (FIG.4.2).
TRABALHO EXPERIMENTAL
43
FIGURA 4.2. Esquema utilizado em laboratório para a extração por solvente do Zn.
Nesta etapa investigou-se o efeito das seguintes variáveis de processo: tipo e
concentração do agente extratante, pH da fase aquosa, relação volumétrica entre as fases e
concentração do agente reextratante. Para realizar o ajuste do pH, foram utilizadas pequenas
quantidades de hidróxido de amônio 3 mol/L e 1 mol/L. O ajuste era realizado durante a agitação
e para controle do pH foi utilizado um medidor digital de pH. Quando não especificado no
experimento, a relação volumétrica entre as fases foi igual a 1.
Os ensaios de reextração foram realizados com solução aquosa de ácido sulfúrico. A
influência da concentração do ácido foi investigada no intervalo de 0,01 a 3 mol/L. O tempo de
contato foi de 5 minutos. O carregamento do orgânico, utilizado nos experimentos de reextração,
foi realizado mediante dois contatos sucessivos do D2EHPA com o licor sulfúrico ZnCu,
mantendo a mesma fase orgânica e acrescentando uma fração nova do licor. Os contatos foram
realizados nas condições pré-estabelecidas nos estudos descontínuos de extração: pH 2,
concentração do extratante = 1 mol/L e uma relação de fases A/O = 1/1. Os experimentos foram
realizados em béquer de 100 mL à temperatura ambiente (~25oC), com agitação mecânica
(rotação de 450 rpm), que garantiu um bom contato entre as fases. Para cada ensaio, foram
TRABALHO EXPERIMENTAL
44
usados 15 mL da fase aquosa (H2SO4) e 15 mL da fase orgânica (D2EHPA) carregada com os
metais de interesse.
Nos experimentos de extração, as fases orgânicas foram preparadas no laboratório a
partir dos extratantes selecionados e diluídos com EXXSOL D-100 na concentração desejada. As
soluções de ácido sulfúrico, utilizadas nos experimentos de reextração, foram preparadas
utilizando-se H2SO4 de grau analítico, diluído em água destilada na concentração adequada.
Para confirmar e otimizar os parâmetros estudados e definidos em laboratório, foram
realizados 5 ensaios contínuos em contra-corrente. Os quatro primeiros foram realizados com
solução sulfúrica de Zn e Cu, preparada em laboratório, simulando a amostra ZnCd. A solução
foi preparada dissolvendo-se os sais sulfato de zinco e sulfato de cobre em água e o pH ajustado
para 1,6 com ácido sulfúrico de grau analítico. Após obtida a melhor condição operacional
(experimento 4), utilizou-se então a solução ZnCu para a realização do experimento 5. O circuito
para os testes contínuos foi montado com baterias de células misturador/ decantador, construídas
em policarbonato, com capacidade de 70 mL no misturador e 260 mL no decantador, conforme
mostrado na FIG. 4.3.
FIGURA 4.3. Bateria de células misturador/ decantador usadas nos testes contínuos.
TRABALHO EXPERIMENTAL
45
Cada estágio do circuito é constituído de um misturador e um decantador. A agitação
nos misturadores é realizada através de hélices acionadas por um motor elétrico de velocidade
controlada. No decantador ocorre a separação das fases, por gravidade.
A alimentação do circuito é realizada por bombas peristálticas acopladas em
controladores de velocidade, que fornecem vazões constantes. A fase orgânica flui do misturador,
pela parte superior, para um pequeno compartimento com abertura inferior, que alimenta o
decantador. Neste compartimento, o orgânico é succionado para o estágio seguinte. A fase aquosa
flui por uma abertura na parte inferior do decantador para o misturador seguinte, em
contracorrente com a fase orgânica.
Durante o experimento, a cada hora, media-se as vazões dos fluxos de alimentação e
coletava-se amostras dos efluentes de cada fluxo para análise. Ao término de cada corrida, o
sistema era desligado, e no dia posterior coletava-se amostras das fases orgânica e aquosasdo
decantador de cada célula para análise e construção do perfil de concentração dos elementos de
interesse ao longo do circuito. Para o ajuste de pH nos estágios de extração dos testes contínuos
foram testados gás de amônia concentrada, gás de amônia 20% e solução de hidróxido de amônio
3 mol/L. Nos experimentos contínuos, o D2EHPA foi recirculado direto da etapa de reextração.
O circuito utilizado para os ensaios pode ser observado na FIG. 4.4.
TRABALHO EXPERIMENTAL
46
FIGURA 4.4. Circuito usado nos ensaios contínuos.
4.2. Soluções e Reagentes
Neste item são apresentados as soluções e os reagentes empregados durante a realização
deste trabalho.
4.2.1. Cementação
O licor sulfúrico (ZnCd), utilizado nos experimentos, foi obtido a partir da lixiviação
sulfúrica de um resíduo de zinco e cádmio, fornecido pela CPM. O resíduo é gerado no processo
de produção de zinco metálico eletrolítico, através do processamento metalúrgico do minério
sulfetado de zinco. A cementação do cádmio foi realizada com pó de zinco metálico, fornecido
pela mesma empresa.
TRABALHO EXPERIMENTAL
47
4.2.2. Extração por solvente
O licor sulfúrico (ZnCu) utilizado foi obtido a partir da lixiviação sulfúrica de um
resíduo de zinco e cobre, gerado no processo de produção de zinco metálico eletrolítico, através
do processamento metalúrgico do minério sulfetado de zinco. Este resíduo foi fornecido pela
CPM.
O estudo de extração por solventes foi realizado com os seguintes extratantes:
•
D2EHPA (ácido di-2-etil-hexil fosfórico), 97 % p/p;
•
CYANEX®272 (ácido bis-2,4,4-trimetilpentil-fosfínico), 99 %p/p;
•
IONQUEST®801 (ácido 2-etilhexilfosfônico mono-2-etilhexil ester), 97% p/p;
•
LIX®63 (5,8-dietil-7-hidroxidodecano-6-oxima), 2,27 mol/L oxima;
•
LIX 984®N (composto de uma mistura de oximas: 5-nonalsalicílaldoxima e 2-hidroxi-5nonalacetofenona oxima), 1,66 mol/L oxima;
•
LIX ®612N-LV (mistura de 5-nonalsalicílaldoxima e um modificador de baixa viscosidade),
1,79 mol/L oxima;
O D2EHPA e IONQUEST, marca Albright & Wilson – Americas, foram fornecidos pela
Pecos Brasil Ltda. O CYANEX 272, marca Cytec Canada Ing, foi fornecido pela Cytec do Brasil
Ltda. Os extratantes da série LIX são da marca Cognis, e foram fornecidos pela Cognis do Brasil
Ltda. As soluções dos extratantes foram preparadas em Exxsol®D-100 (querosene purificado),
fornecido pela Exxson Química. Os estudos de reextração foram realizados com soluções de
ácido sulfúrico grau p.a., preparadas em água destilada.
4.3. Materiais e Equipamentos
4.3.1. Cementação
•
Medidor de pH – DIGIMED DM20
TRABALHO EXPERIMENTAL
48
•
Agitadores mecânicos – IKA LABORTECHNIK RW20.N
•
Cronômetro – CRONOBIO SW 2018
•
Banho maria
•
Tacômetro Minipa MDT-2238
•
Hélices de vidro
•
Funis de separação, balões volumétricos, provetas, pipetas e demais vidrarias comuns de
laboratórios químicos.
4.3.2. Extração por solventes
Ensaios descontínuos:
•
Medidor de pH – DIGIMED DM20
•
Agitadores mecânicos – IKA LABORTECHNIK RW20.N
•
Cronômetro – CRONOBIO SW 2018
•
Tacômetro Minipa MDT-2238
•
Hélices de vidro
•
Funis de separação, balões volumétricos, provetas, pipetas e demais vidrarias comuns de
laboratórios químicos.
Ensaios contínuos:
•
Células de misturador/decantador, construídas em policarbonato.
•
Bombas peristálticas – Master Flex 7518-10 e 17519-20.
•
Controladores de velocidade – Master Flex.
4.4. Métodos Analíticos
As análises quantitativas dos elementos de interesse das amostras geradas nos ensaios de
cementação e extração por solventes foram realizadas pelos seguintes métodos:
TRABALHO EXPERIMENTAL
•
49
Espectrofotometria de absorção atômica VARIAN AA240FS – para determinação de zinco,
cobre, cádmio, níquel e cobalto, entre outros, em amostras líquidas.
•
Gravimetria – para determinação de SO42-.
•
Energia Dispersiva de Raios X SHIMADZU 720 – para determinação de zinco, cobre,
cádmio, níquel e cobalto, entre outros, em amostras sólidas.
RESULTADOS E DISCUSSÃO
50
CAPÍTULO 5
5. ENSAIOS DE CEMENTAÇÃO
Os experimentos visaram investigar as variáveis de processo e definir as melhores
condições operacionais para atingir o objetivo proposto.
5.1. Cementação
De acordo com Azevedo e Chasin (2003), o cádmio possui propriedades físico-químicas
semelhantes ao zinco. Por isto, os dois metais são extraídos simultaneamente ao se utilizar
extração por solvente. Devido ao exposto, para a separação Zn/ Cd foi escolhido a técnica de
cementação. As variáveis de processo investigadas foram: temperatura, pH inicial do licor, tempo
de reação e excesso de pó de zinco metálico.
Nos ensaios de cementação, realizados a partir do licor sem diluição (TAB.5.1), a
concentração de zinco na solução final ficou muito alta. Para evitar este fato, os experimentos de
cementação foram realizados com o licor diluído 1,175 vezes. A caracterização do licor diluído
utilizado está apresentada na TAB. 5.2.
TABELA 5.1
Caracterização química dos principais constituintes da amostra ZnCd
Espécie
Amostra
ZnCd
Zn (g/L)
Cd (g/L)
Cu (g/L)
Co (g/L)
141,0
53,4
0,002
0,011
Ni (g/L) SO 2- (g/L)
4
0,003
330
pH
2,0
RESULTADOS E DISCUSSÃO
51
TABELA 5.2
Caracterização química dos principais constituintes da amostra ZnCd diluída
Espécie
Amostra
Zn (g/L)
Cd (g/L)
Cu (g/L)
Co (g/L)
Ni (g/L)
120,0
45,4
0,002
0,009
0,003
ZnCd
5.1.1. Efeito da Temperatura
O efeito da temperatura foi investigado desde a temperatura ambiente (22oC) até 50oC,
sendo que o pH inicial do licor foi igual a 1,5. Foram utilizados 20% de excesso de pó de Zn
metálico e o tempo de reação foi de duas horas. Os resultados obtidos estão apresentados na FIG.
5.1. Observa-se que para temperaturas abaixo de 40oC, embora o rendimento da reação seja
superior a 90%, o teor de cádmio em solução é relativamente alto (4,0 g/L para a temperatura de
22oC). Na temperatura de 40oC, o teor de Cd remanescente em solução foi de 0,014 g/L,
enquanto para a temperatura de 50oC, este teor foi de 0,005 g/L Cd. Os demais experimentos
foram realizados na temperatura de 50oC.
Recuperação de Cd (%)
95
Recuperação
90
4
Concentração
85
3
80
2
75
1
70
65
Cd no filtrado (g /L)
5
100
0
20
30
40
50
Temperatura (°C)
FIGURA 5.1. Influência da temperatura na cementação do Cd.
RESULTADOS E DISCUSSÃO
52
Observa-se que, com temperatura mais altas, há um aumento na precipitação do Cu, ou
seja, uma maior solubilização do zinco metálico. Tal fato ocorre porque o equilíbrio entre íons
em solução e uma fase sólida é afetado diretamente por mudanças de temperatura: quanto maior a
temperatura, normalmente, maior a solubilização do sólido presente no sistema. Portanto, ao se
aumentar a temperatura, aumenta-se a dissolução do zinco metálico e a precipitação do cobre em
solução (ROSENQVIST, 1984).
5.1.2. Efeito do pH
O efeito do pH foi investigado utilizando 20% de excesso de pó de zinco metálico com
um tempo de reação de 2 horas a 50°C. Ensaios variando o pH inicial do licor no intervalo de 0,5
a 2,5 indicaram que a partir de pH 1,5, praticamente todo o cádmio divalente presente no licor foi
convertido a cádmio metálico (FIG. 5.2). A partir do pH inicial do licor igual a 2,0, (pH de
equilíbrio > 4,5) houve formação de uma pequena quantidade de precipitado marrom após algum
tempo de estocagem do licor (de um dia para outro). A caracterização do precipitado por difração
de raios X indicou tratar-se de um precipitado amorfo. Já a análise qualitativa por fluorescência
de raios X indicou a presença dos metais Zn e Fe. Como todo o ferro presente no licor está no
estado divalente, provavelmente, houve a formação do precipitado da ferridrita de zinco. A
ocorrência desta reação pode ser evitada pelo controle do pH (HABASHI, 1993). Desta forma, o
pH ideal do licor que alimenta a etapa de cementação do cádmio é 1,5 e 2,0. Para o pH do licor
igual a 1,5, o pH final foi de 1,95. Em pH menor que 1,5, aumenta-se a concentração de Cd no
filtrado, devido à reação secundária entre o íon H+ e o Zn. Nestas condições, a formação do
hidrogênio gasoso é favorecida, diminuindo assim o rendimento da redução do Cd2+ e
conseqüentemente, a formação do Cd(s).
RESULTADOS E DISCUSSÃO
53
Recuperação de Cd (%)
Recuperação
1
Concentração
0,8
95
0,6
90
0,4
85
0,2
80
Cd no filtrado (g /L)
1,2
100
0
0,5
1
1,5
2
2,5
pH inicial
FIGURA 5.2. Influência do pH inicial do licor na cementação do Cd.
5.1.3. Efeito do Tempo
Nos ensaios variando o tempo de reação, foram usados 12,5 % de excesso de pó de
zinco e pH inicial do licor igual a 1,5 a 50°C. Verificou-se que 2 horas são suficientes para atingir
o equilíbrio entre as espécies Cd2+ e Cd0 no licor (TAB. 5.3). Para 1 hora de reação, a
recuperação de Cd foi de 92%, passando para 98% para 1,5 horas e chegando a 99,99% para 2
horas de reação, com uma pureza de 97%.
TABELA 5.3
Influência do tempo na cementação do cádmio
Tempo (hs)
Concentração inicial (g/L)
Concentração final (g/L)
Rec. Cd (%)
Zn
Cd
Zn
Cd
1
120,0
45,4
147,0
4
92,1
1,5
120,0
45,4
151,2
1,1
97,8
2
120,0
45,4
152,0
0,007
99,9
3
120,0
45,4
142,0
0,014
99,9
RESULTADOS E DISCUSSÃO
54
5.1.4. Efeito do Excesso de Pó de Zinco Metálico
O estudo da influência do excesso de pó de zinco metálico foi realizado no intervalo
compreendido entre 0% até 20%. Os resultados destes experimentos estão apresentados na FIG.
5.3. Conforme observado, é necessário certo excesso de zinco metálico para a completa redução
do Cd2+ a Cd0. Para 5% de excesso de Zn metálico, o teor de Cd2+ em solução foi de 0,06 g/L Cd,
3
100
95
Recuperação
90
Concentração
2,5
2
85
1,5
80
1
75
0,5
70
Cd no filtrado (g /L)
Recuperação de Cd (%)
enquanto para 10% de excesso este teor de 0,005 g/L Cd.
0
0
5
10
15
20
Excesso de pó de Zinco (%)
FIGURA 5.3. Influência do excesso de zinco em pó na cementação do Cd.
Como já mencionado anteriormente, a cementação do Cd é uma reação heterogênea
controlada pela difusão dos reagentes na interface da reação. Este tipo de transferência de massa
depende do contato entre a fase líquida e a fase sólida. Ao se aumentar a quantidade de pó de
zinco metálico, aumenta-se a probabilidade de colisão entre as partículas envolvidas na reação,
favorecendo a cinética da cementação do cádmio (ROSENQVIST, 1984).
Para que a reação de oxi-redução entre o Zn e o Cd seja possível do ponto de vista
termodinâmico é necessário que a diferença de potencial seja positiva. Sendo assim, foi utilizado
um potenciômetro para medir a diferença de potencial eletroquímico em função do tempo. Foram
feitas medidas de 30 minutos em 30 minutos considerando o excesso de pó de zinco metálico
(TAB. 5.4).
RESULTADOS E DISCUSSÃO
55
TABELA 5.4
Variação do potencial (Eh) em função do tempo
Eh (mV)
Excesso de Zn
(%)
Inicial
0,5 hora
1 hora
1,5 hora
2 horas
0
720
510
440
430
420
5
720
490
450
430
430
10
720
500
450
400
390
15
720
520
390
340
290
20
720
490
420
367
320
Observa-se, a partir das medidas de potencial, que a oxidação do Zn e a redução do Cu
ocorre, espontaneamente, durante todo o tempo de reação, independente do excesso de pó de
zinco. Em todos os experimentos, o potencial diminui com o tempo. O potencial para os excessos
de 0%, 5% e 10% apresentam pequenas variações entre si. Quando o excesso de pó de zinco é
15% e 20%, a reação ocorre, principalmente, na primeira hora, o que causa a redução
considerável do potencial.
RESULTADOS E DISCUSSÃO
56
CAPÍTULO 6
6. ENSAIOS DESCONTÍNUOS DE EXTRAÇÃO POR SOLVENTE
Os experimentos visaram investigar as variáveis de processo e definir as melhores
condições operacionais para atingir o objetivo proposto.
6.1. Extração Líquido-Líquido
De acordo com Dienstbach et al (citado por JHA, KUMAR e SINGH, 2001) não é
recomendável o tratamento de um licor com alta concentração de cobre pela técnica de
cementação. Dienstbach et al purificaram um licor que continha 32 g/L de Cu e 73 g/L de Zn e
observaram que o consumo de pó de zinco foi muito alto devido a concentração de cobre, o que
aumentou muito o custo com o reagente. Devido ao exposto, foi escolhido para tratar o licor
ZnCu a técnica de extração por solventes.
Na extração líquido-líquido investigou-se a influência das seguintes variáveis de
processo: tipo e concentração do agente extratante, acidez da fase aquosa, relação volumétrica
entre as fases e concentração do agente reextratante (solução de ácido sulfúrico). Foram
selecionados seis extratantes trocadores catiônicos. Três da classe dos extratantes ácidos
(D2EHPA, IONQUEST®801 e CYANEX®272) e três da classe dos extratantes quelantes
(LIX®63, LIX®984N e LIX®612N-LV). Os extratantes ácidos organofosforados são seletivos
para o zinco enquanto os extratantes quelantes extraem preferencialmente o cobre.
6.1.1. Ensaios de Extração
Nos ensaios de extração, foram investigados o tipo e a concentração do agente
extratante, o pH da fase aquosa e a relação volumétrica entre as fases. Para realizar o ajuste do
pH, foram utilizadas pequenas quantidades de hidróxido de amônio 3 mol/L e 1 mol/L. A
caracterização química do licor sulfúrico utilizado para os ensaios está apresentada na TAB. 6.1.
RESULTADOS E DISCUSSÃO
57
TABELA 6.1
Caracterização química dos principais constituintes da amostra ZnCu
Espécie
Amostra
ZnCu
Zn (g/L)
Cu (g/L)
Cd (g/L)
Co (g/L)
Ni (g/L)
SO42- (g/L)
pH
29,6
37,4
1,94
0,127
0,100
220
1,60
6.1.1.1. Definição do Agente Extratante
A primeira etapa do estudo foi à determinação do extratante mais adequado para a
separação seletiva do Zn e Cu. Foram testados seis extratantes: D2EHPA, IONQUEST®801,
CYANEX®272, LIX®63, LIX®984N e LIX®612N-LV. Os extratantes organofosforados foram
preparados na concentração de 1mol/L. Os extratantes da série LIX foram preparados na
concentração de 1mol/L em oxima. De acordo com a literatura, o D2EHPA extrai o Zn entre pH
1 e 2,5, enquanto o Cu é removido a partir do pH 2. Ao se utilizar o CYANEX, o Zn é extraído
entre pH 1 e 3,0, enquanto o Cu é removido a partir do pH 3,5. Com o LIX 63, o Zn é extraído a
partir do pH 5, enquanto o Cu é completamente removido até pH 3. Portanto, os experimentos
foram realizados com os extratantes em pH 3, para garantir a completa remoção do zinco,
utilizando os extratantes ácidos organofosforados, e a do cobre, utilizando os extratantes
quelantes. Os resultados obtidos estão apresentados na TAB. 6.2.
RESULTADOS E DISCUSSÃO
58
TABELA 6.2
Influência do agente extratante na extração de zinco e cobre
Extratante
pHeq.
LIX®63
Fator de Separação
% Extração
Zn/ Cu
Cu/ Zn
Zn
Cu
Cd
Ni
Co
3,0
--
62
4,1
72,5
18,0
0,0
0,0
LIX®612N-LV
2,9
--
94
6,4
86,6
13,4
2,4
1,6
LIX®948 N
3,1
--
37
9,5
79,4
14,4
0,0
0,8
D2EHPA
3,0
296
--
94,5
5,5
1,0
1,4
0,0
IONQUEST®
3,0
323
--
88,9
2,4
3,1
0,0
0,8
CYANEX®272
3,0
361
--
70,9
0,7
11,1
0,0
3,1
Observa-se que foram obtidos para todos os extratantes testados bons fatores de
separação, o que indica boa seletividade de extração dos metais em estudo, sendo possível,
portanto, a utilização de qualquer um destes reagentes para experimentos posteriores. No entanto,
ao se utilizar os reagentes da série LIX, observa-se problemas na separação de fases, além de
dificuldades em se estabelecer o equilíbrio entre as fases. Já o IONQUEST e o CYANEX 272,
apesar da boa separação de fases, são menos utilizados comercialmente que o D2EHPA. Devido
ao exposto, a estabilidade química, a maior disponibilidade do extratante e ao fato de ser mais
barato, os ensaios posteriores com o intuito de determinar as condições ótimas de processo, foram
realizados com o extratante D2EHPA.
6.1.1.2. Variação do pH de equilíbrio
Após a escolha do extratante, foram realizados ensaios para determinar o melhor pH de
equilíbrio a ser utilizado. O efeito do pH de equilíbrio foi testado de 1 a 3,5 com D2EHPA 1
mol/L e relação de fases A/O igual a 1. Os resultados obtidos estão apresentados na FIG. 6.1.
RESULTADOS E DISCUSSÃO
59
100
90
Extração (%)
80
70
60
% Ext. Zn
% Ext. Cu
50
40
30
20
10
0
0,5
1
1,5
2
2,5
3
3,5
pH de equilíbrio
FIGURA 6.1. Influência do pH de equilíbrio na extração de Zn e Cu.
A partir da figura, observa-se que o efeito do pH é mais significativo para a extração de
Zn, enquanto a extração de Cu não varia consideravelmente. Observa-se, inclusive, que com o
decréscimo do pH (maior concentração de H+), a extração de ambos os metais diminui. Tal fato
pode ser explicado por dois fatores. Em pH mais baixo, o extratante sofre protonação,
desfavorecendo a extração dos íons metálicos. Além disso, em soluções sulfúricas, ocorre um
equilíbrio entre as espécies SO42-, HSO4-1 e H2SO4, resultando na formação de complexos destas
espécies com o extratante, o que também diminui a extração dos íons metálicos (RITCEY e
ASHBROOK, 1984).
Em pH 2, a extração de Zn e Cu foi, respectivamente, 88,2% e 2,1%. Já em pH 3, a
extração dos metais foi 94,5% e 5,57%. Em pH maior que 3, a concentração de Cu no licor
aumenta consideravelmente, de 0,8 g/L para 5,3 g/L (14,2%), não sendo interessante para o
processo. Em pH menor que 2, a extração de Cu é, aproximadamente, 1% e a de Zn menor que
60%.
Os experimentos realizados em pH 2 são facilmente controláveis e apresentam bons
resultados. Em pH 3, apesar da eficiente extração de Zn, são difíceis de controlar. Por tais
motivos, os demais experimentos foram realizados em pH 2.
RESULTADOS E DISCUSSÃO
60
O tempo de contato para se atingir o equilíbrio da concentração dos metais entre as fases
para o pH 3,5 é de, aproximadamente, 20 minutos. Para pH 3, o tempo de contato é de 15
minutos e para pH 2 é de 8 a 10 minutos. Já para pH 1 e 0,7, cincos minutos são suficientes para
se atingir o equilíbrio. O tempo de separação entre as fases orgânica e aquoso, utilizando
D2EHPA foi menor que 1 minuto, em todos os experimentos.
6.1.1.3. Variação da concentração do extratante
Para determinar a concentração ideal do D2EHPA, foram realizados ensaios com 0,25
mol/L; 0,50 mol/L; 0,75 mol/L e 1,0 mol/L, mantendo uma relação de fases A/O = 1. Os
resultados estão apresentados na FIG. 6.2. Observa-se um aumento da extração de Zn com o
aumento da concentração do extratante. Tal fato ocorre devido a um aumento de sítios
disponíveis do extratante para a extração do íon de interesse. O melhor resultado obtido foi com a
concentração 1 mol/L, sendo que a extração de Zn e Cu foram, respectivamente, 91,1 % e 2,0 %.
Nessas condições, o licor final obtido continha, em média, 2,6 g/L de Zn e 36,6 g/L de Cu.
100
90
Extração (%)
80
70
60
50
% Ext. Zn
% Ext. Cu
40
30
20
10
0
0,25
0,5
0,75
1
Concentração (mol/L)
FIGURA 6.2. Influência da concentração do D2EHPA na extração de Zn e Cu.
RESULTADOS E DISCUSSÃO
61
6.1.1.4. Variação da relação de fases
A última variável de processo testada foi a relação de fases aquoso/orgânico. Os ensaios
foram realizados com D2EHPA 1 mol/L em pH 2. Variou-se a relação A/O de 1/1 a 5/1.
Observou-se que há uma queda na extração de Zn ao se aumentar a relação de fases (FIG.6.3).
Tal fato pode estar relacionado com a maior disponibilidade de outros metais na solução de
alimentação, que competem com o zinco pelo sítio ativo do agente extratante. Muitos destes
metais possuem raios iônicos próximos do Zn, por exemplo, Ni, Co e Fe. Para uma relação de
fases 1/1, foram obtidos 91% de extração de Zn e 2% de Cu. Já em uma relação 3/1 foram
obtidos 34% de extração de Zn e 0,1 % de Cu. A extração de Cu permaneceu em todos os
experimentos menor que 2,5%.
100
90
% Ext. Zn
% Ext. Cu
Extração (%)
80
70
60
50
40
30
20
10
0
1
1,5
2
2,5
3
Relação de Fases A/O
FIGURA 6.3. Influência da relação de fases do Aquoso/ D2EHPA na extração de Zn e Cu.
6.1.1.5. Curva de Equilíbrio
Após a determinação das melhores condições de processo para a etapa de extração,
construiu-se a isoterma (curva de equilíbrio) do zinco (metal extraído preferencialmente) e
RESULTADOS E DISCUSSÃO
62
traçou-se o diagrama de McCabe – Thiele, para a determinação do número teórico de estágios e
da relação volumétrica de alimentação do licor e do extratante, necessários à realização dos
ensaios contínuos. Para a construção da curva de equilíbrio, fez-se cinco contatos sucessivos
entre as fases, carregando o orgânico e esgotando o aquoso. Em relação ao cobre, verificou-se
que após os contatos sucessivos, este foi pouco extraído pelo extratante (< 2 g/L). A isoterma de
extração/ Diagrama de McCabe - Thiele para o zinco está apresentada na FIG. 6.4.
Zn na fase orgânica (g/L)
30
25
20
E
Reta de
operação
15
10
5
E
0
0
5
10
15
20
25
30
Zn na fase aquosa (g/L)
FIGURA 6.4. Isoterma de extração do zinco; E = estágios teóricos de extração.
De acordo com a FIG. 6.4 (Diagrama de McCabe – Thiele), para se obter um refinado
praticamente isento de zinco, mantendo uma relação volumétrica de alimentação licor/ solvente
igual a 0,84, são necessários 2 a 3 estágios de células misturador/ decantador. Nestas condições, é
possível obter uma fase orgânica carregada com, aproximadamente, 25 g/L de Zn.
RESULTADOS E DISCUSSÃO
63
6.1.2. Ensaios de Reextração
Para os ensaios de reextração, foi utilizado como agente reextratante solução aquosa de
ácido sulfúrico, devido ao licor ser de origem sulfúrica. Os experimentos de reextração foram
realizados a partir do D2EHPA 1,0 mol/L carregado com os metais (extrato). A concentração de
H2SO4 variou no intervalo de 0,01 mol/L a 3,0 mol/L. A relação volumétrica entre as fases
orgânica e aquosa (A/O) foi de 1/1 e o tempo de contato entre as fases foi de 5 minutos. O extrato
(orgânico carregado) foi obtido através de 2 contatos sucessivos, utilizando o mesmo solvente e
licor novo, na relação de fases A/O igual a 1 e pH de equilíbrio igual a 2. A caracterização
química do orgânico carregado, utilizado nos experimentos de reextração, está apresentada na
TAB. 6.3. Os resultados dos experimentos de reextração estão apresentados na FIG. 6.5.
TABELA 6.3
Caracterização química dos principais constituintes do orgânico carregado
Espécie
Zn (g/L)
Cu (g/L)
Cd (g/L)
Co (g/L)
Ni (g/L)
Orgânico
33,0
0,137
0,003
<0,001
<0,001
Extração (%)
6.1.2.1. Variação da Concentração do Reextratante
100
90
80
70
60
50
40
30
20
10
0
% Ext. Zn
% Ext. Cu
0
0,5
1
1,5
2
2,5
Concentração do Reextratante
3
FIGURA 6.5. Influência da concentração de H2SO4 na reextração de Zn e Cu.
RESULTADOS E DISCUSSÃO
64
Conforme mostra a FIG. 6.5, o cobre é reextraído preferencialmente ao zinco. Os
experimentos realizados com baixa de H2SO4 visaram a reextração do Cu co-extraído. Para a 0,01
mol/L H2SO4, 47% do Cu extraído foi reextraído, com apenas 6,1% de reextração de Zn (2 g/L
Zn). Para a 0,05 mol/L H2SO4 a porcentagem de reextração dos metais passou para 81% de Cu e
12% de Zn. A partir de 1,5 mol/L H2SO4 pode-se observar um patamar na curva de reextração de
Zn com pequenas diferenças na reextração dos dois metais. A partir dos experimentos de
reextração observa-se a viabilidade técnica da separação Zn/Cu pela técnica de extração por
solventes, utilizando o D2EHPA como agente extratante. O cobre co-extraído pode ser retornado
para a fase aquosa mediante a introdução de uma etapa de lavagem com uma solução de baixa
concentração de H2SO4. Após a etapa de remoção de lavagem, o zinco pode ser completamente
reextraído com uma solução 2 mol/L de H2SO4.
6.1.2.2. Curva de Equilíbrio
Na seqüência dos estudos de reextração, construiu-se a isoterma de reextração (curva de
equilíbrio) do zinco e traçou-se o diagrama de McCabe – Thiele, para a determinação do número
teórico de estágios e da relação volumétrica de alimentação do orgânico e do reextratante (H2SO4
2 mol/L), necessários à realização dos ensaios contínuos. Para a construção da curva de
equilíbrio, fez-se contatos sucessivos entre as fases aquosa e orgânica: 3 contatos para o
carregamento do aquoso e sete contatos para esgotamento do orgânico. No aquoso, a
concentração do Cu ficou menor que 4 g/L e a concentração do Zn chegou a, aproximadamente,
125 g/L. Conforme apresentado no diagrama de McCabe - Thiele (FIG. 6.6), a relação
volumétrica de alimentação orgânica/ aquoso pode ser de até 3,7 (inclinação da reta de operação),
sendo possível obter um reextrato com 110 g/L. A obtenção de um orgânico isento de zinco
requer 2 a 3 estágios de células de misturador/ decantador.
Zn na fase aquosa (g/L)
RESULTADOS E DISCUSSÃO
140
130
120
110
100
90
80
70
60
50
40
30
20
10
0
65
E
Reta de
operação
E
0
5
10
15
20
25
30
Zn na fase orgânica (g/L)
FIGURA 6.6. Isoterma de reextração do zinco; E = estágios teóricos de extração.
RESULTADOS E DISCUSSÃO
66
CAPÍTULO 7
7. ENSAIOS CONTÍNUOS DE EXTRAÇÃO POR SOLVENTE
Para confirmar e otimizar as condições definidas em laboratório, foram realizados 5
experimentos contínuos em instalações micro piloto, que totalizaram 107 horas de operação. Os
experimentos foram feitos em células misturador/ decantador com capacidade de 70 mL no
misturador e 260 mL no decantador (FIG. 7.1). Em todos os experimentos, os estágios foram
numerados em ordem crescente da esquerda para a direita e, após a etapa de reextração, o
solvente foi circulado direto para a etapa de extração.
FIGURA 7.1. Instalação micro-piloto para a realização dos experimentos contínuos.
A solução aquosa de alimentação utilizada nos experimentos 1 a 4 foi produzida em
laboratório e sua composição está apresentada na TAB. 7.1. No experimento 5, após obtida a
melhor condição operacional, foi utilizada a solução ZnCu (TAB.5.4), para observar a extração e
RESULTADOS E DISCUSSÃO
67
reextração dos demais metais presentes (Cd, Ni e Co). Como agente extratante foi utilizado
D2EHPA 1 mol/L e como agente reextratante foi utilizado solução de ácido sulfúrico.
TABELA 7.1
Caracterização química dos constituintes da fase de alimentação
Espécie
Amostra
ZnCu 2
Zn (g/L)
Cu (g/L)
SO42- (g/L)
pH
30,0
38,0
140
1,60
De acordo com as curvas de equilíbrio construídas, seriam necessários 2 a 3 estágios de
extração e reextração para os ensaios contínuos. A relação de alimentação é igual à inclinação da
reta de operação do diagrama, considerando um limite de 15 a 20% abaixo do ponto de saturação.
Para o estágio de extração, a relação de alimentação foi de 0,84 e para o de reextração foi de 3,7.
Nestas condições, seria possível obter, no estágio de extração, uma fase orgânica carregada com
25 g/L de Zn e, na reextração, um reextrato com 110 g/L de Zn.
O tempo de residência no misturador foi estipulado em 10 minutos, levando em
consideração o tempo para se atingir o equilíbrio da concentração dos metais e o tempo de
separação entre as fases nos ensaios descontínuos. As vazões dos fluxos de entrada e saída são
calculados com base no volume do misturador das células utilizadas nos experimentos, no tempo
de residência e na relação volumétrica entre as fases. Portanto, conhecendo-se o volume do
misturador, o tempo de residência e a relação volumétrica entre as fases, são possíveis determinar
as vazões do aquoso e orgânico (EQ. 7.1 e 7.2).
Vazãoaquoso
Vazãoorgânico
= Valordiagrama
(7.1)
McCabe −Thiele
Vazãoaquoso + Vazãoorgânico =
Volumemisturador
Temporesidência
(7.2)
RESULTADOS E DISCUSSÃO
68
7.1. Experimento Contínuo 1
O experimento contínuo 1 (EC1) durou 30 horas, onde foram processados
aproximadamente 8 litros de licor. Foram utilizados 2 estágios de extração, 2 estágios de lavagem
e 5 estágios de reextração. Para a remoção do Cu co-extraído foi utilizado ácido sulfúrico 0,1
mol/L, na relação O/A de 6,1. O tempo de residência na extração foi de 6 minutos. Optou-se por
um tempo de residência menor que o considerado nos experimentos de bancada, considerando a
maior eficiência no ajuste do pH nos experimentos contínuos, realizado com gás
automaticamente. Para o estágio de extração, a relação de alimentação foi de 0,6 e para a
reextração foi de 7,3. Nestas condições, seria possível obter, no estágio de extração, uma fase
orgânica carregada com 18 g/L de Zn e, na reextração, um reextrato com 130 g/L de Zn,
aproximadamente.
Neste experimento, a correção de pH (pH 2) foi realizada nos dois estágios de extração
com gás de amônia 20%, diluído em argônio. Na reextração foi utilizado H2SO4 2 mol/L. As
condições operacionais usadas estão apresentadas na TAB. 7.2. Na extração, o 1° estágio
corresponde a saída do rafinado e a entrada do orgânico limpo (D2EHPA) e o 2° estágio
corresponde à entrada da alimentação (ZnCu 2). Na etapa de lavagem, o 4° estágio corresponde à
entrada da solução de lavagem. Na etapa de reextração, o 5° estágio corresponde à saída do
reextrato e o 9° estágio corresponde à entrada do reextrante e a saída do orgânico regenerado
(FIG.7.2).
RESULTADOS E DISCUSSÃO
69
FIGURA 7.2. Esquema do circuito do ensaio contínuo 1.
TABELA 7.2
Condições operacionais do experimento contínuo 1 (EC1)
Vazão média
Solução
Etapa
Reagente
(mL/min.)
Concentração
(mol/L)
Aquoso Orgânico
Tempo de
Residência
(min.)
N° de
estágios
Extração
D2EHPA
1
4,4
7,3
6
2
Lavagem
H2SO4
0,1
1,2
7,3
8
2
Reextração
H2SO4
2
1,0
7,3
8
5
A etapa de extração estabilizou-se a partir de 10 horas de operação, sendo que o solvente
efluente da etapa de reextração passou a ser recirculado no sistema a partir de 7 horas de
operação. Após o término do experimento foi feito o perfil da concentração dos metais em cada
estágio do circuito. Nas FIG. 7.3 e 7.4 são apresentados os perfis de extração para o zinco e
cobre, respectivamente.
RESULTADOS E DISCUSSÃO
70
110
Lavagem
Extração
100
Re-extração
U3O8
(g/L)
Zn (g/L)
90
80
Aquoso
Orgânico
70
60
50
40
30
20
10
0
1
2
3
4
5
6
7
8
9
Estágios
FIGURA 7.3. Perfil de extração e reextração de zinco no ensaio contínuo 1.
45
40
Extração
Lavagem
Re-extração
Cu (g/L)
U3O8
(g/L)
35
Aquoso
Orgânico
30
25
20
15
10
5
0
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.4. Perfil de extração e reextração de cobre no ensaio contínuo 1.
RESULTADOS E DISCUSSÃO
71
A FIG. 7.3 representa a concentração do zinco nas fases aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a curva de concentração deste metal na fase
orgânica é pouco ascendente. Isto significa que a extração do zinco ocorre, principalmente, no
estágio 2. Na etapa de lavagem, o zinco é pouco removido (aproximadamente 1,5 g/L).
A FIG. 7.4 representa a concentração do cobre na fase aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
menor que 1 g/L. Isto indica a preferência do extratante pelo zinco. Na etapa de lavagem, o cobre
é praticamente todo removido.
Como já dito, anteriormente, objetiva-se realizar a separação Zn/Cu da solução
industrial. Neste sentido, deseja-se um rafinado com a menor concentração possível de zinco e
um reextrato com baixa concentração de Cu e alta concentração de Zn. A TAB. 7.3 apresenta as
concentrações do Zn e Cu no rafinado, no reextrato e no orgânico regenerado, obtidos neste
experimento.
TABELA 7.3
Resultados obtidos após 30 horas de operação no experimento contínuo 1
Horas
Amostra
Zn
Cu
Rafinado
5,5 g/L
30,1 g/L
Reextrato
105,8 g/L
0,97 g/L
Orgânico regenerado
<0,005 g/L
<0,005 g/L
30 h
A partir da TAB. 7.3, observa-se que a concentração de Cu no reextrato foi baixa. No
entanto, o refinado possui um elevado teor de zinco, indesejável no processo. Sendo assim, as
condições operacionais usadas foram alteradas com o intuito de diminuir esta concentração.
7.2. Experimento Contínuo 2
Com o intuito de aumentar a extração de zinco, aumentou-se o tempo de residência no
estágio de extração e reextração e manteve-se a relação de alimentação. O circuito permaneceu
com 2 estágios na etapa de extração, 2 estágios de lavagem e 5 estágios de reextração.
RESULTADOS E DISCUSSÃO
72
A correção de pH (pH 2) foi feita nos dois estágios de extração com hidróxido de
amônio 3 mol/L. Na lavagem e na reextração, foi utilizado H2SO4 0,1 mol/L e 2 mol/L,
respectivamente. As condições operacionais usadas estão apresentadas na TAB. 7.4. Na extração,
o 1° estágio corresponde a saída do rafinado e a entrada do orgânico limpo (D2EHPA) e o 2°
estágio corresponde à entrada da alimentação (ZnCu 2). Na etapa de lavagem, o 4° estágio
corresponde à entrada da solução de lavagem. Na etapa de reextração, o 5° estágio corresponde à
saída do reextrato e o 9° estágio corresponde à entrada do reextrante e a saída do orgânico
regenerado (FIG. 7.5).
FIGURA 7.5. Esquema do circuito do ensaio contínuo 2.
RESULTADOS E DISCUSSÃO
73
TABELA 7.4
Condições operacionais do experimento contínuo 2 (EC2)
Vazão média
Solução
Etapa
Reagente
(mL/min.)
Concentração
(mol/L)
Aquoso Orgânico
Tempo de
Residência
(min.)
N° de
estágios
Extração
D2EHPA
1
2,6
4,4
10
2
Lavagem
H2SO4
0,1
0,7
4,4
14
2
Reextração
H2SO4
2
0,6
4,4
14
5
O experimento contínuo 2 (EC2) teve 32 horas de duração, no qual foram processados 5
litros de solução, aproximadamente. O tempo de residência no misturador na etapa de extração
foi de 10 minutos, enquanto na etapa de lavagem e reextração foi de 14 minutos. Para o estágio
de extração, a relação de alimentação foi de 0,6 e para a reextração foi de 7,3. Nestas condições,
seria possível obter, no estágio de extração, uma fase orgânica carregada com 18 g/L de Zn e, na
reextração, um reextrato com 130 g/L de Zn, aproximadamente.
A etapa de extração estabilizou-se a partir de 10 horas de operação, sendo que o solvente
efluente da etapa de reextração passou a ser recirculado no sistema a partir de 14 horas de
operação. Nas FIG. 7.6 e 7.7 são apresentados os perfis de extração para o zinco e cobre,
respectivamente.
RESULTADOS E DISCUSSÃO
100
74
Extração
Re-extração
Lavagem
90
Zn (g/L)
U3O8
(g/L)
80
Aquoso
Orgânico
70
60
50
40
30
20
10
0
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.6. Perfil de extração e reextração de zinco no ensaio contínuo 2.
40
Extração
Lavagem
Re-extração
35
Cu (g/L)
U3O8
(g/L)
30
25
Aquoso
Orgânico
20
15
10
5
0
1
2
3
4
5
6
7
8
9
Estágios
FIGURA 7.7. Perfil de extração e reextração de cobre no ensaio contínuo 2.
RESULTADOS E DISCUSSÃO
75
A FIG. 7.6 representa a concentração do zinco nas fases aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
praticamente constante, sendo que a extração do zinco ocorre, principalmente, no estágio 2. Na
etapa de lavagem, o zinco é pouco removido (aproximadamente 0,5 g/L). Para a reextração quase
completa deste metal são necessários 4 estágios de reextração.
A FIG. 7.7 representa a concentração do cobre na fase aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica, que
circulará nos estágios seguintes, é aproximadamente 1 g/L. Na etapa de lavagem, o cobre extraído
é praticamente todo removido. Na etapa de extração, obteve-se um orgânico carregado com 16,2
g/L de Zn e 1,14 g/L de Cu. A concentração dos metais no rafinado, reextrato e orgânico
regenerado estão apresentados na TAB. 7.5.
TABELA 7.5
Resultados obtidos após 32 horas de operação no experimento contínuo 2
Horas
Amostra
Zn
Cu
Rafinado
3,2 g/L
19,0 g/L
Reextrato
91,9 g/L
2,7 g/L
Orgânico regenerado
<0,005 g/L
<0,005 g/L
32 h
A análise da concentração no rafinado de Zn e Cu foi, respectivamente, 3,2 g/L e 19 g/L.
A diluição devido ao uso de NH4OH, para a correção do pH, foi de 1,6 vezes, o que propiciou
uma queda na concentração de Zn no rafinado. No entanto, houve um aumento na concentração
de Cu no reextrato, indesejável no processo. Sendo assim, as condições operacionais usadas
foram alteradas com o intuito de diminuir esta concentração.
7.3. Experimento Contínuo 3
O experimento contínuo 3 (EC3) teve 19 horas de duração, no qual foram processados 5
litros de solução, aproximadamente. Com o intuito de melhorar a extração do zinco e de reduzir o
teor de cobre no reextrato, aumentou-se o número de estágios nas etapas de extração e de
RESULTADOS E DISCUSSÃO
76
lavagem. Foram utilizados 3 estágios de extração, 3 estágios de lavagem e 5 estágios de
reextração. O tempo de residência no misturador, na etapa de extração, foi de 6 minutos e a
correção de pH foi feita com gás de amônia 20%, diluído em argônio, como no EC1. Para o
estágio de extração, a relação de alimentação foi de 0,6 e para a reextração foi de 7,3. Nestas
condições, seria possível obter, no estágio de extração, uma fase orgânica carregada com 18 g/L
de Zn e, na reextração, um reextrato com 130 g/L de Zn, aproximadamente.
A correção de pH (pH 2) foi feita no 2° e 3° estágios de extração. As condições
operacionais usadas estão apresentadas na TAB. 7.6. Na extração, o 3° estágio corresponde à
entrada da alimentação (ZnCu 2), o 1° estágio corresponde a saída do rafinado e a entrada do
orgânico limpo (D2EHPA). Na etapa de lavagem, o 6° estágio corresponde à entrada da solução
de lavagem. Na etapa de reextração, o 7° estágio corresponde à saída do reextrato e o 11° estágio
corresponde à entrada do reextrante e a saída do orgânico regenerado.
TABELA 7.6
Condições operacionais do experimento contínuo 3 (EC3)
Vazão média
Solução
Etapa
Reagente
(mL/min.)
Concentração
(mol/L)
Aquoso Orgânico
Tempo de
Residência
(min.)
N° de
estágios
Extração
D2EHPA
1
4,4
7,3
6
3
Lavagem
H2SO4
0,1
1,2
7,3
8
3
Reextração
H2SO4
2
1,0
7,3
8
5
A etapa de extração estabilizou-se a partir de 9 horas de operação, sendo que o solvente
efluente da etapa de reextração passou a ser recirculado no sistema a partir de 7 horas de
operação. Nas FIG. 7.8 e 7.9 são apresentados os perfis de extração para o zinco e cobre,
respectivamente.
RESULTADOS E DISCUSSÃO
77
110
Extração
100
90
80
Zn (g/L)
U3O8
(g/L)
Re-extração
Lavagem
Aquoso
Orgânico
70
60
50
40
30
20
10
0
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.8. Perfil de extração e reextração de zinco no ensaio contínuo 3.
50
Lavagem
Extração
45
Re-extração
Cu (g/L)
U3O8
(g/L)
40
35
Aquoso
Orgânico
30
25
20
15
10
5
0
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.9. Perfil de extração e reextração de cobre no ensaio contínuo 3.
RESULTADOS E DISCUSSÃO
78
A FIG. 7.8 representa a concentração do zinco nas fases aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
crescente, sendo que a extração do zinco ocorre, principalmente, no estágio 3. Na etapa de
lavagem, o zinco é pouco removido (aproximadamente, 1 g/L).
A FIG. 7.9 representa a concentração do cobre na fase aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
aproximadamente 1 g/L. Na etapa de lavagem, o cobre é praticamente removido.
Neste experimento, obteve-se um orgânico carregado com 15,9 g/L de Zn e 1,11 g/L de
Cu na etapa de extração. A concentração dos metais no rafinado, reextrato e orgânico regenerado
estão apresentados na TAB. 7.7.
TABELA 7.7
Resultados obtidos após 19 horas de operação no experimento contínuo 3
Horas
Amostra
Zn
Cu
Rafinado
2,8 g/L
28,9 g/L
Reextrato
109,0 g/L
170 μg/mL
Orgânico regenerado
<0,005 g/L
<0,005 g/L
19 h
A análise da concentração no rafinado de Zn e Cu foi, respectivamente, 2,8 g/L e 28,9
g/L. Observa-se que o reextrato apresentou uma baixa concentração de cobre e, em relação aos
experimentos anteriores, houve uma redução na concentração do Zn no rafinado, porém este
ainda permaneceu elevado, o que levou a realização do experimento contínuo 4.
7.4. Experimento Contínuo 4
Com o intuito de diminuir mais a concentração do Cu no reextrato, aumentou-se a vazão
do ácido de lavagem. O tempo de residência e a relação de alimentação nos estágios de extração e
reextração foram mantidos. O circuito permaneceu com 3 estágios na etapa de extração, 3
estágios na etapa de lavagem e 5 estágios na etapa de reextração.
RESULTADOS E DISCUSSÃO
79
A correção de pH (pH 2) foi feita no 2° e 3° estágios de extração com gás de amônia
20%. As condições operacionais usadas estão apresentadas na TAB. 7.8. Na etapa de lavagem, o
6° estágio corresponde à entrada da solução de lavagem. Na extração, o 3° estágio corresponde à
entrada da alimentação (ZnCu 2) , o 1° estágio corresponde a saída do rafinado e a entrada do
orgânico limpo (D2EHPA). Na etapa de reextração, o 7° estágio corresponde à saída do reextrato
e o 11° estágio corresponde à entrada do reextrante e a saída do orgânico regenerado.
TABELA 7.8
Condições operacionais do experimento contínuo 4 (EC4)
Vazão média
Solução
Etapa
Reagente
(mL/min.)
Concentração
(mol/L)
Aquoso Orgânico
Tempo de
Residência
(min.)
N° de
estágios
Extração
D2EHPA
1
4,4
7,3
6
3
Lavagem
H2SO4
0,1
1,4
7,3
8
3
Reextração
H2SO4
2
1,0
7,3
8
5
O experimento contínuo 4 (EC4) teve duração de 13 horas e foram processados
aproximadamente 3,5 litros de solução. O tempo de residência no misturador na etapa de extração
foi de 6 minutos, enquanto na etapa de lavagem e reextração foi de 8 minutos, aproximadamente.
Para o estágio de extração, a relação de alimentação foi de 0,6 e para a reextração foi de 7,3.
Nestas condições, seria possível obter, no estágio de extração, uma fase orgânica carregada com
18 g/L de Zn e, na reextração, um reextrato com 130 g/L de Zn, aproximadamente. Nas FIG. 7.10
e 7.11 são apresentados os perfis de extração para o zinco e cobre, respectivamente.
Zn (g/L)
U3O8
(g/L)
RESULTADOS E DISCUSSÃO
130
120
110
100
90
80
70
60
50
40
30
20
10
0
80
Extração
Re-extração
Lavagem
Aquoso
Orgânico
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.10. Perfil de extração e reextração de zinco no ensaio contínuo 4.
40
Lavagem
Extração
Re-extração
35
Cu (g/L)
U3O8
(g/L)
30
25
Aquoso
Orgânico
20
15
10
5
0
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.11. Perfil de extração e reextração de cobre no ensaio contínuo 4.
RESULTADOS E DISCUSSÃO
81
A FIG. 7.10 representa a concentração do zinco nas fases aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
crescente, sendo que a extração do zinco ocorre, principalmente, no estágio 3. Na etapa de
lavagem, a concentração de zinco é praticamente constante.
A FIG. 7.11 representa a concentração do cobre na fase aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
aproximadamente 1 g/L. Na etapa de lavagem, o cobre é praticamente removido.
Nestas condições, obteve-se um orgânico carregado com 19,3 g/L de Zn e 0,62 g/L de
Cu na etapa de extração. A concentração dos metais no rafinado, reextrato e orgânico regenerado
estão apresentados na TAB. 7.9.
TABELA 7.9
Resultados obtidos após 13 horas de operação no experimento contínuo 4
Horas
Amostra
Zn
Cu
Rafinado
0,35 g/L
28,5 g/L
Reextrato
125,0 g/L
0,160 g/L
Orgânico regenerado
<0,005 g/L
<0,005 g/L
13 h
Observa-se que o reextrato apresentou uma baixa concentração de cobre e o rafinado
uma baixa concentração de Zn, desejáveis no processo. Estes resultados indicam uma eficiente
separação dos metais Zn/Cu da solução artificial.
7.5. Experimento Contínuo 5
Com o intuito de verificar a extração do Cd, Ni e Co, presentes na solução industrial, foi
circulado a solução ZnCu, mantendo-se as condições operacionais anteriores. O experimento
contínuo 5 (EC5) teve 13 horas de duração, no qual foram processados 3,5 litros de solução,
aproximadamente. O tempo de residência no misturador na etapa de extração foi de 6 minutos,
enquanto na etapa de lavagem e reextração foi de 8 minutos, aproximadamente. Para o estágio de
extração, a relação de alimentação foi de 0,6 e para a reextração foi de 7,3. Nestas condições,
RESULTADOS E DISCUSSÃO
82
seria possível obter, no estágio de extração, uma fase orgânica carregada com 18 g/L de Zn e, na
reextração, um reextrato com 130 g/L de Zn, aproximadamente. Nas FIG. 7.12 e 7.13 são
Zn (g/L)
U3O8
(g/L)
apresentados os perfis de extração para o zinco e cobre, respectivamente.
120
110
100
90
80
70
60
50
40
30
20
10
0
Re-extração
Lavagem
Extração
Aquoso
Orgânico
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.12. Perfil de extração e reextração de zinco no ensaio contínuo 5.
RESULTADOS E DISCUSSÃO
83
45
Lavagem
Extração
40
Re-extração
Cu (g/L)
U3O8
(g/L)
35
30
Aquoso
Orgânico
25
20
15
10
5
0
1
2
3
4
5
6
7
8
9
10
11
Estágios
FIGURA 7.13. Perfil de extração e reextração de cobre no ensaio contínuo 5.
A FIG. 7.12 representa a concentração do zinco nas fases aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
crescente, sendo que a extração do zinco ocorre, principalmente, no estágio 3. Na etapa de
lavagem, o zinco é pouco removido (aproximadamente 1 g/L).
A FIG. 7.13 representa a concentração do cobre na fase aquosa e orgânica ao longo do
circuito. Na etapa de extração, observa-se que a concentração deste metal na fase orgânica é
aproximadamente 1 g/L. Na etapa de lavagem, o cobre é praticamente removido.
Neste experimento, obteve-se um orgânico carregado com 14,9 g/L de Zn, 0,36 g/L de
Cu, 0,026 g/L de Cd e traços de níquel e cobalto (<0,001 g/L). A concentração dos metais no
rafinado, reextrato e orgânico regenerado estão apresentados na TAB. 7.10.
RESULTADOS E DISCUSSÃO
84
TABELA 7.10
Resultados obtidos após 13 horas de operação no experimento contínuo 5
Horas
13 h
Amostra
Zn
Cu
Cd
Ni
Co
Rafinado
0,49 g/L
28,6 g/L
1,48 g/L
0,08 g/L
0,10 g/L
Reextrato
125 g/L
0,05 g/L
<0,005 g/L
<0,005 g/L
<0,005 g/L
<0,005 g/L <0,005 g/L <0,001 g/L
<0,001 g/L
<0,001 g/L
Orgânico
regenerado
Observa-se que o reextrato apresentou uma baixa concentração de cobre, cádmio, níquel
e cobalto e o rafinado apresentou uma baixa concentração de Zn, desejáveis no processo. Estes
resultados indicam uma eficiente separação dos metais Zn/Cu da solução industrial.
7.6. Balanço de Massas
O balanço de massas foi realizado com o intuito de verificar a eficiência do processo e
resultados analíticos. Este se baseia no princípio de conservação de massa e por isto, é de grande
importância no desenvolvimento de processos hidrometalúrgicos (ROSENQVIST, 1984).
7.6.1. Experimento Contínuo 1
A FIG. 7.14 apresenta de forma esquemática a bateria de células misturador/ decantador
utilizada no EC1 com as indicações de fluxos de entrada e saída.
RESULTADOS E DISCUSSÃO
FIGURA 7.14. Extração por solvente multi-estágio em contracorrente no EC1.
Onde:
[MAl] = concentração do metal na fase aquosa de alimentação
[MRaf] = concentração do metal no rafinado
[MLv] = concentração do metal na solução de lavagem
[MOi] = concentração do metal no orgânico ao entrar no sistema
[MOc] = concentração do metal no orgânico carregado na saída da etapa de lavagem
[MOe] = concentração do metal no orgânico esgotado na saída da etapa de reextração
[MRx] = concentração do metal no reextrato na saída da etapa de reextração
A = vazão da fase aquosa
O = vazão da fase orgânica
L = vazão da solução de lavagem
Rex = vazão do reextratante
R = vazão do rafinado
M = Zn ou Cu
ETAPA DE EXTRAÇÃO
Um balanço de massa para os metais na etapa de extração fornece:
85
RESULTADOS E DISCUSSÃO
A [MAl] = R [MRaf] + O [MOc]
86
(7.3)
Onde: R = A + L
Considerando:
[ZnAl] = 30 g/L
[CuAl] = 38 g/L
[ZnRaf] = 5,5 g/L
[CuRaf] = 29,7 g/L
Tem-se para o metal Zn:
4,4 x 30 = (4,4 + 1,2) x 5,5 + 7,3 [ZnOc]
132 = 30,8 + 7,3 [ZnOc]
[ZnOc] = 13,9 g/L
Tem-se para o metal Cu:
4,4 x 38 = (4,4 + 1,2) x 29,7 + 7,3 [CuOc]
167,2 = 166,3 + 7,3 [CuOc]
[CuOc] = 0,12 g/L
ETAPA DE REEXTRAÇÃO
O [MOc] = O [MOe] + Rex [MRx]
Considerando:
[ZnOe] = 0,005 g/L
[CuOe] = 0,005 g/L
[ZnOc] = 13,9 g/L
[CuOc] = 0,12 g/L
(7.4)
RESULTADOS E DISCUSSÃO
87
Tem-se para o metal Zn:
7,3 x 13,9 = 7,3 x 0,005 + 1,0 [ZnRx]
101,47 = 0,0365 + 1,0 [ZnRx]
[ZnRx] = 101,4 g/L
Tem-se para o metal Cu:
7,3 x 0,12 = 7,3 x 0,005 + 1,0 [CuRx]
0,876 = 0,0365 + 1,0 [CuRx]
[CuRx] = 0,84 g/L
Os resultados experimentais forneceram:
[ZnOc] = 15,3 g/L
[CuOc] = 0,215 g/L
[ZnRx] = 105,8 g/L
[CuRx] = 0,97 g/L
A precisão e a exatidão de uma medida podem ser afetadas por dois tipos de erros: erros
determinados e erros indeterminados. Os erros determinados têm causas definidas e não são
localizáveis. São eles: erros instrumentais, erros de operação, erros pessoais, erros do método e
erros dos reagentes. Já os erros indeterminados representam à incerteza experimental que ocorre
em qualquer medida. A influência destes erros no processo pode ser indicada pelo desvio padrão.
Como não é possível eliminar todos os erros, o pesquisador deve minimizá-los até um nível
tolerável (SILVA e TÓFANI, 2003). A TAB. 7.11 apresenta as análises quantitativas dos
elementos de interesse (Zn e Cu) das amostras geradas no EC1 e o balanço de massa realizado
para verificar a eficiência do processo.
RESULTADOS E DISCUSSÃO
88
TABELA 7.11
Comparação dos resultados obtidos no experimento contínuo 1
Resultados
Extração
Reextração
ZnOc
CuOc
ZnRx
CuRx
Análise (g/L)
15,3
0,22
105,8
0,97
Balanço de massa (g/L)
13,9
0,12
101,4
0,84
Desvio padrão (%)
1,0
0,07
3,1
0,09
Considerando como tolerável um erro de 5%, pode-se considerar o balanço de massa
global para os metais satisfatório. Isto indica que o processo é eficiente e que o erro do método
analítico utilizado possui um nível de insignificância tolerável.
7.6.2. Experimento Contínuo 2
A FIG. 7.15 apresenta de forma esquemática a bateria de células misturador/ decantador
utilizada no EC2 com as indicações de fluxos de entrada e saída.
FIGURA 7.15. Extração por solvente multi-estágio em contracorrente no EC2.
RESULTADOS E DISCUSSÃO
89
Onde:
[MAl] = concentração do metal na fase aquosa de alimentação
[MRaf] = concentração do metal no rafinado
[MLv] = concentração do metal na solução de lavagem
[MOi] = concentração do metal no orgânico ao entrar no sistema
[MOc] = concentração do metal no orgânico carregado na saída da etapa de extração e lavagem
[MOe] = concentração do metal no orgânico carregado na saída da etapa de reextração
[MRx] = concentração do metal no reextrato na saída da etapa de reextração
A = vazão da fase aquosa
O = vazão da fase orgânica
L = vazão da solução de lavagem
Rex = vazão do reextratante
R = vazão do rafinado
H = vazão da solução de hidróxido de amônio
M = Zn ou Cu
ETAPA DE EXTRAÇÃO
Um balanço de massa para os metais na etapa de extração fornece:
A [MAl] = R [MRaf] + O [MOc]
Onde: R = A + L + H
Considerando:
[ZnAl] = 30 g/L
[CuAl] = 38 g/L
[ZnRaf] = 3,2 g/L
[CuRaf] = 19,7 g/L
(7.3)
RESULTADOS E DISCUSSÃO
90
Tem-se para o metal Zn:
2,6 x 30 = (2,6 + 0,7 + 1,6) x 3,2 + 4,4 [ZnOc]
78 = 15,7 + 4,4 [ZnOc]
[ZnOc] = 14,2 g/L
Tem-se para o metal Cu:
2,6 x 38 = (2,6 + 0,7 + 1,6) x 19,7 + 4,4 [CuOc]
98,8 = 96,5 + 4,4 [CuOc]
[CuOc] = 0,52 g/L
ETAPA DE REEXTRAÇÃO
O [MOc] = O [MOe] + Rex [MRx]
Considerando:
[ZnOe] = 0,280 g/L
[CuOe] = 0,013 g/L
[ZnOc] = 14,2 g/L
[CuOc] = 0,52 g/L
Tem-se para o metal Zn:
4,4 x 14,2 = 4,4 x 0,280 + 0,6 [ZnRx]
62,48 = 1,232 + 0,6 [ZnRx]
[ZnRx] = 102,1 g/L
Tem-se para o metal Cu:
4,4 x 0,52 = 4,4 x 0,013 + 0,6 [CuRx]
2,3 = 0,057 + 0,6 [CuRx]
(7.4)
RESULTADOS E DISCUSSÃO
91
[CuRx] = 3,7 g/L
Os resultados experimentais forneceram:
[ZnOc] = 16,2 g/L
[CuOc] = 1,1 g/L
[ZnRx] = 109,0 g/L
[CuRx] = 2,7 g/L
A TAB. 7.12 apresenta as análises quantitativas dos elementos de interesse (Zn e Cu)
das amostras geradas no EC2 e o balanço de massa realizado para verificar a eficiência do
processo.
TABELA 7.12
Comparação dos resultados obtidos no experimento contínuo 2
Resultados
Extração
Reextração
ZnOc
CuOc
ZnRx
CuRx
Análise (g/L)
16,2
1,1
109,0
2,7
Balanço de massa (g/L)
14,2
0,52
102,1
3,7
Desvio padrão (%)
1,4
0,41
4,9
0,7
Considerando como tolerável um erro de 5%, pode-se considerar o balanço de massa
global para os metais satisfatório. Isto indica que o processo é eficiente e que o erro do método
analítico utilizado possui um nível de insignificância tolerável. No entanto, para diminuir o erro
na etapa de reextração, deve-se medir a vazão do rafinado, diretamente na saída da célula, uma
vez que a correção do pH neste experimento foi realizado com solução de NH4OH e não com gás
como nos demais.
RESULTADOS E DISCUSSÃO
92
7.6.3. Experimento Contínuo 3
A FIG. 7.14 apresentada anteriormente mostra de forma esquemática a bateria de células
misturador/ decantador utilizada no EC3 com as indicações de fluxos de entrada e saída.
ETAPA DE EXTRAÇÃO
Um balanço de massa para os metais na etapa de extração fornece:
A [MAl] = R [MRaf] + O [MOc]
Onde: R = A + L
Considerando:
[ZnAl] = 30 g/L
[CuAl] = 38 g/L
[ZnRaf] = 2,8 g/L
[CuRaf] = 29,6 g/L
Tem-se para o metal Zn:
4,4 x 30 = (4,4 + 1,2) x 2,8 + 7,3 [ZnOc]
132 = 15,7 + 7,3 [ZnOc]
[ZnOc] = 15,9 g/L
Tem-se para o metal Cu:
4,4 x 38 = (4,4 + 1,2) x 29,6 + 7,3 [CuOc]
167,2 = 165,72 + 7,3 [CuOc]
[CuOc] = 0,20 g/L
(7.3)
RESULTADOS E DISCUSSÃO
93
ETAPA DE REEXTRAÇÃO
O [MOc] = O [MOe] + Rex [MRx]
Considerando:
[ZnOe] = 0,005 g/L
[CuOe] = 0,005 g/L
[ZnOc] = 15,9 g/L
[CuOc] = 0,20 g/L
Tem-se para o metal Zn:
7,3 x 15,9 = 7,3 x 0,005 + 1,0 [ZnRx]
116,1 = 0,0365 + 1,0 [ZnRx]
[ZnRx] = 116,0 g/L
Tem-se para o metal Cu:
7,3 x 0,20 = 7,3 x 0,005 + 1,0 [CuRx]
2,56 = 0,0365 + 1,0 [CuRx]
[CuRx] = 1,4 g/L
Os resultados experimentais forneceram:
[ZnOc] = 15,9 g/L
[CuOc] = 1,11 g/L
[ZnRx] = 109,0 g/L
[CuRx] = 0,170 g/L
(7.4)
RESULTADOS E DISCUSSÃO
94
A TAB. 7.13 apresenta as análises quantitativas dos elementos de interesse (Zn e Cu)
das amostras geradas no EC3 e o balanço de massa realizado para verificar a eficiência do
processo.
TABELA 7.13
Comparação dos resultados obtidos no experimento contínuo 3
Resultados
Extração
Reextração
ZnOc
CuOc
ZnRx
CuRx
Análise (g/L)
15,9
1,1
109,0
0,2
Balanço de massa (g/L)
15,9
0,2
116,0
1,4
Desvio padrão (%)
0,0
0,6
4,9
0,9
7.6.4. Experimento Contínuo 4
A FIG. 7.14 apresentada anteriormente mostra de forma esquemática a bateria de células
misturador/ decantador utilizada no EC4 com as indicações de fluxos de entrada e saída.
ETAPA DE EXTRAÇÃO
Um balanço de massa para os metais na etapa de extração fornece:
A [MAl] = R [MRaf] + O [MOc]
Onde: R = A + L
Considerando:
[ZnAl] = 30 g/L
[CuAl] = 38 g/L
[ZnRaf] = 0,35 g/L
[CuRaf] = 28,5 g/L
(7.3)
RESULTADOS E DISCUSSÃO
95
Tem-se para o metal Zn:
4,4 x 30 = (4,4 + 1,4) x 0,35 + 7,3 [ZnOc]
132 = 2,03 + 7,3 [ZnOc]
[ZnOc] = 17,8 g/L
Tem-se para o metal Cu:
4,4 x 38 = (4,4 + 1,4) x 28,5 + 7,3 [CuOc]
167,2 = 165,3 + 7,3 [CuOc]
[CuOc] = 0,26 g/L
ETAPA DE REEXTRAÇÃO
O [MOc] = O [MOe] + Rex [MRx]
Considerando:
[ZnOe] = 0,005 g/L
[CuOe] = 0,005 g/L
[ZnOc] = 17,8 g/L
[CuOc] = 0,26 g/L
Tem-se para o metal Zn:
7,3 x 17,8 = 7,3 x 0,005 + 1,0 [ZnRx]
129,9 = 0,0365 + 1,0 [ZnRx]
[ZnRx] = 129,9 g/L
Tem-se para o metal Cu:
7,3 x 0,26 = 7,3 x 0,005 + 1,0 [CuRx]
(7.4)
RESULTADOS E DISCUSSÃO
96
1,9 = 0,0365 + 1,0 [CuRx]
[CuRx] = 1,9 g/L
Os resultados experimentais forneceram:
[ZnOc] = 19,3 g/L
[CuOc] = 0,62 g/L
[ZnRx] = 125,0 g/L
[CuRx] = 0,160 g/L
A TAB. 7.14 apresenta as análises quantitativas dos elementos de interesse (Zn e Cu)
das amostras geradas no EC4 e o balanço de massa realizado para verificar a eficiência do
processo.
TABELA 7.14
Comparação dos resultados obtidos no experimento contínuo 4
Resultados
Extração
Reextração
ZnOc
CuOc
ZnRx
CuRx
Análise (g/L)
19,3
0,62
125,0
0,16
Balanço de massa (g/L)
17,8
0,26
129,9
1,9
Desvio padrão (%)
1,1
0,25
3,5
1,2
7.6.5. Experimento Contínuo 5
A apresentação esquemática da bateria de células misturador/ decantador utilizada no
EC5 com as indicações de fluxos de entrada e saída também corresponde a apresentada na FIG.
7.14.
RESULTADOS E DISCUSSÃO
97
ETAPA DE EXTRAÇÃO
Um balanço de massa para os metais na etapa de extração fornece:
A [MAl] = R [MRaf] + O [MOc]
(7.3)
Onde: R = A + L
Considerando:
[ZnAl] = 29,6 g/L
[CuAl] = 37,4 g/L
[ZnRaf] = 0,49 g/L
[CuRaf] = 28,6 g/L
Tem-se para o metal Zn:
4,4 x 29,6 = (4,4 + 1,4) x 0,49 + 7,3 [ZnOc]
130,24 = 2,84 + 7,3 [ZnOc]
[ZnOc] = 17,5 g/L
Tem-se para o metal Cu:
4,4 x 37,4 = (4,4 + 1,4) x 28,3 + 7,3 [CuOc]
164,6 = 164,14 + 7,3 [CuOc]
[CuOc] = 0,063 g/L
ETAPA DE REEXTRAÇÃO
O [MOc] = O [MOe] + Rex [MRx]
Considerando:
(7.4)
RESULTADOS E DISCUSSÃO
98
[ZnOe] = 0,005 g/L
[CuOe] = 0,005 g/L
[ZnOc] = 17,5 g/L
[CuOc] = 0,063 g/L
Tem-se para o metal Zn:
7,3 x 17,5 = 7,3 x 0,005 + 1,0 [ZnRx]
127,75 = 0,0365 + 1,0 [ZnRx]
[ZnRx] = 127,7 g/L
Tem-se para o metal Cu:
7,3 x 0,30 = 7,3 x 0,005 + 1,0 [CuRx]
2,19 = 0,0365 + 1,0 [CuRx]
[CuRx] = 2,2 g/L
Os resultados experimentais forneceram:
[ZnOc] = 14,9 g/L
[CuOc] = 0,36 g/L
[ZnRx] = 125,0 g/L
[CuRx] = 0,050 g/L
A TAB. 7.15 apresenta as análises quantitativas dos elementos de interesse (Zn e Cu)
das amostras geradas no EC5 e o balanço de massa realizado para verificar a eficiência do
processo.
RESULTADOS E DISCUSSÃO
99
TABELA 7.15
Comparação dos resultados obtidos no experimento contínuo 5
Resultados
Extração
Reextração
ZnOc
CuOc
ZnRx
CuRx
Análise (g/L)
14,9
0,36
125,0
0,050
Balanço de massa (g/L)
17,5
0,063
127,7
2,2
Desvio padrão (%)
1,8
0,21
1,9
1,5
CONCLUSÕES
100
CAPÍTULO 8
8. CONCLUSÕES
Com base nas discussões deste trabalho, as conclusões obtidas para o estudo de separação dos
metais zinco e cádmio, pela técnica de cementação, a partir do licor sulfúrico ZnCd, proveniente
da etapa de lixiviação de um resíduo de indústria de beneficiamento de minério de zinco, são
apresentadas a seguir:
•
Os estudos de cementação do cádmio indicaram a viabilidade técnica da recuperação dos
metais zinco e cádmio separadamente;
•
Todas as variáveis de processo estudadas (temperatura, pH inicial do licor, tempo de
reação, concentração de Zn no licor e excesso de pó de zinco metálico) apresentaram
efeitos significativos nos níveis estudados;
•
Devido a alta concentração de cádmio no licor e, consequentemente, a necessidade de
adição de quantidade relativamente elevada de pó de zinco para a completa precipitação
do Cd, a concentração inicial de zinco no licor deve ser controlada de forma a evitar a
supersaturação do íon Zn2+ em solução, evitando assim a pós precipitação do sulfato de
zinco.
•
Na condição de cementação selecionada, ou seja, temperatura de 50°C, 10% de excesso
de pó de zinco metálico, duas horas de reação e pH do licor igual a 1,5, foi obtida uma
solução de sulfato de zinco, com um teor de 150 g/L de Zn e 0,005 g/L de Cd, passível de
alimentar a etapa de eletrólise para a obtenção do zinco metálico, com recuperação do
cádmio foi superior a 99,9%. O cádmio metálico obtido apresentou pureza superior a
90%.
A partir do estudo de separação dos metais zinco e cobre a partir do licor sulfúrico ZnCu, gerado
na etapa de lixiviação de um resíduo proveniente do processamento de minério de zinco, pela
técnica de extração por solventes, pode se concluir:
CONCLUSÕES
•
Os
extratantes
101
organofosforados
selecionados
(D2EHPA,
IONQUEST®801
e
CYANEX®272) apresentaram boa capacidade de separação dos metais Zn/Cu a partir do
licor estudado. Já os extratantes quelantes (LIX®63, LIX®948N e LIX®612N-LV)
apresentaram uma menor seletividade.
•
Estudos realizados com o D2EHPA 1 mol/L indicaram o pH de equilíbrio próximo de 2
como o pH de operação ideal para a separação dos metais. O aumento no pH aumenta a
extração do cobre, indesejável no processo.
•
O ácido sulfúrico apresentou boa eficiência na reextração dos metais, sendo que em
baixas concentrações do ácido é possível reextrair o cobre enquanto a reextração do zinco
requer concentrações mais elevadas.
•
Os diagramas de McCabe-Thiele indicaram a necessidade de 2 a 3 estágios de
misturador/ decantador para as etapas de extração e de reextração. Nos ensaios contínuos
observou se a necessidade de 3 estágios de extração e 5 estágios de reextração. O número
maior de estágios de reextração teve como objetivo obter um reextrato com teor de zinco
superior ao obtido na curva de equilíbrio.
•
Depois de otimizadas as condições operacionais, foi obtido uma solução rica em zinco
(125 g/L de Zn e 0,05 g/L de Cu e traços de Cd, Co e Ni (<0,005 g/L) e outra rica em
cobre (28,6 g/L Cu, 0,49 g/L Zn, 1,48 g/L Cd, 0,080 g/L Ni e 0,098 g/L Co). Isto a partir
do licor contendo 29,6 g/L Zn, 37,4 g/L Cu, 1,94 g/L Cd, 0,127 g/L Co e 0,100 g/L Ni. O
circuito continuo para a separação dos metais foi montado com 3 estágios extração, 3
estágios de lavagem e 5 estágios de reextração. O pH de equilíbrio na etapa de extração
foi ajustado em 2 no segundo e terceiro estágios com gás de amônia. No primeiro estágio,
o pH ficou próximo de 1,6.
•
Os resultados indicam viabilidade técnica de recuperar separadamente os metais zinco
(Zn) e cobre (Cu) do licor sulfúrico ZnCu, gerado na etapa de lixiviação do resíduos
sólido da Companhia Paraibuna de Metais – CPM, com a obtenção de dois produtos de
qualidade comercial.
SUGESTÕES PARA TRABALHOS FUTUROS
102
CAPÍTULO 9
9. SUGESTÕES PARA TRABALHOS FUTUROS
AMOSTRA ZnCd
•
Estudar a separação de Zn e Cd utilizando a técnica de extração por solvente e comparar a
eficiência da técnica com a de cementação utilizada neste trabalho, considerar também os
fatores econômicos das duas técnicas.
AMOSTRA ZnCu
•
Precipitar o cobre a partir do reextrato obtido e verificar a pureza do produto final.
•
Estudar a precipitação por oxi-redução (cementação) do cobre, utilizando pó de zinco
metálico e comparar os resultados com os obtidos pela técnica de extração por solventes
utilizada neste trabalho.
•
Realizar ensaios contínuos com os outros extratantes organofosforados (IONQUEST®801,
CIANEX®272) para comparar a eficiência dos processos.
PUBLICAÇÕES
104
CAPÍTULO 10
10. PUBLICAÇÕES RELACIONADAS AO PRESENTE TRABALHO
GOUVEA, L. R.; MORAIS, C. A. Recovery of zinc and cadmium from industrial waste by
leaching/cementation. Minerals Engineering, v. 20, p. 956-958, 2007.
GOUVEA, L. R.; MORAIS, C. A. Estudo de Separação de zinco e Cobre a Partir de Licor
Sulfúrico pela Técnica de Extração Líquido - Líquido. In: XXII Encontro Nacional de
Tratamento de Minérios e Metalurgia Extrativa - XXII ENTMME, 2007, Ouro Preto/
MG. XXII Encontro Nacional de Tratamento de Minérios e Metalurgia Extrativa - XXII
ENTMME. Ouro Preto/ MG: Editora, 2007, v. 2, p. 87-92.
GOUVEA, L. R.; MORAIS, C. A. Recovery of zinc and cadmium from industrial waste by
leaching/cementation. In: International Symposium on Material, Mineral, & Metal
Ecology - MMM 06, 2006. Proceedings of Material, Minerals, & Metal Ecology 06. Cape
Town, South Africa: MEI Conferences, 2006.
GOUVEA, L. R.; MORAIS, C. A. Recuperación de Metales de Residuos de la Industria de Cinc.
In: VIII Jornadas Argentinas de Tratamiento de Minerales, 2006, San Juan. ACTAS de
las VIII Jornadas Argentinas de Tratamiento de Minerales. San Juan: EFU Editorial
Fundación Universidad Nacional de San Juan, 2006, v. 1, p. 345-354.
GOUVEA, L. R.; MORAIS, C. A. Recuperação de zinco e metais associados de resíduos
industriais - Estudo de lixiviação. In: XXI ENCONTRO NACIONAL DE
TRATAMENTO DE MINÉRIOS E METALURGIA EXTRATIVA - XXI ENTMME,
2005, Natal/RN. Editora, v.2, p.131 – 137.
MORAIS, C. A.; GOUVEA, L R.; TAKAYAMA FILHO, T.; CASTRO, V. A.. Recuperação de
zinco e cádmio de resíduo industrial por lixiviação/cementação. In: XXI ENCONTRO
NACIONAL DE TRATAMENTO DE MINÉRIOS E METALURGIA EXTRATIVA XXI ENTMME, 2005, Natal/RN. Editora, v.2, p.158 – 164.
REFERÊNCIAS BIBLIOGRÁFICAS
104
CAPÍTULO 11
11. REFERÊNCIAS BIBLIOGRÁFICAS
ALAMDARI, E.K. Synergistic effect of MEHPA on co-extraction of zinc and cadmium with
DEHPA. Minerals Engineering, v.17, p. 89-92, 2004.
ALI, A.M.I.; AHMAD, I.M.; DAOUD, J.A. CYANEX 272 for the extraction and recovery of
zinc from aqueous waste solution using a mixer-settler unit. Separation and Purification
Technology, v.47, p.135-140, 2006.
AUROUSSEAU, M.; PHAM, N.T.; OZIL, P. Effects of ultrasound on the electrochemical
cementation of cadmium by zinc powder. Ultrasonics Sonochemistry, v. 11, p. 23-26,
2004.
AZEVEDO, F.A.; CHASIN, A.A.M. Metais – Gerenciamento da Toxicidade. São Paulo:
Atheneu, p. 143- 182, 187-199, 263-296, 2003.
BANZA, A.N.; GOCK, E.; KONGOLO, K. Base metals recovery from copper smelter slag by
oxidising leaching and solvent extraction. Hydrometallurgy, v. 67, p. 63-69, 2000.
CERNA, M. Use of solvent-extraction for the removal of heavy-metals from liquid wastes.
Environmental monitoring and assessment, v. 34 (2), p. 151-162, 1995.
CHENG, C.Y. Solvent extraction of nickel and cobalt with synergistic systems consisting of
carboxylic acid and aliphatic hydroxyoxime. Hydrometallurgy, v. 84, p. 109-117, 2006.
CIMINELLI, V. S. T. Introdução ao Processamento Aquoso. Belo Horizonte: Universidade
Federal de Minas Gerais - Departamento de Engenharia Metalúrgica, p. 2-8, 2004.
DEPARTAMENTO NACIONAL DE PRODUÇÃO INDUSTRIAL. Sumário Mineral Mineralnegócios: Guia do Investidor no Brasil. Brasília, 2001, p.118 - 120. Disponível
em:
<http://www.dnpm.gov.br/assets/galeriadocumento/balancomineral2001/zinco.pdf>.
Acesso em: 04/05/2008.
DEPARTAMENTO NACIONAL DA PRODUÇÃO MINERAL. Perfil Analítico do Zinco –
Boletim n° 26. Rio de Janeiro, 1973, p. 1 - 16.
DEPARTAMENTO NACIONAL DA PRODUÇÃO MINERAL. Perfil Analítico do Cobre –
Boletim n° 56. Brasília, 1982, p. 1 - 19.
DIAZ, G.; MARTIN, D. Modified zincex process: The clean, safe and profitable solution to zinc
secondaries treatment. Resources, Conservation and Recycling, v.10, p.43–57, 1994.
REFERÊNCIAS BIBLIOGRÁFICAS
105
DIENSTBACH, U.; MOULAND J.; ZULIANI, P. Separate treatment of cottrell dust at Kidd
Creek. In: PROC. 28TH ANNUAL CONF. METALLURGISTS OF CIM, 1989, Halifix,
Canada.
DRAA, M.T.; BENAMOR, M. Extraction of Pb(II) by XAD7 impregnated resins with
organophosphorus extractants (DEHPA, IONQUEST 801, CYANEX 272). Separation
and Purification Technology, v.40, p.77-86, 2004.
FEIJÓ, F. D. Tratamento dos Resíduos de Cementação Provenientes de Metalugia de Zinco
da Votorantim Metais para Recuperação de Metais de Valor Agregado. Belo
Horizonte: Universidade Federal de Minas Gerais - Departamento de Engenharia
Metalúrgica e de Minas, p. 30, 2005.
FLETT, D.S. Solvent extraction in hydrometallurgy: the role of organophosphorus extractants.
Journal of Organometallic Chemistry, v. 690, p.2426-2438, 2005.
GARDUCCI, G.C. Extração seletiva de zinco, presente em efluentes clorídricos de processos
de galvanização a quente, pela técnica de extração líquido-líquido. 2006. 112 p.
Dissertação (Mestrado em Engenharia Química) - Escola de Engenharia, Universidade
Federal de Minas Gerais, 2006.
GOUVEA, L. R.; MORAIS, C. A. Recuperação de zinco e metais associados de resíduos
industriais - Estudo de lixiviação. In: XXI ENCONTRO NACIONAL DE
TRATAMENTO DE MINÉRIOS E METALURGIA EXTRATIVA - XXI ENTMME,
2005, Natal/RN. Editora, v.2, p.131 – 137.
HABASHI, F. A Textbook of Hydrometallurgy. Canada: Métallurgie Extractive Québec,
(1993), 689p.
HABASHI, F. Handbook of Extractive Metallurgy. New York: Wiley-VCH, (1997), v. II,
488p.
JHA, M.K.; KUMAR, V.; SINGH, R.J. Review of hydrometallurgical recovery of zinc from
industrial wastes. Resources, Conservation and Recycling, v. 33, p. 1–22, 2001.
KARAVASTEVA, M. The effect of certain surfactants on the cementation of cadmium by
suspended zinc particles, Hydrometallurgy, v. 47, p. 91-98, 1997.
MELLAH, A.; BENACHOUR, D. The solvent extraction of zinc and cadmium from phosphoric
acid solution by di-2-ethyl hexyl phosphoric acid in kerosene diluent. Chemical
Engineering and Processing, v.45, p. 684-690, 2006.
MORAIS, B.S.; MANSUR, M.B. Characterisation of the reactive test system ZnSO4/D2EHPA in
n-heptane. Hydrometallurgical, v.74, p. 11-18, 2003.
REFERÊNCIAS BIBLIOGRÁFICAS
106
MORAIS, C. A.; GOUVEA, L R.; TAKAYAMA FILHO, T.; CASTRO, V. A.. Recuperação de
zinco e cádmio de resíduo industrial por lixiviação/cementação. In: XXI ENCONTRO
NACIONAL DE TRATAMENTO DE MINÉRIOS E METALURGIA EXTRATIVA XXI ENTMME, 2005, Natal/RN. Editora, v.2, p.158 – 164.
NOGUEIRA, C.A.; DELMAS, F. New flowsheet for the recovery of cadmium, cobalt and nickel
from spent Ni-Cd batteries by solvent extraction. Hydrometallurgical, v.52, p. 267-287,
1999.
OWUSU, G. Selective extractions of Zn and Cd from Zn-Cd-Co-Ni sulphate solution using di-2ethylhexyl phosphoric acid extractant. Hydrometallurgical, v.47, p. 205-215, 1998.
PINA, P.S.; SILVA, C.A.; DAMAN, D.; FRENAY, J. Tratamento de resíduo contendo cádmio
originado da produção de zinco eletrolítico. In: XIX ENCONTRO NACIONAL DE
TRATAMENTO DE MINÉRIOS E METALURGIA EXTRATIVA - XIX ENTMME,
2002, Recife. Editora, p.299-305.
REDDY, B.R.; PRYA, D.N. Process development for the separation of copper(II), nickel(II) and
zinc(II) from sulphate solutions by solvent extraction using LIX 84 I. Separation and
Purification Technology, v.45, p.163-167, 2005.
RITCEY, G.M.; ASHBROOK, A.W. Principles and Applications to Process Metallurgy.
(Parte I) New York: Elsevier Science Publishers, (1984), 364p.
ROSENQVIST, T. Principles of Extractive Metallurgy. Japão: McGraw-Hill Kogakusha LTD.,
(1974), 524p.
SAN MIGUEL, E.R.; AGUILAR, J.C.; BERNAL, J.P.; BALLINAS, M.L.; RODRIGUEZ,
M.T.J.; GYVES, J.; SVHIMMEL, K. Extraction of Cu(II), Fe(III), Ga(III), Ni(II), In(III),
Co(II), Zn(II) and Pb(II) with LIX®984 dissolved in n-heptane. Hydrometallurgical, v.47,
p. 19-30, 1997.
SILVA, J.E.; PAIVA, A.P.; SOARES, D. LABRINCHA, A.; CASTRO, F. Solvent extraction
applied to the recovery of heavy metals from galvanic sludge. Journal of Hazardous
Materials, v. B120, p.113-118, 2005.
SILVA, M.J.S.F.; TÓFANI, S.F.B. Análise Quantitativa Prática. Belo Horizonte: Universidade
Federal de Minas Gerais - Departamento de Química, p. 6-7, 2003.
SOLE, K.C.; FEATHER, A.M.; COLE, P.M. Solvent extraction in southern Africa: An update of
some recent hydrometallurgical developments. Hydrometallurgical, v.78, p. 52-78, 2005.
TAHA, A.A.; ABD EL-GHANI, S.A.H. Effect of surfactants on the cementation of cadmium.
Journal of Colloid and Interface Science, v.280, p.9-17, 2004.
REFERÊNCIAS BIBLIOGRÁFICAS
107
THORNTON, J.D. Science and Practice of Liquid-Liquid Extraction. Oxford Science
Publications, v.2, 1992.