Newsletter TDT
nº21, Janeiro 2015
Os TDT no
Cancro da Próstata
Newsletter TDT
Nº 21, Janeiro de 2015
Os Técnicos de Diagnóstico e Terapêutica no
Cancro da Próstata
Grupo Newsletter
Análises Clínicas: Teresa Matos
Anatomia Patológica: Luís Martins
Cardiopneumologia: Eunice Conduto
Dietética: Cecília Gomes
Farmácia: Marco Silva
Fisioterapia: Maria do Carmo Rocha
Neurofisiologia: Joana Pires
Radiologia: Mónica José
Radioterapia: Sofia Moura
Terapia da Fala: Pedro Aires de Sousa
Terapia Ocupacional: Liliana Mendes
Comentários e/ou sugestões: [email protected] Pág. 2 de 19
Newsletter TDT
nº21, Janeiro de 2015
Índice
«Cancro da Próstata» ......................................................................................................................................................... 4
A) Anatomia Patológica .................................................................................................................................................. 4
A1) Anatomia geral da próstata.................................................................................................................................. 4
A2) Estrutura da próstata ........................................................................................................................................... 4
A3) Patologias da próstata .......................................................................................................................................... 4
A4) Diagnóstico das patologias da próstata ............................................................................................................... 5
A5) Classificação do adenocarcinoma da próstata através da escala de Gleason ..................................................... 5
A6) Diferentes produtos biológicos que podem chegar ao serviço de Anatomia Patológica .................................... 6
A7) Cuidados a ter no manuseamento das biópsias por agulha e RTU-P................................................................... 6
A8) Cuidados a ter no caso de peças cirúrgicas simples e complexas da próstata .................................................... 7
B) Análises Clínicas e Saúde Pública ............................................................................................................................. 11
B1) Determinação do Antigénio Específico da Próstata (PSA) ................................................................................. 11
C) Radiologia ................................................................................................................................................................. 12
C1) A Imagiologia no estadiamento do Cancro da Próstata ..................................................................................... 12
D) Farmácia ................................................................................................................................................................... 13
D1) Hormonoterapia ................................................................................................................................................. 13
D2) Quimioterapia .................................................................................................................................................... 14
E) Radioterapia ............................................................................................................................................................. 14
E1) Radioterapia externa .......................................................................................................................................... 14
E2) Braquiterapia ...................................................................................................................................................... 15
F) Dietética .................................................................................................................................................................... 16
F1) Intervenção nutricional em doentes com Cancro da Próstata submetidos a Radioterapia ............................... 16
G) Fisioterapia ............................................................................................................................................................... 17
G1) Intervenção da Fisioterapia do CHLN – HSM em utentes submetidos a prostatectomia radical ...................... 17
Newsletter TDT
Nº 21, Janeiro de 2015
«Cancro da Próstata»
1
2
2
Ana Judite Santos , Ana Luísa Corte Real , Henrique Pereira , Mara
3
4
2
5
6
6
Carriço , Mara Santos , Marco Silva , Mayra Pereira , Mónica José , Pedro Nunes ,
7
1
4
3
8
Rita Dias , Rute Dias , Sónia Perdigão , Susana Silva , Teresa Matos
1
Fisioterapeuta, Serviço de Medicina Física e Reabilitação, Hospital de Santa Maria,
CHLN, EPE
2
Técnico de Farmácia do Serviço de Gestão Técnico-Farmacêutica, Hospital de Santa
Maria, CHLN, EPE
3
Técnica de Análises Clínicas e Saúde Pública – Laboratório de Química Clínica, Serviço
de Patologia Clínica, Hospital de Santa Maria, CHLN, EPE
4
Técnica de Anatomia Patológica, Serviço de Anatomia Patológica, Hospital de Santa
Maria, CHLN, EPE
5
Técnica de Radioterapia, Serviço de Radioterapia, Hospital de Santa Maria, CHLN, EPE
6
Técnico de Radiologia, Serviço de Imagiologia, Hospital de Santa Maria, CHLN, EPE
7
Dietista, Serviço de Dietética e Nutrição, Hospital de Santa Maria, CHLN, EPE
8
Técnica de Análises Clínicas e Saúde Pública – Laboratório de Urgência, Serviço de
Patologia Clínica, Hospital de Santa Maria, CHLN, EPE
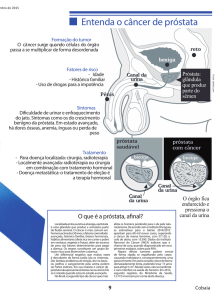
O cancro da próstata é um dos principais problemas médicos do
universo masculino, uma vez que se trata do tipo mais frequente de
cancro no homem. Segundo a Associação Portuguesa de Urologia,
este representa a segunda causa de morte por cancro no homem
4
nos países ocidentais.
Com o aumento da esperança média de vida verifica-se também um
81
aumento da incidência e da mortalidade do cancro da próstata.
Por ter uma evolução geralmente silenciosa (assintomática) pode
atingir estadios avançados até que seja diagnosticado, como tal, é
deveras importante que se aposte na detecção precoce da doença.
Em Portugal, o cancro da próstata atinge anualmente 3500 a 4000
39
portugueses, sendo que 1800 acabam por morrer.
Como é uma doença geralmente assintomática é relevante ter em
conta a qualidade de vida do doente versus os efeitos secundários
do tratamento. Assim, e para cada doente, as características do
tumor a tratar devem ser cuidadosamente valorizadas, bem como
as diferentes opções de tratamento. Os possíveis tratamentos
15
dependem igualmente do grau e do estadio da doença.
Fig. 1 - Imagem ilustrativa da vista lateral da próstata na cavidade pélvica. 76
A2) Estrutura da próstata
A glândula prostática é constituída por 30 a 50 glândulas túbuloalveolares dispostas em 3 camadas concêntricas (Fig. 2):
- Zona central, que rodeia os canais ejaculadores, por onde o sémen
vai passar para a uretra (cerca de 25% do órgão);
- Zona de transição, a zona que rodeia a uretra prostática, onde se
desenvolve o aumento benigno ou hiperplasia benigna da próstata
(5 a 10% da próstata normal);
- Zona periférica, zona que rodeia a uretra distal, onde estão
contidas a maior parte das glândulas prostáticas e, mais
frequentemente, se originam os adenocarcinomas da próstata (e
que corresponde a 70% da próstata normal).
Os principais tratamentos existentes para o cancro da próstata são
a cirurgia, a radioterapia e a terapêutica farmacológica
74
(hormonoterapia e quimioterapia).
A) Anatomia Patológica
A1) Anatomia geral da próstata
A glândula prostática pesa aproximadamente 20 g e mede cerca de
4 cm de comprimento e 2 cm de largura. Localiza-se na cavidade
pélvica, atrás da face posterior da sínfise púbica, na base da bexiga,
onde envolve a uretra prostática e os dois canais ejaculadores. É
composta por uma cápsula de músculo liso e de numerosos feixes
de fibras musculares, que irradiam para o interior da glândula na
direcção da uretra. Recobrindo estas trabéculas musculares
encontra-se o epitélio cilíndrico que forma dilatações saculares,
para o interior das quais as células excretam o líquido prostático. Os
canais prostáticos, em número de 20 a 30, conduzem estas
secreções para a uretra prostática.
Fig. 2 - Esquema representativo das três camadas concêntricas da próstata. 48
A3) Patologias da próstata
Como patologias mais comuns da próstata podem enumerar-se:
- A doença inflamatória da próstata, designada por prostatite (que
pode ser aguda ou crónica), normalmente provocada por agentes
infecciosos que causam primeiramente infecção aguda da bexiga
e/ou uretra, de como é exemplo a E.coli e Proteus spp, ou até
mesmo, microrganismos sexualmente transmissíveis, como
Comentários e/ou sugestões: [email protected] Pág. 4 de 19
Newsletter TDT
Gonococcus e Chlamydia. A prostatite aguda pode evoluir para uma
prostatite crónica, caso não seja tratada convenientemente.
- A hiperplasia benigna da próstata (HBP), a patologia mais
frequente e com uma grande incidência em homens com idade
superior a 45 anos. A próstata vai crescendo com o decorrer da
idade sob a influência da hormona testosterona e quando aumenta
significativamente de volume, a cápsula prostática, sendo pouco
distensível,
começa
a
contrariar
esse
crescimento.
Consequentemente,
a
glândula
começa
a
provocar
compressão/obstrução da uretra prostática e eventualmente do
colo vesical, dificultando a capacidade de micção do doente (Fig. 3).
nº21, Janeiro de 2015
A5) Classificação do adenocarcinoma da próstata através da escala
1
de Gleason
O esquema de classificação histológica mais utilizado para o
adenocarcinoma da próstata é o proposto por Gleason (Fig. 4), o
qual é baseado na diferenciação arquitectural do tumor,
considerando que diferentes padrões podem ser observados no
mesmo tipo de tumor. Existem 5 graus diferentes, numerados de 1
a 5, em que o 1 corresponde a um tumor bem diferenciado (menor
diferença do padrão histológico normal) e o 5 a um tumor pouco
diferenciado (afasta-se completamente do padrão histológico
normal). Segundo esta classificação, o Patologista atribui um score
final de Gleason, que consiste na soma de dois dos graus acima
referidos: o primeiro que traduz o padrão arquitectural
predominante, isto é, a população celular mais abundante na
totalidade da amostra; e o segundo grau, que tem em consideração
o segundo padrão morfológico mais frequente (segunda população
celular mais abundante na amostra). Desta forma, o score final de
Gleason varia entre 2, no caso de Gleason 1+1 (tumor bem
diferenciado) e 10, de Gleason 5+5 (tumor pouco diferenciado).
Fig. 3 - Esquema ilustrativo da obstrução da uretra prostática e do colo vesical por
HBP.52
Consequentemente, a parede da bexiga torna-se mais espessa, uma
vez que tem de realizar um maior esforço para expulsar a urina e
começa a ficar irritável e sensível, contraindo-se com pequenas
quantidades de urina, o que provoca micções frequentes. Com o
progressivo enfraquecimento da força muscular da bexiga, ela
perde a capacidade de se esvaziar a si própria e a urina começa a
ficar parcialmente retida. Esta realidade pode conduzir a inúmeras
consequências prejudiciais, nomeadamente infecções do trato
urinário (a urina ao ficar retida, gera um ambiente propício ao
desenvolvimento de agentes infecciosos que não são eliminados
através da micção), a formação de cálculos renais e, em casos de
obstrução grave, pode provocar hidronefrose e insuficiência renal.
A patogenesia da HBP não é bem conhecida, mas pensa-se que se
deve a um desequilíbrio do balanço androgénio-estrogénio. Na
verdade, ao longo da sua vida, o homem produz testosterona, a
principal hormona masculina, mas também pequenas quantidades
de estrogénio, a principal hormona feminina. Com a idade, a
quantidade sanguínea de testosterona diminui, havendo uma maior
percentagem de estrogénio, responsável pelo aumento da
actividade de substâncias que promovem o crescimento das células
prostáticas. Outra teoria recente aponta a dihidrotestosterona
(DHT), uma substância derivada da testosterona, como a
responsável pelo crescimento prostático. Cientistas demonstraram
que os homens que não produzem testosterona DHT não
desenvolvem HBP.
Fig. 4 - Escala de Gleason para a classificação histológica do adenocarcinoma da
próstata, tendo em conta a morfologia/arquitectura tecidular e diferenciação tumoral e
as respectivas imagens histológicas exemplificativas de cada grau.57
O estadiamento do tumor é definido através da classificação TNM
(Tabela 1): a inicial “T” refere-se ao tumor primário, às suas
dimensões e extensão, isto é, se está limitado à próstata ou já
invade estruturas/órgãos anatomicamente próximos (Fig. 5); a “N”
refere-se à existência ou não de invasão dos gânglios linfáticos
regionais por tumor (gânglios pélvicos e paraaórticos) (Fig. 6); e a
“M” diz respeito à existência ou não de metástases à distância, isto
é, se células neoplásicas já entraram na corrente sanguínea e se
disseminaram para outros órgãos em que não existe uma relação
anatómica, como os ossos, pulmões, fígado e cérebro, sendo, neste
caso, a metastização óssea a mais frequente.
- O adenocarcinoma da próstata, que é o segundo tipo de tumor
mais frequente no homem, com uma grande taxa de incidência
acima dos 55 anos.
A4) Diagnóstico das patologias da próstata
Apesar de existirem inúmeros exames complementares que podem
ser indicadores de patologia prostática, como a fluxometria
urinária, a medição do resíduo urinário pós-miccional, a urografia
endovenosa e a cistoscopia, é o toque rectal, a ecografia e a análise
sanguínea dos níveis de Antigénio Específico da Próstata (PSA) que
mais são utilizados como principais exames no diagnóstico de
patologias da próstata.
1
Donald F. Gleason, M.D., patologista-chefe do Minneapolis Veterans Affairs
Hospital, conhecido por ter elaborado a escala de Gleason.
Comentários e/ou sugestões: [email protected] Pág. 5 de 19
Newsletter TDT
Tabela 1 - Tabela de classificação TNM utilizada para o estadiamento dos tumores da
41
próstata.
nº21, Janeiro de 2015
As biópsias prostáticas transrectais (ecodirigidas), recebidas no
serviço de Anatomia Patológica, são realizadas por agulha e
normalmente são sextantes, isto é, seguem um protocolo de
colheita. Assim sendo, são enviados seis tubos, cada um deles com
dois fragmentos filiformes, em média com 1 cm de comprimento,
da zona basal, medial e apical à esquerda e à direita da próstata
(Fig. 7).
Fig. 7 - Biópsias prostáticas sextantes.53
Os RTU-P são produtos constituídos por vários fragmentos
irregulares/cilíndricos, de aspecto cinzento-rosado e com
consistência elástica, que resultam da remoção do tecido prostático
obstrutivo (hiperplásico), através de um ressectoscópio que é
introduzido na uretra (Fig. 8).
Fig. 8 - Fragmentos de RTU-P.
Fig. 5 - Esquema ilustrativo da classificação de T1 a T4 para o estadiamento do tumor
da próstata.36
59
No caso das peças de prostatectomia simples/adenomectomia
prostática, a próstata é excisada parcialmente, sendo removida a
parte interna obstrutiva e poupadas as vesículas seminais. Pelo
contrário, nas prostatectomias radicais, a próstata é excisada na sua
totalidade, juntamente com as vesículas seminais e gânglios
linfáticos periféricos. Nas peças de cistoprostatectomias radicais (as
mais complexas), é feita a remoção em bloco da próstata, vesículas
seminais, bexiga, cotos ureterais e gânglios linfáticos.
A7) Cuidados a ter no manuseamento das biópsias por agulha e
RTU-P
Fig. 6 - Esquema ilustrativo do tumor da próstata que já se disseminou aos gânglios
linfáticos regionais.44
A6) Diferentes produtos biológicos que podem chegar ao serviço
de Anatomia Patológica
No que diz respeito à próstata, são vários os produtos que podem
chegar ao Laboratório de Anatomia Patológica. Numa ordem
crescente de complexidade podem enumerar-se: as biópsias por
agulha (ecoguiadas), Ressecção Transuretral da Próstata (RTU-P), as
peças operatórias de prostatectomia simples/adenomectomias, de
prostatectomias radicais e ainda as cistoprostatectomias radicais.
As biópsias por agulha bem como os RTU-P são seguidos, no próprio
dia, pelo técnico de Anatomia Patológica (TAP). Tendo em
consideração o protocolo do serviço, existem alguns cuidados a ter:
a)
No caso das biópsias por agulha - o TAP deve conferir
sempre o número do exame, bem como o nome do doente
que consta na requisição, com os respectivos tubos das
biópsias e colocá-los por ordem na bancada da hotte (de 1 a
6, no caso das biópsias sextantes); depois deve identificar as
cassetes com o respectivo número de exame e nível da
biópsia (de 1 a 6); colocar os fragmentos filiformes o mais
esticados possível nas devidas cassetes, sob esponjas
embebidas em álcool a 70°; posteriormente deve medir
Comentários e/ou sugestões: [email protected] Pág. 6 de 19
Newsletter TDT
cada fragmento e apontar as suas medidas na requisição e
na lateral da cassete; e por fim deve proceder ao registo da
colheita de fragmentos no computador, onde também fica
gravado o número de fragmentos e cassetes de cada caso
(Fig. 9).
Fig. 9 - Manuseamento e preparação das biópsias prostáticas por agulha para o
processamento histológico: Confirmação do produto com a requisição do doente;
Identificação; Acondicionamento nas respectivas cassetes e registo das suas
24
dimensões.
b)
No caso dos RTU-P - o TAP deve também confirmar se o
número do exame e o nome do doente correspondem ao
tubo, antes de começar a manusear os fragmentos. Depois
de confirmado, o TAP identifica as cassetes e realiza a
pesagem dos fragmentos, apontando o seu peso total na
requisição; posteriormente começa a colocá-los nas
cassetes. Normalmente, todo o material é seguido, no
entanto, em casos em que o material enviado seja muito
abundante (peso superior a 10 g), perfazem-se quatro
cassetes e segue-se mais 1 cassete por cada 10 g de peso,
por ex: RTU-P com 23 g, seguem 6 cassetes e o restante
material fica para reserva, podendo ser analisado
posteriormente, caso haja alguma suspeita por parte do
Patologista.
A8) Cuidados a ter no caso de peças cirúrgicas simples e
complexas da próstata
As peças cirúrgicas que chegam ao serviço de Anatomia Patológica,
sejam elas simples ou complexas, ficam a fixar em formol até ao dia
seguinte, para serem sujeitas a um exame macroscópico por parte
do Patologista ou do Técnico assistente do Patologista, que é o TAP
com formação em Macroscopia de Peças Cirúrgicas, que está
também autorizado a dar entradas no lugar do Patologista.
No momento do Exame Macroscópico é necessário ter em atenção
alguns cuidados, que são comuns a todas as biópsias e peças
cirúrgicas, nomeadamente confirmar o nome do doente e o número
do exame; leitura do diagnóstico clínico para uma melhor
interpretação da peça; elaboração da sua descrição macroscópica
de forma sistemática e com uma linguagem científica e bastante
completa, de forma a que qualquer Patologista que a leia consiga
reproduzir a imagem da peça em causa; e por fim proceder ao
protocolo de colheita da peça de forma objectiva, reunindo
fragmentos que sejam representativos da globalidade da peça e
todas as suas diferentes áreas. No relatório de resposta do
Patologista ao médico assistente do doente, constará tanto a
descrição macroscópica como a microscópica, dada através da
posterior histologia.
nº21, Janeiro de 2015
Peça operatória de prostatectomia simples/adenomectomia
prostática por HBP
Procedimentos na Sala de Entradas (Laboratório 1):
- Identificação da peça recebida, registo do peso, dimensões
(comprimento x largura x profundidade) e descrição das
características da superfície externa e de secção, após o corte
(forma, cor, aspecto) (Figs. 10 e 11) e consistência da peça.
Fig. 10 - Aspecto macroscópico da superfície externa de uma peça de prostatectomia
simples por HBP.38
Fig. 11 - Aspecto macroscópico da superfície de secção de uma peça de prostatectomia
simples por HBP.64
- Depois de realizada a descrição macroscópica, seccionar a peça
em fatias seriadas e observar toda a sua superfície de secção,
seleccionando as diferentes áreas a colher, e que sejam mais
relevantes para confirmação do diagnóstico. Como no caso das
prostatectomias simples por HBP, a superfície de secção é
normalmente muito homogénea, deve colher-se em média 3/4
fragmentos representativos da amostra, tendo em conta também o
peso da peça e a sua homogeneidade/heterogeneidade. Caso o
Patologista suspeite histologicamente de algo, como por exemplo
um foco de adenocarcinoma (apesar de raro nestas amostras por
HBP), pode voltar-se a ver a peça e colher novos fragmentos.
Peça operatória de prostatectomia radical
Procedimentos na Sala de Entradas (Laboratório 1):
- No caso das prostatectomias radicais, como o órgão é enviado na
sua totalidade, é muito importante realizar a orientação da peça
(caso seja possível), tendo em atenção os seguintes aspectos
anatómicos: a face posterior da próstata é plana (Fig. 12) e a face
anterior ligeiramente convexa (Fig. 13); os canais deferentes e as
vesículas seminais têm inserção na sua face posterior (Fig. 14); a
base, na face superior junto ao colo vesical é mais plana (Fig. 14) e o
ápex na face inferior, onde se reconhece também o orifício da
uretra prostática, tem forma convexa, conferindo-lhe um aspecto
de cone (Figs. 12 e 13). Para ajudar a orientar a peça, pode colocarse um estilete através da uretra prostática desde o ápex até à base
(Fig. 14);
Comentários e/ou sugestões: [email protected] Pág. 7 de 19
Newsletter TDT
nº21, Janeiro de 2015
- Realizar a pintura da peça com tinta-da-china, de modo a que o
Patologista consiga avaliar microscopicamente as margens do
tumor e, verificar se o mesmo está confinado à próstata ou invade a
sua cápsula, o que significa que poderá existir tumor nos tecidos
periprostáticos e órgãos anatomicamente relacionados (ex: bexiga);
- Seccionar a peça em fatias seriadas (Fig. 16) e segui-la na
totalidade de acordo com o protocolo do serviço.
Fig. 12 - Vista posterior da peça operatória de prostatectomia radical: face posterior
55
mais plana e o ápex (inferiormente) com forma convexa.
Fig. 16 - Secções paralelas e seriadas da peça de prostatectomia radical dispostas por
ordem do ápex para a base.57
Fig. 13 - Vista anterior da peça operatória de prostatectomia radical, com aspecto mais
convexo.55
É de salientar que existem vários protocolos de colheita de
prostatectomias radicais na literatura da Anatomia Patológica, no
entanto, numa tentativa de uniformizar os procedimentos, todos os
Patologistas seguem o mesmo protocolo de colheita, o qual está
ilustrado no esquema seguinte:
Fig. 14 - Vista superior da peça operatória de prostatectomia radical, onde se observa a
base mais plana, o colo vesical, com o orifício da uretra prostática (com estilete) e a
inserção posterior das vesículas seminais. 55
- Proceder à gravação da sua descrição macroscópica, na qual se
identifica a peça operatória em causa e se descreve o peso total, as
dimensões da próstata (eixos súpero-inferior, latero-lateral e
ântero-posterior) e das vesículas seminais, o aspecto da superfície
externa e de secção (Fig. 15) (se macroscopicamente se identifica
tumor, descrever a sua localização, dimensões, cor, definição dos
limites, consistência e distância à margem cirúrgica) e a consistência
geral da peça;
Fig. 17 - Esquema com exemplo de protocolo de colheita de fragmentos na
prostatectomia radical.55
Tomando em consideração este esquema, as cassetes são
numeradas sempre da mesma forma: as 4 primeiras correspondem
ao ápex; da cassete 5 à 32 (no caso ilustrado) correspondem aos
diferentes fragmentos da próstata na sequência - anterior (direita e
esquerda) e posterior (direita e esquerda) e as últimas cassetes ao
shaving do colo vesical e fragmentos das vesículas seminais direita e
esquerda.
Peça operatória de cistoprostatectomia radical
Procedimentos na Sala de Entradas (Laboratório 1):
Fig. 15 - Superfície de secção de uma prostatectomia radical, na qual se observa um
tumor periférico adjacente à margem cirúrgica, assinalado com setas negras. 46
- Orientar a peça em questão, tendo sempre presentes alguns
aspectos anatómicos relevantes, que ajudam na sua orientação: o
revestimento peritoneal na face posterior da bexiga é mais longo
que na face anterior e as vesículas seminais estão presentes na face
posterior (Fig. 18);
Comentários e/ou sugestões: [email protected] Pág. 8 de 19
Newsletter TDT
nº21, Janeiro de 2015
- Depois de orientada a peça, é necessário pintá-la com tinta-dachina e abrir a bexiga pela face anterior em y (longitudinalmente e
depois em direcção aos ureteres) (Figs. 18 e 19), esticá-la numa
cortiça e submergir a peça em formol durante 24 a 48h, para
fixação e posterior exame macroscópico;
É de salientar que as peças de cistoprostatectomias radicais
poderão ser acompanhadas de celulectomias pélvicas, que
consistem em fragmentos de tecido adiposo, dos quais se podem
isolar gânglios linfáticos que poderão estar comprometidos e, como
tal, apresentarem metástases.
Do exame macroscópico ao exame microscópico
Fig. 18 - Orientação da cistoprostatectomia, pintura e abertura.
100
Após a colheita de fragmentos, segue-se todo o processamento
histológico normal até à obtenção das lâminas, que depois de
sujeitas a um controlo de qualidade por parte do TAP, são
entregues ao respectivo patologista. O patologista observa cada
lâmina ao microscópico e elabora a descrição microscópica, que
juntamente com a descrição macroscópica da peça constituirá o
relatório final, que será encaminhado para o médico assistente. No
caso das biópsias prostáticas e RTU-P, em que se observe
microscopicamente tumor, o Patologista inclui no relatório
microscópico o score de Gleason. No caso das peças operatórias de
prostatectomias radicais e cistoprostatectomias radicas, é descrito
o score de Gleason e definido o estadiamento do tumor através da
classificação TNM.
“Da Macroscopia à Microscopia, que se observará depois ao
microscópio?”
Fig. 19 - Macroscopia de uma peça de cistoprostatectomia já aberta e a fresco. 51
- Depois de fixada a peça, procede-se à sua descrição macroscópica,
na qual se dá a denominação da peça, se regista as dimensões de
todos os seus componentes: bexiga, ureteres, próstata, vesículas
seminais, eventual tecido adiposo aderente, bem como de gânglios
linfáticos que se isolem da peça; descrição das superfícies externas
(Fig. 20) e de secção de cada um dos órgãos envolvidos e
características do tumor: localização, dimensões, cor, consistência,
definição dos contornos e estruturas invadidas.
Dando continuidade ao exame macroscópico que é extremamente
importante e fornece por vezes informação que permite transpor
logo para o diagnóstico, pode apresentar-se de seguida um
esquema muito sucinto sobre a estrutura da próstata e algumas
fotos ilustrativas da sua histologia, visto ser interessante observar
as peças a olho nu, procedendo à sua descrição macroscópica e
posteriormente comprovar histologicamente, através da
microscopia, esses mesmos achados macroscópicos.
Fig. 21 - Esquema ilustrativo da histologia da próstata e fotografia de corte histológico
da próstata corado com Hematoxilina-Eosina. 35
Fig. 20 - Macroscopia de uma peça de cistoprostatectomia radical ainda fechada e a
fresco, onde se pode visualizar a próstata (P), a bexiga (B) e gânglios linfáticos (L). 56
- Depois de seccionada a peça, procede-se a uma boa amostragem
de fragmentos, representativos de toda a peça em causa, para a
avaliação microscópica e posterior diagnóstico. Assim sendo, na
colheita de fragmentos destas peças, seguem-se múltiplos
fragmentos do tumor da próstata, tendo em conta as diferentes
áreas/aspectos do tumor, a transição para o parênquima normal e a
relação do tumor com órgãos/estruturas adjacentes invadidas
(bexiga, vesículas seminais, gordura adjacente); fragmentos das
vesículas seminais; fragmentos de várias áreas da bexiga (face
anterior, posterior e paredes laterais direita e esquerda, por
exemplo) e cotos ureterais, e de eventuais gânglios linfáticos.
Tecido prostático normal
Fig. 22 - Fotografia de corte histológico de próstata corado com Hematoxilina-Eosina,
mostrando o tecido prostático normal. 54
Comentários e/ou sugestões: [email protected] Pág. 9 de 19
Newsletter TDT
Hiperplasia Benigna da Próstata
nº21, Janeiro de 2015
de células basais, em pequenos focos de glândulas atípicas,
ajudando a estabelecer um diagnóstico de benignidade ou
malignidade, ou seja, distinguindo adenocarcinoma invasivo de
lesões benignas, que mantêm a camada basal. Estas células são
caracteristicamente marcadas por uma citoqueratina de elevado
peso molecular, como a Citoqueratina 34βE12 (usada de forma
preferencial no nosso serviço), mas também por marcadores como
o CD10 e o p63.
Mais recentemente, surgiu um marcador positivo para carcinoma
da próstata, a α-methylacyl CoA racemase (AMACR), descrita como
tendo uma sensibilidade de 82 a 100%, em casos de
adenocarcinoma da próstata.
Fig. 23 - Fotografia de corte histológico corado com Hematoxilina-Eosina, ilustrando os
nódulos (N) característicos da HBP, que se observam macroscopicamente numa peça
58
de prostatectomia simples.
Adenocarcinoma da próstata
A Citoqueratina 34βE12 é um marcador membranar, enquanto a
AMACR se caracteriza por uma marcação citoplasmática granular,
podendo ser utilizados de forma independente ou em simultâneo,
de acordo com o caso e o pedido efectuado pelo patologista.
Com o objectivo de melhor visualizar e diferenciar as áreas malignas
das benignas, implementou-se desde o início de 2013, a técnica da
dupla marcação. Esta técnica permite efectuar a imunomarcação de
ambos os marcadores, Ck 34βE12 e AMACR no mesmo corte
histológico, como exemplificam as figuras 26 e 27.
Fig. 24 - Fotografia de corte histológico de uma biópsia prostática obtida por agulha,
corado com Hematoxilina-Eosina, revelando o padrão histológico típico de carcinoma
da próstata.37
Fig. 26 - Biópsia da Próstata, Amp. 100x Vermelho – Marcação da CK 34βE12, Células
benignas; Castanho – Marcação da AMCR, Células Tumorais. 24
Fig. 25 - Fotografia de corte histológico corado com Hematoxilina-Eosina, ilustrando o
adenocarcinoma da próstata (T), que se pode visualizar macroscopicamente numa peça
de prostatectomia radical.58
Finalizando esta apresentação temática, pode ainda dizer-se que
poderá ser requerida por parte do Patologista, a realização de
outras técnicas complementares, como colorações especiais a nível
de Histoquímica e principalmente a nível de Imunocitoquímica, para
ajudar no diagnóstico final.
A9) A Imunohistoquímica no Cancro da Próstata
Os esforços de detecção precoce do carcinoma da próstata,
identificados em fases clínicas e patológicas iniciais levaram ao
aumento do número de biópsias, que se caracterizam pelo seu
tamanho bastante reduzido e, por vezes, por uma área tumoral
escassa. Na realidade, a conclusão de adenocarcinoma pode tornarse difícil devido à presença de carcinomas mínimos ou alterações
pseudoneoplásicas, como proliferação atípica de pequenos ácinos.
Fig. 27 - Biópsia da Próstata, Amp. 400x Vermelho – Marcação da CK 34βE12, Células
benignas; Castanho – Marcação da AMCR, Células Tumorais. 24
É ainda de referir a importância do marcador específico de próstata
– PSA – útil no diagnóstico de metástases do carcinoma da próstata.
Nestes casos, o uso da técnica de Imunohistoquímica, tornou-se
essencial para evidenciar a presença ou ausência de uma camada
Comentários e/ou sugestões: [email protected] Pág. 10 de 19
Newsletter TDT
nº21, Janeiro de 2015
B) Análises Clínicas e Saúde Pública
B1) Determinação do Antigénio Específico da Próstata
(PSA)
O Antigénio Específico da Próstata (Prostate Specific Antigen – PSA),
identificado e caracterizado em 1979, é uma enzima (serina
protease do grupo das calicreínas), com um peso molecular de
33,000 Da, sintetizada pela próstata e segregada no líquido seminal,
71,78
onde tem uma função fluidificante.
A maior parte do PSA circula no sangue complexada com proteínas
inibidoras das proteases, a α1-antiquimotripsina (ACT) e a α2macroglobulina, e uma pequena fracção de PSA mantém-se no
estado livre, PSA livre.
A percentagem de PSA livre varia de acordo com a doença
prostática, sendo mais baixa em doentes com cancro da próstata,
comparativamente a indivíduos saudáveis ou com doença
71
prostática benigna.
Sendo o PSA produzido quase exclusivamente pelas células
epiteliais da próstata, é um bom marcador da próstata, mas não
específico para cancro.
Níveis elevados de PSA podem estar presentes na Hipertrofia
Benigna da Próstata (HBP), Prostatite e outras condições nãomalignas.
Aqui entra a determinação do PSA livre, onde o rácio PSA livre/total
tem sido usado na prática clínica para diferenciar a HBP do cancro
da próstata, sendo usado para estratificar o risco de cancro da
próstata, em homens com níveis de PSA total entre 4 ng/mL e 10
22
ng/mL.
A concentração de PSA não deve, portanto, ser interpretada como
evidência absoluta da presença ou ausência de doença maligna.
Ainda assim, quando associado a outros exames e história clínica,
ajuda a definir grupos de risco para o cancro da próstata, sendo um
dos pilares no seu acompanhamento.
Como exemplo, no seguimento dos doentes tratados com
prostatectomia radical, radioterapia, hormonoterapia ou por
braquiterapia, se o tratamento obtém sucesso, o PSA total baixa,
por vezes, em duas a três semanas. Se a curva da diminuição pouco
desce depois da terapêutica, suspeita-se da persistência de resíduos
22,82
tumorais.
A velocidade (vPSA) e o tempo de duplicação (TDPSA), também são
consideradas variáveis interessantes.
A primeira é definida como um aumento absoluto do doseamento
do PSA (ng/mL/ano), com um valor universalmente definido de
<0,75 ng/mL/ano. Relativamente à segunda, o tempo de duplicação
do PSA, mede o aumento exponencial do doseamento do PSA no
tempo.
De acordo com alguns estudos, estas variáveis têm um valor
prognóstico em utentes já tratados de carcinoma da próstata, mas
não acrescentam informação, quando comparados com o PSA total.
Tem sido proposto também medir a “densidade” do PSA,
relacionando o valor de PSA com o volume medido na ecografia,
sendo 0,15 o valor limiar definido para esta relação. Esta medida de
volume está sujeita a aproximações ecográficas.7
2000 xpi, que tem como método um imunoensaio de fase sólida, do
tipo sandwich, quimioluminescente, em que é usada uma fase
13
sólida (esfera), que é revestida com anticorpo anti-PSA.
A amostra do paciente e um reagente que contém outro anticorpo
anti-PSA conjugado com uma enzima, a fosfatase alcalina, são
incubados com a esfera revestida. O PSA na amostra do doente,
liga-se ao anticorpo anti-PSA conjugado com a fosfatase alcalina, e
o anticorpo anti-PSA da esfera, de modo a formar um complexo de
sandwich entre anticorpos. A enzima conjugada que não se liga é
removida por lavagem.
Finalmente, é adicionado um substrato quimioluminescente, e o
sinal originado é proporcional à enzima ligada. Existe, portanto,
uma relação directa entre a concentração de PSA na amostra e o
sinal detectado pelo sistema analítico.
A sensibilidade analítica desta técnica é de 0,04 ng/mL
13
(concentração mínima detectável).
O soro é o tipo de amostra recomendado. Para tal, é necessária a
colheita de uma amostra de sangue através de punção venosa, para
um tubo seco (sem anticoagulante), não sendo necessário o doente
70
estar em jejum.
Deve-se deixar a amostra coagular, sendo que a mesma é depois
centrifugada em laboratório, procedimento esse que vai permitir a
separação do sangue nos seus diversos componentes,
nomeadamente o soro, a partir do qual é então feito o doseamento
de PSA.
Deverá ter-se em consideração a altura para a colheita da amostra,
uma vez que certas técnicas invasivas como a biópsia da próstata, a
ecografia transrectal, a resseção transuretral da próstata e a
prostatectomia radical, elevam o PSA, o qual normaliza ao fim de 2
a 3 semanas. Prostatite e retenção urinária aguda podem também
22
elevar o PSA sérico.
Quanto ao exame rectal digital (DRE), não há concordância sobre a
relevância clínica do seu efeito nos valores de PSA, e alguns autores
sugerem, por isso, proceder à colheita da amostra de sangue antes
12,66
da realização deste exame.
Como referido pela European Association of Urology, nas Guidelines
no Cancro da Próstata, o uso do PSA como marcador sérico veio
revolucionar o diagnóstico do Cancro da Próstata, e inclui-se nas
linhas de orientação para o diagnóstico e estadiamento do cancro
da próstata, escolha do tratamento e avaliação da progressão da
22
doença.
Em Portugal, a Direcção-Geral da Saúde é um serviço central do
Ministério da Saúde, que se assume como um organismo de
referência para todos os cidadãos que pensam e actuam no campo
da saúde.
Incluído na DGS, existe o Departamento da Qualidade na Saúde
(DQS), que tem como missão promover e disseminar, nas
instituições prestadoras de cuidados de saúde, uma cultura de
102
melhoria contínua da qualidade.
Foi actualizada a 1 de Agosto de 2014, a Norma n.º 060/2011 de
29/12/2011 da DGS, com o título “Prescrição e Determinação do
Antigénio Específico da Próstata – PSA”, realizada pelo DQS e pelo
Conselho para Auditoria e Qualidade da Ordem dos Médicos.
,16,71
No serviço de Patologia Clínica do Hospital de Santa Maria, o
doseamento in vitro de PSA é realizado no autoanalizador Immulite
Esta norma, dirigida a médicos do Sistema de Saúde, define um
algoritmo clínico (Fig. 28) que pode ser seguido pelo médico
assistente na sua anamnese ao utente em risco.
Comentários e/ou sugestões: [email protected] Pág. 11 de 19
Newsletter TDT
nº21, Janeiro de 2015
No HSM-CHLN, o exame é realizado num equipamento de alto
campo magnético (3T), com estudo paramétrico que engloba um
estudo por difusão e perfusão da próstata. As sequências utilizadas
são sequências FSE (FAST – SPIN- ECO) de alta resolução,
ponderadas em T2 e nos 3 planos: axial, coronal e sagital, desde o
fundo das vesículas seminais até ao ápex prostático.
No HSM, a RM é realizada preferencialmente antes da biópsia, mas
se tal não for possível, a RM só deverá ser realizada passadas 4 a 6
semanas, para que o sangue seja reabsorvido e não influencie assim
o estudo da perfusão.
A perfusão é realizada como procedimento de avaliação habitual da
próstata e inclui as sequências base (T1, T2 e T2 SPAIR).
É realizada uma sequência 3D dinâmica, ponderada em T1, antes e
após a injecção intravenosa de gadolínio. Inicialmente, obtém-se
uma série sem contraste ("máscara"), seguida de repetidas séries
pós-contraste de alta resolução temporal (< 20 segundos por série),
durante cerca de 5 a 10 minutos, que visa avaliar o comportamento
hemodinâmico de todo o tecido prostático.
Fig. 28 - Algoritmo Clínico de acordo com a Direcção-Geral de Saúde.78
No Laboratório de Química Clínica do Serviço de Patologia Clínica
do Centro Hospitalar Lisboa Norte, foram doseados entre Janeiro e
Agosto do ano corrente de 2014, uma média de 1255 pedidos de
PSA total por mês, tendo sido os serviços mais requisitantes os de
Consulta Externa de Urologia, Radioterapia, Oncologia Médica e
Nefrologia.
C) Radiologia
C1) A Imagiologia no estadiamento do Cancro da
Próstata
A sequência de difusão é muito importante, pois as neoplasias
costumam apresentar restrição à difusão das moléculas de água. As
sequências são realizadas com altos b values (500, 1000, 1500 e
2000) e são tidas também em conta as imagens do mapa de
coeficiente de difusão aparente para a detecção tumoral.
Os planos são realizados com uma espessura de 3 mm de modo a se
conseguir um bom estudo de toda a próstata.
O carcinoma prostático apresenta a sua localização frequente na
zona periférica da próstata (65% a 74% dos casos), apresentando-se
geralmente como nódulo ou lesão mal definida, com hiposinal em
T2, que contrasta com o hipersinal da zona anatómica normal, tal
como mostra a figura 29.
Uma vez confirmada a existência de doença através da biópsia, de
acordo com o valor de PSA e o tipo de tumor detectado, são
efectuados exames imagiológicos como a Cintigrafia Óssea, a
Tomografia Computorizada (TC) e a Ressonância Magnética (RM),
com o objectivo de estadiar a doença, determinando assim a sua
extensão.
A Cintigrafia Óssea consiste na injecção de uma pequena
quantidade de substância radioactiva num vaso sanguíneo que se
vai fixar nos ossos. É feito um scanning, que vai detectar e mostrar
as imagens ósseas que apresentam ou não tumor.
Na TC é possível avaliar a extensão da lesão tumoral da próstata,
bem como determinar a presença de metástases e envolvimento
101
ganglionar, através da injecção de meio de contraste iodado. São
obtidas imagens, desde o fígado até à sínfise púbica, de modo a ser
possível detectar lesões secundárias no fígado e vasos ganglionares.
No entanto, este método de estudo é pouco preciso e tem cada vez
mais dado lugar à RM.
Na RM é utilizada uma bobine endorectal, uma vez que como a
próstata é um órgão interno, uma bobine endocavitária vai permitir
uma melhor captação do sinal e assim melhor estudo anatómico.
No entanto, no CHLN, estas bobines não existem e portanto é
utilizada apenas uma bobine de volume.
O procedimento é explicado ao paciente e é administrado
butilescopolamina ao paciente, de modo a minimizar os artefactos
provocados pelo peristaltismo intestinal.
Fig. 29 - Imagem ponderada em T2, mostrando área nodular hipointensa na zona
periférica prostática no terço médio à direita (seta). 14
Na RM existem alguns critérios que, observados, ajudam no
estadiamento da lesão:
Extensão extracapsular, que se caracteriza, quando o
tumor passa para além da cápsula cirúrgica (limite entre a
zona periférica e a glândula central) e no qual se observa
a existência de tecido sólido na gordura prostática, bem
como, abaulamento irregular da cápsula prostática e
obliteração do ângulo prostático.
Invasão das vesículas seminais, que pode ocorrer por
extensão directa do tumor localizado na base da próstata,
através do ducto ejaculatório, ou ainda por disseminação
hematogénica. Observa-se, neste caso, hipointensidade
em T2 e perda do padrão ductal caraterístico.
Comentários e/ou sugestões: [email protected] Pág. 12 de 19
Newsletter TDT
Apesar de no CHLN, não se encontrar disponível para estadiamento
prostático, a literatura descreve como técnica da RM, útil no
estadiamento de tumor da próstata, a espectroscopia. Trata-se de
uma técnica que demonstra em gráfico, os picos dos metabólitos
existentes numa lesão, fazendo assim a diferenciação das várias
lesões, que apenas por simples imagem, pode levantar dúvidas
5
quanto à caracterização das mesmas.
Os metabólitos analisados são: a colina, a creatina, o citrato e, mais
recentemente, a poliamina. A análise é realizada por meio de
gráficos de amplitude × frequência, sendo as frequências específicas
para cada metabólito. As áreas sob os picos correlacionam-se com a
concentração de cada metabólito no tecido prostático (Fig. 30).
nº21, Janeiro de 2015
Após a radioterapia, observa-se redução difusa da intensidade de
sinal nas sequências ponderadas em T2, em virtude de fibrose e
atrofia glandular. Os seguintes critérios de imagem fazem suspeitar
de recidiva tumoral:
Área nodular com acentuado hipossinal em T2;
Na espectroscopia, existência de voxels com relação
(colina + creatina)/citrato > 0,5; ou qualquer voxel com
2
colina aumentada.
Outras condições, com hipointensidade de sinal em T2 na zona
periférica, podem simular cancro da próstata, como hemorragia,
prostatite, hiperplasia prostática benigna, trauma, outros tumores
como linfoma e sarcoma, entre outras.5
A hemorragia pós-biópsia caracteriza-se por hipersinal em T1 e
intensidade de sinal variável em T2. Os focos hemorrágicos
diminuem significativamente 21 dias após o procedimento,
devendo-se utilizar este intervalo mínimo entre a biópsia e a RM.5
No entanto, a RM apresenta algumas limitações em tumores
3
pequenos (< 0,5 cm ) e em tumores de baixo grau, sendo, nestes
casos, a detecção tumoral dificultada no estudo de RM, mesmo
com a utilização da espectroscopia e da perfusão.5
Fig. 30 - A – Zona periférica normal, com alto sinal na imagem de RM ponderada em T2
e, com gráfico espectral demonstrando a colina baixa e o citrato alto; B – carcinoma da
próstata na zona periférica, com baixo sinal na imagem de RM ponderada em T2, e com
gráfico espectral demonstrando colina alta e citrato baixo. 5
Pode-se suspeitar de tumores da glândula central, pela presença de
área homogeneamente hipointensa em T2, com margens mal
definidas ou espiculadas, forma lenticular, que condiciona
indefinição da cápsula cirúrgica, invasão uretral ou do estroma
fibromuscular anterior e relação (colina + creatina)/citrato > 0,7 na
espectroscopia. Por sua vez, os nódulos de hiperplasia prostática
benigna geralmente exibem contornos bem definidos, halo
hipointenso e heterogeneidade de sinal em T2.
A RM consegue ainda demonstrar recidiva local e/ou tumor residual
pós-prostatectomia, que se apresenta como uma massa de tecidos
moles com discreto hipersinal em T2, em relação ao tecido
adjacente. A diferenciação principal a ser feita é com fibrose pósoperatória, que se apresenta com marcado hipossinal em T2.
Os principais sítios de recidiva tumoral são: retrovesical (40%),
perianastomótico (29%) e em vesículas seminais retidas (22%).5
Aproximadamente 25% dos pacientes com cancro de próstata são
tratados por radioterapia, com recidiva do PSA após cinco anos
variando entre 15% e 67%, na dependência do risco de cada
paciente.5
D) Farmácia
A abordagem farmacológica no tratamento do cancro da próstata
abrange a hormonoterapia e a quimioterapia.
D1) Hormonoterapia
O cancro da próstata é um tumor sensível à acção das hormonas,
nomeadamente da testosterona, a qual estimula o seu
desenvolvimento e crescimento. Deste modo, o objectivo primário
da hormonoterapia assenta em diminuir os níveis circulantes de
testosterona de modo a travar ou diminuir o crescimento do
101,11
tumor.
Com base no funcionamento do eixo hipotálamo-hipófise-gonadal,
responsável pela síntese de testosterona, delinearam-se diversas
formas de supressão da testosterona num contexto de cancro da
11
próstata.
Esta supressão hormonal pode ser alcançada de duas formas:
Eliminação da secreção de androgénios;
Inibição da sua acção através dos seus receptores,
utilizando fármacos conhecidos como anti-androgénios.
Estas duas formas de hormonoterapia podem, no entanto, ser
74
combinadas para conseguir um completo bloqueio androgénico.
A hormonoterapia retarda a progressão da doença e previne,
potencialmente, as suas complicações. Esta abordagem é eficaz em
doentes com idade avançada e em que o cancro se encontre num
101
estadio avançado ou metastizado.
Comentários e/ou sugestões: [email protected] Pág. 13 de 19
Newsletter TDT
nº21, Janeiro de 2015
Tabela 2 - Alternativas terapêuticas dentro da hormonoterapia.
Classes
Terapêuticas
Agonistas da
Hormona
Libertadora
da Hormona
Luteinizante
(LHRH)
Antagonistas
da LHRH
Fármacos
existentes
no HSM
Características
Triptorrelina
Goserlina
O seu efeito não é
imediato e na primeira
semana de tratamento
observa-se um aumento
de Hormona Luteinizante
(LH) e testosterona no
sangue, que leva a um
agravamento dos
sintomas da doença. Para
evitar esta situação, estes
fármacos são utilizados
em associação com anti11,74
androgénios.
Estes fármacos são
aplicados através de uma
injecção intra-muscular ou
subcutânea, uma vez por
mês ou a cada 3, 6 ou 12
meses.101
Tratamento do
carcinoma avançado
ou metastizado da
11,74
próstata.
Imediata e reversível
diminuição da hormona
LH e testosterona.11
Administrado por via
subcutânea uma vez por
mês.
Tratamento do
carcinoma avançado
ou metastizado da
próstata, em doentes
sintomáticos.11,74
Degarrelix
Esteróides:
Ciproterona
Antiandrogénios
Inibidores da
Síntese dos
Androgénios
Não
Esteróides:
Nilutamida
Flutamida
Bicalutamida
Abiraterona
Utilização
D2) Quimioterapia
A quimioterapia é usada quando o cancro da próstata se torna
refractário à hormonoterapia. Isto é, quando deixa de ser sensível
11,101
aos tratamentos hormonais.
O objectivo da quimioterapia é destruir, através de fármacos, as
células que originam o cancro, quando este se encontra
11
metastizado.
Actualmente, apenas doentes com carcinoma da próstata resistente
à castração (CPRC) com doença metastizada devem ser
considerados para quimioterapia. O tratamento com docetaxel é o
11
tratamento standard de primeira linha do CRPC metastizado.
O efeito positivo do Docetaxel sobre o CRPC foi suportado por dois
ensaios clínicos, que demonstraram que este fármaco aumenta
11,96
significativamente a sobrevivência de doentes com CRPC.
Outro fármaco citotóxico aprovado para o tratamento de doentes
sintomáticos com CRPC é a Mitoxantrona. No entanto, este está
11
apenas indicado nos casos de doentes paliativos.
Esteróides: bloqueiam a
interacção entre o
androgénio e o seu
receptor e têm efeito
progestativo, pelo que
diminuem a produção de
LH e consequente
diminuição dos níveis de
testosterona.11,74
Não Esteróides:
bloqueiam o efeito dos
androgénios gonadais e
extra-gonadais no
receptor, resultando num
aumento dos níveis de LH
e testosterona, podendo
ser preservadas a libido e
a função sexual.11
Estes fármacos são
compostos orais, em
forma de comprimidos,
que se tomam
diariamente.
Usados em
tratamentos de
combinação,
nomeadamente com
os Agonistas da LHRH
em doentes com
cancro da próstata
avançado ou
metastizado.11
Inibe selectiva e
irreversivelmente a
actividade enzimática da
CYP17A1, que é essencial
na catalização de
percursores androgénicos,
o que leva a uma
diminuição da
testosterona circulante e
uma redução dos
androgénios
intratumorais.11
Este fármaco é
administrado oralmente,
em forma de
comprimidos, numa toma
única diária.
Indicada no
tratamento de doentes
com carcinoma da
próstata resistente à
castração (CPRC)
metastizado,
assintomático ou
pouco sintomático,
para os quais não se
considere haver, ainda,
indicação para
tratamento com
quimioterapia.11
Aprovada para o
tratamento do CPRC
metastizado em que o
cancro da próstata
progrediu durante ou
após quimioterapia
baseada em
Docetaxel.11
A eficácia deste fármaco foi demonstrada num estudo onde se
verificou que a associação de Mitoxantrona e rednisolona é eficaz
na redução da dor e no aumento do tempo de controlo da
11
mesma.
A abordagem farmacológica no cancro da próstata é essencial na
melhoria da qualidade de vida e do aumento de sobrevida do
doente. O Técnico de Farmácia (TF) intervém no tratamento do
cancro da próstata na preparação e manipulação dos agentes
citotóxicos usados na quimioterapia. O TF faz parte de uma equipa
pluridisciplinar que garante que as técnicas usadas são seguras,
nomeadamente pela dupla validação dos processos e confirmação,
no final da preparação, de que o produto corresponde ao mapa de
produção validado pelo farmacêutico.
O TF intervém ainda na dispensa dos fármacos necessários para os
doentes com cancro da próstata em tratamento em regime de
internamento ou de ambulatório, neste caso em particular, ao
assegurar a reposição dos medicamentos em falta no ambulatório
dos Serviços Farmacêuticos.
E) Radioterapia
A Radioterapia é uma das opções terapêuticas utilizadas no
tratamento do cancro da próstata. Esta tem por base a utilização
controlada de radiações ionizantes com o objectivo de administrar
uma dose tumoricida de radiação num volume alvo bem definido
com o mínimo dano possível nos tecidos sãos adjacentes, de modo
a possibilitar uma terapêutica óptima com o mínimo de
morbilidade.
Existem dois tipos de radioterapia: a radioterapia externa e a
braquiterapia.
E1) Radioterapia externa
A radioterapia externa é o método de irradiação mais frequente na
radioterapia e consiste na aplicação de feixes de radiação exteriores
ao corpo.
Com o avanço da tecnologia, para além do aperfeiçoamento das
técnicas convencionais, foram surgindo novas técnicas de
Comentários e/ou sugestões: [email protected] Pág. 14 de 19
Newsletter TDT
nº21, Janeiro de 2015
administração da radiação conformadas à lesão, como é o caso da
radioterapia conformacional 3D (3D-CRT) e da radioterapia de
intensidade modulada (IMRT).
Na 3D-CRT, os feixes de radiação são conformados ao volume alvo,
permitindo desta forma um aumento da dose nesse volume e uma
diminuição da dose nos tecidos são adjacentes. O objectivo da 3DCRT prende-se com o aumento da taxa de cura (aumento do
controlo local), redução das complicações a longo prazo e redução
do volume total tratado.
A IMRT é uma técnica aperfeiçoada e mais precisa da técnica 3DCRT (figura 31), uma vez que enquanto na 3D-CRT só se aplica a
conformação geométrica dos campos, na IMRT também se modela
a intensidade da fluência no campo geometricamente conformado.
Em IMRT cada campo de tratamento é dividido em múltiplos
segmentos com diferentes intensidades, o que permite uniformizar
e optimizar a dose no volume alvo, minimizando a dose nos tecidos
sãos adjacentes, diminuindo a toxicidade ou efeitos secundários
enquanto se mantém o controlo tumoral. O tumor vai ser irradiado
exactamente na sua forma ou, muito próximo a isso.
Fig. 32 - Braquiterapia com implantes permanentes ou de baixa taxa de dose. 43
Os implantes temporários (Fig. 33) consistem na implantação de
isótopos radioactivos, num volume bem definido, por um
determinado período de tempo. O isótopo radioactivo mais
utilizado neste tipo de implantes é o Irídio 192.
Fig. 31 - Comparação entre duas distribuições de dose: à esquerda 3D-CRT e à direita
IMRT.47
E2) Braquiterapia
A braquiterapia é um método de irradiação, no qual um ou vários
elementos radioactivos são colocados próximo ou mesmo no
interior do volume que se pretende irradiar. A principal vantagem
deste método é a possibilidade de se administrar altas doses de
radiação, num volume estritamente confinado à próstata,
minimizando os danos nos tecidos adjacentes (recto e bexiga).
No caso específico da braquiterapia nos tumores da próstata,
podem ser utilizados dois procedimentos diferentes: os implantes
permanentes ou de baixa taxa de dose e os implantes temporários
ou de alta taxa de dose.
Ambos os procedimentos são realizados com o doente anestesiado
e posicionado em litotomia dorsal. É introduzida uma sonda de
ultrassonografia no recto do doente para visualizar a próstata e
guiar a introdução dos aplicadores através dos quais são inseridos
os isótopos radioactivos. É uma terapia de ambulatório com um
período de recuperação curto.
Tal como o nome indica, os implantes permanentes (Fig. 32)
consistem na implantação permanente de isótopos radioactivos ou
sementes num volume bem definido. Os isótopos radioactivos mais
utilizados neste tipo de implante são o Iodo 125 e o Palladium 103,
uma vez que estes têm uma semi-vida relativamente curta e um
nível de decaimento elevado.
Fig. 33 - Braquiterapia com implantes temporários ou de alta taxa de dose. 49
E3) Qual a modalidade de radioterapia mais eficaz?
A escolha do tratamento mais adequado baseia-se na performance
status e esperança de vida do doente, no valor do PSA, no Gleason
score, no estadio da doença, bem como nas preferências do doente,
tendo em consideração os possíveis efeitos secundários
decorrentes de cada uma das opções terapêuticas. Alguns destes
parâmetros, nomeadamente o valor do PSA, o Gleason score e o
estadio da doença, permitem estratificar os doentes em grupos de
risco, consoante as suas possibilidades de cura (Tabela 3).
Comentários e/ou sugestões: [email protected] Pág. 15 de 19
Newsletter TDT
nº21, Janeiro de 2015
Tabela 3 - Grupos de Risco.
Risco intermediário e alto risco
Baixo
Intermediário
Alto
Muito Alto
PSA
< 10 ng/ml
10 a 20 ng/ml
> 20
ng/ml
\
Gleason
score
2a6
7
8 a 10
\
Estadio
T1 – T2a
T2b – T2c
T3a
T3b – T4 ou
qualquer T-N1
A radioterapia pode ser utilizada como tratamento único, adjuvante
ou paliativo. Consoante o grupo de risco em que se insere o doente,
é possível selecionar a modalidade de radioterapia mais eficaz.
Baixo risco
Nos doentes de baixo risco, tanto a radioterapia externa (com as
suas variantes: convencional, conformacional, IMRT) como a
braquiterapia podem ser aplicadas em monoterapia.
A mais comum, a radioterapia externa, pode ser considerada uma
alternativa à prostatectomia radical, uma vez que apresenta
resultados semelhantes em termos de sobrevida e qualidade de
vida.
Os doentes que estão indicados apenas para radioterapia externa
são tratados usando inicialmente quatro campos, dois paralelos
(um a 90º e outro a 270º), um anterior (a 0º) e um posterior (a
180º) – box technique, de modo a irradiar a próstata e os gânglios.
Nesta primeira fase de tratamento a dose total administrada é de
46 Gy em 23 fracções, ou seja, o fraccionamento é de 2 Gy/fracção.
Na segunda fase de tratamento, a box technique é substituída por
seis campos de dimensões mais reduzidas (mais conformacionados
à próstata), um lateral esquerdo, um oblíquo posterior esquerdo,
um oblíquo anterior esquerdo, um lateral direito, um oblíquo
posterior direito e um oblíquo anterior direito. Nesta segunda fase
de tratamento, a dose total administrada é de 26 Gy em 13
fracções, ou seja, o fraccionamento é de 2 Gy/fracção.
Por fim, na terceira fase de tratamento, o doente pode fazer mais 2
ou 4 Gy (a 2 Gy/fracção) dependendo da dose recebida no recto e
na bexiga. Todo o tratamento é realizado com a bexiga cheia e o
recto vazio, de modo a afastar estes órgãos do campo de irradiação.
No total, a dose administrada é de 74 ou 76 Gy.
A braquiterapia da próstata, na sua variante de implantes
permanentes, encontra-se estabelecida como uma opção primária
de tratamento para o cancro da próstata, em doentes de baixo
risco. Na selecção dos doentes também se deve ter em conta os
seguintes factores: a próstata deve ter menos que 60 cc de volume
(no caso desta ser maior, pode recorrer-se à hormonoterapia antes
do implante); a anatomia do doente deve ser favorável ao implante;
aquando do diagnóstico, os doentes, não podem apresentar
sintomas urinários muito severos; e, não é aconselhável em
doentes que tenham sido submetidos a resseção transuretral da
próstata.
Na braquiterapia de implantes permanentes como monoterapia são
recomendadas as seguintes doses: com Iodo 125, 140 a 160 Gy e
com Palladium 103, 115 a 130 Gy.
Nos doentes que se inserem nos grupos de risco intermediário e
alto risco, a radioterapia externa combinada com outras opções
terapêuticas, tais como a hormonoterapia, a cirurgia ou a
braquiterapia, oferece uma melhor possibilidade de controlo local
da doença, com menor morbilidade.
Os doentes submetidos a prostatectomia radical, com indicação
para radioterapia externa, fazem na primeira fase de tratamento 46
Gy e na segunda fase 20 Gy (2 cGy/fracção).
Os doentes que estão indicados para radioterapia externa e boost
com braquiterapia, fazem inicialmente 46 Gy mais 14 Gy com
radioterapia externa (2 Gy/fracção), caso façam posteriormente
apenas uma sessão de braquiterapia. No caso de fazerem
posteriormente duas sessões de braquiterapia, apenas fazem 46 Gy
com radioterapia externa. Neste caso, a modalidade de
braquiterapia utilizada é a de implantes temporários de alta taxa de
dose. A dose do boost deve ser prescrita em função da dose de
radioterapia externa.
Muito alto risco
Nos doentes de muito alto risco a radioterapia externa pode ser
utilizada com intuito paliativo na doença metastizada.
F) Dietética
F1) Intervenção nutricional em doentes com Cancro da Próstata
submetidos a Radioterapia
O cancro da próstata apresenta risco reduzido de malnutrição,
constatando-se que a maioria dos parâmetros nutricionais dos
87,90
utentes é estável e mantém-se ao longo do tratamento.
Na
generalidade, apresentam-se com peso normal, excesso de peso ou
87
obesidade.
O estado nutricional e o tratamento de radioterapia encontram-se
interligados em termos de efeitos secundários, sendo que a
alteração da funcionalidade intestinal, causada pela radiação, pode
comprometer o trato gastrointestinal e o estado nutricional do
9
utente. Deste modo, é importante detectar e avaliar a presença de
malnutrição, uma vez que a mesma promove o aumento do risco de
toxicidade relacionado com a terapia e conduz a uma diminuição a
9,93
qualidade de vida. A avaliação do estado nutricional contempla a
avaliação dos parâmetros antropométricos, bioquímicos, clínicos e
dados dietéticos (recall das 24h, hábitos alimentares, entre
9,87,90,93
outros).
Durante as 5-7 semanas do tratamento de radioterapia pode
2,26,61,67
ocorrer toxicidade aguda gastrointestinal.
Os sintomas
agudos incluem diarreia (efeito secundário mais frequente),
i
tenesmo e movimentos intestinais mais frequentes ou urgentes,
incontinência fecal, flatulência ou distensão abdominal e
1,25,26,61,67
hemorragia rectal.
A longo prazo podem desenvolver-se
alterações do trânsito intestinal com episódios intermitentes de
diarreia, urgência ou incontinência, e dor ou hemorragia rectal,
assim como, obstipação resultante da fibrose e da alteração da
25,26,79
motilidade do cólon.
A evidência para a eficácia da restrição de fibra e/ou lactose, de
modo a diminuir as complicações gastrointestinais durante o
31,88,99
tratamento de radioterapia, é limitada e inconclusiva.
No
entanto, a intervenção nutricional com restrição de fibra insolúvel e
Comentários e/ou sugestões: [email protected] Pág. 16 de 19
Newsletter TDT
lactose pode diminuir a prevalência e a severidade da diarreia e
31,87,88,99
distensão abdominal.
A intervenção nutricional consiste na modificação da ingestão de
fibra alimentar e lactose, através da restrição de alimentos ricos em
fibra insolúvel e lactose, e na substituição de alimentos de elevado
teor de fibra solúvel e clinicamente isentos de lactose durante o
1,31,87,88,99
período de tratamento.
No serviço de Radioterapia do CHLN-HSM, a intervenção nutricional
em utentes com neoplasia da próstata é efectuada pelo dietista, de
acordo com o protocolo definido pela equipa multidisciplinar.
Segundo este, está preconizado que o utente seja avaliado
individualmente em consulta em três momentos - 1ª consulta (que
antecede a realização da TC de planeamento), follow-up (após 5 a 6
semanas), e após tratamento de radioterapia.
G) Fisioterapia
G1) Intervenção da Fisioterapia do CHLN – HSM em utentes
submetidos a prostatectomia radical
Segundo Kubagawa et al. (2006), a prostatectomia radical (PR) é o
mais antigo e possivelmente o mais eficaz método de tratamento
do cancro da próstata. No entanto, este tipo de cirurgia apresenta
algumas complicações, entre as quais a incontinência urinária (IU) e
10,32,77
a disfunção eréctil.
Mungovan et al. (2013) referem que 59 a 63% dos utentes
apresentam leve a severa IU, nas primeiras seis semanas após a
cirurgia. A causa que leva à IU após PR é, segundo Pannek et al.
(2005), a deficiência esfincteriana ou anormalidades do músculo
detrusor, e pode estar relacionada com problemas pré-existentes:
idade avançada, peso, volume da próstata, recessão transuretral da
próstata, radioterapia, trauma, lesão espinal medula, obstrução
10
urinária, doença de Parkinson, demência, medicação.
A frequência da incontinência urinária varia dependendo do tipo de
60
cirurgia e da técnica cirúrgica. Segundo Mottet et al. (2014), 89 a
100% dos utentes intervencionados por laparoscopia e 80 a 97%
dos utentes submetidos a cirurgia retropúbica apresentam
incontinência urinária. O utente deve ser esclarecido e preparado
para a possibilidade de ocorrência destas complicações e deve
compreender, aquando da proposta da intervenção, que pelo
menos temporariamente a incontinência pode alterar a sua
10,72,77
qualidade de vida.
Segundo Ferreira et al. (2006), a incontinência é uma complicação
que causa um profundo impacto negativo na qualidade de vida do
indivíduo, gerando dificuldades psicológicas como ansiedade,
insónia e depressão, além de complicações como infecção
recorrente do trato urinário, dermatites e constrangimento,
afectando desta forma a auto-estima do homem. Hirschhorn et al.
(2014) referem que no follow-up, um ano após a cirurgia, os
utentes recuperam 70 a 100% da continência. Contudo, alguns
permanecem com incontinência urinária após este tempo.
Segundo Kakihara et al. (2007), o tratamento recomendado para
incontinência urinária após PR é a fisioterapia, método não invasivo
34
e de baixo custo. Em 1948, Kegel foi o primeiro a preconizar
exercícios para a musculatura do pavimento pélvico, com o
objectivo de aumentar o controlo esfincteriano, promovendo o
controlo urinário. A realização destes exercícios tem como objectivo
a consciencialização da existência e da função dos músculos do
pavimento pélvico.
nº21, Janeiro de 2015
Kakihara et al. (2007) e Kubagawa et al. (2006) referem ainda que a
fisioterapia no pré e pós-operatório, logo após a remoção da sonda
vesical, mostrou-se mais eficaz do que apenas a fisioterapia
realizada semanas após a cirurgia, ao reduzir o tempo para a
obtenção da continência, auferindo melhores resultados nos
primeiros quatro meses do pós-operatório. Mungovan et al. (2013)
acrescentam ainda que, realizar exercícios do pavimento pélvico
antes da cirurgia reduzem a severidade e a duração da
incontinência pós cirurgia à próstata.
A fisioterapia, através de exercícios para fortalecimento do
pavimento pélvico, pode diminuir o tempo de recuperação
esfincteriana, abreviando o período de incontinência e também
auxiliando na resposta de tratamentos futuros que sejam
19
necessários efectuar.
Kakihara et al. (2007) salientam que o tratamento recomendado
para incontinência urinária após PR é a fisioterapia incluindo o
treino dos músculos do pavimento pélvico; o uso do “biofeedback”;
a electroestimulação funcional utilizando um eléctrodo endo-anal;
estimulação eléctrica transcutânea ou uma combinação desses
métodos. O tratamento conservador deve ser combinado com
alterações e modificações do estilo de vida, como por exemplo, a
diminuição do consumo de cafeína e do tabaco, a prática de
exercício físico, manter o peso dentro dos padrões normais e o
treino da bexiga, aumentando gradualmente o intervalo entre as
60,69
micções.
Kubagawa et al. (2006) referem que foi possível verificar a eficácia
da fisioterapia quanto aos sintomas urinários, como: a diminuição
da perda urinária devido ao aumento da força de contracção da
musculatura pélvica, aumento do intervalo entre as micções,
diminuição da frequência urinária, diminuição do grau de
incontinência e maior satisfação dos utentes quanto à sua
qualidade de vida.
Os utentes submetidos a PR são referenciados para a fisioterapia
pré e pós-operatória com o objectivo de realizar o treino da
75
musculatura do pavimento pélvico. Desta forma, o fortalecimento
dos músculos do pavimento pélvico é uma das medidas mais
recomendadas para acelerar a recuperação da continência,
conseguindo-se o encerramento da uretra, com a realização de um
conjunto de exercícios que treinam os músculos auxiliares. Mas,
antes de iniciar este tipo de conduta terapêutica, é necessário
verificar se o utente é capaz de executar a contracção da
91
musculatura perineal. Estes exercícios são ensinados ao utente e
72
podem ser amplificados com sistemas de estimulação eléctrica.
Os exercícios de interrupção da urina não devem ser recomendados
como prática contínua por promoverem o aumento da pressão de
encerramento uretral durante a micção, momento em que a uretra
deve permanecer aberta e os seus mecanismos de encerramento
devem estar relaxados. Quando efectuada, esta prática promoveria
a alteração da fisiologia da micção durante a fase de esvaziamento
20,65
vesical.
Os homens que são ensinados a realizar exercícios de
fortalecimento da musculatura do pavimento pélvico apresentam
69
uma recuperação mais rápida da continência.
Em 2009, no CHLN-HSM, iniciou-se o projecto de intervenção em
utentes com disfunções do pavimento pélvico, entre os quais,
utentes submetidos a PR. O tratamento conservador tem uma
duração de cerca de 5 meses, numa fase inicial com uma
periodicidade de 2 vezes por semana e no final com uma sessão
semanal. Este é composto por sessões individuais, que permitem ao
fisioterapeuta avaliar o utente, ajudando-o a compreender onde se
localiza a musculatura do pavimento pélvico, como é realizada a sua
Comentários e/ou sugestões: [email protected] Pág. 17 de 19
Newsletter TDT
contracção e o ensino de comportamentos preventivos das
disfunções. Após a conclusão das sessões individuais, os utentes são
convidados a realizar sessões de grupo, onde para além dos
exercícios de fortalecimento da musculatura do pavimento pélvico,
fazem exercícios de mobilidade e fortalecimento globais, assim
como o reforço dos comportamentos preventivos das disfunções da
musculatura do pavimento pélvico. Actualmente, os utentes
admitidos na consulta de medicina física e reabilitação do CHLNHSM, são provenientes da consulta externa de urologia, bem como,
da consulta de medicina geral e familiar, a partir dos centros de
saúde que têm como hospital de referência o CHLN-HSM.
Na semana de 15 a 21 de Setembro de 2014, assinalou-se a semana
europeia de prevenção de doenças da próstata, que teve como
objectivo alertar os homens, acima dos 45 anos, para esta
problemática, insistindo que a vigilância médica periódica é
essencial para despistar o cancro da próstata, uma vez que este não
apresenta sintomas numa fase inicial.
Referências bibliográficas
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
American Cancer Society. Cancer facts and figures 2009. Atlanta, Ga.:
American
Cancer
Society;
2009.
http://www.cancer.org/acs/groups/content/@nho/documents/document
/500809webpdf.pdf . Accessed February 2, 2010.
Andreyev J. Gastrointestinal complications of pelvic radiotherapy: are they
of any importance? Gut. 2005;54(8):1051-4.
Ash, D; Dobbs, J. Pratical Radiotherapy Planning. 3ª edição. Oxford
University Press Inc. 1999.
Associação Portuguesa de Urologia (APU); (2014); Semana Europeia de
Prevenção
de
Doenças
da
Próstata;
disponível
em:
http://www.apurologia.pt/index.htm.
Baroni, Hueb Ronaldo; NOVIS, Maria Inês; Ressonância Magnética da
próstata: uma visão geral para o Radiologista; artigo de revisão; radiologia
brasileira; volume 42, nº 3; São Paulo; Maio / Junho de 2009.
Barrett, Ann [et al]. Pratical Radiotherapy Planning. 4th ed. Hodder Arnold.
2009. ISBN: 978 034 0927731.
Benson MC(1), Whang IS, Pantuck A, Ring K, Kaplan SA, Olsson CA, Cooner
WH. Prostate specific antigen density: a means of distinguishing benign
prostatic hypertrophy and prostate cancer. J Urol. 1992 Mar; 147(3 Pt
2):815-6.
Bentel, Gunilla C. Radiation Therapy Planning. 2.ª edição. McGraw Hill.
1996.
Bentzen SM. Preventing or reducing late side effects of radiation therapy:
radiobiology meets molecular pathology. Nature reviews Cancer.
2006;6(9):702-13.
Borgermann, C. Kaufmann, A., Sperling, H., Stohrer, M. and Rubben, H.
(2010) The treatment of Stress Incontinence in Men, Deustsches Arzteblatt
International, vol. 107, pp. 484-491.
Botelho, Francisco. Pina, Francisco. Recomendações Clínicas no
Tratamento do Carcinoma da Próstata. Grupo Português Génito-Urinário.
2013.
Breul J, Binder K, Block T, Hartung R. Effect of digital rectal examination on
serum concentration of prostate-specific antigen. Eur Urol. 1992; 21(3):
195-9.
Bula Informativa de PSA para Immulite 2000 Systems. SIEMENS
13.08.2008.
Caldas, Manoel Eduardo; MIRANDA, Luíz Carlos Duarte; A Ressonância
Magnética no estadiamento locoregional do cancro da próstata:
resultados comparados com a análise histopatológica pós-cirúrgica;
Revista do Colégio brasileiro de Cirurgiões; vol. 37; nº6; Novembro/
Dezembro de 2010.
Cancro da Próstata – Tudo o que precisa de saber. Sociedade Portuguesa
de Oncologia e Associação Portuguesa de Urologia. 2007.
Caquet R. Guia Prático de Análises Clínicas. Climepsi. 1ª Ed. 2004 Lisboa.
Cevik I, Türkeri LN, Ozveri H, Ilker Y, Akdaş A. Short-term effect of digital
rectal examination on serum prostate-specific antigen levels. A
prospective study. Eur Urol. 1996; 29(4): 403-6.
Chybowski FM, Bergstralh EJ, Oesterling JE. The effect of digital rectal
examination on the serum prostate specific antigen concentration: results
of a randomized study. J Urol. 1992 Jul; 148(1): 83-6.
Damião, R. e Carrerette, F. (2010) Revista do Hospital Universitário Pedro
Ernesto (UER), vol. 9, Supl. 2010.
Dubbelman, Y. et al.; (2012); Urodynamic quantification of decrease in
sphincter function after radical prostatectomy: relation to prostoperative
continence status and the effect of intensive pelvic floor muscle exercises.
Neuroulogy and Urodynamics, vol, 31, p. 646-651.
Esteves, Sérgio Carlos Barros [et al]. Braquiterapia de alta taxa de dose no
tratamento do carcinoma da próstata: análise da toxicidade aguda e do
comportamento bioquímico. RadiolBras. 2006; 39(2): 127-130.
nº21, Janeiro de 2015
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
European Association of Urology (2014). European Association of Urology
Guidelines. European Association of Urology (EAU) Web Site. Acedido a
26/09 2014, em http://www.uroweb.org/guidelines/online-guidelines/.
Evans, Mererid; Mason, Malcolm D. Urological Cancers in Clinical Practice.
Radical Radiotherapy for Prostate Cancer. Waxman, J. (Ed.) 2007. ISBN:
978-1-84628-464-9.
Fotografia gentilmente cedida pelo Serviço de Anatomia Patológica do
CHLN – HSM.
Franklin J.; Berkey, D. O. Managing the Adverse Effects of Radiation
Therapy. Am Fam Physician. 2010 Aug 15;82(4):381-388.
Ghadjar P, Vock J, Vetterli D, Manser P, Bigler R, Tille J, Madlung A,
Behrensmeier F. Acute and late toxicity in prostate cancer patients treated
by dose escalated intensity modulated radiation therapy and organ
tracking Radiation Oncology 2008, 3:35.
Ghadjar P, Vock J, Vetterli D, Manser P, Bigler R, Tille J, Madlung A,
Behrensmeier F. Acute and late toxicity in prostate cancer patients treated
by dose escalated intensity modulated radiation therapy and organ
tracking Radiation Oncology 2008, 3:35
Griffiths, Sue; Short, Chris. Radiotherapy: Principles to Practice. Churchill
Livingstone. 1994.
Hansen, Eric K.; Roach III, Mack. Handbook of Evidence-Based Radiation
Oncology. 2nd ed. Springer. 2010. ISBN: 978-0-387-92988-0.
Heidenreich, A [et al]. Guidelines on Prostate Cancer. European
Association of Urology. 2013.
Henson CC, Burden S, Davidson SE, et al. Nutritional interventions for
reducing gastrointestinal toxicity in adults undergoing radical pelvic
radiotherapy. Cochrane Database Syst Rev. 2013;11:CD009896.
Hirschhom, A., Kolt, G., Brooks, A.; (2013); Barriers and enablers to the
provision and receipt of preoperative pelvic floor muscle training for men
having radical prostatectomy: a qualitative study. BMC Health Services
Research, 13:305.
Hirschhorn, A., Kolt, G., Brooks, A.; (2014); A multicomponent theorybased intervention improves uptake of pelvic floor muscle training before
radical prostatectomy: a “before and after” cohort study; BJU Int; 113:
383-392.
Honório, M., Santos, S.; (2009); Incontinência urinária e envelhecimento:
impacto no cotidiano e na qualidade de vida. Revista Brasileira de
Enfermagem, Brasília, vol. 62 p. 51-56.
http://cabmn.blogspot.pt/2011/11/histologia-da-prostata.html.
http://cancer.osu.edu/NCI/Media/CDR0000457829_full.jpg.
http://en.wikipedia.org/wiki/Prostate_cancer.
http://library.med.utah.edu/WebPath/MALEHTML/MALE041.html.
http://lifestyle.sapo.pt/saude/noticias-saude/artigos/cancro-da-prostatatem-uma-taxa-de-cura-de-85-quando-detetadoprecocemente?r=saude.sapo.pt.
http://medicosdofuturo.blogspot.pt/p/o-cancro-da-prostata-joanamarinho.html.
http://revista.hupe.uerj.br/detalhe_artigo.asp?id=196.
http://www.alessandrorossol.com.br/?op=patologia&gerenciamentoPatol
ogiasTratamentosId=174.
http://www.appuurology.com.au/prostate-treatments/brachytherapy/.
http://www.cancerresearchuk.org/about-cancer/type/prostatecancer/treatment/the-stages-of-prostate-cancer.
http://www.clinicahm.pt/infosaude/hipertrofia-benigna-da-prostata.html.
http://www.europeanurology.com/article/S0302-2838(08)011731/fulltext/positive-surgical-margins-in-radical-prostatectomy-outliningthe-problem-and-its-long-term-consequences.
http://www.ijcto.org/index.php/IJCTO/article/view/Ekambaram/ijcto.0203
.2html.
http://www.institutodaprostata.com.
http://www.intechopen.com/books/advances-in-prostate-cancer/highdose-rate-interstitial-brachytherapy-as-monotherapy-in-one-fraction-forthe-treatment-of-favora.
http://www.mdsaude.com/2011/03/hiperplasia-prostatica-benigna.html.
http://www.medscape.com/viewarticle/442387_9.
http://www.prostataembolizacao.com.br/hpb.html.
http://www.prostrcision.com/qa/evaluating-your-cancer.
http://www.proteinatlas.org/dictionary/normal/prostate+1.
http://www.rcpa.edu.au/Library/Practising-Pathology/Macroscopic-CutUp/Specimen/Genitourinary/Prostate.
http://www.scielo.br/scielo.php?pid=S167755382005000400011&script=sci_arttext.
http://www.thelancet.com/journals/lanonc/article/PIIS147020450770136
5/images?imageId=gr1&sectionType=green&hasDownloadImagesLink=tru
e.
http://www.uaz.edu.mx/histo/pathology/ed/ch_17/c17_52.html.
http://www.uro.com.br/rtu.html.
Kakihara, C. T., Sens, Y. A., Ferreira, U.; (2007); Efeito do treinamento
funcional do assoalho pélvico associado ou não à eletroestimulação na
incontinência urinária após prostatectomia radical; Rev. bras. fisioter.; v.
11, n. 6, p. 481-486.
Khalid U, McGough C, Hackett C, et al. A modified inflammatory bowel
disease questionnaire and the Vaizey Incontinence questionnaire are more
sensitive measures of acute gastrointestinal toxicity during pelvic
radiotherapy than RTOG grading. Int J Radiat Oncol Biol Phys.
2006;64(5):1432-41.
Khan, Faiz M; Potish, Roger A. Treatment Planning in Radiation Oncology.
Williams &Wilkins, USA. 1987.
Comentários e/ou sugestões: [email protected] Pág. 18 de 19
Newsletter TDT
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
93.
94.
Kubagawa, L. M., et al; (2006); A eficácia do tratamento fisioterapêutico da
incontinência urinária masculina após prostatectomia; Revista Brasileira de
Cancerologia; 52(2): 179-183.
Kumar et al.: Robbins & Cotran, Pathologic Basis of Disease, 8ª edição,
Saunders, 2009.
Lanza, E., Contujoch, M., Miranda, E.; (2009); Fisioterapia y manejo
paliativo em La incontinência urinaria en el cáncer de próstata: principio y
fin de um camino. Archivos Españoles de Urologia, Barcelona, Espanha,
vol. 62, p. 889-895.
Lechevallier E, Eghazarian C, Ortega JC, Roux F, Coulange C. Effect of digital
rectal examination on serum complexed and free prostate-specific antigen
and percentage of free prostate-specific antigen. Urology. 1999 Nov;
54(5): 857-61.
Lesperance RN, Kjorstadt R J, Halligan JBm, Steele SR. Colorectal
complications of external beam radiation versus brachytherapy for
prostate cancer Am J Surg. 2008 May;195(5):616-20; discussion 620. doi:
10.1016/j.amjsurg.2007.12.037. Epub 2008 Apr 2.
Lester, Susan C., Manual of Surgical Pathology, 3rd ed, Saunders, 2010.
Lucas, M. G. et al.; (2014); Guidelines on Urinary Incontinence in:
European
Association
of
Urology
Guidelines;
disponívelem
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.p
df.
Manual de Colheitas do Serviço de Patologia Clínica do Centro Hospitalar
Lisboa Norte, 5ª Edição, Setembro 2014, Lisboa.
Molina R., Fillla X., Augé JM, Escudero JM. Clinical value of tumor markers,
current status and future prospects III. Hospital Clínico de Barcelona. 2011
Roche.
Monteiro, P. G.; (2010); Incontinência Urinária Masculina; disponível em:
http://www.apurologia.pt/index.html.
Monteiro, Pedro Gomes. Terapêutica e Seguimento do Carcinoma da
Próstata. Acta Urológica. 2006. 23; 3: 89-92.
Mottet, N. et al.; (2014); Guidelines on Prostate Cancer in: European
Association
of
Urology
Guidelines;
disponível
em
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.p
df.
Mungovan e al.; (2013); Relationships between perioperative physical
activity and urinary incontinence after radical prostatectomy: an
observational study. BMC Urology, 13: 67.
Netter, Frank H., Atlas de Anatomia Humana, 2ª edição, Porto Alegre:
Artmed, 2000.
Nilssen, S. R. et al., (2012), Does physiotherapist-guided pelvic floor muscle
training increase the quality of life in patients after radical prostatectomy?
A randomized clinical study. Scandinavian Journal of Urology and
Nephrology, 46: 397-404.
Norma n.º 060/2011 de 29/12/2011, actualizada a 01/08/2014 da DGS.
Departamento da Qualidade na Saúde da Direcção-Geral da Saúde e
Conselho para Auditoria e Qualidade da Ordem dos Médicos.
Ohri N, Dicker AP, Showalter TN. Late toxicity rates following definitive
radiotherapy for prostate cancer. Can J Urol. 2012 Aug;19(4):6373-80.
Review.
Oliveira, Angelo [et al]. Radioterapia no Cancro da Próstata. Acta
Urológica. 2005. 22; 1: 17-25.
Oliveira, R. Estudo dos Antigénios HLA no Cancro da Próstata.
Universidade do Porto – Instituto de Ciências Biomédicas de Abel Salazar.
Dezembro de 2001.
Pádua, MM. Marcadores Tumorais. Patologia Clínica para Técnicos - Tomo
II – Química Clínica (303-304). Lusociência. 2009 Loures.
Pannek, J. &Konig, J. E.; (2005); Clinical Usefulness of Pelvic Floor
Reeducation for Men Undergoing Radical Prostatectomy, Urologia
Internationalis, vol.74, pp 38-43.
Patanjali, Nitya; Williams, Scott. Advances in radiation therapy for prostate
cancer. Cancer Forum. 2010. Volume 34 Number 1.
Perez, Carlos A [et al]. Radioterapia externa definitiva nos estádios T1 e T2
de carcinoma de próstata. Colégio Brasileiro de Radiologia. 1513-1535.
Perez, Carlos A; Brady. Principles and Practice of Radiation Oncology.
Lippincott – Raven Publishers. 1997.
Pettersson, A. 2014. Diet and Gastrointestinal Symptoms in Patients with
Prostate Cancer Treated with Radiotherapy. Digital Comprehensive
Summaries of Uppsala Dissertations from the Faculty of Medicine 969. 93
pp. Uppsala: Acta Universitatis Upsaliensis. ISBN 978-91-554-8861-1.
Pettersson, A., Johansson, B., Persson, C., Berglund, A., Turesson, I.(2012)
Effects of a dietary intervention on acute gastrointestinal side effects and
other aspects of health-related quality of life: A randomized controlled
trial in prostate cancer patients undergoing radiotherapy. Radiotherapy
and Oncology, 103(3):333-40.
Potters, Louis [et al]. Braquiterapia permanente para câncer de próstata.
Colégio Brasileiro de Radiologia. 1447-1462.
Pressoir M, Desne S, Berchery D et al. Prevalence, risk factors and clinical
implications of malnutrition in French Comprehensive Cancer Centres. Br
Cancer. 2010;102:966-971.
Rodrigues, M. H.; (2010) Fisioterapia no tratamento da incontinência
urinária de esforço pós-prostatectomia radical: revisão de literatura;
Urologia Contemporânea; vol. 19, n. 4, p. 20-30.
Rosai, Juan e Ackerman, Lauren Vedder, Rosai and Ackerman's Surgical
Pathology, 9th edition, Mosby Elsevier, Edinburgh, 2004.
Santarpia L, Contaldo F, Pasanisi F. Nutrition screening and early treatment
of malnutrition in cancer patients. J Cachexia Sarcopenia Muscle.
2011;2(27):35.
Stevens, Alan, Lowe, James e Scott, Ian, Core Pathology, 3rd edition, 2009.
nº21, Janeiro de 2015
95.
Tate, Seeley Stephens, Anatomia & Fisiologia, 3ª edição, Lusodidacta,
2001.
96. TAXOTERE. Resumo das Características do Medicamento.
97. Varregoso, João. Braquiterapia Próstatica. Acta Urológica. 2006; 23; 3: 2130.
98. Wang MC, Valenzuela LA, Murphy GP, e Chu TM. Purification of a human
prostate-specific antigen. Invest. Urol. 1979; 17:159.
99. Wedlake LJ, Shaw C, Whelan K, et al. Systematic review: the efficacy of
nutritional interventions to counteract acute gastrointestinal toxicity
during therapeutic pelvic radiotherapy. Aliment Pharmacol Ther.
2013;37(11):1046-56.
100. Westra, William H. et. al, Surgical PAthology Dissection: An illustrated
guide, second edition, Springer, 2003.
101. www.apurologia.pt; cancro da próstata – tudo o que precisa de saber;
Associação portuguesa de Urologia.
102. www.dgs.pt.
i
contractura espasmódica dolorosa do esfíncter anal ou vesical, acompanhada por
impressão de queimadura, por sensação penosa de tensão e necessidade imperiosa e
permanente de evacuar ou urinar.
Comentários e/ou sugestões: [email protected] Pág. 19 de 19