Mestrado integrado em Engenharia do Ambiente
Licenciatura Bolonha em Engenharia de Materiais
1º Teste de Química Orgânica
27/04/2013
Resolução
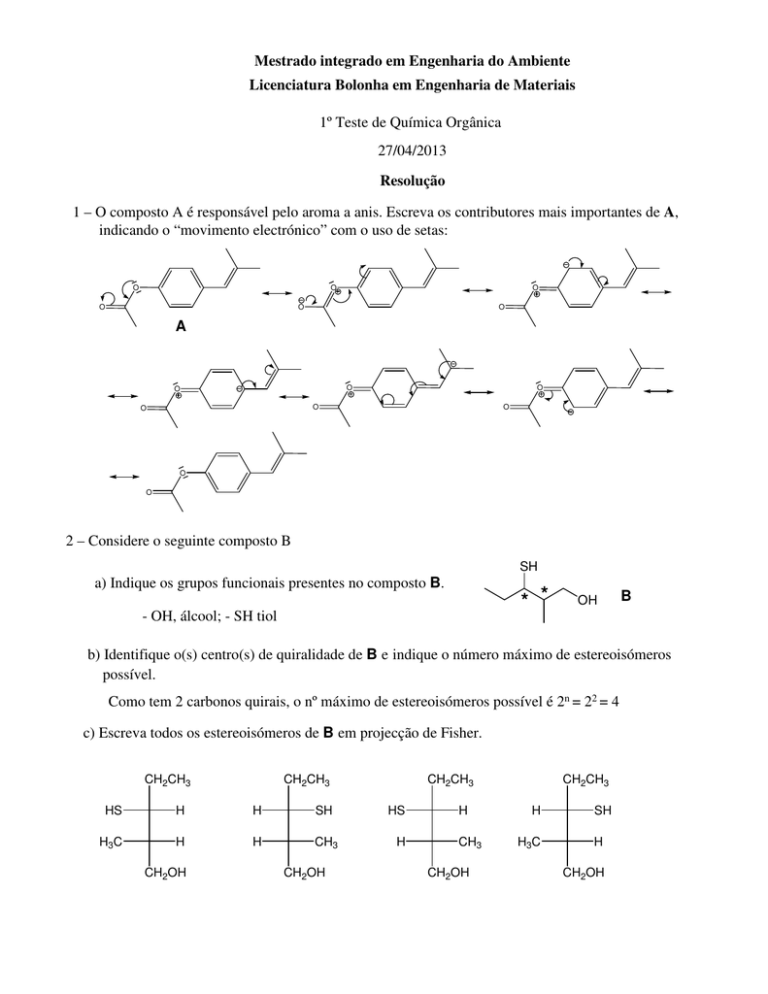
1 – O composto A é responsável pelo aroma a anis. Escreva os contributores mais importantes de A,
indicando o “movimento electrónico” com o uso de setas:
O
O
O
O
O
O
A
O
O
O
O
O
O
O
O
2 – Considere o seguinte composto B
SH
a) Indique os grupos funcionais presentes no composto B.
* *
- OH, álcool; - SH tiol
OH
B
b) Identifique o(s) centro(s) de quiralidade de B e indique o número máximo de estereoisómeros
possível.
Como tem 2 carbonos quirais, o nº máximo de estereoisómeros possível é 2n = 22 = 4
c) Escreva todos os estereoisómeros de B em projecção de Fisher.
CH2CH3
CH2CH3
HS
H
H
SH
H3C
H
H
CH3
CH2OH
CH2OH
CH2CH3
HS
H
H
CH3
CH2OH
CH2CH3
H
H3C
SH
H
CH2OH
d) Atribua uma designação R/S a cada um dos centros de quiralidade de todos os estereoisómeros.
S
1
HS
R
R
H3C
3
S
CH CH
3 2 3
A
H
2
1B
H
CA
2
S
C
1
H
C
1
H
3
C
3
C
C
4
CB
4
H
C
S
H
H
C H
C
2
H
H
H
C
H
O H
2
CH2OH
CH2CH3
R
HS
S
H3C
CH2CH3
H
H
S
H
H
R
CH2OH
CH2CH3
SH
CH3
CH2OH
HS
R
H
R
CH2CH3
H
H
CH3
H3C
CH2OH
S
SH
S
H
CH2OH
e) Indique as relações de estereoisomeria entre os diferentes estereoisómeros. Justifique.
(R,R) e (S,S)
⇒ Porque são a imagem no espelho um do outro.
⇒ Não são sobreponíveis.
⇒ Os carbonos quirais têm configuração absoluta oposta.
(R,S) e (S,R)
São enanteómeros porque:
(R,S) = (S,R) e (R,R)
⇒ Porque não é a imagem no espelho um do outro.
⇒ Não são sobreponíveis.
⇒ Os carbonos quirais têm configuração absoluta diferente.
(R,S) = (S,R) e (S,S)
São diastereómeros porque:
f) Passe da projecção de Fisher de um dos estereoisómeros à sua escolha, para uma estrutura em
cavalete alternada e a correspondente projeção de Newman, mostrando como procedeu.
CH2CH3
HS
H3C
HS
H
HS
H
CH3
H
H
CH2OH
Projeção de Fisher
CH2CH3
H 3C
H
CH2CH3
HS
CH3
HOH2C
CH2OH
Cavalete eclipsada
HOH2C
H
Cavalete alternada
ou estrela
H
CH2CH3
Projeção de Newman
alternada ou estrela
3 – a) Qual dos seguintes compostos, C ou D é mais ácido. Justifique, mostrando as bases
conjugadas e a possível existência de híbridos de ressonância.
Um ácido será tanto mais forte, quanto mais estável for a sua base conjugada:
H
H
H
H
H
C
C
H
H
C
D
B
NC
B
NO2
CH2
NC
Base
conjugada
de C
CH2
NO2
Base
conjugada
de D
CH2
CH2
NC
NO2
CH2
CH2
NC
NO2
CH2
CH2
C
NO2
Carbono sp3
N
CH2
C
NO2
CH2
N
CH2
Carga negativa deslocalizada
por 5C
O
NC
N
O
CH2
O
NC
N
O
Carga negativa deslocalizada
por 1O + 1N + 5C
⇒
⇒
CH2
⇒
NC
NO2
⇒
Base conjugada de C
⇒
Base conjugada de D
C é o ácido mais forte.
⇒
A base conjugada de D é menos estável que a de C porque:
A carga negativa só é deslocalizada por 5C.
Não há estabilização por ressonância com o grupo tertbutilo (carbono sp3).
Tem efeito indutivo dador por parte do grupo tert-butilo.
⇒
D é o ácido mais fraco.
⇒
⇒
⇒
CH2
A base conjugada de C é a mais estável porque:
Tem a carga negativa deslocalizada por 1 átomo de
O, 1 átomo de N (mais eletronegativos que C) e 5C
Tem mais estruturas de ressonância devido ao grupo
CN e NO2 poderem receber eletrões por ressonância.
Tem efeito indutivo atrator dos grupos CN e NO2
devido à eletronegatividade dos átomos de O e N.
b) Qual o átomo mais básico do composto E. Justifique.
H
H
β
αN
H
N
N
N
O
N
H
O
N
H
O
H
E
H
H
N
N
N
N
O
⇒
⇒
⇒
⇒
⇒
⇒
H
O
H
Existem 2 átomos de N e 1 de O que têm pares de eletrões não partilhados que podem captar
protões, atuando como base. O oxigénio por ser mais eletronegativo é menos básico que os
azotos.
O par de eletrões de N α está muito deslocalizado por ressonância quer pelo átomo de O do
grupo carbonilo (C=O) quer pelo anel aromático.
N α é muito pouco básico.
O par de eletrões do átomo de N β não está estabilizado por ressonância devido aos
carbonos sp3 aos quais se encontra ligado.
Há ainda efeito indutivo dador de eletrões por parte do grupos alquilo.
N β é o atomo mais básico.
4 - Preveja os produtos das seguintes reacções indicando o nome da reacção, mecanismo e a
estereoquímica quando aplicável:
2
H3CH2C
a)
SPh
H
H3C
3
NaSPh
OTs
1
1
PhS
⇒
H
CH3
3
Na
O
O
S
H3C
O
R
S
⇒
2
CH2CH3
Carbono α é secundário, PhS- é um excelente nucleófilo e TsO- é um excelente
grupo de saída. Há inversão da configuração do átomo de carbono.
Reação SN2.
b)
H2SO4
H2O
HO
O
H O S OH
O
H H H HSO4
H H
HSO4
⇒
⇒
⇒
⇒
O carbono α é terciário.
Não existe nucleófilo.
HO- não é um GS, utiliza-se o ácido sulfúrico para protonar o OH e transformá-lo num
melhor GS (H2O)
É uma E1.
5 - Considere a seguinte reação:
H3 C
O
S O
O
H3 C
CH3OH
CH3
a) Diga o nome da reação e mostre o mecanismo, o(s) produto(s) e a estereoquímica quando
aplicável.
⇒
⇒
⇒
⇒
⇒
O carbono α é terciário.
O metanol (CH3OH) é um nucleófilo fraco.
CH3SO3- é um excelente GS.
É uma SN1/E1.
O carbono não é quiral (não há formação de mistura racémica)
O
H3C
CH3OH
CH3OH
O
S
H
O
CH3
OCH3
OCH3
CH3OH
CH3
CH3
CH3
CH3
H3C
H3C
H3C
b) De que modo alteraria a velocidade da reação se o eletrófilo fosse
Justifique.
Cl
A velocidade de uma SN1 é tanto maior quanto melhor for o GS, já que o carbocatião
seria idêntico.
Se o grupo de saída fosse Cl-, a velocidade da reação diminuiria, porque Cl- é um pior
GS que CH3SO2O- . Este GS é muito estabilizado por ressonância.
⇒
⇒
O
O
O
S
H3C
O
O
O
S
S
O
H3 C
O
O
H3C
6 - Considere a seguinte reação:
CH3
ONa
F
H3CH2C
CH2CH3
Br
a) Desenhe as duas conformações em cadeira para o composto F e diga qual é a mais estável. Justifique.
CH2CH3
Equatorial
CH3
Br
H
H
Axial
CH2CH3
H
Axial
Equatorial
CH3
H3CH2C
Equatorial
Axial
H
CH2CH3
Br
Axial
Mais estável
Equatorial
A 2ª conformação em cadeira é a mais estável porque tem os 2 grupos mais volumosos nas
posições equatoriais onde há menos repulsões.
⇒
b) Diga o nome da reação e mostre o mecanismo, o(s) produto(s) e a estereoquímica quando aplicável.
O
O
H
CH2CH3
CH3
H
H
H3CH2C
H
CHCH3
H
CH3
Br
O carbono α é terciário.
(CH3)3O- é uma base muito forte.
Br- é um bom GS.
É uma E2.
O protão que é captado pela base e o grupo de saída têm que
estar antiperiplanares.
⇒
⇒
⇒
⇒
⇒
H
H
CH3
c) Indique se a velocidade da reação será rápida ou lenta. Justifique.
⇒
A velocidade da reação é rápida, pois a conformação mais estável é aquela em que o Br
está numa posição axial (ficando antiperiplanar), essencial para que se dê a E2.
7 - Qual dos seguintes compostos G ou H tem maior ponto de ebulição? Justifique.
G
⇒
OH
HO
OH
H
Os grupos OH permitem estabelecer ligações por pontes de hidrogénio intermoleculares,
aumentando o ponto de ebulição. Como H tem 2 grupos OH, forma mais ligações de
hidrogénio e por isso irá ter maior ponto de ebulição.












