,
I
-
,
-
--
--
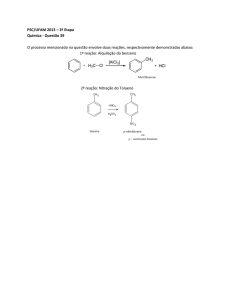
REAÇOES DE SUBSTITUIÇAO
Desde a invenção da pólvora, o ser humano busca outras substâncias químicas explosivas mais eficientes - tanto no
poder de explosão como em outras propriedades, como estabilidade, custo, facilidade de manuseio ete. Com o avanço dos
cenhecimentos científicos, outras substâncias foram sintetizadas, grande parte delas por reações de substituição.
Uma substância que pode ser destacada é o 2,4,6-trinitrotolueno (TNT), sintetizado pela primeira vez em 1863, um explosivo de alta performance, uma vez que sua velocidade de deslocamento é de aproximadamente 6.940 m/s.
Propriedades importantes tornam esse explosivo crucial no mundo militar: estabilidade química relativamente alta,
insensibilidade moderada ao impacto e ao atrito e ponto de fusão baixo (80,8 °C) Além disso, o TNT é obtido de matérias-primas facilmente disponíveis e baratas. Seu poder destruidor pode ser potencializado com a mistura de outros
explosivos.
Para a produção do trinitrotolueno são feitas três substituições de hidrogênio por grupos nitro, nas posições 2, 4 e 6, '
em relação ao grupo substituinte metil. Qual átomo (ou grupo de átomos) teria de ser substituído para a produção
da trinitroglicerina a partir do glicerol (propano-1 ,2,3-triol)?
Professor, aqui se pode trabalhar a habilidade 17 da matriz de referência do Enem, que consiste em "relacionar informações apresentadas em diferentes formas de linguagem e representação usadas nas ciências físicas, químicas ou biológicas, como texto discursivo, gráficos, tabelas, relações
matemáticas ou linguagem simbólica".
Da mesma forma que na produção do TNT foram substituídos três hidrogênios, na produção do TNG também serão substituídos três hidrogênios.
...--,\
!\ençfo
• Reações de substituição envolvendo alcanos
iIQuebra(ou cisão) homolítica-e
Os alcanos são hidrocarbonetos de baixa reatividade, porque as ligações H - (e ((
são relativamente fortes, portanto difíceis de serem quebradas. Tamanha é essa dificuldade
que essa classe de hidrocarbonetos é conhecida também como parafina (proveniente do latim
afjinis - pouco reativo).
A forma encontrada para que esses compostos sofram reações é a substituição de átomos
de hidrogênio por outros grupos funcionais. A substituição é possível porque a diferença de
eletronegatividade entre os átomos de (e H é muito pequena (as eletronegatividades do (e
do H são, respectivamente, :2,5 e 2,1).
Para entender como ocorre esse tipo de reação, deve-se lembrar que ligações químicas
covalentes são feitas por partes) de elétrons. Assim, ligações químicas podem ser quebradas
de duas formas: homolítica ou heteroliticamente.
Em quebra homolítica, cada fragmento mantém um elétron da ligação quebrada, formando radicais. A quebra heterolítica é aquela na qual uma espécie consegue reter o par de
elétrons compartilhado, fazendo com que um átomo perca elétron e se transforme em cátion
e a outra substância que ficou com o par eletrônico se transforme em um ânion; logo, nesse
caso, haverá formação de íons. O
Fórmula
estrutural
=
H-C/
Fórmula
eletrônica
=
H
--'.>
:ci:
.. ~
H+C/
Fórmula
estrutural
.ci:
..
Fórmula
eletrônica
H· +
~
=H
-
=
H
C/
:ci:
..
H" + C/-
-)o
+[:ci:]..
w
-)o
~
Cisão homolítica,
formação de radicais
Cisão heterolítica,
formação de íons
Essesconceitos são importantes para entendermos reações de substituição de alcanos, pois
promover uma quebra de ligação em um alcano não é algo fácil de se fazer, considerando-se
a quantidade de energia para se quebrar uma ligação química. A solução, quando se deseja
quebrar uma dessas ligações, é promover uma reação em cadeia que leva - por diversos
passos - ao produto de substituição desejado.
Corno exemplo, vamos examinar a reação de substituição de um átomo de hidrogênio do
metano por um átomo de cloro, dando origem ao clorometano.
C/-C/
H
I
H-(-H
~
h
••
••
••
••
:C/. + .C/:
(luz):
H
••
+ .C/:~ H-('+H-C/
I
o
H
H
""~
H
H
c,
...-
I
I
~ H-C-C/
I
H
H
H
I
I
I
I
I
I
I
I
H
H~ H-(-(-
H
+ .C/: ~C/-C/
H
I
••
I
I
••
I
H-C'+ .C/: ~ H-C-C/
H
H
H
I
H-C-H+C/-C/
I
H
H
..
H
+ .C/:
I
H
..
e :C/.
..
:;,o
H-C' +C/-C/
H
H-('+'(-
I
I
Iniciação
H
H
~
H-
I
C-
I
H
C/ + H -
C/ ~
Reação global
H
H
homólise
Quebra (ou cisão) heterolítica =>
=> heterólise
=>
--rnefinição
~ Radical: espécie química
que tem elétrons desernparelhados, ou seja, que estão
isolados e prontos para efe·
tuar ligação cova lente.
-mbservação
iJ A fotólise, que é uma reação
na qual a quebra de ligação
ocorre na presença de luz
(À, ou hu), é um dos aspectos
mais importantes da química
com radicais e está envolvida
em processos biológicos relacionados a radicais livres,
como o câncer de pele, provocado por luz ultravioleta.
-flenção
a Os
halogênios
~2 e 12 podem ou não fazer reações de
substituição com alcanos por
motivos diferentes. O F2 é
muito reativo (forte oxidante)
e sua reação com alcanos
provoca decomposição
do
composto orgânico; já o 12 é
pouco reativo. Assim, essas
duas substâncias
só farão
reações de substituição em
alcanos sob condições muito
específicas.
Observe que a reação em cadeia tem sua iniciação com a quebra homolítica da ligação
C/- C/,formando dois radicais cloro. Um desses radicais pode promover a quebra homolítica de uma ligação C- H do metano, resultando no radical metila, que reage com o gás
cloro, formando o produto desejado - o clorometano - e mais radicais cloro. Essasreações
refletem a propagação da cadeia. Quando dois radicais se encontram, ocorre a terminação
.da reação, com formação de novos produtos.
.
Não é necessário memorizar todos os passos desse tipo de reação. O ponto fundamental é lembrar que os halogênios (principalmente C/Z e Brz) podem substituir um dos
hidrogênios de um alcano. Nessa reação de monocloração do metano, houve somente a
formação do clorometano.
Se o alcano fosse um pouco maior, como o propano, teríamos dois carbonos com possibilidade de substituição.
n
(secundariO
t
~J
(primilrioseSaOigUaiS1!!
.
Nesse caso, quando há mais de uma possibilidade de substituição, verifica-se experimentalmente que há uma ordem de prioridade:
Cterciário
> Csecundário > Cprimário
Ou seja, no caso da monocloração do propano, teremos dois produtos orgânicos que serão
formados em proporções diferentes.
Veja:
2H3C-
CH2 -
CH3 + 20-
IO .
0--+H3C-
H -
CH3 + H/-
1
1
+ 2H -
O
O
1
Maior rendimento
Substituição no
CH2 -1Hz
Menor rendimento
1
Substituição no
CSe(l,mdário
(primário.
Isso ocorre porque, no mecanismo da reação de substituição.carbonos
com mais átomos
de hidrogênio são mais estáveis, diminuindo a possibilidade da substituição.
Nos alcanos, também ocorrem reações de nitração (reação com ácido nítrico - HNO) e
sulfonação (reação com ácido sulfúrico - H2S04), que são de grande importância industrial.
Veja a seguir.
Mononitração do metano:
H
H-
I~
CI
H
H
H + HO -
NO
2
~
_--=LI_--7)
H,SO,
H-
I
I
CH
1
HNO,
•
Nitrometano
(nitrocomposto)
NO + HOH
2
Monossulfonação do metano:
H
H-
H
I~
CI
H + HO -
SO H
_---"'tJ._~)
H-
3
H~·
I
I
SO H + HOH
C-
3
H
!
1
Ácido metanossulfônico
(ácido sulfônico)
H,S04
!rIVIDADES
o Faça a monobromação
do etano.
H
H
H
H
I
I
I
I
H -c-c-
o (Unifoa-RJ) A obtenção
H + Br~
Br-+
Br + H ~ Br
H -C-C-
I
I
I
I
H
H
H
H
de tetracloreto
de carbono a partir de metano necessita de reação com:
a) cloreto de hidrogênio.
d) diclorometano.
b) cloro.
e) l,2-diclorometano.
c) cloreto de sódio.
H
H-
Alternativa
CI
I
C-
H + 4C1- CI-+ CI-
I
C-
I
I'
H
CI
CI + 4H -
CI
b
D (UFSC)Para efetuarmos
a) 1
b) 2
a cloração total de uma molécula de etano, deveremos utilizar quantas moléculas de cloro?
c) 3
e) 6
d) 4
Como a doracão é total, teremos:
H-
H
H
CI
I
I
I
C-
C-
I
I
H
Alternativa
H + 6C1- CI-+ CI-
H
CI
I
C-
C-
I
I
CI
CI + 6H -
CI
CI
e
o Faça a monocloração
do propano, mostrando apenas o produto formado em maior quantidade.
H C-
CH -
, I'
Carbono
secundário
CH
l
+ CI-
CI...• H C -
'I
CH -
CH
3
CI
+
HCI
D Faça a monobromação
do 2-metilpentano,
mostrando todos os produtos possíveis de serem obtidos.
Carbono
H........-'terciãrio
H C-
t
3
C-
I
CH,
CH2
i i
Br
CH + 5Br \
Carb~nos+-CHl
pnrnanos
Carbonos
Iguais
+ HlC-
I
Br --> HC-C-CH
3
-CH
I
3
2
-(H
2
+ H(-CH-(H-CH-CH.+
3
3
CHl
Carbo,no
pnrnano
I
I
CHj
Br
2
,
Produto principal
secundários
CH-
I
CH3
CH,-
CH-
I
CH3 + H2C-
Br
I
Br
CH-
CH2-
I
CH2-
CH1 + H C1
CH1
CH-
I
CHJ
CH 2
CH2
CH + 5H -
I
Br
2
Br
(fi (Fuvest-SP,adaptada)
Na primeira etapa da reação de alcanos com cloro, ocorre a troca de apenas um átomo de hidrogênio por um átomo de cloro. Considerando-se somente essa etapa, quantos hidrocarbonetos clorados podem se formar
ao reagirem 2-metilpropano e cloro? Justifique sua resposta por meio das equações químicas.
Dois.
ou
o (Mackenzie-SP) Do butano, gás utilizado
para carregar isqueiros, fazem-se as seguintes afirmações:
I. Reagecom o cloro por meio de reação de substituição.
11. É isômero de cadeia do metilpropano.
111. Apresenta, no total, 13 ligações covalentes simples.
Dessas afirmações:
a) somente I está correta .
. b) somente 11 e 111 estão corretas.
c) somente I e 11 estão corretas.
d) somente I e 111 estão corretas.
e) 1,11 e 111 estão corretas.
I. (V)
11. (V)
111. (V)
H
H
H
H
I
I
I
I
H-(-C-(-(-H
I
H
Alternativa e
I
H
I
H
I
H
11a:mm ["24] Reações químicas
são amplamente usadas:
em diferentes aplicações para a sociedade. Uma reação
de interesse comercial é a cloração de alcanos, cujos pro- :
dutos são haletos orgânicos. Em determinado processo, I
uma indústria, ao realizar a monocloração do metilbu- !
tano, irá obter:
a) um total de quatro produtos orgânicos diferentes..
bono assi -'
. I I
b ) apenas um pro d uto com car ano assimétnco (quiral).
-'
~ .
- h'd
~.
.
C) vanos compostos orgarucos e gas I rogenlo..
. _
.~
_.
d) somente produtos que nao apresentam Isomeros OptICOS.
ilb
h I
.
e) o 2 -c Ioro- 2 -rnen utano como o a eto com maior
di
.
ren irnento.
H C-
CH -
I
3
CH + C/ -
CH 2
I
C/ -;
3
CHl
C/
I
-; H C-
C-
CH + H -
CH -
I
3
2
CI
3
CH3
Produto principal
a) (F) Uma mistura de compostos diferentes.
b) (F) Dois produtos têm carbono quiral.
c) (F) O gás formado será o cloreto de hidrogênio.
d) (F)
e) (V)
Outros produtos que podem ser formados:
H C-
CH -
*CH -
CH,
C/
I
3
1
H C-*CH-CH
'I
2
m Observe a equação
3
CH3
H C-CH
3
-CH
I
C/
CH
I
I
-CH
-CH
2
I
I
2
seguinte:
propano + 2(/z
-4
produtos diclorados
Considerando que os isômeros ópticos são compostos
distintos, quantos produtos orgânicos serão formados?
a) 3
b) 4
c) 5
d) 6
e) 7
C/
CH3
Com base nesses dados, pode-se afirmar que a equação
representa:
a) uma reação de adição.
b) uma reação de eliminação.
c) uma reação de esterificação.
d) uma reação de substituição.
_ .
.
lI!) (Unicenp-Pk)
Os combustíveis apresentam grande Interesse
_.
~..
.
técruco e economlCO,relacionados especialmente pelo fato de
.
serem facilmente usados como fontes de energia. A octanad
b - I d
. ~ . gem eumcom ustíve me easuaresstênoaacompressão,
.
_
.
e o composto escolhido como padrao para a medida desse
-m diIce e- o .iso-octano, nome comercia
. I do 2,2,4-tnmetl
"1
pentano. Sobre essecomposto, analise as seguintes afirmações:
1. Pode possuir isômeros de cadeia e de posição.
2. Apresenta carbono quiral e, portanto, é uma substância opticamente ativa.
3. Existe composto com sua mesma fórmula molecular
(CSH1S)
que apresenta isomeria geométrica.
. 4. Se um dos seus átomos de hidrogênio for substituído
por um átomo de cloro, poderão ser obtidos apenas
dois compostos diferentes.
5. É um composto apoiar, insolúvel em água.
Indique a alternativa que apresenta as afirmações erradas:
~ 1-2-3
~ 2-3-4
~ 2-4-5
~ 3-4-5
c) 1- 3-4
Alternativa e
m (UFTO)Osalcanos são inertes a muitos reagentesdevido à forte
~omplementares
D (UFVjM-MG.
adaptada) A reação a seguir produz uma
mistura de isômeros.
H3CCH/H2".C -
!
HP H3CCH2CHz,,'.
Br -A-ce-"-to-na~)
C -.p "- +
Hl"'o'
H3CCH2
o"
H C'"
3
(S)-3,bromo-3-metil-hexano
(R)-3-metil-3-hexanol
H
(S)-3-metil-3-hexanol
+ HBr
+
!
H3CCHZ
ligação C- H e à pequena diferença de eletronegatividade
existente entre carbono e hidrogênio. Nô entanto, eles reagem rapidamente com (/z ou Brz (halogenação, na presença
de luz, para produzir um haleto de alquila). Sobre a reação
do 2-metilpropano com bromo (Br) é incorreto afirmar:
a) A reação ocorre em três etapas: iniciação, propagação
e terminação .
b) A halogenação de alcanos é um método ruim de
preparação de haletos de alquila porque resulta em
uma mistura de produtos.
c) A reação ocorre através da formação de radicais livres,que
são espéciesquímicas com um elétron desemparelhado.
d) O produto principal da reação é o 2-bromo-2-metilpropano.
e) A reação do 2-metilpropano com cloro é mais seletiva
que a reação com bromo.
TAREFA PROPOSTA 1-12
.Reações
de substituição envolvendo compostos aromáticos
Em meados dos anos 1960, pesquisadores da indústria farmacêutica divulgaram a notícia de que haviam sintetizado uma substância que ajudaria as pessoas a superar seus problemas, acabando com a ansiedade da vida moderna: o diazepam. O diazepam é o princípio ativo do valium', um ansiolítico - medicamento que reduz os sintomas
de ansiedade - que foi usado indiscriminadamente,
no mundo todo, até o fim dos anos 1980. Os vários casos de
dependência do diazepam fizeram com que o acesso a esse medicamento fosse controlado.
No início dos anos 1990, um novo medicamento, mais moderno, eficiente e - supostamente - seguro, foi desenvolvido para reduzir as pressões do dia a dia, a ftuoxetina, cujo nome comercial mais conhecido é Prezar".
Os dois medicamentos ~ assim como milhares de outras substâncias - apresentam em sua estrutura anéis aromáticos. Observe na ilustração abaixo que em ambas as estruturas o benzeno se encontra inalterado. Não houve adição à sua
estrutura, mas, sim, uma substituição de um ou mais hidrogênios por outros átomos ou grupos de átomos.
Nessaclasse de reações de substituição aromáticas existem cinco reações principais: sulfonação, nitração, halogenação e as
reações de Friedel-Crafts, que podem ser de alquilação ou acilação do anel benzênico, as quais serão explicadas detalhada mente.
H
ÚOó"-~'
f~C
'"
..,
~ I
f1lJoxetlt),;
Sulfonação
O benzeno reage lentamente com ácido sulfúrico em altas temperaturas,
na formação de água.
H
6
o que resulta no ácido benzenossulfônico
•
e
6~
S03H
+ H,SO.
/l
H,SO. (fumegante)
)
.-7
+H20
De maneira muito simplificada, podemos imaginar que um hidrogênio do composto aromático se associa a um grupo
OH do ácido sulfúrico, formando água, enquanto o grupo - S03H se associa ao benzeno, resultando no produto.
6
H~
+HO-SO,H
Este, entretanto, não é o mecanismo real dessa reação. Em água, em aquecimento, ocorre a formação de S03a partir do
ácido sulfúrico. Essecomposto se adiciona ao benzeno, que, para se reestabilizar, doa um próton W (hidrogênio sem o par de
elétrons) ao grupo S03' resultando em um ácido sulfônico. Dessa forma, o uso de ácido sulfúrico saturado de S03' o chamado
ácido sulfúrico fumegante (H2S04 (fumegante)), é a melhor forma de promover a sulfonação.
-mbservação
iIPor que o ácido sulfúrico é
necessário na nitração?
Nitração
A nitraçãodo benzeno é feita misturando-se ácido nítrico e benzeno na presença de ácido
sulfúrico concentrado e aquecendo-se a mistura.
O uso de ácido sulfúrico na
nitração está associado ao
mecanismo dessa reação e
não deve ser esquecido, pois
a reação depende de sua presença. O ácido nítrico não é
capaz de reagir sozinho com
um anel aromático, mas sua
reação com ácido sulfúrico
resulta no cátion nitroso, que
se adiciona ao anel aromatico. Neste ponto, note que
foi feita apenas uma adição,
e um átomo de hidrogênio
do anel ainda está ligado.
O ânion hidrogenossulfato
(que foi formado também
na reação entre o ácido nltrico e sulfúrico) captura
esse hidrogênio na forma
de próton W, ou seja, os
elétrons de sua ligação com
o anel ficam no anel, o que
regenera o ácido sulfúrico
e o catalisador e forma o
produto nitrado.
De maneira análoga à apresentada na sulfonação, podemos simplificar a reação como
uma substituição do hidrogênio do anel aromático pelo grupo N02 do ácido nítrico, O
H~
Ó
+HO-NO,
Halogenação
Na presença de uma substância inorgânica halogenada, ou seja, X é um elemento
do grupo 17 (família dos halogênios) (AIX3 ou FeX3 ou, em alguns casos, o próprio metal
ferro) como catalisador, compostos aromáticos reagem com halogênios, resultando em
produto aromático halogenado,
X
----7)
MX3
Ó~
+ HX
fi'
ó
NO
H
Ó
I
"-
#
Observe que, se mudarmos as condições nas quais uma reação química ocorre, poderá
haver formação de produtos completamente diferentes, Na presença de luz, calor e tolueno,
gás cloro resulta em t-cloro-t-fenilrnetano
e ácido clorídrico, por meio de uma reação de cadeia envolvendo quebras homolíticas de ligação, É a chamada regra do CCC(calor, claridade
e cadeia). Isso significa que, na presença de luz (claridade) e a quente (calor), a substituição
ocorrerá na cadeia (radical metil). Nesse caso, é chamada de substituição por radicais livres.
Em contra partida, na presença de cloreto de alumínio como catalisador, ausência de luz e a
frio, os principais produtos da reação são o 1-cloro-4-metilbenzeno e o 1-cloro-2-metilbenzeno,
graças à quebra heterolítica de ligações covalentes, que, em um sistema aromático, têm maior
probabilidade de ocorrer do que em carbonos saturados. É a chamada regra do NNN (noite,
neve e núcleo). Isso significa que, na ausência de luz (noite) e a frio (neve), a substituição será
no anel benzênico (núcleo benzênico); logo, pode ser denominada de substituição eletrofílica.
G
H
+ +NO,
->
~'4
NO,
HSO~
""HSO"
I
"-
#
Não se preocupe com os detalhes da reação, mas lembre-Sê da necessidade do ácido
sulfúrico nessa reação.
,
-mbservação
li Grupos alquil são grupos
substituintes constituídos por
hidrocarbonetos
de cadeia
carbônica aberta.
Grupos aril são grupos subs-
tituintes com anéis aromáti-
Alquilação e acilação de Friedel-Crafts
As reações de Friedel-Crafts podem ser divididas em dois tipos: alquilações e acilações. Quando essas reações são escritas de forma genérica, elas mostram que ambas
têm O mesmo princípio e diferem apenas no tipo de grupo a ser substituído por um
hidrogênio no anel aromático. O
cos (benzênicos).
H
Grupos acil são grupos con-
R
Ó~
tendo uma carbonila.
+X-R
~
)
MX3
Ó~
+HX
~
R: alquil ou acil
X: C/ ou Br
MX3: é um ácido de Lewis (A/C/3' AlBr3, FeC/3, FeBr)
Dessa forma, uma alquilação de Friedel-Crafts é a substituição de um hidrogênio de
um anel aromático por uma cadeia carbônica, enquanto uma acilação é a substituição
de um hidrogênio por uma cadeia que contém uma carbonila. Para que essas reações
aconteçam, é necessário o uso de um catalisador - composto inorgânico halogenado,
normalmente derivado de alumínio ou de ferro.
Grupo alquil
Alquilação de Friedel-Crafts.
Acilação de Friedel-Crafts.
Anidridos orgânicos podem ser usados como agentes de acilação. Essas reações podem ter grande importância sintética, principalmente quando são utilizados anidridos
cíclicos. O
'-.
6
~"""''''''''
H!
1+0
~
/0
LR::-:-:-"C,\:""
R-C
,
Anidrido
/
°
.Orientação
-fluriosidade
(J O trinitrotolueno
em reações de substituição aromática
(TNT), um
importante explosivo de uso
militar, pode ser obtido pela
nitração total do tolueno.
A partir do momento em que um ponto de referência é definido por um substituinte em um anel aromático, as outras posições recebem nomes especiais: as
duas posições imediatamente ao lado, posições 2 e 6, recebem o nome de orto (o);
as seguintes, posições 3 e 5, são chamadas meta (m); e a posição oposta ao substituinte usado como referência, posição 4, recebe o nome de para (p).
Veja, a seguir, um exemplo de R sendo o grupo referência:
HO-
N02
+ HO-
N02
H,SO.
------>
HO-NO,
R/POSiÇãO
orto (o)
de referência
Tolueno
orto (o)
,",
meta (m)
;
s 4/ meta (m)
H2SO.
------>
para (P)
Quando um substituinte é adicionado ao benzeno ou a outro anel aromático,
ele define a posição de referência. A partir desse momento, suas propriedades vão
definir a posição na qual outros substituintes, por meio de reações de substituição,
serão adicionados ao anel.
Orientadores orto/para dirigentes
Orientadores meta dirigentes
(ou grupos ativadores do anel)
(ou grupos desativadores do anel)
-NH2
-N02
-OH
-NR;
-O-CH3
Aumenta a
intensidade de
desativação
do anel
O
-CN
-COOH e
O
11
-N-C-R
I
-c/<,
R e-Ar*
-S03H
H
-
O-R
-Cl,-Br,-I
-CHO
*- R -+ radical alquila
-
Ar -+ radical arila
Veja os exemplos a seguir.
Grupo orto/para dirigente
Grupo meta dirigente
t
r
26 +20-0~&,O+Q
OH
OH
orto
N02
OH
/"
para
CI
+2H-O
6+(1-0
+ 3HOH
NO,
2,4,6-trinitrotolueno
A capacidade de determinado substituinte direcionar a posição de substituição de outros
grupos é chamada dirigência e depende das características de cada grupo.
Aumenta a
intensidade
de ativação
do anel
2
02N*N0
O
CHJ
6
1
(TNT)
CONEXÕES
o
uso de substâncias químicas como arma de guerra começou na Antiguidade. Há relatos de que, já na Guerra do Peloponeso,
espartanos jogavam gases provenientes da queima de enxofre sobre os atenienses.
Foi durante a Revolução Industrial que a indústria química conseguiu tornar economicamente viável o uso de su bstâncias químicas
como arma poderosa de destruição em massa. A produção dessas substâncias pode acontecer por diferentes caminhos reacionais.
A primeira tentativa do uso de armas químicas, da forma como conhecemos hoje, foi num ataque alemão contra os russos em
janeiro de 1915. Esseataque foi efetuado com uma substância chamada brometo de xilila, um agente lacrimogênio, produzida pela
reação de substituição de um h.idrogênio da cadeia lateral do tolueno por um átomo de bromo. Esseataque foi frustrante do ponto de
vista militar, por sua baixa eficácia, por causa do frio intenso e da baixa volatilidade do brometo de xiii Ia. O gás sofreu condensação,
transformando-se em líquido e perdendo seu efeito lacrimogênio.
A reação para a obtenção desse gás pode ser equacionada por:
CH3
CH2Br
Ó+B',~ O+HB'
Outra substância amplamente usada como gás de guerra foi o gás mostarda ou iperita, um líquido oleoso com ponto de fusão
e ebulição, respectivamente, de 13 O( e 215°C. É um agente vesicante, ou seja, que causa bolhas (vesículas) na pele, eritema, além
de afetar a visão, iniciando-se com um leve edema das pálpebras, prurido intenso e evoluindo para conjuntivite e posterior cegueira.
Uma das formas de obtenção desse gás é pela reação:
./'--.../s~
HO
OH + 2H -
C/
----->
C/
~S~
C/ + 2H -
OH
Soldadosbritânicos temporariamente cegospelo gásmostarda, perto de Béthune, França,durante a Batalhade Estaires,em 10 de abril de 1918.
Essesforam os gases mais usados durante a Primeira Guerra Mundial, mas centenas de outras substâncias foram desenvolvidas
com o intuito de serem usadas como arma de guerra. Estima-se que durante a Primeira Guerra foram usadas 100 mil toneladas
de gases, o que provocou a morte de 100 mil pessoas e fez aproximadamente 1,3 milhão de vítimas.
Defina o tipo de reação orgânica que ocorre na produção do brometo de xilila e do gás mostarda. Escreva também as funções
orgânicas às quais pertencem esses gases.
I
~IVIDADES
lEl (UFAL) Os compostos
fenólicos, embora tóxicos para o
ser humano, são bastante usados como germicidas, cuja
ação é potencializada pela presença de grupos alquilas no
anel aromático. A introdução desses grupos requer uma
reação de Friedel-Crafts, sendo que o tamanho ideal do
grupo alquila, para uma atividade germicida máxima, é
de seis átomos de carbono. Sendo assim, o haleto de alquila apropriado para a 'reação com o fenol é:
a) 1-cloro-2,2-dimetilbutano.
b) 1-cloro-2,2-dimetilpropano,
c) 2-cloro-2,3-d imeti I-hexano.
d) 1-cloro-3-etilpentano.
Como o grupo alquila deverá ter 6 carbonos, o composto será:
CHJ
I
I
H (-C-CH
'I
CI
z
(04) O explosivo TNT (2,4,6-trinitrotolueno) é obtido pela
nitração do tolueno.
(08) Nosanéis aromáticos ocorrem reaçõesde substituição.
(16) Os fenóis são compostos orgânicos que apresentam
o grupo hidroxila ligado diretamente a um carbono
do anel benzênico.
Dê a soma dos números dos itens corretos.
NH,
(01) (V) Anilina
=>
6
(02) (V) Ressonância dos elétrons pio
(04) (V)
6;
HHO
-
NO, ~
CH
N02
3
CH,
NO, + 3H,0
O,N ~
(08) (V)
(16) (V)
o-0H
Alternativa a
Soma
= 31
(01+ 02 + 04 + 08 + 16)
m (Cesgranrio)
Se, pela síntese de Friedel-Crafts, se deseja obter etilfenilcetona,
deve-se reagir benzeno com
cloreto de:
a) propanoíla.
d) etanoíla.
e) propila.
b) benzoíla.
c) fenila.
Etilfenilcetona
+
1m (PUC-SP,adaptada)
Em condições reacionais apropriadas,
o benzeno sofre reação de substituição. Grupos ligados
ao anel benzênico interferem na sua reatividade. Alguns
grupos tornam as posições orto e para mais reativas para
reações de substituição e são chamados orto e para dirigentes, enquanto outros grupos tornam a posição meta
mais reativa, sendo chamados meta dirigentes.
Grupos o e p dirigentes: - CH3, - Br,- NH2, - OH
Grupos m dirigentes: - N02, - COOH,- S03H
Considerando-se as informações dadas, qual o principal
produto da reação do ácido benzoico com bromo?
Ctoreto de propancrla
Alternativa a
COOH
COOH
+ HBr
6+Br!~~Br
Ácido metabromobenzoico
m (U_E. Ponta Grossa-PR,adaptada)
Sobre hidrocarbonetos
aromáticos, assinale o que for correto.
(01) Anilina (fenilamina) é um exemplo de composto,
aromático,
(02) No benzeno, todas as ligações carbono-carbono
apresentam a mesma distância.
m (Mackenzie-SP, adaptada)
A + Br2 T
B+
B + HBr
O~3 V
+ HBr
Nas equações dadas, as substâncias A e B são, respectivamente:
a) metanà e bromometano.
b) etano e bromoetano.
c) eteno e bromoetano.
d) propeno e 2-bromopropeno.
e) eteno e etino.
H3C -
CH3 + Br,
»<.
Br +
Sobre essa reação, pode-se afirmar que:
a) o C02 é o nucleófilo.
b) o grupamento OH exerce efeito indutivo retirador de
elétrons no anel aromático.
c) o grupamento OH exerce efeito orientador (dirigente)
meta.
d) além do ácido salicílico, forma-se água como produto.
e) o grupamento OH exerce efeito orientador (dirigente)
orto-para.
»<:
T
Br + HBr
O·
~
I "'" ~V
+ HBr
Alternativa b
orto/para
lI!]
(Ufersa-RN) A nitração do nitrobenzeno com ácido nítrico, usando-se cloreto de ferro 111como catalisador,
produz uma mistura dos seguintes isômeros do dinitrobenzeno:
N02
N02
&N01
r6LN0
I
~'
2
dirigente
Ataque no carbono com carga parcial negativa, assim substituição eletrofílica (texto). O reagente que ataca é "amigo do elétron", ou seja, eletrofílico.
Alternativa e
I
fI!] a:mmn
[H17] O benzeno é um hidrocarboneto aromático com alta estabilidade que pode ter seus átomos de
hidrogênio substituídos por radicais, como exemplificado
a seguir.
N02
o-dinitrobenzeno
m-dinitrobenzeno
p-dinitrobenzeno
Sobre esses isômeros, pode-se afirmar que:
a) o isômero meta é o que seforma em maior proporção.
b) o isômero para possui momento dipolar.
c) os três isômeros se formam em igual proporção.
d) os três isômeros possuem fórmula C6H6N204.
I
Nas reações do benzeno e obedecendo às regras de
orientação aromática, temos que:
a) a alquilação do fenol forma o 2-metil-hidroxibenzeno.
b) a acilação do benzeno forma o álcool benzílico.
c) o metoxibenzeno tem um radical meta dirigente.
d) 2-metil-hidroxibenzeno e álcool benzílico são isômeros de posição.
e) o metoxibenzeno é isômero de cadeia do álcool
benzílico.
A equação da reação é:
NO,
FeC/3
Á"
+ H-
------> ~
OH
NO,
~
o
isômero para ( O,N
-O-
a) (V)
Isômero com
maior
rendimento
OH
NO,) tem momento dipolar igual a
zero (a molécula é apoiar). A fórmula molecular dos isômeros é: C,H4N,O,
Alternativa a
i
!
fi] (Emescam-ES) O ácido
salicílico, precursor na síntese do
ácido acetilsalicílico, pode ser obtido reagindo-se fenol
com dióxido de carbono, numa reação de substituição
eletrofílica aromática.
HO&O
':
Ácido salicílico
I
OH
6
O+
I
b) (F)
.O
OH
A/C/
H;C-C/
I
I
I
~CH
3
---4
A/C/3,
Otetona
c) (F) - O - CH3 => radical orto/para dirigente
d) (F) São isômeros de função.
e) (F) São isôrneros de função.
Alternativa a
o
11
C-
CH,
~omplementares
m (UFF-RJ,adaptada)
Quando uma reação química ocorre,
ligações existentes entre os átomos de uma molécula se
rompem, formam-se novas ligações e surgem novas moléculas. Observe, então, oseguinte esquema reacional:
medicamentosa. Em uma enciclopédia, encontrou que
o ácido pícrico é um derivado fenólico trissubstituído
obtido a partir da reação de fenol (C6HsOH)com o ácido
nítrico (HN03), em presença de ácido sulfúrico (HZS04)concentrado, cuja reação de obtenção estava expressa por:
H,SO,
C6 H2 (NO)23 OH + 3H 2
)
°
Ácido pícrico
(11)
Y+ HBr
Considerando-se o efeito de orientação dos grupos hidroxila
(- OH) e nitro (- NO) sobre o anel aromático na reação
de nitração total, pode-se afirmar que, entre os isômeros
a seguir, a fórmula estrutural correta do ácido pícrico é:
OH
(111)
H3CCHp, A/C/3
(IV)
Z+ HC/
ai
o,N*NO,
N02
a) Identifique, por meio de suas respectivas fórmulas
estruturais, os compostos X, Y, W e Z.
b) As reações representadas por 1,11,111 e IVsão reações
de su bstitu ição eletrofíl ica. Classifiq ue-as.
W(UPE)
Dissolveu-se 1,0 g de fenol em 1 mL de água, dentro
de um tubo de ensaio. Em seguida, resfriou--se a solução com um banho de gelo. Depois, gota a gota, adicionaram-se 6,0 mL de uma solução gelada de ácido
nítrico aquoso (1 : 1) e transferiu-se a mistura reacional para um erlenmeyer contendo 20,0 mL de água.
Os dois produtos isoméricos, de fórmula C6HsN03,
dessa reação foram extraídos com diclorometano em
um funil de separação e, posteriormente,
purificados.
Adaptado de IMAMURA, Paulo M. e BAPTISTELLA, Lúcia H. B. Nitração do fenol, um método em
escala semimicro para disciplina prática de 4 horas.
Química nova, 23, 270-272, 2000.
Em relação ao experimento relatado, é correto afirmar que:
a) um dos produtos da reação é um álcool saturado.
b) os isômeros produzidos são o o-nitrofenol e p-nitrofenol.
c) os produtos da reação são enantiômeros, contendo
anel benzênico.
d) dois isômeros geométricos cis-trans são produzidos
nessa síntese.
e) cada um dos isômeros produzidos possui uma ligação
amida em sua estrutura.
OH
c)
o,N*NO,
'N02
~NO,
OH
d)
OzN
NOz
lI! (UFPB)Quando os derivados do benzeno sofrem reações de
substituição no anel aromático, os grupos ligados ao anel
influem na formação dos produtos, agindo como orientadores das posições onde ocorrerão as substituições. Nesse sentido, se você é um químico e está trabalhando em
uma indústria que deseja sintetizar o composto A (figura
a seguir), utilizando o benzeno como material de partida,
proponha uma sequência adequada de reações para a obtenção desse composto. Justifique sua resposta.
fEl (UFRN)Tiago, ao queimar a mão fazendo café, aplicou,
na região afetada, uma pomada de cor amarela intensa
o rapaz procurou conhecer um pouco mais sobre essa substância
°
II
)Q>-C-CH3
à base de ácido pícrico. Por curiosidade,
C/
A
UAREFA PROPOSTA
o Para se obtertetracloreto de carbono a partir do metano,
deve-se fazer reagir esse gás com:
a) 4 moi de cloro.
b) 3 moi de cloro.
c) 2 moi de cloro.
d) 1 moi de cloro.
e) cloreto de hidrogênio.
D (Cesgranrio)
No 3-metilpentano,
presentada a seguir:
1
H3C-
2
CH2 -
í
3
o (IFGO)A cloração
cuja estrutura está re-
4
H-
Na reação do cloro gasoso com 2,2-dimetilbutano, em
presença de luz, o número de compostos rnonoclorados
que podem ser formados e que não possuem, em sua
molécula, carbono assimétrico é:
a) 1
b) 2
c) 3
d) 4
e) 5
CH2 -
5
CH3
CH3
6
hidrogênio mais facilmente substituível por halogênio I
está situado no carbono de número:
'
a) 1
b) 2
c) 3
d) 4
e) 6
de alcanos é um método sintético para
a preparação de cloretos de alquila. Desconsiderando a
isomeria óptica, o akano de peso molecular 114 que
apresenta 4 derivados rnonoclorados é o:
a) 2,2,4-trimetilpentano.
b) 2,4-dimetilpentano.
c) 2,3-dimetilbutano.
d) 3-metil-hexano.
e) 2-metilpentano.
O
IJ (PUC-MG)Qual o produto
principal da reação de substituição apresentada a seguir?
D (UFPR)Considerando
a reação de halogenação do metilbutano em presença de luz e cloro, responda:
a) Quais asfórmulas dos derivados monoclorados obtidos?
b) Dos produtos obtidos, quais os que apresentam
isômeros ópticos? Dê nomes a eles e justifique sua
resposta.
11 (Mackenzie-SP)A reação de halogenação de alcanos é uma
a)
b)
c)
d)
Cioreto de isobutila.
1,1-diclorobutano.
1,2-diclorobutano.
2-metil-2-cloropropano.
11 (PUC-SP)A equação
CH4 ->
a) formação de íon.
b) reação de adição.
c) reação de homólise.
•
CH3 + • H está indicando:
d) reação de heterólise.
e) reação de substituição.
O (UECE)O produto
orgânico obtido preferencialmente
monocloração do 2,4-dimetilpentano é o:
a) 1-cloro-2,4-dimetilpentano.
b) 5-cloro-2,4-dimetilpentano.
c) 3-cloro-2,4-dimetilpentano.
d) 2-cloro-2,4-dimetilpentano.
n (Fuvest-SP) A reação do propano
reação radicalar, sendo utilizado aquecimento ou uma luz
de frequência adequada para que a reação ocorra. Essa
reação comumente produz uma mistura de compostos isoméricos, quando o alcano possui mais de uma
possibilidade de substituição dos átomos de hidrogênio.
O exemplo a seguir ilustra uma reação de monocloração
de um alcano, em presença de luz, formando compostos
isoméricos.
na
com cloro gasoso, em
presença de luz, produz dois compostos rnonodorados.
Assim, ao realizar a monocloração do 3,3-dimetil-hexano, em condições adequadas, é correto afirmar que o
número de isômeros planos formados nessa reação é:
a) 3
b) 4
c) 5
d) 6
e) 7
[TI] (UFRJ)OS radicais
livres, grandes inimigos da pele, são
formados quando há exposição excessiva ao sol. A formação desses radicais envolve um diferente ganho de energia e, por isso, eles apresentam estabilidades diferentes.
O gráfico a seguir apresenta a comparação da energia
potencial dos radicais t-butila e isobutila formados a
partir do isobutano.
CH3
I
H3CCHSH2+ H·
CH
3
"H)98
V
/
1
H,c~CH,::
.
kcal . rnol "
fJ.Ho = +91 kca
. H3CCHCH3
i
m (UFPA) As reações de bromação
e cloração de alcanos
ocorrem via mecanismo radicalar. Casoo produto dessas
reações tenha um centro quiral, então será obtida uma;
mistura racêmica. Por exemplo, a cloração radicalar do
n-butano produz uma mistura racêmica de 2-clorobutano, com 71% de rendimento. Já a bromação do n-butano
produz uma mistura racêmica de 2-bromobutano com
98% de rendimento. Nesse caso, o maior rendimento em
mistura racêmica da bromação é devido à:
a) maior estabilidade do carbocátion secundário formado durante a reação de cloração.
b) menor reatividade do radical de bromo formado
durante a reação de bromação.
c) maior estabilidade do radical alquila primário forma_
_
do durante a reaçao de bromaçao.
d) menor reatividade do radical de cloro formado du- •
_ d I
I
rante a reaçao e c oraçao.
e) maior reatividade do radical de bromo formado I
durante a reação de bromação.
m DlI'!ml [H24] As reações a seguir são exemplos
Haleto
Amida
Propanal
b)
Haleto
Amina
Propanol
c)
Haleto de ácido
Amida
Propanona
d)
Haleto
Cetona
Propenóxi
e)
Haleto de ácido
Amida
Ácido propanoico
m (UECE)° benzeno, um dos principais
I
CH3
a) Qual dos dois radicais é o mais estável? Justifique sua
resposta.
b) Qual é a fórmula estrutural do composto resultante
da união dos radicais t-butila e isobutila?
a)
hidrocarbonetos aromáticos, é substância usada como solvente (de iodo, enxofre, graxas, ceras etc.) e matéria-prima básica na produção
de muitos compostos orgânicos importantes como fenol,
anilina, trinitrotolueno, plásticos, borracha sintética e tintas. Pode reagi r com ácido nítrico nas seguintes condições:
Assinale a alternativa que corretamente apresenta os
produtos e o tipo dessa reação.
S04
a) ~
+ N02 + H20 + H2' eliminação
b)
N02
~
+ H20, adição
OH
+ HN02, adição
c) ~
.NO
d)
~
2
+H
2
°
su
b . ._
snturçao
'
m (F. Carlos Chagas-BA) Observe os compostos
.
a seguir:
I
de rea- :
ções de substituição em derivados de ácidos carboxílicos.
a)
/0
CI
+ NH3.....•
I. H C-CH -C
3
2
"CI
b)
9"NO,
e)
CI
(8)
/0
11. H3C-CH2-C
"CI
As letras A, B e C podem ser corretamente classificadas I
e substituídas por:
I
c)
o,N*NO,
CI
Pela cloração do benzeno, seguida de uma nitração e
outra nitração, obtém-se, preponderantemente,
qual
dos compostos apresentados?
m (PUC-PR)A reação do metilbenzeno
(tolueno) com HN03 em I
presença de catalisadorfornecerá como principal composto: I
a) somente o l-metil-3-nitrobenzeno.
b) somente o l-metil-2-nitrobenzeno.
c) somente o l-metil-4-nitrobenzeno.
d) mistura do l-metil-2-nitrobenzeno e l-metil-3-nitrobenzeno.
e) mistura do 1-metil-2-nitrobenzeno e 1-metiI4-nitrobenzeno.
I]J (U. F.Santa Maria-RS) Observe as equações
de reações de
substituição eletrofílica em compostos aromáticos:
feBr,
©
A + HBr
+ Brz
I
m (UFCE)O orto-hidroximetilbénzeno
não reage com ácido
etanoico, mas reage com cloreto de acetila. Qual o nome
do composto orgânico produzido dessa reação?
a) Formiato de orto-toluíla.
b) Acetato de orto-toluíla.
c) Propianato de orto-toluíla.
d) Acetato de fenila.
e) Um composto diferente dos anteriormente citados.
fIi] (Fuvest-SP,adaptada)
Considere o esquema simplificado
de produção de anilina a partir do benzeno.
O
Benzeno
OH
©
H,O/W
+ 3Brz
Fenol
Os nomes corretos dos produtos A e B são, respectivamente:
a) 1,4-dibromobenzeno e 4-bromofenol.
b) 1,2,3-tribromobenzeno e 2-bromofenol.
c) 5-bromobenzeno e 2,4-dibromofenol.
d) 1,2-dibromobenzeno e 1,1 ,3-tribromofenol.
e) bromobenzeno e 2,4,6-tribromofenol.
m (UFRJ) OSnitrotoluenos
m (ITA-SP) A nitrocelulose
I
I
I
m (U. F.Pelotas-RS)O DDT(da sigla de dicloro-difenil-tricloroetano) foi o primeiro pesticida moderno, tendo sido largamente
usado após a Segunda Guerra Mundial. Analise a equação
química de síntese do DDTejUlgoUe(Vou F)os itensa seguir.
2C1
-0\\
r
~
-
(e)
+ Cl3C _/
h
'"
~,
H
·8 ~·8
Nesseesquema,A, B eX correspondem, respectivamente, a:
a) HNOz, Hz e red ução.
b) HN03' Hz e redução.
c) HN03, Hz e oxidação.
d) NOz, HP e hidrólise.
e) HNOz, HzO e hidrólise.
Observação: Em compostos orgânicos, oxidação é o aumento de átomos de oxigênio e redução é o aumento de
átomos de hidrogênio.
B + 3HBr
é considerada uma substância
química explosiva, sendo obtida a partir da nitração da
celulose. Cite outras cinco substâncias explosivas sintetizadas por processos de nitração.
,;,~ç,o
são compostos intermediários
importantes na produção de explosivos. Os mononitrotoluenos podem ser obtidos simultaneamente,
a
partir do benzeno, através da seguinte sequência de
reações:
I
I rA
I
g+A
6O
CH3
AICl
3
----=-----+.
+ produto inorgânico
H2S04('Qj
====~
(e)
i. O nome de um dos reagentes é clorobenzeno.
li. Quando a reação atingir o equilíbrio,
as concentrações dos reagentes serão iguais a zero.
111. O acido sulfúrico age como um catalisador.
IV. O nome do DDT segundo a IUPAC é 1,1,1-tricloro-2,2-bis(p-clorofenil)etano.
V. Esta reação é classificada como substituição nucleofílica aromática.
I
I
a) Escreva a fórmula estrutural do composto A e o nome
do composto B.
b) Identifique o tipo de isomeria plana presente nos três
produtos orgânicos finais da sequência de reações.
m (Fuvest-SP)A adição
Reação 1
O
(
+
1,3-butadieno
de HBr a um alceno pode conduzir
a produtos diferentes, caso, nessa reação, seja empregado o akeno puro ou o alceno misturado a uma pequena
quantidade de peróxido.
O
fH~ifH
Propenal
(dienófilo)
CH3
Compostos com duplas-ligações entre átomos de carbono podem reagir com HBr, sob condições adequadas,
como indicado:
Reação 2
H C2
H
peróxido
I
3
Br
, H CZ
Br-C-CH
I
Considerando os compostos 1,11 e 111, cuja estrutura molecular é mostrada a seguir:
o
~CH3
O
II
I
Br
3
CH3
CH
CH3
CH3
~(H,
I
I
I
C-
I
I
C-
CH
3
H
a) O 1-metilciclopenteno
reage com HBr de forma
análoga. Escreva, empregando fórmulas estruturais, as equações que representam a adição de
HBr a esse composto na presença e na ausência
de peróxido.
b) Dê as fórmulas estruturais dos rnetilciclopentenos
isoméricos (isõmeros de posição).
c) Indique o rnetikiclopenteno
do item b que forma,
ao reagir com HBr, quer na presença, quer na ausência de peróxido, uma mistura de metilciclopenta nos monobromados que são isõmeros de posição.
J ustifiq ue.
III
e considerando que os compostos que reagem com III
para formar I e II são os dienófilos IVe V, respectivamente, escolha a alternativa correta.
a) A reação (2) com o composto 11 provoca a formação
de um carbono assimétrico.
b) Um dos três compostos, I, II e 111, apresenta isomeria
geométrica.
c) Na fórmula estrutural do produto obtido quando o
composto I sofre a reação (2), o número de átomos
de carbono assimétricos formados é 2.
d) O dienófilo V apresenta isomeria plana.
e) Os dienófilos IV e V são isõmeros constitucionais .
fI] a:mn [H17] Assim como
ocorre nos alcenos, os alcinos
podem sofrer hidratação com a adição direta de água,
catalisada por íon mercúrio (11), produzindo um composto
que segue a regra de Markovnikov. Dessemodo é formado
um composto instável, quetem como produto final uma
cetona ou um aldeído. O produto obtido da hidratação
catalisada por íon mercúrio (11) do but-1-ino é:
a) butanal.
b) butanona.
c) 2-metilpropanal.
d) 3-metilbutanona.
e) butan-t-ol.
...
Vá em frente
f2 ACESSE
http://super.abril.com.brlsaude/margarina-mais-saudavel-manteiga·620246.shtml
(acessoem 12 fev. 2015)
Neste artigo você conhecerá algumas propriedades da margarina e da manteiga e poderá avaliar qual é mais saudável para o nosso organismo.
~abarito
Capítulo 1
Capítulo 2
Complementares
Complementares
9. a
10. Soma = 5 (01 + 04)
9. b
10. b
H
11.a
12.
11. a)
~
I
I
H N-C-CH
2
3
II ~ 1,2 butadieno
I ~ 1,3 butadieno
Explicação,
21. e
22. c
23. e
24. d
~
b) Remédio A. Explicação.
12. Fórmula molecular = CSH'20
Carbono assimétrico = composto 2
Tarefa proposta
1. d
2. e
3. Ocorre isomeria de posição.
CI
*
-CH-CH
H C-CH
3
2
-OH
I
2
CH)
~
21.e
22. Estrutu ras A e D.
23. v-v
24.d
CI
m-diclorobenzeno
ou 1,3-diclorobenzeno
o-diclorobenzeno
ou 1,2-diclorobenzeno
Tarefa proposta
1.
2.
3.
4.
5.
6.
CI
e
b
c
e
= 10 (02 + 08)
Soma
b
7. a) H3C-0-CH2-CH3
p-diclorobenzeno
ou 1,4-diclorobenzeno
metoxietano
OH
4. a
/"-:.
5. a) H2C
CH2
I
I
""
CH2 -
ciclopentano
CH2 -
CH)
H/-CH
CH2
b) Não. Justificativa.
b) Uma das possibilidades:
H2C = CH - CH2 - CH2 - CH3 "" pent-1-eno
6. b
7. b
8. c
9. b
10. a) Compostos 2 (propanona) e 3 (propanal), isõmeros de função.
b) Composto 1 (propano). Justificativa.
11.d
12. b
13. a
14. a
15. b
16. e
17. b
18. b
19. b
20. c
21. b
22.
8. e
9. a
/0
10. a) H C-CH
-C
)
2
""
OH
Ácido propanoico
Isômeros ~
CI
CI
I
HC-CH
I
I
/0
2
""OH
b) Ácido 2,3-dicloropropanoico
23. c
24. c
trans-pent-
3-enona
/0
H C-C-C
-C
CI
cis-pent -3-enona
-CH)
propan-2-ol
propan-l-ol
I
H2C -
OH
I
CH2
J
I
CI
""OH
H"
11. a) H C~C
3
C~C
-/
~H
I
I
/CH3
-,
23. c
3" C ,/
HC
I
I:
H
OH
©+
HJC~C
"CI
I
tsõrnero trons
b) Isomeria óptica. Justificativa.
12. e
13. d
14. a) Função álcool (hidroxila ligada em átomo de carbono saturado).
-- ©
,/ O
124•
O
3" ,/ °
!
HC
C
©
b} ~IOH
3" ,/ °
H C
____
+CI~CI
C
~
15. c
17. a) C2sH4S02
b) Fenol e éter cíclico.
c) Um carbono quiral, considerando o radical - C'6H3J com
cadeia normal.
18. e
19. a
20. b
21. d
22. V - F - V - F - F - V
23. a) 4 ca rbonos assimétricos
e 16 isômeros optica mente
ativos.
b) Isomeria de função.
I
HOsHi
(=0
0=)
!
I
H-(-OH
H-(
5. d
6. b
7. a
íHzOH
HO-(-H
I
-OH
I
CHpH
(-) frutose
I
8. a)
4H C~CH~CH
2
H
CI
I
T~
À
H/ ~
H-)-OH
I
CH2
~
CH3 + HJC ~
CH3
HO-)-H
H
I
I
I
HO- )-H
1
CI
HO,H)
I.
TH ~ I ~
CHJ
CH ~
2
CH + H C ~
3
3
CH ~
I
CH3
CI
CH3
CH ~
2
CH + 4H ~
I 2
CI
frutose (+)
b) H C ~
3
H C~
Complementares
9. d
10.d
11. c
2
1
CI
12.e
Y~©J
Br
I
CH ~
I
CH ~
I
-
2-cloro-3-metilbutano
3
CHJ
CI
CH ~
CH ~
I
CH
CH -
2
t-cloro-z-metilbutano
3
CH3
Os dois compostos apresentam
9. d
10.a) Radical r-butila. Justificativa.
carbono quiral.
CH3
b) H C 3
I
C-
I
CH3
11. b
12.e
13.d
I 14. b
15. e
16. e
1
CH3 +
.
c*~
+ H C~
2
I
CI ~
3
CH3
Capítulo 3
b) I ~ sulfonação
11 ~ halogenação
111 ~ nitração
IV~ alquilação
22.b
+4C1~
~CH
I
3
~
24.b
~
CI
2. c
3. d
4. c
I
I
I
+ HCI
Tarefa proposta
1. a
16. V - V - F - F - F
C)
+HCI
CH 2
CH -
I
CH3
CH
3
CI
17.
I
21.a
22. b
23.e
24. a) As equações são:
HzC=CH -
Trinitroglicerina (TNG)
(trinitrato de glicerila)
Trinitrot~lueno
(TNT)
Ácido pícrico
O-NO
I
-©L
O
ON
I
NO
I
Trinitrobenzeno
I
3
N
OzN
CH-
I
CH + H 50
3
2
4
-CH
3
<
rrooan-z-ot
Álcool isopropílico
OH
r >:»>.
2
NOz Tarefa proposta
1. b
2. a
Ciclotrimetileno·
3. e
4. e
trinitroamina
5. c
6. a
(RDX)
7.
c
20. b
I
8. a)
Tetranitrato de
pentaeritrol (PETN)
e
19.
b) H C-CH
I
N
0-N02
18. V-F-V-V-F
I
2
H2
CH
3
OH
N
/"-.
H2C CH2
z N-O-C-C-C-O-NO
H2
H -+ H C-
I
I
°
+ H-O
N02
2
CH2
NOz
CH3 + H2504 -+
C
H2
CH3
21.a)
©
+~3C-C!
r6
-+
+H-C/
A
HC=CH + C/-C/
C/
C/
I
I
eis
HC= CH
-->
trans
b)
B
= Ácido nítrico
33%
b) Apresentam isomeria de posição.
22. a
23. a) 5equência I. Justificativa.
HC=C-
b) A. H,c(H),~(H),cH,
CH3+ C/-
C/
C/
I
I
C/ --> HC= C-
eis
CHJ
trans
503H
HC= C -
c)
24.d
CH -
I
CH + CI-
-.C=C
CH3
Capítulo 4
Complementares
9. a
-+
C/
10. HC=C-CH
C/
I I
+2(/ -+HC-C-CH
3
z
I I
C/
CI
CI
I
I
HC = C -
CI
H/
CH -
I
CH3
CI -+
CH
3
H"
E
C=C
(//
C/
1,1,2,2·tetracloropropano
9.
a) Progesterona ~ 2 cetonas
Testosterona ~ 1 cetona e 1 álcool
b)
12.
I
c
0+
-+CX
Br
Br-Br
Br
b)
/
CI
"CH(CH)
32
/CI
"CH(CHJ2
Z
3
•
3
b)
10.c
11.V-V-F-V-V
1Z.e
13. c
14. C
15. b
16. d
17. d
18. d
19. a)
C) Eti Ibenzeno.
Z1.b
22. a
,,/,11
C=C + HCI_ -C-C/,,,
1 1
CH
3
b)
1
HCJ
/1
C-
C"""",'o CH3
CI
H
Reação de adição
, 23.a)
CH
C mais hidrogenado
r>
C = CH + HCI
H
Z
3
1
---->
HC3
C-
H
C-
1 1
CH3
2;
2;
+ HB'----:c:-S""7em~-+H3)0H
peróxido
mo.
+ HBr
'
U
>
X
H,C
U
-p""'e""7róx-idT-:-o-+'
CH
J
CI
20. a)
C) 3·metilciclopenteno.
24.b
Justificativa.
r