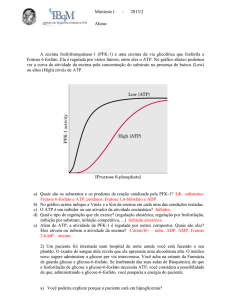
QBQ-0116
BIOQUÍMICA: ESTRUTURA DE BIOMOLÉCULAS
e METABOLISMO
2014
pH e SISTEMAS TAMPÃO
01. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é
1,6 x 10-6. Calcular:
a) O grau de ionização do ácido para uma solução 10-3 M.
b) O pH
02. Segel, Biochemical Calculations, Capítulo 1, Problema 1-26.
a) Indicar os componentes de um tampão acetato
b) Mostrar através de reações como o tampão acetato resiste a mudanças de pH
quando se adiciona íons OH- ou H+.
03. Quais os fatores que determinam a eficiência ou capacidade tamponante de uma solução?
04. Dispõe-se de solução de ácido acético e acetato de sódio ambas 0,1 M. Com estas duas
soluções, preparar os seguintes tampões acetato 0,1 M (pKa do ácido acético = 4,7):
a) pH = 3,7
b) pH = 5,7
08. Lehninger, Biochemistry, segunda edição, Capítulo 2, Problema 8.
a) Calcular a relação [HCO3-]/[H2CO3] no plasma sanguíneo em pH 7,4 (pKa =
3,77),
b) Calcular a relação [HPO42-]/[H2PO4-] no plasma sanguíneo (pKa = 7,20),
c) Qual dos dois pares ácido-base conjugados é o tampão mais eficiente em uma
amostra de plasma sanguíneo em um frasco fechado, sem espaço disponível para
gases (totalmente ocupado por líquido)?
09. Segel, Biochemical Calculations, Capítulo 1, Problema 1-52. O plasma sanguíneo
contém uma reserva ("pool") total de carbonato (essencialmente HCO3- + CO2) de 2,52 x
10-2M.
a) Qual é a razão [HCO3-]/[CO2] e a concentração de cada componente do tampão
presente a pH 7,4?
b) Qual seria o pH se for adicionado 10-2 M de H+ sob condições tais que o aumento
da [CO2] não possa ser liberado?
c) Qual seria o pH se for adicionado 10-2 M de H+ e o excesso de CO2 eliminado
(mantendo-se assim a [CO2] original)?
Considerar o pKa para o equilíbrio abaixo:
CO2 + H2O
←
→
HCO3- + H+, como sendo 6,1.
→
AMINOÁCIDOS
01. Segel, Biochemical Calculations, Capítulo 1, Problema 1-45. Escreva as estruturas das
várias formas de alanina, ácido aspártico e lisina que podem ser obtidas. Mostre como
cada forma ioniza em água.
02. Segel, Biochemical Calculations, Capítulo 1, Problema 1-46 Desenhe a curva de
titulação de cloridrato de alanina com KOH. Indique o pI. São dados:
pKa1 = 2,4 e pKa2 = 9,6
03. Conhecidos os valores dos pKas, discuta as curvas de titulação do ácido aspártico e
lisina. Indique os respectivos pIs.
04. Segel, Biochemical Calculations, Capítulo 2, Problema 2-2. Quais são as mobilidades
eletroforéticas relativas de glicina, leucina, ácido aspártico, ácido glutâmico e lisina a pH
4,7?
Dados:
Aminoácido
Lisina
Glicina
Leucina
Ácido Glutâmico
Ácido Aspártico
Considere: mobilidade eletroforética = k .
P.M.
146,2
75,1
131,2
147,1
133,1
pI
9,74
5,97
5,98
3,22
2,98
pH - pI
P.M.
05. Lehninger, Principles of Biochemistry, Capítulo 5, Problema 3. Relação entre estrutura e
propriedades químicas dos aminoácidos.
Uma vez que os aminoácidos servem como unidades fundamentais formadoras das
proteínas, o conhecimento de suas estruturas e propriedades químicas é crucial para a
compreensão de como as proteínas executam suas funções biológicas.
a) Escreva as estruturas das cadeias laterais (grupos R) dos seguintes aminoácidos: (1) Ala,
(2) Arg, (3) Asn, (4) Asp, (5) Cys, (6) Glu, (7) Gly, (8) His, (9) Lys, (10) Met, (11) Phe,
(12) Pro, (13) Ser, (14) Trp, (15) Tyr e (16) Val.
b) Associe compatibilizando cada estrutura com a descrição de suas propriedades fornecidas
abaixo (algumas descrições podem ser usadas mais de uma vez).
(Associe o número do aminoácido com a letra correspondente à descrição).
a) Grupo R pequeno e polar contendo um grupo hidroxila. Este aminoácido é importante no
sítio ativo de algumas enzimas.
b) Provoca o menor impedimento estérico.
c) O grupo R tem pKa próximo de 10,5, o que torna-o carregado positivamente no pH
celular.
d) O grupo R contém enxofre e é neutro em todos os pHs.
e) O grupo R é aromático, de natureza hidrofóbica e neutro em todos os pHs.
f) Hidrocarboneto saturado, importante em interações hidrofóbicas.
g) O único aminoácido que possui um grupo R ionizável com pKa próximo de 7. É um
grupo importante no sítio ativo de algumas enzimas.
h) O único aminoácido que possui um alfa-amino grupo substituído. Influencia o
dobramento da proteína forçando uma curvatura na cadeia.
i) O grupo R tem pKa próximo de 4 e assim está carregado negativamente em pH 7.
j) Tem grupo R aromático, capaz de formar pontes de hidrogênio; tem pKa perto de 10.
k) Forma ligações cruzadas de dissulfeto (pontes de dissulfeto) entre cadeias polipeptídicas,
o pKa do seu grupo funcional é cerca de 8.
l) O grupo R tem pKa próximo de 12, fazendo-o positivamente carregado em todos os pHs
fisiológicos. Sua carga positiva é importante em algumas proteínas para a ligação com
grupos fosfatos negativamente carregados.
m) Quando seu grupo R polar não carregado é hidrolisado, este aminoácido converte-se em
outro que possui uma carga negativa em seu grupo R quando em pH ao redor de 7.
06.Wood et al., Biochemistry: A Problems Approach, Capítulo 2, Problema 2-2. Analisando
as estruturas dos aminoácidos, indique qual deles se adapta às seguintes descrições:
a) ______________________ altera o dobramento da cadeia polipeptídica porque não é um
verdadeiro aminoácido. Nas cadeias polipeptídicas da mioglobina e hemoglobina nem
todo dobramento tem ________________, mas todo(a) _________ produz um
dobramento. (Todos os três espaços vazios correspondem ao mesmo resíduo de
aminoácido, o qual é único na maneira pela qual ele forma ligações peptídicas).
b) ________________ tem uma cadeia lateral não polar e interage com outros anéis
aromáticos. (Os anéis aromáticos têm a tendência a se empilhar (estaquear) com outros
anéis aromáticos).
c) ______________ é pequeno(a), e não contém enxofre. Ele (ela) pode formar pontes de
hidrogênio internas numa proteína enovelada.
d) O par de elétrons solitário em um dos nitrogênios do anel no(a) ______________, o(a)
torna, como metionina um ligante potencial, importante na união dos íons de ferro na
hemoglobina.
e) ______________________ desempenha um papel crucial na estabilização da estrutura de
muitas proteínas em virtude da habilidade de dois de tais resíduos formar uma ligação
covalente entre suas cadeias laterais, quando estes resíduos estão presentes na mesma ou
em diferentes cadeias polipeptídicas.
f) Os carbonos em um aminoácido são designados por letras do alfabeto grego começando
com o carbono alfa e extendendo pela cadeia lateral: beta, gama, delta, ... Se dois ou três
grupos (não átomos de hidrogênio) são ligados ao carbono beta, a molécula é dita
ramificada no carbono beta. Dois resíduos adjacentes que têm ramificações no carbono β
tornam a estrutura do polipeptídeo conhecido como alfa hélice instável. Por este critério
__________, ________ e ________ devem interromper a α-hélice quando adjacentes.
g) Nas proteínas, sob condições fisiológicas normais (próximo ao pH = 7), as cadeias laterais
de ________ e __________ são quase totalmente positivamente carregadas, mas as
cadeias laterais de __________ estão somente em parte positivamente carregadas.
PEPTÍDEOS
1. Baseado em Marzzoco e Torres, Bioquímica Básica, Página 220, Problema 3.
Para o tripeptídeo H3N+-Ala-Lys-Ser-COOa) Classifique os grupos R segundo suas polaridades.
b) Diga para que tipo de ligação esses grupos poderiam contribuir na estrutura terciária de
uma proteína.
c) Calcule o pI sabendo que:
Ala
Lys
Ser
Glu
2,34
2,18
2,21
2,19
pKa1
9,69
8,95
9,15
9,67
pKa2
10,53
4,25
pKa3 (grupo R)
d) Para que polo migraria o tripeptídeo numa eletroforese feita a pH = 7?
e) Discuta a capacidade do peptídeo de atuar como tampão.
f) Refaça os ítens anteriores para um tripeptídeo contendo ácido glutâmico no lugar de
lisina.
02. Stryer, Biochemistry, 3a edição, Capítulo 3, Problema 1. Os seguintes reagentes são
comumente usados na Química de Proteínas:
CNBr (brometo de cianogênio)
Cloreto de Dabsila
Uréia
HCl 6N
Ninhidrina
β-Mercaptoetanol
Tripsina
Fenil isotiocianato
Ácido Perfórmico
Quimiotripsina
Qual(is) dele(s) é(são) o(s) mais adequado(s) para executar cada uma das seguintes tarefas?
a) Determinação da sequência de aminoácidos de um peptídeo pequeno.
b) Identificação de um resíduo amino-terminal de um peptídeo (do qual dispõe-se somente
de menos de 10-7 g).
c) Desnaturação reversível de uma proteína isenta de pontes de dissulfeto. Que outro
reagente seria necessário se elas estivessem presentes?
d) Hidrólise de ligações peptídicas no lado carboxílico de resíduos com R aromático.
e) Clivagem de ligações peptídicas no lado carboxílico de metioninas.
f) Hidrólise de ligações peptídicas no lado carboxílico de resíduos de lisina e arginina.
03. Rawn, Biochemistry, Capítulo 3, Problema 4. Um peptídeo tem a composição: Ala, Arg,
Asp2, Glu2, Gly3, Leu, Val3.
Os seguintes peptídeos foram isolados após hidrólise ácida parcial e suas sequências
determinadas:
(1) Asp-Glu-Val-Gly-Gly-Glu-Ala
(2) Val-Asp-Val-Asp-Glu
(3) Val-Asp-Val
(4) Glu-Ala-Leu-Gly-Arg
(5) Val-Gly-Gly-Glu-Ala-Leu-Gly-Arg
(6) Leu-Gly-Arg
Com estes dados, indique a sequência de aminoácidos no peptídeo original.
04. Segel, Biochemical Calculations, Capítulo 2, Problema 2-3. A hidrólise parcial de uma
proteína forneceu vários polipeptídeos. Um deles foi purificado. Deduza a sequência de
aminoácidos neste polipeptídeo a partir das seguintes informações:
a) A hidrólise ácida completa forneceu Ala + Arg + 2 Ser + Lys + Phe + Met + Trp + Pro.
b) O tratamento com fluorodinitrobenzeno (FDNB, o reagente de Sanger) seguido da
hidrólise ácida completa forneceu como únicos dinitrofenil derivados (DNP derivados), a
alfa- dinitrofenilalanina (alfa-DNP-Ala) e a epsilon-dinitrofenilisina (epsilon-DNP-Lys).
c) Carboxipeptidase A ou carboxipeptidase B não liberaram qualquer aminoácido C
terminal.
d) O tratamento com brometo de cianogênio (CNBr) forneceu dois peptídeos. Um continha
Ser + Trp + Pro. O outro continha todos os aminoácidos restantes (inclusive a segunda
serina).
e) O tratamento com quimiotripsina forneceu três peptídeos. Um continha somente Ser +
Pro. Outro, somente Met + Trp. O terceiro Phe + Lys + Ser + Arg + Ala.
f) O tratamento com tripsina forneceu três peptídeos. Um continha somente Ala + Arg.
Outro continha somente Lys + Ser. O terceiro continha Phe + Trp + Met + Ser + Pro.
Informações: (1) FDNB reage com amino-grupos livres fornecendo DNP-aminoácidos após
hidrólise; (2) Carboxipeptidase A libera todos os aminoácidos C terminais, exceto Arg, Lys e
Pro e Carboxipeptidase B libera somente C terminal correspondente a Arg ou Lys; (3) CNBr
cliva especificamente no lado carboxílico de resíduos de Met; e (4) Quimiotripsina e tripsina
clivam especificamente no lado carboxílico, respectivamente, de resíduos com R aromático
(Phe, Tyr e Trp) e de resíduos com R de Lys e Arg.
PROTEÍNAS
01. Indique as propriedades das proteínas nas quais se baseiam as seguintes técnicas
utilizadas na sua purificação:
(a) Eletroforese, (b) Salting out, (c) Precipitação no pI, (d) Ultra centrifugação e (e) Diálise
02. Lehninger, Biochemistry, 2a. ed., Capítulo 7, Problema 6. Para que direção, isto é para o
anodo (A), para o catodo (C) ou permenência na origem (O), migrarão num campo
elétrico as seguintes proteínas, nos pHs indicados?
a) Albumina do ovo (pI = 4,6) em pH 5,0
b) β-Lactoglobulina (pI = 5,2) nos pHs 5,0 e 7,0
c) Quimiotripsinogênio (pI = 9,5) nos pHs 5,0, 9,5 e 11,0
03. Lehninger, Biochemistry, 2a. ed., Capítulo 7, Problema 7. Em que pH será a eletroforese
mais eficiente na separação das seguintes misturas de proteínas?
a) Albumina sérica e hemoglobina; pIs = 4,9 e 6,8, respectivamente
b) Mioglobina e quimiotripsinogênio; pIs = 7,0 e 9,5, respectivamente
c) Albumina do ovo, albumina sérica e urease, pIs = 4,6, 4,9 e 5,0, respectivamente
04. Marzzoco e Torres, Bioquímica Básica, Página 220, Problema 7. Abaixo está
representada a mobilidade eletroforética em pH 8,6 da hemoglobina normal e de uma
série de hemoglobinas anormais (que possuem um aminoácido substituído):
(-)______________________________________________________(+)
A
B
Normal
C
D
Indique a que posição A, B, C ou D corresponde cada hemoglobina anormal:
HbS - Val em lugar de Glu, HbJ - Asp em lugar de Gly, HbN - Glu em lugar de Lys e
HbC - Lys em lugar de ácido Glu.
05. Segel, Biochemical Calculations, 2a. ed., Capítulo 2, Problema 2-7. O peso molecular
médio de um resíduo de aminoácido é 120. A densidade média de uma proteína é 1,33
g/cm3. Calcule:
a) A massa de uma única molécula de uma proteína que contém 270 aminoácidos, (b) O
volume ocupado por uma única molécula desta proteína, e (c) Poderá uma molécula desta
proteína adaptar-se no interior de uma membrana celular medindo 100 Å de espessura?
Considere que esta molécula é esférica.
06. Wood et al, Biochemistry: A Problems Approach, Capítulo 4, Problema 4-1. Indique se
as seguintes afirmações são falsas ou verdadeiras. Justifique as que forem falsas:
a) Pontes de hidrogênio ocorrem entre átomos de Hidrogênio na superfície das moléculas de
proteína em solução.
b) A conformação termodinamicamente mais estável de uma proteína corresponde a
estrutura de energia livre mais baixa.
c) A formação de pontes de hidrogênio internas corresponde a principal interação que
direciona o dobramento da molécula de proteína.
d) Solventes orgânicos desnaturam proteínas, principalmente por dificultar interações
iônicas.
e) O dobramento de uma molécula de proteína hidrofóbica é acompanhado por um aumento
na entropia do polipeptídeo.
f) O termo estrutura quaternária refere-se a conformação da proteína em quarta dimensão,
isto é, como uma função do tempo.
g) Pontes dissulfeto ligam covalentemente resíduos de cisteína cujas proximidades são
determinadas por interações prévias não covalentes.
h) Numa alfa-hélice, os Hidrogênios amídicos de todas as ligações peptídicas estão
formando pontes de Hidrogênio.
i) A partir da estrutura primária completa de uma proteína, é possível predizer sua
conformação tridimensional.
07. Wood et al., Biochemistry: A Problems Approach, Capítulo 4, Problema 4-2
a) As conformações das proteínas correspondentes ao mínimo de energia livre muitas vezes
são favorecidas por ligações cruzadas covalentes entre resíduos de ____________.
b) As interações hidrofóbicas levam a um(a) ____________ de energia livre quando as
cadeias laterais dos resíduos de aminoácidos não polares são removidos da fase aquosa.
c) O posicionamento de cadeias laterais hidrofóbicas no interior de uma proteína
________________ a entropia do ambiente aquoso.
d) Solventes orgânicos estabilizam (diminuem a energia livre) de grupos _______________
em meio aquoso.
e) Na α-hélice, as pontes de hidrogênio entre os grupos C=O e N-H são bastante estáveis
porque os três átomos envolvidos são __________________.
08. Wood et al., Biochemistry: A Problems Approach, Capítulo 4, Problema 4-16. Suponha
que foram fornecidas a você pequenas quantidades de três proteínas desconhecidas: A, B
e C. Seu instrutor de bioquímica lhe informou que uma delas forma predominantemente
α-hélice, outra, folha pregueada β e a terceira, hélice tripla de colágeno. O laboratório
onde você está trabalhando está equipado com um analisador de aminoácido, mas
infelizmente não dispõe de um equipamento para R-X cristalográfico. Você determinou a
composição de aminoácidos (em porcentagem molar) para cada proteína, como mostrado
na tabela a seguir:
A
B
C
A
B
C
29,4
5,0
10,7
0,5
6,9
2,4
Ala
Leu
0,5
7,2
5,0
0,3
2,3
3,4
Arg
Lys
1,3
6,0
4,5
0,5
0,8
Asp
Met
11,2
0,5
2,5
1,2
Cys
Phe
1,0
12,1
7,1
0,3
7,5
12,2
Glu
Pro
44,6
8,1
33,0
12,2
10,2
4,3
Gly
Ser
0,2
0,7
0,4
0,2
1,2
His
Trp
9,4
5,2
4,2
0,4
Hypro
Tyr
0,7
2,8
0,9
2,2
5,1
2,3
Ile
Val
Baseado nos dados da tabela, você pode prever a estrutura secundária predominante
para cada uma?
09. Lehninger, Principles of Biochemistry, Capítulo 8, Problema 9. Comparação entre as
hemoglobinas da mãe e do feto. Estudo do transporte de oxigênio em mulheres grávidas
mostraram que as curvas de saturação pelo oxigênio do sangue materno e fetal são
marcadamente diferentes quando medidas nas mesmas condições. Esta observação
provém do fato de os eritrócitos fetais possuirem uma variante natural da hemoglobina A
(hemoglobina F, alfa2 gama2), enquanto que os eritrócitos maternos contém a
hemoglobina A (alfa2 beta2), normal em adultos.
a) Qual das hemoglobinas apresenta maior afinidade pelo oxigênio nas condições
fisiológicas? Explique.
b) Qual é o significado fisiológico das diferenças de afinidade? Explique.
Removendo-se cuidadosamente todo DPG de amostras de hemoglobina A e F,
verifica-se que as curvas de saturação pelo oxigênio (e consequentemente as afinidades) são
deslocadas, no gráfico, para o lado esquerdo. Nesta situação, hemoglobina A passa a ter
maior afinidade pelo oxigênio. Recolocando-se DPG, as curvas de saturação voltam ao
normal, como mostrado no gráfico acima. Pergunta-se:
c) Qual é o efeito de DPG na afinidade da hemoglobina pelo oxigênio?
d) Como as informações acima (relativas ao item c) podem explicar a razão das diferentes
afinidades apresentadas pela hemoglobina fetal e materna?
10. Seguindo as instruções abaixo, faça com papel um modelo aproximado da alfa-hélice:
a) Trace em papel milimetrado duas linhas paralelas separadas 1,8 cm uma da outra.
b) Na linha de baixo, a partir de origem marque pontos distantes 3 cm um do outro.
c) Na linha superior marque a origem 0,5 cm à frente da origem correspondente na linha
inferior. A partir da origem, marque pontos na linha superior distantes 3 cm um do outro.
d) Una os pontos correspondentes nas linhas superior e inferior, de tal modo a obter uma
série de paralelogramos.
e) Em cada paralelogramo trace três segmentos auxiliares:
(1) No lado menor da esquerda marque um ponto 0,3 cm abaixo do vértice esquerdo
superior. No lado menor à direita marque um ponto 0,3 cm acima do vértice inferior. Una
estes pontos.
(2) e (3) Trace segmentos paralelos aos lados menores que distem entre si 1 cm. Desta
forma o paralelogramo é dividido por estes segmentos em três terços iguais.
f) Escreva a letra C (Carbono) no encontro dos segmentos (1) e (2) e o N (Nitrogênio) no
encontro de (1) e (3).
g) No centro dos lados menores escreva Cα.
h) Una C α - C - N - C α - C - N - ....
i) Faça C = O para cima ao longo do segmento (2) e N - H para baixo ao longo de (3).
j) Dobre a tira de papel nas posições correspondentes aos lados menores e fixe as pontes de
hidrogênio N - H ... O = C com pequeno pedaço de fita adesiva, de tal forma a obter no
conjunto uma hélice.
11. Seguindo as instruções abaixo, faça com papel um modelo aproximado de um folha
pregueada beta com cadeias polipeptídicas antiparalelas:
a) Numa folha de papel sulfite com seus lados maiores em posição horizontal trace as linhas
auxiliares da maneira indicada abaixo.
b) Trace levemente linhas verticais distantes entre si 6 cm. A primeira linha à esquerda pode
distar 1 cm do lado menor.
c) Trace levemente pares de paralelas horizontais distantes 1,2 cm entre si. No primeiro par,
a linha superior deve distar 1 cm do lado maior superior da folha de papel. A paralela
inferior dista 1,2 cm da linha superior.
d) Abaixo 4,2 cm da linha inferior do primeiro par de paralelas trace a linha superior do
segundo par. Trace em seguida a linha inferior do segundo par.
e) Da mesma forma trace o terceiro e quarto pares de paralelas.
f) Com as verticais e os pares de paralelas você obteve uma série de retângulos medindo 1,2
cm (lado menor) por 6 cm (lado maior).
g) Na primeira série de retângulos (a série superior) escreva Cα no vértice superior esquerdo
do primeiro retângulo da esquerda. No vértice inferior direito escreva também Cα. Assim,
de forma diagonalmente oposta, vá escrevendo Cα na primeira série de retângulos.
h) Na segunda série de retângulos (uma abaixo da série superior) escreva Cα no vértice
inferior esquerdo do primeiro retângulo da esquerda. No vértice superior direito escreva
também Cα. Assim, de forma diagonalmente oposta, vá escrevendo Cα na segunda série
de retângulos.
i) Proceda com em (g) para escrever Cα na terceira série de retângulos.
j) Proceda como em (h) para escrever Cα na quarta série de retângulos.
k) Entre duas verticais (separadas de 6 cm) trace levemente duas outras verticais separadas
de 2 cm.
l) Agora, na primeira série de retângulos escreva C de forma diagonalmente aposta a Cα.
Diagonalmente oposto a C escreva N. Vá escrevendo C e N diagonalmente opostos.
m) Também, na segunda série de retângulos escreva N de forma diagonalmente oposta a Cα.
Diagonalmente oposto a N escreva C. Vá escrevendo N e C diagonalmente opostos.
n) Na terceira série de retângulos escreva C e N como em (l).
o) Na quarta série de retângulos escreva N e C como em (m).
p) Nos C (não em Cα) faça C = O (as ligações devem estar centradas em C e a 120o).
q) Nos N faça N - H (as ligações devem estar centradas em N e a 120o).
r) Estabeleça as pontes de hidrogênio entre as cadeias com os C = O e H - N próximos
(C = O --- H - N).
s) Dobre a folha de papel em zig-zag, vincando-a nas verticais que passam por Cα.
ENZIMAS
01. Segel, Biochemical Calculations, Capítulo 4, Problema 4-18. Um extrato bruto livre de
células contém 20 mg/ml de proteína. Uma alíquota de 10 µl (microlitros) deste extrato
em um volume total de reação standard de 0,5 ml catalisou a formação de 30 nmoles
(nanomoles) do produto em 1 min sob condições ótimas de ensaio (força iônica e pH
ótimos, concentrações saturantes de todos substratos, coenzimas, ativadores, etc.)
a) Expresse v em termos de nmoles x ml-1 x min-1, nmoles x litro-1 x min-1, µmoles
x litro -1 x min-1, M x min-1
b) Qual seria o valor de v se os mesmos 10 µl do extrato fossem ensaiados em um volume
total de 1,0 ml?
c) Em termos de unidades/ml, qual é a concentração da enzima na mistura de ensaio e no
extrato?
d) Qual é a atividade específica da preparação?
02. Rawn, Biochemistry, Capítulo 7, Problema 1. A acetilcolinesterase (uma esterase)
catalisa a hidrólise da acetilcolina:
acetilcolina + H2O
→
colina + acido acetico
a) Escreva a reação catalisada usando fórmulas estruturais e indique na estrutura da
acetilcolina a ligação que é clivada. A enzima é inativada por DFP (diisopropilfluorofosfato).
b) Qual é o resíduo de aminoácido que provavelmente está no sítio ativo da esterase?
c) Como poderia ser identificado o resíduo modificado?
d) Qual é o provável papel deste resíduo no mecanismo da catálise?
03. Wood et al., Biochemistry: A Problems Approach, Capítulo 7, Problema 7-7 (Resolver
numericamente; não graficamente). Os dados da tabela abaixo foram obtidos para uma
reação enzimática (volume final 10 ml), usando-se o seguinte procedimento:
A fim de se estudar a dependência da velocidade de uma reação enzimática pela
concentração de substrato, uma quantidade constante de enzima foi adicionada a uma
série de tubos contendo diferentes concentrações de substrato. As velocidades iniciais da
reação foram determinadas medindo-se o número de moles (ou µmoles) de substrato
consumido (ou produto formado) por minuto. A tabela a seguir mostra as velocidades
iniciais fornecidas pelas respectivas concentrações de substrato:
[S] (moles/litro)
5,0 x 10-2
5,0 x 10-3
5,0 x 10-4
5,0 x 10-5
5,0 x 10-6
5,0 x 10-7
v (µmoles/min)
0,25
0,25
0,25
0,20
0,071
0,0096
Pergunta-se:
(a) Qual é a Vmax para esta concentração de enzima?
(b) Qual é o KM desta enzima?
(c) Verifique se esta reação segue uma cinética simples de Michaelis-Menten.
(d) Quais serão as velocidades iniciais para:
[S] = 1,0 x 10-6 M e [S] = 1,0 x 10-1 M?
(e) Calcule a quantidade total de produto formado durante os primeiros cinco minutos
quando a [S] = 2,0 x 10-3 M. É possível fazer o mesmo cálculo para uma
[S]=2,0x10-6 M?
(f) Suponha que a concentração de enzima em cada tubo foi aumentada por um fator de 4.
Quais são os valores de KM e Vmax? Neste caso, qual é o valor de v para
[S] = 5,0x10-6 M?
04. Stryer, Biochemistry, 2a. ed., Capítulo 6, Problema 2. A penicilinase, uma enzima
presente em algumas bactérias resistentes, hidrolisa penicilina tornando-a inativa. O P.M.
desta enzima em Staphylococcus aureus é 29.600. Mediu-se em função da concentração
de penicilina, a quantidade deste antibiótico que foi hidrolisada em 1 min em 10 ml de
uma solução que continha 10-9 g de penicilinase purificada. Considere que a
concentração de penicilina não se altera apreciavelmente durante o ensaio:
Penicilina
(moles/litro)
0,1 x 10-5
0,3 x 10-5
0,5 x 10-5
1,0 x 10-5
3,0 x 10-5
5,0 x 10-5
Quantidade hidrolisada
(moles)
0,11 x 10-9
0,25 x 10-9
0,34 x 10-9
0,45 x 10-9
0,58 x 10-9
0,61 x 10-9
(a) Projete 1/v versus 1/[S] para estes dados. Há indicação de que a penicilinase segue uma
cinética de Michaelis-Menten? Em caso afirmativo, qual é o valor de KM?
(b) Qual é o valor de Vmax?
(c) Qual é o valor do número de transformação (turnover) da penicilinase nestas condições
experimentais? (Considere um centro ativo por molécula de enzima)
05. Faça o gráfico da velocidade de uma reação enzimática em função do pH, admitindo-se
que a enzima seja estável de pH 3 a 12, o substrato não contém grupos ionizáveis e a
catálise depende da presença no centro ativo de: (a) uma carboxila (pKa = 5)
desprotonada, (b) um grupo amina (pKa = 9) protonado, e (c) uma carboxila (pKa = 5)
desprotonada e um grupo amina (pKa = 9) protonado.
06. Stryer, Biochemistry, 2a. ed., Capítulo 6, Problema 3. Foram efetuadas medidas
cinéticas para uma enzima na ausência e na presença de inibidor ([I] = 2 x 10-3 M, fixa).
As velocidades iniciais correspondentes às várias concentrações de substrato estão
indicadas na tabela abaixo:
[S] M
0,3 x 10-5
0,5 x 10-5
1,0 x 10-5
3,0 x 10-5
9,0 x 10-5
Pergunta-se:
Velocidade (µmol/min)
sem inibidor
com inibidor
10,4
4,1
14,5
6,4
22,5
11,3
33,8
22,6
40,5
33,8
(a) Quais são os valores de Vmax e KM na ausência de inibidor? E na sua presença? (b)
Qual é o tipo de inibição? (c) Qual é a constante de dissociação do complexo enzimainibidor? Compare com o valor de KM.
07. Stryer, Biochemistry, 2a ed., Capítulo 6, Problema 4. Foram efetuadas medidas cinéticas
para a enzima discutida no exercício anterior na presença de um inibidor diferente
([I] = 10-4 M, fixa):
[S] M
0,3 x 10-5
0,5 x 10-5
1,0 x 10-5
3,0 x 10-5
9,0 x 10-5
Velocidade (u mol/min)
sem inibidor
com inibidor
10,4
2,1
14,5
2,9
22,5
4,5
33,8
6,8
40,5
8,1
Pergunta-se:
(a) Quais são os valores de Vmax e KM na presença deste inibidor? (b) Qual é o tipo de
inibição? (c) Qual é a constante de dissociação do complexo enzima-inibidor?
CARBOIDRATOS
01. Stryer, Biochemistry, 3a ed., Capítulo 14, Problema 1. Indique se cada um dos seguintes
pares consiste de anômeros, epímeros ou par aldose-cetose:
a) D-gliceraldeido e dihidroxiacetona
b) D-glicose e D-manose
c) D-glicose e D-frutose
d) α-D-glicose e β-D-glicose
e) D-ribose e D-ribulose
f) D-galactose e D-glicose
02. Gumport et al., Student’s Companion to Stryer’s Biochemistry, Capítulo 14, Self-Test,
Problema 3. Examine as cinco seguintes estruturas de açúcares.
Indique através das letras representativas os açúcares que:
a) contêm ou são pentoses
b) contêm ou são cetoses
c) contêm os mesmos monossacarídeos
dê o nome destes
monossacarídeos
d) fornecem diferentes açúcares por hidrólise enzimática ou química da ligação glicosídica
e) são redutores
f) contêm um carbono β anomérico
g) sofrem mutarrotação
h) é sacarose
i) correspondem aos que são liberados na digestão do amido
03. Lehminger, Principles of Biochemistry, Capítulo 11, Problema 1. Interconversão das
formas de D-galactose.
Uma solução recém-preparada da forma α (1g/ml em um tubo polarimétrico de 1 dm)
mostra uma rotação óptica de + 150,7o. Quando deixada em repouso por um longo
período de tempo a rotação decresce gradualmente até atingir um valor de equilíbrio
igual a + 80,2o. Em contraste, uma solução recém-preparada (1g/ml) da forma β mostra
rotação ótica de apenas +52,8o . Quando esta solução é deixada em repouso por várias
horas a rotação aumenta até o valor de equilíbrio igual a +80,2o , valor idêntico àquele
observado para a α-D-galactose.
a) Escreva as fórmulas de projeção de Haworth das formas α e β da D-galactose. Qual
característica distingue as duas formas?
b) Por que a rotação de uma solução recém-preparada da forma α decresce gradualmente
com o tempo? Explique por que soluções das formas α e β (de concentrações iguais)
atingem o mesmo valor de rotação óptica no equilíbrio? Explique.
c) Calcule a composição percentual das duas formas de galactose no equilíbrio.
04. Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo 11, Structure
and Properties of Monosaccharides, Study Questions and Problems, Problema 7. Frutose,
o principal açúcar do mel, é comumente usada como adoçante de alimento. Este açúcar
na forma β-D-piranose é provavelmente a substância mais doce conhecida. A forma β-Dfuranose é muito menos doce.
Quais são as estruturas da β-D-frutopiranose e β-D-frutofuranose?
A doçura do mel diminui ao deixá-lo em repouso e ao mesmo tempo aumentando a
temperatura. Explique.
05. Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo 11, Covalently
Bonded Monosaccharides: Disaccharides and Polysaccharides, Study Questions and
Problems. Problema 1. Conhecendo-se as fórmulas de projeção de Haworth da maltose,
lactose e sacarose, identifique em cada uma delas a ligação glicosídica. Quais são os
produtos quando cada dissacarídeo é hidrolisado em presença de ácido? Escreva as
estruturas dos monossacarídeos.
06. Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo 11, Covalently
Bonded Monosaccharides: Disaccharides and Polysaccharides, Study Questions and
Problems. Problema 2. Uma amostra de dissacarídeo corresponde ou lactose ou sacarose.
A amostra fornece resultado negativo no teste para se verificar se o dissacarídeo é
redutor. Entretanto, o mesmo teste dá resultado positivo se a amostra é antes tratada com
ácido diluído e aquecida. A amostra desconhecida corresponde a lactose ou a sacarose?
Explique.
07. Lehninger, Principles of Biochemistry, Capítulo 11. Problema 7. Comparação entre
celulose e glicogênio. A Celulose, praticamente pura obtida das fibras que envolvem as
sementes do algodão, é resistente, fibrosa e completamente insolúvel em água.
Diferentemente, o glucogênio extraído de fígado ou músculo dispersa-se facilmente em
água quente formando uma solução turva. Embora eles tenham propriedades físicas
marcadamente diferentes, as duas substâncias são compostas por moléculas de D-glicose
polimerizadas através de ligações 1 → 4 e têm pesos moleculares comparáveis.
Quais características estruturais são responsáveis por estas propriedades tão diferentes
dos dois polissacarídeos?
Quais as vantagens biológicas de suas respectivas propriedades físicas?
08. Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo 11,
Glycoproteins: Hybrid Molecules of Carbohydrate and Protein, Problema 1. A figura
abaixo mostra uma unidade repetitiva da molécula de uma glicoproteína.
Escreva a fórmula de projeção de Haworth desta unidade, assumindo-se que os
monossacarídeos são ligados por ligação glucosídica β1 → 4.
09. Van Eikeren, Guide to Lehninger’s Principles of Biochemistry, Capítulo 11, Self-Test,
Problema 13. A porção de natureza sacarídica de algumas glicoproteínas pode servir
como sítio de reconhecimento celular. Para desempenhar esta função, os oligossacarídeos
ou glicoproteínas devem ter a capacidade de formar um grande número de diferentes
estruturas. Qual dos dois pode produzir uma maior variedade de estruturas:
oligopeptídeos compostos de cinco resíduos de diferentes aminoácidos ou
oligossacarídeos compostos de cinco resíduos de diferentes monossacarídeos? Explique.
10. Stryer, Biochemistry, 3a ed. Capítulo 14, Problema 7. Supõe-se que uma unidade
trissacarídica de uma glicoproteína de uma superfície celular desempenha um papel
crítico em promover a adesão célula-célula em um determinado tecido. Planeje um
experimento simples para testar esta idéia.
LIPÍDEOS e MEMBRANAS
01. Lehninger, Princípios de Bioquímica, Capítulo 12, Problema 1. Ponto de fusão dos
ácidos graxos. Os pontos de fusão de uma série de ácidos graxos de 18 átomos de
carbono são: ácido esteárico (69,9oC), ácido oléico (13,4oC), ácido linoléico (-5oC) e
ácido linolénico (-11oC). Que aspecto estrutural destes ácidos graxos de 18 carbonos
pode ser correlacionado com o ponto de fusão? Forneça uma explicação molecular para
esta tendência do ponto de fusão.
02. Lehninger, Princípios de Bioquímica, Capítulo 12, Problema 13. Fluidez e função da
membrana. Uma hipótese central, na área da pesquisa de membranas, é que os lipídeos
de membrana devem ser fluídos (em oposição a "congelados") a fim de que a membrana
possa desempenhar suas funções. O apoio para esta hipótese é fornecido pela observação
de que a composição de ácido graxo das membranas pode ser alterada pelas condições
nas quais a bactéria cresce. Por exemplo, se a bactéria está crescendo em temperatura
menor que a normal, as quantidades observadas de ácidos graxos insaturados (relativas
ao conteúdo de ácido graxo saturado) estão acima do normal.
Contrariamente, se a bactéria está crescendo em temperatura acima da normal, as
quantidades observadas de ácidos graxos insaturados nos lipídeos da membrana
(relativas aos ácidos graxos saturados) estão abaixo do normal.
(a) Sugira razões por que o conteúdo lipídico na membrana bacteriana deve ser fluido para
que a membrana intacta opere apropriadamente.
(b) Explique como a alteração observada nos níveis dos ácidos graxos insaturados relativa
aos níveis dos ácidos graxos saturados, em diferentes temperaturas de crescimento, apóia
a hipótese da fluidez da membrana.
03. Rawn, Biochemistry, Capítulo 9, Problema 1. Seja uma bicamada lipídica sintética
formada apenas de fosfatidato, na qual as duas cadeias hidrofóbicas correspondem ao
ácido graxo saturado C18, ácido esteárico. Considere que a esta bicamada foram
impostas as seguintes mudanças:
(a) substituição de metade das cadeias hidrofóbicas por outras cadeias hidrofóbicas derivadas
de C18, nas quais ocorrem uma insaturação de configuração cis (entre C9 e C10).
(b) Adição de íons Ca2+ à solução que contém a bicamada.
Em ambos os casos, faça uma previsão a respeito da temperatura de transição de fase.
04. Stryer, Biochemistry, 2a. ed., Capítulo 10, Problema 1 Quantas moléculas de
2
fosfolipídeo existem em 1 µm da região da membrana em bicamada de fosfolipídeo?
Considere que a molécula de fosfolipídeo ocupa 70 Å2 de área.
05. Rawn, Biochemistry, Capitulo 9, Problema 3. Qual é a força ("driving force") que dirige
a formação de bicamadas fosfolipídicas?
06. Lehninger, Principles of Biochemistry, Capítulo 4, Problema 9. O pH e a absorção de
drogas. A droga aspirina, intensamente receitada, é um ácido fraco com um pKa de 3,5.
a) Escreva por fórmulas estruturais a ionização reversível da aspirina.
A aspirina é absorvida para o sangue através das células de revestimento do estômago e
do intestino delgado. Para uma substância ser absorvida ela deve atravessar facilmente a
membrana celular. A passagem através da membrana celular é determinada pela
polaridade da molécula: moléculas iônicas (carregadas) e moléculas altamente polares
passam lentamente, enquanto aquelas neutras e hidrofóbicas passam rapidamente. Como
o pH do suco gástrico é cerca de 1 e o pH no intestino delgado, cerca de 6, pergunta-se:
b) Onde a aspirina é mais absorvida para a corrente sanguínea, no estômago ou no intestino
delgado? Justifique claramente a sua escolha.
07. Rawn, Biochemistry, Capítulo 9, Problema 2. Forneça uma explicação termodinâmica
para o fato de que moléculas de fosfolipídeo difundem rapidamente no plano da
bicamada, mas muito lentamente mudam de uma face à oposta.
08. Stryer, Biochemistry, 3a. ed., Capítulo 12, Problema 5. R.D. Kornberg e H.M.
McConnell (1971) pesquisaram a difusão transversa (flip-flop) de fosfolipídeos em uma
membrana em bicamada usando um análogo paramagnético da fosfatidilcolina chamado
fosfatidilcolina marcada com marcador de spin. (Procure a fórmula estrutural deste
marcador de spin no Stryer).
O grupo nitróxido (NO) em uma fosfatidilcolina marcada com marcador de spin fornece
um espectro de ressonância paramagnética eletrônica característico. Este espectro
desaparece quando nitróxidos são transformados em hidroxilaminas por agentes
redutores, tal como o ascorbato.
Vesículas de lipídeos contendo fosfatidilcolina (95%) e o análogo marcado (5%) foram
preparadas por sonicação e purificadas por cromatografia de filtração em gel. O diâmetro
externo destes lipossomos mediu cerca de 25Å. A amplitude do espectro de ressonância
paramagnética eletrônica decresceu a 35% do seu valor inicial em poucos minutos após a
adição de ascorbato. Não houve nenhuma mudança detectável no espectro poucos
minutos após a adição de uma segunda alíquota de ascorbato. Entretanto, a amplitude do
espectro residual decai exponencialmente com uma meia-vida de 6,5 h.
Como você interpreta estas mudanças na amplitude do espectro paramagnético?
09. Campbell, Biochemistry, Capítulo 16, Problema 15. Por que, ao invés de na forma livre,
o colesterol é transportado na corrente sanguínea na forma empacotada? (Ler no
Campbell, no Capítulo 11, o tópico "Receptores de Membrana" e, no Capítulo 16, o
tópico "O Papel do Colesterol em Doenças do Coração". Ler no Stryer, no Capítulo 23,
os tópicos "Colesterol e outros Lipídeos são transportados a Alvos Específicos por
Lipoproteínas", "O Receptor da Lipoproteína de Baixa Densidade (LDL) desempenha
um papel importante no controle do Metabolismo do Colesterol", "O Receptor da LDL é
uma Proteína Transmembrânica com cinco domínios funcionalmente diferentes" e "A
ausência do Receptor de LDL leva a Hipercolesterolemia e a Aterosclerose").
10. Campbell, Biochemistry, Capítulo 11, Problema 8. Que tipo de resíduos de aminoácidos
é mais provável se encontrar no sítio de ligação do receptor da LDL? Dê uma razão para
sua resposta.
TERMODINÂMICA APLICADA ÀS REAÇÕES BIOQUÍMICAS
01. Wood et al., Biochemistry: A Problems Approach, Capítulo 9, Problema 9-4. O ∆Go’
para a hidrólise do ATP a ADP + Pi é -7,3 Kcal/mol.
a) Calcule a constante de equilíbrio para esta reação. No equilíbrio há mais ADP que ATP ou
o inverso?.
b) Na célula, esta reação está no equilíbrio?
02. Wood et al., Biochemistry: A Problems Approach, Capítulo 9, Problema 9-5. No interior
da célula é, em geral, o ∆G' para a hidrólise do ATP mais negativo ou menos negativo
que o ∆Go’? Por quê?
03. Stryer, Biochemistry, 3a edição, Capítulo 13, Problema 5. A formação de Acetil CoA a
partir de Acetato é um processo dependente de ATP:
Acetato + ATP + CoA
Acetil CoA + AMP + PPi
a) Calcular o ∆Go' da reação acima, sabendo-se que os ∆Go' de hidrólise do Acetil CoA a
Acetato é -7,5 Kcal/mol e do ATP a AMP e PPi é -7,3 Kcal/mol.
b) Sabendo que nas células o PPi formado é rapidamente hidrolisado a 2Pi por uma
pirofosfatase inorgânica (∆Go'= -8 Kcal/mol), discuta o efeito da hidrólise do PPi na
formação de Acetil CoA a partir de Acetato.
04. Stryer, Biochemistry, 3a edição, Capítulo 13, Problema 4. Dados os ∆Go' de hidrólise de
glicose-6-fosfato e glicose-1-fosfato, respectivamente -3,3 Kcal/mol e -5,0 Kcal/mol,
calcule:
a) O ∆Go' da isomerização de glicose-6-fosfato a glicose-1-fosfato.
b) No equilíbrio, qual é a razão entre as concentrações de glicose-6-fosfato e de glicose-1fosfato?
c) Em que condições celulares a isomerização referida no item (a) poderia produzir
continuamente e em alta velocidade a glicose-1-fosfato?
05. Stryer, Biochemsitry, 3a edição, Capítulo 13, Problema 1. Discuta em que sentido
ocorrem as reações abaixo, quando os reagentes estão presentes inicialmente em
quantidades equimolares
a) ATP + creatina
creatinafosfato + ADP
b) ATP + glicerol
glicerol-3-fosfato + ADP
c) ATP + piruvato
fosfoenolpiruvato + ADP
d) ATP + glicose
glicose-6-fosfato + ADP
∆Go' de hidrólise
creatinafosfato
-10,3 Kcal/mol
glicerol-3-fosfato
- 2,2 Kcal/mol
fosfoenolpiruvato
-14,8 Kcal/mol
glicose-6-fosfato
- 3,3 Kcal/mol
ATP a ADP
- 7,3 Kcal/mol
06. Van Eikeren, quide to Lehninger's Principles of Biochemistry, Capítulo 14, Self-Test,
Problema 1. Considere um ecossistema que consiste de um ovo e uma chocadeira. A
clara e a gema do ovo contêm proteínas, carboidratos e lipídeos. Se fertilizado, o ovo
transforma-se de uma simples célula em um organismo complexo. Discuta este processo
irreversível em termos de variações de entropia que se verificam no sistema, vizinhanças
e universo. Esteja certo de que, antes de mais nada, você tenha definido claramente o
sistema e as vizinhanças.
INTRODUÇÃO AO METABOLISMO
01. Considerar o mapa metabólico simplificado apresentado em classe e responder:
(a) Quais são os passos irreversíveis que aparecem no mapa?
(b) Qual é o primeiro composto comum que aparece na degradação de proteínas, lipídeos e
carboidratos?
(c) Animais de laboratório foram submetidos a dietas compostas exclusivamente de
carboidratos, ou lipídeos, ou proteínas. Analisar em que caso haveria sobrevivência,
verificando se é possível sintetizar:
ácido graxo a partir de glicose
proteína a partir de glicose
glicose a partir de ácido graxo
proteína a partir de ácido graxo
glicose a partir de proteína
ácido graxo a partir de proteína
Em cada caso afirmativo, indicar a via utilizada
02. Que compostos um indivíduo deve obrigatoriamente receber na dieta? Utilizar apenas as
informações do mapa metabólico simplificado.
03. Glicose é utilizada como fonte de energia para a célula, ou organismo com a finalidade
de produzir ATP. O excesso de glicose pode ser convertido em gordura. O esquema
simplificado abaixo mostra estas duas possibilidades:
Discuta:
a) Neste esquema, quais são as possíveis reações catalisadas por enzimas alostéricas?
b) Como funciona o esquema acima quando há disponibilidade de muita glicose?
c) O substrato B pode dar origem a dois produtos diferentes. Faça os gráficos de velocidade
em função da concentração de B para cada uma das enzimas.
d) Quando houver pouca disponibilidade de B qual seu caminho preferencial? Por quê?
04. Lehninger, Principles of Biochemistry, Capítulo 13, Problema 5. Comparação entre via
catabólica e via anabólica. A interconversão de glicose a frutose-1,6-difosfato, uma série
muito importante de etapas no metabolismo de carboidratos, é mostrada abaixo. A
quebra da glicose constitui a via catabólica, enquanto a biossíntese de glicose a partir de
frutose-1,6-difosfato corresponde a via anabólica. Ambas as vias usam as mesmas
hexoses monofosfato intermediárias. Embora estas vias tenham semelhanças, elas
apresentam diferenças básicas. A finalidade deste exercício é reconhecê-las.
a) Esquematize a reação balanceada para cada passo na via catabólica. Escreva a equação
líquida que resulta quando soma-se os passos individuais.
b) Repita o item (a) para a via anabólica.
c) Baseado nas equações líquidas, quais são as diferenças que podem ser notadas entre as
vias catabólica e anabólica? As duas vias são simplesmente o reverso uma da outra?
d) O que assegura o sentido das reações individuais no catabolismo da glicose? Ou seja, o
que impede que no catabolismo da glicose passe a ocorrer por vias reversas?
e) Nas vias catabólica e anabólica, a interconversão de glicose e glicose-6-fosfato poderia ser
catalisada pela mesma enzima? Explique. A interconversão de glicose-6-fosfato e
frutose-6-fosfato nas vias catabólica e anabólica poderia ser catalisada pela mesma
enzima? Explique
GLICÓLISE
01. Stryer, Biochemistry 3a edição, Capítulo 15, Problema 3. Escreva a equação balanceada
para a conversão da Glicose a Lactato.
a) Calcule a variação de energia livre padrão desta reação usando os dados apresentados na
tabela 15-2 do capítulo 15 do Stryer (3a edição) e levando em conta que o ∆Go' para a
reação Piruvato + NADH + H+ → Lactato + NAD+, é igual a -6 Kcal/mol
b) Qual é a variação de energia livre (∆G', não ∆Go’) para esta reação quando as
concentrações de reagentes e produtos são:
Glicose
Lactato
ATP
5 mM
0,05 mM
2 mM
ADP
Pi
0,2 mM
1 mM
02. Stryer, Biochemistry, 3a edição, Capítulo 15, Problema 2. Glicose marcada com 14C em
C-1 é incubada com as enzimas da glicólise e os cofatores necessários. Qual é a
distribuição de 14C no Piruvato que é formado? (Considerar que a interconversão entre
Gliceraldeído 3-fosfato e Dihidroxiacetona fosfato é muito rápida comparada com o
passo subsequente).
03. Discutir a regulação da via glicolítica em função da relação ATP/ADP.
04. Em relação a via glicolítica:
a) Verificar os compostos que apresentam ligações tipo: fosfoenol, anidrido fosfórico e éster
fosfórico e identificar aqueles que são compostos ricos em energia
b) Indicar as reações de oxidorredução
c) Dizer como é regulada a via glicolítica e citar as enzimas e seus moduladores
d) Mostrar os passos irreversíveis que fazem parte do mapa
e) Determinar quantas moléculas de Ácido Pirúvico se formam a partir de uma molécula de
hexose
05. Rawn, Biochemistry, Capítulo, 12, Problema 14. Uma pessoa incapaz de executar
exercícios físicos intensos e prolongados teve suas enzimas analisadas. Todas as enzimas
da via glicolítica estavam em concentração normal, com excessão da fosfoglicerato
mutase muscular.
a) Como será afetada a produção de energia metabólica em uma célula que apresenta baixos
níveis desta enzima?
b) Como será afetada a produção de Lactato na ausência desta enzima? [Referência: Di
Mauro, S.; Miranda, A.F.; Kahn, S.; Gitlin, K. - Human muscle phosphoglycerate mutase
deficiency Science 212: 1277-1279, 1981].
β-OXIDAÇÃO DE ÁCIDOS GRAXOS
01. Carnitina é amplamente distribuída nos tecidos, mas atinge concentração elevada no
músculo. O que sugere este dado?
02. Cite os compostos que devem ser fornecidos para a manutenção da espiral de Lynen.
03. Compare a oxidação de 3 Glicose → Acetil-CoA, com a oxidação de Ácido Láurico
(12C) a Acetil-CoA, quanto a:
a) Número de moléculas de Acetil-CoA formadas
b) Liberação de CO2
c) Gasto em ATP
d) Saldo de ATP
e) Número de moléculas de NADH ou FADH2 formadas
f) Coenzimas e vitaminas envolvidas
g) Localização celular
04. Indique o caminho percorrido pelos carbonos do Glicerol na sua transformação a Acetil
CoA.
CICLO DE KREBS
01. Quando uma preparação de mitocôndrias (convenientemente tratada) é incubada com
Acetil-CoA, verifica-se que para cada mol de Acetil-CoA adicionado formam-se dois
moles de CO2 e que a velocidade de formação de CO2 (µl de CO2/min) tem um valor A
qualquer.
a) Quando se adiciona Acetil-CoA + Succinato, observa-se que a velocidade da produção de
CO2 aumenta e o aumento de CO2 produzido excede a quantidade de Succinato
adicionado, ou seja, o efeito do Succinato é catalítico.
Discuta as observações acima.
b) O que aconteceria se a incubação fosse feita na presença de Acetil-CoA + Succinato +
Malonato?
02. Como os intermediários do ciclo de Krebs poderiam ser repostos se houvesse intensa
síntese de Ácido Aspártico e Glutâmico às custas dos intermediários do ciclo de Krebs?
03. A carboxilase pirúvica é estimulada alostericamente por Acetil-CoA. Discuta a
importância deste fato para o metabolismo energético.
04. Mostre como o ciclo de Krebs e a glicólise podem ser reguladas pela isocitrato
desidrogenase.
05. Por que um esquimó com dieta deficiente em carboidratos estaria nutricionalmente
melhor comendo alimentos com lipídeos contendo ácidos graxos com número ímpar de
átomos de Carbono ao invés de número par?
CADEIA RESPIRATÓRIA
01. A relação entre energia livre de uma reação e o potencial redox é:
∆Go' = -nF∆Eo' onde n é o número de elétrons transferidos
F é a constante de Faraday
(F = 23.060 cal V-1)
∆Eo' é o potencial padrão da dupla redox.
Utilizar esta relação para calcular os pontos da cadeia respiratória onde a energia
"liberada" na reação de transferência de elétrons poderia ser usada para a síntese de um
composto rico em energia, aproximadamente +7300 cal/mol.
02. A uma solução 1 M de NAD+, NADH, Piruvato e Lactato, adicionou-se lactato
desidrogenase:
Lactato + NAD+ ↔ Piruvato + NADH + H+
Eo' (NAD+/NADH) = -0,32 V
Eo' (Piruvato/Lactato) = 0,19 V
a) Em que sentido a reação ocorrerá?
b) À medida que a reação ocorre, como variam esses potenciais redox?
c) Quando a reação atingirá o equilíbrio? Qual o valor do potencial redox (∆E) nessa
situação?
03. Citar as consequências dos seguintes fatores para o funcionamento da cadeia respiratória
e da fosforilação oxidativa:
a) Presença de KCN ou CO
b) Carência de Pi
c) Carência de ADP
d) Presença de DNP (dinitrofenol)
e) Carência de Pi e/ou ADP em presença de DNP
f) Presença de oligomicina
g) Presença de oligomicina + DNP
04. Uma droga X inibe o consumo de O2 e a síntese de ATP em uma suspensão de
mitocôndrias. Que tipo de droga deveria ser adicionada para se determinar o modo de
ação da droga X?
05. Calcular o número de moléculas de ATPs formadas na oxidação total de:
I. glicose (uma molécula)
II. ácido palmítico (16C) (uma molécula)
a) Qual seria o destino da energia não armazenada sob a forma de ATP?
b) Qual seria o resultado na presença de dinitrofenol?
06. Discutir o funcionamento do ciclo de Krebs, beta-oxidação e via glicolítica em uma
suspensão de células hepáticas na presença dos seguintes compostos:
antimicina, oligomicina, dinitrofenol, antimicina + dinitrofenol e oligomicina +
dinitrofenol.
Justificar.
07. A membrana externa da mitocôndria é permeável à maioria dos solutos de baixo peso
molecular. A membrana interna, entretanto, possui seletividade, sendo impermeável por
exemplo a coenzimas, nucleotídeos, etc. De posse dessas informações responder as
seguintes indagações:
a) Como os acil-CoA produzidos após ativação dos ácidos graxos podem ser degradados na
β-oxidação?
b) Como o NADH produzido na via glicolítica pode ser reoxidado na cadeia respiratória?
c) Como o ATP produzido na cadeia respiratória pode ser utilizado nas biossínteses que
ocorrem no citoplasma?
08. Um microorganismo aeróbico facultativo é cultivado em meio líquido glicosado com
aeração e sem aeração. Em qual das duas culturas o consumo de glicose pelas células é
maior? Justificar a resposta em termos de regulação metabólica.
09. Aceita-se que a oxidação de NADH ao nível de cadeia respiratória produz, em média, 3
ATP. É conhecido que existem "sítios" de produção de ATP (quais?). Discutir a relação
estequiométrica e a existência de "sítios" à luz da teoria do acoplamento quimiosmótico.
VIA DAS PENTOSES
01. Pode-se considerar, para efeito de melhor compreensão, que a via das pentoses constituise de um ramo oxidativo (transformação irreversível de glicose-6-fosfato a pentoses) e de
um ramo não oxidativo (transformação reversível de pentoses a frutose-6-fosfato e
gliceraldeído-3-fosfato). Partindo-se de glicose-6-fosfato e considerando-se estes dois
ramos, pede-se indicar como podem ser obtidos os seguintes intermediários quando uma
determinada célula deles necessite em grandes quantidades:
a) ribose-5-fosfato
b) ribose-5-fosfato e NADPH
c) NADPH
02. Experimentos com glicose-6-fosfato marcada com isótopo radioativo (14C) no C1 ou no
C6 indicam quanto do substrato inicial é metabolizado pela via das pentoses e quanto é
metabolizado pela ação combinada da glicólise e ciclo de Krebs. Uma alíquota do
homogenato do tecido em estudo é incubada com glicose-6-fosfato com 14C no C1 e
outra, com o mesmo substrato com 14C no C6. Que resultado deve ser esperado, em
termos de produção de 14CO2 em função do tempo, se o homogenato metaboliza
glicose-6-fosfato:
a) Somente pela ação combinada da glicólise e ciclo de Krebs,
b) Somente pela via das pentoses, e
c) Pelas duas vias simultaneamente
03. Discutir as condições em que deverá haver predomínio de uma das vias (glicólise ou via
das pentoses) no metabolismo da glicose. Citar os tecidos onde a via das pentoses é mais
ativa.
04. Esquematizar o catabolismo da glicose na hemácia enfatizando:
a) O destino do lactato
b) A função do NADPH
A hemácia é uma célula aeróbica? Ela utiliza o oxigênio transportado pela
hemoglobina?
05. Ler o Stryer, no cap. referente a Via das Pentoses, o tópico: "A deficiência de glicose-6fosfato desidrogenase causa anemia hemolítica induzida por droga".
BIOSSÍNTESE DE ÁCIDOS GRAXOS
01. Escrever a equação de síntese de ácido palmítico (16C) a partir de Acetil-CoA.
02. Comparar a beta-oxidação com a biossíntese de ácidos graxos no complexo
multienzimático quanto a:
a) Localização celular
b) Coenzimas envolvidas e suas vitaminas
c) Carregador de grupo acila
d) Forma em que as unidades de carbono são removidas ou adicionadas
03. Comparar a degradação de ácido palmítico até acetil-CoA com sua síntese a partir de
acetil-CoA quanto a necessidade de:
a) ATP
b) Coenzimas
04. Discutir a regulação da síntese de ácidos graxos em função da relação ATP/ADP
05. A síntese de triglicerídeos requer glicerol-3-fosfato, mas o tecido adiposo não possui a
enzima glicerol quinase. Como os adipócitos obtém esse composto essencial para a
estocagem de ácidos graxos ?
06. Verificar em quais das seguintes situações haverá estímulo da formação de corpos
cetônicos:
a) Dieta rica em carboidratos e normal em lipídeos
b) Jejum
c) Dieta rica em lipídeos e normal em carboidratos
d) Diabetes
07. Em caso de jejum prolongado o cérebro passa a oxidar também corpos cetônicos, além
de glicose, como fonte de energia. Citar as enzimas que o cérebro deve sintetizar nessa
adaptação metabólica.
08. Citar as vias de produção e de utilização de acetil-CoA pela célula.
09. Explicar com base na regulação de enzimas alostéricas o fato de uma dieta rica em
carboidratos promover o acúmulo de lipídeos.
NEOGLICOGÊNESE
01. O hepatócito pode reverter a transformação de glicose em piruvato apesar de haver três
reações irreversíveis na glicólise. Em cada uma dessas etapas, comparar as reações no
sentido glicose → piruvato e piruvato → glicose, quanto às enzimas, reagentes, produtos
e coenzimas.
02. Lactato produzido pelo músculo e pelas hemácias pode ser utilizado pelo fígado para
convertê-lo novamente em glicose. Calcular o número de moléculas de ATP, por
molécula de glicose, necessário a essa conversão.
03. Lehninger, Princípios de Bioquímica. Capítulo, 20, Problema 4. Quais são os efeitos de
concentração crescente de ATP e AMP nas atividades catalíticas de frutose difosfatase e
fosfofrutoquinase? Quais são as consequências destes efeitos do ATP e AMP no fluxo
relativo dos metabolitos através da neoglicogênese e da glicólise?
04. Lehninger, Princípios de Bioquímica, Capítulo 20, Problema 5. Um procedimento
comum para determinação da efetividade de compostos como precursores da glicose é
colocar um animal em jejum até que os estoques de glicogênio do fígado sejam
depletados e então administrar o substrato em questão. Um substrato que leva a um
aumento líquido no glicogênio hepático é chamado de glicogênico pois ele deve primeiro
ser convertido em glicose-6-fosfato. Mostre por meio de reações enzimáticas conhecidas
quais das seguintes substâncias são glicogênicas:
(a) succinato, (b) glicerol, (c) acetil CoA, (d) piruvato e (e) butirato.
Escreva as fórmulas estruturais das substâncias relacionadas de (a) a (e).
05. Lehninger, Princípios de Bioquímica, Capítulo 20, Problema 6. As concentrações de
lactato no plasma sanguíneo, antes, durante e depois de uma corrida de 400 metros serão
mostradas no gráfico concentração de lactato sanguíneo versus tempo, a ser fornecido
durante a aula. (Ver no livro).
(a) O que provoca a rápida elevação na concentração do lactato?
(b) O que provoca o declínio do nível do lactato depois do término da corrida? Por
que o declínio ocorre mais lentamente de que a elevação?
(c) Por que a concentração do lactato não é zero durante o estado de repouso?
SÍNTESE E DEGRADAÇÃO DO GLICOGÊNIO
01. Esquematizar simplificadamente a estrutura da molécula do glicogênio indicando os
terminais não redutores, redutor e pontos de ramificação e mostrar as ações das seguintes
enzimas envolvidas na degradação do polissacarídeo a glicose-6-fosfato:
(a) fosforilase, (b) transferase (enzima de desramificação), (c) α-1,6-glicosidase, (d)
fosfoglicomutase
02. Lehninger, Princípios de Bioquímica, Capítulo 20, Problema 9. Escrever a sequência e a
reação global requeridas para calcular o custo em número de moléculas de ATPs
necessárias para a conversão de glicose-6-fosfato citoplasmática em glicogênio e deste
de volta a glicose-6-fosfato. Que fração do número máximo de ATPs, que é disponível
do catabolismo completo da glicose-6-fosfato, este custo representa?
03. Lehninger, Princípios de Bioquímica, Capítulo 20, Problema 10. Uma amostra de tecido
de fígado foi obtida "post-mortem" do corpo de um paciente, o qual acreditava-se ser
geneticamente deficiente em uma das enzimas do metabolismo de carboidratos. Um
homogenato da amostra do fígado mostrou as seguintes características:
1. Degradou glicogênio a glicose-6-fosfato
2. Foi incapaz de sintetizar glicogênio a partir de qualquer açúcar mais simples, ou
utilizar galactose como fonte de energia, e
3. Sintetizou glicose-6-fosfato a partir de lactato.
Qual das três enzimas seguintes é deficiente?
(a) glicogênio fosforilase, (b) frutose difosfatase, (c) UDP-glicose pirofosforilase
Fornecer razões para sua escolha
04. Nível alto de insulina no sangue indica que o organismo está bem nutrido (período logo
após a refeição). Nível baixo, por outro lado denota estado de jejum. Glucagon age de
maneira oposta à de insulina. Adrenalina tem ação semelhante à do glucagon.
Relacionar estas afirmações com o papel destes hormônios na síntese e degradação do
glicogênio.
05. Existem várias doenças relacionadas com alterações no metabolimo do glicogênio.
Nestas doenças certas enzimas são produzidas em forma defeituosa, ou em quantidade
deficientes ou mesmo não são produzidas.
Indicar, nos casos assinalados, na sequência das reações metabólicas, o passo que é
afetado e o que isto implica na síntese e/ou degradação do glicogênio.
nome da doença
enzima deficiente
Von Gierke
glicose-6-fosfatase
Cori
α-1,6-glicosidase
McArdle
fosforilase de músculo
Andersen
enzima ramificadora
METABOLISMO DE AMINOÁCIDOS
01. Esquematizar as reações que permitem a síntese da maioria dos aminoácidos a partir de
NH3, alfa-cetoglutarato e alfa-cetoácidos correspondentes. Discutir as implicações da
reversibilidade das reações.
02. Lehninger, Princípios de Bioquímica, Capítulo 19, Problema 6. Os três átomos de
carbono no lactato e alanina tem estados de oxidação idênticos, e animais podem usar
qualquer um deles como combustível metabólico. Comparar o rendimento líquido de
ATP (moles de ATP por mol de substrato) para a oxidação completa (a CO2 e H2O) de
lactato versus alanina quando o custo de excreção de nitrogênio como uréia é incluído.
03. A alanina desempenha um papel importante no transporte de amônia para o fígado, numa
forma não tóxica. A amônia produzida no músculo e outros tecidos, principalmente pela
degradação de aminoácidos, torna-se o alfa-amino grupo da alanina e desta forma é
transportada do músculo (e outros tecidos) para o fígado através da corrente sanguínea.
No fígado, a alanina perde o amino grupo que é eliminado como uréia. O esqueleto
carbônico da alanina é convertido em glicose, que volta através da corrente sanguínea ao
músculo. Esta interrelação entre músculo e fígado é chamada ciclo da alanina-glicose.
Esquematize o ciclo da alanina-glicose. Identifique as vias metabólicas envolvidas em
células de músculo e fígado.
04. Lehninger, Princípios de Bioquímica, Capítulo 9, Problema 4. Uma criança de dois anos
de idade foi levada ao hospital. Sua mãe indicou que ela vomitava frequentemente,
especialmente após as refeições. O peso da criança e o seu desenvolvimento físico eram
abaixo do normal. Seus cabelos, embora escuros, continham porções de cabelos brancos.
Uma amostra de urina tratada com cloreto férrico (FeCl3) apresentou cor verde
característica da presença de ácido fenilpirúvico. A análise quantitativa de amostras de
urina apresentou os resultados mostrados na tabela abaixo:
Substância
Paciente
Normal
(mmol/l)
(mmol/l)
Fenilalanina
7,0
0,01
Fenilpiruvato
4,8
0
Fenilactato
10,3
0
a) Sugerir a enzima que possa estar deficiente. Propor um tratamento para esta condição.
b) Por que a fenilalanina aparece na urina em grandes quantidades?
c) Qual é a fonte de fenilpiruvato e do fenilactato? Por que estas vias (normalmente não
funcionais) entram em ação quando a concentração de fenilalanina se eleva?
d) Por que o cabelo da paciente apresenta porções brancas?
05. Analisar as consequências, para o metabolismo geral, de uma dieta calórica normal e
contendo proteínas de baixo valor biológico (proteína com baixo conteúdo em
aminoácidos essenciais).
Definir balanço de nitrogênio. O que significa balanço de nitrogênio negativo, zero e
positivo?
AÇÃO HORMONAL
01. Lehninger, Princípios de Bioquímica, Capítulo 25, Problema 3. Baseados nas suas
propriedades físicas, os hormônios caem em duas categorias; aqueles que são muito
solúveis em água mas relativamente insolúveis nos lipídeos, por exemplo, a adrenalina, e
aqueles que são relativamente insolúveis em água mas altamente solúveis nos lipídeos,
por exemplo, os hormônios esteroídicos. Na sua função de reguladores da atividade
celular, a maioria dos hormônios hidrossolúveis não penetram no interior das células dos
tecidos-alvo. Os hormônios lipossolúveis, por outro lado, penetram nas células-alvo e
finalmente atuam no núcleo. Qual é a base para a correlação entre solubilidade, a
localização dos receptores e o modo de ação destas duas categorias de hormônios?
02. Lehninger, Princípios de Bioquímica, Capítulo 25, Problema 4. Na década de 50, Earl
Sutherland e seus colegas realizaram experimentos pioneiros para elucidar o mecanismo
de ação da adrenalina e do glucagon. À luz da nossa atual compreensão da ação
hormonal interprete cada um dos seus experimentos descritos abaixo. Identifique os
componentes e indique o significado dos resultados.
a) A adição da adrenalina a um homogeneizado ou preparação de células rompidas do fígado
normal resulta num aumento da atividade da glicogênio fosforilase. Entretanto, se o
homogeneizado for primeiro centrifugado numa alta velocidade e a adrenalina ou o
glucagon adicionados à fração sobrenadante límpida, nenhum aumento na atividade da
sua fosforilase é observado.
b) Quando a fração particulada, sedimentada de um homogeneizado do fígado por
centrifugação é preparada e tratada com adrenalina, uma nova substância é produzida.
Esta substância foi isolada e purificada. Ao contrário da adrenalina, esta substância ativa
a glicogênio fosforilase quando adicionada à fração sobrenadante do homogeneizado.
c) A substância formada pela fração particulada era estável ao calor; isto é o tratamento com
calor não impedia sua capacidade de ativar a glicogênio fosforilase (Dica: seria este o
caso se a substância fosse uma proteína?). A substância era idêntica a um composto
obtido quando ATP puro era tratado com hidróxido de bário.
03. Lehninger, Princípios de Bioquímica, Capítulo 25, Problema 7. Durante uma situação de
"lutar ou correr", a liberação de adrenalina promove a degradação do glicogênio no
fígado, coração e músculo esquelético. O produto da degradação do glicogênio no fígado
é a glicose. Ao contrário, o glicogênio do músculo esquelético é degradado pela
glicólise:
a) Por que produtos diferentes são observados na degradação do glicogênio nestes dois
tecidos diferentes?
b) Qual é a vantagem para o organismo durante uma condição de "lutar ou correr", de se ter
estas vias específicas de degradação do glicogênio?
04. Lehninger, Princípios de Bioquímica, Capítulo 25, Problema 8. Certos tumores malignos
do pâncreas provocam uma excessiva produção de insulina pelas células B. Tais
pacientes apresentam calafrios e tremores, fraqueza e fadiga, sudorese e fome. Se esta
condição se prolongar ocorre lesão cerebral. Qual é o efeito do hiperinsulinismo no
metabolismo dos carboidratos, aminoácidos e lipídeos do fígado? Quais são as causas
dos sintomas observados? Sugira por que esta condição, se prolongada leva a lesão
cerebral?
INTEGRAÇÃO METABÓLICA
01. Os nutrientes absorvidos no trato intestinal passam diretamente ao fígado (com excessão
de uma grande parte de triacilgliceróis). Por este grande centro de distribuição, açúcares,
aminoácidos e aluguns lipídeos são processados e distribuídos aos outros órgãos e
tecidos. Propor um mapa metabólico unificado, integrando as principais vias destes
nutrientes neste órgão.
02. Ao contrário do músculo esquelético, o músculo cardíaco deve trabalhar constante e
ritmicamente. O que torna possível, a nível de metabolismo e características da célula
cardíaca, esta adaptação para o trabalho constante?
03. Lehninger, Princípios de Bioquímica, Capítulo 24, Problema 14. O glicerol-3-fosfato é
um intermediário chave na biossíntese dos triacilgliceróis. As células adiposas, que são
especializadas na síntese e degradação dos triacilgliceróis, não podem usar o glicerol
diretamente devido à falta da gliceroquinase, que catalisa a reação:
Glicerol + ATP → Glicerol-3-fosfato + ADP
Como o tecido adiposo obtém o glicerol-3-fosfato necessário para a síntese do
triacilglicerol? Explicar.
04. Lehninger, Princípios de Bioquímica, Capítulo 24, Problema 20. Pacientes com
deficiência de tiamina exibem um conjunto de sinais neurológicos característicos: perda
dos reflexos, estado de ansiedade e confusão mental. Sugira uma razão por que a
deficiéncia de tiamina é manifestada na função cerebral.
05. A tabela (a ser fornecida na sala de aula) indica vários efeitos da deficiência de insulina
(Diabetes mellitus) no metabolismo. Para cada um dos ítens compare com uma situação
em que o organismo foi submetido a jejum severo.
(Ver tabela 25-6 do Lehninger, Princípios de Bioquímica, Capítulo 25).
06.Van Eikeren , Guide to Lehninger’s Principles of Biochemistry, Capítulo 26 (Nutrição
Humana), Challenge Problems, Problema 19.
Acidose láctica e hipoglicemia em dependentes de álcool.
Pessoas que consomem muita bebida alcoólica desenvolvem níveis sangüíneos não
normal e baixo em glicose (hipoglicemia), maior do que o normal de ácido láctico
(acidose láctica suave) e ainda apresentam cetose. Explique.
QBQ-211
BIOQUÍMICA: ESTRUTURA DE BIOMOLÉCULAS
e METABOLISMO
1996
LABORATÓRIOS: I, II, III, IV, V e VI
QBQ-211 - 1996 - LABORATÓRIO I
TITULAÇÃO E CROMATOGRAFIA DE AMINOÁCIDOS
Identificação de um aminoácido através de cromatografia em papel e de titulação.
OBJETIVOS
01. Execução de cromatografia em papel e de titulação
02. Identificação de um aminoácido através de seu Rf e de seus pKas
03. Comparação da curva de titulação de um aminoácido com a de um ácido fraco
monoprótico
04. Verificação do pH de diversos fluidos biológicos mais comuns (de origem vegetal e
animal) e não biológicos, conforme mostrado na figura 2-15 do Rawn, Biochemistry, pg
39 e na figura 4-9 do Lehninger, Principles of Biochemistry, pg 77.
FUNDAMENTOS
As unidades constituintes das proteínas são os L α-aminoácidos. Como o próprio
nome indica, estes compostos em suas moléculas apresentam pelo menos um grupo amina
(-NH2) e um grupo carboxílico (-COOH). Em consequência deste fato, ao serem dissolvidos
em água, os aminoácidos apresentam caráter anfotérico, ou seja comportam-se como ácido e
como base. Os grupos amina e carboxila podem sofrer protonações e desprotonações
reversíveis, isto é comportam-se como eletrólitos fracos. Se os considerarmos em suas
formas de ácidos conjugados: -NH+3 e -COOH, veremos que cada um deles apresentará um
valor de pKa. Assim, um aminoácido apresenta pelo menos dois valores de pKa e
dependendo da natureza ionizável ou não do grupo R ligado ao carbono alfa, pode ocorrer ou
não um terceiro valor de pKa.
Em pH 7,0 e no estado sólido, o amino grupo apresenta-se protonado (forma ácida) e
o grupo carboxila desprotonado (forma básica).
Neste experimento utilizaremos um processo de separação de aminoácidos baseado
na polaridade dos grupos R de cadeia lateral e que determina a preferência do aminoácido
por uma fase líquida polar ou apolar, isto é sua partição entre duas fases. A água que hidrata
a celulose, principal constituinte do papel, constitui a fase polar, neste caso a fase
estacionária, enquanto que o solvente orgânico que migra pelo papel por capilaridade
constitui a fase apolar, neste caso a fase móvel. Assim, quanto mais apolar for o grupo R,
maior a mobilidde do aminoácido com a fase móvel e o seu Rf maior . O Rf é dado pela
relação entre a distância percorrida pelo aminoácido no papel e a distância percorrida pela
fase móvel. A Tabela I apresenta valores de Rf de alguns aminoácidos.
Através da cromatografia em papel identificaremos um aminoácido desconhecido em
comparação com quatro outros conhecidos e por isso denominados de aminoácidos-padrão.
Com ajuda da Tabela I e dos valores de pKa obtidos na titulação, confirmaremos a
identidade do aminoácido.
TABELA I
Rf de vários aminoácidos determinados nas seguintes condições:
solvente de Partridge, n-butanol/ácido acético glacial/água (4:1:1),
papel Whatman no 1 e temperatura 20oC
Aminoácido
Rf
Aminoácido
Rf
Cys
0,08
Ala
0,38
Lys
His
Arg
Asp
Gly
Ser
Glu
Thr
0,14
0,20
0,20
0,24
0,26
0,27
0,30
0,35
Pro
Tyr
Trp
Met
Val
Phe
Ile
Leu
0,43
0,45
0,50
0,55
0,60
0,68
0,72
0,73
TABELA II
Aminoácido
Glu
Lys
Gly
His
Cys
Thr
Asn
Ala
Leu
Pro
pKa
2,19
4,25
9,67
2,18
8,95
10,53
2,34
9,6
1,82
6,0
9,17
1,71
8,33
10,78
2,62
10,43
2,02
8,80
2,30
9,70
2,36
9,60
1,99
10,60
PROCEDIMENTO
1. CROMATOGRAFIA EM PAPEL
Tomar uma folha (23 x 16 cm) de papel Whatman no 1 e fazer um traço a lápis ao
longo do comprimento maior a 2 cm da borda. Evitar tocar no papel durante toda a operação.
Deixar uma margem de 1,5cm de cada lado.Marcar seis pontos sobre essa linha que distem 4
cm um do outro e numerá-los a lápis de 1 a 6. As amostras devem ser aplicadas nos pontos
numerados com auxílio de um capilar de tal modo que a mancha formada sobre o papel seja
a menor possível. Nos números de 1 a 4 aplicar os padrões e no número 6, a mistura de
padrões. A amostra desconhecida é aplicada no número 5. Enrolar o papel de modo a
transformá-lo em um cilindro e prender as extremidades superiores com clip. Colocar 25 ml
de solvente de Partridge (n- butanol/ácido acético glacial/água 4:1:1) em uma placa de Petri
e mergulhar o cilindro de papel em seu interior de modo que este fique perfeitamente na
vertical. Evitar que o papel toque na parede da placa. Cobrir o sistema com um béquer de 2
litros e deixar o solvente migrar 10 cm. Retirar o papel e marcar imediatamente a linha de
frente do solvente. Secar o papel na capela, mergulhar em solução 0,1% de ninhidrina em
acetona e levar á estufa (80oC-100oC) por alguns minutos. Delimitar com lápis as manchas
que aparecem no papel. Determinar o Rf dos padrões e do aminoácido desconhecido.
2. TITULAÇÃO
Colocar 50 ml da solução do aminoácido (0,10 M) em pH 1,0 em um béquer e titular
com solução 0,5 M de KOH medindo o pH após cada adição de 1 ml até atingir pH 11,0.
Colocar 50 ml de ácido acético 0,15 M em outro béquer e titular com solução 0,5 M
de KOH medindo o pH após cada adição de 0,5 ml até pH 12,0.
ANÁLISE DOS RESULTADOS E DISCUSSÃO
CROMATOGRAFIA E TITULAÇÃO
01. Comparar seus valores de Rf para os aminoácidos padrão com os valores da TABELA I.
Discutir a respeito das possíveis causas de discrepâncias.
02. Fazer um gráfico de titulação do aminoácido com base. Estimar os valores de pKas e
comparar estes valores obtidos para o aminoácido desconhecido com aqueles da
TABELA II.
Fazer o gráfico de titulação do ácido acético.
Comparar as curvas de titulação do aminoácido e do ácido fraco.
03. Identificar seu aminoácido desconhecido, escrever sua estrutura e suas sucessivas
ionizações verificadas ao se aumentar o pH.
MEDIDA DO pH DE ALGUNS FLUÍDOS BIOLÓGICOS OU NÃO E COMPARAÇÃO DOS
VALORES OBTIDOS COM AQUELES APRESENTADOS NA FIGURA 2-15 DO LIVRO DO RAWN
OU FIGURA 4-9 DO LIVRO DO LEHNINGER
Selecionar alguns fluidos, com os quais não haja problemas de manipulação e medir
seu pH. Eventualmente com auxílio de uma pipeta Pasteur adicionar uma vez, HCl gota a
gota e outra vez, KOH. Observar a resistência ou não à variação do pH.
QBQ-211 - 1996 - LABORATÓRIO II
ELETROFORESE EM PAPEL E DOSAGEM COLORIMÉTRICA DE
PROTEÍNAS
Identificação de proteínas através da eletroforese em acetato de celulose e
eletroforese de proteínas do soro humano na mesma matriz em tampão barbital-Tris pH =
8,6.
Determinação da concentração de uma proteína em solução aquosa através da
colorimetria.
OBJETIVOS
Execução de uma eletroforese em fita de acetato de celulose.
Identificação eletroforética de proteínas e identificação das classes de proteínas do
soro humano.
Previsão da direção de migração proteica em base aos pIs e ao pH da solução.
Montagem de um protocolo para construção de uma curva padrão para determinação
da concentração de proteínas pelo Método do Biureto.
FUNDAMENTOS
(I) ELETROFORESE
A eletroforese abrange todas as operações nas quais as moléculas carregadas migram
num campo elétrico através de soluções.
Dependendo da ausência ou presença de uma matriz rígida que sirva como suporte à
solução submetida a um campo elétrico, podem existir dois tipos de eletroforese:
Eletroforese em solução - O seu uso é limitado. Consiste em se efetuar a operação
em tampão aquoso na ausência matriz-suporte. Esse sistema é vulnerável às pertubações
mecânicas (choques, correntes de convecção) o que leva à mistura das bandas em migração e
à consequente perda da resolução. As modificações introduzidas para a estabilização
mecânica do sistema não se constituem em refinamentos que possam permitir larga aceitação
deste método.
Eletroforese de zona - Os métodos eletroforéticos aqui englobados são mais
utilizados. Consiste basicamente em efetuar a operação com a solução mantida em uma
matriz rígida que a suporta (exemplos de matriz: papel, acetato de celulose, gel de
poliacrilamida, gel de agarose (poligalactose) e outras). Aqui o termo zona quer indicar que a
amostra submetida à eletroforese migra delimitando uma pequena região ou zona no suporte
(papel, fita de acetato de celulose ou gel). As perturbações mecânicas, neste caso não afetam
o sistema.
Os dois tipos de eletroforese são governados pela expressão:
constante
•
(voltagem aplicada) • (carga líquida)
Mobilidade =
(fricção molecular)
Assim a mobilidade de uma molécula numa solução aumenta com o aumento da
voltagem ou carga da molécula e diminui com o aumento da ficção. Esta última depende do
tamanho e da forma da molécula.
Macromoléculas, como as proteínas, podem ter suas mobilidades eletroforéticas
preditas pela expressão acima. Porém, efetuar esta previsão pode não ser muito simples
porque a forma da molécula influencia na fricção (moléculas filamentosas - um eixo
prepondera sobre o outro - têm menos mobilidade que moléculas esféricas). Também, a
carga de macromoléculas é bastante afetada pela presença de outros íons, além do H+. Estes
fatores ligados a forma e a carga podem dificultar a previsão da mobilidade para
macromoléculas.
Proteínas do soro humano - Quando se permite que uma amostra de sangue
coagule, obtem-se por centrifugação uma solução denominada soro.
Plasma é a solução obtida por centrifugação do sangue total na presença de anticoagulante.
A diferença entre plasma e soro reside no fato de que o primeiro contém, além das
proteínas do soro, fibrinogênio, fibrina e fatores de coagulação. Estas três últimas proteínas,
no plasma estão em solução.
As proteínas do plasma são classificadas em base ao comportamento eletroforético,
em seis categorias:
Classe
Porcentagem em relação
ao total de proteínas
Função/Natureza
Albumina
55
α1-Globulinas
5
Glicoproteínas e lipoproteínas HDL.
α2-Globulinas
9
Transportadoras de hemoglobinas livre
no plasma (haptoglobina), de Cu2+,
(ceruloplasmina) e Lipoproteínas
VDL.
β-Globulinas
13
Transportadores de Fe2+ (transferrina)
e Lipoproteínas LDL
Fibrinogênio
7
Formador do coâgulo
γ-Globulinas
11
Imunoglobulinas
Mantém a pressão osmótica.
Transportadora de ânions orgânicos
(ex. ânion dos ácidos graxos, de
fármacos (ex. aspirina).
A eletroforese de proteínas do soro é efetuada em papel de acetato de celulose
embebido de tampão barbital-Tris (as extremidades da fita mergulhadas no mesmo tampão)
em pH 8,6. Este pH é maior que os pIs de todas as proteínas normais (albumina e globulinas)
de tal forma que elas se apresentam negativamente carregadas e migram em direção ao
anodo (polo positivo). A albumina é a mais negativa e a γ-globulina, a menos negativa das
proteínas.
pH < pI
macromolécula
com carga
positiva
pI
pH > pI
macromolécula
com carga
negativa
As γ-globulinas são sintetizadas por uma classe especial de linfócitos e as outras
proteínas plasmáticas são produzidas pelo fígado. Desta forma, a análise do resultado da
eletroforese pode indicar uma possível doença hepática. De fato, a eletroforese de proteínas
do soro constitui-se numa análise clínica importante.
Para maiores esclarecimentos, inclusive fotos de fita onde foi corrida uma
eletroforese e sua respectiva densitometria, consultar o “Biochemistry: a case-oriented
approach” (The C.V. Mosby Company) 5a ed. autores: Montagomery, Conway e Spector
(pag. 67).
DOSAGEM DE PROTEÍNA POR COLORIMETRIA
A fotometria é frequentemente usada para se determinar a concentração de um
composto que absorve luz monocromática que está presente em solução. A lei de Lambert e
Beer permite afirmar que:
A = abc
ou seja, ao atravessar uma solução transparente, a fração de luz absorvida A é proporcional a
uma constante a (absortividade molar), à distância b atravessada pela luz na solução e à
concentração molar c. Modificando-se convenientemente a constante, a absorbância A pode
ser relacionada com a concentração em g/l.
A equação derivada da lei de Lambert e Beer indica que a projeção de A versus c,
mantida constante a distância b atravessada pela luz na solução, é uma reta que passa pela
origem.
Dispondo-se de tal projeção é possível, a partir de valores de A, determinar
graficamente as concentrações correspondentes. Neste procedimento o gráfico A versus c é
chamado curva padrão.
O Método do Biureto faz uso da propriedade de íons de Cu2+ em meio alcalino de
formar ligações com o nitrogênio das ligações peptídicas. Desta reação (reação de biureto)
resulta uma coloração púrpura intensa. Este fato pode ser explorado para se determinar
colorimetricamente a quantidade de proteínas em solução.
O Método do Biureto é mais apropriado para proteínas cujas soluções são incolores,
ou seja para proteínas não conjugadas (simples). A cor desenvolvida numa reação de íons de
Cu2+ em meio alcalino com estas proteínas deve-se unicamente às ligações peptídicas e a sua
intensidade é proporcional a quantidade de tais ligações. Deve-se lembrar que a quantidade
de ligações peptídicas é proporcional à massa da proteína em solução.
Reforçando o que foi dito acima, pode-se afirmar que esta reação, específica para
nitrogênios peptídicos, ocorre em igual extensão para uma dada massa proteica qualquer que
seja a natureza da proteína em solução.
PROCEDIMENTO
(1) Eletroforese
Retirar uma fita de acetato de celulose do banho de tampão (barbital-Tris pH 8,6).
(Atenção: Não manusear a fita, usar pinça). Secá-la entre duas folhas de papel de filtro.
Marcar com lápis o polo positivo e a partir dos pontos médios dos lados maiores demarcar a
origem com um traço muito leve. (Unir os pontos médios dos lados maiores).
Retornar a fita para o banho. Mergulhar, retirar e secá-la novamente.
Em seguida aplicar num ponto da origem uma pequena quantidade de mistura de
citocromo c e albumina bovina. Sobre um outro ponto da origem, aplicar a amostra de soro
humano. CUIDADO: as amostras de soro humano não estão testadas em relação a presença
de microorganismos patogênicos. USAR LUVA DE POLIETILENO PARA APLICAR AS
AMOSTRAS.
Montar as fitas no suporte da cuba de eletroforese com todos os polos positivos do
mesmo lado. Fechar a cuba de correr a eletroforese com 5mA/fita durante 60 minutos.
Desligar a corrente, mergulhar as fitas no corante Ponceau por 10 minutos e descorar
com ácido acético 5%.
Cuidados especiais
- Não tocar as fitas com a fonte da corrente contínua ligada.
- Prestar atenção para o fato de que uma das faces da fita de acetato de celulose
apresenta-se mais brilhante. Esta face, correspondente as costas da fita, contém uma película
de plástico não absorvente sobre o qual assenta-se a verdadeira matriz que suporta o tampão
e as amostras, o acetato de celulose. As amostras devem ser aplicadas na parte opaca (face de
acetato de celulose).
- Antes de levar a fita com as aplicações à cuba, fazer uma pequena marca que a
identifique como pertencente a um determinado grupo.
A mistura de proteínas contém:
pI
P.M.
Albumina de soro bovino
4,7
66.500
Citocromo c
10,7
13.000
Com base a estes dados prever a posição de cada uma dessas proteínas na fita ao final
da operação. Justificar.
Examinar o eletroforetograma das proteínas do soro humano. Compará-lo com o
resultado final da eletroforese de soro apresentado na literatura (p. ex. “Biochemistry: A
case-oriented approach”, The C.V.Mosby Company, 5a ed., autores: Montgomery, Conway,
e Spector, pág. 67).
3. DOSAGEM DE PROTEÍNA PELO MÉTODO DO BIURETO
Elaborar um protocolo para construir uma curva padrão, para a qual se utilizará uma
solução estoque de Albumina de concentração conhecida (8mg/ml) e 2,5 ml de Reagente de
Biureto, num volume final de 4,0ml por tubo.
Após a adição do reagente, agitar e incubar os tubos por 15 minutos a 37oC. Ler as
absorbâncias a 550 nm.
Construir um tubo a partir de 1,0ml de Albumina de concentração desconhecida,
adicionar Biureto, completar o volume final a 4,0ml, medir a Absorbância e determinar a
concentração desconhecida.
Agradecimento: As amostras de soro humano foram cedidas pelo Laboratório de
Análises Clínicas da FCFUSP. Agradecemos aos responsáveis por este Laboratório e em
especial à Profa.Dra. Ana Campa.
BIBLIOGRAFIA
01. Biochemistry: A Case-Oriented Approach, Montgomery, Conway e Spector, 5a ed.,
1990. The C.V. Mosby Company (Ver pág. 65).
02. Biochemistry for Medical Sciences, Danishlfsky, 1980. Little, Brown and Company (Ver
págs. 34, 40 e 469).
03. Experimental Biochemistry, Clark e Switzer, 2a ed., 1977. W.H. Freeman and Company.
04. Outlines of Biochemistry, Conn e Stumpf, 4a ed., 1976. John Wiley & Sons, Inc. (Ver
últimas págs. do livro, págs. 587 a 609 - Apêndice 2).
QBQ-211 - 1996 - LABORATÓRIO III
CINÉTICA ENZIMÁTICA
OBJETIVO
Estudar as influências das concentrações de enzima e de substrato na velocidade de
uma reação enzimática, examinar as curvas obtidas, obter alguns parâmetros cinéticos (Km e
Vmax) e discutir seus valores e importância.
INFORMAÇÕES GERAIS
A enzima escolhida para este estudo é a invertase de levedura que catalisa a hidrólise
da sacarose para produzir glicose e frutose.
C12H22O11 + H2O → C6H12O6 + C6H12O6
sacarose
glicose
frutose
A determinação da velocidade da reação (ou da atividade enzimática) pode ser feita
através da dosagem dos açúcares redutores formados (glicose e frutose). A dosagem baseiase na reação entre o ácido 3,5 dinitro-salicílico (DNS) e os açúcares redutores. Estes
monossacarídeos reduzem o DNS fornecendo um produto de cor característica, cuja
formação pode ser acompanhada a 540 nm.
Nestas experiências as velocidades da reação serão expressas em µmoles de sacarose
hidrolisada por minuto.
Conhecendo-se por colorimetria a quantidade (µmoles) de açúcares redutores
formada, por um cálculo estequiométrico simples, pode-se determinar a quantidade
correspondente (µmoles) de sacarose hidrolisada.
Para estudos de velocidade, o tempo de reação deve ser medido com a maior exatidão
possível. Para isso, o grupo deverá organizar-se de maneira a não permitir que a reação se
inicie em tempos diferentes nos vários tubos. Para tal, é importante manter os tubos em gelo
durante a adição dos reagentes. Esses devem ser adicionados na ordem em que aparecem nos
protocolos, com a enzima sendo adicionada por último. Leva-se então os tubos, todos juntos,
ao banho a 37oC para reagir. Transcorrido o tempo determinado , os tubos devem voltar
todos juntos, simultaneamente, para o gelo. Aí a reação pára.
PROCEDIMENTO
1) Curva Padrão
Atenção: A curva padrão será fornecida na forma de um xerox do gráfico A540 versus
µmoles de sacarose hidrolisada.
A finalidade da curva padrão é relacionar valores de absorbância a 540 nm com
µmoles de sacarose hidrolisada.
Para construir a curva padrão utiliza-se seis tubos (180 x 20 mm), conforme indicado
abaixo, contendo volumes crescentes de solução padrão redutora (glicose 5,5 mM mais
frutose 5,5 mM), completando o volume em cada tubo para 2,0 ml com tampão. Como não
ocorrerá hidrólise de sacarose nos tubos de 1 a 5, pode-se acrescentar logo em seguida ao
tampão, o reagente DNS.
Tubos
B
1
2
3
4
5
Sol. padrão
redutora(ml)
0,2
0,4
0,6
0,8
1,0
Sol. tampão
pH 4,77(ml)
2,0
1,8
1,6
1,4
1,2
1,0
Reagente
DNS (ml)
2,0
2,0
2,0
2,0
2,0
2,0
A540
Sacarose hidrolisada
(µmoles)
0,000
0,00
Após a adição do DNS, colocar os tubos em banho-maria fervente por dez minutos.
Findo este tempo, esfriar em água corrente e adicionar 16 ml de água destilada.
HOMOGENEIZAR e ler as absorbâncias a 540 nm (A540) contra o branco (tubo B).
Construir um gráfico A540 versus µmoles de sacarose hidrolisada (curva padrão).
2) Efeito da CONCENTRAÇÃO DA ENZIMA
Numerar sete tubos de ensaio (180 x 20 mm) e adicionar os reagentes segundo o
protocolo abaixo:
TUBOS NO GELO
Tubos
B
1
2
3
4
5
6
Sacarose
5% em
tampão
1,0
1,0
1,0
1,0
1,0
1,0
1,0
Tampão
pH 4,77
(ml)
Sol.
Enzima
(ml)
Conc. de
Enzima
Micromolar
A540
Sacarose
hidrolisada por
min(µmoles/min)
1,0
0,9
0,7
0,5
0,3
0,1
-
0,1
0,3
0,5
0,7
0,9
1,0
0,00
0,000
0,00
Após a adição da enzima, agitar suavemente. Retirar os tubos de uma temperatura de
o
0 C e colocá-los simultaneamente em banho-maria a 37oC. MARCAR o tempo inicial.
Incubar a 37oC por 5 minutos. Transcorrido este tempo, os tubos devem voltar
imediatamente para o gelo. Assume-se que nesse instante a reação pára. Ainda no gelo,
adicionar a cada tubo 2 ml de DNS. Na presença de DNS, devido à alcalinidade do reagente,
a enzima em pH muito alto, pára de funcionar. Transferir os tubos para banho-maria fervente
e esperar 10 minutos. Findo este tempo, esfriar em água corrente e adicionar 16 ml de água
destilada em cada tubo. AGITAR com inversão da posição na vertical (3 vezes). Ler as
absorbâncias a 540 nm.
Fazer um gráfico colocando a concentração da enzima microM nas abcissas e nas
ordenadas a velocidade de hidrólise expressa em µmoles de sacarose hidrolisada por minuto.
Durante a aula de laboratório será fornecido valor da concentração da enzima
(microM) na solução estoque.
3) Efeito da CONCENTRAÇÃO DE SUBSTRATO
Numerar sete tubos de ensaio (180 x 20 mm) e adicionar os reagentes segundo o
protocolo a seguir:
TUBOS NO GELO
Tubos
B
1
2
3
4
5
6
Sacarose
5% em
tampão
0,05
0,1
0,3
0,5
0,7
1,0
Tampão
pH 4,77
(ml)
Sol.
Enzima
(ml)
Conc. de
Substrato
Milimolar
A540
Sacarose
hidrolisada por
min(µmoles/min)
1,5
1,45
1,40
1,20
1,0
0,8
0,5
0.5
0,5
0,5
0,5
0,5
0,5
0,5
0,00
0,000
0,00
Proceder EXATAMENTE como no caso do estudo do efeito da concentração da
enzima (ítem anterior).
Fazer um gráfico da velocidade (µmoles de sacarose hidrolisada/min.) versus
concentração inicial do substrato (mM de sacarose). Estimar os valores de Vmax e Km.
Fazer o gráfico de Lineweaver e Burk e calcular os valores de Vmax e Km.
Comparar o valor de Km com o encontrado na literatura.
ANÁLISE DOS RESULTADOS E DISCUSSÃO
1). Discutir curvas obtidas para:
a) efeito da concentração da enzima
b) efeito da concentração de substrato
2). Elaborar um protocolo para estudar o efeito do pH sobre a atividade enzimática.
Consultar na biblioteca:
1. The enzymes, Boyer (editor) (1971) vol. 5, cap. 10
2. Técnicas e Experimentos de Bioquímica, Villela, Bacila e Tastaldi, (1973) cap. 4, pags
222 a 232.
3. Asare-Brown, E. and Bullock, C., Simple Practical Investigations Using Invertase,
Biochem.Educ. (1988), 16, 98-100.
QBQ 211 - 1996 - LABORATÓRIO IV
LIPOSSOMOS e LIPOPEROXIDAÇÃO EM UM MODELO DE
MEMBRANA
OBJETIVOS
1. Ilustrar o uso de lipossomos como modelo de membrana.
2. Incorporar um marcador colorido (azul de metileno, AM) em lipossomos de asolecitina e
separar AM incorporado de AM extralipossomal por diálise.
3. Observar um dos efeitos deletéricos da lipoperoxidação em membranas.
FUNDAMENTOS
Lipossomos
Membranas biológicas cumprem inúmeras funções: organizam moléculas em
diferentes compartimentos, limitam microambientes adequados para funções vitais e
controlam o transporte de várias substâncias. Visando uma simplificação estrutural e
química das membranas naturais foram propostos diversos sistemas-modelo de membrana.
Lipídeos extraídos de membranas podem ser utilizados para a preparação de diversos
sistemas reconstituídos que permitem reproduzir, de forma selecionada e simplificada,
alguns dos fenômenos que ocorrem em membranas naturais (1). Lipossomos são
constituídos por múltiplas bicamadas concêntricas de fosfolipídeos (2) e podem ser formados
por simples agitação de lipídeos em solução aquosa. Têm sido utilizados para se medir
permeação passiva de vários íons e moléculas (3). Como a maior parte do lipídeo está
presente na forma multilamelar, o volume sequestrado por mol de lipídeo (eficiência de
incorporação) é relativamente baixo em comparação com aquele de uma população
constituída por vesículas.
Neste experimento, vamos primeiramente incorporar o azul de metileno (AM) em
lipossomos de asolecitina. Estimaremos a porcentagem de incorporação usando a
propriedade do azul de metileno de absorver luz visível (660nm). Para isso eliminaremos a
turbidez das partículas lipossomais micelizando-as com um detergente. Numa segunda etapa,
como a asolecitina extraída de soja é especialmente rica em lipídeos com cadeias insaturadas
(4), os lipossomos de asolecitina serão utilizados para se observar um dos efeitos deletérios
da lipoperoxidação, o aumento de permeação do AM.
Lipoperoxidação
Várias evidências recentes sugerem que radicais livres (e/ou espécies ativas de
oxigênio) têm um importante papel em vários processos fisiológicos e patológicos (5,6).
Dentre esses pode-se citar a atividade microbicida das células do sistema imune, o
envelhecimento, a carcinogênese, a artrite reumatóide, as injúrias decorrentes de processos
de isquemia e reperfusão, a catarata, os efeitos terapêuticos e colaterais de drogas, etc (6).
Alguns dos efeitos deletérios de radicais livres parecem envolver lipoperoxidação das
membranas biológicas. Essas são frequentemente ricas em lipídeos insaturados e estão
banhadas por fluídos que contêm metais de transição e oxigênio. Tais condições favorecem a
peroxidação de lipídeos porque os íons metálicos ajudam a quebrar a regra da conservação
do spin que torna lenta as reações entre o oxigênio e moléculas orgânicas. A peroxidação de
lipídeos é um processo radicalar constituído por uma cadeia de reações com três estágios:
Iniciação, Propagação e Terminação.
Iniciação
LH → L • + H •
(1)
Propagação
Terminação
L • + O2 → LOO •
LOO • + LH → LOOH + L •
LOO • + L • → LOOL
LOO • + LOO • → LOOL + O2, etc
(2)
(3)
(4)
(5)
A iniciação da lipoperoxidação pode ser promovida por enzimas ou agentes
químicos. Dentre esses, estão os agentes redutores como a vitamina C (ácido ascórbico) em
presença de metais de transição, como Fe(III). O mecanismo pelo qual ascorbato e Fe(III)
complexado iniciam a peroxidação não está completamente elucidado mas parece envolver a
formação do radical hidroxila, uma espécie extremamente reativa (6). Obviamente,
processos enzimáticos que geram o radical hidroxila também podem iniciar a
lipoperoxidação. O radical hidroxila, ou outros radicais livres, podem abstrair um átomo de
hidrogênio da cadeia de ácido graxo, iniciando a cadeia de reações (eq 1-5) que resulta em
consumo de oxigênio, rearranjo das duplas nos lipídeos insaturados e, eventualmente,
destruição dos lipídeos com produção de uma série de produtos menores tais como aldeídos,
álcoois e hidrocarbonetos (Esquema 1). O malondialdeído, apesar de corresponder a apenas
5% do total de produtos dos lipídeos, tem sido um importante indicador de lipoperoxidação
em membranas biológicas porque forma um produto colorido com o ácido tiobarbitúrico
(TBA) que absorve intensamente a 535nm (ε = 1.56 x 105 M-1 cm-1) (Esquema 1).
Esquema 1: Representação esquemática da lipoperoxidação e de métodos analíticos
utilizados para detectá-la.
PROCEDIMENTO (7)
1) Determinação da porcentagem de incorporação.
Lipossomos 10mM serão obtidos por vortexação de asolecitina (L-α-fosfatidilcolina
de soja tipo IV - S, Sigma Chemical Company, grau comercial) em solução 0.2mM de azul
de metileno (AM).
Quatro alíquotas de lipossomos com azul de metileno (LAM) de 1.0 ml cada serão
submetidas a um processo de diálise em tubos de celofane contra água (2 l) sob agitação
constante com barra magnética (0.5h). Como controle, simultaneamente será dialisada uma
solução de azul de metileno 0.2mM (AM) (1.0 ml). Após a diálise, uma das quatro tripas
contendo lipossomos (LAM) será rompida para determinação da porcentagem da
incorporação, que é dada por:
A2c
A2
% incorporação = 100.
, onde,
A1c
A1
A1 e A2 são as absorbâncias a 660nm de uma alíquota de 0.2ml de LAM adicionada a 2ml
de água e 1 ml de TRITON X-100 (1%) antes e depois da diálise, respectivamente.
A1c e A2c são as absorbâncias a 660nm de uma alíquota de 0.2ml da solução de azul de
metileno 0.2mM (AM) adicionada a 2ml de água e 1ml de TRITON X-100 (1%) antes e
depois da diálise, respectivamente.
Os dados a serem obtidos estão sumarizados na Tabela I.
TABELA I
Diálise e determinação da porcentagem de incorporação de AM em lipossomos
de asolecitina
AMOSTRAS*
ABSORBÂNCIA 660nm
% DE INCORPORAÇÃO
ANTES DA
APÓS A
DIÁLISE
DIÁLISE
LAM
A1 =
A2 =
AM
A1c =
A2c =
*Note bem que as leituras de absorbâncias a 660nm são feitas em 0.2ml de amostra, 2ml de
água e 1ml de TRITON X-100.
Como branco pode-se usar 3ml de água destilada
2) Determinação da permeação de AM induzida pela lipoperoxidação
Para induzir a lipoperoxidação, utilizaremos o sistema ácido ascórbico/Fe3+/EDTA.
Em um tubo CONTROLE I (CI) adicionaremos uma das três tripas dialisadas contendo
lipossomos (LAM) e 9.0ml de água. Em outro tubo CONTROLE II (CII) adicionaremos
outra das três tripas, 7.0ml de água e 2.0ml de ácido ascórbico (AA) 10mM. No terceiro tubo
TESTE (T), coloca-se a terceira tripa, 5.0ml de água, 2.0ml de AA 10mM e 2.0ml de
Fe3+/EDTA 1mM. Os três tubos serão então incubados durante 0.5h a 40oC sob agitação.
Após esse período de incubação, será feita a leitura de absorbância a 660nm de alíquotas de
3ml de cada uma das soluções externas às tripas em CI, CII e T. As leituras de absorbância a
660nm devem preencher a Tabela II. Uma vez feitas as leituras, as alíquotas da solução
externa devem ser devolvidas aos respectivos tubos de origem e as tripas arrebentadas. O
conteúdo interno das tripas é recolhido junto com a solução externa.
Para determinar a extensão de lipoperoxidação, alíquotas de 1ml de CI, CII e T
serão adicionadas a 2ml do reagente TBA. Como BRANCO , será usado 1ml de água
adicionados a 2ml de TBA. As quatro amostras assim obtidas serão incubadas a 100oC
durante 15min. Após esfriar, serão lidas as absorbâncias a 535nm. Essas leituras permitem
preencher a Tabela III.
TABELA II
Permeação do azul de metileno induzida pela lipoperoxidação
SOLUÇÕES EXTERNAS
ÀS TRIPAS APÓS INCUBAÇÃO
A660
CONTROLE I (CI)
(água + LAM)
CONTROLE II (CII)
(água + ác. ascórbico + LAM)
TESTE (T)
(água + ác. ascórbico + Fe3+/EDTA + LAM)
TABELA III
Lipoperoxidação em lipossomos de asolecitina induzida pelo sistema ácido
ascórbico/Fe3+/EDTA.
VOLUME DA TBA*
AMOSTRA
A535 LIPOPEROXIDAÇÃO
(%)
AMOSTRA
(ml)
(ml)
água (BRANCO)
9.0 ml água + tripa c/ 1.0ml de
LAM (CONTROLE I) (CI)
7.0 ml água + tripa c/ 1.0ml de
LAM + 2.0ml de AA 10mM
(CONTROLE II) (CII)
5.0 ml água + tripa c/ 1.0ml de
LAM + 2.0ml de AA 10mM +
2.0 ml de Fe3+/EDTA 1mM
(TESTE) (T)
1
1
2
2
1
2
1
2
*TBA é uma solução contendo 1% do agente micelizante TRITON X-100, HCl 0.25M e
0.375% de ácido tiobarbitúrico.
ANÁLISE DOS RESULTADOS E DISCUSSÃO
01. Calcule a porcentagem de incorporação do AM em lipossomos de asolecitina. Use a
expressão fornecida.
02. O que se pode dizer da permeabilidade dos lipossomos de asolecitina ao azul de metileno
com os seus dados de diálise?
03. Calcule a porcentagem de lipoperoxidação de seus lipossomos nas diferentes condições
experimentais (CI, CII e T) às quais foram submetidos. Considere que o malondialdeido
corresponde a apenas 5% da lipoperoxidação total.
04. Discuta o efeito da lipoperoxidação sobre a permeação do azul de metileno através das
membranas lipossomais.
BIBLIOGRAFIA
01. Gomperts, D.D. (1977) - "The Plasma Membrane: Models for Structure and Function",
Academic Press (London).
02. Bangham, A.D.; Standish, M.M. e Watkins, J.C. (1965) - J. Mol. Biol. 13, 238.
03. Bangham, A.D.; de Gier, J. e Greville, G.D. (1967) - Chem. Phys. Lipids 1, 225.
04. Kagawa, Y. e Racker, E. (1966) - J. Biol. Chem. 241, 2467.
05. Meneghini, R. (1987) - A toxicidade do oxigênio, Ciência Hoje, 5, 57.
06. Halliwell, B. e Gutteridge, J.M.C. (1985) - Free Radicals in Biology & Medicine,
Claredon Press, Oxford.
07. Augusto, O. e Carmona-Ribeiro, A.M. (1989) - Introducing Model Membranes and
Lipoperoxidation, Biochemical Education 17(4), 209.
QBQ-211 - 1996 - LABORATÓRIO V
I - FRACIOAMENTO CELULAR E VERIFICAÇÃO DA ATIVIDADE DA
SUCCINATO DESIDROGENASE.
Fracionamento celular - Sacrificar um rato por concussão cerebral. Remover o
fígado, mergulhá-lo em 20 ml de uma solução de sacarose 0,25 M, previamente resfriada a
0o C e picá-lo bem com tesoura. Decantar a sacarose adicionar outros 20 ml e tornar
decantar. Adicionar 20 ml sacarose 0,25 M, também gelada. Homogeneizar o fígado e
centrifugar a 800 x g (4.000 rpm) por 10 minutos.
Decantar o sobrenadante e centrifugá-lo a 10.000 x g (10.000 rpm) por 30 minutos.
Decantar este precipitado. Recolher o sobrenadante em tubo de ensaio e conservá-lo no gelo.
Esta será a fração celular I.
VERIFICAÇÃO DA ATIVIDADE DA SUCCINATO DESIDROGENASE
O azul de metileno pode apresentar-se na forma oxidada (azul) ou reduzida (incolor).
A redução do azul de metileno pode ser obtida a partir da oxidação do succinato, catalisada
pela succinato desidrogenase. Seguir o protocolo 1. Para verificar a oxidação do succinato,
as frações devem ser incubadas a 37oC, por 10 minutos.
Antes de iniciar a experiência, o grupo deve:
1. escrever a reação que está sendo analisada;
2. discutir as funções de succinato, sacarose, azul de metileno e óleo mineral;
3. planejar o controle da experiência.
II - INIBIÇÃO DA SUCCINATO DESIDROGENASE POR MALONATO
Sabendo em que fração celular se encontra a atividade da succinato desidrogenase,
observe a inibição competititva da enzima por malonato, um processo historicamente
importante na elucidação das etapas de ciclo de Krebs. Você utilizará a redução do MTT via
succinato desidrogenase: o MTT é amarelo quando oxidado e violeta quando reduzido, não
sendo reoxidado pelo O2 do ar. Seguir o protocolo 2.
Deixe os tubos 10 minutos à temperatura ambiente e compare suas cores. Se a reação
estiver lenta (isto dependerá da sua preparação mitocondrial), aqueça os tubos a 37oC por
5 minutos e os compare novamente. NÃO ESQUEÇA, a inibição é competitiva, existe o
fator cinético e você deverá fazer as comparações ATENTAMENTE A CURTOS
INTERVALOS DE TEMPO.
III - DETERMINAÇÃO DO PONTO DE AÇÃO DE DROGAS NA CADEIA DE
TRANSPORTE DE ELÉTRONS.
Esta determinação deve ser feita com o uso de aceptores e doadores artificiais de
elétrons: a escolha dos aceptores e doadores artificiais de elétrons deve ser feita consultando
as tabelas que se seguem.
Os aceptores e doadores são fornecidos na forma oxidada, com exceção do reagente
p-fenilenodiamina.
PAR REDOX
NADH / NAD+
Succinato / Fumarato
FADH2 / FAD
Azul de Metileno red/ox
Cit b (Fe2+) / Cit B (Fe3+)
Cit c1 (Fe2+) / Cit c1 (Fe3+)
Cit c (Fe2+) / Cit c (Fe3+)
Cit a-a3 (Fe2+) / Cit a-a3 (Fe3+)
Eo'
-0,32
-0,03
0,00
0,01
0,06
0,22
H2O / 1/2 O2
0,82
ACEPTORES E DOADORES ARTIFICIAIS
Piocianina red/ox
2,6-diclorofenolindofeno (DCPI) red/ox
Benzil Viológeno red/ox
Ferricianeto Fe(CN)64-/Fe (CN)63p. fenilenodiamino (p-FDA) red/ox
Eo'
-0,34
0,20
-0,36
0,36
0,25
0,40
0,27
COR DOS ACEPTORES E DOADORES ARTIFICIAIS NAS FORMAS
REDUZIDA E OXIDADA.
Piocianina
2,6-diclorofenolindolenol
(DCPI)
Benzil violágeno
Ferricianeto
p-fenilenodiamino (p-FDA)
REDUZIDO
OXIDADO
incolor
incolor
azul
azul
VOLUME
UTILIZADO
0,1
0,3
incolor
incolor
incolor
violeta
amarelo
violeta
0,3
0,2
0,5
Seguir o protocolo 3
Incubar os tubos a 37oC por 10 minutos e discutir o resultado com os colegas, identificando
a droga A e B.
PROTOCOLO 1
TUBO
Tampão A
Sacarose 0, 7 M
Succinato 0,5 M
Azul de Metileno
Água Destilada
Fração Celular
Nujol
1
0,3 ml
1,0 ml
0,1 ml
1,5 ml
0,1 (I)
0,5 cm
2
0,3 ml
1,0 ml
0,1 ml
1,5 ml
0,1 (II)
0,5 cm
3
0,3 ml
1,0 ml
0,2 ml
0,1 ml
1,3 ml
0,1 (I)
0,5 cm
4
0,3 ml
1,0 ml
0,2 ml
0,1 ml
1,3 ml
0,1 (II)
0,5 cm
5
0,3 ml
1,0 ml
0,2 ml
0,1 ml
1,4 ml
0,5 cm
QBQ-211 - 1996 - LABORATÓRIO VI
TRANSAMINAÇÃO
OBJETIVO: Verificar a reação de transaminação em homogenato de fígado.
INTRODUÇÃO
A transaminação consiste na transferência reversível do grupo amino de um
aminoácido a um cetoácido sem que o grupo -NH2 ou -NH+3 fique livre no meio aquoso. O
aminoácido perde o grupo amino e se converte no cetoácido correspondente e o cetoácido
que ganha o grupo amino se converte no aminoácido respectivo.
As transaminases se econtram na maioria dos tecidos animais. Todos os aminoácidos
que fazem parte das proteínas participam em transaminações enzimáticas, com exceção da
lisina
Nesta experiência se identificarão os produtos de uma reação de transaminação por
meio de cromatografia em papel.
MÉTODO
Uma alíquota de um homogenato de fígado será incubada com um aminoácido e um
cetoácido. A identificação dos produtos da reação será feita por cromatografia em papel.
PREPARAÇÃO DO HOMOGENATO DE FÍGADO DE RATO
O Fígado de um rato é picado e lavado 2 vezes com 20 ml de tampão fosfato 0,05 M,
pH 7,4 e em seguida é homogeneizado com 10 ml deste tampão fosfato. Este homogenato é
centrifugado a 800 x g por 15 minutos para eliminar células não destruídas e núcleos. O
sobrenadante é decantado em um tubo de ensaio mantido em gelo e esta fração consiste na
preparação enzimática. Notar que não é necessária a enzima pura para que esta catalise a
reação.
REAÇÃO DE TRANSAMINAÇÃO
O sistema completo de reação é composto por um aminoácido, um cetoácido, a
preparação enzimática, arsenito de sódio (NaAsO2) e um tampão. O arsenito é empregado
com a finalidade de evitar a oxidação posterior dos cetoácidos pelo sistema enzimático
presente no hepatócito.
MISTURA DE REAÇÃO
α-cetoglutarato 0,2 M, pH 7,4 - 0,1 ml
Alanina 0,2 M, pH 7,4 - 0,1 ml
Prep. enzimática - 0,2 ml
Tampão fosfato 0,05 M, pH 7,4 - 0,2 ml
Arsenito de Sódio 0,2 M - 0,2 ml
Incubar a 37o C por 30 minutos. Em seguida colocar em banho-maria fervente por 3
minutos. Centrifugar por 10 minutos em centrífuga Eppendorf. Decantar o sobrenadante
transferindo para um segundo tubo Eppendorf e fazer a cromatografia com os padrões
adequados.
CROMATOGRAFIA
Em um papel de filtro Whatman no 1 (10x20 cm) traçar com lápis uma linha a 2,5 cm
da origem e marcar pontos com 2,5 cm de distância entre si. Colocar padrões de alanina,
glutamato, piruvato e α-cetoglutarato, mistura de reação, branco* e 2,4-dinitrofenilhidrazina.
Sobre os pontos onde foram aplicados o α-cetoglutarato, piruvato e mistura de reação,
adicionar uma aplicação capilar de 2,4-dinitrofenilhidrazina.
O solvente utilizado para a cromatografia será n-Butanol/Etanol/NH4OH (0,5N).
(70:20:30).
Após o solvente chega a 1 cm do final do papel, marcar a frente do solvente, secar o
papel, marcar as manchas amarelas dos produtos de reação da 2,4-dinitrofenilhidrazina e os
α-cetoácidos, e revelar o cromatograma com ninhidrina.
branco: mistura de apenas alanina e α-cetoglutarato.
*