Curso de Biomedicina
Artigo de Revisão
RESISTÊNCIA BACTERIANA: A ERA PÓS-ANTIBIÓTICOS
THE POST-ANTIBIOTIC ERA
Fábio do Carmo Silva Júnior de Souza¹, Jacqueline Coimbra Gonçalves2
1 Aluno do Curso de Biomedicina
2 Professora Mestre do Curso de Biomedicina
Resumo
Introdução: A Ciência médica é antiga, porém, o desenvolvimento de drogas com atividade antimicrobiana é recente, somente a partir
do século XX, no ano 1930, que foram introduzidas com maior veemência, combatendo as infecções, maiores causadoras de mortalidade
mundial na época. A primeira classe de drogas antibacterianas amplamente utilizada foram as sulfonamidas em 1938, seguida dos βlactâmicos em 1940, no qual a penicilina é o seu maior representante, tendo papel fundamental após a segunda guerra mundial. O
desenvolvimento de novas classes de antibióticos aconteceu de forma contínua até o ano de 1963 quando a evolução tornou-se lenta,
surgindo apenas drogas de classes já existentes, ocasionando na perda da disputa para as bactérias que com o passar do tempo
desenvolveram novos mecanismos de resistência aos antimicrobianos. Materiais e Métodos: Foi realizada uma pesquisa não
sistemática das bases de dados Scielo, Bireme e Pubmed, empregando os termos, Resistência Bacteriana, Uso de Antibióticos,
Necessidade de novos antibióticos. Conclusão: A utilização correta de antimicrobianos é essencial para o controle de doenças
infecciosas, sendo imprescindível para a sobrevivência humana.
Palavras-Chave: Resistência Bacteriana, Uso de Antibióticos, Necessidade de novos antibióticos, Uso indiscriminado de
antimicrobianos.
Abstract
Introduction: Medical Science is old, however, the development of drugs with antimicrobial activity is recent, only from the twentieth
century, in 1930, which were introduced more strongly, fighting infections, the largest cause of mortality worldwide at the time. The first
class of widely used antibacterial drugs were sulfonamides in 1938, followed by the β-lactam in 1940, in which penicillin is its greatest
representative, a fundamental role after World War II. The development of new classes of antibiotics occurred continuously until the year
1963 when evolution became slow, just emerging existing classes of drugs, resulting in loss of dispu-ta for bacteria which over time have
developed new mechanisms of resistance to antimicrobials. Materials and Methods: A non-systematic search was conducted of Scielo
databases Bireme and Pubmed, using the terms, Bacterial Resistance, Antibiotic, need for new antibiotics. Conclusion: The correct use
of antimicrobials is essential for the control of infectious diseases, being essential for human survival.
Keywords: Bacterial Resistance, Antibiotic, need for new antibiotics, the indiscriminate use of antibiotics.
Contato: [email protected]
Introdução
A medicina arcaica teve sua origem na
Mesopotâmia e no Egito, baseada na magia e no
empirismo8, enquanto a medicina como ciência
surgiu somente com Hipócrates (460 – 375 a.C) no
século V.
Grandes epidemias como Cólera, Tifo e
Peste bubônica poderiam ter sido controladas
imediatamente se existissem naquela época,
antimicrobianos. Estima-se que a peste bubônica
tenha dizimado metade da população europeia
entre 1347 e 1351, a Tifo ocasionara 3 milhões de
mortes entre 1918 e 1922. Atualmente a OMS
(Organização Mundial da Saúde) calcula que a
Cólera causa cerca de 28 a 142 mil mortes por ano
em todo o mundo.2,22
O surgimento e a disseminação de
patógenos resistentes a antibióticos, entre
humanos e populações animais em todo o mundo
como, Staphylococcus aureus Resistente a
Oxacilina (ORSA) e Enterobacterias Resistentes a
Carbapenêmicos
(CRE),
tornaram-se
um
problema global. A perda da eficácia contra
bactérias comuns não só levou a uma mudança
para antibióticos mais caros em países de alta
renda, mas também ao aumento da morbidade e
mortalidade em países de média e baixa renda,
onde a acessibilidade do preço aos medicamentos
de primeira linha limita seu uso.35
Objetivo do trabalho
Alvo de Ação dos Antimicrobianos
As bactérias contém alvos para ação
farmacológica que em geral podem ser descritos
em: inibidores da síntese da parede celular, da
síntese proteica, da replicação e reparo do DNA
bacteriano e da transcrição e tradução. Os efeitos
produzidos pelos fármacos antibacterianos são
divididos em bactericidas ou bacteriostáticos, o
primeiro causa a morte celular, o segundo impede
o crescimento bacteriano e é dependente do
sistema imunológico do hospedeiro para sua
eficiência clínica.13
Classes de Antibióticos
Fonte: LAURENCE, L, B., 2012, p. 1464
Figura 2. Sulfanilamida e Ácido p-aminobenzoico
respectivamente.
β-lactâmicos
Os antibióticos podem ser produzidos de
forma natural, semissintéticos e sintéticos, sendo
as duas primeiras formas as mais encontradas em
uso clínico atualmente. Podem ser classificados de
acordo com sua estrutura química em
sulfonamidas, β-lactâmicos, aminoglicosídeos,
polipeptídios,
tetraciclinas,
cloranfenicóis,
macrolídeos, nitroimidazólicos, glicopeptídeos,
quinolonas,
lincosaminas,
estreptograminas,
oxazolidinonas, lipopeptídeos. A figura 1
representa a cronologia do desenvolvimento
dessas classes.
Constitui a classe mais utilizada na clínica
terapêutica
atualmente.35
Os
β-lactâmicos
conectam-se aos receptores celulares (proteínas
ligadoras de penicilina [PBP]) na bactéria,
ocasionando
o
bloqueio
da
fase
de
transpeptidação do peptidoglicano, através da sua
ligação a um ou mais receptores, interrompendo a
síntese de peptidoglicano.
A ligação dos β-lactâmicos às PBPs
impossibilita a síntese do peptidoglicano fazendo
com que a célula bacteriana em crescimento fique
defeituosa, acarretando na lise osmótica, ou seja,
a bactéria não sobreviverá por decorrência da
hipertonicidade intracelular, salvo casos em que se
encontre em meio hipertônico, como na urina,
sobrevivendo na forma de esferoplasto ou
protoplasto sem se reproduzir até que o efeito do
antibiótico acabe.
Em gram-negativos a pressão osmótica é
menor do que em gram-positivos e a constituição
da parede celular em sua maioria são de
lipopolissacarídeos e lipoproteínas, sendo assim,
mesmo que haja inibição da síntese do
peptidoglicano,
os
outros
componentes
preservarão por maior tempo a integridade física
da bactéria gram-negativa.33,36
Polipeptídios
Figura 1. Cronologia do desenvolvimento dos
antibióticos, desde 1930 a 2015.
Sulfonamidas
Foi a primeira classe utilizada no tratamento
de infecções bacterianas, fato ocorrido em 1930.
Microrganismos vulneráveis às sulfas não
possuem a capacidade de obterem ácido fólico de
origem externa, sendo assim, necessitam
sintetizá-lo, e para que isso ocorra é fundamental
o ácido p-araminobenzóico (PABA). Como a
sulfanilamida possui estrutura similar ao PABA, as
bactérias utilizam as sulfonamidas no lugar PABA,
inibindo a síntese do ácido diidrofólico, e por
consequência, impedindo a síntese do DNA
bacteriano.6
As polimixinas, isoladas por meio da cultura
da bactéria Bacillus polymyxa em 1947, tiveram o
seu uso disponível no início da década de 60 e
deixaram de ser utilizadas na década de 70 devido
à sua toxicidade aos sistemas nervoso e renal
quando administrada em doses elevadas.
Polimixinas são caracterizadas como polipeptídios
e denominados Polimixinas A, B, C, D e E, porém,
apenas as B e E voltaram a ser utilizadas
clinicamente. 24
As Polimixinas causam mudanças na
permeabilidade da membrana da bactéria e por
consequência sua morte, atuantes contra Gramnegativas, seu anel peptídico policatiônico adere a
membrana da bactéria e substitui as pontes de
magnésio e cálcio que solidificam as moléculas
lipopolissacarídicas, ocorrendo o extravasamento
de componentes da célula e por consequência,
sua morte. Devido a baixa resistência às
Polimixinas, são fármacos de escolha no
tratamento de microrganismos gram-negativos
multirresistentes.18,24
Tetraciclinas
A tetraciclina é um derivado semi-sintético
da clortetraciclina, são detergentes catiônicos e
produto da fermentação natural da bactéria
Streptomyces aureofiens, descrita primeiramente
em 1948. Essa classe de antimicrobianos se liga a
um sítio na subunidade 30S do ribossomo
bacteriano, impedindo o acesso do aminoaciltRNA ao sítio A do ribossomo, inibindo a síntese
proteica. 7
Cloranfenicois
O cloranfenicol foi introduzido para uso
terapêutico em 1948, produzido através da
bactéria Streptomyces venezuelae, é utilizado
atualmente somente em casos de infecções
altamente patogênicas como meningites e outras
causadas por riquétsias. A razão da restrição se dá
devido a possibilidade do fármaco provocar
anemia aplásica e em bebês a síndrome do bebê
cinzento, por isso somente deve ser usado quando
o benefício ao paciente superar seu ônus. 19
Seu mecanismo de ação consiste na
inibição da síntese proteica tanto nas bactérias
quanto em células eucariontes, porém este último
em menor intensidade, liga-se à subunidade 50s
do ribossomo no local da peptidiltransferase e
impede a transpeptidação, inibindo a formação da
ligação peptídica.7,19
Macrolídeos
Os macrolídeos foram descobertos em 1952
a partir da bactéria Streptomyces eritreus,
possuem esse nome devido seus grandes anéis de
lactona no qual estão fixados um ou mais
desoxiaçucares, a eritromicina é o antibiótico mais
conhecido dessa classe, inibem a síntese de
proteína devida a sua ligação na subunidade 50s
ribossomal, impedindo etapas de translocação.9,19
Lincosaminas
Produzida através da bactéria Streptomyces
lincolmensis, foi descoberta em 1962.18 A
clindamicina é o principal integrante desse grupo.
Seu mecanismo de ação é o mesmo da
eritromicina, inibe a síntese proteica ligando-se à
subunidade 50s dos ribossomos bacterianos
intervindo nas reações de translocações aminoacil e na formação de complexos de iniciação.7,19
Estreptograminas
As estreptograminas fazem parte da mesma
família dos macrolídeos e lincosaminas e
apresentam propriedades semelhantes, a exemplo
do mecanismo de ação. Em 1999 foi aprovado pela
Food and Drug Administration (FDA) o primeiro
fármaco
dessa
classe,
a
quinupristina/dalfopristina, que é uma mistura de
duas estreptograminas na proporção 30/70
respectivamente, oriundas de um estreptomiceto e
modificadas sinteticamente.3,9,13
Oxazolidinonas
Em 2000, a FDA aprovou a primeira droga
pertencente a essa classe, a linezolida, que inibe
a síntese de proteínas devido a sua ligação ao
local P da subunidade 50S ribossomal,
impossibilitando a formação do complexo fMettRNA-ribossômico responsável pelo início da
síntese proteica.7, 13
Aminoglicosídios
A
estreptomicina
foi
o
primeiro
aminoglicosídio descoberto, fato ocorrido em
1944, fazem parte dessa classe também a
neomicina,
kanamicina,
paromomicina,
gentamicina, tobramicina, netilmicina e a
amicacina. A destruição bacteriana é dependente
da concentração.
Os aminoglicosídios atuam na síntese
proteica ligando-se ao rRNA 16S da subunidade
30S, em baixas concentrações conduzem os
ribossomos a efetuarem erroneamente a leitura do
mRNA durante o alongamento, ocasionando em
uma síntese proteica que contêm aminoácidos
incorretos.13
Essa classe possui vários efeitos adversos,
alguns deles específicos como: nefrotoxicidade,
otoxicidade e bloqueio neuromuscular.13
Nitroimidazólicos
O metronizadol foi introduzido em 1959 para
tratamento da tricomoníase vaginal, é um
antiprotozoário nitroimidazólico que também
possui potente atividade contra bactérias
anaeróbias, necessita de ativação pelos
microrganismos. Quando captado, interage com a
ferredoxina reduzida ou com nitroredutases
específicas, tal reação origina compostos
citotóxicos reduzidos, ativando o metronizadol,
compostos esses que se ligam às membranas,
proteínas e DNA nas células alvo, gerando grave
lesão.3,13,19
Glicopeptídeos
A vancomicina foi o primeiro fármaco
introduzido para uso terapêutico dessa classe,
evento ocorrido em 1958, é um antibiótico
glicopeptídico
tríciclico
produzido
por
Streptococcus orientalis e Amycolapsis orientalis,
inibe a síntese da parede celular por ligar-se
fortemente a extremidade D-Ala-D-Ala terminal do
peptídeo glicano em crescimento, devido ao seu
tamanho molecular ser grande, são incapazes de
penetrar na membrana externa de gramnegativas.3,7,19
Quinolonas
O ácido nalidíxico foi isolado como
subproduto da síntese da cloranquinina, sendo a
primeira quinolona, e disponibilizada para
tratamento de ITU. As quinolonas inibem a
topoisomerase
II
(DNA-girase)
e/ou
a
topoisomerase IV, bloqueando a síntese do DNA
bacteriano. O DNA superespiralado positivamente
é impedido de relaxar-se devido a inibição da DNAgirase, o que é necessário para transcrição e
replicação normais. A inibição da topoisomerase IV
acarreta na interferência da separação do DNA
cromossômico que permitem a replicação ou a
transcrição do DNA.7,13,19
Lipopeptídeos Cíclicos
Aprovada em 2003 pela FDA, o primeiro
fármaco pertencente a essa classe é a
daptomicina, produto da fermentação do
lipopeptídeo cíclico do Streptmyces roseosporus,
liga-se à membrana celular da bactéria pela
inserção dependente de cálcio de sua cauda
lipídica, ocasionando o efluxo de potássio, a
despolarização da membrana e a morte celular.7,21
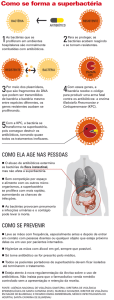
Mecanismos de Resistência aos Antibióticos
Mutações
A presença de mutações espontâneas nas
bactérias, para qualquer gene, é baixa, e a chance
é de que aproximadamente apenas uma célula em
10 milhões originará, na divisão, a uma bactéria
contendo uma mutação no determinado gene.
Todavia, é possível que existam muito mais células
que isso na evolução de uma infecção, e a
viabilidade de uma mutação ocasionar uma
modificação desde sensibilidade à resistência ao
fármaco, pode ser muito aumentada em
determinadas espécies de bactérias e com alguns
fármacos.26
As mutações gênicas não possuem grande
importância clínica, deve-se isso ao fato de que a
presença de que poucas mutações nem sempre
são suficientes para produzirem resistência e que
os
mutantes
frequentemente
apresentam
patogenicidade diminuída.26
Ampliação Gênica
Há pouco tempo, descobriu-se que a
duplicação e a replicação gênicas são importantes
mecanismos
de
resistência
em
alguns
microrganismos. De acordo com a tese, a
antibacterioterapia induziria o aumento de cópias
de genes de resistência preexistentes, como
enzimas que destroem os antibióticos e bombas de
efluxo.26,29
Plasmídeos
Plasmídeos são pequenas moléculas de
DNA dupla fita, contendo os elementos
necessários para a sua replicação e pelo menos
um gene que confere resistência a antibiótico.
Estes elementos genéticos extracromossomais
variam de 5 a 400 kilobases e comumente estão
presentes em duas ou mais cópias por célula.
Os plasmídeos presentes num grande
número de cópias são usados como veículos de
clonagem desde que capacitem à amplificação do
segmento do DNA neles clonado.23 Os plasmídeos
que transferem genes para resistência aos
antibióticos (genes r) são denominados como
plasmídeos R. Não se conhece como esses genes
surgiram mas, muito da resistência aos antibióticos
é determinada por plasmídeos. Sabe-se que a
espécie bacteriana S. aureus tem uma capacidade
significativa em desenvolver mecanismos de
resistência a antibióticos através de mecanismos
mediados por plasmídeos, dentro de apenas 2
anos, foi capaz de adaptar-se a meticilina sucessor
da penicilina.11
Transferência através de Elementos Genéticos
na Bactéria
Transpósons
Trata-se da transferência de segmentos de
DNA entre plasmídeos e de plasmídeocromossomo,
cromossomo-plasmídeo,
a
integração desses segmentos no DNA aceptor
pode ocorrer independente do mecanismo normal
de recombinação genética homóloga. Os
transpósons não possuem a capacidade de
autorreplicarem, no entanto pode ocorrer no
processo de integração, ocasionando em uma
cópia na molécula do DNA doador e na do
aceptor.26
Os transpósons são capazes de transferir
um ou mais genes de resistência e também se
infundirem em um plasmídeo para adentrarem em
uma nova espécie bacteriana.
Integrons e cassetes gênicos
Um íntegron é uma unidade genética que
inclui os determinantes dos componentes de um
sistema de recombinação específica de local,
capazes de captar e mobilizar genes que estão
contidos em elementos móveis chamados
cassetes gênicos. Os cassetes são elementos
celulares que incluem um gene (geralmente um
gene de resistência a antibióticos) e um local de
recombinação específica de integrase, que é um
membro de uma família de locais conhecidos como
elementos de base 59. Cassetes podem existir
tanto em uma forma livre circular ou integrado a um
sitio de recombinação, e somente quando
integrado, é um cassete formalmente parte de um
integron.17
Ocorre através da incorporação do DNA do
plasmídeo a um vírus bacteriano (fago), sendo
transferido para outra bactéria da mesma espécie.
Constitui papel importante na disseminação de
genes de resistência entre estreptococos e
estafilococos. 25
Transformação
Fonte: Range & Dale, 2011, p. 618.
Figura 3. (A) Representa dois plasmídeos, a e b,
a seta indica transpósons integrado ao Plasmídeo
b. (B) O transpósons codifica uma enzima que
corta o DNA do plasmídeo doador e do plasmídeoalvo para formar um cointegrado, ocorrendo a
replicação do transpósons durante esse processo.
(C) O cointegrado será uma enzima codificada
pelo transpósons. (D) Os dois plasmídeos passam
a conter o DNA do transpósons.
A Transferência de Resistência entre as
Bactérias
A transferência de genes de resistência intra
e interespécies é primordial para a disseminação
de resistência aos antimicrobianos, dividem-se em
três mecanismos, sendo a conjugação o mais
importante entre eles.
Conjugação
Trata-se do contato entre células, no qual
ocorre a transferência de material genético, é a via
principal de dispersão de resistência. O contato
ocorre através da organela fímbria sexual ou ainda
por contato direto entre as células. Essa organela
é desenvolvida pela bactéria doadora que possui o
plasmídeo conjugativo (fator F) e transfere para a
bactéria receptora. A transferência por meio de
fimbrias ocorre geralmente em gram-negativas e o
contato entre células é mais observado em grampositivos, sendo resultante da secreção de
feromônio que ocasiona a adesão e agregação
entre as células doadoras e receptoras. 25,34
Transdução
Trata-se de um mecanismo de captação,
onde a bactéria receptora obtém DNA de parte ou
de todo plasmídeo ou cromossomo liberado no
meio por uma célula doadora, após isso ocorre a
introdução ao genoma por meio da recombinação
homóloga. 25,34
Mecanismos Bioquímicos de Resistência aos
Antibióticos
São vários os mecanismos, dentre eles
destacam-se a produção de enzimas, alteração do
local sensível ao fármaco ou do sítio de ligação do
fármaco, diminuição da concentração do fármaco
na bactéria.25
A produção de enzimas é o mecanismo de
resistência mais importante, inativam a droga
através do bloqueio ou alteração da estrutura do
fármaco, à exemplo dos fármacos β-lactâmicos,
onde hidrolisam o anel β-lactâmico, ocasionado
sua inativação.
A alteração do local sensível ao fármaco ou
do sítio de ligação do fármaco geralmente ocorre
por mutação cromossômica, pode ocorrer em
alguns locais como: redução da afinidade dos
antibióticos pelas proteínas ligadoras, alteração no
receptor do ribossomo bacteriano, modificação ou
ausência de proteínas do ribossomo, diminuição
ou ausência de componentes da membrana e a
formação de DNA-girases modificadas.
A diminuição da concentração do fármaco
na bactéria pode ocorrer através da inibição da
síntese de porinas, que são responsáveis pelos
locais de entrada do fármaco. Ocorre também por
meio de um sistema denominado de bomba de
efluxo, mecanismo que utiliza energia ligada à
movimentação de prótons e que acarreta no
bombeamento da droga para fora da bactéria.
Tabela 1. Classes, local e espectro de ação dos antibióticos.
Inibidores da síntese da parede celular
Classe
Local de Ação
Espectro de Ação
β-Lactâmicos
Transpeptidase/transglicosilages
Amplo espectro*
Glicopeptídeos
D-Ala D-Ala do peptideoglicano
Gram-positivas
Inibidores da síntese de proteínas
Aminoglicosídeos
Subunidade 30S ribossomal
Amplo-espectro, principalmente
Gram-negativas
Tetraciclinas
Subunidade 30S ribossomal
Amplo-espectro
Lincosamidas
Subunidade 50S ribossomal
Gram-positivas, Gram-negativas,
bactérias anaeróbias e atípicas
Macrolídeos
Subunidade 50S ribossomal
Gram-positivas, Gram-negativas,
bactérias anaeróbias e atípicas
Anfenicóis
Subunidade 50S ribossomal
Gram-positivas, Gram-negativas,
bactérias anaeróbias e atípicas
Oxazolidinonas
Subunidade 50S ribossomal
Gram-positivas, micobactérias,
anaeróbios
Estreptograminas
Subunidade 50S ribossomal
Amplo espectro
Inibidores da transcrição do RNA e da replicação do DNA
Quinolonas
DNA Girase / Topoisomerase IV
Amplo-espectro
Ação sobre a membrana citoplasmática
Lipopeptídeos Cíclicos
Membrana plasmática
Gram-positivos
Polimixinas
Membrana plasmática
Gram-negativas
Ação na síntese de ácidos nucleicos
Sulfonamidas
Diidropteroato sintase
Gram-positivas
Fonte: Santos, 2014, p. 40-42.
*Antibióticos β-lactâmicos possuem espectros de ação que variam, em sua maioria são de amplo espectro.
Fonte: GOLAN, D. E., 2009, p. 533
Figura 8. Mecanismo de ação das classes e de algumas subclasses de antibióticos.
Importância da descoberta de novos agentes
antibacterianos e o estado atual da resistência
aos Antibióticos
O
desenvolvimento
de
fármacos
antibacterianos ocorreu progressivamente entre os
anos de 1940 a 1963, porém, poucos avanços
após essa época foram obtidos, enquanto a
resistência bacteriana aumentava, a descoberta
de novos agentes diminuía, desde 1963, somente
duas novas classes com mecanismos de ação
diferentes foram introduzidas, uma em 2000 e
outra em 2003. Alimentando a necessidade de
avanços na área da descoberta de novos
antibióticos com diferentes estruturas moleculares
e novos mecanismos de ação. 5,16
Em 2001, a OMS publicou o que foi
denominado de: Estratégia Global para Conter a
Resistência Antimicrobiana, trazendo ações
necessárias para o controle do avanço da
resistência bacteriana e convidou os países a
aderirem essas políticas. O Brasil, em 2010
anunciou a RDC nº 20, que trata sobre o controle
da dispensação, prescrição, controle, rolagem e
embalagem de produtos classificados como
antimicrobianos. A norma regulamentadora trouxe
a obrigatoriedade da apresentação de receita
médica para obtenção do medicamento, entre
outros fatores.14,28
Em 2013, as farmácias e drogarias foram
obrigadas a incluírem no Sistema Nacional de
Gerenciamentos
de
produtos
Controlados
(SNGPC) da Anvisa, detalhes sobre a receita
médica, sobre o tratamento, o nome do paciente e
do médico, afim de diminuir problemas como a
escassez do controle da dispensação e da
automedicação, fatores estes que contribuem para
a implantação de uma possível resistência
bacteriana. 14,,28,31
A OMS (Organização Mundial de Saúde),
em 2014, publicou um relatório sobre a resistência
bacteriana, onde, de acordo com o diretor geral
adjunto de segurança da saúde, o mundo está
caminhando para uma era pós-antibióticos em que
infecções outrora comuns podem voltar a serem
letais. Os dados obtidos em 114 países evidenciou
que a resistência está ocorrendo em todo o mundo,
classes
consideradas
como
antibióticos
superpotentes já não funcionam em metade dos
doentes de diversos países.4,37
Embora a OMS tenha coletado dados de
países de diversos continentes, como por
exemplo: África, América, Mediterrâneo Oriental,
Europa, Sudeste da Ásia e Pacifico Ocidental,
foram analisados apenas dados referentes ao
Brasil, com o fim de alertar quais os isolados
bacterianos que apresentaram resistência ou
redução da sensibilidade à alguma droga.
Os dados foram alcançados através de
questionários enviados à fontes nacionais, bem
como, relatórios e ou outras compilações em nível
nacional nos ministérios de saúde, laboratórios
nacionais de referência, institutos de saúde
pública, redes nacionais e internacionais de
vigilância de resistência bacteriana, contactados
por meio de telefone e e-mail, e artigos científicos
publicados a partir de 2008. 37 A tabela 2 apresenta
a incidência de resistência publicada ou relatada,
de espécies bacterianas comuns no Brasil,
publicada pela OMS.
Tabela 2. Incidência de resistência publicada ou relatada, de espécies bacterianas comuns no Brasil,
publicada pela OMS.
Escherichia coli: Resistência às cefalosporinas de 3ª geração
Fonte de
Nº de isolados
Tipo de amostra,
Resistência
Período de
Ano de publicação
dados
testados
população ou
%
coleta de dados
0
2010
vigilância
Dados
247
Infecção do trato
nacionais
2013
urinário não
complicadas
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 79.
Escherichia coli: Resistência a fluorquinolonas
Fonte de
Nº de isolados
Tipo de amostra,
Resistência
Período de
Ano de publicação
dados
testados
população ou
%
coleta de dados
8
2010
vigilância
Dados
247
Infecção do trato
nacionais
2013
urinário não
complicadas
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 90.
Klebsiella pneumoniae: Resistência às cefalosporinas de 3ª geração
Fonte de
Nº de
Tipo de amostra,
Resistência
Período de
dados
isolados
população ou
%
coleta de
testados
vigilância
81
Isolados de sangue
Publicação
Ano de publicação
dados
55,6
2004-2006
2009
33
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 98.
Klebsiella pneumoniae: Resistência aos carbapenemos
Fonte de
dados
Publicação1
Nº
de
Tipo de amostra,
isolados
população ou
testados
vigilância
63
Isolados clínicos
Resistência
Período
de
%
coleta
de
Ano de publicação
dados
0 (IMI)*
2009
2011
1,6(ETP)**
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 104.
* Imipenem
** Ertapenem
Staphylococcus aureus: Resistência à meticilina
Fonte de
dados
Publicação10
Nº de
Tipo de amostra,
Resistência
Período de
%
coleta de
isolados
população ou
testados
vigilância
388
Funcionários da
Ano de publicação
dados
16
2006-2008
2011
43,4
-
2010
saúde
Publicação15
53
Isolados
sanguíneos
(pacientes em
diálise)
Publicação25
102
Estudantes
2,4
2007
2010
Publicação27
164 FC; 200
Pacientes com
44,5 FC;
-
2010
não FC
Fibrose Cística
35 não FC
5,8
2007
2008
31
2005-2008
2009
41,5
2002-2003
2009
(FC) e Pacientes
sem FC.
Publicação30
52
Funcionários da
saúde
Publicação12
2218
Isolados
laboratoriais
Publicação32
105
Hospital de
maternidade
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 111.
Streptococcus pneumoniae: Resistência, ou não suscetibilidade a Penicilina
Fonte de
Nº de
Tipo de amostra,
Não
Período de
dados
isolados
população ou
especificadas
coleta de
testados
vigilância
se resistente,
dados
Ano de publicação
ou não
suscetível %
Dados
807
Isolados invasivos
20,1
2010
2013
nacionais
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 119.
Salmonella não tifóide: Resistência a fluorquinolonas
Fonte de
Nº de isolados
Tipo de amostra,
Resistência
Período de
dados
testados
população ou
%
coleta de
vigilância
Dados
7221
Isolados de
nacionais
Ano de publicação
dados
2
2010
2013
comunidade
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 130.
Shigella: Resistência a fluorquinolonas
Fonte de
Nº de isolados
Tipo de amostra,
Resistência
Período de
dados
testados
população ou
%
coleta de
vigilância
Dados
77
Isolados de
Ano de publicação
dados
1,3
2010
2013
comunidade (S.
nacionais
flexneri + S. sonnei)
Fonte: Antimicrobial resistance: Global report on surveillance. Word Heath Organization, 2014, p. 138.
A resistência microbiana é produto da
utilização inadequada e/ou desnecessária de
antibióticos, a busca de novos agentes é bastante
complexa. No dia 18 de novembro de 2015 foi
publicado no jornal online the lancet, um estudo
científico demonstrando a descoberta de
resistência à uma das drogas antibacterianas mais
potentes, a polimixina, fato este que de acordo
com cientistas, se a mutação genética se espalhar,
poderá levar a humanidade ao início da era pósantibiótica.38 A Tabela 3 demonstra a resistência
aos antimicrobianos, o ano de descoberta do
fármaco, de introdução e de resistência relatada.
Tabela 3. Resistência aos antimicrobianos
Classe de Antibiótico
Ano de descoberta
Ano de introdução no
Ano de observação
mercado
da resistência
Sulfonamidas
1932
1936
1942
β-lactâmicos
1928
1938
1945
Aminoglicosídeos
1943
1946
1946
Cloranfenicóis
1946
1948
1950
Macrolídeos
1948
1951
1955
Tetraciclinas
1944
1952
1950
Rifamicina
1957
1958
1962
Glicopeptídeos
1953
1958
1960
Quinolonas
1961
1968
1968
Estreptograminas
1963
1998
1964
Oxazolidinonas
1955
2000
2001
Lipopeptídeos
1986
2003
1987
Fonte: LEWIS, 201320
Considerações Finais
A resistência bacteriana pode estar levando
a população à era pós-antibióticos, onde
voltaríamos a tratar doenças facilmente
combatidas com antibióticos, através de
amputações ou até mesmo não termos mais
opções para o tratamento. 37
Medidas inteligentes são necessárias para o
controle da disseminação da resistência, como
combater o uso indiscriminado de antibióticos.
Para isso é necessária uma abordagem intensiva
e apoio governamental, para que as medidas
anunciadas por normas regulamentadoras sejam
cumpridas.
Agradecimentos
Gratidão à minha família, ao meu grande
amigo e companheiro pai, à minha esposa pelo
apoio incondicional, à minha orientadora
Jacqueline Coimbra pela confiança, à minha
mestre Luciana Ramalho pelo apoio, e a Deus por
me conceder sabedoria e entendimento para
realização desse artigo.
Referências
1 - ABREU, A.; MARQUES, S.; MONTEIRO, N. V.; CARVALHO, R. Nosocomial infection and characterization
of extended-spectrum s-lactamases-producing Enterobacteriaceae in Northeast Brazil. Rev Soc Bras Med
Trop. 44(4):441-446: 2011.
2 - ALI, M.; LOPEZ, A.L.; YOU, Y.A. The global burden of cholera. Bulletin World Health Organization. 90:
209–18ª: 2012.
3
ANVISA,
Antimicrobianos
Bases
teóricas
e
uso
clínico.
Disponível em:
http://www.anvisa.gov.br/servicosaude/controle/rede_rm/cursos/rm_controle/opas_web/modulo1/lincosamina
s.htm. Acesso em 19 de outubro de 2015.
4
BBC
BRASIL
–
Resistencia
Antibióticos.
Disponível
em:
http://www.bbc.com/portuguese/noticias/2014/04/140430_resistencia_antibioticos_rb. Acesso em 26 de
novembro de 2015.
5 - BRITO, M. A.; CORDEIRO, B. C. Necessidade de novos antibióticos. Jornal Brasileiro de Patologia e
Medicina Laboratorial. Rio de Janeiro: 2012.
6 - BROOKS, Geo. F. et al. Microbiologia Médica de Jawetz, Melnick & Adelberg. 26ª ed, New York: McGrawHill. p. 375. 2014.
7 - BRUNTON, L. L.; CHABNER, B. A.; KNOLLMANN, B. C. As Bases Farmacológicas da Terapêutica. 12ª
ed, New York: McGrallHill. p. 1464-1545. 2012.
8 - CARDOSO, M. H. C. de A.: História e medicina: a herança arcaica de um paradigma. História, Ciências,
Saúde. VI(3): 551-575. Rio de Janeiro: 2000.
9 - CLARK, M. A.; FINKEL, R.; REY, J. A.; WHALEN, K. Farmacologia ilustrada. 5ª ed. Porto Alegre: Artmed.
p. 370-371. 2013.
10 - DE ALMEIDA, C. E.; PIMENTA F.; VANZATO P. I.; DA COSTA, D. A.; GIR, E. Prevalence of
Staphylococcus aureus in saliva of healthcare workers. J Colomb Med. 42(S1):10−16: 2011.
11 - DE LENCASTRE, H.; OLIVEIRA, D.; TOMASZ, A. Antibiotic resistante Staphylococcus aureaus: a
paradigm of adaptive power. Curr. Opin Microbiol. 10(5):428-35: 2007.
12 - GALES A.C.; SADER, H.S.; RIBEIRO J.; ZOCCOLI, C.; BARTH, A.; PIGNATARI, A. C. Antimicrobial
susceptibility of gram-positive bacteria isolated in Brazilian hospitals participating in the SENTRY Program
(2005-2008). Braz J Infect Dis. 13(2):90-98: 2009.
13 - GOLAN, D. E.; CAIRO, C. W.; SIMON, J. B. Princípios Fundamentais de Farmacologia. 2ª Ed. Rio de
Janeiro: Guanabara Koogan. p. 547-586. 2009.
14 - GRAYSON, M. L. et al. A crescente ameaça da resistência bacteriana. Organização Mundial da Saúde.
2012.
15 - GROTHE. C.; DA SILVA, BELASCO, A. G.; DE CASSIA, B. A. R.; VIANNA, L. A.; DE CASTRO, C. S. R.;
BARBOSA, D. A. Incidence of bloodstream infection among patients on hemodialysis by central venous
catheter. Rev Lat Am Enfermagem: 2010.
16 - GUIMARÃES, D. O. et al. Antibióticos: Importância terapêutica e perspectivas para a descoberta e
desenvolvimentos de novos agentes. Rev Quimica Nova. Ribeirão Preto: 2010.
17 - HALL R.M.; COLLIS C.M. Mobile gene cassettes and integrons: capture and spread of genes by sitespecific recombination. J Mol. Microbiology. 15, 593-600: 1995.
18 - HOGARDT, M.; SCHMOLDT, S.; GÖTZFRIED, M.; ADLER, K.; HEESEMANN, J. Pitfalls of polymyxin
antimicrobial susceptibility testing of Pseudomonas aeruginosa isolated from cysstic fibrosis patients. J
Antimicrob Chemother. 54:1057-1061: 2004.
19 - KATZUNG, B. G.; MASTERS, S. B.; TREVOR, A. J. Farmacologia básica e clínica. 12 ª Ed. New York:
McGrallHill. p. 790-847. 2014.
20 - LEWIS, K. Platforms for antibiotic discovery. Nature Reviews Drug Discovery, v.12, n. 5, p. 371-387:
2013.
21 - LOPES, H. V. Daptomicina: finalmente disponível para a América do Sul. Rev Panam Infectol. 10(3):7071. São Paulo: 2008.
22 - MAGIGAN, M.T.; MARTINKO, J. M.; DUNLAP, P.V.; CLARK, D.P. Microbiologia de Brock. 12ª ed. Porto
Alegre: Artmed. 2010.
23 - NASCIMENTO, A. A. C.; ESPREAFICO, E. M.; LARSON, M. L. P.; MONESI, N.; ROSSI, N. M. M.;
RODRIGUES, V. Tecnologia do DNA recombinante. Ribeirão Preto: 1999.
24 - PARUSSOLO, L.; GARCIA, B. L.; TOGNIM, M, C, B. Polimixinas: Essenciais na era das bactérias
multirresistentes. Rev Biociências. v. 1415-7411.Taubaté: 2004.
25 - PRATES, K.A.; TOREES, A.M.; GARCIA, L.B.; OGATTA, S.F.; CARDOSO, C.L.; TOGNIM, M.C. Nasal
carriage of methicillin-resistant Staphylococcus aureus in university students. Braz J Infect Dis. 14(3):316318: 2010.
26 - RANG, H.P.; DALE, M.M.; RITTER, J.M.; FLOWER, R.J.; HENDERSON, G. Farmacologia. 7ª ed. Rio de
Janeiro: Elsevier. p. 609-619. 2011.
27 - REITER, K.C.; MACHADO, A.B.; FREITAS, A.L.; BARTH, A. L. High prevalence of methicillin-resistant
Staphylococcus aureus with SCCmec type III in cystic fibrosis patients in southern Brazil. Rev Soc Bras Med
Trop. 43(4):377- 381: 2010.
28
Resolução-RDC
Nº
20,
de
5
de
maio
de
2011.
Disponível
em:
http://www.anvisa.gov.br/sngpc/Documentos2012/RDC%2020%202011.pdf. Acesso em 10 de novembro de
2015.
29 - SANDEGREN, L.; ANDERSSON, D.I. Bacterial gene amplification: implications for the evolution of
antibiotic resistance. Nat. Rev. Microbial. 7, 578-588: 2009.
30 - SILVA, E. C.; ANTAS, M.; MONTEIRO, B. N. A.; RABELO, M.A.; MELO, F. L.; MACIEL, M.A. Prevalence
and risk factors for Staphylococcus aureus in health care workers at a university hospital of Recife-PE. Braz
J Infect Dis. 12(6):504-508 2008.
31 - SNGPC - Sistema Nacional de Gerenciamento de Produtos Controlados. Disponível em:
https://sngpc.anvisa.gov.br/. Acesso em 10 de novembro de 2015.
32 - SOUSA JUNIOR, F.; NUNES, E.; NASCIMENTO, E.; OLIVEIRA, S.; MELO, M.; FERNANDES, M.
Prevalence of methicillin-resistant Staphylococcus spp isolated in a teaching maternity hospital in the city of
Natal, State of Rio Grande. [Article in Portuguese]. Rev Soc Bras Med Trop. 42(2):179-182: 2009.
33 - SUPERTI, S. V.; AUGUSTI, G.; ZAVASCKI, A. P. Risk factors for and mortality of extended-spectrumbeta-lactamaseproducing Klebsiella pneumoniae and Escherichia coli nosocomial bloodstream infections. Rev
Inst Med Trop. Sao Paulo. 51(4):211-216: 2009.
34 - TAVARES, W. Antibióticos e Quimioterápicos para o clínico. 1ª ed. São Paulo: Atheneu. p. 17-19.
2007.
35 - Van BOECKEL, T. P. et al. Global antibiotic consumption 2000 to 2010: an analysis of national
pharmaceutical sales data. Princeton: 2014.
36 - WELDHAGEN, G. F. Integrons and β-lactamases - a novel perspective on resistance. International
Journal of Antimicrobial Agents, v. 23, p. 556–562: 2004.
37 - WHO. Antimicrobial resistance: global report on surveillance 2014. World Health Organization, Geneva;
2014. Disponível em http://www.who.int/drugresistance/documents/surveillancereport/en/. Acesso em 18
de outubro de 2015.
38 – YI-YUN L. et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and
human beings in China: a microbiological and molecular biological study. J The Lancet Infectious Diseases.