Governador
Cid Ferreira Gomes
Vice Governador
Domingos Gomes de Aguiar Filho
Secretária da Educação
Maria Izolda Cela de Arruda Coelho
Secretário Adjunto
Maurício Holanda Maia
Secretário Executivo
Antônio Idilvan de Lima Alencar
Assessora Institucional do Gabinete da Seduc
Cristiane Carvalho Holanda
Coordenadora da Educação Profissional – SEDUC
Andréa Araújo Rocha
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Escola Estadual de
Educação Profissional - EEEP
Ensino Médio Integrado à Educação Profissional
Curso Técnico em Química
QUÍMICA ORGÂNICA II
TEXTOS DE APOIO
Técnico em química – Química Orgânica II
1
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Índice
01. REAÇÕES EM COMPOSTOS AROMÁTICOS.............................................03
02. REAÇÕES....................................................................................................04
2.1 Nitração........................................................................................................04
2.2 Halogenação............................................................................................................06
2.3 Sulfonação...............................................................................................................07
2.4 Reações de Friedel-Crafts do benzeno..................................................................08
2.4.1 Acilação de Friedel-Crafts do benzeno..............................................................08
2.4.2 Alquilação de Friedel-Crafts do benzeno..........................................................09
03. Reações de aldeídos e cetonas...............................................................................15
04. Reações de adição e substituição..........................................................................17
05. Exercícios ..............................................................................................................25
06. Reações de Nitração e Sulfonação........................................................................28
07. Substituições Nucleofílicas e Eletrofílicas............................................................31
08. Exercícios...............................................................................................................-34
09. Experimentos..........................................................................................................37
Técnico em química – Química Orgânica II
2
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
01.REAÇÕES EM COMPOSTOS AROMÁTICOS: BENZENO
Os compostos isolados de fontes naturais são, em grande parte, aromáticos.
A
denominação aromático, primeiramente teve influência pelo odor que alguns compostos
exalavam, porém, depois de
vários estudos, os químicos adotaram outra maneira de
classificação para os mesmos. Alguns exemplos onde estes compostos estão presentes são: em
fármacos, como o analgésico morfina; em drogas sintéticas, em que o tranquilizante diazepan é um
representante e, também, na indústria plástica, onde o vinil-benzeno é bastante utilizado. Com isso,
fica evidente o interesse pelo estudo destes compostos. O benzeno é o principal representante
desta classe de compostos orgânicos, tendo sido estudado por muitos químicos orgânicos até
receber a classificação de aromático. Atualmente, usa-se o benzeno como exemplo de reações
de compostos ditos aromáticos. As reações a partir destes compostos são em número de cinco .As
principais são estas: nitração, halogenação, sulfonação, acilação de Friedel-Crafts e alquilação
de Friedel- Crafts.
O benzeno foi sintetizado por aquecimento do ácido benzóico (C6H5CO2H) com óxido de
cálcio (CaO), pelo químico alemão Eilhart Mitscherlich, que mostrou, posteriormente, que o
benzeno tem fórmula molecular C6H61. Embora sua fórmula molecular indicasse um alto grau de
insaturação, o composto não apresentava as reações típicas de um hidrocarboneto insaturado.
Em 1865, August Kekulé, o criador da teoria estrutural, propôs a primeira estrutura definida
para o benzeno. Os resultados obtidos a partir de investigações experimentais cuidadosas
levaram os químicos à conclusão de que o benzeno é melhor representado por um par de estruturas
de Kekulé2, como ilustradas na FIGURA 1
Técnico em química – Química Orgânica II
3
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
FIGURA 1 – Forma representativa da estrutura do benzeno (Fonte:
ALLINGER,
Kekulé propôs que os átomos de carbono do benzeno estão em um anel, que são
ligados uns ais outros por ligações simples e duplas que se alternam e que cada
átomo de hidrogênio está ligado a um átomo de carbono, atendendo aos requisitos
da teoria estrutural onde os átomos de carbono formam quatro ligações e todos os
átomos de hidrogênio são equivalentes1.
Por ser uma molécula cíclica, planar, com uma nuvem cíclica de
elétrons π deslocalizados, abaixo e acima do plano do anel, o benzeno é
classificado como um nucleófilo, e é facilmente atraído por um eletrófilo 4. Quando
um eletrófilo se liga a um anel benzênico, é formado um carbocátion intermediário.
Se este intermediário tivesse de reagir de modo semelhante com um nucleófilo, o
produto não seria mais aromático . Como há uma grande estabilização energética
associada a aromaticidade, o anel perde um próton do sítio de ataque eletrófilo, e a
aromaticidade é restaurada. O resultado é a substituição de um hidrogênio, do
anel, por um eletrófilo.
Com base no que foi descrito anteriormente, iremos estudar as cinco
reações mais comuns de substituição aromática eletrofílicas do benzeno, sendo estas:
► Nitração: um grupo nitro (NO2) substitui um hidrogênio;
► Halogenação: um bromo (Br), um cloro (Cl) ou um iodo (I) substituem um
hidrogênio;
► Sulfonação: um grupo ácido sulfônico (SO3H) substitui um hidrogênio;
► Acilação de Friedel-Crafts: um grupo acila (RC═O) substitui um hidrogênio;
► Alquilação de Friedel-Crafts: um grupo alquila (R) substitui um hidrogênio.
Uma vez que o eletrófilo é formado, todas as cinco reações seguem o
mesmo mecanismo em duas etapas para a substituição aromática eletrofílica.
Técnico em química – Química Orgânica II
4
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
2. Reações
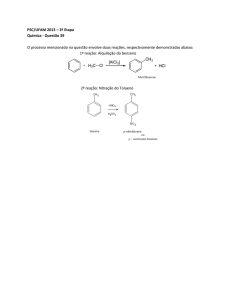
2.1 Nitração
A nitração do benzeno é feita misturando-se ácido nítrico (HNO3) e
benzeno na presença de ácido sulfúrico (H2SO4) concentrado e aquecendo-se a
mistura. Sendo o ácido sulfúrico mais forte que o ácido nítrico, este último acaba
se comportando como base de Lewis, recebendo um próton do H2SO4. Trata-se de
um equilíbrio ácido-base.
FIGURA 2 – Reação de nitração (Fonte: ALLINGER
A reação de substituição eletrofílica começa com o ácido sulfúrico, que é
um ácido extremamente forte, protonando o ácido nítrico para dar H2NO3+, o qual
pode perder água para formar NO2+. O ácido sulfúrico facilita esta reação porque é
desidratante. O íon NO 2+ ataca então o anel aromático e a reação segue o
mecanismo usual3. O mecanismo completo está esquematizado abaixo
Técnico em química – Química Orgânica II
5
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Mecanismo para a reação de nitração
2.2Halogenação
O benzeno não reage com o bromo ou o cloro a não ser que um ácido de
Lewis esteja presente na
mistura. Quando ácidos de Lewis estão presentes,
entretanto, o benzeno reage prontamente com o bromo ou o cloro, e as reações
fornecem bromobenzeno e clorobenzeno , respectivamente, com bons rendimentos.
Técnico em química – Química Orgânica II
6
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Os ácidos de Lewis mais comumente usados para efetuar as reações de
cloração e bromação são FeCl3, FeBr3 e AlCl3. A FIGURA 5 mostra o mecanismo de
halogenação para o bromo.
.
2.3 Sulfonação
O benzeno reage lentamente com o ácido sulfúrico a temperatura elevadas. O
produto da reação é o ácido benzeno-sulfônico2. A FIGURA 6 mostra a reação de
sulfonação.
Reação de sulfonação
Técnico em química – Química Orgânica II
7
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Em todas as reações, o eletrófilo parece ser trióxido de enxofre. Em ácido
sulfúrico concentrado, trióxido de enxofre é produzido em um equilíbrio onde
H2SO4 atua tanto como um ácido quanto como uma base1. A figura abaixo mostra o
mecanismo de sulfonação.
2.4 Reações de Friedel-Crafts do benzeno
Duas reações de substituição eletrofílica trazem os nomes dos químicos
Charles Friedel e James Crafts. A acilação de Friedel-Crafts coloca um grupo acila
no anel benzênico e a alquilação de Friedel-Crafts coloca um grupo alquila no anel
benzênico 3. A FIGURA 8 mostra a estrutura do grupo acila e do grupo alquila.
Estrutura do grupo acila e do grupo alquila
Técnico em química – Química Orgânica II
8
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
2.4.1 Acilação de Friedel-Crafts do benzeno
Reagindo-se haletos de ácido com benzeno, em presença de AlCl3 ou FeCl3
(ácidos de Lewis), obtém-se cetonas. O eletrófilo é o íon acetoxônio 5.
Uma vez que o produto de uma acilação de Friedel-Crafts contém um grupo
carbonila que pode complexar com AlCl3, reações de acilação de Friedel-Crafts
devem ser conduzidas com mais de um equivalente de AlCl3. Quando a reação
termina, é adicionado água à mistura para liberar o produto do complexo.
2.4.2 Alquilação de Friedel-Crafts do benzeno
Reagindo-se haletos de alquila com benzeno, em presença de AlCl3 ou FeCl3
(ácidos de Lewis), obtém-se outro hidrocarboneto aromático. O eletrófilo é o
carbocátion que se forma5. Fluoretos de alquila, cloretos de alquila, brometos de
alquila e iodetos de alquila podem ser usados. Haletos de vinila e haletos de arila não
podem ser empregados, porque seus carbocátions são instáveis demais para se
formar 3. A FIGURA 10 mostra o mecanismo de reação da alquilação de FriedelCrafts.
Técnico em química – Química Orgânica II
9
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Uma limitação importante na alquilação de Friedel-Crafts está no fato de
que alguns carbocátions, ao serem formados após a reação entre o haleto e o ácido
de Lewis, sofrem um rearranjo instantâneo, alterando o radical que se pretendia
adicionar ao anel. Esse íon sofre rearranjo sempre que, por transposição vicinal de
um hidrogênio ou de um grupo alquila, for possível formar um carbocátion mais
estável.
Técnico em química – Química Orgânica II
10
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Lista de exercícios /reações de aromáticos
1. Quando o benzeno reage com um eletrófilo hipotético (Y – X) o produto é sempre de
substituição e não de adição. Explique!
2. Mostre o mecanismo de halogenação do benzeno.
3. Mostre o mecanismo de nitração do benzeno.
4. Mostre o mecanismo de sulfonação do benzeno. Mostre também porque a
dessulfonação do ácido sulfônico é possível através de um diagrama de ∆G x
coordenada de reação. Mostre as reações envolvidas.
5. Qual o principal produto de alquilação de Friedel-Crafts usando os seguintes haletos:
a. cloreto de etila c. cloreto de neo-pentila
b. 2-cloro-butano d. Cloreto de alila
6. Desenhe as estruturas dos seguintes compostos:
a. o-nitroanilina d. trinitro-tolueno (nome usual)
b. m-clorobenzonitrila e. 2,5-dinitrobenzaldeído
c. 2-bromo-4-iodofenol f. o-xileno
07. Em substituições eletrofílicas de benzenos monosubstituidos que orientam orto e
para (grupos alquila, por exemplo), existirá diferença nas proporções de produtos orto e
para numa série quando esses grupos aumentam de tamanho? Justifique sua resposta.
08. A reação de substituição eletrofílica aromática é uma importante ferramenta para a
síntese de diversas substâncias, sendo muito utilizada em indústrias. As reações desse
tipo, mais comuns e importantes, são: halogenação, nitração, alquilação de FriedelCrafts, sulfonação e acilação de Friedel-Crafts.
A) Escreva a estrutura do produto principal da reação de acilação do benzeno pelo
cloreto de etanoila na presença de na presença de tricloreto de alumínio.
B) A reatividade e a orientação da reação de substituição eletrofílica aromática estão
diretamente associadas aos grupos já presentes no anel aromático. Considerando as
reações I e II mostradas abaixo, escreva as estruturas dos produtos principais formados
em cada reação e explique a diferença de reatividade apresentada (rápida/lenta).
Técnico em química – Química Orgânica II
11
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
-Existem outros compostos aromáticos, altamente reativos (mais do que o benzeno)
Possuem elétrons π mais disponíveis e que reagem comhalogênios sem a necessidade
de ácidos de Lewis.
Os derivados halogenados de compostos aromáticos têm aplicação nas mais diversas
indústrias. (Problemas ambientais → Alta persistência)
- Um exemplo de composto aromático mais complicado é o DDT (dicloro-difeniltricloroetano) Inseticida que mata efetivamente o mosquito transmissor da malária e
febre amarela.
Seu uso foi proibido em muitas partes do mundo porque ele pode interromper o
equilíbrio natural do meio ambiente, envenenando peixes e enfraquecendo as cascas de
ovos das aves.
Bioacumulação, Bioconcentração, Metabolização (Em muitas aves, os metabólitos
interferem na enzima que regula a distribuição de cálcio →ovos com casca fina )
- Problema semelhante tem sido criado pelas PCBs (bifenilas policloradas).
Reações
com derivados do benzeno
Vimos, até agora, como obter vários benzenos substituídos. Nesta etapa, veremos
reações envolvendo os derivados do benzeno. Muitas vezes, para se obter um
determinado composto, é necessário se preparar um derivado da maneira como vimos
anteriormente e, após, modificar quimicamente este substituinte. Os substituintes,
entretanto, exercem efeitos sobre a reatividade do benzeno. Veremos, também, os
efeitos provocados por estes substituintes e as consequências sobre as reações
envolvendo o anel.
Digamos que quiséssemos, por exemplo, obter a anilina,
partindo do benzeno. Nas reações vistas anteriormente,
nenhuma indica a substituição de um hidrogênio por um
grupo amino. Temos, então, que utilizar outra estratégia. A
mais simples parece ser a preparação do nitrobenzeno
seguida da redução do grupo nitro, que gera o grupo amino
- portanto, a anilina. Para fazer esta redução é necessário o uso de um sistema redutor.
Os mais utilizados são a bases de metais, tal como Pd/C ou Sn/HCl. No segundo caso,
forma-se a anilina protonada (íon anilínio), que pode ser neutralizada com uma base.
Técnico em química – Química Orgânica II
12
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Seguindo a mesma analogia, a anilina pode ser oxidada - para o nitrobenzeno.
Um reagente muito versátil na síntese orgânica, envolvendo derivados do
benzeno, é o NBS (N-bromosuccinimida). Com este reagente, é possível
seletivamente substituir um hidrogênio na posição benzílica por um bromo.
Uma vez que o bromo esteja nesta posição, é possível se obter uma série de
outros compostos, por substituições nucleofílicas via SN1 ou SN2. Os
químicos sintéticos obtém muitos compostos orgânicos desta forma,
incluindo álcoois, aminas, acetonitrilas, entre outros. O esquema abaixo ilustra algumas
reações possíveis com o brometo de benzila - que pode ser obtido através da reação do
tolueno com o NBS.
O anel benzeno não pode ser oxidado;
entretanto,vários de seus derivados podem sofrer
oxidação. Uma das oxidações mais clássicas é a do
tolueno, que pode ser oxidado para um ácido
carboxílico - no caso, o ácido benzóico. A reação pode
ser feita com soluções ácidas de dicromato de sódio ou
permanganato de potássio. Como a reação de oxidação
envolve a remoção de hidrogênios do grupo alquila, um carbono terciário, tal como o
tert-butilbenzeno, não sofre oxidação. Independentemente do tamanho do grupo alquila
ligado ao anel, o composto sempre será oxidado no sentido de substituir os hidrogênios
benzílicos, isto é, formando o ácido benzóico (ou derivados).
Técnico em química – Química Orgânica II
13
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
3. Reações de aldeídos e cetonas
O grupo carbonila faz parte de varias funções orgânicas que estão presentes na Natureza e na indústria química desempenhando papel importante. Os aldeídos, RCHO, e
cetonas, RCOR1, são responsáveis pelo aroma e sabor de muitos alimentos. No sistema
biológico participam das funções de muitas enzimas. O centro reativo das estruturas
carboniladas esta no grupo carbonila, - C = O, que devido ao efeito de ressonância
permite uma variedade de reações de adição.
Aldeído por oxidação de álcool primário
Os aldeídos podem ser preparados a partir de álcool primário por oxidação com
clorocromato de piridínio, C5H5NH+CrO3Cl (PCC).
Técnico em química – Química Orgânica II
14
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Aldeído por oxidação de alceno
Os alcenos com hidrogênios vinílicos através de clivagem oxidativa produzem
aldeídos. A reação ocorre com o ozônio em presença de dimetilsulfeto.
Cetonas a partir de arenos
Este método de obtenção de cetona segue o processo de reação desenvolvido pelos
químicos Charles Friedel e James Crafts. Esta reação é conhecida com o nome de
acilação de Friedel-Crafts, e tem o objetivo de gerar cetonas aromáticas pela introdução
de um grupo acila no anel aromático. A outra reação descoberta por eles é a alquilação
de FriedelCrafts que tem a finalidade de introduzir radical alquila no anel aromático.
Nesta reação o anel aromático é um substrato rico em elétrons e sendo assim, mostra
afinidade por eletrófilos (E+). O eletrófilo desta reação é gerado de um cloreto de acila.
O benzeno é um substrato pouco reativo e por esta razão esta reação ocorre na
presença de um catalisador. O catalisador utilizado é o cloreto de alumínio, que inicia o
mecanismo preparando o eletrófilo. Qualquer eletrófilo ao interagir com o anel
aromático quebra a aromaticidade do anel.
Técnico em química – Química Orgânica II
15
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
No final do mecanismo a aromaticidade do anel é recuperada por uma base.
Desenvolvimento do mecanismo. Primeira etapa preparação do eletrófilo.
O par de elétrons do cloro é deslocado para o orbital vazio do alumínio. O complexo
formado é rompido na ligação carbonila–cloro gerando o eletrófilo. Na segunda etapa o
eletrófilo formado recebe o par de elétrons do anel aromático.
A próxima etapa do mecanismo tem como finalidade recuperar a aromaticidade do
anel, este procedimento é realizado por uma base de Lewis.
.
Técnico em química – Química Orgânica II
16
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
4.Reações de Adição e Substituição
As reações orgânicas são muito lentas, por isso geralmente necessitam de catalisadores,
altas pressões e temperaturas elevadas.
As reações de adição são comuns nas cadeias insaturadas (com ligação dupla ou tripla),
ou seja, cadeias que apresentam ligação π. Não esqueça que a ligação π é fraca e por
isso se quebra com muita facilidade. A ligação π proporciona certa instabilidade à
cadeia carbônica, possibilitando reações conforme ilustrado abaixo.
As reações de substituição são comuns em cadeias saturadas (apresentam apenas
ligações simples, ou seja, todas as ligaçõe
torna a cadeia mais estável. Dessa forma é mais difícil a quebra de ligações, o que
dificulta as reações de adição.
Na impossibilidade de ocorrer adição, haverá uma substituição, uma troca de átomos
entre os compostos reagentes, conforme ilustrado abaixo.
Reações com o anel benzênico
O anel benzênico possui três ligações duplas. Em função disso, era de se esperar que
sofresse reações de adição com a quebra das ligações pi.
Porém o fenômeno da ressonância (deslocamento dos elétrons pi) atrapalha, dificulta,
impede a quebra das ligações pi, tornando a cadeia estável de forma que dificilmente
ocorrerá reação de adição.
Técnico em química – Química Orgânica II
17
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
O anel benzênico sofre reações de substituição.
Reações em cadeias cíclicas.
As cadeias cíclicas com mais de quatro carbonos são muito estáveis (dificilmente
podem ser quebradas).
Em função disso, esses compostos sofrem substituição.
As cadeias cíclicas com três ou quatro carbonos são muito instáveis, ou seja, se
rompem com grande facilidade permitindo reações de adição com quebra da cadeia
cíclica.
Hidrogenação Catalítica ou Redução
Corresponde à reação com hidrogênio (H2) resultando na quebra da ligação pi.
Ocorre mediante pressão e temperatura elevadas com níquel ou platina como
catalisadores.
Redução dos alcenos
Técnico em química – Química Orgânica II
18
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
– Redução dos alcinos
Ocorre em duas etapas se for empregado um catalisador fraco (Pd com BaSO4).
Sendo a 2ª etapa mais lenta que a primeira porque a ligação tripla é mais instável que a
ligação dupla.
Se for empregado um catalisador forte (Ni ou Pt), a reação produz direto o alcano.
Hidrogenação do propino com catalisador fraco
Hidrogenação do acetileno diante de níquel como catalisador.
Redução dos compostos nitrogenados:
No estágio final, sempre produzem aminas, independente do composto orgânico
reagente ser um nitrilo, uma amida ou um nitro-composto.
Determine o produto da reação do cianeto de etila com 2 mols de hidrogênio.
– Redução dos hidrocarbonetos cíclicos:
Podem ocorrer na presença de níquel (Ni) como catalisador, em temperaturas da ordem
de 200oC, para o ciclopropano e o ciclobutano. Nessa temperatura, a estabilidade dos
anéis com cinco carbonos (ou mais) não permitem a quebra das moléculas.
Apenas em temperaturas da ordem de 300oC os anéis com cinco carbonos sofrem
hidrogenação, mas é bom lembrar que, quanto maior a quantidade de carbonos no anel,
maior será a temperatura necessária para a hidrogenação, tornando-as praticamente
inviáveis.
Hidrogenação do ciclobutano, com níquel e aquecido a 200oC.
Hidrogenação do ciclopentano, com níquel e aquecido a 300ºC
Técnico em química – Química Orgânica II
19
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
– Reação de Halogenação.
Reações entre composto orgânico e moléculas de X2 (sendo X um halogênio) diante de
calor e luz ultravioleta, podendo ocorrer na forma de adição ou de substituição,
geralmente obedecendo aos critérios.
Adição: Quando X2 reage com compostos insaturados ou com cadeias cíclicas
instáveis.
Substituição: Quando X2 reage com cadeias abertas saturadas, ciclos estáveis ou anel
benzênico.
Etileno tratado com gás cloro.
Etano reagindo com bromo (diante do calor e luz ultravioleta).
Observe que à medida que aumenta o número de átomos de carbono no anel, diminui
a distorção sofrida no ângulo entre as ligações. Sendo assim os anéis são mais estáveis,
à medida que aumenta o número de átomos de carbono.
Adição de 1 mol cloro a 1 mol de acetileno.
O produto obtido (1,2–dicloro–eteno) apresenta isomeria geométrica.
Adição de bromo ao ciclopropano.
Técnico em química – Química Orgânica II
20
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Reação entre gás cloro e ciclopentano.
Metano reagindo com cloro diante do calor e luz ultravioleta
Nas reações de substituição é formado em maior percentual, o produto que corresponde
à troca do hidrogênio pertencente ao carbono menos hidrogenado. Segundo Saytzeff.
O átomo de hidrogênio é retirado do átomo de carbono menos hidrogenado.
Propano
+
Bromo (diante do calor e luz ultravioleta)
Iso–butano tratado com cloro na presença de calor e luz ultravioleta.
Qual o produto orgânico formado pela reação entre cloro gasoso e benzeno?
Ocorreu como substituição porque anéis aromáticos são estáveis.
Técnico em química – Química Orgânica II
21
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Observação: A adição de F2 é tão rápida e violenta que destrói a molécula orgânica.
A adição de I2 é tão lenta, mesmo diante de catalisador, que é como se não ocorresse.
Dessa forma as adições de halogênio, na prática, envolvem apenas o cloro e o bromo.
Os compostos clorados são importantes como solventes orgânicos não inflamáveis,
usados tanto em laboratório como na indústria.
Adição de Halogenidretos
Reação entre composto orgânico e moléculas do tipo HX (HCℓ, HBr ou HI).
Ocorrem na forma de adição com a quebra da ligação pi em compostos alifáticos ou
quebra de anéis pouco estáveis (3 ou 4 carbonos no ciclo).
Etileno tratado com ácido clorídrico.
Regra de Markownikoff Nas reações de adição, a parte positiva (H+, por exemplo) é
preferencialmente adicionada ao carbono mais hidrogenado.
Propeno tratado com brometo de hidrogênio
Quais os dois produtos obtidos quando o buteno – 1 é tratado com ácido clorídrico ?
Qual deles é produzido em maior percentual ?
Qual o nome oficial (IUPAC) do composto formado em maior abundância quando o
metil–buteno–2 é tratado com ácido bromídrico ?
Efeito ou inversão de Kharash
Na reação de adição exclusivamente do HBr na presença de peróxido (H2O2), ocorre o
inverso das previsões de Markownikoff, ou seja, o átomo de hidrogênio é adicionado ao
carbono menos hidrogenado.
Técnico em química – Química Orgânica II
22
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Qual o produto obtido quando o buteno–1 é tratado com brometo de hidrogênio diante
de água oxigenada?
Qual o composto formado quando o propeno é tratado com ácido bromídrico na
presença de um peróxido ?
Reação entre ciclobutano e ácido clorídrico.
Não ocorrem as adições de HX aos anéis do ciclopentano e ciclohexano devido à
estabilidade desses anéis.
Reação de Hidratação
Corresponde a adição de água em meio ácido sob ação catalítica, provocando a quebra
da ligação pi.
Importante: Água = H+
OH–
Hidratação do etileno em meio ácido
Hidratação do buteno – 1 em meio ácido
Hidratação do acetileno
Técnico em química – Química Orgânica II
23
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Hidratação do propino
Quando a adição de água quebra a molécula orgânica em outras duas moléculas, têm-se
uma hidrólise do composto orgânico (reação essa que será vista posteriormente nesse
mesmo capítulo). Quando a água é adicionada ao composto orgânico sem quebra da
molécula, temos reação de hidratação.
Técnico em química – Química Orgânica II
24
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
05.Exercícios
01.Os alcenos podem reagir com várias substâncias como mostrado abaixo originando
produtos exemplificados como B, C e D. Quais os produtos exemplificados
02. A reação entre o cloreto de hidrogênio e o 2-metil-2-penteno, origina
03. Na hidrogenação catalítica do propeno em condições apropriadas, obtém-se como
produto da reação
04. Os lipídios formados pelos ácidos graxos insaturados geralmente são óleos; os
lipídios formados pelos ácidos graxos saturados são gorduras. Partindo de um óleo, qual
a reação necessária para obtenção de gordura?
05. Analisando-se qualitativamente uma amostra desconhecida, constatou-se, em função
de suas ropriedades, que ela era um hidrocarboneto. Essa amostra, ao reagir com ácido
bromídrico, produz 2-bromopropano.
Em função desse dado, qual o hidrocarboneto.
06. Uma reação típica de alquenos é a de adição à ligação dupla C
C. Em relação a
essa classe de reações, podemos afirmar o que segue.
I II
0 0 O propeno sofre reação de adição de HBr gerando 2-bromopropano.
1 1 O 2–metil–2–buteno sofre reação de adição de Br2 gerando o 2,3–dibromo–2–
metilpropano.
2 2 O 2–pentanol pode ser obtido a partir da reação de hidratação (adição de água em
meio ácido) do 1–penteno.
3 3 A reação de adição de HBr ao 2–metil–2–buteno gera um composto que apresenta
um carbono assimétrico.
4 4 A reação de adição de Br2 ao 2–metil–2–buteno gera produtos sem carbono
assimétrico (quiral).
07. Reações de hidrogenação catalítica são utilizadas, por exemplo, na indústria
alimentícia durante a produção de margarinas. A hidrogenação catalítica de 0,2 mol de
3,4-dimetil-2-penteno forneceu 16,4 g de um único produto. Determine o rendimento
percentual da reação.
Considere as seguintes Massas atômicas (g/mol): H = 1; C = 12; N = 14; O = 16.
Técnico em química – Química Orgânica II
25
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
08. O odor agradável das cascas de limão e laranja é devido ao limoneno. Qual a massa,
em gramas, de hidrogênio gasoso necessária para saturar completamente 2,72 kg de
limoneno na presença de platina metálica (100% de rendimento)? Considere as
seguintes massas atômicas molares (g/mol): H = 1,0 e C = 12,0.
09. O HCℓ, o HBr e o HI transformam os alcenos nos correspondentes haletos de
alquila. Na reação do HBr com o H3C – CH = CH2, na ausência e na presença de
peróxidos, ocorrerá respectivamente:
a) a formação do 2-bromopropano e a formação do 1-bromopropano.
b) a formação do 1-bromopropano e a formação do 2-bromopropano.
c) a formação do 1-bromopropano e a reação não ocorre.
d) a formação do 2-bromopropano e a reação não ocorre.
e) a reação não ocorre e a formação do 1- bromopropano.
10. A preocupação com o meio ambiente levou ao desenvolvimento de metodologias
verdes (pouco poluentes), que procuram reduzir a produção de rejeitos e a utilização de
reagentes tóxicos. Um exemplo de metodologia verde é a síntese descrita abaixo do
ácido adípico, utilizado na preparação do náilon–66. Considere as massas molares do
cicloexeno e do ácido adípico iguais a 82 e 146 g.mol–1, respectivamente.
Calcule a massa de ácido adípico em kg que será formada a partir de 41 kg de
cicloexeno, considerando que o rendimento da reação é 85%. Assinale o número inteiro
mais próximo.
Técnico em química – Química Orgânica II
26
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
11. Um estudante em laboratório fez reagir, de forma conveniente, o bióxido de
manganês, com quantidade estequiométrica de uma solução de ácido clorídrico. O gás
obtido foi posteriormente inflado em doisrecipientes: o primeiro contendo metano, e o
segundo, benzeno. O estudante tomou todas as precauções necessárias no laboratório,
para que as reações ocorressem de acordo com as exigências experimentais.
Em relação às reações, é CORRETO afirmar quea) a reação ocorrida no primeiro
recipiente não necessitou de luz, pois ela só ocorre às escuras e a temperaturas abaixo de
0ºC.
b) a reação que ocorreu no primeiro recipiente é de adição e só se realiza na presença
de luz e a temperaturas abaixo de 0ºC.
c) a reação que ocorreu no segundo recipiente requer catalisador específico e é
identificada como uma reação de adição halogenada.
d) a reação que ocorreu no segundo recipiente é de substituição e necessita de
catalisador específico para sua realização.
e) no segundo recipiente, a reação praticamente não ocorre, mesmo se utilizando
catalisador apropriado, pois o benzeno é energeticamente estável.
Técnico em química – Química Orgânica II
27
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
06. Reações de Nitração e Sulfonação
A hidroxila do ácido nítrico (HNO3) ou do ácido sulfúrico (H2SO4) deslocam um
hidrogênio (do carbono menos hidrogenado) do hidrocarboneto, produzindo um nitro
composto ou um ácido sulfônico.
Qual o produto da nitração do metano?
: Qual o produto da sulfonação do metano?
:Qual o produto obtido quando o propano é tratado com ácido nítrico em solução de
ácido sulfúrico concentrado?
Qual o produto da nitração do benzeno?
Qual o composto orgânico obtido quando o benzeno é tratado ácido sulfúrico
concentrado?
Técnico em química – Química Orgânica II
28
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Quando o hidrocarboneto é tratado com uma mistura de ácido nítrico e sulfúrico, quem
reage é o ácido nítrico e o ácido sulfúrico é apenas o agente que provoca a reação (a
desidratação).
Reações no anel benzênico e grupos orto/para e meta dirigentes
Para o estudo deste tópico, considere um anel benzênico contendo um grupo G.
Quando já existe um grupo (G) ligado ao anel benzênico, ele influi em todas as
substituições aromáticas descritas anteriormente. Ocorrem, então, duas situações
distintas:
O grupo G é orto–para–dirigente, ou seja, orienta as substituições para as posições orto
e para.
São grupos ativantes ou orto–para–dirigentes, em ordem crescente de intensidade:
O grupo G é meta-dirigente, ou seja, o grupo G orienta as substituições para as posições
meta.
São grupos desativantes ou meta–dirigentes:
Qual o produto da mononitração do Tolueno
Técnico em química – Química Orgânica II
29
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Trinitração do tolueno ou nitração total do tolueno
Qual o produto orgânico formado quando o ácido benzóico é tratado com mistura de
ácido nítrico e ácido sulfúrico concentrado ?
Quais os possíveis produtos esperados na monocloração do Fenol. Qual deles apresenta
maior ponto de ebulição ?
Técnico em química – Química Orgânica II
30
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
7. Substituições Nucleofílicas e Eletrofílicas
Substituintes são radicais que são acrescentados a cadeia orgânica substituindo um dos
hidrogênios dessa cadeia.
Substituinte Nucleofílico ( Y-)
Reagentes nucleófilos, também conhecidos como nucleofílicos, são favoráveis ao
núcleo como uma espécie de molécula ou íon, capaz de oferecer um par de elétrons para
a formação de uma ligação. Os nucleófilos são bases de Lewis*.
É um radical de carga negativa que substitui um hidrogênio da cadeia orgânica.
Produção de metanol a partir de cloro–metano com KOH em meio aquoso.
Substituinte Eletrófilo ( X+)
Reagente eletrófilo também é conhecido como eletrofílico é favorável ao elétron, como
uma espécie capaz de formar uma nova ligação, aceitando um par de elétrons. Os
eletrófilos são ácidos de Lewis*.
Reagente eletrófilo é um radical de carga positiva que substitui um hidrogênio da cadeia
orgânica.
Técnico em química – Química Orgânica II
31
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Qual o produto da nitração do metano?
Qual o produto da sulfonação do metano?
nitrações e sulfonações são substituições eletrofílicas.
Toda reação catalisada com AℓCℓ3 é substituição eletrofílica, a exemplo da
cloração do benzeno com AℓCℓ3.
Em linguagem simplificada.
Técnico em química – Química Orgânica II
32
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Em linguagem detalhada, explicitando o mecanismo de reação.
As cinco reações de substituição eletrofílicas aromáticas mais comuns, já
estudadas, são:
Halogenação: um halogênio (Br, Cl ou I) substitui um hidrogênio;
Nitração: um grupo nitro (NO2) substitui um hidrogênio;
Sulfonação: um grupo de ácido sulfônico (SO3H) substitui um hidrogênio;
Acilação de Friedel-Crafts: um grupo acil (RC=O) substitui um hidrogênio;
Alquilação de Friedel-Crafts: um grupo alquil (R) substitui um hidrogênio.
Técnico em química – Química Orgânica II
33
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
8.Lista de exercícios
01.Do ponto de vista da “Química Verde”, as melhores transformações são aquelas
em que não são gerados subprodutos. Mas, se forem gerados, os subprodutos
não deverão ser agressivos ao ambiente.
Considere as seguintes transformações, representadas por equações químicas,
em que, quando houver subprodutos, eles não estão indicados.
Qual a ordem dessas transformações, da pior para a melhor, de acordo com a
“Química Verde”:
03. A reação de hidratação de alguns alcinos pode ser representada por
em que R e R1 são dois grupos alquila diferentes
a) Escreva as fórmulas estruturais dos isômeros de fórmula C6H10 que sejam hexinos de
cadeia aberta e não ramificada.
b) A hidratação de um dos hexinos do item anterior produz duas cetonas diferentes, porém
isoméricas. Escreva a fórmula estrutural desse alcino e as fórmulas estruturais das cetonas
assim formadas.
Técnico em química – Química Orgânica II
34
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
04. A adição de HCl a alcenos ocorre em duas etapas. Na primeira delas, o íon H+,
proveniente do HCl, liga-se ao átomo de carbono da dupla ligação que está ligado ao
menor número de outros átomos de carbono. Essa nova ligação (C–H) é formada à custa
de um par eletrônico da dupla ligação, sendo gerado um íon com carga positiva, chamado
carbocátion, que reage imediatamente com o íon cloreto, dando origem ao produto final.
A reação do 1-penteno com HCl, formando o 2-cloropentano, ilustra o que foi descrito.
a)Escreva a fórmula estrutural do carbocátion que, reagindo com o íon cloreto, dá origem
ao seguinte haleto de alquila:
b) Escreva a fórmula estrutural de três alcenos que não sejam isômeros cis-trans entre si e
que, reagindo com HCl, podem dar origem ao haleto de alquila do item anterior.
c)Escreva a fórmula estrutural do alceno do item b que não apresenta isomeria cis-trans.
Justifique.
05.O medicamento utilizado para o tratamento da gripe A (gripe suína) durante a pandemia
em 2009 foi o fármaco antiviral fosfato de oseltamivir, comercializado com o nome
Tamiflu®. A figura representa a estrutura química do oseltamivir.
Técnico em química – Química Orgânica II
35
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Uma das rotas de síntese do oseltamivir utiliza como reagente de partida o ácido
siquímico. A primeira etapa dessa síntese é representada na equação:
a) Na estrutura do oseltamivir, identifique as funções orgânicas que contêm o grupo
carbonila.
b) Apresente a estrutura do composto orgânico produzido na reação do ácido siquímico
com o etanol.
Técnico em química – Química Orgânica II
36
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
9. EXPERIMENTOS
ANÁLISE ORGÂNICA QUALITATIVA
ESTUDO DA REATIVIDADE RELATIVA DE GRUPOS FUNCIONAIS
POR MEIO DE REAÇÕES ORGÂNICAS CLÁSSICAS.
OBJETIVOS
Apresentação do paralelo entre a análise sistemática clássica de identificação de amostras
desconhecidas e uma “nova abordagem de análise orgânica qualitativa”.
Estudo da reatividade relativa de diversos grupos funcionais.
Realização de algumas interconversões funcionais clássicas através de exemplos práticos
envolvendo teste de grupos funcionais e preparação de derivados.
Uso da análise clássica qualitativa na elucidação de amostras desconhecidas.
A sistemática clássica usada na identificação de amostras orgânicas foi desenvolvida muito
depois da sistemática de análise de substâncias inorgânicas e elementos. O primeiro e bem sucedido
programa de análise qualitativa para amostras orgânicas foi desenvolvido pelo professor Oliver
Kamm, apresentado no seu livro texto publicado em 1922.
Recentemente, o desenvolvimento de métodos instrumentais de separação e análise
(particularmente, cromatografia e técnicas espectroscópicas) revolucionou a prática da química
orgânica. Entretanto, o interesse na análise qualitativa clássica permanece grande, pois esse método é
muito eficaz, sendo ainda um dos meios mais interessantes de ensinar química orgânica.
Na análise clássica qualitativa de compostos orgânicos recomenda-se a execução seqüencial
dos seguintes procedimentos experimentais:
EXAME PRELIMINAR - O exame preliminar pode fornecer muitas informações se este for levado
a cabo inteligentemente. Vejamos alguns exemplos:
Cor - A cor da amostra é bastante informativa; amostras mais puras são incolores, brancas ou
pouco coloridas. A cor de uma substância orgânica pura é usualmente atribuída a presença de duplas
conjugadas. Substâncias orgânicas coloridas comuns incluem: nitro e nitrosos (amarelo), -dicetonas
(amarelo), quinonas (amarelo ao vermelho), azo (amarelo ao vermelho) e olefinas conjugadas e
cetonas (amarelo ao vermelho). A cor marrom é característica mais freqüente da presença de pequenas
impurezas, por exemplo, aminas e fenóis (incolores) tornam-se rapidamente marrom ou púrpura pela
formação de produtos de oxidação.
Odor - O cheiro de muitas substâncias orgânicas é extremamente característico, particularmente os
de baixo peso molecular. Através de um esforço consciente, poderemos ser capazes de reconhecer os
odores característicos de muitas classes funcionais. Álcoois, cetonas, hidrocarbonetos aromáticos e
olefinas alifáticas têm odores característicos. Algumas aminas líquidas e sólidas são reconhecidas por
seus odores de peixe. Ésteres apresentam, freqüentemente, fragrância agradável. O desagradável odor
dos tióis, isonitrilas e ácidos carboxílicos de baixo peso molecular não podem ser descritos com
clareza, mas é facilmente reconhecido. O odor mais agradável pode ser reconhecido mais facilmente
do que descrito. Devemos ser cautelosos ao cheirar substâncias desconhecidas, pois muitos compostos
não são apenas mal cheirosos bem como irritantes para as mucosas.
Técnico em química – Química Orgânica II
37
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
TESTE DE SOLUBILIDADE
Os ensaios de solubilidade podem dar informações indicativas na identificação de amostras
desconhecidas. A solubilidade dos compostos orgânicos pode ser dividida em duas categorias
principais: a solubilidade na qual somente está envolvida a simples miscibilidade e a solubilidade na
qual uma reação química é a força motriz, por exemplo, a reação ácido-base.
Na prática, determina-se a solubilidade de uma amostra desconhecida naqueles solventes que
podem fornecer informações úteis tais como: água, ácido clorídrico diluído, hidróxido de sódio
diluído, solução de bicarbonato de sódio e ácido sulfúrico concentrado e frio. Recomendam-se
também ensaios de solubilidade em solventes orgânicos, em geral, éter.
Os testes de solubilidade ainda hoje podem ser usados para dar informações indicativas na
identificação de substâncias desconhecidas. Entretanto, deve-se ter em mente que os mesmos não são
infalíveis, muitos casos limítrofes de solubilidade são conhecidos.
TESTE DE GRUPOS FUNCIONAIS
Após amostra desconhecida ter sido classificada em um dos grupos de solubilidade, pode-se
escolher e aplicar os testes de funcionalidade adequados. Por meio desses testes, funções muito
parecidas podem ser facilmente diferenciadas, como por exemplo: aldeídos de cetonas, acetilenos de
olefinas, álcoois de éteres, etc. Em geral esses testes são muito simples e rápidos, mas em certos casos
usam quantidades de reagentes considerados excessivas.
Os métodos espectrométricos modernos são muito mais rápidos e econômicos, mesmo assim,
os testes de caracterização de grupos funcionais muitas vezes ainda são usados para elucidar questões
duvidosas sob o ponto de vista das técnicas espectrométricas.
TESTES DE GRUPOS FUNCIONAIS
Cada grupo funcional apresenta certas reações características, daí as mesmas serem utilizadas como
reações de identificação. Estas reações são testes qualitativos que permitem caraterizar uma
determinada funcionalidade observando-se uma transformação química através de mudanças físicas
provocadas por uma reação. Algumas dessas mudanças não são fáceis de serem observadas, mas úteis
num determinado instante particular. Com restrições adicionais, os testes de análise funcional devem
ser realizados à pressão atmosférica e num intervalo de tempo relativamente pequeno.
A partir da evidência experimental acumulada, deduz-se o grupo funcional, ou os grupos
funcionais, que provavelmente estão presentes na amostra desconhecida, e realizam-se os ensaios por
meio de reagentes apropriados à classificação.
Listados abaixo encontramos os mais importantes testes de análise funcional, organizados por
classes funcionais, inclusive com as instruções para o respectivo emprego. O estudante é fortemente
aconselhado a não efetuar ensaios desnecessários, pois não somente constituem uma perda de tempo e
reagente bem como aumentam a possibilidade de erro. Sugere-se a leitura de obras especializadas em
que são discutidas em profundidade as limitações de cada teste.
Técnico em química – Química Orgânica II
38
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
ALQUENOS E ALQUINOS
A ligação múltipla é o grupo funcional reativo em alquenos e alquinos devido à pronta
disponibilidade dos elétrons , podendo sofrer uma série de reações químicas incomuns
em outras classes de substâncias orgânicas. Usualmente, os testes de insaturação mais
utilizados para determinar a presença de uma ligação múltipla em amostras orgânicas
são os testes de adição de bromo e oxidação com permanganato (teste de Bayer).
TESTE DE BAYER - O teste de Bayer consiste no descoramento da solução de permanganato de
potássio pela ligação múltipla de um alqueno ou alquino, com formação de um precipitado marrom
(MnO2).
C=C
+
MnO4
H2O
+
C C
OH OH
(violáceo)
MnO2
(precipitado
marron)
Procedimento: Testar uma pequena porção da amostra a ser analisada, sob agitação, com uma
solução de permanganato de potássio até que a coloração violácea persista. Uma vez que o
permanganato não é miscível com compostos orgânicos poderá ser adicionado 0,5 mL de 1,2dimetoxi-etano ou uma pequena quantidade de um catalisador de transferência de fase.
TESTE COM SOLUÇÃO DE BROMO EM TETRACLORETO DE CARBONO - Ligações
múltiplas de alquenos e alquinos descoram a solução de bromo em tetracloreto de carbono devido à
formação de dibrometo ou tetrabrometo, incolores. Ligações múltiplas conjugadas com grupos
carbonílicos (C=C-C=O) nas condições da realização do teste de adição de bromo, geralmente
manifestam resultado negativo.
R
R
R
C=C
CCl4
Br2
+
R
(vermelho)
R
Br
R
C C R
R
Br
(incolor)
Br Br
R C C
R
+
2 Br2
CCl4
R C C
R
Br Br
(vermelho)
(incolor)
Procedimento: Dissolver uma pequena porção da amostra a ser analisada em 2 mL de tetracloreto de
carbono e adicionar a solução de bromo em tetracloreto de carbono, gota a gota, até que a coloração
vermelha da solução de bromo persista.
Técnico em química – Química Orgânica II
39
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
HALOGENETOS DE ALQUILA
Os testes químicos de identificação de halogenetos de alquila tanto servem para evidenciar a presença
de halogênio (cloro, bromo ou iodo) como para decidir se a amostra em questão é um halogeneto
primário, secundário ou terciário. Os dois testes mais empregados são: a reação com solução alcoólica
de nitrato de prata e a reação com solução de iodeto de sódio em acetona.
SOLUÇÃO ALCOÓLICA DE NITRATO DE PRATA - Os halogenetos de alquila reagem com
nitrato de prata com precipitação do halogeneto de prata. A reação ocorre através de mecanismo SN1 e
a reatividade dos halogenetos de alquila cresce na seguinte ordem: primários
secundários
terciários.
R X
+
AgNO3
etanol
AgX
+
RONO2
(ppt branco, X = Cl)
(ppt amarelo-pálido, X = Br)
(ppt amarelo, X = I)
A velocidade da reação também é influenciada pelo tipo de halogênio envolvido na reação. Os
brometos e iodetos de alquila são mais reativos do que os cloretos que podem, às vezes, exigir
aquecimento. Os halogenetos de arila, vinila e/ou alquinila não reagem. Os halogenetos de alila (C=CC-X) e de benzila apresentam reatividade semelhante à dos halogenetos terciários.
Esse teste pode ser também usado na determinação do halogênio, já que o halogeneto de prata
formado tem coloração diferente, dependendo do íon halogeneto: cloreto de prata é branco; brometo
de prata, amarelo-pálido; e iodeto de prata, amarelo.
Procedimento: Colocar em um tubo de ensaio, 2 mL da solução alcoólica de nitrato de prata e 1 gota
da substância halogenada. Se não houver precipitação à temperatura ambiente, em 5 minutos, aquecer
o tubo em banho-maria. A formação de um precipitado é resultado positivo para halogênio. Observar
sua coloração. Adicionar ao precipitado algumas gotas de ácido nítrico a 5% e observar possíveis
mudanças. Os halogenetos de prata são insolúveis nestas condições, por outro lado, os sais de prata de
compostos orgânicos são solúveis.
SOLUÇÃO DE IODETO DE SÓDIO EM ACETONA - A solução de iodeto de sódio em
acetona pode ser usada para distinguir os halogenetos primários, secundários e terciários. Esse teste
complementa o anterior, e baseia-se no fato de que tanto o cloreto de sódio quanto o brometo de sódio
são pouco solúveis em acetona, sendo o iodeto de sódio é solúvel.
R Cl
+ NaI
acetona
+ NaI
acetona
R
I
+ NaCl
(ppt)
R Br
R
I
+ NaBr
(ppt)
A reação ocorre através de mecanismo SN2 e a reatividade dos halogenetos de alquila segue a segue
ordem: primário secundário terciário.
Este ensaio é limitado a cloretos e brometos de alquila. Os brometos primários precipitam
como brometo de sódio em cerca de 3 minutos à temperatura ambiente. Os brometos secundários e
terciários reagem quando aquecidos a 50 C. Os cloretos primários e secundários só reagem quando
aquecidos a 50 C. Os cloretos terciários não reagem.
Técnico em química – Química Orgânica II
40
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Procedimento: Colocar, em um tubo de ensaio, 1 mL da solução de iodeto de sódio e 2 gotas do
halogeneto de alquila (no caso de sólidos, dissolver cerca de 50 mg em um pequeno volume de
acetona). Agitar e deixar em repouso durante 3 minutos, à temperatura ambiente. Se não houver
formação de precipitado, aquecer a mistura em banho-maria a 50 C. Após 6 minutos de aquecimento,
resfriar até atingir temperatura ambiente e observar a formação do precipitado.
Outro ensaio para verificar a presença de halogênios (alquila ou arila) é o Teste de Beilstein. Neste
ensaio faz-se um pequeno anel na extremidade de um fio de cobre e aquece-se na chama de um
combustor Bunsen até que não apareça mais a coloração verde. O fio é então arrefecido naturalmente.
Depois mergulha-se o anel no composto original e aquece-se na borda da chama de Bunsen. A chama
verde indica a presença de halogênio.
FENÓIS
Os fenóis têm características ácidas. Os valores de pKa variam muito com a natureza dos
substituintes. Os principais testes de identificação de fenóis produzem cor. São os testes
com hidróxido de sódio e com cloreto férrico.
TESTE COM HIDRÓXIDO DE SÓDIO - Os fenóis reagem com hidróxido de sódio,
produzindo fenolatos, que podem ser coloridos ou tornar-se marrons, por oxidação. Alguns
fenolatos precipitam em solução aquosa de hidróxido de sódio a 10%, mas se dissolvem em
água.
Procedimento: Colocar, em um tubo de ensaio, 1 mL de solução aquosa de hidróxido de sódio a 10%
e uma pequena quantidade do fenol a ser analisado. Agitar bem e observar o aparecimento de cor.
Caso isto não ocorra, deixar a solução em repouso por 30 minutos. Se ocorrer precipitação, diluir a
solução com 20 mL de água e agitar.
TESTE COM CLORETO FÉRRICO - Os fenóis formam complexos coloridos com íon Fe3+. A
coloração varia do azul ao vermelho. O teste do cloreto férrico pode ser efetuado em água, metanol ou
em diclorometano.
3ArOH
+
[Fe(H2O)6]3+
Fe(H2O)3(OAr)3
+
3H3O+
Procedimento: Dissolver 10 a 20 mg de amostra em 1 mL de água. Adicionar 5 gotas da solução de
cloreto férrico a 3% e observar o desenvolvimento de cor (caso a amostra seja insolúvel em água,
dissolver em etanol).
Técnico em química – Química Orgânica II
41
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
ÁLCOOIS
A identificação dos álcoois primários e secundários é feita com o teste de Jones e com o teste de
Lucas.
TESTE DE JONES - O teste de Jones baseia-se na oxidação de álcoois primários e secundários a
ácidos carboxílicos e cetonas, respectivamente, pelo ácido crômico. A oxidação é acompanhada pela
formação de um precipitado verde de sulfato crômico. O teste de Jones também dá resultado positivo
para aldeídos e/ou fenóis.
O
RCH2OH + CrO3 +
H2SO4
O
R C
H
R2CHOH + CrO3 +
R
H2SO4
R
+
R C
C O
OH
+
Cr2(SO4)3
(verde)
Cr2(SO4)3
(verde)
R3COH
+ CrO3 +
H2SO4
não reage
Procedimento: Dissolver 2 gotas de amostra a ser analisada (ou 15 mg, se a amostra for sólida) em
10 gotas de acetona pura. Adicionar, com agitação, 5 a 6 gotas da solução de ácido crômico. O
aparecimento, em 5 segundos, de um precipitado verde confirma a presença de álcool primário ou
secundário. Testar primeiro a acetona que será utilizada como solvente. No caso positivo, adicionar
uma pequena quantidade de permanganato de potássio, refluxar e destilar.
TESTE DE LUCAS - O chamado teste de Lucas é a reação de álcoois com solução de ácido
clorídrico e cloreto de zinco, com a formação de cloreto de alquila.
R OH + HCl
ZnCl2
R Cl
+ H2O
A reação ocorre com a formação de um carbocátion intermediário. Forma-se mais rapidamente o
carbocátion mais estável e, a reatividade de álcoois aumenta na seguinte ordem: primário secundário
terciário alílico benzílico. O teste de Lucas é indicado somente para álcoois solúveis em água.
Procedimento: Misturar, em um tubo de ensaio, 2 a 3 mL do reagente de Lucas e 4 a 5 gotas da
amostra a ser analisada e observar o tempo gasto para a turvação da solução ou o aparecimento de
duas camadas. Os álcoois alílicos, benzílicos e terciários reagem imediatamente. Os álcoois
secundários demoram cerca de 5 minutos para reagir. Se não ocorrer reação em 5 minutos, aquecer
cuidadosamente em banho-maria durante 3 minutos. Os álcoois primários não reagem.
Técnico em química – Química Orgânica II
42
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
ALDEÍDOS E CETONAS
TESTE COM 2,4-DINITROFENILIDRAZINA - Os aldeídos e cetonas reagem com a 2,4dinitrofenilidrazina em meio ácido para dar 2,4-dinitrofenilidrazonas, usualmente como um
precipitado de coloração amarelo-avermelhada. O produto tem, na maior parte dos casos, um ponto de
fusão definido, o que permite caracterizar o aldeído ou cetona original.
NO2
NO2
R
(H)R C=O
H2 SO4
+
NO2
NO2
NHNH2
NH N=C
2,4-dinitrofenilidrazina
R
R(H)
2,4-dinitrofenilidrazona
(ppt amarelo-avermelhado)
Procedimento: Dissolver 1 ou 2 gotas do líquido (ou cerca de 100 mg do sólido) a ser analisado em 2
mL de etanol e adicionar 2 mL da solução de 2,4-dinitrofenilidrazina. Agitar fortemente. Caso não
haja precipitação imediata, deixar em repouso por 15 min. Se ainda assim não ocorrer precipitação,
aquecer ligeiramente a solução, e deixar em repouso por mais 15 min. Um precipitado amareloavermelhado é resultado positivo.
ENSAIO DE TOLLENS - Este ensaio permite a distinção entre aldeídos e cetonas. A oxidação do
aldeído pelo reagente de Tollens fornece um precipitado de prata elementar que aparece como um
espelho nas paredes do tubo de ensaio. As cetonas não reagem.
R CHO
+
2 Ag(NH3)2OH
2 Ag
reagente de
Tollens
espelho de
prata
+
RCOO NH4
+
3 NH3
+
H2O
Procedimento: Dissolver uma pequena quantidade da amostra a ser analisada em algumas gotas de
água ou etanol. Gotejar esta solução, com agitação constante, sobre cerca de 0,5 mL do reagente de
Tollens. Caso a reação não ocorra imediatamente, aquecer o tubo de ensaio levemente, em banhomaria. A formação de um precipitado escuro de prata e/ou a formação de espelho de prata são
resultados indicativos da presença de aldeído ou de outro grupo redutor.
Técnico em química – Química Orgânica II
43
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
TESTE DO IODOFÓRMIO - Este ensaio é positivo com amostras que contêm os grupos
CH3CO-, ou CH2ICO-, ou CHI2CO-, ligados a um átomo de hidrogênio ou um átomo de carbono que
não tem hidrogênios muito ativos, ou grupos que contribuem com um grau excessivo de impedimento
estéreo. O ensaio permite a distinção entre cetonas (RCOR) e metilcetonas (RCOCH3). As substâncias
que contêm um dos grupos mencionados não darão iodofórmio se o grupo for destruído pela ação
hidrolítica do reagente, antes da iodação se completar.
O
+
RCOCH3
3I2
+
3NaOH
R
C
+
CI3
3NaI
+
O
23H
NaOH
RCO2Na +
CHI3
iodofórmio
(sólido amarelo)
O ensaio do iodofórmio será positivo, como é claro, com compostos que reagem com o reagente teste
e formam um derivado que contem um dos grupos mencionados acima. A seguir aparecem os tipos
principais de compostos que dão resultado positivo no ensaio:
CH3CHO
CH3CH2OH
RCOCH2COR
CH3COR
RCHOHCH2CHOHR
CH3COCHOHCH3
CH3COCOCH3
CH3CHOHR
CH3CHOHCHOHCH3
CH3COCH2CH2COCH3
Procedimento: Dissolver uma pequena quantidade da amostra a ser analisada em algumas gotas de
dioxano (se a amostra não for solúvel em água), em um tubo de ensaio. Adicione 1 mL de solução de
hidróxido de sódio a 10% e depois uma pequena quantidade de uma solução de iodo em iodeto de
potássio, agitando sempre até que, até ter um ligeiro excesso, evidenciado pela coloração típica do
iodo. Coloque o tubo de ensaio em um banho de água, mantido à temperatura de 60 C. Quando o
ligeiro excesso de iodo for descorado (neste aquecimento), continue a adição da solução de iodo,
mantendo o aquecimento e agitando sempre, até que se manifeste, novamente, o excesso de iodo. A
adição de iodo de iodo deverá ser continuada até que a coloração escura não desapareça depois de 2
min de aquecimento no banho de água a 60 C. Ao final dessa etapa, o excesso de iodo é removido
pela adição de algumas gotas da solução de hidróxido de sódio a 10%. Então, enche-se o tubo de
ensaio com água e deixa-se em repouso por 15 min. o resultado positivo é indicado pela formação de
um sólido amarelo de odor característico (iodofórmio).
TESTE DE FEHLING OU BENEDICT - Os reagentes de Fehling e de Benedict são usados para
promover a oxidação seletiva dos aldeídos, especialmente em carboidratos. Estes reagentes contêm o
íon cúprico (Cu+2) em solução básica, complexado com o ânion do ácido tartárico (Fehling) ou do
ácido cítrico (Benedict). Ao oxidar-se o aldeído para formar um ácido carboxílico, o complexo azul de
Cu+2 é reduzido a íon cuproso (Cu+), que na solução básica, forma um precipitado marromavermelhado de Cu2O.
RCHO
+
2Cu+2
+
4OH
calor
RCO
2H
+
Cu2O
+
2H2O
ppt marrom-avermelhado
Técnico em química – Química Orgânica II
44
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
A D-glicose e outros carboidratos que são oxidados por oxidantes fracos, como reagente de Tollens
(Ag+), Fehling ou Benedict (Cu+2), são chamados redutores (porque reduzem estes reagentes) O
reagente de Fehling é usado como um teste qualitativo para a presença de glicose na urina, uma
indicação de diabetes ou disfunção renal.
Procedimento: Coloque cerca de 4 mL do reagente de Benedict ou de Fehling recentemente
preparado [obtido, misturando-se volumes iguais da solução a (solução de sulfato de cobre) e da
solução B (solução alcalina de citrato ou tartarato)], em um tubo de ensaio. Adicione 2-3 gotas da
amostra a ser analisada e ferva a solução. A formação de um precipitado vermelho de óxido cuproso é
um resultado positivo.
ÁCIDO CARBOXÍLICO
TESTE DO pH - Os ácidos carboxílicos são geralmente caracterizados pela sua capacidade de
ionizar e reagir com bases. Os ácidos carboxílicos são solúveis em solução aquosa de bicarbonato de
sódio a 5%, com evolução de dióxido de carbono, e em solução aquosa de hidróxido de sódio a 5%.
Os ácidos carboxílicos solúveis em água ionizam-se, dando pH menor que 7.
O
R C
O
+
R C
H2O
OH
+
H3O
O
Procedimento para análise do pH. Para ácidos carboxílicos solúveis em água, dissolver uma
pequena porção da amostra a ser analisada em 1 mL de água e testar o pH da solução com papel
indicador. Para ácidos carboxílicos insolúveis em água, dissolver uma pequena quantidade de
amostra em 1 mL de etanol ou metanol. Adicionar água, lentamente e com agitação, até a
turvação da solução. Acrescentar etanol ou metanol, gota a gota, até que a solução se torne
límpida, e testar o pH com papel indicador.
Técnico em química – Química Orgânica II
45
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
ÉSTERES
TESTE COM CLORETO DE HIDROLIXAMÔNIO - Os ésteres de ácidos carboxílicos são
normalmente caracterizados pela reação com hidroxilamina e cloreto férrico. O éster reage com
cloreto de hidroxilamônio (cloridrato de hidroxilamina), em meio básico, para dar o sal do ácido
hidroxâmico. Este se converte, em meio ácido, em ácido hidroxâmico, que por sua vez, reage com
cloreto férrico, produzindo um complexo de coloração violácea. A cor varia em intensidade,
dependendo do éster.
R C
O
+
H3NOHCl
NaOH
O
R C
OR'
HCl
R C
O
N O Na
N OH
H
H
ácido hidroxâmico
3R C
O
O
+
FeCl3
R C
Fe
N O
N OH
H
H
+
3HCl
3
complexo de cor
violácea
Os cloretos de ácido, os anidridos, as aminas, o ácido fórmico e algumas amidas também formam
complexos coloridos com os reagentes citados acima. Compostos nitrados alifáticos interagem com
cloreto férrico em meio básico. Este teste não é recomendado para compostos que contenham grupos
capazes de formar complexos coloridos com cloreto férrico. Dentre estes grupos, destacam-se a
hidroxila de fenóis e a forma enólica de certos aldeídos e cetonas. Por este motivo, costuma-se fazer
um ensaio preliminar, utilizando apenas cloreto férrico.
Procedimento:
Teste preliminar
Dissolver cerca de 50 mg da substância a ser analisada em 1 mL de etanol e
adicionar 1 mL de ácido clorídrico 1 M. Adicionar, então, 1 gota de solução aquosa de cloreto férrico
a 5% e observar o aparecimento de cor laranja, vermelha ou violeta. Se isto acontecer, o teste para a
função éster não poderá ser usado.
Teste para o grupo éster
Colocar, em um tubo de ensaio, cerca de 50 mg da substância a ser
analisada, 1 mL de solução etanólica 0,5 M de cloreto de hidroxilamônio e 0,2 mL de hidróxido de
sódio a 20%. Aquecer a mistura até a ebulição, esfriar um pouco e adicionar 2 mL de ácido clorídrico
1 M. Se houver turvação, adicionar cerca de 2 mL de etanol. Adicionar 1 a 2 gotas de solução aquosa
de cloreto férrico a 5% e observar o aparecimento de cor. Comparar com a do teste preliminar. A cor
vinho ou violeta, comparada com a coloração amarelada do teste preliminar, confirma a presença do
grupo éster.
Técnico em química – Química Orgânica II
46
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
NITROCOMPOSTOS
TESTE COM SULFATO FERROSO AMONIACAL (para substâncias mononitradas) - As
substâncias orgânicas que possuem grupos oxidantes são capazes de oxidar hidróxido ferroso (azul) a
hidróxido férrico (marrom). A reação ocorre principalmente com compostos alifáticos ou aromáticos
mononitrados, que são reduzidos a aminas. Compostos nitrosos, hidroxilaminas, nitratos de alquila,
alquilnitrilas e quinonas também costumam oxidar o hidróxido ferroso.
R NO2
+
6Fe(OH)2
+
4H2O
+
R NH2
azul
6Fe(OH)3
marron
Procedimento. Misturar, em um tubo de ensaio, uma pequena quantidade da amostra a ser analisada e
1,5 mL de uma solução recém prepara de sulfato ferroso amoniacal a 5%. Adicionar 1 gota de ácido
sulfúrico 3 M e 1 mL de solução metanólica de hidróxido de potássio 2 M. Arrolhar o tubo, agitar
bem e observar a mudança de cor azul para o marrom O oxigênio do também é capaz de interferir na
análise. Recomenda-se, portanto, o uso de um tubo de ensaio pequeno e a feitura de um teste em
branco para efeito de comparação.
AMINAS
TESTE DE pH EM SOLUÇÕES AQUOSAS - Aminas são substâncias com caráter básico, isto
é, interagem com água para produzir íons hidróxido. O pH da solução resultante normalmente é maior
do que 7.
R3N
+
H2O
R3NHOH
R3NH
+
OH
Procedimento. Dissolver em água uma pequena porção da amostra a ser analisada e testar o pH da
solução com papel indicador universal. No caso de aminas insolúveis em água, dissolvê-la em uma
mistura etanol-água.
Técnico em química – Química Orgânica II
47
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
TESTE DO ÁCIDO NITROSO - As aminas primárias alifáticas ou aromáticas reagem com ácido
nitroso para formar íons diazônio. Os sais de diazônio alifáticos são muito pouco estáveis e se
decompõem com produção de nitrogênio, álcool e olefinas, além de outros produtos derivados de
reações de acoplamento e de reações via carbocátion. Os sais de diazônio aromáticos são estáveis a
temperatura baixa (0 a 5 C) e reagem com fenóis e naftóis, com produção de corantes.
Procedimento. Dissolver, em um tubo de ensaio, uma pequena porção da amostra a ser analisada em
2 mL de ácido clorídrico 2 M e esfriar até 0-5 C em banho de gelo. Adicionar 5 gotas de solução fria
de nitrito de sódio a 20% e observar os resultados.
i) Se houver liberação imediata de gás incolor (nitrogênio), a amina é primária alifática.
RNH2
NaNO2
HCl
H2 O
R N2 Cl
N2
+
ROH
+
RCl + alquenos
ii) Se houver liberação imediata de nitrogênio, adicionar algumas gotas de uma solução fria contendo
50 mg de 2-naftol em 2 mL de hidróxido de sódio 2 M. O aparecimento de cor vermelha ou laranja
indica a presença de amina aromática.
iii) Se houver separação de um líquido amarelo insolúvel, sem liberação de gás, a substância pode ser
uma amina secundária alifática ou aromática.
RNH2
+
R2N NO
HONO
+
H2O
iv) Se não for observada reação, a amina é terciária alifática. O sal é insolúvel em solução ácida.
R3N
+
HCl
R3NHCl
(ppt)
O aparecimento de coloração amarelada em meio ácido pode também ser indicativo de N,Ndialquilanilina. Este tipo de amina reage com ácido nitroso, com produção de um derivado p-nitroso
de coloração verde que forma um sal amarelo em meio ácido.
TESTE COM p-N,N-DIMETILAMINOBENZALDEÍDO - Este teste aplica-se exclusivamente
a aminas primárias aromáticas e baseia-se na reação destas aminas com o p-N,Ndimetilaminobenzaldeído em meio ácido com produção de iminas. Estas iminas são conhecidas como
bases de Schiff e possuem coloração laranja avermelhada intensa.
NH2
N(CH3)2
H
CH3 CO2 H
+
N C
N(CH3)2
CHO
base de Schiff
Procedimento. Em um cadinho de porcelana, adicionar uma pequena porção da amostra a ser
analisada e algumas gotas de solução saturada de p-N,N-dimetilaminobenzaldeído em ácido acético
glacial. Intensa coloração laranja avermelhada indica a presença de aminas primárias aromáticas.
Técnico em química – Química Orgânica II
48
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
AMINOÁCIDOS
TESTE COM NINIDRINA - Todos os aminoácidos que contêm o grupo -amino livre
reagem com ninidrina, produzindo uma substância de coloração azul-violácea. Enquanto que a
prolina e a hidroxiprolina, que possuem o grupo -amino substituído, fornece derivados com a
cor amarelo característica
O
O
OH
H2O
O
NH2
O
RCHCO2H
N C CO2H
OH
O
ninidrina
O
H
- CO2
R C
+
N=CHR
O
O
O
O
H
H2O
O
NH2
O
O
H
O
+
O
NH2
Técnico em química – Química Orgânica II
O
49
H
O
O
O
R
N=
O
O
azul
H
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
REATIVIDADE RELATIVA DE GRUPOS FUNCIONAIS
Objetivo: Demonstrar que os grupos funcionais apresentam certas reações características, daí as
mesmas poderem ser utilizadas como reações de identificação. Pretende-se mostrar ainda que funções
muito parecidas podem ser diferenciadas por esse mecanismo e que, mesmo dentro de uma
determinada classe funcional, as substâncias que ali se enquadram manifestam comportamento
diferenciado, na maioria das vezes, em função de efeitos eletrônicos e estéreos.
Procedimento Experimental:
Parte I – Reatividade relativa de hidrocarbonetos [amostras sugeridas: hexano, cicloexano,
cicloexeno, 1-octino e tolueno].
A) Teste de chama (demonstrativo) - Em um vidro de relógio colocar 2 a 3 gotas ou alguns
miligramas de várias amostras disponíveis e inflamá-las (certifique de que não há nada
inflamável por perto!!!). Compare a luminosidade da chama e a produção de fuligem. Uma
chama amarela fuliginosa indica a presença de um composto aromático altamente insaturado, mas
uma chama amarela não fuliginosa normalmente é característica de hidrocarbonetos alifáticos.
B) Adição de bromo - Em tubos de ensaio seco adicione 2 a 3 gotas de cada amostra e adicione a
solução de bromo em tetracloreto de carbono, gota a gota, até que a coloração vermelha da
solução de bromo persista. Observe a evidência de descoramento da solução laranja de bromo.
C) Teste de Bayer – Em um tubo de ensaio dissolva 2 a 3 gotas de cada amostra a ser analisada em
dioxano (hidrocarbonetos são imiscíveis com a solução reagente) e gotejar, com agitação, a
solução de permanganato de potássio até que a coloração violácea persista. Observe a produção
de dióxido de manganês (ppt escuro).
Parte II – Reatividade de haletos de alquila e arila [amostras sugeridas: 1-bromobutano, 1clorobutano, cloreto de terc-butila e clorobenzeno].
A) Teste com solução etanólica de nitrato de prata – Em tubos de ensaio juntar 2 a 3 gotas de cada haleto e
adicionar cerca de 0,5 mL de solução etanólica de nitrato de prata. Agitar vigorosamente e observar a
reatividade de cada composto. Se não houver precipitação à temperatura ambiente, em 5 minutos,
aquecer o tubo em banho-maria. A formação de um precipitado é resultado positivo para halogênio.
Observar sua coloração.
B) Teste com solução de Iodeto de sódio em acetona – Em tubos de ensaio contendo cerca de 0,5
mL de solução de iodeto de sódio/acetona adicionar 2 a 3 gotas de cada amostra de haleto.
Aguardar alguns minutos e observar a eventual formação do precipitado. Agitar e deixar em
repouso durante 3 minutos, à temperatura ambiente. Se não houver formação de precipitado,
aquecer a mistura em banho-maria a 50 C. Após alguns minutos de aquecimento, resfriar até
atingir temperatura ambiente e observar a formação do precipitado.
C) Teste de Beilstein (demonstrativo) - Aquecer na chama de um bico de Bunsen um pequeno anel
na extremidade de um fio de cobre até que não apareça mais a coloração verde. Depois de frio,
mergulhar o anel no composto original e aquecer na borda da chama de Bunsen. A chama verde
indica a presença de halogênio.
Técnico em química – Química Orgânica II
50
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Parte III – Reatividade de álcoois, éteres e fenóis [amostras sugeridas: álcoois (1-butanol, 2propanol, terc-butanol), fenóis (resorcinol, 2-naftol) e éter (dioxano ou éter etílico).
A) Teste de Jones - Testar as várias amostras de álcoois fornecidas, dissolvendo 2 gotas de
amostra a ser analisada em cerca de 10 gotas de acetona pura. Adicionar, com agitação, 5 a 6
gotas da solução de ácido crômico. O aparecimento, em 5 segundos, de um precipitado verde
confirma a presença de álcool primário ou secundário. Testar primeiro a acetona que será
utilizada como solvente. Incluir no teste o dioxano (éter).
B) Teste de Lucas – Testar as várias amostras fornecidas (álcoois miscíveis com água) misturandose em um tubo de ensaio, 2 a 3 mL do reagente de Lucas (ZnCl2/HCl) e 4 a 5 gotas da amostra a
ser analisada. Observar o tempo gasto para a turvação da solução ou a separação eventual de duas
fases. Se não ocorrer reação em 5 minutos, aquecer cuidadosamente em banho-maria durante 3
minutos.
C) Teste com Cloreto Férrico – Testar as várias amostras fornecidas, no caso fenóis, misturando-se
5 ou 6 gotas (ou alguns miligramas, se sólido) com cerca de 1 mL da solução de FeCl 3/MeOH.
Verificar eventual mudança de coloração. Fenóis geralmente (mas nem sempre!) dão cores
variadas devido à formação de quelatos com íon FeIII. Incluir no teste o butanol (álcool).
Parte IV – Reatividade relativa de aldeídos e cetonas (amostras sugeridas: formaldeído, acetona,
acetofenona, benzaldeído, glicose, acetato de etila).
A) Teste de 2,4-dinitrofenilhidrazina - Testar as várias amostras fornecidas misturando-se 2 a 3
gotas (ou alguns miligramas, se sólido) com cerca de 1 mL do reagente (solução alcoólica de 2,4dinitrofenilhidrazina/H2SO4 diluído). Caso não haja precipitação imediata, deixar em repouso por
15 min. Se ainda assim não ocorrer precipitação, aquecer ligeiramente a solução, e deixar em
repouso por mais 15 min. Um precipitado amarelo-avermelhado é resultado positivo. Incluir o
teste com acetato de etila (éster).
B) Teste de Tollens (Teste específico para distinção entre aldeídos e cetonas) O reagente de
Tollens é obtido misturando-se cerca de 1mL de AgNO3 a 5% com 1 a 2 gotas de NaOH a 10% e
redissolvendo o precipitado formado com hidróxido de amônio (apenas o suficiente para total
dissolução). Testar as várias amostras de aldeídos e cetonas fornecidas misturando-se 3 a 5 gotas
(ou alguns miligramas, se sólido) com cerca de 1 mL do reagente de Tollens previamente
preparado. Caso a reação não ocorra imediatamente, aquecer brandamente o tubo de ensaio em
banho-maria. A formação de um precipitado escuro de prata e/ou a formação de espelho de prata
são resultados indicativos da presença de aldeído ou de outro grupo redutor.
Técnico em química – Química Orgânica II
51
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
C) Reação do iodofórmio – (Teste específico para o grupo metilcetona – CH3COR) – Dissolver
uma pequena quantidade das cetonas fornecidas em algumas gotas de dioxano (se a amostra não
for solúvel em água), em um tubo de ensaio. Adicione 1 mL de solução de hidróxido de sódio a
10% e depois uma pequena quantidade de uma solução de iodo em iodeto de potássio, agitando
sempre até que, até ter um ligeiro excesso, evidenciado pela coloração típica do iodo. Coloque o
tubo de ensaio em um banho de água, mantido à temperatura de 60 C. Quando o ligeiro excesso
de iodo for descorado (neste aquecimento), continue a adição da solução de iodo, mantendo o
aquecimento e agitando sempre, até que se manifeste, novamente, o excesso de iodo. A adição de
iodo de iodo deverá ser continuada até que a coloração escura não desapareça depois de 2 min de
aquecimento no banho de água a 60 C. Ao final dessa etapa, o excesso de iodo é removido pela
adição de algumas gotas da solução de hidróxido de sódio a 10%. Então, enche-se o tubo de
ensaio com água e deixa-se em repouso por 15 min. o resultado positivo é indicado pela formação
de um sólido amarelo de odor característico (iodofórmio).
Técnico em química – Química Orgânica II
52
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
SOLUBILIDADE DE COMPOSTOS ORGÂNICOS
Materiais
15 Tubos de ensaio
2 Espátulas (MP)
Papel Indicador (MP)
4 Pipetas graduadas de 5mL
3 Provetas de 100 mL (Capela)
3 Pipetas graduadas de 10 mL (Capela)
3 Peras (Capela)
2 Provetas de 100 mL (MP)
2 Pipetas Graduadas de 10 mL (MP)
2 Peras (MP)
Reagentes
50 mL de Solução de HCl 5%
50 mL de Solução de NaOH 5%
50 mL de Solução de NaHCO3 5%
300 mL de Éter Etílico (Capela)
Ácido Sulfúrico 98% (Conc.) (Capela)
p-metil anilina (ou p-toluidina)
ácido benzóico
Antraceno
etanodiol (etilenoglicol)
acetato de etila
Objetivo:
Determinar a solubilidade de algumas amostras líquidas e sólidas (A, B, C, D e E) para
identificar o tipo de grupo funcional que as amostras devem conter e conseqüentemente
propor qual será o composto orgânico em cada caso.
Fundamentações Teóricas
A solubilidade de compostos orgânicos é um importante parâmetro para a
caracterização química. Testes de solubilidade permitem prever a presença ou ausência
de
grupos
funcionais
e
reatividade
em alguns casos. De forma genérica, os testes de solubilidade permitem em uma
primeira análise classificar o composto em substância ácida, básica ou neutra. Assim os
testes são realizados em água, solução de hidróxido de sódio, solução de bicarbonato de
sódio,
ácido
clorídrico
diluído,
éter
e
ácido
sulfúrico
concentrado.
A solubilidade dos compostos orgânicos pode ser dividida em duas categorias principais:
a solubilidade decorrente da simples miscibilidade e a solubilidade resultante de uma
reação química, por exemplo, uma reação ácido-base. As duas estão inter-relacionadas.
Técnico em química – Química Orgânica II
53
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
A primeira é para determinar os solventes apropriados para: recristalização, análises
espectrais e reações químicas. A segunda é usada para identificar os grupos funcionais.
Em geral, compostos com grupos polares e de baixa massa molecular terão
solubilidade em água. A presença de grupos ácidos (um grupo carboxila, por exemplo)
resultará
em
solubilização
em
meio
básico devido à reação de formação de um sal (carboxilato de sódio). Por outro lado,
compostos
com
grupos básicos (aminas, por exemplo) terão reação em meio ácido gerando um sal de
amônio. Os testes de solubilidade estão descritos pelo Esquema 1 e a classificação é
apresentado na Tabela 1.
Segurança: O ácido clorídrico e o hidróxido de sódio são corrosivos. O ácido sulfúrico e
o ácido fosfórico concentrado provocam queimaduras quando em contato com a pele.
Procedimento Experimental
1. Testar a solubilidade das amostras A, B, C, D e E seguindo o roteiro apresentado
no Esquema 1, ou seja, realizar o primeiro teste com água, caso a substância seja
solúvel em água, testar com éter etílico, caso seja insolúvel em água, testar com
hidróxido de sódio 5% e assim por diante. Realizar os mesmos testes com as
amostras B, C, D e E, separadamente.
2. Inicialmente adicionar 2,0 mL do solvente em um tubo de ensaio. No caso dos
ácidos adicionar apenas 1 mL (redução de resíduos).
3. Adicionar algumas gotas do líquido (ou alguns cristais do sólido) desconhecido,
diretamente no solvente. (Atenção não adicionar grande quantidade de amostra
porque a análise visual poderá ser comprometida).
4. Agitar cuidadosamente durante alguns minutos, acompanhando visualmente o
comportamento do sistema.
5. Se houver dissolução completa da amostra, o composto será considerado solúvel
no solvente de teste.
6. Se a amostra dissolver em água, o pH deverá ser medido com papel indicador.
Técnico em química – Química Orgânica II
54
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
SUBSTÂNCIA
DESCONHECIDA
ÁGUA
INSOLÚVEL
SOLÚVEL
NaOH 5%
ÉTER
INSOLÚVEL
SOLÚVEL
HCl 5%
NaHCO3 5%
INSOLÚVEL
INSOLÚVEL
S2
SOLUVEL
SOLÚVEL
INSOLÚVEL
B
A1
A2
SOLÚVEL
VERMELHO AO
TORNASSOL
AZUL AO
TORNASSOL
NÃO ALTERA O
TORNASSOL
sa
SB
S1
H2SO4 96%
INSOLÚVEL
H3PO4 85%
I
SOLÚVEL
INSOLÚVEL
N1
N2
Observações
1. Quando um composto colorido se dissolve a solução assume esta cor.
2. O ácido sulfúrico concentrado pode provocar uma mudança de coloração,
indicando um teste positivo de solubilidade.
3. Sólidos desconhecidos que não dissolvem nos solventes citados acima podem
ser substâncias inorgânicas.
Quando forem fazer o relatório, indiquem quais compostos abaixo correspondem às
amostras A, B, C, D e E com base na Tabela 1 e nos resultados de solubilidade obtidos
experimentalmente. JUSTIFIQUE SUAS RESPOSTAS
Técnico em química – Química Orgânica II
55
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Questões:
1. Defina solubilidade e miscibilidade.
2. Por que determinados compostos orgânicos são solúveis em soluções ácidas e
outros são solúveis em soluções básicas? Esta dissolução é devido à solubilidade
ou miscibilidade?
3. Por que determinados compostos orgânicos são solúveis em água e éter etílico?
Esta dissolução é devido à solubilidade ou miscibilidade?
4. Indique a reação que está ocorrendo, quando for o caso.
Técnico em química – Química Orgânica II
56
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
DETERMINAÇÃO DE PONTO DE FUSÃO, EBULIÇÃO E
DENSIDADE
Materiais
1 Termômetro
Vários tubos capilares (MP)
Banho de aquecimento de glicerina (óleo mineral) - 1 Bico de bunsen
1 Tubo de Thiele
1 Rolha adaptada para termômetro.
1 Proveta de 10 mL
Elásticos (MP)
2 Balanças Semi-Analíticas (MP)
2 Pipeta Volumétrica de 20 mL (MP)
1 Pipeta Volumétrica de 20 mL
2 Espátulas (MP)
4 béqueres de 25 mL
4 Pipetas Pasteur (MP)
2 caixas de fósforo (MP)
2 peras (MP)
1 Garra por bancada (fixar tubo de Thiele)
1 Suporte Universal por bancada
2 Tubos de ensaio pequenos para Ponto de Ebulição
2 Almofariz com pistilo (MP)
Reagentes
Amostras sólidas A e B
Amostras líquidas C e D
Amostras metálicas 1 e 2
Objetivos:
Determinar o ponto de fusão e ebulição de alguns compostos orgânicos sólidos e
líquidos, respectivamente.
Determinar a densidade de alguns metais e de alguns líquidos.
Introdução:
O ponto de fusão
O ponto de fusão depende das forças existentes entre as moléculas (ou entre íons, no
caso de cristais iônicos) da substância sólida. Se estiverem fortemente ligadas umas as
outras, a temperatura necessária para separá-las deve ser elevada, para dispô-las em sua
nova forma, o líquido.
O ponto de ebulição
Se um líquido é colocado em um recipiente fechado, parte dele evapora, até que o vapor
formado tenha certo valor de pressão denominado tensão de vapor. Esta é uma
propriedade que depende da temperatura. Representa o limite máximo para a
evaporação daquele líquido, naquela temperatura. Quando a pressão de vapor igualase ao valor da pressão externa exercida sobre o líquido, a água ferve, com o
característico fenômeno da formação de bolhas de ar na massa líquida. Durante a
Técnico em química – Química Orgânica II
57
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
ebulição, bem como em qualquer transição de estados físicos, a temperatura do
sistema mantém-se constante, até que toda a massa líquida passe ao estado gasoso.
Densidade de Sólidos e Líquidos
A densidade de uma substância é a razão da sua massa por unidade de volume; ela
pode ser obtida, matematicamente, pela divisão entre esses dois valores. A fórmula é d
= m/v, onde d é a densidade, m é a massa e v é o volume. A razão é constante a
uma dada temperatura. As unidades de densidade mais empregadas são g/mL ou
g/cm3, a 20º C. A temperatura deve ser mencionada, uma vez que o volume da
substância varia com a temperatura e, conseqüentemente a densidade também varia.
Procedimento Experimental.
Determinando o ponto de fusão:
1. Montar uma aparelhagem para determinação do ponto de fusão usando um tubo
de Thiele e termômetro (Figura 1).
2. Pegar um capilar (cuidado para não quebrar) com diâmetro de 1-2 mm e
comprimento de 7-8 cm, fechado em uma das extremidades, caso necessário
feche uma das extremidades utilizando um bico de bunsen.
3. Triturar uma pequena quantidade do composto cujo ponto de fusão será
determinado (Amostra A) e coloque em uma cápsula de porcelana. Macere a
amostra.
4. Transfira uma pequena quantidade do composto triturado para o tubo capilar,
pressionando gentilmente a extremidade aberta contra a amostra na cápsula de
porcelana.
5. Empacotar o tubo capilar, soltando o capilar (com a extremidade selada voltada
para baixo) sobre uma superfície, para que o sólido se acomode no fundo do
capilar.
6. Repetir os itens 3.1.4 e 3.1.5 até acumular uma amostra de 1 cm de altura no
fundo do tubo capilar.
7. Colocar o capilar junto a um termômetro, de modo que sua ponta inferior atinja
aproximadamente a metade do bulbo de mercúrio.
8. Mergulhar o termômetro no banho de óleo contido no Tubo de Thiele (Figura 1).
9. Aquecer o óleo com uma chama moderada de um bico de Bunsen, dirigindo-a
para a lateral do tubo.
10. Controlar os valores das temperaturas atingidas pelo mercúrio, à temperatura do
banho deve aumentar de 2 a 3 graus por minuto.
11. Anotar a temperatura do momento em que a substância começar a fundir e na
fusão total. Essa faixa de temperatura é a temperatura de fusão da substância.
12. Repetir os itens 3.1.3 até 3.1.11 para a amostra B. Faça em duplicata.
Determinando o ponto de ebulição:
1. Desligue o bico de bunsen de sua bancada (há risco do líquido pegar fogo).
2. Colocar em um tubo de ensaio (Figura 2), utilizando uma pipeta Pasteur, o
líquido cujo ponto de ebulição será determinado (Amostra C).
3. Introduzir no líquido um tubo capilar com uma de suas extremidades fechada de
modo que
a extremidade aberta deste fique voltada para baixo.
Técnico em química – Química Orgânica II
58
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
4. Ajustar o tubo de ensaio com a amostra a um termômetro por meio de um
pequeno anel de borracha e colocar este conjunto em um tubo de Thiele (Figura
2).
5. Aquecer lentamente o tubo de Thiele até que uma corrente de bolhas suba
rápida e continuamente do tubo capilar. Interrompa o aquecimento neste ponto.
6. Quando as bolhas pararem de sair e o líquido entrar no tubo capilar anotar a
temperatura. Está será a temperatura de ebulição.
7. Este ponto indica que a pressão atmosférica é idêntica à tensão de vapor do
líquido.
8. Repetir os itens 3.2.1 até 3.2.6 para a amostra D. Faça em duplicata.
A correção da temperatura medida (Tm) com a pressão atmosférica P é calculada por:
Determinando a densidade de líquidos e Metais:
Determinação da Densidade de Metais
1. Pesar cada amostra e anotar a massa com precisão de 0,01 g na Tabela fornecida a
seguir.
2. Em uma proveta de 10 mL, adicionar água até aproximadamente à metade, para
fazer o
item 3.3.1.3.Anotar cada volume com precisão de 0,10 mL.
3. Colocar cuidadosamente (há risco da proveta quebrar), a amostra metálica 1
dentro da
proveta previamente preparada (item 3.3.1.2). Certificar-se de que
não há bolhas aderidas
ao metal. Ler e anotar o novo volume (com
precisão de 0,1 mL). Assumindo que o metal não se dissolve e nem reage com
a água, à diferença entre os dois níveis da água na
proveta, representa o
volume da amostra. Anotar o resultado na Tabela fornecida a seguir.
4. Recuperar a amostra secar cuidadosamente e guardar apropriadamente.
Repetir o procedimento com a amostra metálica 2. Faça em duplicata.
5. De posse dos dados, efetue o cálculo da densidade de cada amostra,
observando os algarismos significativos que deverão ser considerados. Compare
os valores experimentais
com os valores da literatura, listados na Tabela em
anexo.
Técnico em química – Química Orgânica II
59
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Determinação da Densidade de Líquidos
1. Pesar (tarar) um béquer de 25 mL, limpo e seco, com precisão de 0,01 g.
2. Com uma pipeta volumétrica de 20,0 mL, transferir 20 mL da amostra C
para o béquer previamente pesado (tarado). Pesar imediatamente o conteúdo
do béquer, e anotar a
massa com precisão de 0,01g na Tabela fornecida a
seguir.
3. Recolher o líquido utilizado, no frasco original. Repetir o procedimento
com a Amostra líquida D, iniciando cada determinação com um novo béquer de
25 mL, limpo e seco.
4. De posse dos dados, efetue o cálculo da densidade de cada amostra,
observando os
algarismos significativos que deverão ser considerados.
Compare os valores experimentais com os valores da literatura, listados na
Tabela em anexo.
Técnico em química – Química Orgânica II
60
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
DESTILAÇÃO SIMPLES
Destilação da gasolina (Hidrocarbonetos)
Procedimento experimental
Curva de destilação da gasolina
Materiais:
Balão de fundo redondo de 125 mL;
Manta de aquecimento
Cabeça de destilação
Termômetro de 0 a 200°C
Condensador de tubo reto
Provetas graduadas de 100 e de 25 mL
Suportes, garras, mufas, funil, rolha para termômetro, pipeta de 10 mL, tubo de
ensaio, pera, tripê e tela de amianto.
Procedimento
1. Medir com a proveta graduada, 100 mL de gasolina e transferir
completamente para o balão de fundo redondo, usando um funil. Não deixar
“escorrer” gasolina pelas laterais do balão. Não esqueça que você está
trabalhando com combustível. Colocar o balão na manta de aquecimento
apropriada.
2. Colocar umas pedrinhas de ebulição no balão e conectar a adaptação com o
termômetro, deixando o bulbo deste, um pouco abaixo da saída lateral. Conectar
a saída lateral ao condensador de tubo reto, prendendo-o ao suporte com auxílio
de garras e mufas. Tomar cuidado para não deixar “sob tensão”
nenhuma vidraria que irá a ficar presa ao sistema de suporte.
3. Colocar na saída do condensador uma “alonga” ou unha e recolher o destilado na
mesma proveta graduada utilizada na medida do volume da gasolina, sem laválo ou secá-lo (vedar com papel de alumínio).
4. Ligar a manta de aquecimento (tomada de 110v) e ir aumentando gradualmente
a temperatura de modo que a primeira gota caia na proveta graduada após 5 a
10 minutos. Anotar numa tabela a temperatura correspondente à saída da
primeira
gota, que caracteriza “o ponto inicial” da destilação.
5. Regular o aquecimento para que a velocidade de destilação seja de 4 a 5 mL/min.
6. Registrar a temperatura de destilação a cada 5,0 mL de gasolina destilada, até o
volume de 90 mL. A partir desse valor registrar a temperatura a cada 1,0 mL.
O aquecimento deve ser cada vez mais intenso. Deixar de registrar a temperatura
e considerar a destilação terminada quando observar que o seu valor começa a
cair, apesar do aquecimento ter sido mais intenso. O valor máximo da
temperatura caracteriza o “o ponto final” da destilação. Normalmente o
volume da gasolina destilada varia de 90 a 95 mL.
7. Interromper o aquecimento e, depois que o resíduo do balão voltar à temperatura
ambiente, medir o seu volume com uma pipeta de 10 mL e registrar o valor
na tabela. Guardar esse resíduo para a experiência seguinte.
8.
Técnico em química – Química Orgânica II
61
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
DADOS DA EXPERIÊNCIA
Acidez do resíduo da destilação da gasolina
Colocar na proveta graduada, contendo o resíduo, água destilada em volume igual a três
vezes o volume do resíduo. Tampar a proveta com rolha de cortiça e agitar
vigorosamente o conteúdo. Após a separação das duas fases, extrair com pipeta a
maior parte da fase aquosa e transferir para um tubo de ensaio limpo. Acrescentar
uma gota de indicador alaranjado de metila (“metil orange”) e observar a cor. O
aparecimento de uma coloração rósea ou vermelha indica acidez. Registre a sua
observação.
Questionário
1. Qual seria a curva de destilação de uma gasolina que fosse constituída apenas por
n-hexano puro?
2. Por que uma gasolina de boa qualidade não deve conter compostos sulfurados?
3. Como, pela comparação das curvas de destilação de duas gasolinas, pode-se
prever qual deverá ser mais facilmente inflamável?
4. Por que introduz pedras de ebulição no experimento?
5. Por que deve-se manter o sistema aberto e não hermeticamente fechado?
Técnico em química – Química Orgânica II
62
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
DESTILAÇÃO POR ARRASTE DE VAPOR
Introdução
As essências ou aromas das plantas devem-se principalmente aos óleos essenciais. Os
óleos essenciais são usados, principalmente por seus aromas agradáveis, em perfumes,
incenso, temperos e como agentes flavorizantes em alimentos. Alguns óleos essenciais
são também conhecidos por sua ação antibacteriana e antifúngica. Outros são usados na
medicina, como a cânfora e o eucalipto. Além dos ésteres, os óleos essenciais são
compostos por uma mistura complexa de hidrocarbonetos, álcoois e compostos
carbonílicos, geralmente pertencentes a um grupo de produtos naturais chamados
terpenos. Muitos componentes dos óleos essenciais são substâncias de alto ponto de
ebulição e podem ser isolados através de destilação por arraste a vapor.
A destilação por arraste de vapor é uma destilação de misturas imiscíveis de compostos
orgânicos e água (vapor). Misturas imiscíveis não se comportam como soluções. Os
componentes de uma mistura imiscível "fervem" a temperaturas menores do que os
pontos de ebulição dos componentes individuais. Assim, uma mistura de compostos de
alto ponto de ebulição e água pode ser destilada à temperatura menor que 100°C, que é
o ponto de ebulição da água.
O princípio da destilação à vapor baseia-se no fato de que a pressão total de vapor de
uma mistura de líquidos imiscíveis é igual a soma da pressão de vapor dos componentes
puros individuais. A pressão total de vapor da mistura torna-se igual a pressão
atmosférica (e a mistura ferve) numa temperatura menor que o ponto de ebulição de
qualquer um dos componentes.
Para dois líquidos imiscíveis A e B:
Ptotal = PoA + PoB
onde PoA e PoB são as pressões de vapor dos componentes puros.
Note que este comportamento é diferente daquele observado para líquidos
miscíveis, onde a pressão total de vapor é a soma das pressões de vapor parciais dos
componentes.
Para dois líquidos miscíveis A e B:
Ptotal= XA PoA + XB PoB
onde XAPoA e XBPoB correspondem às pressões parciais de vapor.
A destilação por arraste a vapor pode ser utilizada nos seguintes casos:
1. Quando se deseja separar ou purificar uma substância cujo ponto de ebulição é
alto e/ou apresente risco de decomposição;
2. Para separar ou purificar substâncias contaminadas com impurezas resinosas;
3. Para retirar solventes com elevado ponto de ebulição, quando em solução existe
uma substância não volátil;
4. Para separar substâncias pouco miscíveis em água cuja pressão de vapor seja
próxima a da água a 100°C.
Técnico em química – Química Orgânica II
63
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Metodologia
Neste experimento será isolado o eugenol (4-alil-2-metoxifenol, 1) do óleo de cravo
(Eugenia caryophyllata), pela técnica de destilação por arraste a vapor. Uma vez obtido
o eugenol, deve-se separá-lo da solução aquosa através de extrações com
diclorometano. Traços de água presentes no solvente deverão ser retirados com a ajuda
de um sal dessecante (sulfato de sódio anidro). Como é difícil purificar o composto
original ou caracterizá-lo através de suas propriedades físicas, pode-se convertê-lo em
um derivado. Este derivado será obtido através da reação do eugenol com cloreto de
benzoíla. O produto formado é o benzoato de eugenila 2, um composto cristalino com
ponto de fusão bem definido.
Procedimento experimental
Extração do eugenol:
Monte a aparelhagem conforme a Figura 1. O frasco coletor, de 125 mL pode ser um
erlenmeyer e a fonte de calor uma manta elétrica.
Coloque 10 g de cravos num balão de três bocas e adicione 150 mL de água. Inicie o
aquecimento de modo a ter uma velocidade de destilação lenta, mas constante. Durante
a destilação continue a adicionar água através do funil de separação, numa velocidade
que mantenha o nível original de água no frasco de destilação. Continue a destilação até
coletar 100 mL do destilado. Tire a água do funil de separação e coloque o destilado
nele. Extraia o destilado com duas porções de cloreto de metileno (10 mL). Separe as
camadas e despreze a fase aquosa. Seque a fase orgânica com sulfato de sódio anidro.
Filtre a mistura em papel pregueado (diretamente em um balão de fundo redondo
previamente tarado), lave com uma pequena porção de CH2Cl2 e em seguida retire o
solvente no evaporador rotativo.
Opcionalmente, após a filtração concentre a mistura (utilizando um banho de vapor na
capela), transfira o líquido restante para um tubo de ensaio previamente tarado e
concentre o conteúdo novamente por evaporação em banho-maria até que somente um
resíduo oleoso permaneça. Seque o tubo de ensaio e pese. Calcule a porcentagem de
extração de óleo, baseado na quantidade original de cravo usada.
Técnico em química – Química Orgânica II
64
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Destilação por arraste a vapor.
Preparação de um derivado:
Coloque cerca de 0,2 mL de eugenol bruto num tubo de ensaio pequeno e adicione 1
mL de água. Adicione algumas gotas de uma solução 1 M de hidróxido de sódio até que
o óleo seja dissolvido. A solução final pode ser turva, mas não deverá conter gotas
grandes de óleo. Adicione cuidadosamente 0,1 mL (3 a 4 gotas) de cloreto de benzoíla.
Excesso de cloreto de benzoíla deverá ser evitado, uma vez que este impede a
cristalização do produto final. Aqueça a mistura em banho-maria durante 5 a 10
minutos. Esfrie a mistura e atrite o interior do tubo de ensaio com um bastão de vidro,
até que a mistura se solidifique. Caso isto não aconteça, esfrie a mistura num banho de
gelo. Caso ainda não haja solidificação, decante a fase aquosa. Adicione algumas gotas
de metanol ao óleo e continue a atritar com o bastão de vidro o interior do tubo, imerso
em banho de gelo. Colete o sólido num funil de Hirsch e lave com um pequeno volume
de água gelada.
Recristalize o sólido com uma quantidade mínima de metanol. Caso um óleo se separe
da solução, reaqueça a mesma e esfrie mais lentamente, com atrito no interior do
recipiente. Colete os cristais num funil de Hirsch. Seque os cristais e determine o ponto
de fusão. O ponto de fusão do benzoato de eugenol é 70°C.
Técnico em química – Química Orgânica II
65
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
EXTRAÇÃO COM SOLVENTE
Objetivos
Nesta aula o aluno deverá aprender uma das técnicas de separação mais empregadas
em um laboratório Química Orgânica: A Extração com Solvente, assim como todos os
conceitos nela envolvidos. Os conceitos a serem assimilados nos alunos:
Vidraria utilizada para preparação de um sistema de Extração com Solvente;
Conceito de solubilidade;
Conceito de polaridade.
Pré-laboratório
Faça uma pesquisa sobre polaridade;
Faça uma pesquisa sobre solubilidade de uma substância;
Faça uma pesquisa sobre extração com solvente de uma substância;
Faça um resumo do procedimento experimental deste roteiro de prática.
Introdução
A extração com solvente é um método amplamente utilizado para separação de
substâncias. Desde que, estas apresentem um diferença de solubilidade. A extração
do produto desejado se dá pela adição de um solvente capaz de solubilizar a
substância e ao mesmo tempo não ser solúvel em água. Por tanto, neste processo,
seriam obtidas duas fases: uma fase orgânica contendo o produto desejado e uma fase
aquosa contendo os subprodutos.
Procedimento Experimental
Experimental I (Preparo da solução de Iodo - solução de tintura)
1. Num bécker pese 1,0 g de Iodo (I2);
2. Em outro bécker pese 2,0 g de Iodeto de Potássio (KI);
3. Transfira a mistura pesada para um grau. Com o auxílio de um pistilo,
misture-os até a completa homogeneização;
4. Adicione uma pequena quantidade de água destilada e agite até a completa
dissolução;
5. Transfira a solução para um balão volumétrico de 100 mL e afira o volume
com água destilada;
6. Assim, obteve-se uma solução mista com 2% de KI e 1% de I2.
Experimental II (Extração com Solvente)
O Iodo pode ser extraído da solução de tintura pelo n-hexano (solvente orgânico),
permanecendo o Iodeto de potássio em solução aquosa pelo seguinte procedimento:
1. Meça 10 mL da solução de iodo com o auxílio de uma proveta e transfira para o
funil de decantação. OBSERVAÇÃO: Antes, tenha certeza que a torneira esteja
fechada;
Técnico em química – Química Orgânica II
66
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
2. Meça 10 mL de n-hexano com o auxílio de uma proveta e transfira para o funil
de decantação. Observe que as fases orgânicas e aquosas não se misturam (veja
Figura (a));
3. Feche o funil de decantação com rolha apropriada. Com uma das mãos segure a
rolha para ter certeza que não soltará e com a outra mão
segure
a
torneira (veja Figura (b));
4. Em seguida, inverta o balão de ponta-cabeça fazendo um ângulo de 45⁰ e agite
vigorosamente com movimentos circulares (veja Figura (b));
5. Incline a parte inferior do funil para cima e abra lentamente a torneira, para
deixar sair dos gases que possam ser formados. OBSERVAÇÃO: Tome o
máximo de cuidado para não dirigir a saída dos vapores para si ou para seus
colegas;
6. Prenda o funil de decantação com uma garra de argola com um bécker ou
erlenmeyer afixado logo abaixo da saída do funil (veja figura (c));
7. Espere que as duas fases se separarem. A fase aquosa deverá ser a camada
inferior e a orgânica a superior;
8. Abra a tampa da parte superior, separe as duas fases abrindo a torneira;
9. Em seguida, transfira a fase orgânica pela tampa do funil de decantação para
um Bécker;
10. Recoloque a fase aquosa dentro do funil de decantação e adicione mais 10 mL
de n-hexano. Separe novamente as fases. Faça esse processo ao todo 3 vezes;
11. Em seguida colete a fase aquosa em um Bécker de massa conhecida e aqueça-o
até a completa evaporação da água. Deixe o Bécker resfriar e pese-o;
Pós-laboratório
1. Em que se baseia o princípio da técnica de extração com solvente?
2. O Iodo foi solúvel na fase orgânica ou na aquosa, por quê?
3. O Iodeto de Potássio foi solúvel na fase orgânica ou na aquosa, por quê?
4. Calcule o rendimento em porcentagem (%) de KI recuperado na extração.
CÁLCULO DA MASSA DE KI RECUPERADO − m(KI):
mKI = B - A
Onde: Massa do Bécker vazio (A);
Massa do béker vazio + massa do Bécker com KI (B);
Massa de KI recuperado − m(KI).
Técnico em química – Química Orgânica II
67
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
CÁLCULO DO RENDIMENTO DE KI RECUPERADO − R(KI):
Como a concentração de KI é 2%, significa que em 100 mL de solução existem 2 g de
KI. Dessa forma, em 10 mL de solução (volume utilizado no experimento) existem
0,2 g de KI. Agora 0,2 g representam 100% do KI contido nos 10 mL da solução
utilizada neste experimento. Assim:
0,2 g ------------------ 100%
Onde: m(KI) é a massa de KI
recuperado
m(KI) g --------------- R(KI)
R(KI) é o rendimento de
KI, em %.
Técnico em química – Química Orgânica II
68
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
CLASSIFICAÇÃO DE GRUPOS FUNCIONAIS
Objetivos
Estudar a reatividade relativa de diversos grupos funcionais.
Realizar algumas interconversões funcionais por meio de testes de grupos
funcionais e preparação de derivados.
Usar a análise orgânica qualitativa clássica na identificação de amostras
desconhecidas.
Teste de Grupos Funcionais
Após classificação da amostra desconhecida em um determinado grupo de solubilidade,
é necessário aplicar testes de funcionalidade adequados. Por meio deles, funções muito
parecidas podem ser facilmente diferenciadas, como por exemplo: aldeídos de cetonas,
acetilenos de olefinas, álcoois de éteres, etc. Em geral os testes são muito simples e
rápidos, mas exigem sempre o uso de reagentes, muitas vezes agressivos, tóxicos ou
dispendiosos. A caracterização de grupos funcionais por métodos espectrométricos
modernos (particularmente IV e RNM) é muito mais rápida, mas também exigem
instrumentação dispendiosa e nem sempre disponível. De todo modo, muitas vezes os
testes químicos de caracterização de grupos funcionais são ainda indispensáveis na
elucidação questões duvidosas sob o ponto de vista das técnicas espectrométricas.
Cada grupo funcional apresenta certas reações características, que podem ser usadas
para fins de identificação. Testes qualitativos, de fácil execução, permitem caraterizar
determinada funcionalidade observando-se mudanças físicas provocadas por uma reação
química. Algumas mudanças não são facilmente observáveis, mas ainda úteis em certas
circunstâncias. A partir da evidência experimental acumulada, deduz-se que grupo
funcional (ou grupos funcionais), está (estão) presente(s) na amostra desconhecida.
Realizam-se, então, ensaios por meio de reagentes adequados à uma caracterização mais
precisa.
Abaixo enumeramos os mais importantes testes de análise, usados na caracterização dos
grupos funcionais mais comuns.
Atenção: Usar apenas as quantidades recomendadas de reagentes e amostra, e evitar
ensaios desnecessários, reduzindo-se assim o gasto de material, a perda de tempo e
possibilidades de erro.
Sugere-se, além disso, a leitura de obras especializadas nas quais são detalhadas as
limitações de cada teste.
Técnico em química – Química Orgânica II
69
Escola Estadual de Educação Profissional [EEEP]
Ensino Médio Integrado à Educação Profissional
Referencias
1 SOLOMONS, T. W. G.; FRYHLE, C. B.. Química Orgânica 1. 10 Ed.. Rio de
Janeiro: LTC, 2012.
2 ALLINGER, N. L.; CAVA, M. P.; JONGH, D. C.; JOHNSON, C. R.; LEBEL, N. A.;
STEVENS, C. L.. Química Orgânica. Segunda Ed.. Rio de Janeiro: LTC, 1976.
3.
Técnico em química – Química Orgânica II
70
Hino Nacional
Hino do Estado do Ceará
Ouviram do Ipiranga as margens plácidas
De um povo heróico o brado retumbante,
E o sol da liberdade, em raios fúlgidos,
Brilhou no céu da pátria nesse instante.
Poesia de Thomaz Lopes
Música de Alberto Nepomuceno
Terra do sol, do amor, terra da luz!
Soa o clarim que tua glória conta!
Terra, o teu nome a fama aos céus remonta
Em clarão que seduz!
Nome que brilha esplêndido luzeiro
Nos fulvos braços de ouro do cruzeiro!
Se o penhor dessa igualdade
Conseguimos conquistar com braço forte,
Em teu seio, ó liberdade,
Desafia o nosso peito a própria morte!
Ó Pátria amada,
Idolatrada,
Salve! Salve!
Brasil, um sonho intenso, um raio vívido
De amor e de esperança à terra desce,
Se em teu formoso céu, risonho e límpido,
A imagem do Cruzeiro resplandece.
Gigante pela própria natureza,
És belo, és forte, impávido colosso,
E o teu futuro espelha essa grandeza.
Terra adorada,
Entre outras mil,
És tu, Brasil,
Ó Pátria amada!
Dos filhos deste solo és mãe gentil,
Pátria amada,Brasil!
Deitado eternamente em berço esplêndido,
Ao som do mar e à luz do céu profundo,
Fulguras, ó Brasil, florão da América,
Iluminado ao sol do Novo Mundo!
Do que a terra, mais garrida,
Teus risonhos, lindos campos têm mais flores;
"Nossos bosques têm mais vida",
"Nossa vida" no teu seio "mais amores."
Ó Pátria amada,
Idolatrada,
Salve! Salve!
Brasil, de amor eterno seja símbolo
O lábaro que ostentas estrelado,
E diga o verde-louro dessa flâmula
- "Paz no futuro e glória no passado."
Mas, se ergues da justiça a clava forte,
Verás que um filho teu não foge à luta,
Nem teme, quem te adora, a própria morte.
Terra adorada,
Entre outras mil,
És tu, Brasil,
Ó Pátria amada!
Dos filhos deste solo és mãe gentil,
Pátria amada, Brasil!
Mudem-se em flor as pedras dos caminhos!
Chuvas de prata rolem das estrelas...
E despertando, deslumbrada, ao vê-las
Ressoa a voz dos ninhos...
Há de florar nas rosas e nos cravos
Rubros o sangue ardente dos escravos.
Seja teu verbo a voz do coração,
Verbo de paz e amor do Sul ao Norte!
Ruja teu peito em luta contra a morte,
Acordando a amplidão.
Peito que deu alívio a quem sofria
E foi o sol iluminando o dia!
Tua jangada afoita enfune o pano!
Vento feliz conduza a vela ousada!
Que importa que no seu barco seja um nada
Na vastidão do oceano,
Se à proa vão heróis e marinheiros
E vão no peito corações guerreiros?
Se, nós te amamos, em aventuras e mágoas!
Porque esse chão que embebe a água dos rios
Há de florar em meses, nos estios
E bosques, pelas águas!
Selvas e rios, serras e florestas
Brotem no solo em rumorosas festas!
Abra-se ao vento o teu pendão natal
Sobre as revoltas águas dos teus mares!
E desfraldado diga aos céus e aos mares
A vitória imortal!
Que foi de sangue, em guerras leais e francas,
E foi na paz da cor das hóstias brancas!