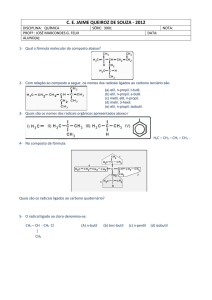
EIXO BIOLÓGICO
Unidade 10
Introdução às biomoléculas: estrutura e função
Autor: Professor Carlos Eduardo Anunciação
I. Introdução
II. Carboidratos
III. Lipídeos
IV. Proteínas e reações enzimáticas
V. Referências
#M2U10 I. Introdução
N
um organismo, os alimentos podem ser utilizados de diferentes maneiras e, de
acordo com as necessidades celulares, podem ser reciclados na sua forma fundamental, ou catabolizados de modo a serem transformados em moléculas menos
complexas que serão usadas como precursores no anabolismo ou para prosseguir sua quebra que cursa juntamente com a conservação de energia utilizada nos processos celulares.
Ao ingerir alimentos, o organismo inicia, por meio da mastigação, um processo de
desagregação dos componentes desses alimentos. Esse processo físico continua quimicamente até sua completa separação, nos intestinos, nas diversas biomoléculas, por ação das
enzimas e demais componentes digestórios do organismo, possibilitando sua absorção
seletiva pelas membranas celulares.
Nesta unidade, vamos discorrer sobre o papel das biomoléculas na nossa organização celular, conhecer suas propriedades e entender como sua estrutura pode ser organizada para desempenhar tantas funções diferentes, como reserva energética, proteção
celular, lubrificação, etc.
Ao final desta unidade você deverá ser capaz de:
Reconhecer e analisar as propriedades dos carboidratos, lipídeos, aminoácidos
e proteínas (aproveite para revisar as propriedades dos ácidos nucléicos na unidade 5 do módulo 1).
Avaliar o papel desempenhado por estas biomoléculas no organismo.
Compreender a estrutura e o mecanismo funcional das proteínas e enzimas.
386 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
P
Biológico
BSC
#M2U10 II. Carboidratos
Também chamados de glúcides ou glicídios, os carboidratos são, de longe, as biomoléculas mais abundantes na natureza e têm funções biológicas muito importantes. São
sintetizados pelos seres vivos e se apresentam de diversas maneiras, tais como a quitina
nos insetos, ou como componente estrutural das paredes celulares, na forma de grandes
polímeros como a celulose nos vegetais. Também são usados como um importante combustível para os seres vivos, sendo armazenados na forma de amido nas plantas e como
glicogênio nas células dos animais. É interessante notar que tanto nas plantas como nos
animais a D-glicose é o carboidrato mais utilizado pelas células e o único a compor a reserva energética destes diferentes seres.
Eles são de fundamental importância, sendo usados como fonte energética em uma
cadeia de reações, chamada glicólise, capaz de conservar grande parte da sua energia.
Essa via central do nosso catabolismo, além de retirar energia para a produção de ATP,
permite usar parte da molécula para biossíntese de novas outras como os aminoácidos e
lipídeos. Observamos ainda a produção pela ação fermentativa de bactérias e leveduras,
de produtos lácteos a partir da lactose do leite, outro tipo de açúcar e de etanol, utilizando
o açúcar sacarose da cana-de-açúcar.
Saiba mais
Metabolismo – conjunto de reações
bioquímicas de transformações nas
biomoléculas no nosso organismo,
objetivando a obtenção, armazenamento
e utilização de energia, no sentido de
construção (anabolismo) ou quebra
(catabolismo) de biomoléculas.
Glicose
Catabolismo
Anabolismo
CO2 + H2O + energia
Quimicamente falando, os carboidratos são poliidroxialdeídos ou
poliidroxicetonas (Aproveite para revisar as funções orgânicas aldeído
e cetona na unidade 4 do módulo 1), compostos a base de “hidratos de
carbono” na proporção de CnH2nOn, cujo número “n” vai de 3 a 10 carbonos aproximadamente. A D-glicose (Figura 1), por exemplo, possui 6
carbonos e, portanto, tem a fórmula de C6H12O6, denominada de hexose,
um poliidroxialdeído cuja fórmula é:
Na natureza podemos encontrar os carboidratos em três formas:
CH2OH
O
OH
OH
OH
OH
Figura 1:
alfa-D-glicose.
Como unidades simples em que são chamados de monossacarídeos, onde temos como exemplos glicose, frutose, galactose, glicerol, eritrose entre outros.
Como pequenas unidades de 2 ou mais monossacarídeos ligados covalentemente, ou oligossacarídeos, como os dissacarídeos, por exemplo, sacarose (glicose e
frutose), lactose (glicose e galactose) e pequenas cadeias de açúcares nas membranas celulares.
Como longas cadeias constituídas de centenas a milhares de unidades monossacarídicas ligadas covalentemente entre si, puras ou mistas, os chamados polissacarídeos, como o amido, o glicogênio, a celulose e os peptideoglicanos nas
paredes celulares das bactérias.
Cabe aqui uma observação – Esse padrão estrutural é comum em alguns grupos de
biomoléculas e é chamado de oligomerização.
Consórcio Setentrional de Ensino a Distância 387
B
#
M2U10
Introdução às biomoléculas: estrutura e função
Num determinado grupo de biomoléculas, encontramos unidades menores e menos complexas que são denominadas monômeros. Da ligação covalente entre monômeros
são originados oligômeros e polímeros, que podem ser diferenciados entre si pelo número de monômeros que os constituem ou pela sua origem, dependendo do contexto em que
são analisados.
Para o caso dos carboidratos, como acabamos de ver, os monômeros são chamados
de monossacarídeos (ex: glicose), os oligômeros são os oligossacarídeos (ex: sacarose, formada por uma glicose ligada a uma frutose) e os polímeros são formados por
centenas de monômeros (ex: amido, formado por diversas unidades de glicose).
Quando ingerimos a mandioca, o milho, a batata ou seus derivados, no ato da mastigação misturamos a enzima alfa-amilase, secretada pelas glândulas salivares, que iniciam o processo de quebra enzimática dos polissacarídeos em oligômeros e nas unidades
monoméricas de glicose. Esse processo, interrompido pelo ácido que se encontra no estômago, se reinicia nos intestinos, onde o pH alcalino é restaurado e mais amilase é secretada, até sua completa clivagem, permitindo a rápida absorção pelas células intestinais.
Os açúcares possuem em sua fórmula um átomo de carbono que pode se apresentar
como uma carbonila (contendo uma dupla ligação com o oxigênio) ou pode ser chamado
de carbono anomérico, caso o açúcar esteja na forma cíclica. Na forma linear, quando esta
dupla está no carbono 1 corresponde à função aldeído (sendo o carboidrato classificado
como aldose) e, na sua outra única posição possível, no carbono 2, a função cetona (sendo
o carboidrato classificado como cetose). (Figura 2)
CHO
CH2OH
OH
O
OH
OH
CH2OH
CH2OH
D-eritrose (aldose)
D-eritrulose (cetose)
Figura 2:
A função cetona e aldeído;
a) D-eritrose (aldose);
b) D-eritrulose (cetose).
388 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
Curiosidade
Importante:
os átomos que
formam uma
biomolécula,
não são seus
monômeros. Os
monômeros
são moléculas.
Cuidado para não
confundir!
P
Biológico
BSC
B
Os carboidratos mais comuns na natureza possuem 6, 5, 4 e 3 carbonos (Figura 3),
sendo o gliceraldeído, o açúcar de 3 carbonos, a única triose a possuir isomeria óptica. Isto
se dá porque os três átomos de carbono se ligam ao O e H formando funções químicas
diferentes, resultando em uma propriedade já conhecida no carbono 2, o carbono quiral.
O carbono 2 do gliceraldeído, ao se ligar a 4 grupos diferentes, coloca seus quatro ligantes em geometria tetraédrica, resultando em duas formas espaciais possíveis, D e L.
Na outra triose (cetose) possível, a dihidroxicetona, o carbono 2, ao fazer a dupla
ligação com o oxigênio, se liga a apenas 3 átomos ou funções químicas diferentes, resultando em uma forma geométrica linear que não apresenta variações espaciais.
109.5º
C
109.5º
A)
Este carbono com 4 ligantes diferentes, chamado de carbono assimétrico ou centro
Molécula Quiral:
Imagem
no éespelho
quiral,
importante para a determinação
dosofrendo
tipo de estereoisômero (açúcar D ou L), e os
mesmo
de uma molécula
A
a molécula
açúcaresoriginal
que possuem mais carbonosrotação
apresentam
mais carbonos quirais, entretanto o carnão pode ser superposta
bono quiral mais distante da carbonila
(o carbono
da dupla ligação) é quem determina
à imagem
do espelho
a forma isomérica
D ouC L.
A
Y
Molécula
original
A)
B
(a)
X
C
Y
X
Imagem
no espelho
A
de uma molécula
original
C
B
B
X
Y
A
A
C
Y
Molécula
original
B
Y
X
B
X
Imagem do espelho
de uma molécula
original
C
X
Y
Molécula Aquiral:
após rotação adequada
a molécula pode ser
superposta à imagem
do espelho
B)
A
A
B
Imagem
do espelho
A
de uma molécula
original
X
C
X
C
B
B)
Molécula
original
A
X
C
(b)
Molécula Quiral:
mesmo sofrendo
rotação a molécula
não pode ser superposta
à imagem do espelho
X
C
B
X
X
A
B
Molécula
original
C
X
X
C
X
Molécula Aquiral:
após rotação adequada
a molécula pode ser
superposta à imagem
do espelho
A
Figura 3:
Assimetria molecular:
B
a) moléculas quirais
A
b) aquirais.
X
C
Consórcio BSetentrional de Ensino a Distância
389
B
X
X
#
M2U10
Introdução às biomoléculas: estrutura e função
A presença de carbono(s) quiral(is) no carboidrato gera uma forma geométrica singular, de característica não plana, resultando, quando da formação de polímeros,
em macromoléculas com formas e características especiais tão diferentes como o
amido e a celulose.
Atividade complementar 1
1. Desenhe a molécula da glicose e calcule quantos carbonos assimétricos ela possui.
2. Vivencie esta diferença química espetando em duas bolinhas de isopor ou em
dois limões, palitos de dente em ângulos de 109 graus.
3. Una as duas bolas ou mais através dos palitos e verifique se é possível assumir a
forma plana? Use palitos partidos ao meio para representar os grupos –OH.
Na natureza e principalmente no meio aquoso, os carboidratos adquirem a forma cíclica, pois se tornam moléculas mais estáveis. A ciclização dos açúcares ocorre
nas moléculas com 5 ou mais carbonos, através da carbonila e o carbono assimétrico
mais distante desta.
Na molécula da glicose ela ocorre entre o carbono 1 com o carbono 5, resultando
numa estrutura contendo 6 átomos na formação do anel. Esta forma assumida é semelhante à da estrutura química do pirano e a glicose é chamada de D-glicopiranose.
Outro monossacarídeo, chamado frutose, apresenta a dupla ligação com o oxigênio
no carbono 2 (cetose), sendo que a ciclização ocorre entre o carbono 2 e 5, resultando em 5
átomos no anel, semelhante a molécula química furano e é chamada de D-frutofuranose.
Observe que na frutose tanto o carbono 1 quanto o 6 ficam de fora do anel. Observe,
também, que na ciclização ocorre a atração do par de elétrons livre do oxigênio do carbono assimétrico pelo carbono quiral mais distante, resultando no deslocamento temporáCHO
CHO
rio da dupla ligação com oCHO
oxigênio, surgindo uma função
CHO –OH (hidroxila).
Lembrando que os carbonos internos do açúcar
são
assimétricos
e, portanOH
H
H
HO
C também
C
OH
H
H
HO C
C
to, não possibilitam ao
carbono
assumir qualquer
posição plana,
que torna inviável a forCH OH
OH
mação do anel entre carbonos
vizinhos. O grupo –OH pode
surgir acima ou abaixo doCH
anel,
2
CH2OH
CH22OH
uma vez que o carbono que apresentava a função
carbonila agora tornou-se assimétrico.
D-Gliceraldeído
L-Gliceraldeído
D-Gliceraldeído
L-Gliceraldeído
Esse carbono assimétrico
exclusivo da forma cíclica
é chamado de carbono anomérico.
Este grupo –OH Fórmulas
quando fica
do anel
é chamado
tipo alfadeouFischer
ά DFórmulas
dede
projeção
de acima
projeção
de Fischer
glicopiranose e, quando para baixo, é chamado de ß D-glicopiranose (figura 4).
CHO
H
CHOCHO
OH
C
COH H
H HOC
CH2OH
CHO
CHO
H
HO
CH2OH
CH2OH
D-Gliceraldeído
CC
CHO
HOH
HO
CH
CH2OH
OH
2
D-Gliceraldeído
L-Gliceraldeído
L-Gliceraldeído
-Gliceraldeído
D
C
H
CH2OH
L-Gliceraldeído
Fórmulas em perspectiva Fórmulas em perspectiva
Fórmulas de projeção de Fischer
H
CHO
H
C
OH
C
O
CH2OH
H
H
D-Gliceraldeído
H
CHO
H
C
C OH H
C
CH
OH
OH
2
HO
L-Gliceraldeído
H
H
CC
H CC
HH
CC
OH
O OH
OHOH
H
H
Dihidroxicetona
Fórmulas em perspectiva
Gliceraldeído
H
O
Gliceraldeído
H
C
OH
C
O
Figura 4:
H
C
Formas isoméricas
do gliceraldeído e a
dihidroxicetona.H
Dihidroxicetona
H
O
390 H
Módulo
II — Processos biológicos na captação e na transformação da matéria e da energia
C
H
C
H
OH
C
OH
C
O
OH
P
Biológico
BSC
Atividade complementar 2
A partir do modelo molecular que você fez com as bolas de isopor, tente representar a estrutura química da glicose, agora com seis bolas. Você vai verificar que
apenas duas formas ou configurações de anel são possíveis de se obter, a de barco
e de cadeira.
Voltando ao princípio da termodinâmica que você aprendeu, onde diz que quanto
mais espaçados ou distantes estão os átomos de uma molécula, mais estável ela será, você
verá que a forma de cadeira é a única que representa esta alternativa (Figura 5). Aproveite
para verificar a posição do grupo –OH em alfa e beta.
6
CH2OH
H
5
4
H
OH
HO
3
O
H
H
H
1
H
OH
OH HO
H
OH
-D-Glicopiranose
O OH
CH
Piran
ß-D-Glicopiranose
H
1
CH2OH HOCH2 O
OH
O
HO 2
HO
H
H
4
OH
3
OH
H
OH
H
-D-Frutofuranose
H
CH
H2C
HOCH2
5
O
HC
HC
H
H
OH
2
H
6
CH2OH
O
HC
CH2OH
CH
C
H
C
H
Furan
ß-D-Frutofuranose
Figura 5: d-glicopiranose e d-frutofuranose.
Atividade complementar 3
Saiba Mais
As papilas
gustativas estão
localizadas na
mucosa que
recobre a língua.
Em cada papila
estão localizados
vários receptores
nervosos que,
ao serem
estimulados,
transmitem
impulsos que são
decodificados no
cérebro. Um fator
que prejudica
o paladar é
o acúmulo
de resíduos
alimentares
na mucosa da
língua, pois
estes bloqueiam
o estimulo às
papilas.
Tente representar a molécula da frutose e verifique a diferença estrutural das formas piranosídicas e furanosídicas.
Agora você está pronto para entender os reflexos nas nossas vidas das formas químicas que aprendemos. Os diferentes açúcares nos dão sensação de doçuras diferentes.
As nossas papilas gustativas possuem moléculas de proteínas capazes de reconhecer os
açúcares pela sua fora geométrica. Como os açúcares, mesmos entre as hexoses possuem
a disposição dos grupos –OH distribuídos ao redor do anel diferentes, eles se encaixam
com intensidades diferentes nos receptores das papilas, com maior e menor intensidade,
nos impingindo maior ou menor sensação de doce.
Saiba mais
6
CH2OH
Você sabia que esta descoberta permitiu que
1
os cientistas desenvolvessem os adoçantes? Os
H
O H HOCH2 O
H 5
açúcares sintéticos utilizados como adoçantes
H
não são metabolizados pelo nosso organismo e
4
β 2 H
HO 5
OH
H1α
foram desenvolvidos com a intenção de simular
a forma geométrica do açúcar que mais nos
O
CH2OH
2
3
4
HO 3
6
desencadeia a sensação de doce, o dissacarídeo
H
OH
H
OH
sacarose (figura 6). Eles estimulam os receptores
Sacarose
de uma forma mais eficiente que a sacarose,
α-D-glicopiranosil β-D-frutofuranosídeo
portanto nos dão maior sensação de doçura.
Glc(α1 2β)Fru
Consórcio Setentrional de Ensino a Distância 391
B
#
M2U10
Introdução às biomoléculas: estrutura e função
Atividade complementar 4
Vamos explorar mais nossa visão geométrica da glicose. Experimente construir
duas moléculas cíclicas de glicose – uma na forma alfa e outra na forma beta.
Tente fazer a sobreposição das duas moléculas sem romper nenhuma ligação. Você
vai verificar que, apesar de serem muito semelhantes e de conterem exatamente os
mesmos átomos e os mesmos tipos de ligação, a disposição espacial do carbono 1
é diferente, de forma que somente poderia existir sobreposição entre as moléculas,
caso as ligações covalentes fossem modificadas.
Indo mais adiante, os açúcares podem se unir para formar os oligo e polissacarídeos
através da ligação entre os grupos –OH do carbono anomérico de um monossacarídeo.
Esta ligação é chamada de ligação glicosídica e ocorre com a saída de uma molécula de
água (Figura 7).
CH OH
CH OH
2
H
H
OH
2
Hemiacetal
O
H
H
H
HO
OH
OH
H
ß-D-Glicose
H2O
6
5
6
4
H
OH
HO
3
H
O
H
Acetal
CH2OH
H5
H
4
OH
H
1
2
H
OH
condensação
H2O
H
H
H
hidrólise
CH2OH
O OH
HO
Álcool
-D-Glicose
H
OH
O
3
H
OH
ß-
-D-Glicose
O
H1
2
OH
H
OH
-D-Glicose
Maltose
-D-Glicopiranosil-(1
Hemiacetal
4)-D-glicopiranose
Figura 7:
Ligação glicosídica.
Atividade complementar 5
Aproveitando o modelo molecular construído por você e observando o grupo –OH
do carbono 1 (anomérico) na posição beta, verifique a possível união de dois anéis
pelos carbonos 1 e 4 (β1 → 4).
Considerando a estrutura na configuração de cadeira do anel e a ligação β1 → 4, verifique que o grupo –OH em alfa do carbono 1 do primeiro anel permite uma boa aproximação do segundo açúcar sem torcê-lo, ou seja, mantendo-o no mesmo plano do primeiro
anel. A figura resultante é como uma escada, onde os degraus representam o assento e
o encosto da cadeira do nosso açúcar. Daí é possível construir uma “fita” em linha reta,
embora na forma de escada, de um polissacarídeo. Esta forma linear permite que possamos justapor duas ou mais linhas de polissacarídeo, formando “folhas”, como acontece
no caso da celulose (Figura 8).
392 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
OH
HO
OH
O
O
O
O
HO
OH
O
Unidades de D-glicose ligadas (β1 Biológico
→ 4)
OH
HO
BSC
OH
O
O
O
P
OH
O
O
HO
OH
OH
Unidades de D-glicose ligadas (β1 → 4)
Figura 8: Estrutura da celulose.
Atividade complementar 6
Agora experimente trocar o grupo –OH de beta para alfa no carbono 1 e aproximáOH
A)
HO
O
lo do grupo –OH do carbono 4 do outro anel. Verifique que isto só
é possível com a
O
torção da molécula de um dos anéis.
CH2OH
O
Ao ligar mais monossacarídeos por ligação glicosídica, a forma assumida pela esCH2OH
trutura resultante é uma estrutura helicoidal, como uma
verdadeira mola. Esta forma
glicosídica resultante da união alfa1 → 4, forma uma grossa fita helicoidal contendo uma
fenda central, permitindo que muitas moléculas de água
se agreguem no seu interior.
O
Esta é a estrutura de um dos polímeros doHO
amido, aOamilose que tem a forma linear.
A amilopectina é outra estrutura encontrada no amido e ocorre quando na cadeia linear
Unidades de D-Glicose ligadas ( l 4)
fazemos ligações do tipo alfa1 → 6 (além das alfa1 → 4) criando ramificações na cadeia
central. O carbono 4 do açúcar inserido na posição 6 permanece livre e é utilizado para
criar uma nova fita helicoidal linear do tipo alfa1 → 4. (Figura 9)
OH
A)
OH
HO
O
B)
O
CH2OH
O
CH2OH
OH
O
HO
O
Unidades de D-Glicose ligadas ( l
B)
4)
Figura 9: a) estrutura linear da amilose; b) estrutura helicoidal
da amilopectina (cada hexágono é um resíduo de glicose).
Quanto mais ramificações acontecem na cadeia central, mais globuloso e esponjoso fica o polissacarídeo, formando grânulos na batata e, no caso da mandioca, menos
ramificada e mais dura ela fica. Por isso, quando fritamos ou congelamos uma batatinha
ou mandioca elas murcham, porque a água que se instala dentro da estrutura helicoidal
dando consistência ao amido se desloca, deixando os espaços internos vazios.
Vale ressaltar que os grupos –OH do açúcar atraem moléculas de água via pontes
de hidrogênio para o interior da estrutura da mola, dando o aspecto de firmeza (dureza)
ao amido encontrado na batata e na mandioca.
Consórcio Setentrional de Ensino a Distância 393
B
#
M2U10
Introdução às biomoléculas: estrutura e função
Outra diferença interessante, o amido, por formar grânulos, não induz agregação
forte entre os polímeros, não possui forma definida e pode ter sua estrutura desfeita pelo
aquecimento. A união β1 → 4 da celulose, por formar fitas ou folhas, permite um contato
muito íntimo entre as fibras e pode ser desfibrilada pela moagem, mas volta a adquirir
consistência de folha ao se juntar às fibras com uma peneira ou moldá-la com as mãos,
como o papier-mâché.
A essa altura você deve ter se perguntado: como eu posso dissolver a sacarose no
café e não posso dissolver o amido e nem a celulose?
Bem, isto acontece porque a massa molecular de um monossacarídeo e até de alguns dissacarídeos, em relação às pontes de hidrogênio com as moléculas de água, são
favoráveis para manter a molécula miscível na água. Quando o número de monossacarídeos no polímero alcança um número muito grande, fica impossível manter o polissacarídeo miscível na água, porque a razão entre pontes de hidrogênio e massa molecular fica
muito desfavorável, fazendo o polímero precipitar.
Esta propriedade é muito utilizada pelos trabalhadores da mandioca, que separam os polímeros de amido em duas frações, a totalmente insolúvel de grande massa
molecular para fazer a farinha e a de massa molecular inferior, mas ainda insolúvel
em água, o polvilho.
Nas membranas das nossas células a estrutura helicoidal resultante das ligações
alfa1 → 4 e alfa1 → 6 são muito úteis. Ligadas aos lipídeos e também às proteínas da
superfície externa da célula, encontramos uma camada de lipopolissacarídeos e glicopolissacarídeos ramificados (glicocálice), delgada ou espessa como no glicogênio e a
zona pelúcida do óvulo.
As cadeias alfa1 → 4 sofrem diversas ramificações do tipo alfa1 → 6, que originam
inúmeras novas pequenas cadeias polissacarídicas alfa1 → 4. A estrutura resultante se assemelha a uma frondosa árvore, cuja copa esconde e protege a membrana citoplasmática
e, pelo pequeno número de unidades de monossacarídeos, não são insolúveis.
Glicocálix
394 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
P
Biológico
BSC
Glicoproteína
É importante notar, também, que devido às pontes de hidrogênio que um monossacarídeo pode fazer (5, uma para cada hidroxila exposta da glicose), um pequeno polímero pode
agregar em torno de si um grande número de unidades de molécula de água. Essa propriedade e a baixa reatividade da glicose quando hidratada, o torna ideal para recobrir não somente a membrana celular, mas também as cartilagens dos ossos nas nossas articulações.
Ao recobrir as articulações com compostos a base de polissacarídeos ramificados de
cadeia curta, que assumem um aspecto semelhante a uma pena macia de ave, permitimos que
os ossos possam se articular uns sobre os outros com um mínimo de desgaste por atrito.
Na verdade, temos nas articulações uma mistura constituída de uma cadeia central
protéica flanqueada de inúmeros polissacarídeos de cadeia curta, denominada de mucopolissacarídeos ácidos. Estas estruturas são macias, esponjosas e gomosas, semelhantes à
cola feita de amido, ideais para recobrir as articulações das cartilagens.
A dupla ligação da carbonila com o oxigênio permite ao carbono participar de reações de óxido-redução pela dupla de elétrons livres no último orbital do átomo de oxigênio. Mesmo com a estrutura de anel, este par de elétrons continua livre e só não permitirá
participar de uma reação quando ambas carbonilas estiverem envolvidas na ligação glicosídica, como acontece na sacarose (βD glicose 2 → 1 alfa D frutose).
6
CH2OH
H
5
4
H
OH
HO
3
H
O H
H
1
HOCH2
1 α
2
OH
β 2
O
H
O
HO 5
H
3
OH
4
H
CH2OH
6
Sacarose
α-D-glicopiranosil β-D-frutofuranosídeo
Glc(α1 2β)Fru
Dessa forma, temos que o carbono anomérico, quando não envolvido em uma
ligação glicosídica, confere ao carboidrato um potencial redutor. Quando se aquecem
unidades de açúcares redutores com compostos de ferro e cobre (sulfatos de cobre e sulfatos de ferro), estes reagem reduzindo o cobre ou o ferro estequiometricamente, gerando
compostos coloridos. Isto é muito útil na análise e quantificação de compostos contendo
Consórcio Setentrional de Ensino a Distância 395
B
#
M2U10
Introdução às biomoléculas: estrutura e função
açúcares, como o plasma ou soro e a urina. A base das reações químicas, utilizadas por
sistemas e aparelhos simples utilizados para checar o nível de glicose no sangue, é muito
útil na determinação do nível de glicemia e controle do diabetes.
Atualmente são utilizados métodos enzimáticos, que apresentam maior sensibilidade e maior especificidade, porém a simplicidade dos métodos que usam a propriedade redutora dos açúcares ainda faz desse método um recurso útil em situações de
recursos limitados.
#M2U10 III. Lipídeos
Na unidade 3 você viu a estrutura e alguns aspectos sobre as moléculas dos lipídeos, suas interações com as moléculas da água e alguns aspectos na formação de micelas
e das membranas celulares. Agora vamos conhecer um pouco mais destas moléculas tão
conhecidas genericamente por nós e que exercem tantas funções importantes e diferentes
no nosso organismo, muitas delas ainda desconhecidas.
Devido à natureza apolar e à baixa reatividade, apesar da alta concentração de
energia nas suas ligações, os lipídeos são considerados moléculas neutras no nosso organismo. Mas alguns tipos dessas moléculas no nosso organismo apresentam uma partição seletiva com a água, originada pela presença de um grupo polar na molécula (cabeça
polar), por isso são moléculas chamadas de anfipáticas. Esta propriedade permite a formação das membranas e manutenção de algumas funções celulares e, dada a estabilidade destas, são muito exploradas para diferenciar a composição das membranas e sua
superfície externa.
Atividade complementar 7
Procure pesquisar quais são os tipos de lipídeos presente no organismo humano ou
animal, sua estrutura química e funções.
A maioria dos tipos de lipídeos no nosso
organismo é derivada dos ácidos graxos e em
segundo plano dos colesteróis. Estes ácidos graxos geralmente estão ligados à molécula do glicerol via ligação éster, contendo de duas a três
cadeias de ácidos graxos. Quando a ligação se
dá com três cadeias de
1
3
CH2 CH2
O ácido graxo, formando
O
um triacilglicerol, toC O
CH O
C
2
dos os três grupos –OH
O
da molécula do glicerol
O C
estão esterificados, não
existindo nenhum grupamento iônico livre,
assim, a molécula torna-se totalmente apolar e é utilizada como
armazenamento de energia pelo organismo.
Quando apenas duas cadeias de ácido graxo estão ligadas
ao glicerol, temos o diacilglicerol, que possui uma estrutura cilíndrica, estrutura ideal para a formação de membranas, como
você viu nas unidades anteriores.
Triacilglicerol
396 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
P
BSC
Biológico
B
Quanto à cadeia carbônica, estes ácidos graxos podem apresentar somente ligações
simples entre os átomos de carbono, ou apresentar uma ou mais duplas ligações espaçadas geralmente por 3 carbonos. Os sufixos –oléico, -linoléico e –linolênico são acrescentados no nome da molécula quando ela possui 1, 2 ou 3 insaturações (Tabela 1).
Tabela 1: Nomenclatura dos ácidos graxos
Solubilidade a 30ºC
(mg/g solvente)
Esqueleto
carbônico
Estrutura*
Nome sistemático†
Nome comum
(derivação)
Ponto de
fusão (ºC)
Água
Benzeno
12:0
CH3(CH2)10COOH
Ácido n-dodecanóico
Ácido láurico
(do latim, laurus,
“árvore do louro”)
44,2
0,063
2,600
14:0
CH3(CH2)12COOH
Ácido n-tetradecanóico
Ácido mirístico
(do latim, Myristica,
gênero de noz moscada)
53,9
0,024
874
16:0
CH3(CH2)14COOH
Ácido n-hexadecanóico
Ácido palmítico
(do latim, palma,
“palmeira”)
63,1
0,0083
348
18:0
CH3(CH2)16COOH
Ácido n-octadecanóico
Ácido esteárico
(do grego, stear,
“gordura dura”)
69,6
0,0034
124
20:0
CH3(CH2)18COOH
Ácido n-eicosanóico
Ácido araquídico
(do latim, Arachis,
“gênero dos legumes”)
76,5
24:0
CH3(CH2)22COOH
Ácido n-tetracosanóico
Ácido lignocérico
(do latim, lignum,
“madeira” + “cera”)
86,0
16:1(Δ9)
CH3(CH2)5CH
CH(CH2)7COOH
Ácido cis-9-hexadecenóico
Ácido palmitoléico
-0,5
18:1(Δ9)
CH3(CH2)7CH
CH(CH2)7COOH
Ácido cis-9-octadecenóico
Ácido oléico
(do latim, oleum, “óleo”)
13,4
18:2(Δ9,12)
CH3(CH2)4CH CHCH2CH
CH(CH2)7COOH
Ácido cis-,cis-9,12octadecadienóico
Ácido linoléico
(do grego, linon, “linho”)
-5
18:3(Δ9,12,15)
CH3CH2CH
CHCH2CH CHCH2CH
CH(CH2)7COOH
Ácido cis-,cis-,cis-9,12,15octadecatrienóico
Ácido α-linolênico
Ácido cis-,cis-,cis-,cis5,8,11,14-icosatetraenóico
Ácido araquidônico
20:4(Δ5,8,11,14) CH3(CH2)4CH CHCH2CH
CHCH2CH CHCH2CH
CH(CH2)3COOH
-11
-49,5
Todos os ácidos têm suas fórmulas apresentadas na forma não-ionizada. Em pH 7, todos os ácidos graxos livres têm um carboxilato
ionizado. Note que a numeração dos átomos de carbono se inicia no carbono carboxílico.
*
O prefixo “n-” indica uma estrutura “normal”, não-ramificada. Por exemplo, “dodecanóico” simplesmente indica 12 átomos de carbono, que
poderiam ser dispostos em uma variedade de formas ramificadas; “n-dodecanóico” especifica a forma linear, não-ramificada. Para ácidos
graxos insaturados, a configuração de cada dupla ligação está indicada; em ácidos graxos biológicos, a configuração é quase sempre cis.
†
É importante notar que os mamíferos não sintetizam ácidos graxos insaturados contendo uma dupla ligação após o carbono 9 (C9). Nossa maquinaria metabólica (mamíferos)
apresenta limites na capacidade da síntese relativa ao número de carbonos e ao número de
duplas ligações, ou seja, não possuímos enzimas para executar esses tipos de anabolismo.
Atividade complementar 8
Pesquise sobre o que são e qual a importância dos ácidos graxos essenciais.
Você também viu na unidade 5 do módulo 1 que o número de cadeias instauradas
nos diacilgliceróis da membrana citoplasmática é um fator crucial na adaptação das nossas células às mudanças climáticas.
Consórcio Setentrional de Ensino a Distância 397
#
M2U10
Introdução às biomoléculas: estrutura e função
Ao contrário do princípio da termodinâmica, os dois átomos de carbono ao redor
da dupla ligação do carbono C9 ocupam a posição Cis e não trans, como era de se esperar
(Figura 10). Isso impõe uma torção na cadeia hidrocarbonatada, dificultando a interação
inter-molecular desses compostos, conferindo característica de tendência ao estado líquido em temperatura ambiente, ideal para períodos de temperatura mais baixas.
H
H
H
C
C
H2
C OH
O
C
C
O
C9
Figura 10:
Diacilglicerol – linoléico. Ácido graxo
insaturado com dupla ligação no
carbono 9 da cadeia.
Nas membranas, o terceiro grupo -OH livre da molécula do glicerol pode ser ligado
a grupos polares, tendo como conseqüência um aumento na polaridade desses lipídeos,
através da inserção de um fosfato (um fosfolipídeo) ou um carboidrato, mais especificamente a glicose (glicolipídeo). Além de aumentar a polaridade e a coesão destes componentes das membranas, eles servem como elo para a adição de diferentes tipos de novas
biomoléculas, originando classes especiais de lipídeos (Figura 11), resultando em atividades específicas ao tipo celular, conforme você verá a seguir.
Lipídios de
armazenamento
(neutro)
Lipídios de membrana (polares)
Fosfolipídios
Ácido graxo
Ácido graxo
Glicerol
Glicerol
Ácido graxo
Ácido graxo
Ácido graxo
PO4
Álcool
Esfingolipídios
Esfingolipídios
Ácido graxo
PO4
Colina
Esfingolipídios
Glicerofosfolipídios
Esfingolipídios
Triacilgliceróis
Glicolipídios
Ácido graxo
Mono ou
oligossacarídeo
Figura 11: classes de lipídios de armazenamento e de membrana.
Triacilgliceróis
Os triacilgliceróis são as gorduras de reserva comuns nos animais e vegetais. Nos
animais, as cadeias de ácidos graxos apresentam carbonos saturados, flexíveis, capazes de
formar uma estrutura cristalina organizada, portanto são sólidos a temperatura ambiente.
Nos vegetais, estes ácidos graxos são insaturados, portanto líquidos a temperatura ambiente. Estes ácidos graxos são muito procurados pelas indústrias alimentícias e farmacêuticas para a produção de margarinas, batons, sorvetes, etc.
Esfingolipídeos
As membranas de algumas células especializadas, como no caso das células nervosas, apresentam um tipo diferenciado dos diacilgliceróis que contêm um composto cha-
398 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
P
Biológico
BSC
mado de esfingosina (Figura 12). Nos esfingolipídeos, temos, substituindo o glicerol e um
ácido graxo, um aminoálcool de cadeia longa ligado à molécula do ácido graxo denominado ceramida.
Esfingosina
HO
CH
3
CH
CH
(CH2)12
CH3
Ácido graxo
O
Esfingolipídio
(estrutura geral)
CH
2
N
C
N
CH2
1
O
X
Figura 12: Esfingosina.
Este tipo lipídico apresenta a porção polar com estrutura física muito semelhante
aos diacilgliceróis, e a cabeça polar pode se ligar ao fosfato ou a uma molécula de
açúcar, que serve como elo para a adição de variados tipos de moléculas, muito
semelhante aos vistos nos diacilgliceróis (Figura 13). Esses tipos de lipídeos são
comuns na bainha de mielina dos axônios das células nervosas.
Nome de esfingolipídio
Nome de X
Fórmula de X
H
Ceramida
O
Esfingomielina
P
Fosfocolina
O
CH2
CH2
+
N(CH3)3
OCH2OH
H
Glicolipídios neutros
Glicosilcerebrosídio
Glicose
O
H
OH
H
OH
H
H
Lactosilceramida
(um globosídio)
Di, tri ou
tetrassacarídeo
Gangliosídio GM2
Oligossacarídeo
complexo
Glc
OH
Gal
Neu5Ac
Glc
Gal
GalNac
Figura 13: Grupos R dos tipos de ligantes as esfingosinas.
Consórcio Setentrional de Ensino a Distância 399
B
#
M2U10
Introdução às biomoléculas: estrutura e função
Quando a ceramida se liga a moléculas de carboidratos diferentes como a glicose
e galactose e, a partir daí formam-se cadeias longas e até ramificadas, forma uma classe
diferente de lipídeos denominados gangliosídeos e cerebrosídeos.
Colesterol e seus derivados
O colesterol é uma molécula derivada do esterol, que apresenta 4 anéis cíclicos fundidos, representando um núcleo tetracíclico. O álcool de esterol mais abundante da
natureza é o colesterol que serve, por sua vez, como base da biossíntese de várias
moléculas do nosso organismo, como os sais biliares, vitamina D e alguns hormônios
esferóides. Não são saponificáveis, uma vez que não apresentam ácido graxo na sua
estrutura, mas apresentam uma forma tridimensional cilíndrica permitindo seu ajustamento na camada lipídica. Imerso na estrutura das membranas, o colesterol interfere no nível de fluidez destas. Embora o organismo animal sintetize o colesterol
(Figura 14), ele é um alimento importante na dieta, devido ao seu elevado consumo.
CH3
CH
CH3
CH2
Cadeia
alquila
lateral
CH2
CH2
CH
CH3
CH3
CH3
A
C
B
Cabeça
HO
polar
CH3
OH
CH3
Núcleo esteróide
C NH CH2 CH2 SO3
O
CH3
HO
D
OH
Ácido taurocólico
(un ácido biliar)
CH3
H3C
H3C
CH2
HO
CH3
Colecalciferol
(vitamina D3)
Figura 14: Colesterol,
Ácido taurocólico,
Colecalciferol
400 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
Saiba Mais
Os gangliosídeos
e os cerebrosídeos
são lipídios
especiais (GM1 e
GM2) encontrados
no tecido nervoso,
principalmente
no cérebro, e
seu catabolismo
é complexo.
Nos indivíduos
afetados pela
doença genéticobioquímica
de Tay-Sachs
observa-se o
acúmulo de tais
compostos dentro
das células.
P
Biológico
BSC
Ceras
As ceras (Figura 15) são ésteres de ácidos graxos de cadeia longa, com álcoois de cadeia longa. As cadeias carbônicas podem ser saturadas ou insaturadas e apresentam de 14 a 36 átomos de carbono.
São comuns nas secreções glandulares da pele, dos cabelos e
cavidade auricular dos animais, recobrindo folhas das plantas e em
pássaros, como impermeabilizante para as penas.
Devido à longa cadeia carbônica flexível, as ceras podem formar estruturas cristalinas estáveis, no estado sólido a temperatura
ambiente, com elevado ponto de fusão.
Figura 15:
triacontanilpalmitato,
componente da cera
de abelhas.
#M2U10 IV. Proteínas e reações enzimáticas
Uma enzima é um catalisador biológico que trabalha em condições moderadas de
temperatura e pH para efetuar uma catálise química, sem produzir produtos intermediários ou produtos alterados. Ela é na realidade uma proteína que apresenta uma atividade
catalítica. Esta fantástica biomolécula é capaz de assumir as mais variadas atividades na
célula que vão desde o catabolismo/anabolismo, ao transporte pelas membranas como
vimos anteriormente, proteção imunológica, etc. Antes de entendermos como ela pode
processar estas atividades, vamos entender brevemente como é sua estrutura molecular.
As proteínas/enzimas são compostas por aminoácidos ligados covalentemente (Figura 16), formando um longo cordão protéico, enovelado (“como um novelo de lã”) no caso
das enzimas ou assumindo outras formas variadas como as fibras musculares (Figura 17).
Figura 16: estrutura química de um aminoácido.
Figura 17: Níveis estruturais de uma proteína.
Consórcio Setentrional de Ensino a Distância 401
B
#
M2U10
Introdução às biomoléculas: estrutura e função
A coesão da estrutura do novelo é mantida por interações químicas e físicas fracas,
mas que por serem numerosas se tornam fortes, como as pontes de hidrogênio,
interações iônicas e hidrofóbicas. Assim, a estrutura da proteína não é rígida, isto
é, ela é flexível, influenciável pelas condições do meio, já que estas interações são
muito influenciadas pelo calor, teor de sais e íons no meio.
Os responsáveis por estas interações são os grupos “R” dos aminoácidos que compõem a estrutura das proteínas. Grupos R dos aminoácidos com carga positiva atraem os
de carga negativa, os grupos hidrofóbicos se atraem na água e o oxigênio, com seu par de
elétrons livres, realiza pontes de hidrogênio (H-H) com o hidrogênio de outro. Quanto
mais destes aminoácidos uma proteína possui, mais força de coesão terá. Mas verifique
que todos os aminoácidos diferem na sua estrutura química apenas pelo grupo R e, que o
grupo carboxila de um pode realizar uma ligação covalente com o grupo amino do outro,
chamada de ligação peptídica.
Assim, dois aminoácidos unidos sempre estarão com um grupo amino e outro carboxílico livre nas extremidades. Eles podem formar, então, longos cordões de aminoácidos, sempre ficando expostos nesta cadeia, chamada de cadeia polipeptídica, os grupos R,
a dupla do oxigênio do ácido carboxílico e o hidrogênio do grupo amino.
Além das interações entre os grupos R, o oxigênio da carboxila e o hidrogênio do
grupo amino podem se atrair formando inúmeras pontes de hidrogênio. Estas pontes
de hidrogênio, quando ocorrem repetidamente, formam padrões estruturais, classificados como estrutura secundária, por exemplo, uma estrutura espiralada chamada de alfa
hélice, que se alterna com trechos aonde esta interação não existe, camada de trechos de
beta-forma (lineares).
O resultado destas interações é a formação da estrutura tridimensional enovelada
(Figura 17), que pode apresentar formas muito variadas e possuir fendas ou cavidades
aonde acontecem as reações catalíticas e de regulação.
Durante o processo evolutivo, estas fendas passaram a apresentar a forma de um
contramolde que permite a entrada do substrato e, como sua estrutura é flexível, elas podem se ajustar perfeitamente a eles durante o processo da reação, através da exposição de
seus grupos R que podem atrair os grupos químicos da molécula do substrato.
Esta atração pode ser tão intensa que pode provocar reações químicas transitórias
entre a enzima e o substrato, modificando-o, ou seja, realizando a catálise. Quando estes
grupos R não podem interagir com o substrato, as enzimas adsorvem dentro de seu sítio
catalítico, moléculas capazes de fazê-lo, moléculas chamadas de coenzimas, que interagem de modo transitório também. Estas coenzimas são fundamentais para a catálise e as
enzimas fornecem o ambiente para que a reação molecular aconteça.
Alguns destes grupos alteram a estrutura da proteína, sendo que sua forma varia de acordo com a seqüência dos aminoácidos, ou seja, com as dobraduras da cadeia. As interações que “unem” as cadeias ou dobras das proteínas são produtos dos
grupos R dos aminoácidos que possuem atração. Elas são fracas, pontes de hidrogênio,
interações iônicas e hidrofóbicas, e fortes, as pontes dissulfeto que ocorrem entre dois
grupos R de aminoácidos cisteína próximos, sendo esse padrão estrutural que depende
de interações entre grupos R de aminoácidos da mesma cadeia, chamado de estrutura
terciária. (figura 18)
As enzimas geralmente possuem massa molecular muito grande, podendo ser constituídas por mais de uma cadeia polipeptídica (estrutura quaternária) e ainda apresentar
componentes químicos diferentes dos aminoácidos, chamados de grupos prostéticos ou
coenzimas (vitaminas). Exemplos destes componentes são metais, moléculas orgânicas
complexas como as hemoglobinas, vitaminas, etc. (Figura 19).
402 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
P
Biológico
Grupo R não-polares e alifáticos
COOCOOCOO+
+
H3N C H
+
CH
CH3 CH3
CH3
Alanina
COO-
COO-
+
H3N C H
+
CH2
CH2
H C CH3
CH
CH3 CH3
CH2
CH2
S
CH3
Isoleucina
CH3
Metionina
Grupo R não-carregados,
mas polares
COOCOOCOOH3N C H
+
H C
Serina
SH
Cisteína
Treonina
COO-
H3N C H
H3N C H
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH3
NH
C NH
CH
C N
H
Histidina
+
+
NH3
Lisina
C NH2
NH2
COO+
H3N C H H3N C
H
CH2
CH2
C
CH2
O
H2N
COO+
Arginina
+
H2C
CH2
Prolina
CH
NH
Triptofano
COO+
H3N C H
CH2
OH
OH
Tirosina
COO+
H3N C H
CH3
COOH
C
+
H2N
CH2
CH2
Grupo R carregados positivamente
+
H3N C H
CH2OH
H3N C H
CH2
Fenilalanina
CH2
+
H3N C H
COO+
C
H3N C H H3N C H
Leucina
+
COO-
+
H3N C H
COO-
+
Valina
COO-
B
Grupo R aromáticos
H3N C H H3N C H
H
Glicina
BSC
Grupo R carregados negativamente
COOCOO+
H3N C H
C
O
Asparagina H2N
Glutamina
+
H3N C H
CH2
CH2
COO-
CH2
Aspartato
COOGlutamato
CH3
Figura 18: Classificação dos aminoácidos baseado nas características do seu grupo R.
-
(a)
O
O
C
C
CH2
CH2
CH2
CH2
C
CH3
C
C
C
C
C
N+
N
C
Fe
C
CH2
C
C
C
CH3
CH
(b)
H
NAD
N
C
C
C
CH3
O
C
CH
CH2
P
-
O
H
P
O
H
H
O
H
H
H
FAD
H
N
CH2 O
CH3
NH2
+
OH OH
N
-
O
C
N
CH2 O
O
O
CH3
+
O
CH
-
N
FMN
-
C
CH
CH
CH
O
O
-
O
NH2
N
Adenina
N
-
O
H
OH OH
Figura 19: grupos prostéticos e coenzimas; a) grupo Heme das hemoglobinas e mioglobinas;
b) NAD (nicotinamida Adenina Dinucleotídeo);
Consórcio Setentrional de Ensino a Distância 403
Flavina
e flav
H
#
M2U10
Introdução às biomoléculas: estrutura e função
(c)
FMN
O
CH3
N
CH3
N
O
HCOH
O
HCOH
FAD
C
HCOH
NH2
N
CH2
O
H
N
N
CH2
+
N
NH
-
O
NH2
N
P
O
O
Adenina
-
N
O
P
O
O
H
H
N
N
CH2 O
H
NH2
N
H
N
H
OH OH
Flavina adenina dinucleotídeo (FAD)
e flavina mononucleotídeo (FMN)
Figura 19:
Grupos prostéticos e coenzimas;
c) FAD (Flavina Adenina
Dinucleotídeo).
A forma tridimensional da proteína-enzima é fundamental para a sua atividade e
nas dobraduras, ela apresenta fendas ou cavidades que simulam o contramolde do substrato (molde – substrato / enzima – contramolde), onde podem apresentar papel catalítico, este é o chamado sítio catalítico. Quanto mais esse contramolde é semelhante ao
molde, mais específica é a enzima e maior poder catalítico ela apresentará (Figura 20). Esse
modelo ficou conhecido como chave-fechadura nos livros didáticos, pois para cada molde
(substrato ou chave) existe uma enzima específica (contramolde ou fechadura).
A
Estado de transição
(bastão dobrado)
Energia livre, G
Substrato
(bastão de metal)
Produtos
(bastão partido)
G
S
P
404 Módulo II — Processos Enzima
biológicos na captação e na transformação da matéria e da energia
complementar ao substrato
B
Ímãs
Energia
S
P
P
Biológico
BSC
Enzima complementar ao substrato
B
Energia livre, G
Ímãs
G não-cat
S
ES
P
G cat
GM
Figura 20: Molde e contramolde da enzima;
a) substrato; b) enzima complementar ao substrato.
Como as dobras das cadeias não estão mantidas por interações fracas, as ações que
afetam estas forças também afetam a forma da enzima.
Quando submetida a variações de temperatura, por exemplo, as pontes de hidrogênio são diretamente afetadas. Quando a temperatura está muito baixa proporciona a
aproximação das cadeias, reduzindo a flexibilidade da enzima. À medida que a temperatura sobe, as cadeias podem se afastar um pouco e a enzima adquire sua forma tridimensional perfeita. Se a temperatura sobe demais, as pontes de hidrogênio se rompem e as
cadeias separam-se podendo levar à desnaturação protéica.
As interações iônicas afetam a ionização dos grupos ácidos e básicos dos grupos R
e afetam as pontes de hidrogênio também. Os grupos básicos (carga positiva –NH3+) são
atraídos pelos grupos de carga negativa dos grupos R ácidos (-COO-), quando o pH se
altera, o excesso de prótons H+ no meio satura os grupos ácidos, protonando-os e assim
ficando sem carga (-COOH). Deixando de ocorrer estas interações, a cadeia protéica relaxa e perde sua forma ótima. Dentro dos sítios catalíticos também pode haver a presença
de grupos ionizados, fundamentais para a catálise. Sua alteração pelo pH leva também à
perda da atividade catalítica.
Como uma enzima trabalha no meio aquoso, os grupos R de natureza hidrofóbica
são afastados da água voltando-se para o interior do novelo protéico. A coesão deles auxilia na manutenção da forma da proteína e agentes que tornam o meio menos hidrofílico
também levam à perda da forma da proteína, como os fenóis e solventes orgânicos.
Os sais monovalentes e divalentes por serem muito solúveis em água, quando em
excesso podem interagir com os grupos R da proteína, afetando em especial as interações
iônicas e as pontes de hidrogênio. De todas estas forças, apenas as pontes dissulfeto, por
serem covalentes, não são rompidas por estes agentes. Assim elas, quando presentes, dão
mais “resistência” à enzima contra as alterações ambientais, porém, se forem excessivas,
podem “engessar” a enzima, reduzindo a flexibilidade da cadeia, vital para seu desempenho como enzima (Figura 21).
Consórcio Setentrional de Ensino a Distância 405
B
#
M2U10
Introdução às biomoléculas: estrutura e função
Pontes de hidrogênio
Entre um grupo R ácido, ácidos carboxílicos e a H2O
Ácidos carboxílicos
O
R
H
O
C
H
R‘
O
Alto PE (formação de duas pontes de hidrogênio)
O
H
PE = 100,5ºC
C
OH
CH3CH2OH
PE = 78ºC
O
R
H
O
C
C
O
R
Dímero
O
H
Pontes dissulfeto
COOCisteína
+
H3N
COO+
CH
H3N
CH2
2H+ + 2e-
SH
Cisteína
CH
CH2
S
2H+ + 2e-
SH
CH2
CH
+
NH3
COO-
Cisteína
S
CH2
CH
+
NH3
COO-
Figura 21: Interações entre os grupos R.
Tendo essa idéia de como é uma estrutura protéica de uma enzima, vamos ver
como ela realiza sua função.
Para que uma reação catalítica ocorra, é necessário haver empenho de energia e,
ao final do processo, a enzima deve estar novamente pronta para um novo trabalho, ou
seja, não pode sofrer alterações químicas permanentes.
Em outras palavras, uma enzima participa do processo catalítico, proporcionando
um “local” (sitio catalítico) adequado para a reação ocorrer, reduzindo a energia
que seria necessária para a realização do processo químico. (Figura 22)
406 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
V0 =
Vmáx[S]
P
Km + [S]
figura 24
Biológico
BSC
Mas e a energia de onde vem? Vem do próprio sistema onde ela está quando a reação é exergônica e, quando ela é endergônica (a energia do produto é maior que energia
do substrato) é necessário haver doação, que pode vir do ATP, de uma reação exergônica
doadora acoplada ou outra molécula com muita energia.
Velocidade inicial, V0 (μM/min)
V0 =
Km + [S]
Vmáx
1/2Vmáx
Km
figura 22
Vmáx[S]
Concentração do substrato, [S] (mM)
Figura 22: Gráfico representativo de uma reação enzimática simples.
Um exemplo de reação:
Numa reação exergônica, a energia para “disparar” o processo catalítico vem
da própria energia livre do substrato ou do sistema da solução. Devido à cadeia polipeptídica ser flexível e ter alta massa molecular, muito maior que o substrato, ao se
chocar com o substrato no sítio catalítico, ela aproveita a energia cinética do substrato
para executar trabalho.
Pelo princípio da termodinâmica, a energia cinética pode ser transformada em trabalho, e é isto que a enzima faz neste caso. No choque com o substrato, a enzima sofre
uma distorção local, fazendo com que o sitio “abrace” o substrato, englobando-o todo ou
no local onde vai haver a transformação.
A energia cinética nesse instante foi transformada em movimento mecânico sobre
o substrato, a energia necessária para que a catálise ocorra. Por isso que em baixa temperatura as reações catalíticas desta natureza são muito lentas, difíceis de ocorrer, pois é
necessária uma energia cinética do substrato que o meio não proporciona.
Então, desse ”abraço” da enzima com o substrato, a enzima mecanicamente aproxima seus grupos químicos ionizados, o cofator ou coenzima, permitindo uma ação atrativa
forte ao substrato, alterando-o (Figura 23). Essa ação é muito rápida e como resultado do
efeito elástico sofrido com o impacto com o substrato, ela “empurra” o material para fora
do sitio catalítico, que, transformado, já é o produto.
Catálise ácido geral
H
A
:A-
O
R1
H
C
..
O
..
H
O
O
R2
R1
O
H
Catálise básica geral
H
OR2
C
R1
O
H
C
OH + H
A
OR2
+
H
Consórcio Setentrional de Ensino a Distância 407
B
#
M2U10
O
C
..
O
..
R1
H
R1
R2
O
H
H
OR2
C
R1
C
OH + H
OR2
OH + H
OR2
+
H
Introdução às biomoléculas: estrutura e função
Catálise básica geral
O
R1
H
C
..
O
..
O
R2
C
R1
:B
H
O
H
O
OR2
H
+
R1
B
C
:B
Figura 23: Catálise ácido base geral.
Assim, quanto maior o número de moléculas de substrato na solução contendo a
energia cinética apropriada para que no impacto ocorra o “abraço” efetivo da enzima com o substrato, maior a quantidade de produto formado.
Assim, tudo que afetar a forma da proteína de forma a tornar o sítio catalítico mais
próximo da forma do molde (substrato) afetará a catálise. Quanto mais relaxado esse sitio,
maior será a energia cinética necessária do substrato para provocar esse “abraço” protéico.
Ou seja, menor será o número de moléculas da solução contendo esse alto nível
de energia cinética, portanto mais difícil e lenta será a quantidade de produto (velocidade) da reação.
Uma outra característica da ação das enzimas em conseguir energia para a catálise
é pela atração do substrato. A arquitetura do sitio catalítico é mantida por interações
entre os grupos R dos aminoácidos. Ao entrar no sitio catalítico, o substrato atrai parte
destas interações, provocando uma reação em cadeia, com deslocamentos sucessivos
destas interações, o que resulta na mudança conformacional das estruturas tanto da
proteína quanto do substrato.
Isto faz com que a estrutura do sítio (cadeias protéicas) se feche como um “abraço”
sobre o substrato. O substrato sofre, então, mudanças químicas, e desfaz sua atração pelos
grupos R da cadeia polipeptídica da enzima. Esta então refaz suas interações, voltando
para sua forma original.
Esse modelo deixa claro a necessidade de uma complementaridade parcial entre
substrato e sítio catalítico para que o processo possa se iniciar, mas o maior nível de complementaridade somente deve ser atingido durante o processo, quando enzima e substrato já tiverem sofrido alterações estruturais, numa situação chamada estado de transição.
Essa especificidade do molde-contramolde é traduzida num símbolo estudado matematicamente por duas pesquisadoras (Michaelis e Menten) que ganharam um
prêmio Nobel por terem conseguido, pela primeira vez, explicar matematicamente
como uma reação enzimática ocorre e seus parâmetros (Figura 24).
V0 =
Vmáx[S]
Km + [S]
figura 24
Figura 24: Equação de Michaelis e Menten (Equação de MM). Km = constante de
MM = concentração de substrato específico, onde a enzima está na metade de sua
velocidade máxima.
408 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia
Vmáx
P
Biológico
1
Equaçao de Lineweaver-Burk
BSC
V0
1
De acordo com o princípio da trigonometria, uma curva pode
Vmáx ser representada por
uma equação de reta. Lineweaver-Burk fez esse tratamento com a equação (Figura 25) de
1
1
MM e com o gráfico, multiplicando a equação por -1, assim:
[S]
Km
Inclinação=
Km
Vmáx
1
1
V0
V0
=
Km
Vmáx[S]
+
1
Vmáx
1
Vmáx
-
1
1
Km
[S]
Figura 25: Equação e representação gráfica de Lineweaver-Burk.
Elas chamaram esta especificidade como a afinidade que a enzima tem pelo seu
substrato específico ou Km.
O Km é um
1 valor deKconcentração
1 de substrato e pode ser medido baseado na vem
= da reação.+
locidade máxima
V
V [S]
V
0
máx
máx
Observe no gráfico que o valor de Km corresponde ao valor de concentração de
substrato em que a enzima trabalha na metade de sua velocidade máxima (Vmáx). Ou
seja, é a projeção da metade do valor de Vmáx na curva, sob o eixo da concentração.
Em termos práticos, significa que quanto menor o valor de Km maior o poder catalítico da enzima, pois menor concentração de substrato específico ela precisa para alcançar a metade da Vmáx. Falando molecularmente, quanto mais eficiente é a interação com o
contramolde (sítio catalítico), menor deformação a enzima precisará sofrer para “abraçar”
o substrato e, consequentemente, de menor energia cinética precisará o substrato.
#M2U10 V. Referências
FUTUYMA, Douglas. J., Biologia Evolutiva, Riberão Preto: Soc. Bras. Genet. 1997.
LEHNINGER , A.; NELSON, D.I.; COX, M.M. Princípios de Bioquímica. 2. ed. São Paulo:
Savier, 1995.
MARZZOCO, A. & TORRES, B.B. Bioquímica Básica. 2. ed., Rio de Janeiro: Ed. Guanabara, 1999.
MURRAY, R. K. et al. Harper’s Biochemistry. 25. ed. LONDON: Ed. Appleton & Lange, 2000.
ROSKOSKI. Bioquímica. Rio de Janeiro: Ed. Guanabara Koogan, 1997
STRYER, L. Biochemistry. 4. ed. New York: Ed. W.E. Freeman and Company, 1995.
Consórcio Setentrional de Ensino a Distância 409
B