Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
Revisão Específicas
1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada
um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
estão apresentadas duas características eletroquímicas e o preço médio de compra de dois
metais no mercado de reciclagem.
Com o objetivo de construir uma pilha que consuma o metal de menor custo, um laboratório
dispõe desses metais e de soluções aquosas de seus respectivos sulfatos, além dos demais
materiais necessários. Apresente a reação global da pilha eletroquímica formada e determine sua
diferença de potencial, em volts, nas condições-padrão
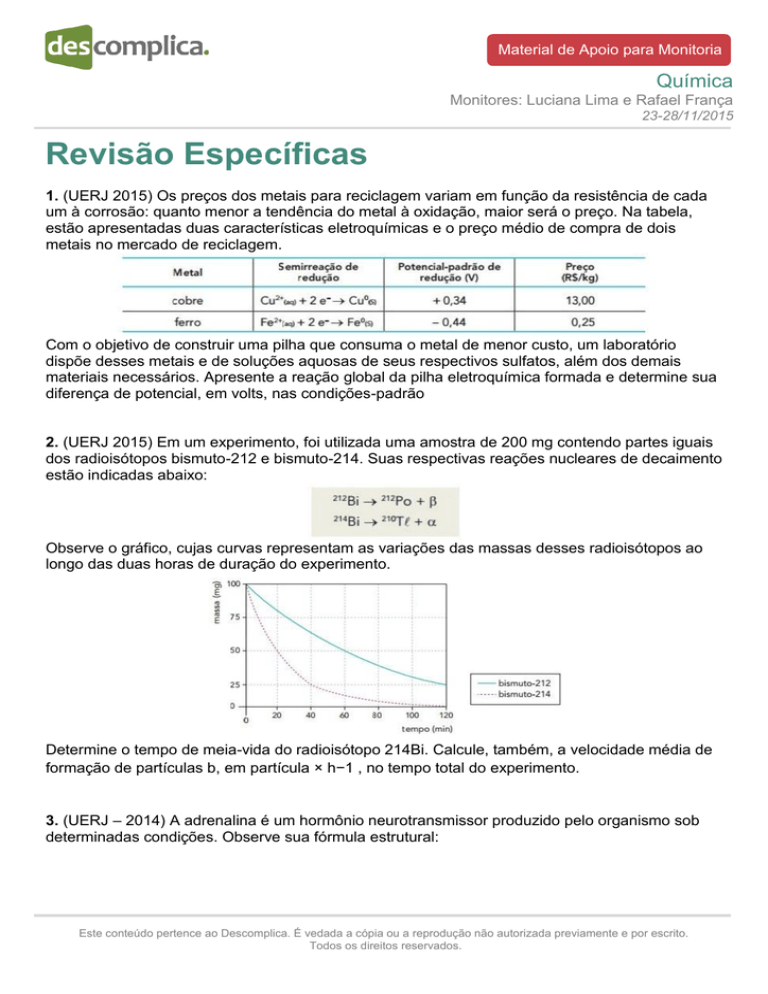
2. (UERJ 2015) Em um experimento, foi utilizada uma amostra de 200 mg contendo partes iguais
dos radioisótopos bismuto-212 e bismuto-214. Suas respectivas reações nucleares de decaimento
estão indicadas abaixo:
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao
longo das duas horas de duração do experimento.
Determine o tempo de meia-vida do radioisótopo 214Bi. Calcule, também, a velocidade média de
formação de partículas b, em partícula × h−1 , no tempo total do experimento.
3. (UERJ – 2014) A adrenalina é um hormônio neurotransmissor produzido pelo organismo sob
determinadas condições. Observe sua fórmula estrutural:
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
Indique o número de isômeros opticamente ativos da adrenalina e apresente a fórmula estrutural
do produto da sua reação de desidratação intramolecular.
4. (UERJ – 2013) A eletrólise da ureia, substância encontrada na urina, está sendo proposta como
forma de obtenção de hidrogênio, gás que pode ser utilizado como combustível. Observe as
semirreações da célula eletrolítica empregada nesse processo, realizado com 100% de
rendimento:
Considere as seguintes informações:
1 - A ureia tem fórmula química CO(NH2)2 e sua concentração na urina é de 20 g.L-1 .
2 - Um ônibus movido a hidrogênio percorre 1 km com 100 g desse combustível.
Apresente a reação global da eletrólise da ureia. Em seguida, calcule a distância, em quilômetros,
percorrida por um ônibus utilizando o combustível gerado na eletrólise de dez mil litros de urina.
5. (UERJ 2013) Aminofenóis são compostos formados pela substituição de um ou mais átomos de
hidrogênio ligados aos carbonos do fenol por grupamentos NH2 . Com a substituição de apenas
um átomo de hidrogênio, são formados três aminofenóis distintos. As fórmulas estruturais desses
compostos estão representadas em:
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
6. (Fuvest) A adição de um soluto à água altera a temperatura de ebulição desse solvente. Para
quantificar essa variação em função da concentração e da natureza do soluto, foram feitos
experimentos, cujos resultados são apresentados abaixo. Analisando a tabela, observa-se que a
variação de temperatura de ebulição é função da concentração de moléculas ou íons de soluto
dispersos na solução.
Dois novos experimentos foram realizados, adicionando-se 1 mol de Na2SO4 a 1 L de água
(experimento A) e 1,0 mol de glicose a 0,5 L de água (experimento B). Considere que os
resultados desses novos experimentos tenham sido consistentes com os experimentos descritos
na tabela.
Assim sendo, as temperaturas de ebulição da água, em °C, nas soluções dos
experimentos A e B, foram, respectivamente, de
a) 100,25 e 100,25.
b) 100,75 e 100,25.
c) 100,75 e 100,50.
d) 101,50 e 101,00.
e) 101,50 e 100,50.
7. (FUVEST 2013 - Primeira Fase) Em um recipiente termicamente isolado e mantido a pressão
constante, são colocados 138g de etanol líquido. A seguir, o etanol é aquecido e sua temperatura
T é medida como função da quantidade de calor Q a ele transferida.
A partir do gráfico de TxQ, apresentado na figura acima, pode-se determinar o calor específico
molar para o estado líquido e o calor latente molar de vaporização do etanol como sendo,
respectivamente, próximos de
Fórmula do etanol: C2H5OH
Massas molares: C(12 g/mol), H(1 g/mol), O(16 g/mol)
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
a) 0,12 kJ/(mol°C) e 36 kJ/mol.
b) 0,12 kJ/(mol°C) e 48 kJ/mol.
c) 0,21 kJ/(mol°C) e 36 kJ/mol.
d) 0,21 kJ/(mol°C) e 48 kJ/mol.
e) 0,35 kJ/(mol°C) e 110 kJ/mol
8. (FUVEST) Recentemente, foi preparado um composto A que é insolúvel em água. No entanto,
quando misturado com água saturada de gás carbônico, forma-se uma solução que contém o íon
B. Quando a solução resultante é aquecida, o gás carbônico é eliminado, e se formam duas
camadas, uma de água e outra de composto A. Essas transformações reversíveis podem ser
representadas pela seguinte equação química:
O composto A está sendo testado em um novo processo de extração do óleo de soja. No
processo atual, utiliza-se hexano para extrair o óleo dos flocos de soja, formando uma solução.
Em seguida, o hexano é separado do óleo de soja por destilação. O novo processo, utilizando o
composto A em vez de hexano, pode ser representado pelo seguinte esquema:
a) Descreva o que deve ser feito nas etapas X e Y para se obter o resultado mostrado no
esquema.
b) Explique por que, no processo de extração do óleo de soja, é vantajoso evitar a destilação do
solvente hexano.
9. (FUVEST) Os componentes principais dos óleos vegetais são os triglicerídeos, que possuem a
seguinte fórmula genérica:
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
Nessa fórmula, os grupos R, R' e R" representam longas cadeias de carbono, com ou sem
ligações duplas. A partir dos óleos vegetais, pode-se preparar sabão ou biodiesel, por hidrólise
alcalina ou transesterificação, respectivamente. Para preparar sabão, tratam-se os triglicerídeos
com hidróxido de sódio aquoso e, para preparar biodiesel, com metanol ou etanol.
a) Escreva a equação química que representa a transformação de triglicerídeos em sabão.
b) Escreva uma equação química que representa a transformação de triglicerídeos em biodiesel.
10. (FUVEST) Cinco cilindros, A, B, C, D e E, contêm gases diferentes. Cada um contém apenas
um dos seguintes gases: monóxido de carbono, dióxido de carbono, dióxido de enxofre, amônia e
metano, não se sabendo, porém, qual gás está em qual cilindro. Com amostras dos gases,
retiradas de cada cilindro, foram feitos os seguintes experimentos, a fim de identificá-los.
I) Cada gás foi borbulhado em água, contendo algumas gotas de solução incolor de fenolftaleína.
Apenas o do cilindro A produziu cor vermelha.
II) O gás de cada cilindro foi borbulhado em água de cal. Apenas os gases dos cilindros C e D
produziram precipitado.
III) Os gases dos cilindros C e D foram borbulhados em uma solução aquosa ácida de
permanganato de potássio, de coloração violeta. Apenas o gás do cilindro D descorou essa
solução.
IV) Os gases dos cilindros restantes (B e E) mostraram-se combustíveis. Ao passar os produtos
da combustão dos gases desses dois cilindros por um tubo contendo cloreto de cálcio anidro,
houve aumento de massa desse tubo apenas no caso do gás do cilindro B.
a) Identifique os gases contidos nos cilindros A, B, C, D e E, preenchendo a tabela da folha de
respostas.
b) Escreva as equações químicas balanceadas das reações do item II.
c) A reação que ocorre no item III é uma reação de precipitação, neutralização ou oxirredução?
Explique, sem escrever a equação química, o que ocorre nessa transformação.
O cloreto de cálcio anidro é usado para absorver água.
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
Gabarito
1. Fe0(s) + Cu2+(aq) → Fe2+(aq) + Cu0(s)
∆E° = + 0,34 − (− 0,44) = + 0,78 V
2.
3.
4.
5. D
6. D
7. A
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
8.
9.
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
23-28/11/2015
10. a) Tubo A → NH3. Dos gases fornecidos, é o único que, em H2O, forma meio básico,
tornando vermelha a solução de fenolftaleína.
Tubo B → CH4. É um gás combustível e seus produtos de combustão são CO2 e H2O. A
H2O, em contato com o CaCl2 anidro, forma um sal hidratado, resultando um aumento de
massa.
Tubo C → CO2. É um óxido ácido que, em contato com água de cal, forma um precipitado
(CaCO3). Além disso, não descora a solução de KMnO4 em meio ácido.
Tubo D → SO2. É um óxido ácido que, em contato com água de cal, forma um precipitado
(CaSO3). Este óxido descora a solução de KMnO4 em meio ácido.
Tubo E → CO. É um gás combustível e seu produto de combustão é o CO 2, que não
aumenta a massa do CaCl2 anidro. Portanto, temos:
b) As equações químicas são:
CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(l)
SO2(g) + Ca(OH)2(aq) → CaSO3(s) + H2O(l)
c) A mudança de cor evidencia alteração no número de oxidação do manganês. No KMnO 4
violeta, o número de oxidação do manganês é + 7. Se ficou incolor, o Nox do Mn variou. A
reação é de oxidorredução, pois o KMnO4 é agente oxidante, portanto é capaz de oxidar o
enxofre do SO2 (Nox = + 4) para SO3 (Nox = + 6), o que não ocorre com o carbono do CO2,
pois o carbono está com o seu Nox máximo.
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.